Diversity and distribution of heterotrophic
flagellates in the Arctic Ocean
Thèse
Mary Thaler
Doctorat en Océanographie
Philosophiae Doctor (PhD.)
Québec, Canada
© Mary Thaler, 2014
Résumé
Dans les environnements marins arctiques, les protistes unicellulaires constituent les premiers maillons du réseau trophique. Les flagellés hétérotrophes (HF) jouent un rôle clé au sein de ce réseau trophique comme brouteurs de bactéries et de phytoplanctons, étant broutés à leur tour par les microzooplanctons comme les dinoflagellés ou les ciliés. Les scientifiques prévoient que les changements environnementaux extrêmes qui ont présentement lieu dans l‟Océan Arctique transformeront ces communautés de protistes. Le sujet de cette thèse porte sur la composition taxonomique des communautés marines HF dans l‟Océan Arctique, et leur réponse aux facteurs environnementaux. L‟approche a été d‟utiliser le comptage sur microscope à l‟aide de l‟hybridation fluorescente in situ pour évaluer l‟abondance de deux taxons HF importants, le genre
Cryothecomonas et le clade MAST-1 parmi les straménopiles marins. Une approche complémentaire a été de décrire la répartition de tous les taxons HF, y compris l‟ordre Cryomonadida, les straménopiles marins, Picozoa, Telonemia, et les choanoflagellés, par l‟utilisation du séquençage à haut débit. Les résultats des deux approches nous ont permis de capturer les tendances environnementales sur une large échelle géographique dans l‟Arctique. Il a été mis en évidence une composition taxonomique structurée, principalement dû à l‟influence de la glace de mer et d‟autres facteurs environnementaux. Les cellules de Cryothecomonas semblaient provenir de la glace de mer, et au sein de la colonne d‟eau ils se trouvaient les plus nombreuses près du bord de glace. Par contre, les trois sous-clades de MAST-1 étaient retrouvés principalement dans la colonne d‟eau, mais répartis différemment par rapport au couvert de glace et les zones marginales de glace. La composition de la totalité de la communauté HF variait aussi par région, avec une plus grande importance de Telonemia et des choanoflagellés dans le Bassin du Canada. Pour plusieurs taxons, nous avons pu identifier un ou deux phylotypes dominants pour une région donnée. L‟importance relative de ces taxons devrait changer lors de la retraite de glace continue dans l‟Arctique, menant à des changements importants dans les réseaux trophiques et les cycles biogéochimiques
Abstract
In marine environments, single-celled protists form the initial links of the food web. Heterotrophic flagellates (HF) play a key role by grazing on bacteria and phytoplankton, being grazed upon in their turn by microzooplankton such as dinoflagellates and ciliates. The extreme environmental changes currently taking place in the Arctic Ocean are expected to transform protist communities. The subject of this thesis is the taxonomic composition of marine HF communities in the Arctic Ocean, and their response to environmental factors. The approach was to use fluorescent oligonucleotide probes to assess the abundance of two important HF taxa, the genus
Cryothecomonas and the clade MAST-1 of the marine stramenopiles, via microscope counts. A complementary approach was to describe distribution of all HF taxa, including Cryomonadida, marine stramenopiles, Picozoa, Telonemia and choanoflagellates, by means of high-throughput sequencing. Results from these two approaches allowed us to capture broad environmental trends over a large geographic scale in the Arctic. A picture emerged of taxonomic composition largely structured by the influence of sea ice and other environmental factors. Cryothecomonas cells are inferred to live principally in the sea ice, and in the water column are more numerous close to the ice edge, whereas three sub-clades of MAST-1 are all found principally in the water column but are distributed differently relative to ice cover and marginal ice zones. The composition of the total HF community also varied by region, with a greater importance of Telonemia and choanoflagellates in the Canada Basin. For several taxa it was possible to identify one or two dominant phylotypes in a given region. The relative importance of these taxa is expected to change as sea ice retreat continues in the High Arctic, leading to important changes in trophic webs and biogeochemical cycles.
Table de Matières
RÉSUMÉ ... III ABSTRACT ... V TABLE DE MATIÈRES ... VII LISTE DES TABLEAUX ... XI LISTE DES FIGURES ... XIII LISTE DE TABLEAUX SUPPLÉMENTAIRES ... XVII LISTE DES ABRÉVIATIONS ...XIX REMERCIEMENTS ...XXI AVANT-PROPOS ... XXIII
CHAPTER 1 : INTRODUCTION GÉNÉRALE ... 1
1.01. INTRODUCTION ... 1
1.02. LES FLAGELLÉS HÉTÉROTROPHES ET LES RÉSEAUX TROPHIQUES MARINS ... 1
1.03. L‘IMPORTANCE ÉCOLOGIQUE DE LA TAILLE DES ORGANISMES... 2
1.04. L‘EFFET DES CHANGEMENTS CLIMATIQUES SUR LES ORGANISMES DE L‘ARCTIQUE ... 2
1.05. LES OBJECTIFS DE CETTE THÈSE ... 3
1.06. LES TAXONS HF ... 4
1.06.1. Cryomonadida ... 4
1.06.2. Choanoflagellés ... 4
1.06.3. Straménopiles Marins (MAST) ... 5
1.06.4. Picozoa ... 5
1.06.5. Telonemia ... 5
1.07. MÉTHODOLOGIE ... 6
1.07.1. Hybridation fluorescente in situ (FISH) ... 6
1.07.2. Séquençage à haut-débit ... 7
1.08. ANALYSES STATISTIQUES ... 8
1.08.1. Les différents types de variables ... 8
1.08.2. Analyses de correspondance et de chemin... 8
1.08.3. Analyse canonique de correspondance ... 9
1.09. RÉGION D‘ÉTUDE ... 10
1.09.1. Nord de la Mer de Baffin ... 10
1.09.2. Archipel Arctique Canadien ... 10
1.09.3. Mer de Beaufort ... 11
1.09.4. Bassin du Canada ... 11
1.09.5. Mer des Tchouktches ... 11
1.10. PLAN DE LA THÈSE ... 11
CHAPTER 2 : DISTRIBUTION AND DIVERSITY OF A PROTIST PREDATOR CRYOTHECOMONAS (CERCOZOA) IN ARCTIC MARINE WATERS ... 21
RÉSUMÉ ... 21
ABSTRACT ... 22
2.01. INTRODUCTION ... 23
2.02.1. Sample collection ... 24
2.02.2. DNA extraction and cloning ... 26
2.02.3. Phylogenetic analysis ... 27
2.02.4. Probe design ... 28
2.02.5. Grazing experiments ... 28
2.02.6. Fluorescent in situ hybridization ... 28
2.02.7. Environmental variables ... 29 2.03. RESULTS ... 30 2.03.1. Phylogenetic analysis ... 30 2.03.2. FISH ... 31 2.04. DISCUSSION ... 33 2.04.1. Phylogeny ... 33
2.04.2. Observations with FISH... 33
2.04.3. Distribution ... 34
2.04.4. Trophic position of Cryothecomonas ... 36
2.05. CONCLUSION ... 37
2.06. ACKNOWLEDGEMENTS ... 37
CHAPTER 3 : ENVIRONMENTAL SELECTION OF MARINE STRAMENOPILE CLADES IN THE ARCTIC OCEAN AND COASTAL WATERS ... 43
RÉSUMÉ ... 43
ABSTRACT ... 44
3.01. INTRODUCTION ... 45
3.02. MATERIALS AND METHODS ... 46
3.02.1. Sample Collection ... 46 3.02.2. FISH ... 48 3.02.3. Environmental Variables ... 49 3.02.4. Phylogenetic Analysis ... 50 3.03. RESULTS ... 50 3.03.1. FISH ... 50 3.03.2. Phylogenetic Analysis ... 52 3.04. DISCUSSION ... 52
3.04.1. Environmental phylogenetic clusters ... 52
3.04.2. Depth Distribution ... 53
3.04.3. Relationship with ice-influenced waters ... 54
3.05. CONCLUSION ... 55
3.06. ACKNOWLEDGMENTS ... 55
CHAPTER 4 : DISTINCT HETEROTROPHIC FLAGELLATE COMMUNITIES IN DIFFERENT REGIONS OF THE ARCTIC OCEAN ... 63
RÉSUMÉ ... 63
ABSTRACT ... 64
4.01. INTRODUCTION ... 65
4.02. MATERIALS AND METHODS ... 66
4.02.1. Experimental Design ... 66
4.02.2. Chukchi Sea samples ... 67
4.02.3. Placement of Reads on Phylogenetic Trees ... 67
4.03. RESULTS ... 68
4.03.2. Phylogenies and evolutionary placement of reads ... 69
4.04. DISCUSSSION ... 70
4.04.1. Regional differences between HF communities ... 71
4.04.2. Size Fractionation of the HF community ... 72
4.04.3. Changes in HF with depth ... 73
4.04.4. MAST ... 74 4.04.5. Cryomonadida ... 74 4.04.6. Telonemia ... 76 4.04.7. Picozoa ... 76 4.04.8. Choanoflagellates ... 76 4.05. CONCLUSION ... 77 4.06. ACKNOWLEDGMENTS ... 77
CHAPTER 5 : CONCLUSIONS GÉNÉRALES ... 95
5.01. SYNTHÈSE DE L‘ÉTUDE ... 95
5.02. COMPARAISON DES TECHNIQUES MOLÉCULAIRES ... 97
5.03. PERSPECTIVES ... 98
5.03.1. Échantillonnage taillé aux questions de recherche ... 98
5.03.2. Mesure des taux écologiques ... 99
5.03.3. Impact des changements climatiques ... 101
Liste des tableaux
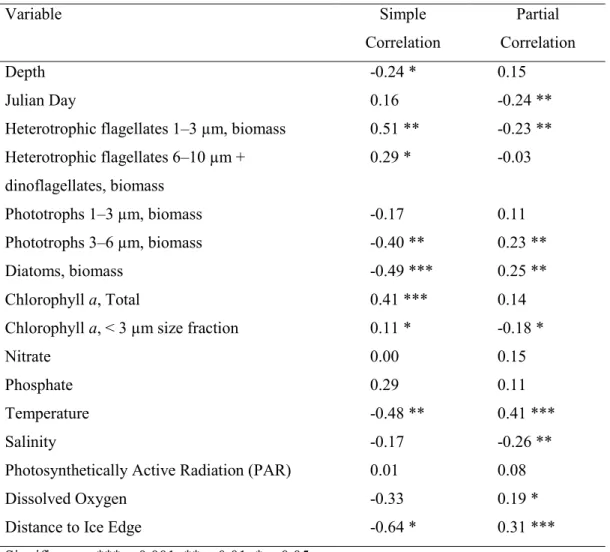
Table 1.1 Méta-données pour les stations d‟échantillonnage dans cette thèse. ... 14 Table 2.1 Simple and partial correlations between abundance of Cryothecomonas and sixteen other
biotic and abiotic variables. ... 39 Table 3.1. Temperature and salinity characteristics of Arctic water masses as defined in this study.
... 56 Table 4.1. References for pyro-tag sequencing data used in this paper. Total reads is given after
removing low-quality reads and sub-sampling to an equal number of reads for each sample in a study. ... 78 Table 4.2. Percentages of HF taxa in < 3 µm and > 3 µm size fractions from the Chukchi Sea. ... 80
Liste des figures
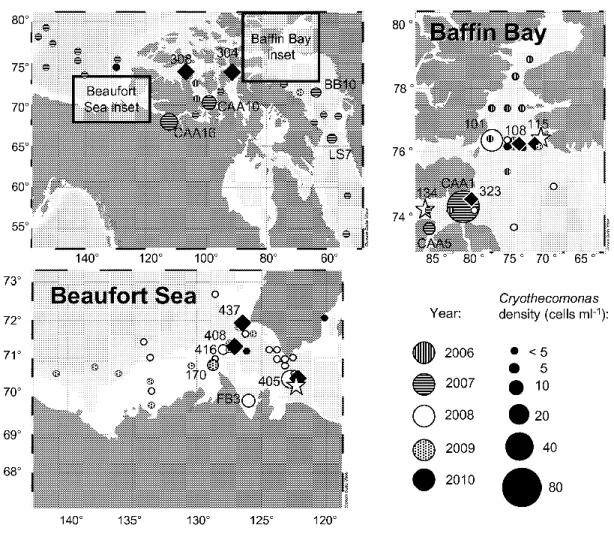
Figure 1.1. Carte des régions de l‟Arctique étudiées dans cette thèse ... 20 Figure 2.1. Stations sampled for counts of Cryothecomonas using Fluorescent in-situ
Hybridization. Station names are given where elevated Cryothecomonas events occurred, or where additional manipulations were performed. Stars indicate clone libraries, 2008;
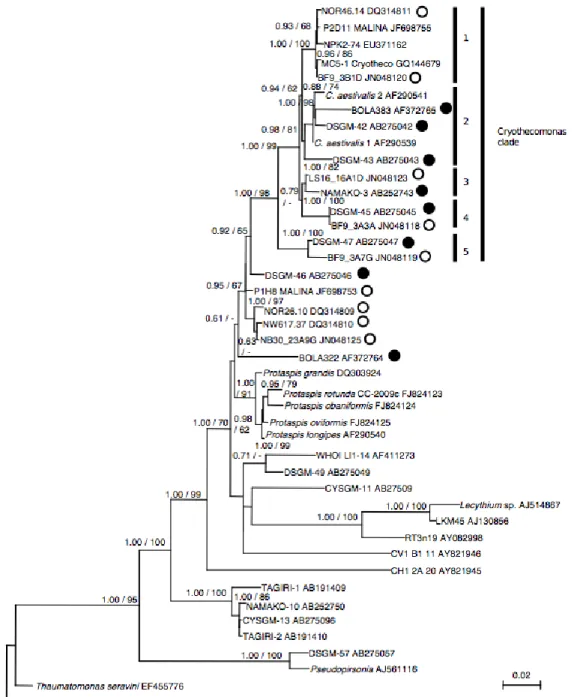
Diamonds indicate grazing experiments. ... 40 Figure 2.2. Rooted maximum-likelihood phylogeny of the Cryothecomonas clade and other
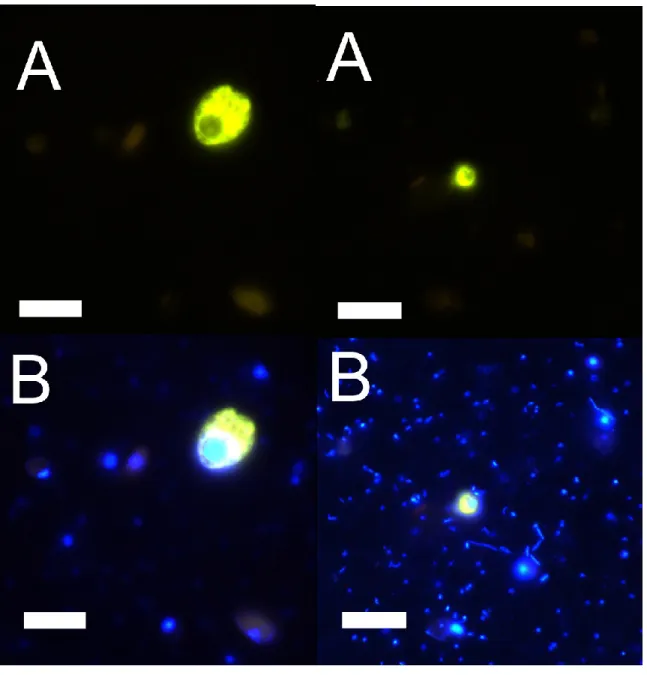
Cryomonadida genera, screened from Arctic clone libraries and reference sequences from the NCBI nr nucleotide database. Scale bar indicates number of substitutions per position. Bayesian posterior probabilities/Maximum Likelihood bootstrap values (as percentages) greater than 0.60/60 are printed above each node. Open circles indicate sequences from Arctic clone libraries. Closed circles indicate sequences from sediment clone libraries. ... 41 Figures 2.3 and 2.4. Epifluorescence micrographs of Cryothecomonas cells hybridized with the
Cryo1134 probe from Station 101 on 15 September 2008, showing the range of morphological variation observed. The difference in size of non-hybridized cells between Figure 2.3 and 2.4. is due to the fact that small bacterial cells are not sharply focused in Figure 2.3, and a longer exposure time causing increased halo-ing. Scale bars = 10 µm for all images. A panels: Green excitation, showing the yellow cytoplasm with fluorescent in situ hybridization (FISH). B panels: Overlay of two pictures of the same cell observed under green excitation and ultraviolet excitation (showing the nucleus stained with 4,6-diamidino-2-phenylindole
(DAPI)). ... 42 Figure 3.1. Map of sampling stations. Shapes correspond with those in Figure 3.2: Beaufort Sea
(square), Baffin Bay (circle), Canada Basin (triangle, point down), Labrador Sea (triangle, point up), Lancaster Sound (diamond). Open symbols are sites sampled July–August 2007. Closed symbols are sites sampled July–October 2008. ... 57 Figure 3.2. Concentration of: a) MAST-1A; b) MAST-1B; and c) MAST-1C in samples from water
masses in different regions of the Arctic. d) Water masses referred to in text. Symbols: Beaufort Sea (square), Baffin Bay (circle), Canada Basin (triangle, point down), Labrador Sea Water (LSW); Atlantic Water (AtW); Bottom Water (BW); Lower Halocline (LH); Arctic Water (AW); Pacific Water (PW); Winter Water (WW); Surface Water (SW). The dashed line indicates the freezing point of seawater at different salinities. Curved grey lines indicate density (sigma-theta). ... 58 Figure 3.3. Ordination diagram of the first two axes of Canonical Correspondence Analysis (CCA) showing the relationship between MAST-1 sub-clades and a) environmental variables, b) water masses. Axes are constrained by abundance of MAST-1 clades and environmental variables. Distance to ice edge (squares) is included as a nominal variable. Water mass features
(triangles) are projected a posteriori onto the diagram. See text and Figure 3.2D, for definition of water masses: Labrador Sea Water (LSW); Atlantic Water (AtW); Bottom Water (BW); Lower Halocline (LH); Arctic Water (AW); Pacific Water (PW); Winter Water (WW); Surface Water (SW). ... 59 Figure 3.4. Rooted maximum-likelihood phylogenies of a) 1A; b) 1B and c) MAST-1C sequences from the NCBI nr nucleotide database. Outgroups not shown. Scale bar indicates number of substitutions per position. Closed circles indicate nodes with bootstrap values > 50
(out of 100). Labels of end-nodes provide clone number, sampling region, and sample depth. Continued on facing page. ... 60 Figure 4.1. Stations sampled by studies in this paper. ... 81 Figure 4.2. Heterotrophic protist groups as a proportion of all eukaryote sequences from studies in
the Arctic Ocean. a) Amundsen Gulf time series (Comeau et al. 2011); b) Franklin Bay sea-ice study 2008 (Comeau et al. 2013); c) Beaufort Sea 2009 (Monier et al. 2013); d) Canada Basin 2007 (Comeau et al. unpublished); e) Chukchi Sea < 3 µm (this study); f) Chukchi Sea > 3 µm (this study). Note the different scale in panel e. Panel c x-axis labels: a = “above SCM”, b = “below SCM. „*‟ in e indicates a sample which had a lower number of non-metazoan reads (n = 1044) ... 82 Figure 4.3. Marine stramenopile clades as a proportion of all eukaryote sequences from studies in
the Arctic Ocean. “Other” includes clades 4, 5, 9 and 10. a) Amundsen Gulf time series (Comeau et al. 2011); b) Franklin Bay sea-ice study 2008 (Comeau et al. 2013); c) Beaufort Sea 2009 (Monier et al. 2013); d) Canada Basin 2007 (Comeau et al. unpublished); e) Chukchi Sea < 3 µm (this study); f) Chukchi Sea > 3 µm (this study). Note the different scale in panel e. Panel c x-axis labels: a = “above SCM”, b = “below SCM. „*‟ in e indicates a sample which had a lower number of non-metazoan reads (n = 1044). ... 83 Figure 4.4. Phylogenetic mapping of Cryomonadida reads from all five studies in this paper.
Rooted Cryomonadida reference phylogenetic tree was constructed using maximum likelihood from an alignment of 92 sequences and 1689 characters. Some non-Cryomonadida reference sequences have been omitted for clarity. Closed circles indicate nodes with bootstrap support > 50 (out of 100). Reads are mapped onto the nodes marked with blue circles using RAxML evolutionary placement algorithm; only placements likelihood weight > 0.5 are shown. Left scale bar indicates number of substitutions per position. Protaspis longipes (*) was formerly identified as Cryothecomonas longipes (Hoppenrath and Leander 2006) and Rhogostoma minus (**) was formerly identified as Lecythium sp. (Howe et al. 2011). Outgroups (not shown) are two radiolarian sequences and an acantharean (Spongaster tetras AB101542, Lithomelissa setosa HQ651801, Acanthometra fusca KC172856). Reference and outgroup sequences are listed in Supplementary Table S4.3 ... 84 Figure 4.5. Phylogenetic mapping of Telonemia reads from all five studies in this paper. Rooted
Telonemia reference phylogenetic tree was constructed using maximum likelihood from an alignment of 52 sequences and 1942 characters. Closed circles indicate nodes with bootstrap support > 50 (out of 100). Reads are mapped onto the nodes marked with blue circles using RAxML evolutionary placement algorithm; only placements likelihood weight > 0.5 are shown. Left scale bar indicates number of substitutions per position. Labelled clades correspond to Bråte et al. (2010b). Outgroups (not shown) are a haptophyte and a katablepharid (Prymnesium parvum AJ246269 and Katablepharis japonica AB231617). Reference and outgroup sequences are listed in Supplementary Table S4.4 ... 85 Figure 4.6. Phylogenetic mapping of Picozoa reads from all five studies in this paper. Rooted
Picozoa reference phylogenetic tree was constructed using maximum likelihood from an alignment of 55 sequences and 1168 characters. Closed circles indicate nodes with bootstrap support > 50 (out of 100). Reads are mapped onto the nodes marked with blue circles using RAxML evolutionary placement algorithm; only placements likelihood weight > 0.5 are shown. Left scale bar indicates number of substitutions per position. Clades are labelled
following Seenivasan et al. 2013. Outgroups (not shown) are a haptophyte, a katablepharid, and a Telonemia (Prymnesium parvum AJ246269, Katablepharis japonica AB231617 and Telonema antarcticum (AJ564773). Reference and outgroup sequences are listed in
Supplementary Table S4.5 ... 86 Figure 4.7. Phylogenetic mapping of choanoflagellate reads from all five studies in this paper.
Choanoflagellate reference phylogenetic tree was constructed using maximum likelihood from an alignment of 49 sequences and 1963 characters. Closed circles indicate nodes with
bootstrap support > 50 (out of 100). Reads are mapped onto the nodes marked with blue circles using RAxML evolutionary placement algorithm; only placements likelihood weight > 0.5 are shown. Left scale bar indicates number of substitutions per position. Outgroups (not shown) are two metazoan sequences, Mnemiopsis leidyi (AF293700) and Beroe ovata (AF293694), a sponge (AY348876), two ichthyosporeans (Y16260 and AF232303), and Corallochytrium (L42528). Reference and outgroup sequences are listed in Supplementary Table S4.6 ... 87
Liste de tableaux supplémentaires
Supplementary Table S3.1. Number of cells counted for each MAST-1 sub-clade. ... 62 Supplementary Table S4.1. Number of reads per sample after processing ... 88 Supplementary Table S4.2. Pyrosequencing raw data, filtering and OTU statistics for data from
ICESCAPE 2010 study. Percentages are given relative to reads available from the preceding step. ... 89 Supplementary Table S4.3. Cercozoan sequences used to construct a reference tree for
phylogenetic placement of Cryomonadida reads. Protaspis longipes (*) was formerly identified as Cryothecomonas longipes (Hoppenrath and Leander 2006) and Rhogostoma minus (**) was formerly identified as Lecythium sp. (Howe et al. 2011). ... 90 Supplementary Table S4.4. Telonemia sequences used to construct a reference tree for
phylogenetic placement of reads. ... 92 Supplementary Table S4.5. Picozoa sequences used to construct a reference tree for phylogenetic
placement of reads... 93 Supplementary Table S4.6. Choanoflagellate sequences used to construct a reference tree for
Liste des abréviations
18S : petite sous-unité du ribosome eucaryoteACC ou CCA : analyses canonique des correspondances ADN ou DNA : acides désoxyribonucléiques
ADNc ou cDNA : acides désoxyribonucléiques complémentaires ARN ou RNA : acides ribonucléiques
ARNr ou rRNA : acides ribonucléiques ribosomaux AtW : Eau Atlantique (Atlantic Water)
AW : Eau Arctique (Arctic Water
BLAST : basic local alignment search tool bp ou pb : paire de bases (base pairs) BW : Eau du fond (bottom water) C3O : Canada‟s Three Oceans
CARD-FISH : catalyzed reporter deposition fluorescent in situ hybridization CCA ou ACC : analyse canonique des correspondances
CCGS ou NGCC : Canadian Coastguard Ship (Navire de Garde Côtière Canadien) cDNA ou ADNc : acides désoxyribonucléiques complémentaires
CFL : Circumpolar Flaw Lead Study chl a : chlorophylle a
CHONe : Canadian Healthy Oceans Network CTD : conductivité-température-profondeur DAPI : 4‟,6-diamidino-2-phenylindole DNA ou ADN : acides désoxyribonucléiques dNTP : désoxyribonucléotide
DOTUR : Distance-based Operational Taxonomic Units and Richness Determination EDTA : acide éthylène diamine tétraacétique
EPA : Environmental Placement Algorithm FCM : cytométrie en flux
FISH : hybridation fluorescente in situ
FLB : fluorescently labeled bacteria (bactéries marquées par un fluorochrome) GF/F : glass fiber (fibre de verre) class F filter
GTR : general time-reversible HF : flagellés hétérotrophes
HPLC : high-performance liquid chromatography (chromatographie en phase liquide à haute performance)
ICESCAPE : Impacts of Climate change on the Ecosystems and Chemistry of the Arctic Pacific Environment
IPY : International Polar Year (Année Polaire Internationale) LH : halocline inférieure (lower halocline)
LSW : Eau de la Mer du Labrador (Labrador Sea Water) MAST : straménopile marin (marine stramenopile) ML : maximum likelihood (maximum de vraisemblance) MUSCLE : Multiple Sequence Comparison by Log-Expectation N2 : Fréquence de Brunt-Väisäla
NCBI : National Center for Biotechnology Information
NGCC ou CCGS : Navire de Gard Côtière Canadienne (Canadian Coastguard Ship) NJ : neighbour-joining
NSERC : Natural Science and Engineering Council of Canada (Conseil de recherches en sciences naturelles et en génie du Canada)
OTU : Operational Taxonomic Unit pb ou bp : paire de bases
PAR : rayonnement photosynthétiquement actif PC : polycarbonate
PCR : réaction en chaîne par polymérase PSU : practical salinity units
PW : Eau Pacifique
RAxML : Randomized Accelerated Maximum Likelihood
RFLP : restriction fragment length polymorphism (polymorphisme de longeur des fragments de restriction)
RNA ou ARN : acides ribonucléiques
rRNA ou ARNr : acides ribonucléiques ribosomaux SCM : maximum sous-superficiel de la chlorophylle a SDS : dodécylsulfate de sodium
SRA : Sequence Read Archive SW : eau du surface
TE : Tris-EDTA
Tris : Tris(hydroxymethyl)aminomethane USCGS : United States Coastguard Ship WW: Eau d‟hiver (Winter Water)
Remerciements
Je tiens premièrement à remercier ma directrice de recherche Connie Lovejoy, qui m‟a fait découvrir l‟intersection merveilleuse entre la biologie moléculaire, la microbiologie et l‟océanographie dans l‟Arctique. Lors d‟innombrable contretemps, quand une crise se produisait sur le terrain, une expérience semblait être en panne, ou la logique d‟un paragraphe de la discussion qui risquait de se compliquer au-delà de la raison, elle était toujours disponible avec ses conseils et encouragements. Je me sens chanceuse d‟avoir bénéficier de sa sagesse et de son soutien constant tout au long de ce processus.
Je voudrais également remercier les membres de mon comité d‟encadrement, Jean-Éric Tremblay et Nicolas Dérôme, pour leurs précieux conseils, commençant avec ma présentation de projet et continuant pendant plusieurs réunions très productives. Je remercie également Jean-Éric Tremblay, Rebecca Gast et Alex Culley pour avoir consenti à être sur le comité d‟évaluation pour cette thèse.
Entre de nombreux mentors lors de ma carrière scolaire, je souhaite mentionner ma directrice de mémoire au baccalauréat, Irena Kaczmarska, qui était la première à me transmettre le virus, de la joie et merveille, des organismes marins microscopiques, et ma chère amie et collègue Anne Jungblut qui m‟a précédé par plusieurs années sur ce chemin, et m‟a donné la confiance de la suivre.
J‟ai été surtout chanceuse de travailler au sein d‟un groupe de recherche où se promouvait un climat de collaboration et d‟entraide. Ce serait impossible de raconter toutes les façons dont chaque personne m‟a aidé au long des années. Mais, pour faire une liste inévitablement incomplète, je mentionne Ramon Terrado qui, en partageant un bureau pour les derniers cinq ans, a vu tous les hauts et les bas de mon doctorat, et restait sage et rassurant tout du long; Marianne Potvin pour les formations dans les techniques de biologie moléculaire quand j‟étais une débutante nerveuse; André Comeau et Adam Monier pour leur aide avec tout ce qui est bioinformatique; Emmanuelle Medrinal, avec qui j‟ai partagé de beaux moments d‟exaltation et d‟anxiété sur le terrain; Cindy DaSilva et Bérangère Péquin pour leur soigneuse relecture de mon français, et les échanges fructueux; et Vani Mohit, Sophie Charvet, et Sophie Crevecoeur pour divers soutiens, conseils, et des matchs de volley-ball vivement engageants. Travailler avec vous tous était une joie, et je vous souhaite tous les bonheurs que vous méritez sur vos chemins respectifs
Une portion des travaux décrits ici a été effectuée pendant un stage de trois mois sous la direction de Carlos Pedrós-Aliñ et Ramon Massana à l‟Institut de Ciències del Mar. Je tiens à les remercier pour leur accueil chaleureux ainsi que Irene Forn, qui m‟a formé dans les techniques de laboratoire.
La plupart de l‟échantillonnage pour cette recherche a été effectué à bord des navires de la Garde Côtière Canadienne. Je dois des remerciements aux commandants et aux équipages de la NGCC Amundsen et la NGCC Louis S. St-Laurent pour leur professionnalisme et leur soutien sur le terrain. Au niveau personnel, je dois une énorme reconnaissance à mes parents pour leur exemple de courage et de détermination, leur confiance inlassable en moi, et leur amour inconditionnel. Plusieurs autres m‟ont soutenu dans cette période de ma vie, ici à Québec ou de loin. Je veux mentionner mes frères, John et Mike, ainsi que les amis Kristen Conrad, Nicole Journal, Mike Walker et Alain LeBlond, et bien d‟autres trop nombreux pour les nommer mais chacun bien apprécié.
Avant-propos
Cette thèse présente mes travaux de doctorat effectués sous la direction du Dr. Connie Lovejoy, professeure du département de Biologie de l‟Université Laval. La thèse est composée de cinq chapitres, dont trois présentés sous forme d‟articles, précédés d‟un résumé en français. Le premier chapitre consiste en une introduction générale à la problématique, la méthodologie, et les régions d‟étude. Elle se termine par une présentation des objectifs des chapitres suivants. Le dernier chapitre présente les conclusions et perspectives de la recherche.
Je suis première auteure de chacun des articles, avec ma directrice Connie Lovejoy comme co-auteure. L‟échantillonnage sur le terrain a été effectué par moi-même ou par des collègues au sein de plusieurs programmes de recherche majeurs : Canadian Arctic Shelf Exchange Study 2003–2004, ArcticNet 2005–2010, Canada’s Three Oceans (C3O) 2007, le Circumpolar Flaw Lead Study (CFL; « Étude sur le chenal de séparation circumpolaire ») 2007–2008, Malina 2009, et ICESCAPE 2010. Pour les chapitres 2 et 3, j‟ai réalisé les banques de clones, l‟hybridation fluorescente in situ (FISH) et les comptes sur microscope. Les données contextuelles, tel que l‟abondance de bactéries, la concentration de chlorophylle a et de nutriments, étaient fournies par les collègues qui sont identifiés dans les chapitres pertinents. Le cinquième chapitre inclut des nouvelles données avec une méta-analyse des données provenant de quatre études déjà publiées ou en voie de publication. Les nouvelles analyses substantielles effectuées sur ces données répondaient à des questions de recherche nettement différentes que les articles originaux. J‟ai réalisé l‟interprétation des données et la rédaction pour tous les trois articles.
Chapitre 1 : Introduction générale
Chapitre 2 : Thaler M, Lovejoy C (2012) Distribution and Diversity of a Protist Predator Cryothecomonas (Cercozoa) in Arctic Marine Waters. Journal of Eukaryotic Microbiology 59: 291– 299. doi: 10.1111/j.1550-7408.2012.00631.x
Chapitre 3 : Thaler M, Lovejoy C (2013) Environmental selection of marine stramenopile clades in the Arctic Ocean and coastal waters. Polar Biology. doi 10.1007/s00300-013-1435-0
Chapitre 4 : Distinct heterotrophic flagellate communities in different regions of the Arctic Ocean. Ce chapitre sera soumis sous peu pour publication.
Par ailleurs, les travaux de recherche de la thèse ont été présentés à des réunions scientifiques générales du Réseau ArcticNet et du regroupement inter-institutionnel Québec-Océan. De plus, certains résultats préliminaires ont été présentés sous la forme d‟affiche au congrès de l‟ASLO (Association for the Sciences of Limnology and Oceanography) à Nice en 2009, et les résultats du deuxième article ont été présentés sous la forme d‟affiche au congrès de l‟ASLO à Salt Lake City en 2012.
Finalement, les travaux effectués pendant le doctorat ont contribué à d‟autres publications :
1) Terrado R, Medrinal E, Dasilva C, Thaler M, Vincent VF, Lovejoy C (2011) Protist community composition during spring in an Arctic flaw lead polynya. Polar Biology 34 : 1901–1914.
2) Blais M, Tremblay J-É, Jungblut A, Gagnon J, Martin J, Thaler M, Lovejoy C (2012) Nitrogen fixation and identification of potential diazotrophs in the Canadian Arctic. Global Biogeochemical Cycles 26 : GB302.
3) Terrado R, Thaler M, Scarcella K, Vincent WF, Lovejoy C (2013) Small phytoplankton in Arctic seas : vulnerability to climate change. Biodiversity 14.
4) Comeau AM, Philippe B, Thaler M, Gosselin M, Poulin M, Lovejoy C (2013) Protists in Arctic drift and land-fast ice. Journal of Phycology 49 : 229–240.
5) Monier A, Terrado R, Thaler M, Comeau AM, Medrinal E, Lovejoy C (2013) Upper Arctic Ocean water masses harbor distinct communities of heterotrophic flagellates. Biogeosciences 10 : 3397–3430.
Chapter 1 :
Introduction Générale
1.01. Introduction
Bien que tous les niveaux des réseaux trophiques marins arctiques sont probablement sensibles aux changements climatiques récents (ex. Fortier et al. 2006; Falk-Petersen et al. 2007; Laidre et al. 2008), ses impacts sont déjà visibles dans la communauté des organismes unicellulaires qui composent la base de ces réseaux (Li et al. 2009; Comeau et al. 2011). Comprendre la composition taxonomique de la communauté des protistes marins hétérotrophes dans l‟Océan Arctique sera primordial pour comprendre la réponse de cet écosystème aux changements. Plusieurs fonctions intéressantes des écosystèmes, comme la respiration et l‟utilisation des substrats, dépendent de la composition taxonomique des communautés bactériennes dans les sols et l‟eau douce (Bell et al. 2005; Langenheder et al. 2006; Strickland et al. 2009). Chez les eucaryotes hétérotrophes, la grande variabilité des taux de broutage et de croissance rapportés (Weisse 2002) suggère que la composition de cette communauté doit également avoir un effet sur les fonctions de l‟écosystème. Les facteurs qui affectent la répartition des taxons et la composition des communautés peuvent donc avoir des effets sur les cycles biogéochimiques et les réseaux trophiques.
Les mécanismes conduisant la répartition de microorganismes sont encore débattus (Hanson et al. 2012). L‟existence des assemblages taxonomiques caractéristiques dans les environnements différents comme les bassins anoxiques et les masses d‟eaux arctiques (Filker et al. 2007; Hamilton et al. 2008; Orsi et al. 2011) suggère un mécanisme au-delà des processus stochastiques. Par contre, plusieurs chercheurs pensent que les barrières à la dispersion ne sont pas importantes pour la répartition des protistes (Fenchel et Finlay 2004; Cermeðo et Falkowski 2009). Donc, c‟est la sélection des organismes par les facteurs environnementaux qui reçoit un intérêt croissant. Les effets des conditions environnementales sur la répartition ont été démontrés pour plusieurs groupes pélagiques marins, y compris une algue de la classe des prasinophytes (Foulon et al. 2008) et un flagellé hétérotrophe (Rodríguez-Martínez et al. 2013). Donc, pour comprendre et prédire les changements dans la répartition des protistes marins, cela est primordial de comprendre comment les variables environnementales déterminent ces répartitions.
1.02. Les flagellés hétérotrophes et les réseaux trophiques marins
C‟est reconnu depuis longtemps que les organismes unicellulaires sont responsables de la plupart de la production primaire dans les environnements marins. Dans les trente dernières années, nous sommes parvenus à comprendre que la plupart de cette production est également consommée et
recyclée par les organismes unicellulaires (Azam et al. 1983). Ce réseau microbien implique les membres des trois domaines de la vie, Eukaryota, Bacteria et Archaea. L‟action des microbes peut faire un « court-circuit » des chaînes trophiques en empêchant le carbone de se transférer aux maillons supérieurs.
1.03. L’importance écologique de la taille des organismes
La taille des organismes influe sur la prise de nutriments, la durée de génération, et les pertes dues au broutage et la sédimentation (Raven 1998). Normalement, les planctons sont cloisonnés dans les classes par leur rétention sur une membrane d‟une taille de pore donnée, selon le système de Sieburth et al. (1978). Les trois classes de taille les plus pertinentes pour les protistes sont les picoplanctons (0,2–2 µm), les nanoplanctons (2–20 µm), et les microplanctons (20–200 µm).
Les petits protistes hétérotrophes, dans la gamme de taille pico à nano, ont reçu moins d‟attention que les phototrophes pigmentés ou les microhétérotrophes comme les dinoflagellés ou les ciliés, en partie à cause des difficultés d‟identification par les moyens conventionnels (Boenigk et al. 2005); ils jouent cependant un rôle clé comme brouteurs des procaryotes hétérotrophes et phototrophes (Sherr et Sherr 2002; Chen et Liu 2010), et dans plusieurs environnements, incluant l‟Arctique, ils exercent un contrôle sur les populations bactériennes (Jürgens et Massana 2008; Vaqué et al. 2008). Le broutage sur les autotrophes picoeucaryotes est moins souvent rapporté, mais a été détecté dans les cultures (Christaki et al. 2005; Bręk-Laitinen et Ojala 2011) et les échantillons environnementaux (Sherr et al. 1997). Les pico- et nano- hétérotrophes sont consommés à leur tour par les microhétérotrophes et le zooplancton (Kuparinen et Bjornsen 1992; Jeong et al. 2007).
1.04. L’effet des changements climatiques sur les organismes de
l’Arctique
L‟Arctique présente plusieurs particularités environnementales pour les organismes unicellulaires. La disponibilité de la lumière pour les organismes photosynthétiques est saisonnièrement très limitée à cause des hautes latitudes et le couvert de glace, et l‟eau reste froide pendant toute l‟année. À cause des patrons globaux d‟évaporation et de précipitation, les apports riverains d‟eau douce, et la fonte saisonnière de la glace de mer (Aagaard et al. 1981), la colonne d‟eau est fortement stratifiée par la salinité (Carmack 2007), ce qui permet la formation de la glace de mer. Cette stratification par la salinité impose également la profondeur de la couche de mélange, dans laquelle les nutriments sont souvent peu disponibles aux planctons (Tremblay et al. 2008). Le compromis entre accès aux nutriments et la lumière crée un maximum sous-superficiel de la biomasse et la fluorescence de chlorophylle a (le SCM; Martin et al. 2010). L‟environnement unique de l‟Arctique
fait qu‟il possède également une communauté de protistes unique (ex. Lovejoy et al. 2006; Terrado et al. 2012). Par exemple, les cyanobactéries, qui sont des picophytoplanctons dominants dans la plupart des Océans mondiaux, sont absentes de l‟Arctique (Waleron et al. 2007), où les picochlorophytes photosynthétiques du genre Micromonas sont les picophytoplanctons dominants (Lovejoy et al. 2007).
Une dernière particularité de l‟Océan Arctique est que la communauté de la colonne d‟eau interagit de façon saisonnière avec la communauté dans la glace de mer. La communauté de la glace s‟initie pendant la formation de glace avec l‟incorporation des cellules de la colonne d‟eau (Rñżańska et al. 2008). Cependant, l‟environnement des bulles et canaux de saumure dans la structure de glace sélectionne une communauté qui est distincte de la communauté de la colonne d‟eau (Ikävalko et Gradinger 1997; Sime-Ngando et al. 1997a). Thomsen et al. (1997) ont trouvé, pour les choanoflagellés acanthoecides dans l‟Antarctique, que la différence dans la communauté est due à un taux de survie différentiel plutôt qu‟un recrutement sélectif pendant la formation de la glace. Ces cellules sont enfin relâchées dans la colonne d‟eau pendant la fonte de glace (Juul-Pedersen et al. 2010).
Tout cet environnement distinctif est présentement menacé par les changements climatiques. Pour plusieurs raisons, l‟effet du réchauffement global est plus sévère dans les régions polaires. Les effets les plus frappants comprennent une augmentation dans les apports d‟eau douce (ACIA 2005), et le retrait massif de la glace (Stroeve et al. 2012). Des tels effets se répercuteront naturellement au sein de la communauté microbienne. Il est fort possible que la production primaire totale dans l‟Océan Arctique augmentera à cause d‟une prolongation de la saison de croissance et une augmentation dans la superficie de l‟eau ouverte (Arrigo et al. 2008). Li et al. (2009) ont détecté une diminution de la taille moyenne des cellules, probablement due à une plus forte stratification et l‟inaccessibilité des nutriments, ce qui peut avoir des effets sur l‟export du carbone par la sédimentation, et le broutage par des niveaux trophiques supérieurs. Comeau et al. (2011) ont détecté un changement dans la composition taxonomique de la communauté de protistes avant et après l‟année minimum de glace en 2007. Les conséquences d‟un tel changement pour le réseau trophique ne sont pas encore bien comprises. Donc, une meilleure compréhension de tous les compartiments du réseau microbien nous aiderait à prédire les effets des changements climatiques sur l‟écosystème, mais surtout des groupes comme les HF, qui ont historiquement reçu moins d‟attention.
1.05. Les objectifs de cette thèse
2) Comprendre l‟impact des variables environnementales sur l‟abondance des différents taxons HF, afin de comprendre comment les changements environnementaux dans l‟Arctique peuvent modifier la composition de la communauté.
1.06. Les taxons HF
Bien qu‟ils puissent se ressembler morphologiquement, les petits HF comprennent une large diversité de niches écologiques. Cinq taxons HF connus pour être répandus dans l‟Océan Arctique ont été sélectionnés et ont reçus une attention particulière dans cette thèse: l‟Ordre des Cryomonadida, l‟Ordre des Choanoflagellida, le groupe polyphylétique des straménopiles marins (MAST), et les super-groupes eucaryotes Telonemia et Picozoa.
1.06.1.
Cryomonadida
L‟Ordre Cryomonadida est dans le super-groupe Rhizaria et le groupe Cercozoa. Cercozoa est sans rang taxonomique officiel reconnu, mais se compose de plusieurs amiboflagellés benthiques et planctoniques qui utilisent un pseudopode pour capturer leur proie (Cavalier-Smith 1998; Chantangsi et al. 2010). Cryomonadida comprend les genres Cryothecomonas, Protaspis, Rhogostoma, Rhizapis et Capsellina (Mylnikova et Mylnikov 2012), dont les trois derniers sont rapportés seulement dans les eaux douces. La majorité des taxons décrits sont des prédateurs de bactéries et des petits phytoplanctons, mais il y a au moins deux espèces, Cryothecomonas aestivalis (Drebes et al. 1996) et Protaspis longipes (Schnepf et Kühn 2000) qui sont des parasitoïdes des diatomées planctoniques. Pour les deux genres marins, Cryothecomonas a été rapporté dans la glace de mer et la colonne d‟eau (Thomsen et al. 1991; Sime-Ngando et al. 1997a; Tillmann et al. 1999; Garrison et al. 2005), alors que Protaspis a été rapporté dans les sédiments marins (Lee et Patterson 2000; Saburova et al. 2009), les lacs (Auer et Arndt 2001), la glace de mer (Ikävalko et Gradinger 1997) et la colonne d‟eau marine (Vørs 1993b).
1.06.2.
Choanoflagellés
L‟Ordre Choanoflagellida est dans le super-groupe Opisthokonta, qui inclut ainsi les animaux metazoaires et les Fungi (Adl et al. 2012). Il est caractérisé par la présence d‟un collier des microvillosités en forme d‟un entonnoir qui entoure le flagelle. À l‟exception d‟une brève phase motile suite à la division cellulaire, ce flagelle n‟est pas utilisé pour la motilité, mais pour générer un courant d‟alimentation. Les espèces connues sont attachées à un substrat, ou passivement suspendues dans la colonne d‟eau (Leadbeater 2008). Historiquement, cet ordre a été divisé en trois familles, Codonosigidae, Salpingoecidae et Acanthoecidae. Cependant, dans les phylogénies multigènes révisées, le seul clade retenu était Acanthoecidae, distingué par la possession d‟une
lorica siliceuse. Cette lorica leur permet un mode de vie planctonique sans fixation à un substrat, en leur donnant assez de masse pour résister à la poussée de la courante d‟alimentation (Carr et al. 2008). Les choanoflagellés comprennent des espèces dans tous les habitats aquatiques, y inclut l‟eau douce et marine, la glace der mer (Ikävalko et Gradinger 1997) et possiblement les sédiments (Dayel et al. 2011).
1.06.3.
Straménopiles Marins (MAST)
L‟expression « MAST » décrit plusieurs clades indépendants dans le super-groupe des straménopiles qui ont été récemment découverts à partir des études environnementales du gène 18S rRNA (Dìez et al. 2001; Not et al. 2009). L‟utilisation de l‟hybridation fluorescente in situ (FISH) a permis la caractérisation morphologique et écologique de plusieurs de ces clades phylogénétiquement définis. MAST-1 semble être un clade globalement répandu (Massana et al. 2006) alors que MAST-4, aussi très répandu dans les Océans globaux, semble être exclut des eaux froides, incluant l‟Arctique (Rodrìguez-Martínez et al. 2013). MAST-2 semble être le plus abondant des MASTs dans la glace de mer (Piwosz et al. 2013). Les observations et les expériences de broutage indiquent que la majorité des clades sont bactérivores (Massana et al. 2002, 2009; Piwosz et al. 2013). Cependant il a été observé chez MAST-6 des petits phytoplanctons eucaryotes dans ses vacuoles (Piwosz et Pernthaler 2010), et il y a une possibilité que MAST-4 puisse consommer des cyanobactéries (Lin et al. 2012).
1.06.4.
Picozoa
Les Picozoa ont été découverts dans les banques de clones du gène 18S ARNr de la fraction de taille < 3 µm (Not et al. 2007). Les observations originales avec les sondes d‟oligonucléotides spécifiques au groupe trouvaient une fluorescence de la phycobiline, concordante avec un lien proche aux cryptophytes (Cuvelier et al. 2008). Cependant, dans une étude génomique des cellules individuelles, Yoon et al. (2011) n‟ont pas détecté les gènes liés à la photosynthèse. Un représentant cultivé de Picozoa peut consommer le matériel colloïdal ou des particules virales (Seenivasan et al. 2013). L‟association putative entre les cellules ciblées par les sondes spécifiques aux Picozoa et la fluorescence de la phycobiline peut se produire si les cryptophytes mangent les Picozoa, ou, inversement, si les Picozoa s‟associent aux cyanobactéries, peut-être même en façon symbiotique comme observé pour un prymnésiophyte (Thompson et al. 2012).
1.06.5.
Telonemia
Le genre Telonema est connu depuis 1913, mais son gène 18S ARNr a été séquencé seulement dans cette dernière décennie. Il est devenu évident que ce groupe consistait un taxon de haut niveau
phylogénétique, peu apparenté aux autres super-groupes eucaryotes (Shalchian-Tabrizi et al. 2006). Une étude sur le gène 18S ARNr a montré qu‟il y avait des clades spécifiques à l‟eau douce et marine (Bråte et al. 2010b). Les espèces Telonemia décrits sont des nanoflagellés qui consomment des phytoplanctons eucaryotes (Klaveness et al. 2005).
1.07. Méthodologie
L‟identification des HF est couramment un problème en écologie microbienne. Bien que les cultures sont essentielles pour pleinement caractériser les taxons, elles sont difficiles à établir pour la majorité d‟entre eux. La microscopie optique conventionnelle peut exiger des échantillons vivants pour une identification concrète, ou simplement ne pas fournir suffisamment de caractères diagnostiques.
Les techniques basées sur le gène 18S ARNr fournissent une solution à ce problème. Ce gène, qui code la petite sous-unité de l‟ARN ribosomique, est retrouvé chez tous les eucaryotes, et une accumulation croissante des séquences de référence publiées facilite l‟identification basée sur la similarité des séquences et l‟analyse phylogénétique (Lim 1996). La présence des régions conservées, ainsi que variables, dans le gène fournit une bonne résolution pour une gamme d‟échelles taxonomiques.
1.07.1.
Hybridation fluorescente in situ (FISH)
FISH utilise une sonde oligonucléotide fluorescente, qui s‟hybride spécifiquement à l‟ARNr 18S. En ciblant différentes régions du gène, il est possible de concevoir des sondes pour de grands groupes taxonomiques ou spécifiques selon les objectifs du chercheur (Amann et a. 1990b). La présence d‟un grand nombre de ribosomes dans une cellule multiplie naturellement le signal fluorescent, qui peut être observé avec un microscope à épifluorescence (Pernthaler et al. 2001). L‟un des avantages de la technique est que les cellules sont observées directement. Nous pouvons interpréter les résultats sans ambiguïté comme la concentration des cellules dans un échantillon. Aussi, la plupart de la morphologie est préservée. Nous pouvons alors calculer la taille des cellules et leur biomasse, dans le cas des cellules phagotrophiques observer des proies dans les vacuoles de phagocytose. Les incertitudes associées à cette technique sont la perte de cellules pendant les manipulations, l‟hybridation non spécifique, et le potentiel que les futures révisions phylogénétiques révèlent des clades qui ne s‟accordent plus avec la séquence de la sonde. Également, le comptage des cellules prends beaucoup de temps, et le chercheur peut seulement examiner un nombre limité de taxons.
1.07.2.
Séquençage à haut-débit
Le séquençage à haut-débit, utilisant des techniques comme le pyroséquençage 454 (Margulies et al. 2005) ou Illumina (Bennett 2004), fournit une méthode pour capturer la diversité entière d‟un échantillon, incluant les taxons rares (Sogin et al. 2006). Les chercheurs peuvent décider de séquencer l‟ARN (sous forme d‟ADNc) au lieu de l‟ADN (p. ex. Terrado et al. 2011; Logares et al. 2012). Il est possible que le séquençage de l‟ARN donne plus d‟information sur l‟activité et l‟expression des gènes dans la cellule, en excluant les cellules mortes ou l‟ADN extracellulaire. Les limitations de cette technique sont le coût initial pour analyser un échantillon (bien que le coût par séquence soit assez bas), et les séquences relativement courtes qui pourraient ne pas fournir une résolution taxonomique assez fine pour certaines questions de recherche. Pourtant les avancées technologiques rapides ont apporté des améliorations aux niveaux des coûts et des longueurs de séquences. Une autre limitation est qu‟il n‟est pas toujours évident d‟anticiper le nombre de séquences produites par échantillon en fonction de l‟abondance initiale des cellules. Le nombre de copies du gène 18S ARNr varie de façon importante chez les protistes, même entre les souches du même genre (Zhu et al. 2005), les cellules avec plus des copies peuvent donc être surreprésentées dans les séquences. S‟il y a une étape initiale de PCR, les biais taxonomiques qui y sont associés (Jeon et al. 2008; Potvin et Lovejoy 2009) s‟appliquent aussi. Finalement, il faut s‟assurer que les erreurs de séquençage ne surestiment pas artificiellement la diversité de l‟échantillon (Huse et al. 2007).
Mon approche dans ce projet était d‟utiliser la technique du FISH pour évaluer la concentration de deux taxons HF, le genre Cryothecomonas et le clade MAST1 (avec ses sousclades MAST1A, -1B et -1C), à différents sites au travers de la Mer de Beaufort, l‟Archipel Arctique Canadien et le nord de la Mer de Baffin. Les échantillons d‟eau de mer étaient récoltés en utilisant un système CTD-rosette, à diverses profondeurs incluant la surface, le SCM, et le cas échéant, les masses d‟eau plus profondes. J‟ai utilisé des analyses statistiques pour déterminer l‟effet d‟une série de variables environnementales sur la répartition de ces taxons. Ces variables incluaient la distance au bord de la glace, la concentration de la chlorophylle a et les concentrations en nutriments nitrate et phosphate, et la biomasse des autres cellules phototrophes ou hétérotrophes dans la communauté.
À la suite des analyses avec la technique du FISH, les résultats étaient comparés à une analyse de l‟abondance relative des cinq taxons HF décrits ci-dessus, à l‟aide de données tirées du pyroséquençage 454. Les séquences HF étaient extraites de l‟ensemble de données déjà analysées provenant de la Mer de Beaufort et du Bassin du Canada, permettant une importante couverture spatiale et temporelle de l‟Ouest d‟Arctique des années 2003–2010. De nouvelles séquences
analysées provenaient de la Mer des Tchouktches. Pour les MAST, la répartition des sous-clades était examinée aussi. Pour les quatre autres taxons, la classification taxonomique des sous-clades est moins bien définie. Pour cette raison, les séquences courtes du pyroséquençage étaient intégrées à un arbre phylogénétique de référence pour caractériser davantage les organismes dans ces échantillons et identifier la potentielle structuration géographique de leurs répartitions.
1.08. Analyses Statistiques
L‟analyse des données d‟abondance des taxons comporte plusieurs particularités statistiques, incluant un manque de réplication, une forte proportion des valeurs nulles, des données non équilibrées et souvent une violation des suppositions de normalité et d‟homoscédasticité. Plusieurs variables environnementaux contextuels peuvent être mesurées et sont probablement autocorrélées. Les approches multivariées permettent de trouver des patrons de répartitions des taxons et peuvent être adaptées dans le cas où les suppositions de normalité et d‟homoscédasticité sont transgressées. Même dans une étude plutôt descriptive que expérimentale, les techniques statistiques qui construisent et testent des hypothèses sont cruciales pour identifier l‟effet des différentes variables environnementales.
1.08.1.
Les différents types de variables
Les variables sont continues si elles peuvent prendre n‟importe quelle valeur réelle dans une gamme possible. Elles sont discrètes, ou catégoriques si seulement un nombre limité de valeurs est possible. Dans le chapitre 3 de cette thèse, la proximité au bord de glace était traitée comme une variable discrète avec trois catégories : couverte de glace, près du bord de glace (≤ 55 km), et eau libre (≥ 55 km). Cette décision a été prise parce que nous considérons que la différence entre ces catégories est qualitative. En effet, la différence entre un site couvert de glace (distance = 0 km) et un site se trouvant à 1 km du bord de glace est plus importante que la différence entre deux sites se trouvant à 1 et 2 km du bord de glace. Au-delà de 55 km, l‟effet de la glace devient insignifiant et ne change pas avec distance. Un autre variable discrète est la masse d‟eau d‟où provient un échantillon. Dans les analyses multivariables, les variables discrètes prennent des valeurs de zéro ou un selon leur catégorie.
1.08.2.
Analyses de correspondance et de chemin
L‟analyse de correspondance trouve des relations entre les paires de variables. Par contre, le chercheur doit toujours garder à l‟esprit que ces relations ne signifient aucune rélation de cause à effet, surtout en ce qui concerne les variables environnementales où leur interdépendance peut masquer les vrais mécanismes de causalité sous-jacents. La correspondance partielle, définie comme
la correspondance entre deux variables si toutes les autres variables dans l‟ensemble sont fixées à leurs moyens, peut servir pour démêler ces relations. Le chercheur peut formuler des hypothèses comme suit : « L‟effet de la variable A sur la variable B est dû à son effet sur la variable intervenante C ». Ces hypothèses sont ensuite testées par comparaison entre les coefficients de correspondance et correspondance partielle. De plus, avec l‟inclusion des coefficients de régression, il est possible de partitionner ces effets entre les variables de façon quantitative, ce qui s‟appelle l‟analyse de chemin (en anglais path analysis). Il est à noter que ces hypothèses causales sont moins puissantes car elles sont construites a posteriori. Néanmoins, l‟exigence de les construire peut se voir comme un avantage car cela force le chercheur à s‟adresser, de façon explicite et mécaniste, à la biologie du système (Legendre et Legendre 1998).
1.08.3.
Analyse canonique de correspondance
Les techniques d‟ordination visent à représenter en façon bidimensionnelle les relations entre l‟abondance des taxons et les variables environnementales. Elles définissent des axes formés de combinaisons linéaires de toutes les variables environnementales et qui donnent la meilleure séparation des taxons dans cet espace bidimensionnel. Plus particulièrement, l‟analyse canonique de correspondance (ACC) suppose que chaque taxon a une valeur optimale pour chaque variable environnementale, c‟est-à-dire, que les taxons et les variables environnementales suivent une relation unimodale au lieu de linéaire. Cette rélation peut être vérifiée en regardant les données (ter Braak and Šmilauer 1998) et est généralement très plausible pour des systèmes biologiques.
Bien qu‟il n‟y ait pas une limite formelle au nombre de variables dans l‟analyse, trop de variables la rendre difficile à interpréter. Une étape initiale de sélection est donc cruciale. Parmi les différentes méthodes de sélection, un des plus populaires est la sélection ascendante. Cette méthode choisit les variables qui contribuent le plus à la variabilité de l‟abondance des taxons. Une fois choisie, chaque variable est enlevée du modèle et les contributions des autres variables sont recalculées. Le chercheur doit être conscient du fait que la sélection ascendante n‟est pas un test rigoureux de l‟importance des variables car elle procède à des testes multiples qui gonflent le taux d‟erreur Type I (Blanchet et al. 2008). Le bon sens dû à la connaissance biologique est le critère qui devrait ultimement primer dans la sélection des variables environnementales.
Comme l‟analyse de correspondance discutée ci-dessus, l‟ACC a un pouvoir limité pour tester les hypothèses, mais peut aider à les construire.
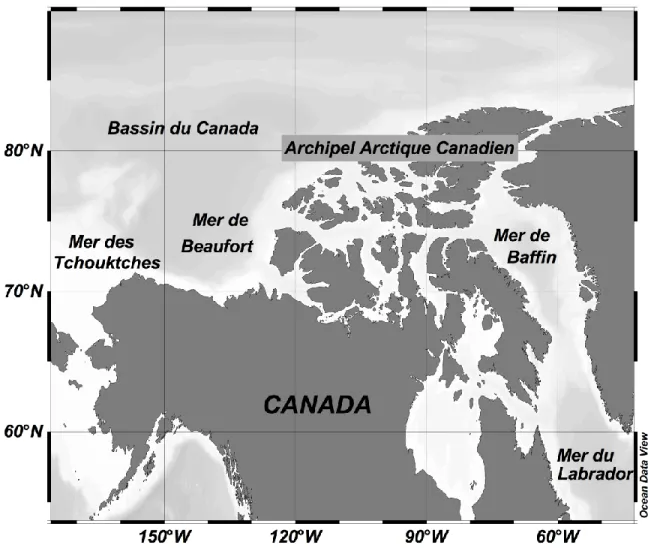
1.09. Région d’étude
Le tableau 1.1 présente une liste des sites d‟échantillonnage, et les méta-données associées, pour les trois articles de cette thèse. L‟échantillonnage a eu lieu au cours de différentes missions dans l‟Arctique, et se concentrait dans cinq régions avec des caractéristiques physiques distinctes : le nord de la Mer de Baffin, l‟Archipel Arctique Canadien, la Mer de Beaufort, le Bassin du Canada, et la Mer des Tchouktches (Figure 1.1). Bien que la disposition des masses d‟eau varie beaucoup à travers l‟Arctique, la plupart des régions sont caractérisées par (de la surface vers le fond): 1) une couche de mélange superficielle; 2) une couche d‟Eau d‟Hiver plus froide et saline, parfois d‟origine Pacifique; 3) l‟Eau Atlantique chaude et encore plus saline; 4) les eaux froides du fond, dont la provenance varie selon la région (Melling et Moore 1995; Bâcle et al. 2002; Lazier et al. 2002; McLaughlin et al. 2002; Prinsenberg et Hamilton 2004; Hamilton et al. 2008; et les références dans les sections ci-dessous).
1.09.1.
Nord de la Mer de Baffin
La Mer de Baffin est caractérisée par un entrelacement extensif entre les masses d‟eau dans la région frontale entre le courant chaud du Groenland occidental, s‟écoulant vers le nord, et le courant froid du Labrador, s‟écoulant vers le sud (Lovejoy et al. 2002). En hiver, un barrage de glace se forme à travers le Détroit de Nares, qui communique avec l‟Océan Arctique au nord, de sorte qu‟il empêche la glace d‟entrer dans la mer. En dessous du barrage les vents poussent la glace vers le sud lorsqu‟elle se forme, créant une région libre de glace, appelé une polynie (Tang et al. 2004). Cette eau libre de glace permet la persistance d‟un haut niveau de biomasse photosynthétique (Lewis et al. 1996), de la productivité primaire et secondaire, des oiseaux et des mammifères marins (Stirling 1980).
1.09.2.
Archipel Arctique Canadien
L‟Archipel Arctique Canadien inclut une importante aire complexe de détroits et de chenaux. Cependant, les études décrites dans cette thèse portent seulement sur le Chenal Parry, spécifiquement les détroits interconnectés de Vicomte Melville, Barrow et Lancaster. Ce chenal est couvert de banquise fixée à la côte qui provient de glace localement formée, ainsi que de glace exportée des autres régions par les vents et les courants. Selon les conditions dans le chenal ainsi que dans les régions avoisinantes, cette glace peut persister au long de l‟année, ou peut se disperser vers la fin de l‟été (Howell et al. 2009). La dérive de glace par les courants dans ce chenal se fait vers l‟est (Welch et al. 1992).
1.09.3.
Mer de Beaufort
La plupart de la Mer de Beaufort est très oligotrophe, sauf une partie du Golfe Amundsen au sud-est, caractérisée par des niveaux plus hauts de nutriments et de productivité primaire (Ardyna et al. 2011). Une caractéristique du sud de la Mer de Beaufort est la polynie récurrente du Cap Bathurst aux alentours de l‟Île Banks (Stirling 1980), et les chenaux de séparation le long de la côte, créés par la rotation anticyclonique de la banquise dans la Gyre de Beaufort (voir la discussion du Bassin du Canada ci-dessous). Ces chenaux restent ouverts pendant l‟hiver. En été, les eaux de surfaces de la Mer de Beaufort sont aussi influencées jusqu‟à une centaine de kilomètres au large de la côte par le panache d‟eau douce et turbide du Fleuve Mackenzie (Carmack et Macdonald 2002).
1.09.4.
Bassin du Canada
Le Bassin du Canada, dont la Mer de Beaufort constitue la partie sud, est dominé par une circulation anticyclonique, appelée la Gyre de Beaufort. La plongée d‟eau produite par cette circulation approfondit la nitracline, ce qui fait que la plupart de la biomasse se trouve à un SCM situé à 60 m ou plus de profondeur (McLaughlin et Carmack 2010). Le Bassin du Canada reste couvert par la banquise centrale de l‟Arctique pendant la plupart de l‟année, mais une partie est découverte par le retrait du bord de glace durant la saison de fonte, de juillet à septembre. Dans les dernières années, l‟ampleur de la zone libre de glace a augmenté, et le bord de la glace peut maintenant se trouver à plus de 80°N vers la fin de l‟été (Service Canadien des Glaces; URL : http://www.ec.gc.ca/glaces-ice).
1.09.5.
Mer des Tchouktches
La mer des Tchouktches recouvre un plateau continental très peu profond, moins de 60 m sur la plupart de sa superficie. L‟eau est mélangée jusqu‟au fond par les vents de surface (Woodgate et al. 2005). Elle est très productive, avec des exports importants de la surface vers le benthos (Grebmeier et al. 2006). Deux courants entrent dans la mer des Tchouktches par le Détroit de Bering: le courant Alaska sur la côte Est, pauvre en nutriments, et le courant Anadyr sur la côte Ouest, très riche en nutriments. La mer des Tchouktches reste couverte par la glace la plupart de l‟année. Les polynies commencent à paraître en juin, et deviennent continues avec l‟eau libre de la Gyre de Beaufort vers la fin août (Stringer et Groves 1991).
1.10. Plan de la thèse
Les trois chapitres de cette thèse consistent en trois articles qui examinent le rôle des facteurs environnementaux qui déterminent la répartition des taxons HF. Elle procède de la spécifque à la
générale : d‟une étude sur un seul genre, continuant avec une étude d‟un groupe majeur des HF, pour terminer avec une étude de l‟ensemble des HF dans l‟Arctique.
Article I — Distribution and diversity of a protist predator Cryothecomonas (Cercozoa) in Arctic Marine Waters (« Répartition et diversité d’un prédateur protiste Cryothecomonas (Cercozoa) dans les eaux arctiques marines »)
Publication: Journal of Eukaryotic Microbiology 59: 291–299, 2012.
Cet article décrit la répartition du genre HF Cryothecomonas dans l‟Arctique pendant une période de cinq ans (2006–2010). Les relations phylogénétiques entre les représentants en culture et les séquences environnementales, incluant des séquences provenant de nouvelles banques de clones, ont été examinées pour la première fois et utilisées pour concevoir une nouvelle sonde oligonucléotide ciblant ce genre pour la technique du FISH. Les cellules de Cryothecomonas étaient comptées dans les échantillons environnementaux, et les analyses de correspondance simples et partielles étaient utilisées pour regarder les relations avec les variables environnementales. Les objectifs de ce chapitre étaient :
1) Réactualiser la phylogénie de Cryothecomonas afin de vérifier l‟identification des séquences environnementales dans les bases de données.
2) Déterminer si les Cryothecomonas dans l‟Arctique sont des espèces brouteurs ou parasitoïdiques, en se basant sur les analyses phylogénétiques et les expériences de broutage.
3) Identifier les facteurs environnementaux qui influencent la répartition de Cryothecomonas.
Article II — Environmental selection of marine stramenopile clades in the Arctic Ocean and coastal waters (« Sélection environnementale des clades de straménopiles marins dans l’Océan Arctique et les eaux côtières »)
Publication : Polar Biology, 2013
Cet article utilise également la technique de FISH pour décrire la répartition géographique de trois sous-clades apparentés de MAST, MAST-1A, -1B et -1C, dans différentes régions de l‟Arctique de 2007 à 2008. Une analyse multivariée était utilisée pour examiner les relations avec les variables
environnementales. La phylogénie était également réactualisée afin d‟identifier les groupes spécifiques aux différents environnements. L‟objectif de ce chapitre était de détecter les différences entre la répartition des trois sous-clades le long des gradients environnementaux.
Article III — Communautés distinctes des flagellés hétérotrophes dans les régions différentes de l’Arctique
Cet article présente une méta-analyse de données de cinq études différentes, quatre de la colonne d‟eau et une de la glace de mer, par l‟utilisation du pyroséquençage 454. Trois études étaient tirées du sud de la Mer de Beaufort et le Golfe Amundsen, une du Bassin du Canada, et une de la Mer des Tchouktches. Ce chapitre compare la proportion des séquences identifiées dans les groupes HF connues (Cryomonadida, MAST, Picozoa, choanoflagellés, et Telonemia) et analyse ces données dans le contexte des variables environnementales. Cryomonadida, Picozoa, choanoflagellés et Telonemia étaient examinés avec un placement phylogénétique plus fin. Les objectifs de cette étude étaient :
1) Comparer la communauté HF dans les régions différentes de l‟Arctique, et les facteurs environnementaux responsables des différences entre ces régions.
2) Vérifier l‟attribution taxonomique des séquences courtes à partir du placement phylogénétique pour certains taxons HF.
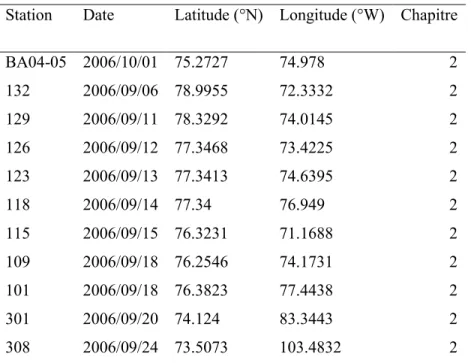
Table 1.1 Méta-données pour les stations d‟échantillonnage dans cette thèse. Canadian Arctic Shelf Exchange Study 2003–2004 :
Station Date Latitude (°N) Longitude (°W) Chapitre
CA-15 2003/10/10 71.5367 126.9555 4
200 2003/11/04 69.929 126.4887 4
200 2004/07/16 70.0453 126.3025 4
200 2004/08/06 70.0418 126.2608 4
ArcticNet 2005 :
Station Date Latitude (°N) Longitude (°W) Chapitre
CA-18 2005/09/12 70.6663 -122.993 4
ArcticNet 2006 :
Station Date Latitude (°N) Longitude (°W) Chapitre
BA04-05 2006/10/01 75.2727 74.978 2 132 2006/09/06 78.9955 72.3332 2 129 2006/09/11 78.3292 74.0145 2 126 2006/09/12 77.3468 73.4225 2 123 2006/09/13 77.3413 74.6395 2 118 2006/09/14 77.34 76.949 2 115 2006/09/15 76.3231 71.1688 2 109 2006/09/18 76.2546 74.1731 2 101 2006/09/18 76.3823 77.4438 2 301 2006/09/20 74.124 83.3443 2 308 2006/09/24 73.5073 103.4832 2
ArcticNet 2006 (suite) :
Station Date Latitude (°N) Longitude (°W) Chapitre
310 2006/09/25 71.4987 102.2413 2
405 2006/10/01 70.6511 -122.9483 4
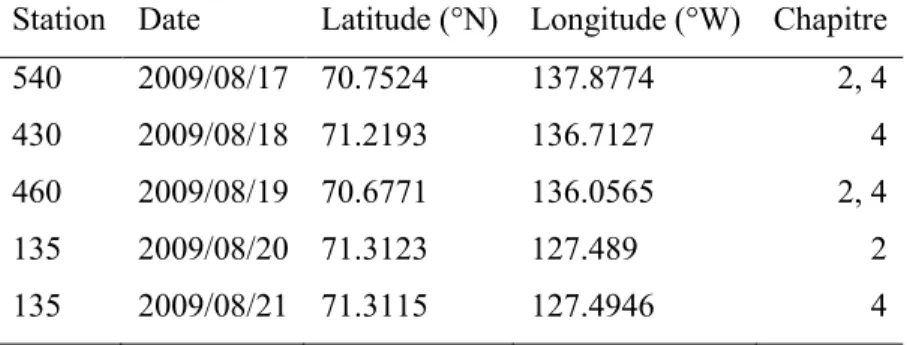
Canada’s Three Oceans (C3O) 2007–2008 :
Station Date Latitude (°N) Longitude (°W) Chapitre
LS2 2007/07/07 54.2543 54.1005 2, 3 LS4 2007/07/08 58.4836 53.6623 2, 3 LS7 2007/07/10 66.0017 57.6666 2, 3 BB1 2007/07/11 68.1953 56.4188 2, 3 BB5 2007/07/12 68.8308 61.7605 2, 3 BB8 2007/07/13 68.0908 64.0000 2, 3 BB10 2007/07/14 71.5651 65.3994 2, 3 BEW11 2007/07/16 72.3846 73.8938 2 CAA1 2007/07/17 74.1411 81.5537 2 CAA2 2007/07/17 74.2177 85.6500 2 CAA5 2007/07/20 73.5258 85.5086 2 CAA6 2007/07/22 71.9487 94.2889 2 CAA10 2007/07/22 70.6508 98.5883 2 CAA12 2007/07/24 68.6795 103.9175 2 CAA16 2007/07/28 68.382 113.115 2 BFB-5 2008/07/26 71.3297 133.7657 4 Canada Basin 2007 :
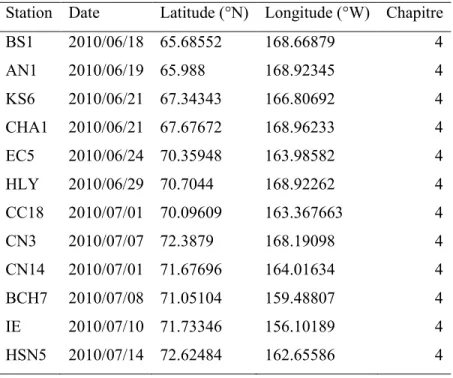
Station Date Latitude (°N) Longitude (°W) Chapitre
CB-4 2007/08/06 74.9183 150.1585 2 CB-9 2007/08/10 77.9348 149.8262 2 CB-10a 2007/08/11 78.3222 154.0436 2 CB-11b 2007/08/12 79.9915 149.9893 2 CB-15 2007/08/15 76.999 140.1874 2, 3, 4 CB-15 2007/08/18 76.9688 140.075 2, 3, 4
Canada Basin 2007 (Suite):
Station Date Latitude (°N) Longitude (°W) Chapitre
PP-6.5 2007/08/19 76.0565 132.481833 4
PP-2 2007/08/20 75.8447 128.6422 2, 3, 4 CB-17.5 2007/08/21 75.6501 139.7168 2, 3, 4
CB-21 2007/08/23 73.967 140.088 2
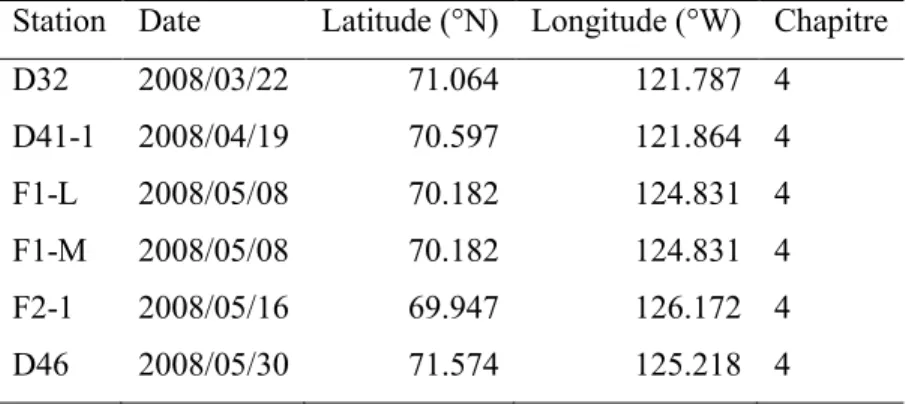
Circumpolar Flaw Lead Study 2007–2008 :
Station Date Latitude (°N) Longitude (°W) Chapitre
405 2007/11/19 70.6217 123.0014 4 D22 2008/02/18 71.3108 124.4966 2 D26 2008/02/25 70.9341 123.9226 2 D27 2008/03/02 70.7905 123.0694 2 D29 2008/03/10 71.0389 123.9108 2 D33 2008/03/28 71.064 121.7867 2 D38 2008/04/12 71.245 124.6117 2 FB1 2008/06/14 69.9838 125.8527 2 FB3 2008/06/14 69.968 125.8699 2 FB5 2008/06/15 69.9563 125.875 2 434 2008/06/20 70.1779 133.5542 2 421 2008/06/20 71.4725 133.9029 2 435 2008/07/02 71.0789 133.9776 2 6006 2008/07/04 72.6588 128.3601 2 410 2008/07/08 71.6947 126.4948 2 420 2008/07/08 71.0506 128.5108 2 416 2008/07/10 71.2884 127.7568 2 405 2008/07/21 70.6936 122.9173 2, 3 CA04.08 2008/07/31 71.0706 133.5682 3