AUGMENTATION DE L’IMMUNOGÉNICITÉ DE LA
NUCLÉOPROTÉINE DE L’INFLUENZA PAR
MULTIMÉRISATION IN VITRO
Mémoire
ALEXIS RUSSELLMaîtrise en microbiologie-immunologie
Maître ès sciences (M. Sc.)Québec, Canada
© Alexis Russell, 2015
iii
Résumé
Les travaux effectués au cours de ce mémoire ont permis de développer une alternative aux vaccins présentement utilisés contre le virus de l’influenza. Nous avons utilisé la nucléoprotéine (NP) de l’influenza comme base vaccinale puisque cette protéine est conservée chez les souches d’influenza A et qu’elle possède un potentiel de protection croisée. Nous avons montré que la multimérisation de la NP grâce à un gabarit d’ARN permet d’augmenter son immunogenicité. Cette multimérisation en pseudo-nucléoparticule virale (NLP) a augmenté la réponse humorale et cellulaire spécifique à NP et l’ajout d’un adjuvant (PAL) a permis d’amplifier davantage la réponse humorale contre NP. Une dose du vaccin candidat NLP-PAL n’a pas réussi à protéger des souris contre une infection létale avec une souche homotypique d’influenza. Cependant, des résultats avec un régime de deux immunisations montrent des résultats encourageants qui permettent d’espérer une protection envers une infection virale.
v
Abstract
The emergence of the highly pathogenic H5N1 avian influenza and the pandemic of 2009 have pushed scientists to find novel vaccinations strategies such as directing the immune response towards the internal proteins of the influenza. In this study, we have used recombinant nucleoprotein (rNP) as a vaccine basis since it is well conserved among the influenza A strains and it can confer cross-protection. To enhance the low immunogenicity of the rNP, we multimerized it using synthetic RNA as a scaffold to form Nucleocapsid-like-particles (NLP). The multimerization increased the cellular and humoral immunogenicity of NP and addition of the PAL adjuvant increased it even further. The NLP-PAL candidate vaccine was not able to fully protect mice from a lethal challenge after one immunization. A prime-boost immunization increased the humoral and cellular response but further experiments are needed to see if the prime-boost strategy can protect against a lethal influenza challenge.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... ix
Liste des figures ... xi
Liste des abréviations ... xiii
Remerciements ... xvii
Avant-propos ... xix
Chapitre 1. Introduction ... 1
1. L’influenza ... 1
1.1. Les composantes protéiques du virus ... 2
1.1.1. L’hémagglutinine (HA) ... 3
1.1.2. La neuraminidase (NA) ... 3
1.1.3. Le complexe d’ARN polymérase ... 4
1.1.4. La nucléprotéine ... 5
1.1.5. Les ribonucléoprotéines virales (vRNPs) ... 5
1.1.6. Les protéines de la matrice (M1, M2) ... 6
1.1.7. Les protéines non structurales (NS1, NS2) ... 7
1.2. Le cycle de réplication viral ... 8
1.3. La réponse immunitaire innée contre l’influenza ... 10
1.3.1. Activation de la réponse immunitaire innée ... 11
1.3.2. Rôle des macrophages ... 11
1.3.3. Rôle des cellules NK ... 12
1.4. La réponse immunitaire adaptative contre l’influenza ... 12
1.4.1. Induction de la réponse adaptative ... 12
1.4.2. La réponse humorale ... 13
1.4.3. La réponse cellulaire ... 15
1.5. Épidémiologie de l’influenza ... 17
1.6. Les pandémies d’influenza ... 19
2. La vaccination contre l’influenza ... 22
viii
2.2. Le vaccin vivant atténué (LAIV) ... 23
2.3. L’efficacité du TIV et LAIV ... 24
2.4. Les nouvelles approches en vaccination ... 25
2.4.1. L’utilisation d’adjuvants ... 25
2.4.1.1. Les nanoparticules du PapMV ... 26
2.4.2. Les vaccins pré-pandémiques ... 28
2.4.3. Les vaccins universels ... 29
2.4.3.1. Vaccin basé sur la région HA2 ... 29
2.4.3.2. Vaccin basé sur le domaine extracellulaire de M2 ... 30
2.4.3.3. Vaccin CTL ... 31
2.4.3.3.1. Les vaccins CTL ciblant NP ... 31
Chapitre 2 : Augmentation de l’immunogénicité de la nucléoprotéine de l’influenza par multimérisation in vitro. ... 35
Résumé ... 35
Abstract ... 38
Introduction ... 39
Results ... 41
Discussion ... 49
Material and methods ... 55
Acknowledgement ... 61 References ... 63 Tables ... 69 Figures ... 71 Chapitre 3 : Discussion ... 87 Chapitre 4 : Conclusion ... 91 Bibliographie ... 93
ix
Liste des tableaux
xi
Liste des figures
Figure 1-1 : Virus de l’influenza ... 2
Figure 1-2 : Organisation structurale des vRNPs d’influenza ... 6
Figure 1-3 : Composantes protéiques de l’influenza A. ... 8
Figure 1-4 : Le cycle de réplication du virus de l’influenza A ... 10
Figure 1-5 : Mécanismes de protection indirecte via la région Fc des anticorps ... 15
Figure 1-6 : Mécanismes classiques des variations antigéniques de l’Influenza A .... 18
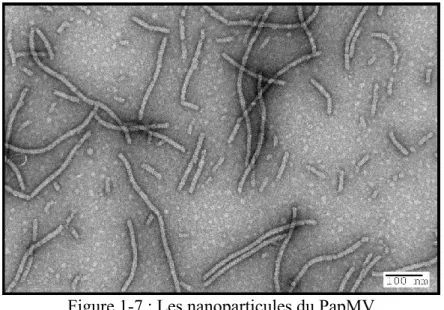
Figure 1-7 : Les nanoparticules du PapMV ... 28
Figure 2-1 : Production and Purification of recombinant NP ... 71
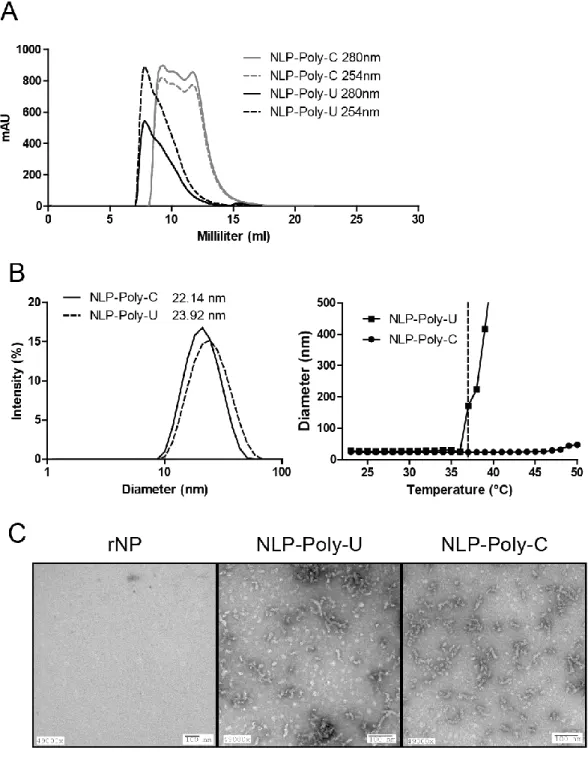
Figure 2-2 : Biochemical characterization of NLP-Poly-U and NLP-Poly-C ... 72
Figure 2-3 : Immunisation with NLP-Poly-C or NLP-Poly-U leads to similar humoral response. ... 73
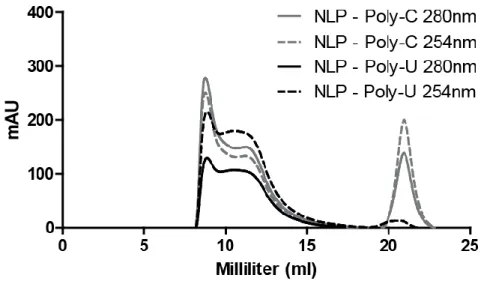
Figure 2-4 : Long-term stability of the NLPs ... 74
Figure 2-5 : Biochemical characterization of the updated NLP-Poly-U production. .. 75
Figure 2-6 : Multimerization of the monomeric rNP increases the humoral and cellular response against NP. ... 76
Figure 2-7 : Multimerization is still beneficial with the addition of an adjuvant ... 78
Figure 2-8 : Boost-immunization increases both humoral and cellular response ... 80
Figure 2-9 : Humoral response before the influenza challenge ... 82
Figure 2-10 : Kinetics of the survival rate and clinical symptoms following infectious challenge with a lethal dose of influenza A/WSN/33 (H1N1) virus. ... 83
Figure 2-11 : Humoral and cellular responses of the mice having survived to an influenza challenge ... 85
xiii
Liste des abréviations
ADCC: Antibody-dependent cell-mediated cytotoxicity Cytotoxicité cellulaire dépendante des anticorps ASC : Antibody-secreting cells
BCR: B-Cell receptor
Récepteur des cellules B
CDC: Complement-dependent cytotoxicity Cytotoxicité dépendante du complément CMH: Complexe majeur d’histocompatibilité CPA: Cellules présentatrices d’antigènes CR : Complement-receptor CTLs : Cytotoxic T-lymphocytes Lymphocytes T cytotoxiques DC : Dendritic cells Cellules dendritiques FcR : Récepteur Fc HA: Hémagglutinine IFN: Interféron
LAIV: Live-attenuated influenza vaccine Vaccin vivant atténué
M1 : Matrice protein 1 Protéine de la matrice 1 M2 : MAVS : Matrice protein 2 Protéine de la matrice 2
Mitochondrial antiviral-signaling protein
Protéines de signalisation mitochondriales antivirales (MAVS)
NA : Neuraminidase
NEP : Nuclear export protein NK : Natural killer cells
Cellules tueuses naturelles NLP : Nucleocapsid-like particles
Pseudo-nucléoparticules
NLRP3 : NOD-like receptor family pyrin domain containing 3
NP: Nucléoprotéine
NS1A: Non-structural protein 1 Protéine non-structurale 1 NS2 Non-structural protein 2
Protéine non-structurale 2 ORF: Open-reading frame
Cadre de lecture ouvert PA: Polymerase acidic protein
PAL: PapMV Adjuvant Long-lasting response PAMPs: Pathogen-associated molecular patterns
xiv
PapMV: Papaya Mosaic Virus PB1: Protéine basique 1 PB2: Protéine basique 2
PRRs: Pattern-recognition receptors QIV: Quadrivalent-inactivated vaccine
Vaccin quadrivalent inactivé RIG-I: Retinoic acid inducible gene-I rNP Recombinant nucleoprotein
Nucléoprotéine recombinante TCD8: Lymphocytes T CD8+
TCR: T-Cell Receptor
Récepteur des cellules T TIV: Trivalent-inactivated vaccine
Vaccin trivalent inactivé TLRs: Toll-like receptors VLPs: Viral-like particles
Pseudo particules virales vRNPs: Viral ribonucleoprotein
xv Au Dr. Joseph Glen Carlou III
xvii
Remerciements
J’aimerais remercier premièrement mon directeur de recherche Pierre Savard ainsi que mon codirecteur Denis Leclerc pour m’avoir donné l’opportunité de faire une maîtrise au sein de leur équipe de recherche.
J’ai passé deux belles années au sein de ce laboratoire puisque mon sujet de recherche me passionnait et particulièrement à cause d’une équipe remplie de gens exceptionnels. J’aimerais remercier Marie-Eve Laliberté Gagné pour ses conseils judicieux et sa participation aux nombreux essais de purifications; Caroline Garneau pour m’avoir montré la plupart des techniques associées au volet industriel de mon projet et sans qui je serais probablement encore en train de faire des bleedings à l’animalerie; Annie Guérin pour son savoir en culture cellulaire, ses réponses à mes nombreuses questions et sa participation à nos nombreuses critiques culinaires de la nourriture de la cafétéria; Geneviève Paquet pour sa bonne humeur contagieuse, sa détermination et sa capacité à m’écouter ; Damien Carignan pour ses connaissances scientifiques inégalées et son opinion éclairée; Ariane «Ardgiane» Thérien pour sa capacité à rire de la majorité de mes blagues, sa participation à l’éternel débat « le ou la bus » ainsi que pour ses goûts musicaux (Koll and the Gang); Sabrina Bossé pour son écoute, sa folie positive contagieuse et son temps investi à aller chercher un «hot beverage» avec moi. Je voudrais remercier spécialement Marilène Bolduc pour son soutien dans les bons et mauvais moments de mon projet, ses nombreux conseils ainsi que pour m’avoir montré ce qu’il fallait pour être quelqu’un de professionnel dans le domaine de la recherche. J’aimerais en dernier remercier Gervais Rioux pour m’avoir enduré chaque jour pendant plus de 2 ans, pour son soutien constant, son aide et son opinion lors de nos nombreuses discussions scientifiques, sa capacité à voir le positif dans chacune de mes expériences ainsi que pour son sens de l’humour légendaire.
xix
Avant-propos
Ce mémoire contient les résultats de mes deux années de maîtrise sous forme d’un article qui sera éventuellement soumis pour une publication dans un journal scientifique. Ce projet a été sous ma responsabilité et j’en suis donc l’auteur principal sous la supervision de mon directeur de recherche Pierre Savard et de mon codirecteur Denis Leclerc.
J’ai rédigé ou adapté l’ensemble des protocoles utilisés dans les expériences présentées dans ce mémoire. Marilène Bolduc et Pierre Savard ont révisé la majorité des protocoles afin que ceux-ci répondent aux critères de qualité du laboratoire. J’ai effectué toutes les expériences seul ou avec l’aide de Gervais Rioux en plus de recevoir de l’aide technique pour les expériences à l’animalerie et lors du processus de purification. Pierre Savard, Denis Leclerc, Marilène Bolduc et Gervais Rioux ont tous participé au processus de réflexion par rapport au projet durant ma maîtrise.
J’ai écrit le manuscrit sous la supervision de Denis Leclerc et Gervais Rioux m’a aidé dans la mise en page de l’article et des figures. Le manuscrit n’a pas encore été soumis à un périodique scientifique avec révision par des pairs.
1
Chapitre 1. Introduction
1. L’influenza
L’influenza est un virus appartenant à la famille des Orthomyxoviridae qui est responsable de maladies respiratoires aiguës (grippe) causant des problèmes à travers le monde. Elle infecte annuellement de 3 à 5 millions de personnes et elle est responsable de 250 000 à 500 000 décès par année[1]. Cette maladie est caractérisée par une montée soudaine de fièvre, toux, maux de tête, malaises et de myalgies intenses [2]. L’influenza se transmet habituellement de personne à personne par l’inhalation de gouttelettes projetées par une personne infectée. La transmission peut aussi se faire par contact direct ou indirect avec des sécrétions respiratoires. Lors d’une infection des voies respiratoires par le virus, la plupart des gens en santé vont se rétablir en une semaine, et ce sans nécessiter de soins médicaux. L’influenza peut par contre causer une maladie sévère et la mort chez les gens ayant un risque accru de complications comme les enfants en bas âges, les personnes âgées ainsi que les personnes qui possèdent un système immunitaire diminué[1].
Les virus qui causent l’influenza sont des virus enveloppés faisant partie de la famille des Orthomyxoviridae et ils sont classés selon trois types différents (Influenza A, B ou C) par rapport à leurs protéines internes distinctes [3]. Ils possèdent une structure sphérique, filamenteuse ou irrégulière d’un diamètre de 80 à 120 nm (Figure 1.1). Ce sont des virus à ARN simple brin, de polarité négative et possédant un génome segmenté. Le virus de l’influenza A est l’agent étiologique majeur des épidémies humaines d’influenza ainsi que le seul des trois types à causer des pandémies chez l’homme [4]. De plus, ce virus peut aussi infecter les oiseaux, les porcs, les chevaux ainsi que d’autres mammifères. Le virus de l’influenza A possède une classification supplémentaire en relation avec les différences antigéniques de deux de ses glycoprotéines de surfaces, l’hémagglutinine (HA) et la neuraminidase (NA). Il y a actuellement seize sous-types de HA et neuf sous-types
2
de NA circulant dans le réservoir naturel du virus: les oiseaux aquatiques. Les sous-types qui circulent chez l’homme sont limités à H1, H2, H3 ainsi qu’à N1 et N2 [5].
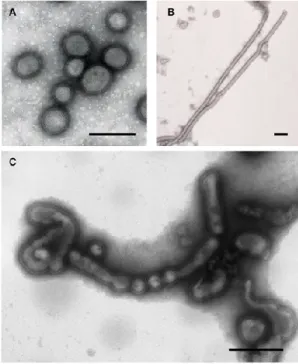
Figure 1-1 : Virus de l’influenza
Microscopie électronique des différentes morphologies du virus influenza
(A) Virions sphériques [A/WSN/33 (H1N1)]. (B) Virions filamenteux [A/Udorn/307/72 (H3N2)]. (C) Virions irréguliers [A/Puerto Rico/8/34 (H1N1)][6]
1.1. Les composantes protéiques du virus
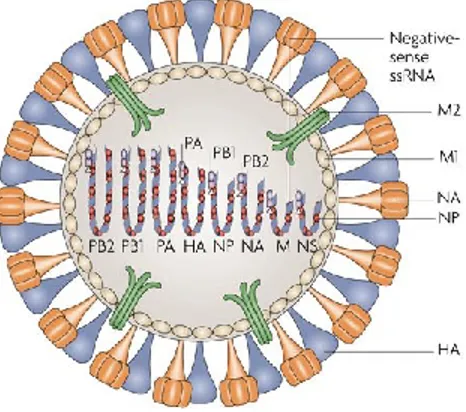
Le virus de l’influenza possède un génome segmenté qui est composé de 8 ARN simple-brin de polarité négative possédant des longueurs différentes et codant pour 11 protéines (Figure 1-3). Les segments d’ARN 1, 2 et 3 codent pour les trois protéines formant le complexe d’ARN polymérase dépendant de l’ARN: la “polymerase acidic protein (PA)”, ainsi que les “polymerase basic proteins 1 and 2 (PB1, PB2)”. La séquence de PB1 code également pour la protéine non structurale PB1-F2 qui possède des propriétés pro-apoptotiques chez les cellules immunitaires [7]. Les segments 4 ,5 et 6 codent respectivement pour HA, la nucléoprotéine (NP) et NA. Via un épissage alternatif de sa séquence, le segment 7 code pour deux protéines de matrice différentes M1 et M2 alors que le segment 8 code quant à lui pour deux protéines non structurales NS1A et NS2/NEP.
3
1.1.1. L’hémagglutinine (HA)
HA est l’une des deux glycoprotéines du virus et elle se trouve sous forme de trimères à la surface du virus. Elle est responsable de l’attachement aux récepteurs d’acides sialiques cellulaires de la cellule infectée ainsi qu’au relâchement des ribonucléoprotéines virales (vRNPs) à l’intérieur du cytoplasme. HA est synthétisée initialement sous forme de précurseur HA0 qui, lorsque clivé par des protéases cellulaires, produira la glycoprotéine mature formée des sous-unités HA1 et HA2 qui sont liées par un pont disulfure [8]. Le clivage du précurseur HA0 est nécessaire à la production d’un virion infectieux et joue aussi un rôle important dans la pathogénicité du virus chez l’homme ainsi que chez les oiseaux [9,10]. La sous-unité HA1 contient le site de liaison à l’acide sialique alors que la sous-unité HA2 contient le peptide nécessaire à la fusion des membranes virales et endosomales lors de l’infection [11,12].
1.1.2. La neuraminidase (NA)
La NA est l’autre glycoprotéine du virus qui se trouve sous forme de tétramères à sa surface. Elle possède une activité ayant pour fonction de cliver les résidus d’acides sialiques terminaux présents sur les glycoprotéines cellulaires, ce qui permet le relâchement des nouveaux virions. La NA a aussi pour fonction de cliver les résidus d’acides sialiques présents à la surface du virus afin d’empêcher son agrégation lors du cycle de réplication [5]. De plus, elle joue un rôle important dans le processus infectieux en clivant les acides sialiques des mucines présentes sur la muqueuse respiratoire de l’hôte, ce qui facilite un rapprochement entre le virus et les cellules cibles [13]. La NA est particulièrement importante dans le cycle de réplication du virus, ainsi une NA inactive ou inhibée entraîne une agrégation du virus à la membrane cellulaire ainsi qu’une diminution importante de l’infectivité [14].
4
1.1.3. Le complexe d’ARN polymérase
Le génome de l’influenza A est segmenté en 8 complexes de vRNPs. Chacun de ces complexes contient un des 8 segments d’ARN, un complexe d’ARN polymérase (contenant PA, PB1, PB2) ainsi que de nombreuses copies de NP liant l’ARN [15]. Les protéines PA, PB1 et PB2 forment le complexe d’ARN qui se charge à la fois de la transcription de l’ARNm viral ainsi que de la réplication du génome à l’intérieur du noyau. Ces trois protéines sont nécessaires afin d’assurer une réplication et une transcription efficace à l’intérieur des cellules infectées [16].
PA possède une activité endonucléase [17] et protéase [18] et elle serait aussi nécessaire à l’accumulation de PB1 à l’intérieur du noyau [19]. PB1 contient quatre motifs d’acides aminés conservés (I, II, III, IV) qui sont caractéristiques d’une activité catalytique ARN polymérase dépendante de l’ARN. PB1 est directement impliquée dans l’élongation de la chaîne d’ARN [19,20]. Un cadre de lecture ouvert (ORF) alternatif de l’ARNm de PB1 code pour PB1F2. Cette protéine de 87 acides aminés possède la propriété intrinsèque de se localiser à la mitochondrie et d’y causer une altération de sa morphologie. Cette altération se traduit par une perte de potentiel à la membrane mitochondriale et entraîne l’apoptose chez les cellules immunitaires, en particulier chez les macrophages [7,21]. De plus, PB1F2 serait impliquée dans l’augmentation de la pathogénicité via une perturbation de la production de cytokine et du déclenchement de l’inflammation [22]. PB2 est quant à elle responsable de la reconnaissance et de la liaison des fragments de l’extrémité 5’ (coiffe) des ARNm cellulaires. Ces fragments sont utilisés comme amorces lors de la transcription de l’ARN viral [23]. PB2 joue un rôle déterminant dans la virulence en interagissant avec des protéines de signalisation mitochondriales antivirales (MAVS) ce qui inhibe l’expression de cytokines antivirales comme l’interféron-β [24].
5
1.1.4. La nucléprotéine
La NP de l’influenza est une protéine de 498 acides aminés riche en résidus arginines, glycines et sérines. Elle est impliquée dans la spécificité de la gamme d’hôtes infectés par le virus en interagissant avec différentes protéines de l’hôte. [25][26]. Sa fonction principale est d’encapsider les ARN génomiques du virus sous forme de vRNPs.Elle est essentielle à la réplication et à la transcription de l’ARN génomique in vitro et in
vivo [27]. Elle influence aussi le choix d’utiliser l’ARN viral pour la transcription en
ARNm ou pour la synthèse de l’ARN complémentaire en se liant à PB1 et PB2 [28]. La NP est capable de lier l’ARN avec une haute affinité, et ce d’une manière indépendante de la séquence d’ARN via une région chargée positivement à l’intérieur de sa structure [29,30].
1.1.5. Les ribonucléoprotéines virales (vRNPs)
Les vRNPs d’influenza sont formées d’un ARN simple-brin, d’un complexe d’ARN polymérase et de nombreuses copies de NP. Elles ont une structure en forme de bâtonnet d’un diamètre de 13 nm et une longueur de 30 à 110 nm qui concorde avec la longueur des différents segments d’ARN du virus [31]. Des analyses en microscopies électroniques montrent que les vRNPs n’ont pas une structure linéaire, mais plutôt une structure en hélice (tige-boucle) [32]. La structure en double-hélice résulte de l’arrangement de l’ARN simple-brin en deux brins antiparallèles qui s’enroule ensemble sous l’action de la NP. L’un des brins se dirige vers le complexe d’ARN polymérase alors que l’autre brin s’en éloigne [33]. Les deux brins antiparallèles sont connectés par une courte boucle à une extrémité de la vRNP et ils interagissent avec le complexe d’ARN polymérase qui est présent à l’autre extrémité (Figure 1-2).
Bien que NP soit responsable de l’encapsidation de l’ARN, elle est incapable de protéger l’ARN contre une digestion par la RNase, ce qui suggérerait que l’ARN se retrouve à l’extérieur de la vRNP (Figure 1-2)[34]. Des analyses sur des vRNPs
6
isolées de virus ont démontré qu’elles étaient capables de maintenir leur structure en double-hélice, et ce, en absence d’ARN [35]. Ces résultats suggèrent que NP joue un rôle majeur dans l’organisation et la stabilisation de la structure des vRNPs. Des analyses structurales ont aussi démontré que NP pouvait s’auto-assembler sous forme d’homo-oligomères grâce à une région « tail-loop » de 28 acides aminés et que cet assemblage était nécessaire pour l’activité des vRNPs [36].
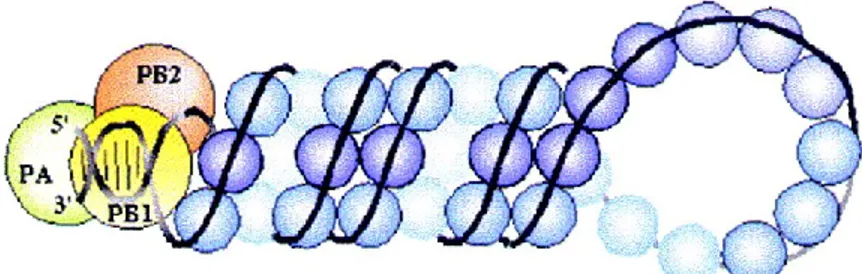
Figure 1-2 : Organisation structurale des vRNPs d’influenza
Les sphères bleues représentent les monomères de NP qui sont associés à l’ARN viral (ligne noire) qui se retrouve à l’extérieur de la vRNP. L’ARN simple-brin forme une structure tige-boucle et possède une courte région double (formée par les extrémités 5’ et 3’) qui forme le site de liaison pour le complexe d’ARN polymérase (PA, PB1, PB2) [37].
1.1.6. Les protéines de la matrice (M1, M2)
La protéine de matrice M1 est la protéine structurale la plus abondante du virus. C’est une protéine de 252 acides aminés qui joue un rôle primordial aussi bien au point de vue structural que fonctionnel lors du cycle viral. Cette protéine, présente sous forme d’oligomères, est localisée entre la membrane lipidique et les vRNPs, et forme la matrice rigide du virus. En interagissant avec l’ARN viral et les vRNPs, M1 est impliquée dans la localisation nucléaire de l’ARN viral, l’inhibition de sa transcription et dans la régulation de l’importation et de l’exportation des vRNPs nouvellement synthétisés [38]. La protéine M1 joue aussi un rôle dans l’assemblage et le bourgeonnement du virus. Elle se charge d’apporter les composantes du virus au site de bourgeonnement, interagit avec les protéines de surfaces du virus (HA,NA,M2) et recrute des composantes cellulaires nécessaires au bourgeonnement des nouveaux virus [39].
7 La protéine de matrice M2 est traduite via un épissage alternatif du segment 7 de l’ARN viral. C’est une protéine membranaire de type III formant un homotétramère à la surface du virus. Elle sert de canal ionique transmembranaire et joue un rôle dans l’entrée ainsi que dans l’assemblage et le bourgeonnement du virus [40]. Lorsque le virus se retrouve à l’intérieur de l’endosome, la protéine M2 pompe des ions hydrogènes à l’intérieur de la particule virale. Cette acidification interne du virion perturbe les interactions protéines-protéines ce qui permet aux vRNPs d’être relâchés de la matrice virale et de se diriger vers le noyau de la cellule infectée [5].
1.1.7. Les protéines non structurales (NS1, NS2)
La protéine non structurale NS1 est responsable de contrecarrer la réponse immunitaire de l’hôte contre le virus, plus particulièrement en inhibant la production de molécules antivirales comme l’interféron. NS1 est une protéine d’environ 26 kDa contenant deux domaines distincts: un domaine N-terminal liant l’ARN et un domaine C-terminal effecteur [41]. NS1 est une protéine multifonctionnelle ayant des propriétés régulatrices qui affectent de nombreuses fonctions cellulaires. NS1 se lie à l’ARN double-brin et prévient l’activation de la ribonucléase L. Elle bloque aussi la reconnaissance de l’ARN viral simple-brin phosphorylé en 5’ par l’ARN hélicase RIG-I «retinoic acid-inducible gene 1», ce qui prévient l’activation de nombreux facteurs de transcriptions et du promoteur de l’interféron-β. NS1 peut aussi inhiber l’épissage de l’ARN messager cellulaire et bloquer l’exportation de transcrits cellulaires polyadénylés [42].
La protéine non structurale NS2, aussi appelée «nuclear export protein» (NEP), est traduite via un épissage alternatif du segment 8 de l’ARN viral. Cette protéine de 121 acides aminés est impliquée dans l’exportation vRNPs du noyau jusqu’au cytoplasme. Elle régule l’accumulation des différents types d’ARN présents lors de la réplication du virus (ARNm, ARNc, ARNv) en plus de jouer un rôle lors du bourgeonnement du virus en interagissant avec une ATPase cellulaire [43].
8
Figure 1-3 : Composantes protéiques de l’influenza A. Représentation schématique des 11 protéines formant le virus de l’influenza [44]
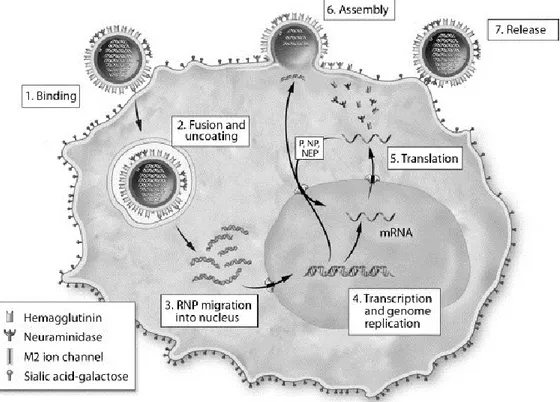
1.2. Le cycle de réplication viral
La première étape du cycle de réplication (Figure 1-4, 1) est la liaison du virus à une cellule de l’hôte. C’est la HA virale qui lie un acide N-acétylneuraminique (sialique) présent sur des glycoprotéines ou glycolipides cellulaires. Chez l’humain, HA lie préférentiellement les acides sialiques attachés au galactose via une liaison α2,6 qui est prédominante chez les cellules de l’épithélium respiratoire supérieur. Chez les souches d’influenza aviaire, HA lie préférentiellement les résidus d’acides sialiques α2,3 des cellules aviaires [5].
Suite à la liaison entre le virus et une cellule de l’hôte, il y a endocytose du virus. Sous l’effet de l’acidification de l’endosome tardif, la baisse de pH entraîne un changement de conformation chez HA ce qui expose le peptide permettant la fusion entre l’enveloppe virale et la membrane de l’endosome (Figure 1-4, 2). Cette fusion crée un pore par lequel les vRNPs sont relâchées dans le cytoplasme [45]. La protéine M2 sert de canal ionique et pompe des ions hydrogène à l’intérieur du virus pour permettre la libération des vRNPs dans le cytoplasme. L’acidification du virus perturbe les interactions entre la matrice virale (M1) et les vRNPs, ce qui favorise leur relâchement dans le cytoplasme [5].
9 Lorsque les vRNPs se retrouvent dans le cytoplasme, elles sont transportées vers le noyau grâce à des signaux de localisation nucléaire localisés dans les protéines virales (Figure 1-4, 3) [46]. La réplication et la transcription de l’ARN génomique sont réalisées dans le noyau et sont médiées par le complexe de réplication (PB1, PB2, PA) du virus (Figure 1-4, 4). La réplication du virus débute par la production d’un ARN complémentaire de polarité positive qui sera utilisé pour produire de multiples copies de l’ARN génomique de polarité négative [47]. Il y a ensuite transcription de l’ARN complémentaire par l’ARN polymérase et traduction des ARNm viraux au niveau du cytoplasme (Figure 1-4, 5). Les sous-unités du complexe de réplication et les nucléoprotéines sont transportées à nouveau dans le noyau pour s’associer avec les différents segments du génome viral [48]. Lorsque les nouvelles vRNPs sont assemblées, elles quittent le noyau via des pores cellulaires avec l’aide de NEP et M1 pour ensuite se diriger vers la membrane cellulaire [47]. Les protéines de l’enveloppe HA, NA et M2 sont synthétisées au réticulum endoplasmique et transférées à l’appareil de Golgi pour subir des modifications post-traductionnelles. Ces trois protéines possèdent des signaux de localisation qui les dirigent directement à la membrane cellulaire [5].
L’assemblage et le bourgeonnement du virus (Figure 1-4, 6-7) se déroulent à la membrane plasmique et sont initiés par l’accumulation de HA et NA aux radeaux lipidiques. M1 se lie à la région cytoplasmique de HA et NA et sert de point d'ancrage pour les vRNPs. L’élongation du virus bourgeonnant est causée par la polymérisation de la protéine M1 alors que la protéine M2 est recrutée en périphérie du virus via des interactions avec M1 et excise le virus de la membrane plasmique. Suite à l’excision, les virus sont encore liés à la membrane via une interaction entre HA et les acides sialiques présents à la surface de la cellule. C’est l’activité sialidase de NA qui brise cette liaison et finalise le cycle de réplication du virus [49].
10
Figure 1-4 : Le cycle de réplication du virus de l’influenza A
Représentation des différentes étapes nécessaires au cycle de réplication du virus de l’influenza [48]
1.3. La réponse immunitaire innée contre l’influenza
La principale cible du virus de l’influenza est la couche de cellules épithéliales présente dans la muqueuse respiratoire. La surface de la muqueuse joue le rôle de barrière physique et chimique puisqu’elle est tapissée d’une couche de mucus contenant des mucines, des collectines ainsi que des cellules immunitaires [50] . Si le virus réussit à passer à travers cette barrière, il peut se lier et infecter une cellule ce qui déclenche une multitude d’événements associés à la réponse immunitaire innée. La réponse qui est générée par une stimulation de l’immunité innée est habituellement rapide et non-spécifique.
11
1.3.1. Activation de la réponse immunitaire innée
L’activation du système immunitaire inné s’amorce par la reconnaissance de motifs répétés présentés par le virus. Ces motifs appelés «Pathogen-associated molecular patterns» (PAMPs) sont reconnus par des récepteurs «Pattern-recognition receptors» (PRRs) exprimés sur les cellules immunitaires. Il y a trois catégories de PRRs qui sont impliquées dans la reconnaissance de l’influenza: les «Toll like receptors» (TLRs), les «retinoic acid inducible gene-I» (RIG-I) et les «NOD-like receptor family pyrin domain containing 3» (NLRP3) [51,52]. Le récepteur intracellulaire TLR7 reconnaît l’ARN simple-brin du virus (ARNss) suite à la dégradation des complexes de ribonucléoprotéines à l’intérieur des endosomes alors que les ARNs viraux 5’-triphosphates sans coiffe qui sont produits dans le cytoplasme lors de l’infection sont reconnus par les récepteurs RIG-I [53]. L’activation de ces différents récepteurs mène à une cascade de signalisation antivirale qui entraîne la production d’interféron de type 1 (IFNs), de cytokines pro-inflammatoires et de chimiokines. Il y a aussi un recrutement des neutrophiles, une activation des macrophages ainsi qu’une maturation des cellules dendritiques [52,54] . Les interférons de type 1 sont sécrétés par les macrophages, les pneumocytes, les cellules dendritiques et les cellules dendritiques plasmacytoïdes et mènent à l’expression de plus d’une centaine de gènes induisant un état antiviral chez les cellules avoisinantes [52].
1.3.2. Rôle des macrophages
Lors de l’infection des cellules épithéliales respiratoires, les cellules infectées produisent la chimiokine CCL2 qui attire les macrophages alvéolaires ainsi que les monocytes au site de l’infection via leur récepteur CCR2. Les macrophages activés vont augmenter la réponse pro-inflammatoire en produisant différentes cytokines comme l’IL-6 et le TNF-α [53]. Les macrophages alvéolaires sont aussi responsables de limiter la propagation du virus en phagocytant les cellules apoptotiques infectées [55]. La réponse immunitaire des macrophages n’est pas seulement bénéfique puisque lorsqu’ils sont activés, ils produisent du TNF-α ainsi que de l’oxyde nitrique
12
synthase 2 (NOS2). Ces deux produits contribuent à augmenter la sévérité de l’infection [56,57].
1.3.3. Rôle des cellules NK
Les cellules tueuses naturelles (NK) sont les lymphocytes du système immunitaire inné et ils ont pour rôle de contrôler l’infection virale via la production d’IFN-γ et la sécrétion de granules cytotoxiques qui vont induire l’apoptose chez les cellules infectées [58]. Lors d’une infection par l’influenza, les macrophages activés vont produire de l’IFN-α, de l’interleukine 12 12) ainsi que de l’interleukine 18 (IL-18) qui vont réguler l’activation des cellules NK et leur production d’IFN-γ. Étant donné que l’IFN-γ active les macrophages, il se crée une boucle de rétroaction positive entre les macrophages et les cellules NK ce qui mène à une réponse innée efficace contre le virus [59]. Les cellules NK possèdent deux récepteurs NKp44 et NKp46 qui reconnaissent les HA présentes à la surface des cellules infectées. Ces récepteurs sont importants pour le contrôle de l’infection et l’absence de ce récepteur chez les souris les rend plus vulnérables à l’infection par influenza menant à une plus grande mortalité [60].
1.4. La réponse immunitaire adaptative contre l’influenza
La réponse immunitaire adaptative requiert plusieurs jours avant de se mettre en marche, mais lorsqu’elle est enclenchée, elle permet de contenir la croissance du virus, de l’éliminer et d’établir une réponse mémoire qui permettra une résistance lors d’une réinfection par une souche homologue du virus. Une infection par l’influenza induit une réponse humorale locale et systémique ainsi qu’une réponse cellulaire.
1.4.1. Induction de la réponse adaptative
Les cellules présentatrices d’antigènes (CPA) professionnelles, dont les cellules dendritiques (DCs), forment le pont entre le système immunitaire inné et le système immunitaire adaptatif. Lors d’une infection, les DCs amorcent la réponse immunitaire
13 adaptative en présentant des antigènes viraux de l’influenza aux lymphocytes B et T naïfs. Les DCs peuvent acquérir les antigènes par deux mécanismes différents. Dans le premier mécanisme, la DC est directement infectée par le virus et des protéasomes présents dans le cytosol dégradent les protéines virales. Les peptides résultants sont chargés et présentés sur les molécules du complexe majeur d’histocompatibilité (CMH) de classe 1. Ces CMH de classe 1 sont reconnus par des lymphocytes T CD8+ cytotoxiques spécifiques aux peptides de l’influenza présentés [58]. Dans le deuxième mécanisme, les DCs acquièrent les antigènes via la phagocytose des particules virales ou des cellules épithéliales apoptotiques. Les protéines virales sont dégradées en peptides à l’intérieur des endosomes/lysosomes. Ces peptides sont ensuite chargés sur les molécules du complexe majeur d’histocompatibilité (CMH) de classe 2 et présentés à la surface des cellules. Les CMH de classe 2 sont reconnus par des lymphocytes T CD4+ auxiliaires spécifiques aux peptides présentés et elles assistent à la prolifération des lymphocytes B et à leur maturation en plasmocytes [53] . Ce deuxième mécanisme d’acquisition d’antigènes peut aussi mener à la présentation de peptides viraux sur les molécules de CMH de classe 1 via un processus de présentation croisée [58].
1.4.2. La réponse humorale
La réponse humorale contre l’influenza s’amorce dans les ganglions lymphatiques lorsqu’un lymphocyte B naïf reconnaît un antigène spécifique au virus via son récepteur d’antigène de la cellule B (BCR). La liaison du BCR par l’antigène mène à la dégradation et à la présentation de peptides viraux à la surface des lymphocytes B via le CMH de classe 2. Ces complexes sont reconnus par des lymphocytes T auxiliaires spécifiques à l’antigène qui vont produire des cytokines entraînant la prolifération des lymphocytes B et leur différenciation en cellules sécrétrices d’anticorps (plasmocytes) et en lymphocytes B mémoires [58]. Les anticorps produits lors de la réponse immunitaire contre l’influenza peuvent protéger contre l’infection via différents mécanismes. Les principaux anticorps produits lors d’une réponse contre l’influenza sont dirigés contre le domaine globulaire de HA. Ces anticorps
14
bloquent directement la liaison entre HA et son récepteur présent à la surface des cellules cibles, ce qui neutralise l’infection par le virus et confère une immunité stérilisante[61]. La plupart des anticorps dirigés contre HA sont spécifiques pour une souche d’influenza et ils n’ont pas la capacité de neutraliser des variants intra sous-typiques et de conférer une protection contre les autres souches (hétéro sous-typique). Il s’agit d’une stratégie virale afin d’échapper à la neutralisation via la grande variabilité du domaine globulaire exposé en surface de HA [53]. Contrairement aux anti-HA, les anticorps dirigés contre NA ne peuvent pas neutraliser l’infection des cellules par le virus mais ils peuvent par contre inhiber l’activité enzymatique de NA et prévenir la libération des nouveaux virus, ce qui limite sa propagation et diminue la durée ainsi que la sévérité de l’infection [62].
Il existe aussi d’autres mécanismes de protection indirecte contre l’influenza et ces mécanismes sont associés à la région constante Fc des anticorps (Figure 1-5). Les virus recouverts d’anticorps peuvent être phagocytés via des récepteurs Fc (FcR) présents sur certaines cellules comme les macrophages. Les cellules infectées peuvent quant à elles être détruites via un processus de cytotoxicité cellulaire dépendant des anticorps (ADCC, Antibody-Dependent Cell-mediated Cytotoxicity) ou dépendant du complément (CDC, Complement-Dependent Cytotoxicity). Lors de l’ADCC, les cellules infectées sont recouvertes d’anticorps et la région Fc de l’anticorps est reconnue par les cellules NK via leur récepteur FcγRIII (CD16). La liaison du récepteur entraîne l’activation de la cellule NK qui va ensuite détruire la cellule cible via la sécrétion de granules cytotoxiques contenant des perforines et des granzymes afin de limiter la propagation de l’infection [61,63]. Pour la CDC, la région Fc de l’anticorps contribue à l’élimination de l’infection via l’activation de la voie classique du complément [64].
15 Figure 1-5 : Mécanismes de protection indirecte via la région Fc des anticorps Les cellules infectées sont tuées via l’ADCC suite à l’activation des cellules NK par la région Fc des IgG (flèche rouge). La phagocytose des particules virales ou des cellules infectées (manquante) est médiée par la reconnaissance de la région Fc des IgG par des macrophages (flèche verte) ou par l’interaction entre le complément et son récepteur à la surface des macrophages (flèche bleu) [61]. ASC : antibody-secreting cells. CR : complement-receptor
1.4.3. La réponse cellulaire
Les lymphocytes T CD4+ auxiliaires jouent un rôle important dans la régulation de la réponse immunitaire contre l’influenza. Ils sont activés suite à la liaison entre un récepteur des cellules T (TCR) et des épitopes viraux présentés sur les CMH de classe II à la surface des CPA activées. Une fois activé, les lymphocytes T CD4+ peuvent se différencier en plusieurs sous-populations caractérisées par les différentes cytokines qu’ils sécrètent [58]. S’il y a présence d’IL-4 tôt dans la réponse immunitaire, les lymphocytes T CD4+ se différencient en lymphocytes T auxiliaires Th2 (T-helper 2). Ces lymphocytes Th2 produisent de l’IL-4, IL-5 et IL-13 ce qui entraîne l’activation et la différenciation des lymphocytes B en plasmocytes. Ces cytokines favorisent la commutation isotypique et la production d’IgG1 et IgE [53]. S’il y a présence d’IL-12 tôt dans la réponse immunitaire, les lymphocytes T CD4+ se
16
différencient en lymphocytes T auxiliaires Th1 (T-helper 1) produisant de l’IFN-γ et de l’IL-2. L’IFN-γ stimule la production de l’isotype d’anticorps IgG2a alors que l’IL-2 est nécessaire à la prolifération des lymphocytes T CD8+ cytotoxiques, aussi connus sous le nom de « Cytotoxic T lymphocytes » (CTLs) [61]. L’infection par le virus de l’influenza mène généralement à une réponse de type Th1 dans laquelle les lymphocytes T CD4+ effecteurs produisent de l’IFN-γ et du TNF-α. Malgré une polarisation de la réponse cellulaire vers un type Th1, la réponse contre l’influenza est aussi caractérisée par une production importante d’IgA et de tous les sous-types d’IgG [65].
Les CTLs jouent un rôle important dans le contrôle de l’infection par l’influenza et sont responsables de l’établissement de la réponse cellulaire cytotoxique. Bien qu’elle ne prévienne pas l’infection d’une cellule par l’influenza, cette réponse des CTLs permet de limiter l’infection en éliminant les cellules infectées. Cette réponse est détectable dans le sang après 6 à 14 jours et disparaît après 21 jours [50]. La réponse cellulaire cytotoxique débute dans les ganglions lymphatiques drainants lorsque des lymphocytes T CD8+ naïfs reconnaissent des épitopes viraux présentés sur les CMH de classe 1 des CPA. La liaison entre le TCR et le CMH de classe 1 permet la différenciation des lymphocytes T CD8+ naïfs en CTLs. Ces cellules vont ensuite migrer jusqu’au site d’infection et éliminer les cellules infectées qui expriment des peptides viraux via leur CMH de classe 1. Les cellules CTL éliminent les cellules infectées en produisant des granules cytotoxiques qui contiennent des perforines et des granzymes causant l’apoptose des cellules. L’expression du ligand du récepteur d’apoptose Fas (FasL) est augmentée chez les CTLs ce qui offre une alternative pour l’apoptose des cellules infectées [66]. Elles vont aussi produire des cytokines pro-inflammatoires, dont le TNF-α, afin d’inhiber la réplication du virus et augmenter la réponse cellulaire. Suite à la résolution de l’infection, il y aura apparition de lymphocytes T CD8+ mémoires antigènes-spécifiques qui formeront la base d’une réponse plus forte et rapide lors d’une infection ultérieure [53].
17 Même si elle n’empêche pas l’infection des cellules, la réponse cytotoxique joue un rôle bénéfique dans la réponse contre l’influenza. L'impact de cette réponse a été démontré chez la souris suite à un transfert adoptif de CTLs aux antigènes de l’influenza. Ce transfert a mené à la lyse directe des cellules infectées de la souris hôtesse[67]. De plus, la déplétion des CTLs lors d’une infection chez la souris se traduit par une augmentation des titres viraux dans les poumons, de la mortalité et de la sévérité de la maladie [61]. Chez l’homme, la réponse cellulaire cytotoxique spécifique à l’influenza est principalement dirigée contre des épitopes hautement conservés des protéines virales internes du virus comme PA, PB2, M1 et NP [68]. Des études chez la souris ont démontré que la majorité des CTLs spécifiques réagissaient à différents sous-types d’influenza, ce qui mettait en évidence le rôle important de la réponse cellulaire cytotoxique dans la protection croisée [69].
1.5. Épidémiologie de l’influenza
Les virus de l’influenza ont la capacité unique de causer à la fois des épidémies annuelles récurrentes ainsi que des pandémies beaucoup plus sérieuses pouvant affecter la majeure partie de la population. Ils sont capables d’échapper au système immunitaire grâce à l’accumulation de variations antigéniques via deux processus distincts : le glissement antigénique et la cassure antigénique (Figure 1-6).
Le glissement antigénique « antigenic drift » est présent chez les souches d’influenza A et B. Ce processus est causé par l’accumulation de mutations ponctuelles au niveau des gènes de HA et NA. La plupart de ces mutations n’affectent pas la conformation des deux protéines, mais certaines entraînent des changements qui affectent la liaison des anticorps dirigés contre le virus [70]. Lorsqu’il y a apparition d’une réponse humorale contre une souche causant une épidémie, il se crée une pression immunologique favorisant les souches d’influenza qui possèdent des HA et des NA altérées [44]. Ces nouvelles souches ne sont pas inhibées par la réponse humorale
18
spécifique aux souches qui circulaient précédemment et elles vont donc devenir prévalentes au sein de la population, entraînant ainsi les épidémies saisonnières d’influenza [2].
Figure 1-6 : Mécanismes classiques des variations antigéniques de l’Influenza A A. Cassure antigénique représentant ce qui se serait passé lors de la pandémie de 1957. Le virus humain H1N1 (bleu) se serait réassorti avec le virus aviaire H2N2 (orange) pour former le virus H2N2 responsable de la grippe Asiatique. B. Dérive antigénique, procédé selon lequel un virus d’influenza circulant dans la population humaine mute sous la pression associée à la réponse humorale contre HA [71].
La cassure antigénique «antigenic shift » est un phénomène se déroulant seulement chez les souches d’influenza A. Elle est caractérisée par l’apparition au sein de la population d’un nouveau virus d’influenza A possédant des protéines de surfaces (HA et/ou NA) qui sont immunologiquement distinctes des souches circulantes dans la population [2]. Si ce virus acquiert la capacité de se transmettre facilement à travers la population, il en résulte une pandémie puisque la majorité des gens ne possèdent pas d’immunité préexistante contre ce nouveau virus. La cassure antigénique peut se produire via deux mécanismes différents.
19 Dans le premier mécanisme, l’infection simultanée d’un hôte par deux souches différentes d’influenza permet un réassortiment des différents segments de leurs génomes, particulièrement au niveau de HA et de NA. L’influenza A est le seul des trois types d’influenza à posséder un large réservoir de sous-types présents chez les oiseaux et c’est cette grande diversité qui facilite le réarrangement avec un des 15 sous types de HA ou un des 9 sous-types de NA. Ce réarrangement permet l’apparition de souches pandémiques pour lesquelles il n’existe pas d’immunité préexistante au sein de la population [72]. Le porc est une cible de choix pour la co-infection de différentes souches d’influenza puisque celui-ci possède à la fois les récepteurs d’acides sialiques α-2,3 ayant une plus grande affinité pour les souches aviaires ainsi que les récepteurs d’acides sialiques α-2,6 ayant une plus grande affinité pour les souches humaines [73]. C’est ce phénomène qui a donné naissance aux virus d’influenza humains qui possèdent des protéines de surfaces de souches aviaires.
Dans le deuxième mécanisme de cassure antigénique, une souche d’influenza A infectant un organisme spécifique comme l’oiseau peut être transmis directement à l’humain, et ce, sans subir de changements génétiques importants. Lorsque cette souche mutante acquiert la capacité de se transmettre efficacement d’humain à humain, on peut craindre l’apparition d’une pandémie [74].
1.6. Les pandémies d’influenza
Le réassortiment génique est responsable des pandémies de 1957, 1968 et 2009. Lors de la pandémie de 1957, il y a eu co-infection entre une souche H2N2 aviaire et la souche H1N1 humaine qui était présente dans la population depuis la pandémie de 1918. Ce réassortiment a donné naissance à un virus pandémique H2N2 (Grippe Asiatique) exprimant les segments aviaires de HA, NA et PB1 en combinaison avec les cinq segments restants de la souche humaine [75]. Ce nouveau virus H2N2 a circulé dans la population jusqu’à la pandémie de 1968 où il a été remplacé par un virus pandémique réassorti H3N2 (Grippe de Hong Kong) contenant deux gènes
20
d’une souche aviaire (H3 et PB1) [76]. Les descendants de ce virus H3N2 continuent encore de circuler dans la population et de causer des épidémies. La souche de H1N1 pandémique de 2009 résulte du réassortiment de gènes viraux et contient une combinaison unique de gènes provenant de souches aviaires, porcines et humaines. Cette souche H1N1 pandémique était inquiétante puisqu’elle contenait des segments provenant de souches porcines américaines et eurasiennes et que ces souches n’avaient jamais été détectées précédemment dans la population [77]. La pandémie de 2009 était particulière puisqu’elle a causé un taux anormalement élevé d’infections chez des jeunes adultes en santé alors que les personnes âgées furent relativement épargnées [78]. Des études ont démontré que ces personnes âgées, particulièrement ceux nés avant les années cinquante, étaient protégées grâce à la présence d’anticorps offrant une protection croisée contre la souche pandémique. Ces anticorps ont été développés suite à une exposition à la souche d’influenza A H1N1 pandémie de 1918 ou à l’un de ses variants présents dans la population entre 1918 et 1957 [79].
La pandémie de 1918 est encore à ce jour la pire pandémie de grippe à avoir frappé l’humanité et elle est responsable de la mort de plus de 40 millions de personnes. La particularité de cette pandémie est que la plupart des décès associés à la maladie sont survenus chez les personnes en santé entre 15 et 35 ans et que 99 % des personnes décédées étaient âgées de moins de 65 ans [6]. Des études phylogénétiques ainsi que des analyses du génome de la souche pandémique ont démontré que ce virus ne serait pas apparu par un réassortiment génique, comme les autres pandémies, mais bien par l’adaptation d’une souche aviaire chez l’humain [75,80]. Des recherches ont démontré que la souche pandémique de 1918 se différenciait des souches aviaires grâce à 10 changements au niveau de la séquence en acides aminés du complexe de polymérase (PB1, PB2, PA). Un certain nombre de ces changements ont été découverts chez la souche aviaire hautement pathogénique (HPAI) H5N1 qui est en circulation à travers le monde et qui serait l’un des candidats pouvant causer une future pandémie [80]. La première éruption de H5N1 HPAI s’est produite à Hong Kong en 1997 chez des humains ayant été en contact avec des oiseaux infectés. Dix-huit personnes ont été infectées et six personnes en sont mortes. La propagation de
21 cette infection a été stoppée par l'abattage de plus de 1,5 million de poulets au sein du territoire de Hong-Kong [81]. En date du 24 janvier 2014, l’Organisation mondiale de la Santé a recensé 386 décès sur 650 cas d’infections par la souche aviaire H5N1[82] et on ne répertorie pas de transmission entre les humains jusqu’à maintenant. Par contre, si cette souche HPAI acquiert la capacité de se transmettre efficacement à travers la population, on anticipe jusqu’à 100 millions de patients nécessitant des traitements ambulatoires, plus de 25 millions d’admissions dans les hôpitaux et plusieurs millions de décès à travers le monde [83].
22
2. La vaccination contre l’influenza
Le meilleur moyen de protéger la population contre une infection par l’influenza demeure la vaccination. Elle vise avant tout à protéger les individus contre l’infection, mais aussi à induire une immunité de groupe permettant de diminuer le risque de transmission de la maladie au sein de la population [84]. Présentement, deux catégories de vaccin sont utilisées dans les campagnes de vaccinations saisonnières : le vaccin trivalent ou quadrivalent inactivé (TIV/QIV) et le vaccin vivant atténué (LAIV). La composition de ces deux catégories de vaccin est mise à jour chaque année puisque les souches d’influenza présentes dans la population mutent constamment sous l’effet de la pression immunologique et du glissement génétique [70,85].
2.1. Le vaccin trivalent inactivé (TIV)
Le TIV contient les trois souches d’influenza les plus susceptibles d’infecter la population au cours de la prochaine saison grippale. Ce vaccin est donné sous forme d’une injection intramusculaire ou intranasale à toute personne âgée de plus de 6 mois, incluant les personnes à haut risque de complications [84]. Les souches présentes dans le vaccin sont sélectionnées en avance par un groupe d’experts en association avec l’Organisation mondiale de la Santé (OMS). Il faut compter approximativement 6 mois entre le choix des souches et la distribution du vaccin pour la campagne annuelle de vaccination [85]. On retrouve dans ce vaccin une souche d’influenza A H3N2, une souche A H1N1 ainsi qu’une souche d’influenza B qui auront été cultivées dans des œufs de poulets embryonnés ou chez des lignées cellulaires [86]. Depuis 2012, le vaccin quadrivalent inactivé (QIV) est disponible et il contient une souche supplémentaire d’influenza B. Les virus inactivés présents dans le vaccin peuvent être sous une forme entière, fragmentée ou sous-unitaire. Le vaccin entier (whole vaccine) contient des virus inactivés chimiquement, concentrés et purifiés. Le vaccin à virions fragmentés (split-vaccine) nécessite un traitement supplémentaire avec des détergents afin de dissocier l’enveloppe virale et ainsi exposer les protéines virales. Pour le vaccin sous-unitaire, des étapes
23 supplémentaires de purification permettent de produire un vaccin composé majoritairement de HA et de NA [84,87]. Ces vaccins induisent une immunité principalement basée sur la production d’anticorps neutralisants spécifiques pour les HA des souches présentes dans le vaccin. Certaines formulations peuvent aussi induire la production d’anticorps spécifiques pour NA. Ces anticorps ne protègent pas contre l’infection, mais ils peuvent jouer un rôle dans la diminution de la sévérité de l’infection [2,62].
2.2. Le vaccin vivant atténué (LAIV)
Le LAIV est utilisé afin d’induire une réponse cellulaire et humorale semblable à celle détectée suite à une infection naturelle par le virus [84]. Les virus contenus dans le vaccin sont des virus réassortis exprimant les HA et NA des souches d’influenza susceptibles d’infecter la population alors que les six autres segments du virus proviennent de souches donatrices atténuées d’influenza A ou B. Les virus réassortis étaient originellement produits par réassortiment classique dans des œufs. Depuis 2008, ils sont maintenant produits par génétique inverse [88,89]. Les souches donatrices atténuées ont été adaptées afin de se développer au niveau de la muqueuse nasale qui est habituellement à une température de 25 °C. Ces souches ne peuvent donc pas se répliquer efficacement dans le tractus respiratoire puisque la température est au-dessus de 35 °C [90].
L’un des principaux avantages du LAIV par rapport aux TIV/QIV est que lors de l’immunisation du vaccin par la voie intranasale, il y a réplication du virus au niveau des cellules épithéliales naso-pharyngées. Cette infection mène à la présentation de protéines virales au niveau des CMH, à la stimulation de lymphocytes T spécifiques au virus et à la production d’une réponse humorale systémique et mucosale [91]. Les lymphocytes T spécifiques jouent un rôle important dans la réponse croisée contre des variants d’influenza qui ne sont pas dans le vaccin, communément appelée protection hétérotypique. Des études ont démontré qu’une immunisation avec le
24
LAIV confère une protection hétérotypique chez la souris via l’induction de lymphocytes T CD8+ [91] et que ce vaccin était efficace chez l’humain même contre des souches ayant subi un glissement génétique important [88,92]. Le vaccin vivant atténué peut être donné à toute personne en santé entre 2 et 49 ans, à condition qu’elle ne soit pas enceinte. Il doit aussi être utilisé préférentiellement chez les enfants de deux à neuf ans qui n’ont pas de contre-indications [93] et il n’est pas recommandé chez les personnes immunocompromises ou chez les individus qui sont en contact direct avec des individus vulnérables [84].
2.3. L’efficacité du TIV et LAIV
Lorsque les souches présentes à l’intérieur du vaccin correspondent à celles présentes dans la population lors de la saison grippale, les vaccins TIV et LAIV confèrent une bonne protection contre l’influenza [94]. Une méta-analyse récente sur plus d’une trentaine d’essais cliniques aléatoires a démontré que TIV était efficace chez 59 % des adultes entre 18 et 65 ans alors que le LAIV était efficace à 83 % chez les enfants de 6 mois à 7 ans [94]. Chez les personnes âgées, l’immunosénescence mène à une diminution de la réponse immunitaire générée par la vaccination. Même lorsque l’homologie entre les souches présentes dans le vaccin et les souches circulantes est bonne, la vaccination permet une protection chez 30 à 40 % des personnes âgées de 65 et plus [95]. De nouvelles stratégies sont donc requises afin d’augmenter la réponse immunitaire contre l’influenza, en particulier chez les populations à risque.
La pandémie de 2009 a aussi révélé les limites associées au spectre de protection des vaccins saisonniers TIV/QIV et LAIV. Puisque la vaccination saisonnière mène en majeure partie à la production d’anticorps neutralisants hautement spécifiques pour les HA incluses dans les vaccins, ils sont inefficaces lorsqu’il y a apparition d’une souche d’influenza exprimant une nouvelle HA [96]. Des études sérologiques ont démontré que le vaccin saisonnier ne conférait pas de protection croisée contre la souche pandémique de 2009 [79], puisque celui-ci était distinct de la souche d’influenza A H1N1 présente à l’intérieur des vaccins saisonniers.
25
2.4. Les nouvelles approches en vaccination
Même si les vaccins présentement utilisés confèrent une protection efficace contre les souches apparentées, il reste que la technologie mise en place comporte plusieurs désavantages tels que la nécessité de produire des nouveaux vaccins à chaque année, la longue période de production pour chaque vaccin, l’incertitude par rapport aux choix des souches à inclure ainsi que leur incapacité à protéger la population lors de l’apparition d’une nouvelle pandémie [84,97]. De plus, l’apparition de mutations chez les souches vaccinales d’influenza adaptées à une culture dans des œufs embryonnés peut diminuer l’efficacité de ces vaccins[98]. De nouvelles approches sont donc nécessaires afin de prévenir les infections saisonnières et les futures pandémies d’influenza.
2.4.1. L’utilisation d’adjuvants
L’utilisation d’adjuvants est l’une des approches utilisées afin d’augmenter l’immunogénicité des vaccins développés contre les infections saisonnières et pandémiques. Les adjuvants permettent d’améliorer l’immunogénicité des vaccins en ayant un effet sur le mode de livraison de l’antigène ou en ciblant certaines voies immunologiques spécifiques [84].
Les adjuvants qui affectent le mode de livraison de l’antigène, comme les sels d’aluminium et les émulsions «oil-in-water», créent un dépôt permettant de relâcher l’antigène sur un plus long laps de temps et ainsi augmenter la possibilité d’interaction avec les CPA [99]. Les adjuvants particulaires (virosomes, liposomes, complexes immunostimulatoires) sont quant à eux pris plus facilement en charge par les CPA, ce qui permet aux antigènes d’être plus rapidement présentés aux cellules immunitaires effectrices [100].
26
Les adjuvants qui potentialisent la réponse immunitaire sont capables d’activer les CPA ce qui permet la production de médiateurs pro-inflammatoires ainsi que l’expression de molécules de costimulations nécessaires à l’activation des lymphocytes T spécifiques à l’antigène [101]. Une des façons d’activer les CPA est via la liaison des PRRs qui reconnaissent des motifs PAMPs. Les TLRs sont l’une des catégories de PRRs étudiée dans le développement de nouveaux adjuvants [99]. Les TLRs sont une cible intéressante puisqu’ils sont présents principalement chez les monocytes/macrophages et les cellules dendritiques [100]. Différents agonistes des TLRs dont le PolyI:C (TLR3), le glucopyranosyle lipide A (TLR4) ou les CPGs (TLR9) ont été testés comme adjuvant dans un vaccin contre l’influenza [102].
Les seuls adjuvants autorisés pour une vaccination antigrippale sont les émulsions à base de squalène. Le MF59 (Novartis) est autorisé pour une utilisation avec le vaccin saisonnier chez les personnes âgées dans certains pays alors que l’AS03 (GlaxoSmithKline) a été utilisé avec le vaccin monovalent pandémique de 2009 [84]. L’utilisation d’un adjuvant dans un vaccin antigrippal permet d’en augmenter son immunogénicité tout en utilisant moins d’antigène pour chacune des doses[103,104]. Cette économie de dose est particulièrement importante pour un vaccin pandémique puisque la production mondiale de vaccin a de la difficulté à répondre à la demande globale lors d’une pandémie [105].
2.4.1.1. Les nanoparticules du PapMV
Au cours des dernières années, notre groupe de recherche a mis au point un nouvel adjuvant composé de nanoparticules recombinantes du virus de la mosaïque de la papaye (PapMV) (Figure 1-7). Cet adjuvant ayant pour acronyme PAL (PapMV Adjuvant Long-lasting response), est produit in vitro à partir des monomères de la protéine de manteau qui sont produits dans E. coli. Ces monomères vont s’autoassembler autour d’un ARN simple brin synthétique afin de former des nanoparticules filamenteuses et cristallines en forme de bâtonnet (Figure 1-7). Il a été
27 démontré que PAL peut être utilisé comme adjuvant, mais aussi comme plateforme vaccinale [106–111]. Récemment, des études ont été effectuées afin d’élucider les propriétés adjuvantes de PAL. Nous savons maintenant que la nanoparticule complète est nécessaire pour l’activité adjuvante puisque la protéine de manteau seule est peu efficace pour activer le système immunitaire. Étant donné que la seule différence entre la protéine de manteau et la nanoparticule est la présence d’un ARN, il a été proposé que c’est l’ARN simple-brin qui est responsable de l’immunogénicité de l’adjuvant [112]. Cette hypothèse a été confirmée en étudiant les propriétés immunomodulatrices du PAL chez des souris C57BL/6 sauvages ou déficientes pour certaines protéines impliquées dans la reconnaissance de l’ARN. Ces résultats démontrent que PAL induit une activation du système immunitaire via une liaison au récepteur de l’immunité innée TLR7 et que cette activation mène à la production d’IFN de type 1 [113].
L’utilisation de PAL comme adjuvant dans le cadre d’une vaccination antigrippale intramusculaire a été étudiée au sein de notre laboratoire. L’ajout de PAL permet d’augmenter l’ampleur de la réponse humorale contre TIV en plus d’améliorer la faible immunogénicité de certaines protéines du virus qui sont présentes à l’intérieur celui-ci. L’utilisation de PAL augmente la réponse humorale et cellulaire contre plusieurs épitopes conservées de HA, NP et M1, en plus de conférer une protection chez la souris lors d’une infection avec une souche hétérotypique d’influenza. En cas de pandémie, PAL pourrait donc être utilisé comme adjuvant en combinaison avec le vaccin saisonnier afin de protéger la population avant l’arrivée d’un vaccin pandémique [110]. De plus, il a été démontré récemment que PAL induit une immunité mucosale contre TIV lorsqu’il est administré par la voie intranasale. PAL pourrait donc aussi être utilisé comme adjuvant mucosal dans le cadre d’un vaccin contre une infection respiratoire [114].
28
Figure 1-7 : Les nanoparticules du PapMV Microscopie électronique à transmission (49 000X)
2.4.2. Les vaccins pré-pandémiques
Certains groupes comme Novartis (Aflunov ®) et GlaxoSmithKline (Pandemrix ®) ont développé des vaccins «pré-pandémique» qui sont stockés dans l’attente d’une future pandémie. Ces vaccins contiennent l’HA de la souche hautement pathogénique H5N1 qui est susceptible de causer la prochaine pandémie d’influenza [97]. Ces vaccins contiennent un adjuvant (MF59 ou AS03) afin d’augmenter l’immunogénicité du vaccin puisque la population est immunologiquement naïve face aux virus aviaires [115]. L’utilisation d’un adjuvant permet d’améliorer la réponse immunitaire en utilisant moins d’antigène à l’intérieur du vaccin. Cette économie-de-dose permet donc de vacciner une plus grande partie de la population en cas de pandémie [116]. Le désavantage de ce type de vaccin est qu’il est difficile de prévoir quelle souche d’influenza causera la prochaine pandémie. Afin de remédier à cette situation, ce type de vaccin devrait donc contenir plusieurs variants HA [117] ou cibler des protéines conservées à travers les différentes souches d’influenza pour permettre un spectre de protection plus large [70].