1
UNIVERSITE DE PICARDIE JULES VERNE UFR DE PHARMACIE
THESE
POUR LE DIPLOME DE DOCTEUR EN PHARMACIE
Soutenue publiquement le 27 Juin 2016 Par MASSET Anthony
INFLUENCE DE BOTRYTIS CINEREA SUR LA COMPOSITION EN
FLAVONOIDES ET EN STILBENES DE LA PELLICULE DE RAISIN (VITIS
VINIFERA)
JURY
Président : Pr. François Mesnard Membre : M. Roland Molinié Membre : Mme Michèle Duflos
2
Mots Clefs
Vitis vinifera, Botrytis cinerea, flavonoïdes, anthocyanes, stilbènes, LC-MS.
Résumé
Le raisin est le fruit de la vigne (Vitis vinifera). On le consomme tel quel, mais on peut aussi le presser pour en boire le jus, ou encore laisser fermenter ce jus et obtenir du vin. De nombreuses études ont été faites sur la vigne, le raisin et le vin afin d’en connaître la composition et découvrir des molécules d’intérêt pharmaceutique ou alimentaire, tel que le resvératrol, un stilbène utilisé par la plante pour se défendre des infections fongiques, et qui possède des propriétés antioxydantes, ou encore les anthocyanes, responsables de la couleur du grain de raisin. Cette étude a permis de voir l’influence du Botrytis cinerea, champignon responsable de la pourriture grise sur de nombreux fruits et plantes, sur la pellicule du grain de raisin et sur sa composition, en identifiant et quantifiant une trentaine de molécules d’intérêt.
Keywords
Vitis vinifera, Botrytis cinerea, flavonoids, anthocyanins, stilbenoids, LC-MS
Abstract
Grape is the fruit of grape vine (Vitis vinifera). The grape can be eaten fresh, or it can be processed to make juice or wine (made from fermented grapes). A lot of studies have already been done on grape vine, grape or wine to know their composition and to find new molecules of pharmaceutical or nutritional interest, like resveratrol, a stilbene use by plants to fight against fungal infections, and which has antioxidant properties, or anthocyanins that are responsible of the color of the grape. This study has been done to see the impact of Botrytis cinerea, fungus that brings noble rot or grey mould to numerous fruits and plants, on grape skin and on its composition, by identifying and quantifying over thirty molecules of interest.
3
Remerciements
A Monsieur Roland Molinié, pour avoir été un directeur de thèse disponible et dont les conseils ont toujours été précieux,
A Monsieur François Mesnard, pour m’avoir accueilli au sein du laboratoire de Biologie des Plantes et Innovation (BIOPI EA3900) et pour m’avoir fait l’honneur d’accepter la présidence de mon jury de thèse,
A Madame Michèle Duflos, pour avoir accepté de faire partie de mon jury de thèse et d’assister à la présentation de ce travail,
A Benjamin, pour son aide pour l’extraction des données de cette thèse,
A mes parents, pour leur soutien indéfectible et leur présence,
A Clémence, pour sa présence au quotidien et pour l’aide précieuse qu’elle aura su m’apporter sur ce travail,
A mes amis, et en particulier à Claire et Déborah, pour leur amitié sincère et tous ces souvenirs à leurs côtés qui m’ont permis de passer de belles années universitaires.
4
TABLE DES MATIERES
LISTE DES FIGURES………...7
LISTE DES TABLEAUX………...9
LISTE DES ABREVIATIONS………10
INTRODUCTION GENERALE……….11
CONTEXTE BIBLIOGRAPHIQUE………..12
Introduction……….13
I) Le raisin, fruit de la vigne………...14
I.1) Généralités………...14
I.2) Composition du raisin……….16
I.2.1) Valeurs nutritionnelles………16
I.2.2) Vitamines et oligo-éléments………16
I.3) Utilisation en pharmacie………..17
II) Composés phénoliques du raisin………18
II.1) Les acides phénoliques………..18
II.2) Les flavonoïdes………..19
II.2.1) Flavonols………19
II.2.2) Anthocyanes………...20
II.2.3) Flavanols (ou catéchines)………...21
II.1.3) Les proanthocyanes (ou tanins condensés)……….21
II.1.4) Les stilbènes………22
III) Méthodes utilisées pour l’identification et la quantification des composés phénoliques………….23
III.1) Préparation de l'échantillon………..23
III.2) Extraction des polyphénols………..23
III.3) Préparation des échantillons pour l'analyse HPLC………..25
III.3.1) Préparation en vue de l'analyse des flavonols et des HCTA………25
III.3.2) Préparation en vue de l'analyse des monomères d'anthocyanes………...25
III.3.3) Préparation en vue de l'analyse des proanthocyanes………26
III.4) Analyse HPLC………..27
II.2.4.1) Analyse des flavonols et des HCTA………...27
II.2.4.2) Analyse des anthocyanes et dérivés………27
5
II.2.4.4) Analyse des stilbènes………28
IV) Quantités retrouvées……….29
IV.1) Les acides phénols………29
IV.2) Les flavonoïdes……….30
IV.2.1) Flavonols………..30
IV.2.2) Anthocyanes……….31
IV.2.3) Flavanols………..33
IV.3) Les proanthocyanes………..33
IV.4) Les stilbènes……….33
V) Le Botrytis cinerea, parasite de la vigne………...34
V.1) Effets du Botrytis cinerea dans le règne végétal………...34
V.2) Effets du Botrytis cinerea sur le raisin………..35
Conclusion………..36
PARTIE EXPERIMENTALE……….37
Introduction……….38
I) Matériels et Méthodes……….39
I.1) Echantillons……….39
I.2) Broyage et extraction………..39
I.3) Analyse par LC-MS………40
I.4) Récupération des données………...40
II) Résultats……….41
II.1) Flavonoïdes………....41
II.1.1) Quercétine et delphinidine……….41
II.1.2) Kaempférol et cyanidine………42
II.1.3) Isorhamnétine et pétunidine………...44
II.1.4) Myricétine………..45
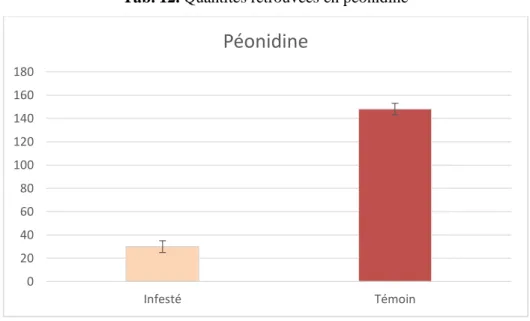
II.1.5) Péonidine………47
II.1.6) Myricétine 3-O-glucoside………..48
II.1.7) Myricétine 3-O-glucuronide et laricitrine 3-O-glucoside………..49
II.1.8) Delphinidine 3-O-glucoside et quercétine 3-O-glucoside……….51
II.1.9) Malvidine 3-O-glucoside et isorhamnétine 3-O-glucuronide………....52
II.1.10) Cyanidine 3-O-glucoside et kaempférol 3-O-glucoside………..54
II.1.11) Pétunidine glucoside, isorhamnétine glucoside et quercétine 3-O-glucuronide……….55
6 II.1.12) Péonidine glucoside, cyanidine glucuronide et kaempférol
3-O-glucuronide……….57
II.1.13) Cyanidine 3-O-(6”acétyl-glucoside)………59
II.1.14) Delphinidine 3-O-(6”acétyl-glucoside)………61
II.1.15) Pétunidine 3-O-(6”acétyl-glucoside)………...62
II.1.16) Péonidine 3-O-(6”acétyl-glucoside)……….64
II.1.17) Delphinidine 3-O-(6-p-coumaroyl)-glucoside……….65
II.1.18) Péonidine 3-O-(6-p-coumaroyl)-glucoside………..66
II.2) Stilbènes……….68 II.2.1) Resvératrol……….68 II.2.2) Picéide………69 II.2.3) Pinosylvine……….71 III) Discussion……….73 Conclusion………..75 CONCLUSION GENERALE………..…76 BIBLIOGRAPHIE………77 ANNEXES………...80
7
Liste des figures
Figure 1. Description d’un cep de vigne………....14
Figure 2. Description du grain de raisin……….15
Figure 3. Composition nutritionnelle du raisin (en g/100g).……….16
Figure 4. Structure de base des acides hydroxycinnamiques……….18
Figure 5. Structure de base des flavonols………..19
Figure 6. Structure de base des anthocyanidols……….20
Figure 7. Structure de base des flavanols………...21
Figure 8. Structure de base des stilbènes………...22
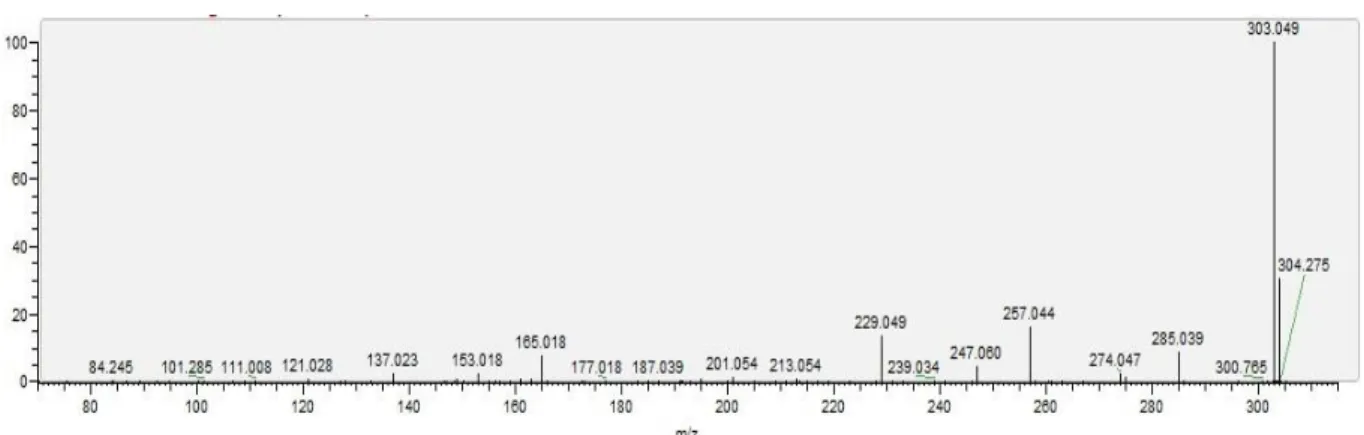
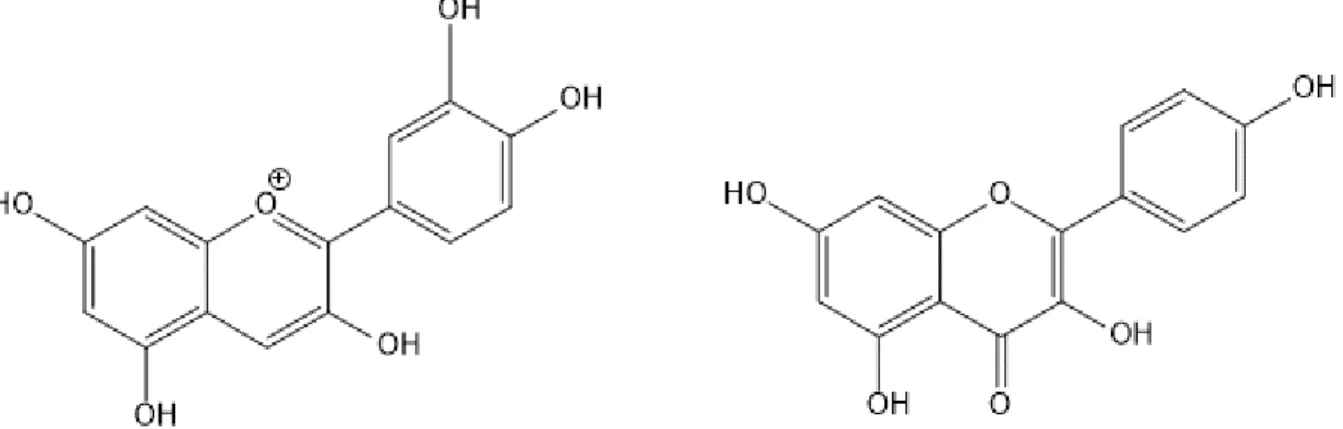
Figure 9. Structures de la delphinidine et de la quercétine………41
Figure 10. Spectre en MS/MS pour une masse correspondant à la quercétine et à la delphinidine…..42
Figure 11. Structures de la cyanidine et du kaempférol……….43
Figure 12. Spectre en MS/MS pour une masse correspondant au kaempférol et à la cyanidine……...43
Figure 13. Structures de la pétunidine et de l’isorhamnétine……….44
Figure 14. Spectre en MS/MS pour une masse correspondant à l’isorhamnétine et à la pétunidine….44 Figure 15. Structure de la myricétine……….45
Figure 16. Spectre en MS/MS pour une masse correspondant à la myricétine……….46
Figure 17. Structure de la péonidine………..47
Figure 18. Spectre en MS/MS pour une masse correspondant à la péonidine………...47
Figure 19. Structure de la myricétine 3-O-glucoside……….48
Figure 20. Spectre en MS/MS pour une masse correspondant à la myricétine 3-O-glucoside……….49
Figure 21. Structures de la laricitrine 3-O-glucoside et de la myricétine 3-O-glucuronide…………..50
Figure 22. Spectre en MS/MS pour une masse correspondant à la laricitrine 3-O-glucoside et à la myricétine 3-O-glucuronide………..50
Figure 23. Structures de la delphinidine 3-O-glucoside et de la quercétine 3-O-glucoside…………..51
Figure 24. Spectre en MS/MS pour une masse correspondant à la delphinidine 3-O-glucoside et à la quercétine 3-O-glucoside………..51
Figure 25. Structures de l’isorhamnétine 3-O-glucuronide et de la malvidine 3-O-glucoside………..52
Figure 26. Spectre en MS/MS pour une masse correspondant à la malvidine 3-O-glucoside et à l’isorhamnétine 3-O-glucuronide……….53
Figure 27. Structures de la cyanidine 3-O-glucoside et du kaempférol 3-O-glucoside……….54
Figure 28. Spectre en MS/MS pour une masse correspondant au kaempférol 3-O-glucoside et à la cyanidine 3-O-glucoside………...54
Figure 29. Structures de la pétunidine 3-O-glucoside, de la quercétine 3-O-glucuronide et de l’isorhamnétine 3-O-glucoside……….56
8
Figure 30. Spectre en MS/MS pour une masse correspondant à la pétunidine 3-O-glucoside, à la
quercétine 3-O-glucuronide et à l’isorhamnétine 3-O-glucoside………..56
Figure 31. Structures de la cyanidine 3-O-glucuronide, du kaempférol 3-O-glucuronide et de la péonidine 3-O-glucoside ………..58
Figure 32. Spectre en MS/MS pour une masse correspondant à la cyanidine 3-O-glucuronide, au kaempférol 3-O-glucuronide et à la péonidine 3-O-glucoside……….58
Figure 33. Structure de la cyanidine 3-O-(6”acétyl-glucoside)……….60
Figure 34. Spectre en MS/MS pour une masse correspondant à la cyanidine 3-O-(6”acétyl- glucoside)………..60
Figure 35. Structure de la delphinidine 3-O-(6”acétyl-glucoside)……….61
Figure 36. Spectre en MS/MS pour une masse correspondant à la delphinidine 3-O-(6”acétyl- glucoside)………..61
Figure 37. Structure de la pétunidine 3-O-(6”acétyl-glucoside)………62
Figure 38. Spectre en MS/MS pour une masse correspondant à la pétunidine 3-O-(6”acétyl- glucoside)……….63
Figure 39. Structure de la péonidine 3-O-(6”acétyl-glucoside)……….64
Figure 40. Spectre en MS/MS pour une masse correspondant à la péonidine 3-O-(6”acétyl- glucoside)……….64
Figure 41. Structure de la delphinidine 3-O-(6-p-coumaroyl)-glucoside……….….65
Figure 42. Spectre en MS/MS pour une masse correspondant à la delphinidine glucoside………...66
Figure 43. Structure de la péonidine 3-O-(6-p-coumaroyl)-glucoside………..67
Figure 44. Spectre en MS/MS pour une masse correspondant à la péonidine 3-O-(6-p-coumaroyl)- glucoside………...67
Figure 45. Structure du resvératrol………68
Figure 46. Spectre en MS/MS pour une masse correspondant au resvératrol………...68
Figure 47. Structure de la picéide………..69
Figure 48. Spectre en MS/MS pour une masse correspondant à la picéide………...70
Figure 49. Structure de la pinosylvine.………..71
Figure 50. Spectre en MS/MS pour une masse correspondant à la pinosylvine………71
9
Liste des tableaux
Tableau 1. Composition en vitamines et oligoéléments du raisin……….16
Tableau 2. Liste des composés d’intérêt étudiés………...18
Tableau 3. Quantités d’acides phénols retrouvés (en mg/kg)………29
Tableau 4. Quantités de flavonols retrouvés (en mg/kg)………...30
Tableau 5. Quantités d’anthocyanes retrouvés (en mg/kg)………...32
Tableau 6. Quantités de flavanols retrouvés (en mg/kg)………...33
Tableau 7. Quantités de proanthocyanes retrouvés (en mg/kg)……….33
Tableau 8. Quantités retrouvées en quercétine ou delphinidine...……….42
Tableau 9. Quantités retrouvées en kaempférol ou cyanidine………...………43
Tableau 10. Quantités retrouvées en isorhamnétine et pétunidine………45
Tableau 11. Quantités retrouvées en myricétine………46
Tableau 12. Quantités retrouvées en péonidine……….48
Tableau 13. Quantités retrouvées en myricétine 3-O-glucoside………49
Tableau 14. Quantités retrouvées en myricétine 3-O-glucuronide ou laricitrine 3-O-glucoside…..…50
Tableau 15. Quantités retrouvées en delphinidine 3-O-glucoside ou quercétine 3-O-glucoside..…....52
Tableau 16. Quantités retrouvées en malvidine 3-O-glucoside ou isorhamnéine 3-O-glucuronide…..53
Tableau 17. Quantités retrouvées en kaempférol 3-O-glucoside ou cyanidine 3-O-glucoside...……..55
Tableau 18. Quantités retrouvées en pétunidine 3-O-glucoside, isorhamnétine 3-O-glucoside ou quercétine 3-O-glucuronide………....57
Tableau 19. Quantités retrouvées en cyanidine 3-O-glucuronide, kaempférol 3-O-glucuronide ou péonidine 3-O-glucoside……….59
Tableau 20. Quantités retrouvées en cyanidine 3-O-(6”acétyl-glucoside)………60
Tableau 21. Quantités retrouvées en delphinidine 3-O-(6”acétyl-glucoside)………...62
Tableau 22. Quantités retrouvées en pétunidine 3-O-(6”acétyl-glucoside)………...63
Tableau 23. Quantités retrouvées en péonidine 3-O-(6”acétyl-glucoside)………65
Tableau 24. Quantités retrouvées en delphinidine 3-O-(6-p-coumaroyl)-glucoside……….66
Tableau 25. Quantités retrouvées en péonidine 3-O-(6-p-coumaroyl)-glucoside……….67
Tableau 26. Quantités retrouvées en resvératrol………69
Tableau 27. Quantités retrouvées en picéide……….70
10
Liste des abréviations
AFSSAPS : agence française de sécurité sanitaire des produits de santé (devenue depuis l’ANSM) ASE : extraction accélérée par solvant
Cy : cyanidine Del : delphinidine
DMP : degré moyen de polymerisation ET : Ecart-type
HCTA : acides hydroxycinammiques
HPLC : chromatographie liquide à haute performance Iso : isorhamnétine Ka : kaempférol Lar : laricitrine LC : chromatographie liquide MS : spectrométrie de masse Mv : malvidine Myr : myricétine PAC : proanthocyanes
PLE : extraction liquide sous pression (Pressurized Liquid Extraction) Pn : péonidine
PPO : polyphénol oxydase
PR : protéines pathogenesis-related Pt : pétunidine
Qu : quercétine
ROMT : resvératrol O-méthyl transférase Rpm : tours par minute
SPE : extraction en phase solide TFA : acide trifluoroacétique v/v : volume / volume
11
Introduction générale
Le raisin est le fruit de la vigne (Vitis sp.), une espèce d'arbrisseau de la famille des vitacées. C'est l'un des fruits les plus cultivés au monde. Il se présente sous forme de grappes, contenant un ensemble de baies botaniquement parlant, et ces baies peuvent être blanches ou rouges. Le raisin est consommé soit comme fruit (frais, ou sec), soit sous forme de vin (après fermentation de son jus). On peut également extraire de l'huile de ses pépins. Le raisin et ses produits sont réputés comme étant bons pour la santé, grâce à sa richesse en vitamines, en sucres facilement assimilables par l'organisme et en polyphénols.
Ces derniers auraient des propriétés antioxydantes, et c'est pour cela que depuis les années 1950, des scientifiques (œnologues, spécialistes du vin, industries pharmaceutiques) se sont intéressés à ces composés et les ont recherchés dans le vin et le raisin à l'aide de différentes méthodes comme la spectrométrie de masse. Les différents cépages, les différents vins des différentes régions de la planète, les différentes fermentations ont été étudiées, et même, il y a peu, l'effet de l'utilisation d'antifongiques sur les raisins avant les vendanges.
Nous avons souhaité présenter cette thèse sur l'action du Botrytis cinerea, un ascomycète connu en œnologie comme étant l'agent responsable de la pourriture noble, permettant la formation des vins liquoreux, sur la composition des peaux de grains de raisins recueillis pour les vendanges.
Dans un premier temps, nous parlerons de la composition physicochimique du raisin, en s'attardant ensuite sur les composés phénoliques. Nous détaillerons les différentes méthodes d'extraction et d'analyse de ces composés avant d'aborder les effets déjà connus du Botrytis sur les polyphénols. Ensuite, nous évoquerons les analyses que nous avons faites en expliquant la méthode utilisée, ainsi que les résultats obtenus autour desquels nous discuterons.
12
Partie I :
13
Introduction
Les plantes produisent des composés que l’on peut classer en métabolites primaires (c’est-à-dire les molécules nécessaires à la vie et à la reproduction de la plante) et en métabolites secondaires. Ces métabolites sont importants car ils permettent à la plante de s’adapter à son environnement et de lutter contre les différents stress que peuvent représenter le manque de soleil, d’eau, de nutriments, mais aussi les infestations fongiques ou animales.
Pour le raisin, on retrouve de nombreux métabolites secondaires, comme les polyphénols, qui ont été largement étudiés pour leur effet antioxydant intéressant dans le domaine pharmaceutique et nutraceutique. Parmi ces polyphénols, on peut distinguer les flavonoïdes, les stilbènes (dont le plus important est le resvératrol), les anthocyanes, les proanthocyanes (utilisés dans le milieu pharmaceutique pour les infections urinaires)…
Ces polyphénols présentent différents rôles. Les flavonoïdes, par exemple, sont des phyto-œstrogènes, qui ont un effet négatif sur les prédateurs, mais servent également à attirer les pollinisateurs en étant responsables de la couleur et de l’odeur de la plante. Ils protègent également les plantes des rayons UV.
14
I) Le raisin, fruit de la vigne I.1) Généralités
La vigne est un nom ambigu qui désigne plusieurs taxons, dont le genre Vitis qui contient en son sein l'espèce Vitis vinifera, la vigne européenne. La vigne est une plante grimpante adaptée aux climats méditerranéen et océanique, cultivée partout dans le monde. Pour chaque espèce, il existe plusieurs cépages, c'est-à-dire plusieurs variétés de plante.
Depuis 1861 et une épidémie de phylloxéra (une sorte de puceron originaire d'Amérique du Nord), les ceps sont principalement obtenus par greffage, avec un greffon provenant d'une vigne européenne, apportant une meilleure qualité des fruits, et un porte-greffon d'origine américaine, connu pour être plus résistant face au phylloxéra. (Fig. 1.)
Fig. 1. Description d'un cep de vigne
La vigne est cultivée depuis des millénaires car elle apporte plusieurs produits :
- le bois des ceps, réputé très solide, permet la fabrication d'objets (par exemple des cannes de marche),
- les sarments, ces rameaux verts que la vigne pousse chaque année et dont la taille va permettre d'obtenir le meilleur compromis entre la qualité et la quantité de raisin obtenues sur chaque cep, servent également pour obtenir du bois de chauffe,
- le raisin, le fruit de la vigne, utilisé soit comme raisin de table, soit en boissons (jus, vin), soit encore en produits alimentaires dérivés (vinaigre, huile de pépins de raisin...)
15 D'un point de vue descriptif, le raisin est un fruit à pépin, qui est en position centrale dans le fruit. Il est entouré de la pulpe, elle-même délimitée par la pellicule qui est la partie que nous allons étudier ici. Sur la pellicule se trouve également la pruine, une couche cireuse qui rend la pellicule non mouillable. Le raisin est attaché à la rafle par le pédicelle, formant un bourrelet au niveau de la pellicule, et qui se prolonge par le pinceau jusqu'au niveau du pépin (Fig.2.)
Fig. 2. Description du grain de raisin
16
I.2) Composition chimique du raisin I.2.1) Valeurs nutritionnelles
Le raisin est composé à plus de 83% en eau, et contient également 12,2 g de sucres, 1,2 g de fibres, 0,5 g de protéines, 0,25 g de lipides et 2,35 g d'acides organiques pour 100 grammes. (1) (Fig.
3.).
Fig. 3. Composition nutritionnelle du raisin (en g/100 g) I.2.2) Vitamines et oligo-éléments
Le raisin est une bonne source de vitamine C (8,4 mg pour 100 g), E (0,2 mg), de bêta-carotène (provitamine A, 24 µg), et de folates (vitamine B9, 26,7 µg). On peut aussi noter la présence de vitamine B1, B2, B3, B5 et B6 (Tab.1.).
Il possède de nombreux oligo-éléments : du magnésium, du potassium, du phosphore, du calcium, du manganèse, du fer, du cuivre, du zinc, du sélénium et de l'iode. Il est cependant pauvre en sodium.
Tab. 1. Composition en vitamines et oligoéléments du raisin.
Vitamines (µg/100 g) Oligo-éléments (mg/100 g sauf indication) Bêta-carotène (Provitamine A) 24 Magnésium 6,78 Vitamine B1 37,5 Phosphore 12,9 Vitamine B2 20 Potassium 172 Vitamine B3 125 Calcium < 11,2 Vitamine B5 75 Manganèse 0,05 Vitamine B6 70 Fer 0,3 Vitamine B9 26,7 Cuivre 0,078 Vitamine C 8400 Zinc < 0,0637 Vitamine E 200 Sélénium < 2,2 µg/100 g Iode 0,45 µg/ 100 g 8
3
12.2
Acides organiques, 2.3Fibres, 1.2 Protéines, 0.5 Lipides, 0.25
Eau Sucres Acides organiques Fibres Protéines Lipides
17
I.3) Utilisation en pharmacie
La vigne et ses produits sont utilisés depuis longtemps en pharmacie. Les indications retenues suite à la publication du cahier n°3 de l’AFSSAPS en 1998 sont :
- l’utilisation traditionnelle, en voie orale ou en usage local, dans le traitement symptomatique des troubles fonctionnels de la fragilité capillaire cutanée tels qu’ecchymoses, pétéchies ;
- l’utilisation traditionnelle, en voie orale ou en usage local, dans les manifestations subjectives de l’insuffisance veineuse telles que les jambes lourdes et dans la symptomatologie hémorroïdaire ;
- l’utilisation traditionnelle, en usage local, en cas d’irritation ou de gêne oculaire due à des causes diverses (atmosphère enfumée, effort visuel soutenu, bain de mer ou de piscine…)
On peut citer plusieurs spécialités ayant comme base la vigne rouge : l’Ophtalmine (plus commercialisé depuis 2010), les gélules de vigne rouge Elusanes ou Arkopharma, l’Antistax … Dans les manifestations de l’insuffisance veineuse, la vigne rouge est généralement associée à d’autres plantes comme le marron d’Inde, l’hamamélis, ou encore le mélilot. Les effets de la vigne sur l’insuffisance veineuse sont dus aux polyphénols et particulièrement aux flavonoïdes, tanins et aux anthocyanes.
Les tanins (ou proanthocyanes) possèdent également une légère activité antibactérienne, et c’est pour cette raison qu’ils sont également utilisés dans la lutte contre les infections bactériennes, même si généralement, ce sont les proanthocyanes issus de la canneberge qui sont utilisés.
La marque de dermocosmétiques Caudalie s’est spécialisée dans l’utilisation des produits de la vigne pour la création de leurs produits. On peut alors retrouver une gamme de produits anti-âge à base de resvératrol, qui est un stilbène qui a des effets anti-oxydants, une autre gamme de produits à base de viniférine, un polymère de ce même resvératrol (2), pour les tâches de vieillesse, et des produits ayant comme base des polyphénols, afin de combler les rides.
18
II) Composés phénoliques du raisin
Nous avons décidé d'étudier les composés d'intérêt les plus présents dans les recherches précédentes. Tous ces composés sont des composés phénoliques non volatiles, et tous, en dehors des acides phénols sont des polyphénols (Tab. 2.) Ils sont responsables de l'arôme, de la couleur, du goût, de l'amertume et de l'astringence du raisin et du vin (3).
Tab. 2. Liste des composés d'intérêt étudiés
Classe Sous-classe Eléments
Acides phénols Acide caftarique, acide coutarique
Flavonoïdes Flavonols Kaempferol, quercétine, myricétine (et dérivés O-méthylés : laricitrine, isorhamnétine et syringétine) Flavanols Epicatéchine, catéchine, gallocatéchine,
épigallocatéchine
Flavononols Taxifoline
Anthocyanidols Pélargonidine, cyanidine, péonidine, pétunidine, delphinidine, malvidine
Anthocyanes Idem ci-dessus mais glycosylés, acétylés...
Proanthocyanes B1...
Stilbènes Resvératrol, pinosylvine, piceatannol, ptérostilbène
Autres polyphénols Curcumine, gingérol...
II.1) Les acides phénoliques
Ce sont des dérivés de l'acide cinnamique en C6-C3. Ils sont associés à la couleur brune du vin lors du vieillissement ainsi qu'au côté astringent du raisin et du vin. Les plus communs sont l'acide caftarique (qui est plus situé dans la chair du raisin), l'acide coutarique (plus présent dans la peau du raisin) et l'acide férulique (3) (Fig. 4.)
19
II.2) Les flavonoïdes
Ce sont des métabolites secondaires des plantes qui ont pour structure commune deux cycles en C6 reliés par trois carbones. Généralement, la chaîne C6-C3-C6 est fermée pour former un troisième hétérocycle oxygéné. Ils sont responsables de la couleur des fruits.
Dans les flavonoïdes sont compris les flavones, les flavonols, les flavanones, les flavononols, les flavanes, les flavanols, les anthocyanes (et anthocyanidols), les chalcones (et dihydrochalcones) (4).
II.2.1) Les flavonols
C'est un sous-groupe des flavonoïdes dérivés de la 3-hydroxyflavone (Fig. 5.). Ils sont responsables de la pigmentation jaune des végétaux, mais aussi de la photo-protection contre les UVA et les UVB (5). Du fait de cette photo-protection, ils se situent essentiellement dans l'épiderme externe de la peau des raisins. On peut observer que la quercétine est le flavonol le plus important dans les cépages blancs ou légèrement rosés / rouges alors que pour les cépages rouges, c'est la myricétine qui est majoritaire (5)
La myricétine, la laricitrine et la syringétine se trouvent seulement dans les cépages rouges. De plus, la myricétine, la laricitrine et l'isorhamnétine ne se trouvent qu'en étudiant les grains, et pas dans les vins issus de ces grains (6).
Les aglycones de flavonols ne sont naturellement pas présents dans les plantes fraîches mais peuvent être retrouvés par la suite lors de la transformation de celles-ci en aliments (7).
20
II.2.2) Les anthocyanes
Ce sont des hétérosides dérivant de leur aglycone associé, qui est l'anthocyanidol (Fig. 6.). Ils sont des pigments naturels des végétaux, pouvant aller de l'orange (pour la cyanidine et ses dérivés) au bleu pourpre (pour la delphinidine et ses dérivés) (5) et qui donnent leur couleur aux grains de raisin ainsi qu'aux vins. Ils sont situés uniquement dans la peau du raisin.
Ils ont également des propriétés anti-oxydantes, antibactériennes et anticancéreuses (2). On les utilise en oenologie pour vérifier la qualité d'un vin ainsi que l'utilisation du ou des cépages indiqués sur l'étiquette car les concentrations sont différentes selon les variétés. Elles évoluent également selon la période de l'année.
Généralement, les anthocyanes sont plus stables que les anthocyanidols (8), et on ne trouve que des dérivés 3-O-monoglucosidiques, 3-O-acétyl et 3-O-pcoumariques chez Vitis vinifera. D'ailleurs, comme pour les flavonols, les anthocyanidols ne sont pas présents dans les plantes fraîches (9).
21
II.2.3) Les flavanols (ou catéchines)
C'est également un sous-groupe des flavonoïdes dont la structure commune est celle de la 2-phényl-3-chromanol (Fig. 7.) Les plus courants sont la catéchine et l'épicatéchine. Ils sont présents dans la peau et les pépins de raisin ainsi que dans le vin. Bien que peu connus et recherchés dans les études, ce sont les métabolites secondaires les plus communs retrouvés dans les grains de raisin (10).
Fig. 7. Structures de base des flavanols. (a) représente la 2-phényl-3-chromanol
II.3) Les proanthocyanes (ou tanins condensés)
Ce sont des polymères de flavanols, généralement de catéchine et d'épicatéchine, dont les unités sont liées entre elles par une liaison carbone-carbone C4-C8 ou C4-C6. Les proanthocyanes les plus communs de l'alimentation sont les procyanidines et les prodelphinidines. Leur hydrolyse donne l'anthocyanidol associé (par exemple, l'hydrolyse de procyanidine donne de la cyanidine). Cependant, ils sont peu connus et peu étudiés, et leurs modalités de formation sont peu connues également. Les tanins contenus dans la peau du raisin peuvent contenir des sous-unités d'épigallocatéchine, contrairement à ceux contenus dans le pépin (10).
Les tanins condensés sont connus pour améliorer les symptômes de l'insuffisance veino-lymphatiques (jambes lourdes) ainsi que pour aider à traiter les infections urinaires. Ils sont donc régulièrement utilisés en phytothérapie dans ce but. Ils auraient des propriétés antioxydantes, anti-agrégantes plaquettaires et anti-cancéreuses. Ces propriétés ont été prouvées in vitro, mais pas in vivo à cause de la biodisponibilité très faible des tanins condensés (11). Ils sont responsables des propriétés astringentes du vin.
22
II.4) Les stilbènes
Les stilbénoïdes sont des polyphénols qui ont pour structure commune deux cycles en C6 reliés par deux carbones. Ce sont des métabolites produits par les plantes en cas d'attaque (fongique ou microbienne) ou en tant que phytoalexines, c'est-à-dire comme régulateur de croissance. Il peut donc être intéressant de rechercher une différence de quantité de ces composés ici puisque nous recherchons l'effet d'une attaque fongique sur les composés d'intérêt. Toutes les molécules recherchées sont des stilbènes car les deux carbones reliant les cycles forment un pont éthène (Fig. 8.).
Le resvératrol possède des activités anti-cancéreuses, anti-oxydantes, anti-inflammatoires et cardioprotectrices (2). Sa conversion en ptérostilbène est catalysée par la resvératrol-O-méthyltransférase (ROMT), ce qui en fait un produit très toxique pour les champignons (12). De même, sa dimérisation permet de donner l'ε-viniférine, synthétisé en cas d'infestation par Botrytis cinerea (13).
23
III) Méthodes utilisées pour l’identification et la quantification des composés phénoliques
Ces composés ayant été largement étudiés depuis des décennies, il existe de très nombreuses méthodes qui permettent de les isoler et de les analyser. Nous ne nous attarderons que sur les plus récentes et les plus utilisées.
III.1) Préparation de l'échantillon
Dans la plupart des cas, les raisins sont éclatés manuellement afin de faire sortir la chair et de permettre de la séparer de la peau. Ensuite, la peau est rincée plusieurs fois à l'eau distillée, ou à l'eau Milli-Q, puis séchée au papier filtre avant d'être broyée, soit au moulin à café, soit au broyeur à billes. Certaines extractions ne nécessitent pas cette étape de broyage.
III.2) Extraction des polyphénols
L'extraction des polyphénols est possible en utilisant des solvants alcooliques ou hydro-alcooliques pouvant contenir ou non un ou plusieurs acides minéraux (généralement l'acide chlorhydrique) ou un mélange acétone/eau. L'avantage de l'utilisation d'un acide minéral (à faible concentration) est que l'extraction des polyphénols est complète.
Cependant, il y a un risque de création d'artéfacts dû à une hydrolyse des proanthocyanes et des anthocyanines acétylés, même en cas de conservation à basse température. D'autres artéfacts peuvent se former, par la polymérisation des polyphénols ou par l'activité d'oxydases des polyphénols (PPO). En revanche, on peut empêcher ces enzymes d'agir en laissant les extraits dans l'azote liquide, en utilisant un solvant avec une concentration importante d'alcool ou d'acétone, ou en ajoutant du dioxyde de soufre.
Une méthode parfois utilisée et qui permet d'extraire le maximum de polyphénols en minimisant le risque d'artéfacts est d'utiliser un "vin synthétique" composé de 5 g d'acide tartrique, 22,2 mL de soude (NaOH) à 1 M, 2 g de métabisulfite de sodium (Na2S2O5), 125 mL d'éthanol et complété pour un volume d'1 L avec de l'eau (14). Cependant, cette solution s'avère moins efficace pour les proanthocyanidines et les autres polyphénols de haut poids moléculaire, mais le solvant n'a pas besoin d'être éliminé avant les analyses, ce qui réduit à nouveau le risque d'artéfacts.
On peut également citer trois méthodes utilisant comme base un solvant acétone/eau. La première ne nécessite pas le broyage des peaux avant l'extraction. Après rinçage, les peaux sont plongées dans 100 mL de solution aqueuse contenant 100 mg/L de dioxyde de sodium et conservées à 4°C (15). Pour l'extraction, l'ensemble est transféré dans un erlenmeyer de 500 mL et on y ajoute 200 mL d'acétone. Ensuite, l'erlenmeyer est recouvert et agité pendant 24 heures à 100 rpm. Après extraction, l'acétone est éliminé par aspiration à 35-40°C, une centrifugation est effectuée et on
24 récupère le surnageant, le dilue à 100 mL avec de l'eau distillée et on le conserve à -20°C jusqu'à l'analyse.
La seconde méthode est l'extraction de la poudre de peaux, obtenue par broyage dans l'azote liquide, dans une solution d'acetone/eau 7:3 (v/v) dans laquelle est ajoutée 0,1% d'acide ascorbique pour éviter une oxydation (16).
La dernière manière d'extraire les polyphénols à l'aide d'un solvant acétone/eau est d'immerger les peaux de raisin dans une solution de 100 mL de méthanol dans laquelle se trouve 5 mg d'acide ascorbique et de les laisser 24h à -24°C sous atmosphère azotée (17,18). Le résidu solide est ensuite extrait avec 100 mL d'un mélange méthanol/eau 4:1 (v/v) pendant 4 heures puis par 100 mL d'un mélange méthanol/eau (1:1) également pendant 4 heures. Enfin, après l'extraction, on rajoute de l'eau distillée et on garde le mélange 15 heures à -24°C. Le résidu est extrait pendant une heure avec un mélange acétone/eau 3:1.
D'autres méthodes d'extraction ont été utilisées : par le méthanol, par le méthanol dans lequel on a ajouté un acide organique (l'acide formique), par un mélange éthanol/eau/chloroforme, par un mélange éthanol/acide chlorhydrique, ou enfin par un mélange éthanol/eau. On peut également parler d’une méthode d’extraction par liquide sous pression (PLE), où le solvant est envoyé à travers des cellules d’extraction avec une pression, une température et des temps donnés (19).
25
III.3) Préparation des échantillons pour l'analyse HPLC
Lors des premières analyses HPLC, les échantillons étaient directement injectés dans la colonne. Ensuite, on a préféré, pour améliorer la qualité de l'analyse, fractionner les différentes classes à l'aide de polymères absorbants, ou d'une colonne en C18. On utilise également cette dernière pour concentrer et purifier les échantillons par extraction en phase solide (SPE) avant l'analyse HPLC.
III.3.1) Séparation en vue de l'analyse des flavonols et des HCTA
On peut analyser les HCTA et les flavonols après acidification de l'extrait. On ajoute 0,5 mL d'acide phosphorique 1M à 4,5 mL d'extrait. Le tout est filtré ensuite sur une membrane 0,45 µm. Avant l'analyse, une concentration des molécules peut être effectuée à l'aide d'une cartouche en C18. De manière plus simple, on peut utiliser 5 mL d'extrait dilué avec de l'acide sulfurique 5 x 10-3 M que l’on passe ensuite à travers une cartouche C18 1-g activée auparavant par le passage de 2 mL de méthanol et de 3 mL d'acide sulfurique. La phase stationnaire est lavée par 2 mL d'acide sulfurique et les analytes sont récupérés à l'aide d'une élution au méthanol. Le solvant est ensuite évaporé puis les analytes sont de nouveau dissous dans un mélange méthanol / acide sulfurique 2:3 (v/v) et filtré à 0,45 µm avant analyse. (14)
III.3.2) Préparation en vue de l'analyse des monomères d'anthocyanes
On a le choix entre deux préparations, en fonction de la concentration en anthocyanes. Si cette concentration est suffisante, on acidifie 4,5 mL d'extrait à l'aide de 0,5 mL d'acide phosphorique 1M, puis on filtre à 0,2 µm. On peut injecter directement cette solution dans la colonne de la HPLC. Si la concentration en anthocyanes est trop faible, il faut concentrer ceux-ci avant l'analyse. Une cartouche C18 300-mg est activée par le passage de 2 mL de méthanol puis de 3 mL d'acide sulfurique 5 x 10-3 M. On mélange 2,5 mL d'extrait avec 7,5 mL d'acide sulfurique et on passe doucement cette solution dans la cartouche. Après lavage par 2 mL d'acide sulfurique, la cartouche est séchée sous un courant azoté, puis l'élution des anthocyanes se fait avec du méthanol. Après élimination du solvant, le résidu est dissous à nouveau par 1 à 2,5 mL d'un mélange méthanol/acide phosphorique 10-3 M 2:3 (v/v) et cette solution est utilisée pour l'analyse HPLC.
Enfin si la concentration en anthocyanes est extrêmement faible, on peut utiliser un volume d'extrait plus important, dilué au cinquième et passé à travers une cartouche C18 plus large (1 g par exemple).
26
III.3.3) Préparation en vue de l'analyse des proanthocyanes
Afin d'analyser les proanthocyanes, il peut être nécessaire d'utiliser des agents nucléophiles comme le phloroglucinol ou le benzylmercaptan (20). En effet, l'utilisation d'un milieu acide risque de dénaturer les proanthocyanes et de former des intermédiaires flavan-3-ol, qui fausseraient les résultats.
Les polyphénols dans l'extrait de peaux sont adsorbés par une cartouche C18 1g. La phase stationnaire est lavée avec de l'eau et les composants adsorbés subissent une élution avec un petit volume de méthanol. Après ajout du volume correspondant d'eau avec 0,1% d'acide trifluoroacétique (TFA), les proanthocyanes sont séparés des catéchines par une chromatographie sur une colonne Toyopearl TSK HW 40-F. La colonne est équilibrée par un mélange méthanol/eau 1:1 (v/v) dans lequel est ajouté 0,1% de TFA. Les monomères de flavonols sont éliminés en rinçant la phase mobile par cinq volumes de la colonne.
L'élution des proanthocyanes se fait avec l'équivalent de trois volumes de la colonne d'un mélange d'acétone/eau 2:1 (v/v) avec 0,1% de TFA. L'éluent est concentré sous pression réduite à 35°C et le résidu est repris avec un volume d'acide chlorhydrique 0,1 M comprenant 50 g/L de phloroglucinol et 10 g/L d'acide ascorbique, pour obtenir une concentration minimale en proanthocyanes de 5 g/L. La réaction se fait pendant vingt minutes à 50°C puis cinq volumes d'une solution d'acétate de sodium aqueux 40 mM sont ajoutés pour arrêter la réaction. L'analyse HPLC peut alors être effectuée (20).
La détermination du degré moyen de polymérisation (DMP) des proanthocyanes et l'analyse des monomères qui composent ceux-ci est effectuée en les hydrolysant avec du benzylmercaptan (15). Les PAC sont séparés des flavan-3-ols comme expliqués ci-dessus. Ensuite, 800 µL d'extrait de PAC et 800 µL d'une solution méthanolique d'acide chlorhydrique 0,4 M contenant 12% de benzyl mercaptan sont mis dans une fiole de 1,8 mL. On laisse les produits réagir pendant 10 minutes au bain-marie à 60°C, puis la réaction est stoppée en ajoutant 200 µL d'une solution méthanolique d'acétate d'ammonium 5,2 M. L'analyse HPLC est faite ensuite.
27
III.4) Analyse HPLC
Généralement, les monomères sont analysés à l'aide d'une HPLC couplée à une colonne C18 en phase inverse; à une température proche de la température ambiante.
III.4.1) Analyses des HCTA et flavonols
On détecte ces deux types de composés simultanément en utilisant une colonne en C18 agissant à 40°C, avec de l'acide phosphorique (H3PO4) à 10-3 M en premier solvant et du méthanol comme second solvant. Les longueurs d'onde permettent de distinguer les deux classes : on trouvera les acides hydroxycinnamiques à 320 nm et les flavonols à 360 nm (14).
Une autre méthode a été utilisée pour l'analyse des flavonols après hydrolyse des formes glycosylées : 15 mL d'extrait de peau de raisin sont mélangés à 30 à 40 mL de méthanol aqueux (1:1, v/v) contenant de l'acide chlorhydrique 0,5 M et de la morine (un flavonol présent dans le goyavier commun) comme étalon interne. L'hydrolyse se fait pendant une heure à 85°C. Après refroidissement, l'échantillon est filtré sur une membrane 0,45 µm et analysé par HPLC.
La concentration des flavonols se fait à travers une colonne C18 activée par le passage de 2 mL de méthanol puis par 3 mL d'acide sulfurique (H2SO4) 5x10-3 M. Les analytes sont récupérés de la cartouche par le passage de méthanol.
L'analyse HPLC se fait quant à elle avec une colonne C18 avec de l'acétonitrile comme premier solvant et de l'acide formique aqueux à 1% comme second solvant. La longueur d'onde de détection est de 360 nm (21).
III.4.2) Anthocyanes et dérivés
Pour l'analyse des anthocyanes dans la peau de raisin par HPLC, une des méthodes utilisées est l'utilisation d'une colonne en C18 à 45°C, avec deux solvants utilisés pour l'analyse : un mélange d'acide formique dans l'eau (1:9, v/v) et un mélange d'acide formique, de méthanol et d'eau (1:5:4, v/v/v). La longueur d'onde utilisée est de 520 nm. (14)
D'autres associations de solvant sont utilisables :
- un mélange d'acide acétique et d'eau (1:9, v/v) et de l'acétonitrile (22). - un mélange d'acide formique et d'eau (1:9, v/v) et de l'acétonitrile (23).
28
III.4.3) Analyse des catéchines et des proanthocyanes
L'analyse directe des extraits de peaux n'est pas assez sensible pour retrouver des dimères de catéchines et de proanthocyanes, ces composés étant trop peu présents. En conséquence, il faut concentrer l'échantillon avant l'analyse par un passage à travers une colonne en C18.
Cette concentration se fait par le passage d'un mélange de 5 mL d'extrait et de 15 mL d'acide sulfurique 5x10^-3 M dans la colonne préalablement activée par le passage de 5 mL de méthanol et de 6 mL d'acide sulfurique à la concentration 5x10^-3 M. Après le passage de l'échantillon, la phase statique est nettoyée par 3 mL d'acide sulfurique et les catéchines sont récupérées par 15 mL d'éther diéthylique et les dimères et oligomères de procyanidines par le passage de 20 mL d'acétate d'éthyle. Après évaporation des solvants, les résidus sont dissous à nouveau dans un mélange méthanol/acide phosphorique 10^-3 M 2:3 (v/v).
L'analyse HPLC est faite à l'aide d'une colonne C18 à 40°C utilisant de l'acide phosphorique 10^-3 M et de l'acétonitrile comme couple de solvants. La détection se fait à une longueur d'onde de 280 nm (14).
III.4.4) Analyse des stilbènes
Pour analyser les stilbènes dans les peaux, une des manières de faire est d'utiliser 20 mL d'extrait et d'extraire les stilbènes par trois fois 10 mL d'acétate d'éthyle. Les extraits sont ajoutés les uns aux autres et évaporés jusqu'à asséchement complet, puis le résidu est repris par 2 mL de méthanol/eau 1:1 (v/v) et filtré à travers une membrane 0,45 µm.
L'analyse HPLC du resvératrol libre et glycosylé et du piceatannol se fait à l'aide d'une colonne en C18 à 25°C avec une élution à l'aide d'un tampon phosphate 0,02 M à pH 3 et d'acétonitrile. Les longueurs d'onde utilisées sont 325 nm (trans-resvératrol et piceatannol) et 285 nm (cis-resvératrol) (14).
La quantité de trans-resvératrol totale peut-être mesurée après une hydrolyse enzymatique de la forme glycosylée (24,25). 1 mL d'extrait est évaporé jusqu'à asséchement, puis dissous à nouveau dans 5 mL de tampon phosphate à pH 6. On ajoute ensuite 15 mg de β-glucosidase à la concentration de 7,55 UI/mg, puis on incube le tout durant une nuit à 40°C. 1 mL de cette solution est extrait 3 fois avec 3 mL d'acétate d'éthyle. Les trois extraits sont combinés et sont filtrés et utilisés pour l'analyse HPLC.
29
IV) Quantités retrouvées
Beaucoup d’articles retrouvés ne mentionnent pas de quantités pour chaque molécule d’intérêt. En effet, puisque les quantités sont mesurées par rapport à un étalon interne, il arrive régulièrement que dans les comptes rendus on ne retrouve qu’une quantité totale ainsi qu’un pourcentage pour chacune des molécules.
Les prochains tableaux montrent, pour chaque famille de composés phénoliques les minima et maxima retrouvés pour chaque molécule, ainsi que les cultivars et les sources bibliographiques dont on a tiré ces résultats.
Nous avons décidé de n’utiliser également que les sources qui parlent des cultivars à peau rouge. Quelques rares variétés possèdent également une chair rouge, ce qui peut influencer la teneur en anthocyanes, même dans la peau (par des interactions entre les anthocyanes de la peau et ceux de la chair)
IV.1) Les acides phénols
L’acide phénol retrouvé en plus grande quantité dans les raisins est l’acide trans-caffeoyltartrique, dans la variété Gambarossa, avec 90,24 mg/kg de peaux sèches (26), suivi par l’acide trans-pcoumaroyltartrique chez le Nebue, avec 83,07 mg/kg (26). Les moins présents sont l’acide trans-ferroyltartrique qui est absent chez plusieurs cultivars, ainsi que l’acide cis-caftarique, avec un maximum à 0,46 mg/kg chez le Merlot (27). (Tab.3.)
On peut remarquer pour les acides phénols que les acides phénols de type trans sont plus présents que les acides de configuration cis, du fait de leur plus grande stabilité. On peut également voir que les cultivars Merlot et Shiraz sont pauvres en acides phénols, contrairement au Gambarossa et au Nebue. Il existe un facteur 10 entre le Merlot qui est le plus pauvre et le Nebue qui est le plus riche.
Tab. 3. Quantités en acides phénols retrouvées (en mg/kg)
(mg/kg) Min Variété Max Variété
Acide trans caffeoyltartrique 3.93 Freisa (26) 90.24 Gambarossa (26) Acide cis pcoumaroyltartrique 0.85 Moscato d’Amburgo (26) 7.00 Nebue (26) Acide trans
pcoumaroyltartrique
3.32 Moscato d’Amburgo (26) 83.07 Nebue (26)
Acide trans ferroyltartrique 0 Plusieurs (26) 6.47 Teinturié (rond) (26) Acide cis-caftarique 0.17 Shiraz (27) 0.46 Merlot (27)
Acide trans-caftarique 4.9 Shiraz (27) 9.5 Cabernet-Sauvignon (27) Acide cis-coutarique 0.94 Merlot (27) 2.7 Cencibel (27)
Acide trans-coutarique 3.2 Merlot (27) 10 Cencibel (27)
30
IV.2) Les flavonoïdes IV.2.1) Flavonols
Contrairement aux acides phénols, de nombreuses sources ont été retrouvées pour obtenir le tableau ci-dessous. On remarquera que certaines sources ont réussi à dissocier les formes glycosylées et les formes glucuronides des flavonols, alors que d’autres non. D’autres sources ont également mesuré les aglycones, après séparation des sucres. (Tab. 4.)
On peut voir que, pour la quercétine, la forme majoritaire est la forme glucuronide, même si la forme glycosylée est également très présente. Pour les autres flavonols dont on a pu mesurer les deux formes, la forme glycosylée est majoritaire. La forme galactoside est marginale en comparaison. Si l’on compare les différents flavonols entre eux, on peut remarquer que la quercétine est le flavonol majoritaire, suivi du kaempferol et de la myricétine (qui sont dans le même ordre de grandeur), et enfin, les trois flavonols minoritaires sont la laricitrine, l’isorhamnétine et la syringétine. On peut noter l’absence de kaempferol pour un cultivar (le Tannat), et de la laricitrine, et de la syringétine pour plusieurs variétés.
Les cultivars les plus riches en flavonols sont le Nebue, avec 297,90 mg/kg de pellicules sèches (26), la Barbarossa, le Tempranillo et le Brachetto roero. A l’inverse, les moins riches sont le Grignolino avec seulement 3,81 mg/kg de peaux sèches (28), et le Rufete (29).
Tab. 4. Quantités retrouvées en flavonols (en mg/kg)
(Mg/kg) Min Variété Max Variété
Quercétine-3-O-glucoside 4.80 Dolcetto (26) 108.15 Barbarossa (26) Quercétine-3-O-glucuronide 5.56 Becuet (26) 113.80 Nebue (26) Quercétine-3-O-glucuronide/glucoside 18.8 Rufete I (29) 56.9 Tempranillo (29) Quercétine-3-O-galactoside 1.1 Rufete II (29) 5.1 Tempranillo (29) Myricétine-3-O-glucoside 13 Merlot (27) 26 Cencibel (27) Myricétine-3-O-glucuronide 5.8 Merlot (27) 10 Cencibel, CS (27) Myricétine-3-O-glucuronide/glucoside 1.48 Avana (26) 80.66 Teinturié (ellip) (26) Myricétine-3-O-galactoside 0.9 Rufete II (29) 4.2 Tempranillo (29) Kaempferol-3-O-glucoside 1.80 Avana (26) 47.17 Brachetto roero (26) Kaempferol-3-O-glucuronide 0 Plusieurs (26) 7.45 Nebue (26)
Kaempferol-3-O-glucuronide/glucoside
2.1 Rufete II (29) 7.7 Tempranillo (29) Kaempferol-3-O-galactoside 0.8 Rufete II (29) 3.6 Tempranillo (29) Laricitrine-3-O-glucoside 1.6 Rufete II (29) 4.5 Tempranillo (29) Isorhamnétine-3-O-glucoside 0.9 Rufete II (29) 48 Shiraz (27)
Quercétine 1.0 Rufete II (29) 209.72 Nebue (26)
Myricétine 0.36 Grignolino (28) 46.27 Casetta (28)
Kaempferol 0 Tannat (28) 54.05 Brachetto roero (26)
Laricitrine 0 Plusieurs (28) 4.02 Carmenere (28)
Isorhamnétine 0.08 Sagrantino (28) 8.32 Cabernet Franc (28)
Syringétine 0 Plusieurs (28) 2.61 Carmenere (28)
31
IV.2.2) Anthocyanes
Les anthocyanes sont les molécules qui ont été le plus étudiées, du moins pour les formes glycosylées. Les sources sont donc multiples pour élaborer ce tableau. (Tab. 5.)
Les variétés Alicante Bouschet et Teinturié (à baies rondes ou ovales) sont toutes deux à chair rouge, ce qui explique le taux important d’anthocyanes que l’on a retrouvé. Les formes glycosylées sont celles que l’on retrouve le plus dans les peaux de raisin. Les autres formes sont marginales. Les anthocyanes les plus courants sont la malvidine, avec un maximum de 2,181 g/kg de pellicules sèches pour la malvidine-3-O-glucoside pour l’Alicante Bouschet, suivi de la delphinidine-3-O-glucoside et un taux de 1,647 g/kg pour le Casetta, et avec deux valeurs similaires, la pétunidine et la péonidine (28). L’anthocyane le plus rare est la cyanidine avec un maximum de 362,58 mg/kg pour la variété Avana (26).
Bien que la forme glycosylée soit la forme majoritaire, on peut voir que les formes acétylées et pcoumaroyl sont également très présentes, contrairement à la forme caffeoyl. On remarque que les pinots ne possèdent aucun anthocyane sous l’une de ces trois dernières formes (26,28). Nous avons déjà évoqué le fait que les raisins à chair rouge sont les plus riches en anthocyanes, comme le montrent les valeurs de l’Alicante Bouschet, et du Teinturié. Cependant, on peut voir également que les variétés Casetta et Tempranillo possèdent également beaucoup d’anthocyanes, contrairement au Muscat rouge de Madère, aux Pinots, et au Rufete.
32
Tab. 5. Quantités retrouvées en anthocyanes (en mg/kg)
(Mg/kg) Min Variété Max Variété
Malvidine-3-O-glucoside 0.30 Gewurztraminer (28) 2181.17 Alicante Bouschet (28) Malvidine-3-O-acétyl-glucoside 3.0 Rufete II (29) 7.8 Rufete I (29)
Malvidine-3-O-pcoumaroylglucoside 56.6 Rufete II (29) 108.3 Tempranillo (29) Malvidine-3-O-caffeoylglucoside 0 Plusieurs (28) 14.44 Casetta (28) Delphinidine-3-O-glucoside 0 Muscat rouge de
Madere (28) 1647.71 Casetta (28) Delphinidine-3-O-acétyl-glucoside 0.2 Rufete II (29) 1.5 Tempranillo (29)
Delphinidine-3-O-pcoumaroylglucoside 7.2 Rufete II (29) 30.5 Tempranillo (29) Cyanidine-3-O-glucoside 1.50 Cannonau (28) 362.58 Avana (26) Cyanidine-3-O-acétyl-glucoside 0.5 Rufete II (29) 1.7 Tempranillo (29)
Cyanidine-3-O-pcoumaroylglucoside 0.1 Rufete II (29) 0.3 Rufete I (29) Pétunidine-3-O-glucoside 0 Muscat rouge de
Madere (28) 1188.06 Casetta (28) Pétunidine-3-O-acétyl-glucoside 1.8 Rufete II (29) 5.7 Tempranillo (29)
Pétunidine-3-O-pcoumaroylglucoside 22.8 Rufete II (29) 70.4 Tempranillo (29) Péonidine-3-O-glucoside 0 Muscat rouge de
Madere (28) 1167.53 Alicante Bouschet (28) Péonidine-3-O-acétyl-glucoside 0.4 Rufete II (29) 1.1 Tempranillo (29)
Péonidine-3-O-pcoumaroylglucoside 3.6 Rufete II (29) 10.7 Tempranillo (29) Péonidine-3-O-caffeoylglucoside 0.2 Rufete II (29) 0.5 Tempranillo (29) Total acétylglucosides 0 Pinot noir (26), Pinots
(28) 1035.75 Teroldego (28)
Total pcoumaroylglucosides 0 Pinot noir (26), Pinots
(28) 754.19 Alicante Bouschet (28)
Total caffeoylglucosides 0 Plusieurs (26) 10.81 Teinturié (rond) (26)
Total 25.58 Muscat rouge de
33
IV.2.3) Flavanols
La catéchine est le flavanol le plus couramment retrouvé, avec un maximum de 25 mg/kg de pellicules sèches pour le Merlot (27). Pour le même cultivar, on retrouve également 13 mg/kg d’épicatéchine. (Tab. 6.)
Le flavanol le plus rare est la gallocatéchine, avec un taux maximum retrouvé de 2,8 mg/kg pour le Carmenere (30).
A l’inverse des acides phénols, le Merlot est le cultivar le plus riche en flavanols avec 96,28 mg/kg (27), alors que le Marzemino est le moins riche avec 3,8 mg/kg (30).
Tab. 6. Quantités retrouvées en flavanols (en mg/kg)
(mg/kg) Min Variété Max Variété
Catechine 0.7 Tenoldego, Marzemino (30) 25 Merlot (27) Epicatechine 0.1 Marzemino (30) 13 Merlot (27) Gallocatéchine 0.8 Pinot Noir (30) 2.8 Carmenere (30) Epigallocatéchine 0.8 Pinot Noir (30) 5.2 Marzemino (30)
Total 3.8 Marzemino (30) 96.28 Merlot (27)
IV.3) Les proanthocyanes
Les valeurs dans le tableau ci-dessous (Tab. 7.) ont été obtenues avec une seule source. On peut voir que le Shiraz possède très peu de proanthocyanes, contrairement au Cencibel (27). Cependant, le manque de sources ne nous permet pas de savoir si il y a d’autres cultivars qui sont plus riches (ou plus pauvres) en proanthocyanes que les trois variétés évoquées dans le tableau.
Tab. 7. Quantités retrouvées en proanthocyanes (en mg/kg)
(mg/kg) Min Variété Max Variété
B1 8.4 Shiraz (27) 22 Cencibel (27)
B2 0.75 Shiraz (27) 2.2 Merlot (27)
B3 16 Shiraz (27) 39 Cencibel (27)
IV. 4) Les stilbènes
Nous n’avons retrouvé que très peu de résultats concernant les stilbènes, et aucune source ne nous indiquait des valeurs absolues.
34
V) Le Botrytis cinerea, parasite de la vigne V.1) Effets sur le règne végétal
Le Botrytis cinerea détruit majoritairement les tissus matures voire vieillissants, mais il agit bien avant ces phases, attendant que les conditions environnementales ou que la physiologie de l’hôte soient favorables à son attaque. Il est difficile à contrôler car il possède une grande diversité d’attaques, d’hôtes chez qui il se propage, et il peut survivre sur des longs laps de temps sous forme de mycélium ou de conidies (31). Selon l’hôte, les attaques peuvent être différentes, et nous allons parler des plus communes à présent. La pourriture grise et la plus typique. Elle s’accompagne généralement d’un collapsus et d’une fuite d’eau dans les tissus parenchymateux qui est suivi par une rapide apparition de masses grises macroscopiques remplies de conidies. Pour beaucoup de fruits et de légumes, dont le raisin dont nous reparlerons ensuite mais également les courgettes, concombres, haricots verts, fraises et pommes), l’infection commence sur les fleurs vieillissantes et atteignent les fruits situés à proximité. Pour certaines fleurs ornementales, comme la rose, l’attaque du champignon se distingue par la présence de petites tâches blanchâtres qui peuvent atteindre la fleur toute entière et aller jusqu’à une véritable pourriture selon les conditions environnementales. Concernant la tomate de serre, le Botrytis vient se loger au niveau des blessures faites lors de la taille de l’arbuste, et peut attaquer les tiges en entier. Pour le framboisier, en plus de la pourriture grise, l’ascomycète peut attaquer les feuilles en formant une lésion de couleur marron avec une marge jaune, qui peut s’étendre ensuite jusqu’au nœud des tiges végétatives, pouvant ainsi créer une lésion atteignant quinze centimètres de longueur dans le cortex primaire des tiges. Enfin, l’infection peut aussi s’étendre au niveau des semences pour plus de 50 espèces, dont le tournesol, le lin, la salade… (31)
35
V.2) Effets sur le raisin
Comme nous l'avons déjà dit précédemment, le Botrytis cinerea est un champignon de la famille des ascomycètes, responsable de la pourriture grise du raisin. Cette maladie est parfois recherchée pour l'élaboration des vins liquoreux tels que le sauternes, et est dans ce cas appelée « pourriture noble ». L'attaque du Botrytis se fait généralement après la véraison. Bien que nous n'évoquerons ici que l'attaque du Botrytis sur le grain de raisin, ce champignon peut attaquer les feuilles de vigne, l'inflorescence, et plus rarement les rameaux. De plus, ce champignon est polyphage, c'est-à-dire qu'il n'attaque pas essentiellement le raisin mais attaque de nombreux autres fruits (fraises, framboises, mûres...), et des fleurs (roses, lys, chrysanthèmes...).
Le mécanisme d'action de l'attaque du Botrytis sur le grain de raisin commence à être connu car largement étudié. On sait qu'il va devoir tuer le tissu afin d'obtenir les nutriments nécessaires à sa reproduction et à sa propagation.
Le Botrytis possède plusieurs mécanismes pour attaquer le grain :
- des enzymes de haut poids moléculaires sécrétées afin de détruire la paroi et la membrane cellulaire et qui aident à la macération puis à la destruction des cellules
- des toxines de bas poids moléculaires (phytotoxines) afin de détruire les cellules de l'hôte. (32)
Cependant, le raisin possède des antifongiques naturels qui permettent de se défendre contre les attaques du Botrytis qui sont les stilbènes et les protéines PR (patheogenesis-related). Selon plusieurs études, le trans-resvératrol (le stilbène prédominant dans la peau des raisins) induirait l'action d'une laccase, enzyme développée par le Botrytis, et cette laccase agirait au niveau du trans-resvératrol pour former de la trans-ε-viniférine, toxique pour le champignon (33). Mais ces études sont contestées, et d'autres ont émis l'hypothèse que le Botrytis cinerea dégraderait le trans-resvératrol à l'aide de la laccase (34,35)
Une dernière étude remarque que le Botrytis permet de mettre en contact le trans-resvératol, les protéines PR et les polyphénols. Il semblerait que le Botrytis se servirait des polyphénols pour éliminer la toxicité des phytoalexines et pour rendre les protéines PR insolubles (36).
36
Conclusion
Les composés phénoliques du raisin et de la vigne sont la cause de l’utilisation de ces plantes dans le domaine de la santé, notamment à cause de l’effet antioxydant pouvant être bénéfique sur un point de vue cardio-vasculaire.
Nous avons pu voir dans cette première partie que le raisin et sa composition ont été largement étudiés. D’un autre côté, nous avons également observé que les effets du Botrytis, bien qu’énormément étudié in vitro, n’avaient pas été observés in vivo, ou alors sous un angle très limité.
En effet, jusqu’alors, nous ne savons pas les effets de ce champignon sur la composition générale d’un organisme (ou d’un de ses organes). C’est pour cela que nous avons souhaité rechercher les différences de composition en polyphénols de la pellicule de grain de raisin, afin d’en savoir un peu plus sur l’infestation par le Botrytis.
Cela permettra également de voir comment on peut améliorer qualitativement et quantitativement les rendements des molécules d’intérêt que l’on peut utiliser en pharmacie.
37
Partie II :
38
Introduction
Nous avons souhaité étudier l’influence que pouvait avoir le Botrytis cinerea sur les composés phénoliques dans la pellicule du grain de raisin, tout d’abord en identifiant les différents composés que l’on pouvait retrouver, puis en essayant de les quantifier. Pour pouvoir réaliser cela, nous avons utilisé une des méthodes d’analyse présentées auparavant (cf. Contexte bibliographique), en utilisant la PLE (extraction liquide sous pression) (19), puis une chromatographie liquide couplée à une spectrométrie de masse, puisque nous savons que ces choix permettaient d’obtenir les meilleurs résultats.
A partir de ces extractions et analyses, nous avons pu identifier des flavonols, des anthocyanes ainsi que des stilbènes grâce aux ions obtenus par les fragmentations de chacune des molécules, et les quantifier ensuite.
39
I) Matériel et méthodes I.1) Echantillons
Nous avons utilisé des raisins issus d'un vignoble de champagne, et dont le cépage est inconnu. Un prélèvement de grappes saines et botrytisées a été réalisé lors des vendanges 2013, puis la pulpe et la pellicule de chaque grain de raisin ont été séparées afin de permettre notre analyse au niveau de la pellicule. En attendant leur utilisation, les pellicules ont été lyophilisées et conservées à une température de -80°C afin d'éviter la disparition de certains composés recherchés.
I.2) Broyage et extraction
Les pellicules lyophilisées ont été broyées en poudre fine à l'aide d'un broyeur à billes (Retsch MM400) à 30 percussions par minute pendant 3 minutes. Nous avons ensuite pesé trois fois 50 mg de chaque pellicule de raisin (sain et infesté) afin de procéder à l'extraction des composés, selon la méthode d’extraction liquide sous pression évoquée dans la partie précédente (19). Pour chaque extraction, les 50 mg de pellicules ont été mélangés avec du sable de l’ancienne mer de Fontainebleau pour ensuite être introduits dans une chambre d'extraction de taille 33 mL avec, à chaque extrémité un filtre en cellulose.
Une extraction solide-liquide a été effectuée par ASE (extraction accélérée par solvant) à l’aide d’une Dionex model ASE 200 (Dionex corp., Sunnyvale, CA) avec une pression de 100 bars, à 50°C, avec un volume de rinçage de 120% et pendant 3 cycles de 5 minutes. Cette extraction comprenait deux étapes :
- la première est une extraction à l'hexane afin d'éliminer tous les composés apolaires. - la deuxième étape par un mélange d'acétone, d'eau et d'acide acétique aux proportions 70-29,5-0,5.
Enfin le solvant est évaporé. Puis, on reprend le culot à l'aide de méthanol acide (0,5% d'acide acétique) afin de séparer les anthocyanes. Pour récupérer les proanthocyanes, on reprend avec de l'eau acide (0,5% d'acide acétique), puis extraction en phase solide (SPE) sur une colonne en C18 (200 mg/ 3 mL) avec une élution au méthanol acide.
40
I.3) Analyse par LC-MS
L'analyse par chromatographie en phase liquide couplée avec une spectrométrie de masse est faite pour chaque échantillon grâce à la colonne en C18 avec un gradient formé par un mélange acétonitrile/eau. Puis, on utilise deux types de détection : la première par UV à une longueur d'onde de 280 nm puis une de 520 nm, et la seconde par spectrométrie de masse (MS) en mode positif, à l'aide d’une Orbitrap XL (ThermoFisher Scientific).
L’acquisition des données se fait en mode positif avec comme limites de masses 200 et 1200 g/mol, en haute résolution (60 000 ; m/z 400). Cette acquisition est faite en mode automatique, ce qui permet d’inclure les fragmentations des molécules par collision avec des molécules neutres et la génération d’un spectre MS/MS basse résolution en mode centroïde.
La perte de neutron est aussi ajoutée afin de pouvoir mettre en évidence la perte de sucre pour les éléments glycosylés.
I.4) Récupération des données
Les pics, leurs aires et les temps de rétention ont été extraits avec l’aide du logiciel XCMS R-package version 1.38.0 après conversion du fichier original RAW en un fichier open source mzXML grâce à MSconvert version 3.0.5163 de chez Proteowizard. Le regroupement des pics de masses proches a été fait par Camera version 1.18.0, et la sélection des signaux représentatifs de chacun des métabolites (pics les plus intenses) pour l’analyse approfondie a été effectuée par script R.