Organisation du circuit locomoteur du mésencéphale et
réorganisation après lésion de la moëlle épinière
Mémoire
David Lafrance-Zoubga
Maîtrise en neurobiologie - avec mémoire
Maître ès sciences (M. Sc.)
Résumé
Les lésions médullaires entraînent un déficit fonctionnel moteur d’importance variable selon leur localisation et leur sévérité. En cas de lésion partielle, il est possible d’observer chez des modèles animaux et des patients un certain degré de récupération fonctionnelle après une période allant de quelques semaines à plusieurs années selon les cas. Cette récupération impliquerait une réorganisation anatomique du circuit locomoteur spinal ainsi que des centres supraspinaux. Parmi ces derniers se trouve la région locomotrice mésencéphalique (MLR) qui est une région fonctionnelle capable d’initier et de moduler la locomotion. Un débat entoure cependant la nature de ses corrélats anatomiques qui pourraient être le noyau cunéiforme (CnF) qui est essentiellement composé de neurones glutamatergiques, le noyau pédonculopontin (PPN) formé de neurones cholinergiques et glutamatergiques, le noyau mésencéphalique profond (MRN/DpMe) qui est glutamatergique et le tegmentum latérodorsal (LDT) formé de populations neuronales semblables au PPN.
Des études suggèrent une augmentation des projections de la MLR vers le tronc cérébral après lésion et que les neurones glutamatergiques du CnF sont responsables de l’initiation et de l’accélération de la locomotion. En combinant le traçage rétrograde, la stéréologie et la cinématique, nous mettons en évidence, dans le CnF mais aussi dans le PPN et le LDT contralatésionnels, une augmentation des projections glutamatergiques de la MLR vers la formation réticulée. Étant donné le rôle majeur des neurones glutamatergiques dans la locomotion, leur recrutement pourrait contribuer à la récupération fonctionnelle spontannée observée après lésion médullaire partielle. Une expérience de traçage antérograde nous permettra de confirmer que ces projections glutamatergiques supplémentaires forment bien de nouvelles synapses dans la formation réticulée voire dans la moelle épinière. Ce projet pourrait contribuer à préciser les sites optimaux de stimulation cérébrale profonde de la MLR pour traiter les déficits moteurs causés par les lésions médullaires partielles voire par d’autres pathologies comme la maladie de Parkinson.
Abstract
Spinal cord injuries cause a functional motor deficit of varying importance depending on their location and their severity. After incomplete spinal cord injury, it is possible to notice in animal models and patients a certain functional recovery occurring on a period going from a few weeks to several years. This recovery may occur thanks to an anatomical reorganization of the spinal locomotor circuit and supraspinal locomotor centers. Among these centers is the mesencephalic locomotor region (MLR) which is a functional region able to initiate and modulate locomotion. Its exact anatomical correlates are still a matter of debate but they could include the cuneiform nucleus (CnF), a cluster of glutamatergic neurons, the pedunculopontine nucleus (PPN) that is cholinergic and glutamatergic, the deep mesencephalic nucleus (MRN/DpMe) that is glutamatergic and the laterodorsal tegmentum which is formed by neuronal populations similar to the PPN.
Some studies suggest that there is an increase of projections from the MLR to the brainstem after lesion and that the glutamatergic neurons of the CnF can initiate and accelerate locomotion. Using retrograde tracing, stereological analysis and kinematic, we show, in the CnF but also in the contralesional PPN and LDT, that there is a recruitment of MLR glutamatergic projections to the medullar reticular formation. Considering the major role of glutamatergic neurones in locomotion, this recruitment could contribute to motor functional recovery after incomplete spinal cord injury. An anterograde tracing experiment could then help us to confirm that these “new” projections form synaptic connections in the medullar reticular formation and, maybe, in the spinal cord. This project could contribute to specify the optimal deep brain stimulation sites in the MLR to treat motor deficits caused by incomplete spinal cord injuries and maybe also by other pathologies such as Parkinson’s disease.
Tables des matières
Résumé ... ii
Abstract ...iii
Tables des matières ... iv
Liste des tableaux ... vi
Liste des figures ... viii
Liste des abréviations ... ix
Dédicace ... xii
Remerciements ... xiii
Avant-propos ... xiv
Chapitre 1 : Introduction ... 1
1.1 Principes généraux et neuroanatomie fonctionnelle de la locomotion ... 2
1.1.1 Réseaux locomoteurs spinaux... 5
1.1.2 Afférences sensorielles et proprioceptives ... 6
1.1.3 Contrôle supraspinal de la locomotion ... 7
1.1.3.1 Le cortex moteur ... 10
1.1.3.2 Les ganglions de la base ... 11
1.1.3.3 La formation réticulée médullaire (MRF) ... 11
1.1.3.4 Autres structures importantes pour la locomotion : le système vestibulaire, le noyau rouge et le cervelet ... 13
1.1.3.5 Les centres locomoteurs supraspinaux initiant la locomotion ... 14
1.2 La région locomotrice mésencéphalique (MLR) ... 16
1.2.1 Découverte, caractéristiques et débat anatomique ... 16
1.2.2 Le noyau cunéiforme (CnF) ... 23
1.2.3 Le noyau pédonculopontin (PPN) ... 28
1.2.4 Le noyau réticulaire mésencéphalique (MRN/DpMe) ... 31
1.2.5 Le tegmentum latérodorsal (LDT) ... 32
1.3 Plasticité neuronale et lésions de la moelle épinière ... 34
1.4 Justification de l’hypothèse de recherche et objectifs du mémoire ... 38
Chapitre 2 : Matériel et Méthodes ... 41
2.1 Préparation des groupes expérimentaux pour le traçage anatomique ... 42
2.1.2 Enregistrements cinématiques et lésions médullaires ... 42
2.2 Traçage cellulaire rétrograde avec Fast-Blue ... 44
2.3 Perfusions, sélections des souris analysables et immunohistochimie ... 44
2.4 Observations et analyses stéréologiques des corrélats anatomiques potentiels de la MLR ... 46
2.5 Analyse cinématique ... 47
2.6 Analyses statistiques ... 48
Chapitre 3 : Résultats ... 50
3.1 Traçage cellulaire rétrograde avec Fast-Blue ... 51
3.2 Récupération fonctionnelle de la marche après lésion médullaire ... 55
3.3 Organisation du circuit descendant des noyaux du mésencéphale avant lésion ... 59
3.4 Changements après lésion de la moelle épinière ... 65
Chapitre 4 : Discussion, perspectives et conclusions ... 72
4.1 Discussion ... 73
4.1.1 Organisation anatomique du circuit descendant de la MLR ... 73
4.1.2 Réorganisation du circuit descendant de la MLR après hémi-lésion médullaire ... 75
4.1.3 Implications pour la stimulation cérébrale profonde (SCP) ... 77
4.1.3.1 Potentiel pour le traitement de la Maladie de Parkinson par SCP ... 77
4.1.3.2 Potentiel pour le traitement des lésions médullaires ... 78
4.2 Perspectives et conclusions ... 80
4.2.1 Perspectives : considérations méthodologiques et études complémentaires ... 80
4.2.2 Conclusions ... 84
Bibliographie : ... 86
Liste des tableaux
Tableau 1. Exemples (pour 12 souris SCI) des vitesses maximales de locomotion avant et après hémi-lésion thoracique de la moelle épinière en T10 ... 58 Tableau 2. Nombre moyen de neurones marqués rétrogradement identifiés selon leurs neurotransmetteurs ou non identifiés dans le CnF, le MRN/DpMe, le PPN et le LDT contralatéraux et ipsilatéraux à l’injection de Fast-Blue dans le GRN (Groupe contrôle « Sham ») ... 65 Tableau 3. Nombre moyen de neurones marqués rétrogradement identifiés selon leurs neurotransmetteurs ou non identifiés (UIDs) dans le CnF, le MRN/DpMe, le PPN et le LDT contralatéraux et ipsilatéraux à l’hémi-lésion médullaire thoracique (Groupe médullaire « SCI ») ... 69
Liste des figures
Figure 1. Le cycle locomoteur chez un quadrupède terrestre ... 4
Figure 2. Neuroanatomie du contrôle supraspinal de la locomotion chez les mammifères ... 9
Figure 3. Diagramme expérimental de stimulation électrique du mésencéphale chez le chat décérébré ... 17
Figure 4. Schéma simplifié de la connectivité fonctionnelle de la MLR ... 19
Figure 5. Localisation des corrélats anatomiques potentiels de la MLR chez l’humain et la souris d’après des études fonctionnelles ... 21
Figure 6. Localisation anatomique des corrélats anatomiques potentiels de la MLR d’après le Brain in Stereotaxic Coordinates Atlas ... 23
Figure 7. La connectivité du noyau cunéiforme (CnF) ... 25
Figure 8. Stimulation anatomique de la MLR-PPN chez le chat décérébré ... 27
Figure 9. La connectivité du noyau pédonculopontin (PPN) ... 30
Figure 10. Localisation anatomique du PPN et du LDT chez la souris d’après le Mouse Brain Atlas ... 33
Figure 11. Schémas simplifiés du contrôle de la locomotion en condition normale et post-lésion médullaire chez l’humain ... 36
Figure 12. Recrutement des projections de la MLR vers le tronc cérébral après hémilésion médullaire cervicale en C4... 38
Figure 13. Résumé chronologique des manipulations effectuées pour le traçage cellulaire rétrograde ... 49
Figure 14. Traçage rétrograde dans le GRN et hémi-lésion médullaire thoracique ... 52
Figure 15. Évaluation du degré de sévérité des lésions médullaires chez les souris sélectionnées ... 53
Figure 16. Populations neuronales de la MLR après marquage rétrograde et immunohistochimique ... 55
Figure 17. Récupération fonctionnelle spontanée de la marche après hémi-lésion thoracique de la moelle épinière gauche en T10 ... 57
Figure 18. Récupération limitée de la vitesse maximale de locomotion des souris lésées au fil des semaines ... 59
Figure 19. Représentation de la distribution des populations glutamatergiques, cholinergiques et doubles des corrélats potentiels de la MLR chez les souris contrôles « Sham » ... 63
Figure 20. Quantification stéréologique des neurones de la MLR marqués rétrogradement chez les souris contrôles « Sham » ... 64 Figure 21. Quantification stéréologique des neurones de la MLR marqués rétrogradement chez les souris médullaires « SCI » ... 68 Figure 22. Recrutement de neurones glutamatergiques rétrogade après hémi-lésion thoracique de la moelle épinière en T10 ... 71 Figure 23. La stimulation cérébrale profonde de la MLR améliore la locomotion chez des souris médullaires... 79 Figure 24. Traçage axonal antérograde des projections axonales du CnF et du PPN bilatéraux chez des souris contrôles VGluT2-Cre ... 82 Figure 25. Traçage axonal antérograde et immunohistochimie: Les neurones glutamatergiques du CnF projettent en direction du GRN alpha et ventral (αGRN/GiV) alors que les neurones glutamatergiques du PPN projettent davantage en direction du GRN chez des souris contrôles VGluT2-Cre ... 83
Liste des abréviations
5-HT : Sérotonine
AAV : Adénovirus/Virus Associé à l’ADN (ADN Associated Virus) ACC : Noyau Accumbens
AMD : Amygdale
AP : Coordonnée Antéropostérieur ChAT : Choline Acétyl-Transférase
CLR : Région Locomotrice du Cervelet (Cerebrum Locomotor Region) CnF : Noyau cunéiforme (Cuneiform nucleus)
CPG : Générateur de Patron Central (Central Pattern Generator) CPU : Striatum
D : Coordonnée de Profondeur
SCP : Stimulation Cérébrale Profonde (Deep Brain Stimulation)
DLR : Région Locomotrice Diencéphalique (Diencephalique Locomotor Region) DPGi : Noyau Pagigantocellulaire Dorsal (Dorsal Paragigantocellular Nucleus) DpMe : Noyau Mésencéphalique Profond (Deep Mesencephalic Nucleus)* EMG: Enregistrement ÉlectroMyographique
FB: Fast-Blue
GABA: Acide Gamma-Aminobutyrique (Gamma-Aminobutyric Acid) GP/GPi : Globus Pallidus/Globus Pallidus interne
GP: Globus Pallidus
GRN/Gi: Noyau Gigantocellulaire (Gigantocellular Relicular Nucleus) Hipp : Hippocampe
ID : Neurones Identifiés selon leurs neurotransmetteurs IHC : Immunohistochimie
L : Coordonnée Latéral
LDT : Tegmentum Latérodorsal LF : Membre antérieur gauche LH : Membre postérieur gauche
LPGi : Noyau Paragigantocellulaire Latéral (Lateral Paragigantocellular Nucleus) MLR : Région Locomotrice Mésencéphalique (Mesencephalic Locomotor Region) MRN : Noyau Réticulaire Mésencéphalique (Mesencephalic Reticular Nucleus)* NM : Noyau Magnocellulaire
NMDA : Acide N-Méthyl-D-Aspartique
PAG : Substance Grise PériAqueducale (PeriAqueducal Grey Matter) PFA : Paraformalddéhyde
PPN : Noyau Pédonculopontin (Pedunculopontine Nucleus)** PPR : Région ParaPyramidale (Parapyramidal Region)
PPTg : Noyau Tegmentaire Pédonculopontin (Pedunculopontine Tegmental Nucleus)**
PRF : Formation Réticulée Pontique
REM : « Mouvements rapides des yeux » (Rapid Eye Movements) RF : Membre antérieur droit
RH : Membre postérieur droit RS : RéticuloSpinal
SCI : Lésion de moelle épinière (Spinal Cord Injury)
SLR : Région Locomotrice Sous-thalamique (Subthalamic Locomotor Region) SNc : Substantia Nigra Compacta
SNr : Substancia Nigra Reticulata SR : Diffusion lente (Slow Release)
STN : Noyau Sous-Thalamique
UID : Neurones Non-identifiés selon leurs neurotransmetteurs
VGluT2 : Transporteur Vésiculaire Glutamatergique 2 (Vesicular Glutamatergic Transporter 2)
VP : Pallidum ventral
Dédicace
« Science sans conscience n’est que ruine de l’âme. »
-François Rabelais (1494-1553)
Remerciements
Je souhaite en premier lieu remercier mon directeur de recherche, Frédéric Bretzner,
pour m’avoir accueilli dans son laboratoire qui m’a permis de développer mon autonomie, ma capacité d’adaptation et mon sens critique pour mener à bien mon projet de recherche.
Je remercie aussi tous mes collègues de travail passé et présent, notamment Marie
Roussel, Louise Thiry, Nicolas Josset et Maxime Lemieux pour leur aide et leurs conseils qui m’ont permis de progresser et d’effectuer mon travail plus efficacement. Un grand merci également à tous les stagiaires que j’ai encadrés et côtoyés et dont le travail à énormément contribué à la progression des différents projets du laboratoire incluant le mien. Merci à plusieurs collègues du CRCHUQ comme Martine St-Pierre, Giulia Cisbani et Marie-Michèle Plante pour m’avoir permis d’utiliser le matériel de stéréologie de leurs équipes sans quoi ce projet n’aurait pu être effectué. Je voudrais également remercier Isabelle Bolduc et Mathieu Vallière-St-Amand car il est agréable d’avoir pu travailler avec des techniciens en animalerie aussi professionnels et compréhensifs.
Finalement, merci à ma famille pour son soutien moral et financier ainsi qu’à mes
amis pour m’avoir encouragé lors des périodes difficiles. Vous vous reconnaîtrez si vous décidez un jour de lire ces lignes et sachez que je n’aurais probablement pas pu mener ma maîtrise à son terme sans votre soutien.
Avant-propos
Le Chapitre 1 de ce mémoire est une revue de la littérature ayant mené à la recherche présentée. Il traite des structures neuronales impliquées dans la locomotion dont principalement la région locomotrice mésencéphalique avant de présenter notre hypothèse suggérant qu’une réorganisation anatomique de ses neurones contribue à la récupération fonctionnelle de la locomotion après une lésion partielle de la moelle épinière. Le Chapitre
2 présente le matériel et méthodes en lien avec notre expérience de traçage rétrograde. Les
résultats de cette expérience constituent le Chapitre 3. Finalement, le Chapitre 4 présente les conclusions de cette étude et présente les compléments à lui ajouter afin de la finaliser et de la rendre plus robuste. En raison de la nécessité de ces compléments, cette recherche ne fait pas encore l’objet d’un article publié. J’ai cependant eu l’opportunité de contribuer à un récent article de notre laboratoire (présenté selon son format de publication en Annexe) intitulé « Distinct Contributions of Mesencephalic Locomotor Region Nuclei to Locomotor Control in the Freely Behaving Mouse » et publié dans Current Biology dont les résultats ont notamment appuyé l’hypothèse de ma recherche.
1.1 Principes généraux et neuroanatomie fonctionnelle de la locomotion
La locomotion réfère à la capacité d’un être vivant à se déplacer d’un point de l’espace à un autre. On la retrouve sous différentes formes telles que le rampement, la marche et la course, la nage, le vol et le saut. Cette variété s’explique notamment par la diversité des milieux environnementaux habitables par les êtres vivants. En effet, on retrouve des modes de locomotion terrestres, souterrains, aériens ou encore aquatiques. Les animaux se déplacent dans leur habitat pour de multiples raisons : se nourrir, se reproduire, migrer ou échapper à un danger. Afin de remplir ces différents rôles, la locomotion dépend d’une interaction complexe entre plusieurs systèmes biologiques. Chez les vertébrés, elle dépend principalement des systèmes nerveux et musculosquelettique. Dans le cas des vertébrés terrestres bipèdes et quadripèdes, la locomotion implique une succession de cycles de pas consistant en une phase de balancement (« Swing phase ») et une phase d’appui (« Stance phase »). Chaque phase est délimitée par les contacts et soulèvements du pied par rapport au sol et comprennent des sous-phases de flexion et d’extension musculaires des membres (Figure 1 A). La phase de balancement correspond au moment où le pied est en l’air et implique une sous-phase de flexion (F) et une sous-phase d’extension (E1). La phase d’appui correspond quant à elle au moment où le pied est en
contact avec le sol et implique deux sous-phases d’extension (E2 et E3). L’existence de ces
phases dépend de l’activité des muscles extenseurs et fléchisseurs des membres impliqués dans le mouvement. En observant un enregistrement électromyographique de l’activité musculaire au cours de la marche (Figure 1 B), on remarque dans un premier temps, comme on pourrait s’y attendre, que les muscles fléchisseurs sont principalement actifs au cours de la phase de balancement et que les muscles extenseurs le sont au cours de la phase d’extension. Dans un deuxième temps, on constate que l’activité des muscles extenseurs et fléchisseurs se fait en alternance. La locomotion est donc une question de rythme et d’alternance entre les extenseurs et fléchisseurs et entre les phases d’appui et de balancement, du moins, chez les animaux terrestres à deux ou quatre pattes. Ce phénomène d’alternance rythmique peut donner différents patrons locomoteurs (Figure 1 C) dépendamment du contexte environnemental et des états mentaux de l’animal.
En effet, selon le contexte, les muscles seront activés avec une intensité variable. Leur activation et leur coordination dépendent de motoneurones situés dans les cornes ventrales de la moelle épinière. Ces motoneurones sont eux-mêmes contrôlés par des centres locomoteurs spinaux formés d’un réseau d’interneurones. Il a effectivement été mis en évidence par T. Graham Brown (Graham Brown, 1911) et différentes études subséquentes (Sigvardt et al., 1985; Cazalets et al., 1990; Cowley et Schmidt, 1994; Guertin et Hounsgaard, 1998a; Nishimaru et al., 2000; Whelan et al., 2000) que la moelle épinière peut générer un rythme et un patron locomoteurs. L’implication de ces réseaux d’interneurones spinaux dans la production du rythme locomoteur a mené au concept de générateurs de patron centraux (CPG). Cette théorie proposée par Graham Brown et reprise par Jankowska, Lundberg et collaborateurs (Jankowska et al., 1967; Lungberg, 1981) suggère que chaque membre est contrôlé par un CPG spinal distinct, que chaque CPG est formé de deux groupes d’interneurones en charge respectivement des muscles extenseurs et fléchisseurs et que chacun de ces deux groupes s’inhibent mutuellement en alternance afin de permettre la coordination des extenseurs et fléchisseurs. Cette inhibition réciproque permet même ainsi, en combinant l’activité rythmique de plusieurs CPGs, de coordonner l’action des membres antérieurs et postérieurs (supérieurs ou inférieurs chez l’humain) de chaque côté du corps. On nomme ce modèle « théorie des demi-centres » des CPGs. Cette théorie a par la suite été modifiée en proposant une organisation plus complexe des centres locomoteurs spinaux dans le but de résoudre certaines limitations du modèle initial (McCrea et Rybak, 2008; Pour revue : Rybak et al., 2015). Les mécanismes présentés par ces concepts demeurent théoriques mais l’importance des centres locomoteurs spinaux dans la locomotion est reconnue dans la littérature. En revanche, si la moelle épinière possède la circuiterie nécessaire pour permettre la locomotion, l’information apportée par les afférences sensorielles sont nécessaires afin de la raffiner. De plus, les centres locomoteurs spinaux ne peuvent générer de mouvement volontaire sans signal provenant de la part des centres locomoteurs du cerveau.
Le premier chapitre de ce mémoire présente ainsi les notions de réseaux locomoteurs spinaux et l’importance des afférences sensorielles dans le mouvement et le raffinement de la locomotion. Nous aborderons ensuite la question des centres supraspinaux capables d’initier et contrôler la locomotion pour finalement nous concentrer sur le principal d’entre
eux : la région locomotrice mésencéphalique (MLR). Nous introduirons ainsi le sujet d’intérêt de la recherche présentée dans ce mémoire, c’est-à-dire l’organisation du circuit descendant de la MLR et sa réorganisation anatomique suite à une lésion partielle de la moelle épinière.
Figure 1. Le cycle locomoteur chez un quadrupède terrestre
A. Cycle locomoteur chez un chat présentant l’alternance entre les phases d’appui (« Stance
Phase ») et de balancement (« Swing Phase »). La phase de balancement se décompose en une sous-phase de flexion (F) et une sous-phase d’extension (E1) alors que la phase d’appui
comporte deux sous-phases d’extension (E2 et E3). LH : Membre postérieur gauche; RH :
Membre postérieur droit; LF : Membre antérieur gauche; RF : Membre antérieur droit.
B. Enregistrements électromyographiques (EMG) des muscles extenseurs et fléchisseurs au
cours des phases de la locomotion. On observe que les muscles extenseurs et fléchisseurs sont activés en alternance les uns par rapport aux autres en fonction des phases. Bandes rouges : Phases de balancement; Bandes grises : Phases d’appui.
C. Comparaison de la durée des phases pour chaque membre entre la marche et le trot.
1.1.1 Réseaux locomoteurs spinaux
Comme mentionné précédemment, différentes études ont permis de suggérer que la moelle épinière possède la capacité de générer un patron et un rythme locomoteur (Pour revue : Grillner et Wallén, 1985). Par exemple, des recherches (Sherrington, 1906 ; Graham Brown, 1911) ont démontré que la locomotion peut être générée même après retrait des hémisphères cérébraux. En effet, après décérébration et dépendamment de l’importance de celle-ci, des chats demeurent capables de marcher spontanément ou sur un tapis roulant (Whelan, 1996). De plus, on peut observer chez des chats ayant subis une transection de la moelle épinière un phénomène connu sous le nom de « marche spinale ». En leur procurant un support de poids et une stimulation périnéale, chimique ou électrique, ces chats peuvent marcher de manière involontaire sur un tapis roulant. On peut également observer une adaptation de la vitesse de cette locomotion en fonction de celle du tapis (Barbeau et Rossignol, 1987). La mise en place d’un tapis roulant séparé en deux bandes et dont chacune d’elles fonctionnaient à différentes vitesses a même démontré que chaque côté pouvait s’adapter indépendamment (Forssberg et al. 1980). Ces travaux suggèrent donc que la moelle épinière peut générer la locomotion grâce à un stimulus approprié et l’adapter jusqu’à un certain point.
Les expériences de locomotion fictive utilisant des moelles épinières isolées de rongeurs néonataux (Kudo et Yamata, 1987; Smith et al. 1988; Cazalets et al., 1990; Cowley et Schmidt, 1994; Whelan et al., 2000) constituent un des arguments les plus solides pour mettre en évidence la capacité de la moelle épinière à générer un rythme locomoteur. Elles démontrent qu’en présence des neuromodulateurs appropriés (5-HT, NMDA, acétylcholine), il est possible d’obtenir un patron de décharge neuronal qui permettrait l’activation des muscles s’ils étaient présents. D’où l’une des nominations que l’on donne à ces expériences : « locomotion fictive ». Comme mentionné plus tôt, il a été proposé que cette capacité de la moelle épinière à produire des décharges rythmiques pouvant permettre la locomotion est due à des réseaux d’interneurones spinaux nommés CPGs. Ce serait la stimulation de ces derniers, électriquement ou par un cocktail de drogues approprié, que la moelle épinière peut générer la locomotion même en étant séparée de l’influence du cerveau. Ces centres locomoteurs spinaux seraient principalement localisés
dans la partie lombaire de la moelle épinière, le long des segments L1-L6 (Kjaerulff, 1994; Cina et Hochman 2000). Chez la souris, le CPG locomoteur serait plus précisément situé au niveau des segments spinaux L1-L2 (Nishimura et al. 2000) et il pourrait en être de-même chez l’humain (Dimitrijevic et al. 1998). En résumé, la locomotion peut donc être générée en stimulant le ou les CPGs lombaires de la moelle épinière. Toutefois, il n’en demeure pas moins qu’en condition normale in vivo, la moelle épinière a besoin d’« inputs » de la part des centres locomoteurs supraspinaux ainsi que de l’information fournie par les afférences sensorielles et proprioceptives pour initier et adapter le mouvement à l’environnement.
1.1.2 Afférences sensorielles et proprioceptives
Les afférences périphériques transmettent les informations proprioceptives (la position des membres dans l’espace) et sensorielles cutanées. Elles ne sont pas essentielles à la coordination de base des membres au cours de la locomotion (Graham Brown, 1911; Miller et al. 1975) mais elles permettent de raffiner le mouvement en l’adaptant au contexte environnemental. Les afférences cutanées, les fuseaux musculaires (fibres afférentes IA et IIA) et les organes tendineux de Golgi sont les structures permettant de capter et transmettre l’information sensorielle nécessaire à cette fin.
Les afférences cutanées transportent l’information relative aux sensations thermiques, mécaniques et douloureuses. Différentes études mettent en évidence leur importance dans l’adaptation du mouvement à l’environnement. Par exemple, d’après les recherches d’Eccles et Sherrington (Ecceles et Sherrington, 1930), elles seraient responsables du réflexe spinal de flexion. Il a aussi été suggéré qu’elles contribuent au rétablissement de l’équilibre pour éviter une chute après contact avec un obstacle (Zehr et al. 1997). De plus, la perte des afférences cutanées chez les chats perturbe la stabilité de leur patron de marche et leur habileté à marcher sur une échelle (Bouyer et Rossignol, 2003) mais sans les priver pour autant de leur capacité à marcher de manière générale. Les fuseaux musculaires (Ia et IIa) et les organes tendineux de Golgi détectent quant à eux le degré de contractions des muscles. La perte de cette information entraîne une locomotion anormale et rend le déplacement sur une échelle déficient (Takeoka et al., 2014). Ces afférences sensorielles contribuent en effet à la bonne coordination des phases
de la locomotion. Par exemple, la détection de l’étirement des muscles fléchisseurs à la fin de la phase d’appui permet de signaler que cette dernière est terminée et que la phase de balancement accompagnée par la contraction des fléchisseurs peut prendre place (Hiebert et Pearson. 1999). Il aussi été mis en évidence que ces afférences proprioceptives contribuent aux actions musculaires synergiques. (Conway et al., 1987; McCrea et al., 1995). C’est-à-dire qu’elles facilitent la coordination entre différents muscles extenseurs et fléchisseurs participant à un même mouvement.
La moelle épinière peut produire un rythme et un patron locomoteur qui est ainsi raffiné par ces afférences sensorielles et proprioceptives améliorant ainsi la coordination des activités musculaires au cours de la locomotion et adaptant cette dernière en fonction de l’environnement. Cependant, un contrôle par les centres supraspinaux est nécessaire afin d’initier le mouvement et le moduler, entre autres à partir des informations environnementales captées par les afférences sensorielles et proprioceptives. Ce rôle crucial des centres supraspinaux du cerveau fait ainsi l’objet de la section suivante.
1.1.3 Contrôle supraspinal de la locomotion
Le contrôle supraspinal de la locomotion dépend de différentes structures. On retrouve parmi les plus essentielles le cortex moteur, les ganglions de la base et la formation réticulée médullaire (MRF). Après avoir discuté de ces régions, nous traiterons des centres locomoteurs pouvant initier la locomotion : la région locomotrice diencéphalique (DLR ou SLR), la région locomotrice du cervelet (CLR) et la région locomotrice mésencéphalique (MLR). Cette dernière étant notre principale région d’intérêt. La Figure 2 présente la connectivité des différentes structures impliquées dans le contrôle supraspinal de la locomotion chez les mammifères. Le cortex moteur reçoit des afférences (ou « inputs ») de la part des cortex visuel et pariétal et projette vers plusieurs structures des ganglions de la base (putamen et noyau caudé (striatum), noyau sous-thalamique), le noyau pédonculopontin et la MRF. Les ganglions de la base (substantia nigra, striatum, globus pallidus et noyau sous-thalamique) communiquent entre eux et aussi indirectement avec le cortex moteur par l’intermédiaire du thalamus. Ils projettent également vers le noyau cunéiforme et le noyau pédonculopontin. Le cortex moteur et les ganglions de la base
constituent ainsi le système de contrôle supraspinal dorsal de la locomotion (proposé comme système de « contrôle locomoteur cognitif » par Takakusaki, 2017) impliqué dans l’activité motrice volontaire. On retrouve aussi le système de contrôle suprapinal ventral de la locomotion (proposé comme système de « contrôle moteur émotionnel » par Takakusaki, 2017) impliquant le noyau accumbens et le système limbique (hippocampe et amygdale) (Pulvirenti et al., 1991; Johnson et al., 1996; Schaub et al., 1996; Tran et al., 2005). Ces structures communiquent avec les noyaux cunéiforme et pédonculopontin par l’intermédiaire de la substantia nigra et de la SLR. Le noyau pédonculopontin projette d’ailleurs vers l’aire tegmentale ventrale (VTA) qui envoie des projections dopaminergiques vers l’hippocampe (Hipp), le noyau accumbens (ACC) et l’amygdale (AMD) et pourrait être impliquée dans le système de récompense lié aux activités motrices. Finalement, la MRF reçoit des projections de la part du noyau cunéiforme, du noyau pédonculopontin, de la possible CLR et projette vers la moelle épinière par l’intermédiaire de la voie réticulospinale de la moelle épinière.
Figure 2. Neuroanatomie du contrôle supraspinal de la locomotion chez les mammifères
A. Système dorsal du contrôle (« cognitif ») de la locomotion : Le cortex moteur (Motor
CTX) intègre les informations apportées par les cortex pariétal (Parietal CTX) et visuel (Visual CTX). Il projette vers le striatum (CPU), le noyau sous-thalamique (STN; voie hyperdirecte), la MLR (CnF et PPN), la formation réticulée (Pontique : PRF, Médullaire noyau gigantocellulaire de la MRF : NRGc, Médullaire noyau magnocellulaire de la MRF : NRMc) et la moelle épinière. Les ganglions de la base (CPU, globus pallidus interne: GPi, la substancia nigra reticulata : SNr et le STN) sont interconnectés entre eux et contrôlent (GABA) l’activité de la MLR. La MLR projette vers la substancia nigra compacta (SNc) et la formation réticulée. La SNc envoie des projections dopaminergiques vers le striatum. La région locomotrice du cervelet (CLR) projette vers la MLR et la formation réticulée. La moelle épinière envoie des informations sensorielles à la MRF et au cervelet et ses centres
locomoteurs (CPGs) sont activés pas les centres supraspinaux par l’intermédiaire de la MRF. Les CPGs activent les muscles extenseurs et fléchisseurs par l’intermédiaires des motoneurones. La locomotion peut être initiée et contrôlée par des contextes environnementaux et par la prise de décisions. B. Système ventral du contrôle (« émotionnel ») de la locomotion : Le noyau accumbens (ACC) projette vers la SNr et le pallidum ventral (VP) qui contrôlent (GABA) l’activation de la MLR. La MLR projette vers l’aire ventrale tegmentaire (VTA) qui elle-même projette vers l’hippocampe (Hipp), le ACC et l’amygdale (AMD). L’Hipp et l’AMD peuvent activer la SLR qui projette vers la MLR et la formation réticulée. La locomotion peut être initiée et contrôlée par des contextes émotionnels (ex : Peur causant la fuite). (Adaptée de Takakusaki, 2017 d’après Snijders et al., 2016)
1.1.3.1 Le cortex moteur
Nous avons abordé plus tôt le fait que la moelle épinière possède déjà la circuiterie nécessaire afin de générer la locomotion. Cette dernière peut en effet être générée même après décortication partielle ou complète, c’est-à-dire, en sectionnant les connexions entre le cortex et les structures du mésencéphale et de la moelle épinière (Eidelberg et Yu, 1981). On déduit ainsi que l’implication du cortex moteur n’est pas une condition sinequanone à la génération du mouvement. En revanche, la littérature scientifique documente largement l’importance du cortex dans le contrôle de la locomotion volontaire et adaptée à l’environnement. Les projections du cortex visuel et pariétal vers le cortex moteur (Figure
2) nous indiquent que ce dernier intègre les informations visuelles et somatosensorielles de
l’environnement. Tout comme les afférences sensorielles périphériques, le cortex moteur aurait donc pour rôle d’adapter le mouvement en fonction du milieu environnemental. Par exemple, des études (Drew et al., 1996; DiGiovanna et al., 2016) démontrent que l’activité corticale est corrélée à l’adaptation de la marche en présence d’un obstacle détecté visuellement. De plus, les neurones pyramidaux du cortex déchargent de manière synchrone avec les pas au cours de la marche (Armstrong et Drew, 1984) et il a été mis en évidence que la stimulation du cortex peut réinitialiser le rythme locomoteur (Orlovsky, 1972; Bretzner et Drew, 2005) et modifier la trajectoire des membres au cours de la locomotion (Armstrong et Drew, 1985). Cela confirme que le cortex exerce bien un contrôle sur le mouvement. Il est ainsi probable que le cortex modifie les différents paramètres de la locomotion à partir des informations somatosensorielles qui lui sont communiquées par rapport à différents stimuli.
1.1.3.2 Les ganglions de la base
Les ganglions de la base jouent un rôle essentiel dans le contrôle volontaire de la locomotion et la prise de décision. Comme mentionné précédemment, les ganglions de la base sont un ensemble de structures formé du striatum (noyau caudé et putamen), du globus pallidus (GP), de la substantia nigra (SN; SNr : pars reticulata; SNc : pars compacta) et du noyau sous-thalamique (STN). Le striatum intègre l’information du cortex moteur et du thalamus (Doig et al., 2010) et communiquent avec le GP interne (GPi) et la SNr qui envoient des signaux inhibiteurs (GABAergiques) vers le thalamus et les structures des centres locomoteurs du mésencéphale (Hikosaka, 2007) comme les noyaux cunéiforme et pédonculopontin. Ainsi, selon le concept du « système de contrôle moteur dorsal » (Figure
2), la locomotion peut être déclenchée par une inhibition du GPi et de la SNr par le striatum
ce qui a pour conséquence de faire cesser leur effet inhibiteur sur les centres locomoteurs (Freeze et al., 2013). Dans le cadre du « système de contrôle moteur ventral », le pallidum ventral (VP) et le SNr inhibent tout deux les centres locomoteurs du mésencéphale et cette inhibition peut être levée par le noyau accumbens (ACC) par l’intermédiaire des projections GABAergiques qu’il envoie vers le VP et le SNr.
1.1.3.3 La formation réticulée médullaire (MRF)
La formation réticulée médullaire (MRF à la Figure 2) est constituée d’un réseau de noyaux du tronc cérébral. On retrouve essentiellement parmi ces derniers la formation réticulée ventrale (MdV), le noyau parvocellulaire, le noyau gigantocellulaire (GRN ou Gi) et sa partie alpha et ventrale (GRN alpha ou GiA/V; aussi appelé noyau magnocellulaire (NM)) chez le chat), les noyaux paragigantocellulaire dorsal (DPGi) et latéral (LPGi), le noyau central, le noyau paramédian, les noyaux du raphé qui sont repartis dans le mésencéphale, le pont et la medulla oblongata. La MRF s’étend ainsi de la partie rostrale du mésencéphale à la partie caudale de la medulla oblongata et il a été mis en évidence que ses noyaux projettent bilatéralement, avec dominance ipsilatérale (Liang et al. 2016), vers la moelle épinière par l’intermédiaire des tractus latéraux et médians de la voie réticulospinale. En plus de son rôle dans le contrôle moteur, la MRF est impliquée dans une large gamme d’autres fonctions. Par exemple, les noyaux de la medulla oblongata
(communément référée comme « bulbe rachidien » dans ce contexte), sont impliqués dans la régulation des fonctions cardiovasculaire (Heidel et al., 2002) et respiratoire (Onimaru et al., 1995). La MRF serait aussi impliquée dans les états de vigilance (Kinomura et al. 1996; Skinner et al. 2004) dont notamment dans le contrôle du tonus musculaire au cours du sommeil paradoxal (REM : « Rapid Eye Movement ») (Takakusaki et al. 2001).
La MRF reçoit des « inputs » de la part des centres locomoteurs supraspinaux comme la possible région locomotrice du cervelet (Mori et al., 1998) et la région locomotrice mésencéphalique (Noga et al., 1988; Noga et al., 2003, Pour revue : Jordan et al., 2008), de l’hypothalamus et du STN (Sinnamon et Stopford, 1987). Ces connexions associées aux projections qu’elle envoie vers les interneuones et motoneurones de la moelle épinière lui permettent d’être un relai des commandes motrices supraspinales. Il a été mis en évidence qu’elle peut activer les CPGs spinaux (Grillner, 1981) et assurer le maintien du tonus musculaire (Mori, 1987; Hägglund et al., 2010). Les populations neuronales excitatrices de la MRF sont principalement glutamatergiques et sérotoninergiques (Hägglund et al., 2010; Cabaj et al., 2017) deux neurotransmetteurs importants pour les fonctions motrices. On y retrouve cependant aussi des neurones monoaminergiques (ex : noradrénaline), cholinergiques (Holmes et al., 1994) ainsi que des neurones inhibiteurs GABAergiques qui semblent projetter jusque dans la partie lombaire de la moelle épinière (Valencia Garcia et al., 2018).
La stimulation optogénétique des neurones glutamatergiques de la MRF projettant dans la moelle épinière permet l’activation des CPGs (Hägglund et al., 2010) et il semble que leur activité soit augmentée après locomotion sur un tapis roulant (Bretzner et Brownstone, 2013). Il a aussi été mis en évidance que l’activité des populations glutamatergiques du LPGi est essentielle au contrôle et au maintien de la locomotion à haute vitesse (Capelli et al., 2017). Les neurones glutamatergiques de la MRF qui projettent vers la moelle épinière peuvent être identifiés par l’expression des facteurs de transcription Lhx3 et Chx10 (Bretzner et Brownstone, 2013). Les neurones glutamatergiques exprimant ces facteurs sont actifs au cours de la locomotion, reçoivent des projections de la part de la région locomotrice mésencéphalique et ont été mis en évidence dans le GRN, le GRN alpha
(ou le NM) et le MdV. Ces recherches nous suggèrent que les neurones glutamatergiques de la MRF favorisent l’initiation de la locomotion et son accélération. En revanche, la stimulation des neurones glutamatergiques V2a (qui expriment aussi Lh3x et Chx10) semble provoquer l’arrêt de la locomotion (Bouvier et al. 2015). Ainsi les neurones glutamatergiques de la MRF seraient bien impliqués dans le contrôle moteur mais n’auraient pas forcément pour effet d’augmenter le rythme locomoteur.
Les neurones sérotoninergiques de la MRF, comme ceux des noyaux du raphé et plus généralement de la medulla oblongata, projettent également vers la moelle épinière (Bowker et Abbott, 1990). Il a aussi été démontré que la stimulation de la région parapyramidale (PPR) de la MRF, qui est essentiellement sérotoninergique, peut induire un patron de décharge caractéristique d’un rythme locomoteur chez des rats néonataux (Liu et Jordan, 2005) et est active au cours de la locomotion sur tapis roulant. La PPR peut activer les CPGs spinaux par l’intermédiaire des récepteurs 5-HT (7) et 5-HT (2A) et l’inhibition ou l’absence de ces récepteurs ont des effets délétères allant d’une perte de la coordination entre les fléchisseurs et extenseurs à un blocage de la locomotion (Pour revue : Jordan et al., 2008). Tout comme le glutamate cependant, l’effet de la sérotonine n’est pas forcément promoteur de la locomotion. L’utilisation d’inhibiteurs et d’agonistes de la sérotonine donnent effectivement des résultats contradictoires dépendamment des récepteurs à sérotonine spinaux présents (Dunbar et al., 2010). Ainsi, l’effet des projections sérotoninergiques de la MRF vers la moelle épinière varie en fonction des récepteurs cibles. La MRF est ainsi une région composée d’un complexe réseau de noyaux et impliquée dans une large gamme de fonctions dont plusieurs aspects restent toutefois à élucider. Son rôle dans la locomotion et, particulièrement, de relais des commandes motrices sont ce qui nous intéresse chez la MRF dans le cadre de notre projet.
1.1.3.4 Autres structures importantes pour la locomotion : le système vestibulaire, le noyau rouge et le cervelet
Avant de traiter des centres locomoteurs pouvant initier la locomotion, mentionnons trois autres structures qui participent aussi au contrôle moteur supraspinal de la locomotion. La première d’entre elles est le système vestibulaire qui est en fait composé de quatre
noyaux : les noyaux vestibulaires médian, latéral, inférieur et supérieur. Leur principale fonction est le maintien de l’équilibre et de la posture ainsi que la perception de son propre déplacement. D’après les études effectuées chez la souris (Liang et al., 2014) le système vestibulaire communique avec la moelle épinière par la voie vestibulospinale. Le tractus vestibulospinal n’atteint toutefois pas les motoneurones directement puisqu’il finit dans les parties médiales de la matière grise. Les noyaux vestibulaires projettent également vers le cervelet et le thalamus et vont ainsi interagir avec ces structures en plus de la moelle épinière afin d’assurer leurs fonctions de maintien de l’équilibre et de la posture.
La seconde structure est le noyau rouge qu’on retrouve bilatéralement dans le mésencéphale rostral et qui projette vers la voie rubrospinale de la moelle épinière. Il serait impliqué dans le contrôle des membres au cours de la locomotion. D’après la littérature, l’importance du noyau rouge et de la voie rubrospinale a cependant diminué chez les vertébrés plus complexes. Chez l’humain par exemple, le noyau rouge servirait de relais entre cortex moteur et le cervelet. En revanche, la voie rubrospinale projette jusqu’aux membres antérieurs et postérieurs chez la souris et exerce un contrôle sur les motoneurones impliqués (Liang et al., 2012a). L’activité du noyau rouge a aussi été corrélée à des tâches complexes comme la préhension d’objets chez le chat (Horn et al., 2002). Ainsi, le noyau rouge aurait un rôle important dans le contrôle et l’ajustement de la locomotion chez certains mammifères.
La troisième région finalement, est le cervelet qui est situé sur la partie dorsale du tronc cérébral. Celui-ci projette principalement vers le système vestibulaire, le noyau rouge et la MRF. Il est impliqué dans la coordination des mouvements et en cas de lésion, une perte de cette dite coordination est effectivement observée (De Zeeuw et al., 2011). Le cervelet pourrait constituer selon certaines études un centre locomoteur pouvant initier la locomotion nommé région locomotrice du cervelet ou CLR. Cette dernière sera d’ailleurs présentée dans la partie suivante.
1.1.3.5 Les centres locomoteurs supraspinaux initiant la locomotion
Il existe trois régions supraspinales pouvant initier la locomotion. La première est la région locomotrice diencéphalique (DLR) qui correspondrait chez la lamproie, où elle a été identifiée pour la première fois, à la partie ventrale du thalamus. En effet, il a alors été
montré que la stimulation de cette dernière permet l’obtention d’un patron de décharge rythmique déclenchant son tour une activité rythmique dans la partie ventrale de la moelle épinière ou elle projette (El Manira et al., 1997). Cette activité neuronale a été associée à la génération d’un rythme locomoteur et une étude a plus tard réussi à générer la nage chez la lamproie en activant cette région (Ménard et Grillner. 2008). Chez les mammifères, la DLR correspondrait à la région locomotrice sous-thalamique (SLR), et potentiellement à l’hypothalamus latéral, d’après des études effectuées chez le chat (Grossman, 1958) et le rat (Milner et Mogenson, 1988; Sinnamon, 1993). Une étude de stimulation de la SLR chez le chat rapporte l’obtention d’une marche lente et accompagnée de mouvements de la tête indiquant que l’animal scrutait les environs. La DLR ou SLR pourrait donc peut-être être impliquée dans la marche exploratoire. Comme mentionné précédemment (Figure 2), cette région reçoit des projections de la part du système limbique et projette elle-même vers la formation réticulée et de potentiels corrélats anatomiques de la région locomotrice mésencéphalique. S’il existe donc de solides évidences sur la capacité de la DLR ou SLR à générer la locomotion, son rôle comportemental et les mécanismes fonctionnels impliqués ne sont pas encore tout à fait élucidés.
La seconde région locomotrice rapportée dans la littérature est la région locomotrice du cervelet ou CLR. Celle-ci a tout d’abord été identifiée en stimulant à répétition la partie médiale de la matière blanche du cervelet (Asanome et al., 1998). Ces stimuli ont eu pour effet d’augmenter le tonus musculaire et une seconde étude utilisant des stimulations semblables de cette région (Mori et al., 1999) rapporte l’obtention d’une locomotion sur tapis roulant. Le site du cervelet permettant cette locomotion a été identifié comme étant des fibres appartenant aux noyaux fastigiaux et l’initiation motrice obtenue s’est traduite par une activation synaptique à courte latence des fibres réticulospinales et vestibulospinales de la moelle épinière. La CLR, comme indiquée à la Figure 2, projette vers la région locomotrice mésencéphalique et la MRF ce qui appuie son rôle potentiel dans l’initiation de la locomotion. Elle aurait également été identifiée chez l’humain (Jahn et al., 2008) et pourrait être associée à la « paralysie de la marche » (« freezing of gait ») dans les cas de la maladie de Parkinson d’après une étude récente (Fasano et al., 2017). Néanmoins, il convient de préciser que la CLR requiert davantage d’études. Par exemple, elle n’a
toujours pas été stimulée chez des animaux éveillés et libres de leur mouvement ce qui contribuerait grandement à déterminer sa pertinence dans l’initiation de la locomotion.
Finalement, la dernière région locomotrice est la région locomotrice mésencéphalique (MLR). Elle reçoit des projections de la part de la CLR et de la DLR/SLR suggérant que les trois régions locomotrices communiquent entre elles. La MLR projette vers le pont, le locus coeruleus et les noyaux gigantocellulaire et magnocellulaire de la MRF (Shefchyk et al., 1984; Figure 2). La MLR est cependant une région essentiellement définie fonctionnellement car son anatomie demeure matière à débat aujourd’hui. La MLR étant notre région d’intérêt, la section suivante lui sera consacrée afin de détailler la physiologie et l’anatomie incertaine de ce centre locomoteur.
1.2 La région locomotrice mésencéphalique (MLR)
1.2.1 Découverte, caractéristiques et débat anatomique
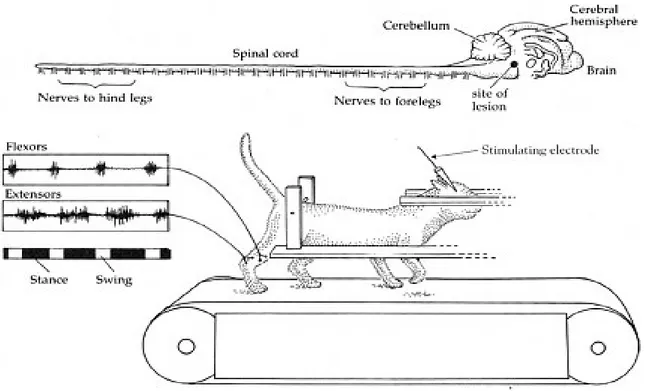
Comme nous l’avons mentionné plus tôt, la région locomotrice mésencéphalique, ou MLR, est un centre supraspinal situé dans le mésencéphale. Elle a été mise en évidence pour la première fois en 1966 par Shik et Orlovsky (Shik et al., 1966) dans le cadre d’une expérience de stimulation de mésencéphale chez le chat décérébré (Figure 3). Le chat était décérébré au niveau pré-colliculaire et post-mamillaire et son poids était soutenu afin de permettre un mouvement des pattes. Les chercheurs ont ainsi découvert qu’en stimulant une région spécifique du mésencéphale, qui deviendra par la suite la MLR, il est possible d’initier et moduler la locomotion. De plus, en augmentant l’intensité des stimulations, ils ont pu obtenir une augmentation de la vitesse de locomotion de l’animal. Cela pouvait alors s’observer par la transition du patron locomoteur, soit d’un patron de marche à un patron de course/trot/galop. Il a ainsi été démontré que la MLR est capable d’initier la locomotion et d’augmenter le rythme locomoteur selon son degré d’activation. Par la suite, des études ont mis en évidence que la MLR est une région largement conservée à travers la phylogénie des vertébrés. On la retrouve en effet chez différents animaux allant de la lamproie (Sirota et al., 2000) à l’humain en passant par la salamandre (Cabelguen et al. 2003), les oiseaux
(Sholomenko et al. 1991), le rat (Garcia-Rill et al. 1987), la souris (Lee et al. 2014) et les singes (Eidelberg et al., 1981; Karachi et al. 2010).
Figure 3. Diagramme expérimental de stimulation électrique du mésencéphale chez le chat décérébré
Après sectionnement des connexions entre le mésencéphale et les structures supérieures, Shik et collaborateurs ont stimulé le mésencéphale et ont mis en évidence qu’une de ses régions pouvait initier la locomotion et augmenter le rythme locomoteur. Cette région deviendra par la suite la région locomotrice mésencéphalique, ou MLR. (Shik et al., 1966).
Il a d’ailleurs été démontré qu’une activation électrique (Skinner et Garcia-Rill, 1984; Bernau et al., 1991; Musienko et al., 2008) ou chimique (Marlinsky et Voitenko, 1991; Sirota et al., 2000) unilatérale de la MLR permet d’obtenir des réponses locomotrices symétriques et bilatérales (Shik et Orlovsky, 1976). Il est aussi désormais connu que la MLR projette vers la MRF comme nous l’avons mentionné plus tôt. En effet, c’est par l’intermédiaire de ses projections vers la MRF et la voie réticulospinale de la moelle épinière que la MLR peut activer les centres locomoteurs spinaux et ainsi initier la locomotion (Orlovsky, 1970; Steeves et Jordan, 1984; Garcia-Rill et Skinner, 1987 a, b). Une étude (Noga et al., 2003) a d’ailleurs montré les effets d’une inactivation, en
l’occurrence un refroidissement, de la MRF et du funicule ventral de la voie réticulospinale sur la locomotion. Le refroidissement bilatéral de la MRF a résulté en une abolition bilatérale de la locomotion et le refroidissement unilatéral du funicule ventral a bloqué la locomotion du côté ipsilatéral et l’a significativement réduite en contralatéral. Ceci appuie donc la composante bilatérale et symétrique de la MLR d’un point de vue fonctionnel et anatomique en ce qui concerne ses projections descendantes. Les Figure 4 et Figure 2 résument la connectivité fonctionnelle de la MLR. On observe que la MLR reçoit des afférences de la part des ganglions de la base et de structures du diencéphale comme la possible DLR/SLR. En plus des projections GABAergiques des ganglions de la base, il a récemment été mis en évidence chez la lamproie, la salamandre et le rat (Ryczko et al., 2016) que l’activité de la MLR serait aussi régulée directement et indirectement par des neurones dopaminergiques méso-diencéphaliques (Roseberry et al., 2016).
Figure 4. Schéma simplifié de la connectivité fonctionnelle de la MLR
L’activité de la MLR est régulée par les « inputs » GABAergiques et dopaminergiques ganglions de la base et des cellules dopaminergiques du méso-diencéphale. Elle projette vers la voie réticulospinale de la moelle épinière par l’intermédiaire de la MRF pour activer les CPGs spinaux et ainsi générer la locomotion. Les cellules dopaminergiques correspondent au tubercule postérieur chez les vertébrés moins complexes et à la SNc chez les mammifères. (Adaptée de Ryczko et Dubuc, 2017 d’après Le Ray et al., 2011)
En résumé, la MLR est une région fonctionnelle pouvant initier et accélérer la locomotion en fonction de son degré d’activation. Elle envoie des projections vers la formation réticulée qui s’étendent ensuite dans la voie réticulospinale de la moelle épinière
afin d’en activer les centres locomoteurs et ainsi générer la locomotion. Elle est également régulée par des projections neuronales dopaminergiques et GABAergiques en provenance du diencéphale et des ganglions de la base. Cependant, même si la connectivité de la MLR est mieux connue aujourd’hui et qu’elle est bien définie d’un point vue fonctionnelle, l’identité réelle de ses corrélats anatomiques est encore incertaine. D’après les travaux d’Edgar Garcia-Rill et collaborateurs (Garcia-Rill et al., 1987) chez le rat, les sites préférentiels de la MLR pour initier la locomotion correspondent au noyau pédonculopontin (PPN) et à ses cellules cholinergiques proximales. Ces études soutiennent que la stimulation du PPN permet d’obtenir une initiation de la locomotion en plus d’une augmentation du tonus postural et de la vitesse de marche. D’après ces résultats, il semble que le PPN corresponde à la définition fonctionnelle de la MLR. En revanche, ces résultats ont plus tard été contredis par Kaoru Takakusaki et collaborateurs (Takakusaki et al., 2003a; Takakusaki et al., 2005). Ceux-ci ne relèvent pas d’initiation de la marche par stimulation du PPN et rapportent plutôt une baisse du tonus musculaire. D’après leurs travaux, le noyau cunéiforme (CnF) serait le site préférentiel pour initier la locomotion alors que PPN contrôlerait plutôt le tonus musculaire et aurait même pour effet de diminuer le rythme locomoteur. Il est donc possible que le corrélat anatomique de la MLR corresponde au CnF plutôt qu’au PPN. Il est cependant aussi possible que la MLR corresponde en fait à plus d’un noyau. La Figure 5 A présente la carte des sites stimulés chez la souris au cours d’une étude de stimulation de la MLR faite par Roseberry et collaborateurs (Roseberry et al., 2016). Les sites marqués d’un point vert représentent les sites ayant initié la locomotion dans leur étude et les croix rouges représentent les sites stimulés mais n’ayant pas évoqué la locomotion. Ces sites se chevauchent principalement entre le CnF, le PPN (aussi nommé PPTg) et le noyau réticulaire mésencéphalique ou noyau mésencéphalique profond (MRN ou DpMe). À la Figure 5 B, on observe les résultats d’une étude d’imagerie fonctionnelle effectuée chez l’humain (Karachi et al., 2012). Ceux-ci indiquent quelles régions sont actives au cours d’une locomotion fictive (imaginée par les sujets). Il apparaît que de s’imaginer en train de marcher puisse être suffisant pour activer la MLR. Les sites activés dans ce contexte correspondent également au CnF et au PPN. Ainsi, la littérature considère généralement que la MLR est formée du CnF et du PPN. Nous discuterons à présent de ces noyaux et nous traiterons aussi du MRN
qui est un noyau proximal aux deux premiers et pourrait être un autre corrélat anatomique potentiel. Finalement nous aborderons aussi la question d’un dernier corrélat éventuel : le tegmentum latérodorsal (LDT).
Figure 5. Localisation des corrélats anatomiques potentiels de la MLR chez l’humain et la souris d’après des études fonctionnelles
A. Localisation des sites de stimulation électriques ayant permis d’initier (points verts) ou
non (croix rouges) la locomotion chez la souris. Les sites favorables à l’initiation de la marche sont retrouvés dans le CnF (Cun), le PPN (PPTg) et le MRN. IC : Collicule inférieur; RRF : Champ rétrorubral; RR : Noyau rétrorubral; LL : Lémnisque latéral ; PB : Noyau parabrachial. (D’après Roseberry et al., 2016) B. Les contrastes sous-corticaux (Fast IG vs Normal IG en orange et Fast IOM vs Normal IOM en bleu) sont superposés sur des séries de sections frontales, axiales et sagittales (2 mm) de la MLR. Les sites activés par la locomotion fictives correspondent au CnF et au PPN. IG : Imagerie de la marche
(« Imagery of gait »), IOM : Imagerie d’objet en mouvement (« Imagery of object moving) (D’après Karachi et al. 2012).
A
Figure 6. Localisation anatomique des corrélats anatomiques potentiels de la MLR d’après le Brain in Stereotaxic Coordinates Atlas
Coupes coronales du mésencéphale et du tronc cérébrales montrant la localisation du (A.) CnF (rouge), du MRN/DPMe (bleu) et du PPN (vert) et (B.) LDT (jaune). (Figure adaptée du Brain in Stereotaxic Coordinates Atlas ; Seconde Édition, Paxinos et Franklin, 2004).
1.2.2 Le noyau cunéiforme (CnF)
Le noyau cunéiforme ou CnF, est situé bilatéralement dans le mésencéphale, plus exactement, dans la partie dorsale du tegmentum mésencéphalique. Il s’étend de la partie caudale du collicule inférieur à la partie caudale du collicule supérieur. Le CnF est ainsi bordé dorsalement par les deux collicules et dorso-médialement par la substance grise périaqueducale (PAG). Sa taille augmente progressivement dans le mésencéphale de la partie caudale à la partie rostrale. On le retrouve latéralement bordé par le lemnisque latéral et ventralement par le PPN et le MRN selon la progression des sections observées le long de l’axe rostrocaudal (voir Figure 6 A). Chez l’humain (Olszewski et Baxter, 1954) et le chat notamment (Taber, 1961), une structure nommée noyau sous-cunéiforme a été identifiée est serait située ventralement par rapport au cunéiforme et dorsalement par rapport au PPN. Le noyau sous-cunéiforme se distingue principalement par ses caractéristiques cytoarchitecturales mais il n’y a en revanche pas de distinction anatomique claire entre la partie ventrale du CnF et le noyau sous-cunéiforme ou la partie dorsale du PPN. Cette incertitude anatomique est un élément qui porte à confusion lors des études de stimulation du CnF et du PPN et contribue ainsi au débat anatomique entourant les corrélats possibles de la MLR.
Les phénotypes de neurotransmetteurs des projections du CnF vers d’autres régions ne sont pas encore complètement caractérisés mais les principaux neurotransmetteurs retrouvés dans ce noyau sont connus. Les neurones glutamatergiques constituent la population dominante dans le CnF (Heise et Mitrofanis, 2006). La seconde population majeure du CnF est GABAergique (Appell et Behan, 1990; Ford et al., 1995) et, plus rarement, on peut aussi retrouver des neurones cholinergiques dans sa partie ventrale (Spann et Grofava, 1992) qui correspond d’ailleurs à la zone d’incertitude impliquant le noyau sous-cunéiforme et la partie dorsale du PPN. Une étude (Pose et al., 2000) rapporte
qu’il est aussi possible de retrouver une faible proportion de neurones exprimant l’oxydase nitrique synthase et une autre recherche chez le rat suggère que le CnF enverrait des projections neurotensinergiques et sérotoninergiques vers le noyau du raphé magnus (Beitz, 1982).
Les projections neuronales ascendantes du CnF sont quant à elles peu nombreuses (non représentées sur la Figure 2), mais elles sont dirigées vers plusieurs structures comme le collicule supérieur, la PAG, l’hypothalamus et la VTA. Notons également que ces connexions sont réciproques pour la PAG (Han et al., 2017) et le collicule supérieur (Zingg et al., 2017). Le CnF est ainsi liée à des régions impliquées dans la réponse au stress (Korte et al., 1992). En ce qui a trait aux projections descendantes, nous avons évoqué plus tôt en présentant notamment la Figure 2, que le CnF projette vers la MRF (Castiglioni et al., 1978), le locus coeruleus et les noyaux du raphé. Ces projections sont particulièrement importantes dans le GRN (Korte et al., 1992), le LPGi (Xiang et al., 2013) et le noyau magnocellulaire (Abols et Basbaum, 1981) de la MRF. Il a également été suggéré (Castiglioni et al., 1978; Liang et al., 2011) que le CnF pourrait aussi projeter directement vers la moelle épinière. Le CnF partage une connectivité similaire à celle proposée pour la MLR par des projections descendantes vers la MRF et par les projections qu’il reçoit de la part des ganglions de la base (Takakusaki et al., 2003a) et, possiblement, de structures dopaminergiques du diencéphale (Rolland et al., 2009; Ryczko et al., 2016). La connectivité du CnF est résumée à la Figure 7.
Figure 7. La connectivité du noyau cunéiforme (CnF)
Le CnF est réciproquement connecté à la substance grise périaqueducale (PAG) et les collicules supérieures (CS). Il reçoit des projections de la part de l’hypothalamus (HYP), de la substancia nigra reticulata (SNr), de l’amygdale (AMD) et possiblement aussi de la SLR. Il projette vers l’aire tegmentale ventrale (VTA), différentes structures de la formation réticulée (MRF : noyau gigantocellulaire (GRN); Noyau Magnocellulaire (NM); RM : Raphé Magus; Noyau paragigantocellulaire latéral (LPGi)) et pourrait projeter aussi directement vers la moelle épinière (« Spinal cord »).
Comme nous avons pu constater, le CnF est connecté à différentes structures liées au stress. L’une des composantes physiologiques associées au stress est l’augmentation de l’activité cardiorespiratoire. Chez le rat, il a été démontré que l’activation chimique (glutamate) (Shafei et Nasimi, 2011) ou électrique (Korte et al., 1992; Lam et al., 1996) du CnF augmente en effet le rythme cardiaque et la pression artérielle. Cet effet a aussi été associé à une activité détectée par le marqueur c-fos dans différentes régions du cerveau impliquées dans le contrôle du rythme cardiaque (Lam et al., 1997). De plus, il semble que la stimulation électrique de la MLR chez le chat décérébré provoque une augmentation de l’activité respiratoire qui précède de quelques secondes les réponses motrices. Les régions évoquant cet effet respiratoire couplé à la locomotion a été identifié comme correspondant au CnF et ses zones proximales (DiMarco et al., 1983; Kawahara et al., 1989). L’activité du
CnF pourrait ainsi être couplé à des réponses locomotrices associées au stress. Même en mettant de côté ces liens avec l’activité cardiorespiratoire, on se rend tout-de-même compte que le CnF est aussi directement associé à l’initiation de la marche. En effet, il a été montré que le CnF décharge au cours de la locomotion (Pialat et al., 2009; Goetz et al., 2016) et que son activation peut initier la marche (Mitchell et al., 1988) et augmenter le rythme locomoteur chez différentes espèces (Eidelberg et Yu, 1981; Mori et al., 1989; Marlinsky et Voitenko, 1991; Musienko et al., 2008). De plus, notre laboratoire a récemment publié une étude (Josset et al., 2018) mettant en évidence que la stimulation des neurones glutamatergiques du CnF permet d’initier et d’accélérer la locomotion. Or, la capacité apparente du CnF à initier la marche et augmenter le rythme locomoteur correspond à la définition fonctionnelle de la MLR. Le CnF est ainsi un candidat sérieux pour être un corrélat anatomique majeur de cette région. Ceci appuie donc les résultats de Takakusaki représentés à la Figure 8 (Takakusaki et al., 2003a; Pour revue : Takakusaki et al., 2004). En effet, la stimulation du CnF considéré comme la MLR dans cette étude a permis de générer un rythme locomoteur et une augmentation du tonus postural. En revanche, la stimulation du PPN n’a résulté qu’en une diminution de ce dernier.
En dépit de ces arguments prometteurs, il existe tout de même une certaine controverse quant à l’appartenance du CnF à la MLR ne serait-ce que par les résultats contradictoires obtenus par Rill et collaborateurs (Rill et al., 1987; Garcia-Rill et Skinner, 1988) suggérant le PPN comme un corrélat plus probable. Une étude ayant effectuée une lésion chimique (ibonetate) bilatérale du CnF (Allen et al., 1996) ne rapporte pas d’effet délétère sur la locomotion et conclue que le CnF ne peut pas être un corrélat anatomique probable de la MLR. Il existe toutefois un doute sur la sélectivité des lésions au cours de ces expériences et il est possible que d’autres régions locomotrices comme la DLR/SLR aient pu compenser le déficit fonctionnel. Une autre étude (Depoortere et al., 1990) rapporte que la stimulation du CnF peut induire des arrêts locomoteurs. Il a toutefois été suggéré plus tard (Tovote et al., 2016) que la stimulation était peut-être trop intense et son site trop médial au CnF car un effet semblable a été obtenu en stimulant la partie ventrale de la PAG. L’implication du CnF est ainsi toujours débattue aujourd’hui comme pour les autres corrélats possibles de la MLR. S’il s’avérait toutefois faire réellement partie de cette région, ses connexions avec des structures liées au stress et sa capacité apparente à