Étude spectroscopique de la thanatine
Interactions avec des membranes lipidiques modèles
Mémoire
Émile Robert
Maîtrise en chimie
Maître ès sciences (M. Sc.)
Québec, Canada
© Émile Robert, 2014
iii
Résumé
L'intérêt porté à l'étude des peptides antimicrobiens est motivé par la résistance croissante des bactéries face aux antibiotiques traditionnels, un problème particulièrement présent en milieu hospitalier. Ayant en vue d’approfondir ce domaine d’expertise, notre attention s’est arrêtée sur la thanatine. Ce peptide naturel présent chez la punaise soldat (Podisus maculiventris) se démarque par sa structure secondaire en forme d’épingle à cheveux et par sa capacité à entraîner l’agglomération des bactéries.
L’objectif du projet est d’étudier l’interaction de la thanatine avec des membranes lipidiques modélisant les cellules eucaryotes et procaryotes afin d’en déduire son mécanisme d’action. En spectroscopie IRTF et RMN en phase solide, la structure et l’organisation des systèmes modèles ont été étudiées. L’agrégation de vésicules modèles a quant à elle été étudiée par diffusion dynamique de la lumière et spectroscopie UV-vis. Des avancées ont été faites concernant la formulation des membranes modèles.
v
Table des matières
Résumé ... iii
Table des matières ... v
Liste des abréviations et symboles ... vii
Liste des tableaux ... ix
Liste des figures ... xi
Remerciements ... xiii
Chapitre 1 Introduction ... 1
1.1 Bactéries résistantes aux antibiotiques ... 1
1.2 Peptides antimicrobiens ... 2
1.2.1 Structures ... 2
1.2.2 Mécanismes d’action ... 3
1.2.3 Présence sur le marché... 5
1.3 La thanatine ... 5 1.3.1 Structure ... 5 1.3.2 Activité antimicrobienne... 6 1.3.3 Effets in vivo ... 8 1.4 Membranes cellulaires ... 9 1.4.1 Membranes naturelles ... 9 1.4.2 Membranes modèles ... 12 1.5 Objectifs du projet ... 14 1.6 Approche spectroscopique ... 16
Chapitre 2 Synthèse peptidique ... 17
2.1 Synthèse peptidique en phase solide ... 17
2.2 Méthodologie ... 18
2.2.1 Couplage du premier acide aminé ... 18
2.2.2 Couplage des acides aminés suivants ... 19
2.2.3 Clivage et récupération du peptide ... 20
2.2.4 Formation du pont disulfure ... 21
2.2.6 Spectroscopie infrarouge... 22
Chapitre 3 Structures et organisation... 23
3.1.1 Méthodologie ... 26 3.1.2 Résultats ... 27 3.2 Dichroïsme circulaire ... 34 3.2.1 Méthodologie ... 34 3.2.2 Résultats ... 35 3.3 Spectroscopie RMN 31P ... 38 3.3.1 Méthodologie ... 41 3.3.2 Résultats ... 41 3.4 Spectroscopie RMN 2H ... 46 3.4.1 Méthodologie ... 46 3.4.2 Résultats ... 47 3.5 Discussion ... 48
Chapitre 4 Dynamiques d’agrégation ... 51
4.1 Diffusion dynamique de la lumière ... 51
4.1.1 Méthodologie ... 54 4.1.3 Résultats ... 55 4.2 Spectrométrie UV-visible... 60 4.2.1 Méthodologie ... 60 4.2.3 Résultats ... 61 4.3 Discussion ... 64 Chapitre 5 Conclusion ... 67 5.1 Conclusions générales ... 67 5.2 Mécanisme d’action ... 68 5.3 Perspectives ... 69 Bibliographie ... 71
vii
Liste des abréviations et symboles
2D deux dimensions
ADC anisotropie de déplacement chimique
Arg arginine
B0 champ magnétique
Beff champ magnétique effectif
CD dichroïsme circulaire
cm-1 nombre d’onde
CMI concentration minimale inhibitrice
Cys cystéine D deutérium d diamètre DBF dibenzofulvène DBU 1,8-diazobicycloundec-7-ène DCM dichlorométhane ºC degré Celsius δ déplacement chimique Δχ susceptibilité magnétique ΔνQ écart quadripolaire Δt écart de temps DIEA N,N’-diisopropyléthylamine
DLS diffusion dynamique de la lumière
DMF diméthylformamide
DMPC dimyristoylphosphoglycérocholine
DMPG dimyristoylglycérophosphoglycérol
EDT éthanedithiol
EDTA acide éthylène diamine tétraacétique
Θ ellipticité éq. équivalent Eu eucaryote Fmoc 9-fluorénylméthyloxycarbonyl γ rapport gyromagnétique G- Gram négatif G+ Gram positif g gramme
HBTU O-(benzotriazol-1-yl)- tétraméthyluronium hexafluorophosphate
HEPES acide 4-(2-hydroxyéthyl)-1-pipérazine éthane sulfonique
HOBt hydroxybenzotriazole
Hz hertz
I intensité
IR infrarouge
IRTF infrarouge à transformée de Fourrier
LPS lipopolysaccharides
LUV large vésicule unilamellaire
M molaire
m/z rapport masse sur charge
MCT mercure-cadmium-tellure
MeOH méthanol
Met méthionine
Met(O) méthionine sulfoxyde
µL microlitre µm micromètre µM micromolaire mg milligramme mL millilitre mm millimètre mmol millimole mW milliwatt min minute nm nanomètre
νasy mode d’élongation asymétrique
νsym mode d’élongation symétrique
Pbf pentaméthyldihydrobenzofurane PC phosphatidylcholine PG phosphatidylglycérol Phos phosphate PO palmitoyloléoyl POPC palmitoyloléoylphosphoglycérocholine POPE palmitoyloléoylphosphoglycéroéthanolamine POPG palmitoyloléoylglycérophosphoglycérol
ppm partie par million
RMN résonance magnétique nucléaire
s seconde
S. aureus Staphylococcus aureus
SPPS synthèse peptidique en phase solide
T tesla
TFA acide trifluoroacétique
Th thanatine
TIS triisopropylsilane
Tm température de transition de phase
TOCl tétraoléoylcardiolipine
TPPM two pulse phase modulation
Tris trishydroxyméthylaminométhane
Ts s-thanatine
ix
Liste des tableaux
Tableau 1.1 : Exemple de familles de peptides naturels retrouvées dans les différentes classes du vivant ... 2
Tableau 1.2 : Comparaison des structures primaires de la thanatine et de la brévinine-1 ... 6
Tableau 2.1 : Solution d’activation pour le couplage de la Fmoc-Met sur la résine de Wang ... 18
Tableau 3.1 : Positions de la bande amide I’ en fonction de la structure secondaire adoptée ... 25
Tableau 3.2 : Pourcentages des différentes structures secondaires adoptées par la thanatine dans le tampon HEPES à 37 ºC ... 36
xi
Liste des figures
Figure 1.1 : Mécanisme d’action d’un peptide cationique typique ... 4
Figure 1.2 : Punaise soldat, Podisus maculiventris ... 5
Figure 1.3 : Image stéréoscopique de la conformation du squelette de la thanatine représentée par la superposition des 18 meilleurs calculs obtenus par RMN en solution... 7
Figure 1.4 : Concentrations minimales inhibitrices de thanatine en fonction de la concentration de NaCl pour différentes espèces bactériennes ... 8
Figure 1.5 : Représentation schématique d’une membrane biologique ... 9
Figure 1.6 : Illustration de la sélectivité des peptides expliquée par la présence de lipides anioniques dans le feuillet externe des membranes procaryotes... 10
Figure 1.7 : Membranes bactériennes schématisées ... 12
Figure 1.8 : Phospholipides du premier système de modèles membranaires ... 13
Figure 1.9 : Mélanges lipidiques du second système de modèles membranaires ... 14
Figure 1.10 : Schématisation des composantes d’un mécanisme d’action de peptide à activité membranaire ... 15
Figure 2.1 : Schéma réactionnel des étapes de couplages de la synthèse peptidique ... 19
Figure 2.2 : Spectres de masse de la thanatine ... 21
Figure 2.3 : Région de la bande amide I’ du spectre IR de la thanatine avant et après la purification par cycles de lyophilisation ... 22
Figure 3.1 : Spectre IR de vésicules de DMPC en présence de thanatine... 23
Figure 3.2 : Comparaison entre les phases gel et fluide ... 24
Figure 3.3 : Région spectrale de la bande amide I’ de la thanatine seule ou en présence de vésicules multilamellaires du premier système de modèles ... 28
Figure 3.4 : Région spectrale de la bande amide I’ de la thanatine seule ou en présence de vésicules multilamellaires du deuxième système de modèles ... 29
Figure 3.5 : Fréquence du mode de vibration νsym CH2 en fonction de la température de vésicules multilamellaires du premier système de modèles ... 31
Figure 3.6 : Région spectrale de la bande νC=O de vésicules multilamellaires du premier système de modèles avec ou sans thanatine ... 32
Figure 3.7 : Fréquence du mode de vibration νC=O en fonction de la température de vésicules multilamellaires du premier système de modèles avec ou sans thanatine ... 33
Figure 3.8 : Spectres CD de différentes structures secondaires ... 35
Figure 3.9 : Spectres CD de la thanatine dans différents tampons à 37 ºC ... 36
Figure 3.10 : Spectres CD de la thanatine dans le tampon HEPES à différentes concentrations de NaCl ... 37
Figure 3.11 : Déplacement chimique du 31P de phospholipides en fonction de son orientation dans le champ magnétique ... 39
Figure 3.12 : Spectres RMN 31P de phospholipides selon différentes phases et structures ... 40
Figure 3.13 : Représentation graphique de l’équation 3.5 ... 41
Figure 3.14 : Spectres RMN 31P de vésicules multilamellaires du premier système de modèles seules ou en présence de thanatine à différents ratios molaires ... 43
Figure 3.15 : Spectres RMN 31P de vésicules multilamellaires du second système de modèles seules ou en présence de thanatine ... 45
Figure 3.17 : Spectres RMN 2H de vésicules multilamellaires du premier modèle eucaryote seules ou en
présence de thanatine ... 48
Figure 4.1 : Schématisation d’un appareil DLS ... 51
Figure 4.2 : Fluctuation de l’intensité lumineuse détectée ... 52
Figure 4.3 : Diminution de l’autocorrélation du signal en fonction du temps ... 53
Figure 4.4 : Comparaison entre le nombre de particules de tailles différentes et l’intensité lumineuse qu’elles diffusent ... 53
Figure 4.5 : Montage Mini-Extruder pour l’extrusion de larges vésicules unilamellaires (LUV) ... 55
Figure 4.6 : Mesures DLS de LUV du modèle procaryote du premier système seules ou en présence de thanatine (100 µM) ... 56
Figure 4.7 : Mesures DLS de LUV du second système de modèles seules ou en présence de thanatine ... 57
Figure 4.8 : Diamètres moyens des LUV du second système de modèles et des agrégats engendrés par l’addition de 100 µM de thanatine en fonction du temps et en présence de sel ou non ... 59
Figure 4.9 : Courbes de cinétiques d’agrégation des LUV du second système de modèles à différentes concentration de thanatine ... 62
Figure 4.10 : Comparaison entre la position sur la courbe de cinétique d’agrégation et l’aspect macroscopique de la solution ... 63
Figure 4.11 : Courbes de cinétique d’agrégation des LUV du modèle G- en présence de 10 µM de thanatine à différentes concentrations de NaCl ... 64
xiii
Remerciements
C’est avec une grande fierté que j’écris ces lignes, qui clôturent en quelque sorte le plus long chapitre de ma vie jusqu’à présent, soit celui de mes études. Je suis fier bien sûr d’avoir accompli tout ce travail, mais encore plus d’avoir su m’entourer de gens extraordinaires qui ont fait de ce parcours quelque chose d’unique et d’inoubliable.
Je remercie d’abord tout spécialement Michèle, sans qui mon curriculum vitae ne tiendrait que sur une page. Tu as su créer un environnement de travail animé par la soif d’apprendre, et où la seule pression ressentie vient de l’envie de te présenter quelque chose de bien en retour de la confiance que tu nous accordes. Merci pour tout.
Je tiens aussi à remercier Thierry, Jean-François, Pierre et François. L’aide des professionnels de recherche est un atout indispensable et vous m’avez toujours accordé la vôtre avec plaisir. Je vous dois la majeure partie de tout ce que j’ai appris au cours de cette maîtrise. Un merci particulier à Thierry qui m’a été d’une grande aide lors de l’analyse des résultats et de la correction de ce travail.
Je remercie aussi tous mes anciens collègues ainsi que ceux qui sont toujours là, spécialement Marise et Jérémie pour m’avoir supervisé lors de mes stages et Matthieu pour m’avoir introduit à plusieurs techniques et méthodes utilisées dans mes travaux.
Je crois que je ne pourrai jamais assez remercier mes parents pour toute l’aide et l’appui qu’ils m’ont offerts, toujours sincèrement et sans que j’aie vraiment à le demander, et ce dans toutes les sphères de ma vie. Vous n’avez évidemment pas pu travailler à ma place, mais vous m’avez fourni tous les outils nécessaires, matériels ou non, pour arriver à mes fins. Je partage aujourd’hui toute ma fierté avec vous. Merci beaucoup.
Je remercie aussi tous mes amis : Mathieu, David, Simon, Louis-Philippe, François, Nicolas et les autres, mes amis d’impro et du bacc, mes amis d’escalade, mes amis de voyages et tous les autres. Sans vous, tout ceci n’aurait aucun sens.
Finalement, un gros merci à Ève, qui a partagé avec moi ces trois dernières années et avec qui, je l’espère, je partagerai toutes les autres. Merci de m’avoir aidé à décompresser quand j’étais stressé, à relativiser quand tout semblait ne pas fonctionner, et surtout de rire avec moi, toujours.
1
Chapitre 1 Introduction
1.1 Bactéries résistantes aux antibiotiques
Plusieurs études montrent que le nombre d’infections par des bactéries résistantes à un ou plusieurs antibiotiques augmente à une vitesse alarmante. Il a été évalué qu’en 2012 aux États-Unis, plus de 70 % des infections impliquaient des bactéries résistantes à au moins un des traitements antibiotiques communément utilisés contre elles.1
L’observation de la résistance bactérienne a suivi de près l’utilisation des premiers antibiotiques. Un
Staphylococcus aureus résistant à la pénicilline a fait son apparition très rapidement suite à l’introduction de
ce médicament dans les hôpitaux dans les années 1940. Malgré toutes les avancés de la médecine moderne, jusqu’à 60 % des souches de S. aureus aux États-Unis et au Royaume-Uni sont aujourd’hui résistantes à la méthicilline, et plus de morts y seront associés faute de traitement. Les pays en voie de développement sont aussi un bassin important de nouvelles souches résistantes. Les antibiotiques y sont souvent disponibles sans prescription et les traitements sont parfois incomplets ou inadéquats.2 Ces conditions sont favorables à la
sélection et à la propagation des bactéries présentant des signes de résistance. Après plusieurs cycles de sélection, la majorité de la population bactérienne n’est plus sensible au traitement.
Une multitude de phénomènes en constante évolution peuvent participer à protéger la bactérie contre les effets d’un antibiotique. Des enzymes qui détruisent ou modifient la molécule active, des modifications de la paroi cellulaire et les pompes à efflux font parties de ces ressources. De plus, des plasmides codant pour les gènes de résistance permettent la transmission rapide de ces atouts d’une souche bactérienne à l’autre.1, 2
L’impressionnante capacité qu’ont les bactéries à évoluer à toute vitesse a grandement influencé l’industrie de la recherche et du développement des médicaments. Les traitements plus généraux maintenant inefficaces sont plutôt remplacés par des antibiotiques visant des cibles précises, sur un genre particulier. Le développement de ces antibiotiques s’étale sur de nombreuses années et les budgets requis sont astronomiques. L’enjeu est donc risqué sachant que la cible peut changer à tout moment. Ces facteurs sont en grande partie la cause du nombre insuffisant de nouveaux traitements disponibles.
L’intérêt de développer des molécules ayant une activité antimicrobienne sur un large spectre de micro-organismes tout en induisant un minimum de résistance est donc bien réel, et la nature semble s’en être chargée pour nous.
1.2 Peptides antimicrobiens
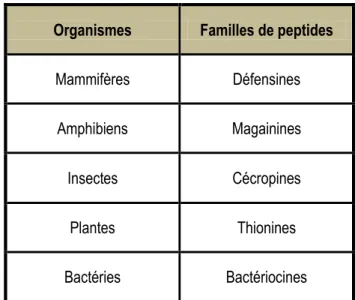
Les peptides antimicrobiens sont retrouvés à tous les échelons du monde du vivant. On peut les diviser en deux grandes classes. D’abord les peptides non ribosomiques, qui ne sont retrouvés que chez les procaryotes et qui sont synthétisés par de larges synthétases peptidiques multifonctionnelles, indépendamment du ribosome, puis les peptides ribosomiques, ou naturels. On recense déjà plusieurs centaines de ces derniers. Ces molécules sont un élément majeur de la défense immunitaire innée chez tous les organismes vivants, y compris encore les bactéries.3 La suite de ce travail sera consacrée aux peptides de cette grande classe.
Organismes Familles de peptides
Mammifères Défensines
Amphibiens Magainines
Insectes Cécropines
Plantes Thionines
Bactéries Bactériocines
Tableau 1.1 : Exemple de familles de peptides naturels retrouvées dans les différentes classes du vivant.
1.2.1 Structures
Les peptides antimicrobiens comportent en moyenne entre 20 et 50 acides aminés, dépassant rarement cinq kilodaltons (kDa). Bien que des portions de séquences soient conservées au sein d’une même famille, la structure complète d’un peptide est souvent propre à une seule espèce animale ou végétale, d’où le nombre très important de peptides différents déjà découverts. La grande majorité de ces peptides sont cationiques, leur charge nette variant entre +2 et +9 en moyenne. Plusieurs d’entre eux possèdent aussi un caractère amphiphile, parfait pour interagir avec la membrane cellulaire tout en conservant une bonne solubilité.
En distinguant les peptides antimicrobiens selon des critères structuraux on obtient, en première approximation, trois familles principales : les peptides formant des hélices (ex. cécropines), les peptides riches en cystéines formant des ponts disulfures (ex. défensines et protégrines) et les peptides riches en un type
3 d’acides aminés précis (ex. indolicidine riche en tryptophane).4 Il est aussi intéressant de mentionner la
sous-classe des peptides synthétiques. Ces peptides sont synthétisés et étudiés en laboratoire afin de maximiser leur pouvoir antimicrobien. Certains consistent en des peptides naturels chez lesquels la séquence primaire a été légèrement modifiée afin d’amplifier des caractères particuliers.5 D’autres sont développés de A à Z en
laboratoire, suivant certaines lignes directrices inspirées de leurs équivalents naturels.6 La conception de ces
nouveaux antibiotiques de synthèse et les prédictions quant à leurs performances ne sont envisageables que si les mécanismes d’actions des peptides naturels sont étudiés et bien compris.
1.2.2 Mécanismes d’action
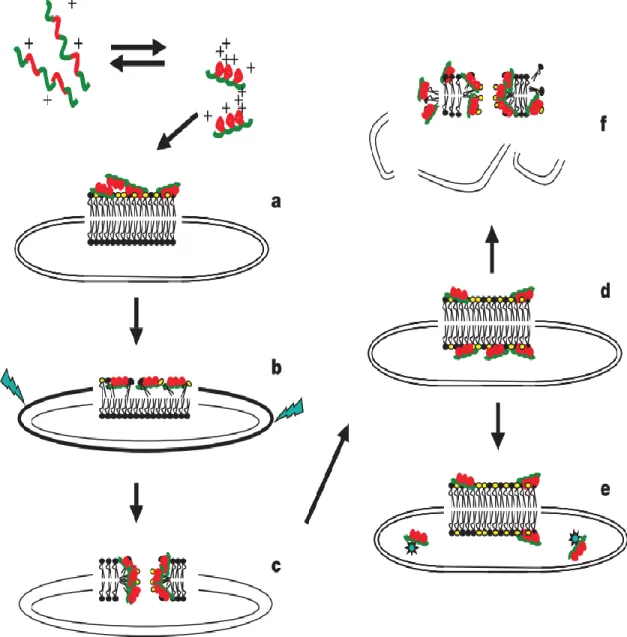
L’activité de tous les peptides antimicrobiens implique nécessairement une interaction avec la membrane lipidique de la cellule visée. Le modèle de Shai-Matsuzaki-Huang propose un mécanisme qui explique le comportement de la plupart des peptides. En premier lieu, il y a une interaction entre le peptide et la membrane. Elle est suivie d’un déplacement des lipides et d’une altération de la structure membranaire. Dans certains cas, il y a finalement entrée du peptide à l’intérieur de la cellule vers une cible interne. Dans d’autres cas, il peut y avoir destruction complète de la membrane, ou encore la formation de pores qui perturbent l’homéostasie de la cellule.7
C’est en se basant sur ces faits que l’on peut expliquer l’étonnante capacité des peptides antimicrobiens à n’induire que peu ou pas de résistance bactérienne. Comme toute la membrane cellulaire est ciblée, la bactérie n’aurait d’autre choix que de modifier significativement la composition et l’organisation de cette dernière pour se protéger, ce qui représente des changements très importants.7 De plus, comme il existe une
grande variété de séquences primaires et de structures secondaires, les bactéries ont peu de chances de bâtir un système de défense adapté à tous les peptides.
Figure 1.1 : Mécanisme d’action d’un peptide cationique typique. En rouge : résidus hydrophiles chargés. En
vert : résidus hydrophobes. a) Adsorption du peptide à la surface de la membrane. b) Intégration du peptide dans la bicouche lipidique entraînant l’amincissement du feuillet externe et des contraintes de courbure. c) Formation de pores accompagnée d’un changement de phase. d) Transport du peptide jusqu’au feuillet interne. e) Diffusion du peptide à l’intérieur de la cellule vers des cibles intracellulaires. f) Destruction de la bicouche en plusieurs fragments. Adaptée de [7].
5
1.2.3 Présence sur le marché
Malgré ces avantages considérables, cette classe d’antibiotiques est relativement peu représentée dans les pharmacies et les milieux hospitaliers. Plusieurs peptides naturels ou dérivés synthétiques ont atteint le stade des études cliniques, mais très peu sont approuvés par les instances gouvernementales.8 Sous forme de
crème, d’aérosols ou par voie intraveineuse, on tente de les utiliser contre diverses infections bactériennes et fongiques.
Beaucoup considèrent que les peptides antimicrobiens seront utilisés à grande échelle un jour. Les connaissances dans ce domaine relativement nouveau ne cessent de s’approfondir et de nouveaux peptides sont découverts chaque année.
1.3 La thanatine
En 1996, Fehlbaum et al.9 ont découvert que lorsque la punaise soldat (Podisus maculiventris) est confrontée
à une attaque bactériologique, elle sécrète dans son hémolymphe un peptide à caractère antimicrobien. La séquence de ce peptide montre des ressemblances avec la famille des brévinines, peptides antimicrobiens retrouvés sur la peau de certaines grenouilles.10 Après avoir confirmé son activité contre plusieurs
pathogènes, ils ont baptisé le peptide thanatine (Th), du grec thanatos, signifiant « mort ».
Figure 1.2 : Punaise soldat, Podisus maculiventris, crédit photo : Dann Thombs.
1.3.1 Structure
La séquence primaire de la thanatine inclut trois résidus arginine et trois résidus lysine, portant sa charge nette à +6 à pH physiologique. Elle contient deux cystéines qui formeront un pont disulfure intramoléculaire, créant ainsi une boucle au niveau du C-terminal.
Peptides Séquences
Thanatine - - - G S K K P V P I I Y C N R R T G K C Q R M
Brévinine-1 F L P V L A G I A A K V V P A L F C - K I T K K C - - -
Tableau 1.2 : Comparaison des structures primaires de la thanatine et de la brévinine-1. En rouge : résidus chargés positivement. En gras : similitudes entre les deux séquences. Adapté de [9].
Mandard et al.11 ont montré par RMN-2D du proton que la thanatine adopte une structure secondaire dite en
«épingle à cheveux», dans laquelle les résidus entre l’isoleucine-8 et la méthionine-21 inclusivement forment un feuillet-β antiparallèle. Ce feuillet est stabilisé entre autres par un pont disulfure entre les cystéines et différentes liaisons hydrogène. Le brin N-terminal de la glycine-1 à la proline-7 adopte une structure désordonnée. On peut voir ces éléments à la Figure 1.3, qui montre la superposition des 18 meilleurs calculs de la position des atomes du squelette du peptide (N, Cα, C’), obtenus à partir des résultats RMN. On observe que la structure du feuillet est très bien définie tandis que le brin N-terminal est hautement dynamique. En croisant les yeux pour superposer les images, on peut même apercevoir l’angle formé entre les deux parties du feuillet-β, séparées par le pont disulfure.
Les extrémités sont plutôt hydrophiles, tandis que le centre est principalement un regroupement de résidus hydrophobes. Ces derniers forment une poche contenant la chaîne latérale de l’arginine-20. Cette conformation, observée chez d’autres protéines, semble avoir un rôle fonctionnel.11
1.3.2 Activité antimicrobienne
La thanatine fut le premier peptide d’insecte à agir à concentration physiologique contre des bactéries à Gram positif (G+), à Gram négatif (G-) ainsi que des cellules fongiques. Les travaux menés par Fehlbaum et al.9 afin
de mesurer la concentration minimale inhibitrice du peptide contre de nombreuses souches bactériennes sont résumés dans un tableau disponible à l’Annexe 1. On y voit notamment que le peptide inhibe complètement la prolifération de nombreuses souches sous la barre des 5 µM, soit environ la concentration endogène dans l’hémolymphe de l’insecte.
7
Figure 1.3 : Image stéréoscopique de la conformation du squelette de la thanatine représentée par la
superposition des 18 meilleurs calculs obtenus par RMN en solution. Adaptée de [11].
L’équipe a aussi synthétisé de multiples dérivés de différentes longueurs en retirant graduellement des résidus d’un bout ou l’autre du peptide. On remarque que l’on peut retirer jusqu’à cinq résidus du côté N-terminal (V16M) sans qu’il n’y ait d’impact majeur sur l’activité du peptide. Par contre, en retirant un seul résidu du côté C-terminal (G20R), presque toute l’activité contre les bactéries G- est perdue. Afin de savoir si la thanatine repose son activité sur un phénomène stéréosélectif, le peptide a été synthétisé aves les énantiomères D de chaque acide aminé (D-thanatin). L’activité contre toutes les bactéries G- est perdue tandis qu’elle est conservée pour la plupart des bactéries G+ et des cellules fongiques. Cette caractéristique implique des différences dans les mécanismes d’action.
Il est important de noter que la thanatine n’est pas hémolytique, c’est-à-dire qu’elle n’entraîne pas la destruction des globules rouges du sang. Ce critère est évidemment capital à l’utilisation de la thanatine comme médicament.
1.3.3 Effets in vivo
Bien que le mécanisme d’action du peptide ne soit pas précisément connu, on connait les différents effets qu’il cause chez les bactéries.9 D’abord, l’ajout de thanatine entraîne presque instantanément une perte de
motilité, rapidement suivie par la formation de larges agrégats de bactéries. L’activité respiratoire n’est pas affectée pendant une heure, après quoi elle diminue tranquillement et s’arrête, persistant jusqu’à six heures après le traitement.
Comme plusieurs peptides antimicrobiens entraînent la formation de pores dans la membrane cellulaire, la perméabilité de cette dernière aux ions K+ en présence de thanatine a été mesurée.9 En mesurant la
concentration en K+ dans le milieu extracellulaire à l’aide d’une électrode spécifique, on observe que cette
dernière reste inchangée suite à l’ajout du peptide. La membrane n’est donc pas perméabilisée car la formation de pores aurait entraîné la diffusion du contenu intracellulaire et aurait fait augmenter la concentration de potassium dans le milieu extracellulaire. Des résultats semblables sont obtenus avec H+.
Wu et al.5 ont démontré que la concentration minimale inhibitrice (CMI), soit la quantité minimale de thanatine
requise pour stopper la prolifération des bactéries, est influencée par la concentration saline ainsi que le pH. Lors d’une étude portant sur la thanatine ainsi qu’un dérivé synthétique chez qui la thréonine-15 est remplacée par une sérine, la s-thanatine (Ts), ils ont observé que la CMI de chaque peptide augmente avec la concentration de NaCl, de KCl, de CaCl2 et de MgCl2, et ce déjà à concentrations physiologiques.
Figure 1.4 : Concentrations minimales inhibitrices (CMI) de thanatine (Th) et s-thanatine (Ts) en fonction de la
9
1.4 Membranes cellulaires
Les membranes cellulaires sont l’ultime frontière qui sépare l’intérieur de la cellule du milieu extracellulaire. En plus d’assurer l’intégrité structurale de la cellule, elles sont le cœur d’une grande activité biochimique. Depuis le premier modèle de la mosaïque fluide proposé par Singer et Nicolson12 en 1972, de grandes avancés
techniques ont permis d’en apprendre énormément sur la composition, l’organisation et la dynamique des membranes cellulaires.
1.4.1 Membranes naturelles
Les membranes naturelles, ou biologiques (Figure 1.5), sont un milieu hautement organisé et extrêmement complexe. De nombreuses familles de biomolécules entrent dans leur composition, qui diffèrera d’un type de cellule à l’autre selon sa fonction, rendant chaque membrane plus ou moins unique. Malgré tout, les membranes partagent toutes plusieurs points communs quant à leur structure et la manière dont elles
s’assemblent.13
Figure 1.5 : Représentation schématique d’une membrane biologique. Les têtes polaires variées des
phospholipides sont représentées par différentes couleurs. Les segments transmembranaires des protéines sont représentés par les cylindres gris. Adaptée de [16].
Le cœur de chaque membrane biologique consiste en une bicouche lipidique, soit un mince film de lipides liés entre eux par des interactions non covalentes, notamment des interactions hydrophobes et de Van der Waals. Cette bicouche agit comme un fluide en deux dimensions (2D) qui permet aux biomolécules qui y sont ancrées de se déplacer latéralement dans le plan de la membrane.14 Il est évalué qu’une cellule eucaryote peut
posséder plusieurs centaines d’espèces de lipides différentes.15 Parmi ces espèces, notons principalement la
famille des phospholipides. Ces molécules sont formées d’une tête polaire phosphatée reliée à une queue apolaire d’acides gras par le biais d’un groupement glycérol. C’est cette nature amphiphile qui les pousse à s’auto-assembler spontanément en bicouche, cachant ainsi les chaînes acyle du milieu aqueux environnant. Comme il existe différentes têtes polaires, chargées ou non, ainsi qu’une multitude de chaînes acyle insaturées, mono- ou polyinsaturées de multiples longueurs, les phospholipides forment une famille très large. D’autres types de lipides importants, tel les sphyngomyélines, les cardiolipines et les glycolipides, peuvent se retrouver à des pourcentages élevés dans certains types de membranes. Finalement, on peut noter la présence importante de cholestérol chez les cellules eucaryotes, qui affecte la fluidité et l’organisation latérale des membranes.16
Notons ici que le feuillet externe de la bicouche lipidique des procaryotes est souvent riche en phopholipides anioniques, chez qui la tête polaire est porteuse d’une charge négative, comme la tête phosphatidylglycérol (PG). Chez les cellules eucaryotes, le feuillet externe est plutôt constitué de lipides globalement neutres, portant par exemple une tête zwitterionique phosphatidylcholine (PC).7 C’est cette différence fondamentale qui
permet aux peptides antimicrobiens, presque toujours cationiques, d’être sélectifs envers les cellules bactériennes et de ne pas interagir avec les cellules eucaryotes comme les érythrocytes. (Figure 1.6)
Figure 1.6 : Illustration de la sélectivité des peptides expliquée par la présence de phospholipides anioniques
11 Les membranes naturelles sont aussi très riches en protéines, qui en moyenne représentent 50 % de leur masse totale.17 Ces protéines, dites membranaires, sont extrêmement diversifiées afin de remplir de
nombreuses fonctions vitales à la cellule, notamment les échanges entre les milieux extra- et intracellulaire ainsi que de nombreux rôles de signalisation. Elles peuvent posséder ou pas un ou plusieurs segments transmembranaires, en hélices-α comme de nombreux canaux ioniques, ou en feuillets-β comme les porines. D’autres aussi peuvent être périphériques et se lient à la surface de la membrane par des interactions électrostatiques. Beaucoup de protéines membranaires fonctionnent en synergie avec d’autres, comme les récepteurs couplés aux protéines G par exemple, et sont donc hautement mobiles latéralement dans la bicouche.18
Cette description d’une membrane cellulaire constituée d’une bicouche lipidique riche en protéines décrit bien la paroi des cellules eucaryotes, mais est toutefois incomplète pour décrire les membranes procaryotes. En effet, les bactéries possèdent, à l’extérieur de la bicouche de lipides, une seconde enveloppe, laquelle permet de différencier les bactéries à Gram positif et négatif selon la coloration qu’elles adoptent lors du test de Gram.19 La Figure 1.7a montre la paroi cellulaire d’une bactérie à Gram positif. La couche supérieure est
épaisse et est constituée principalement de peptidoglycane, polymère naturel composé d’un polysaccharide dont les chaînes sont reliées entre elles par des segments peptidiques. Les bactéries à Gram négatif, représentées à la Figure 1.7b, possèdent elles aussi une couche de peptidoglycane, mais beaucoup plus mince. Au-dessus se trouve une seconde bicouche lipidique, dont le feuillet externe est constitué de lipopolysaccharides (LPS). Les LPS ont une moitié lipidique enfouie dans la bicouche que l’on nomme le lipide A et une autre moitié qui consiste en l’antigène O qui est un polysaccharide pointant vers le milieu extracellulaire. Leur conformation précise varie beaucoup d’une espèce de bactéries à l’autre.
Figure 1.7 : Membranes bactériennes schématisées. a) Représentation d’une membrane de bactérie G+. b)
Représentation d’une membrane de bactérie G-.
1.4.2 Membranes modèles
Tel que mentionné dans la section précédente, les membranes biologiques sont un milieu très complexe et d’une grande variabilité. Ces caractéristiques rendent leur analyse pratiquement impossible pour de nombreuses techniques de spectroscopie. Il est donc impératif de pouvoir modéliser ces membranes par des systèmes plus simples qui permettent d’isoler les interactions qui nous intéressent, ici les interactions entre le peptide et la bicouche de phopholipides.
Il existe une multitude de stratégies pour mimer les bicouches lipidiques naturelles. On peut parler de vésicules uni- ou multilamellaires, de monocouches à l’interface air-eau, de bicouches fixées sur support solide, et bien d’autres.20, 21 Dans le cadre de ce travail, seulement des vésicules ont été utilisées. Elles offrent
plusieurs avantages, comme la facilité de leur préparation ainsi qu’un contrôle précis de leur composition. Les vésicules multilamellaires, aussi appelées liposomes, sont un assemblage de plusieurs bicouches superposées comme les couches d’un oignon. À partir de ces liposomes, on peut former des vésicules unilamellaires par une technique d’extrusion qui permet l’obtention de vésicules de taille unique.
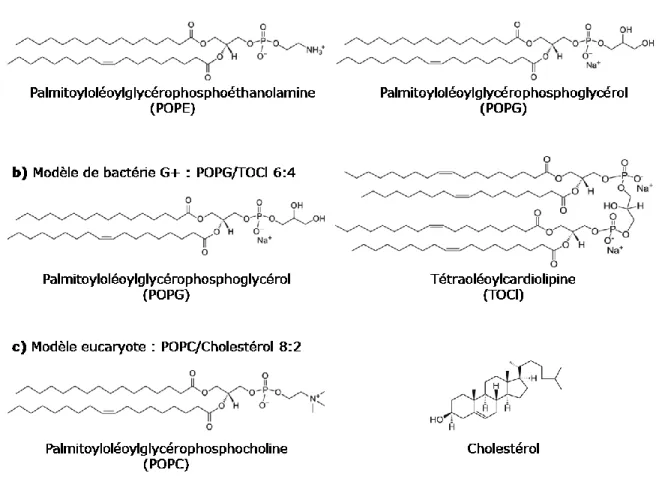
Le choix des lipides utilisés est évidemment d’une importance capitale et sera déterminant quant à la pertinence des résultats obtenus. Bien que certaines tendances soient observées, il n’y pas de consensus dans la littérature sur la composition des membranes modèles. Il faut parfois faire plusieurs tentatives avant de trouver la combinaison gagnante. Le premier système étudié ici est simple et met en comparaison deux
13 modèles composés d’un seul lipide. Le premier est le dimyristoylglycérophosphoglycérol (DMPG), phopholipides anioniques modélisant les membranes bactériennes. Le second est le dimyristoylphosphoglycérocholine (DMPC) qui est globalement neutre et donc qui sera notre modèle de cellules eucaryotes.
Figure 1.8 : Phospholipides du premier système de modèles membranaires.
Pour des raisons qui seront expliquées plus loin dans le texte, ce premier système a dû être amélioré. Un second système de modèles, basé sur des mélanges binaires de lipides, a été développé et s’est avéré être plus efficace pour recréer les effets in vivo de la thanatine. Les différents mélanges sont présentés à la Figure
1.8. On note maintenant une différenciation des modèles de bactéries G- et G+. Les phospholipides à chaînes
palmitoyl-oléoyl (PO) présentent une insaturation cis au milieu de la chaîne oléoyl (18:1 cis-9). Cette caractéristique a pour conséquences de grandement diminuer la température de transition de phase (Tm) et
d’augmenter la fluidité des membranes. On note aussi l’ajout d’autres composants importants des membranes biologiques comme le cholestérol et la cardiolipine. Les différents ratios et compositions sont inspirés de ceux observés chez différentes variétés de cellules.22
Figure 1.9 : Mélanges lipidiques du second système de modèles membranaires.
1.5 Objectifs du projet
Bien que les qualités antimicrobiennes de la thanatine soient déjà répertoriées, peu d’informations sont connues quant aux phénomènes biophysiques qui gouvernent son mécanisme d’action. En fait, la ou les cibles de la thanatine sur la cellule ne sont pas précisément confirmées. Il est impératif de bien comprendre l’origine de l’activité antimicrobienne de ce peptide, et de nombreux autres d’ailleurs, afin de développer de nouveaux traitements contre les infections.
L’objectif général du projet est de mieux comprendre le mécanisme d’action de la thanatine en étudiant les interactions entre le peptide et des membranes lipidiques modèles. Comme la bicouche de phospholipides constitue la principale similitude entre les membranes cellulaires affectées par le peptide et qu’elle est la cible de nombreux autres peptides antimicrobiens, il y a de fortes chances que ces interactions soient au cœur de l’activité de la thanatine.
15 Une multitude d’informations sont nécessaires afin d’expliquer complètement le mécanisme d’action d’un perturbateur membranaire.23 La Figure 1.9 schématise les nombreuses variables à identifier :
Figure 1.10 : Schématisation des composantes d’un mécanisme d’action de peptide à activité membranaire.
Adaptée de [20].
Plusieurs techniques de spectroscopie permettent d’obtenir ces informations et, dans notre cas, les techniques utilisées nécessitent toutes l’utilisation de membranes modèles. Évidemment, le choix du modèle est d’une importance capitale. Des résultats obtenus d’un modèle erroné le seront tout autant. L’objectif plus ciblé de ce travail de maîtrise sera donc de développer un modèle qui semble recréer le mieux possible l’activité in vivo de la thanatine. Du même coup, certaines caractéristiques de l’interaction entre le peptide est les bicouches lipidiques modèles pourront déjà être observées.
1.6 Approche spectroscopique
Plusieurs techniques spectroscopiques ont été utilisées de concert au cours de ce travail. On peut séparer les résultats obtenus en deux grandes catégories. Le Chapitre 3, Structure et organisation, portera sur la structure de la thanatine en présence des différents modèles ainsi que sur l’organisation des phospholipides dans les bicouches avant et après l’exposition au peptide. Plus précisément, la spectroscopie infrarouge à transformée de Fourrier (IRTF) nous permettra d’obtenir de l’information sur la structure secondaire du peptide par l’étude de la bande amide I’. Des résultats complémentaires ont été obtenus par dichroïsme circulaire (CD). La spectroscopie IRTF nous permet aussi d’étudier la transition de phase (Tm) à laquelle les
phospholipides passent d’une phase gel à une phase désordonnée. Finalement, la fréquence de vibration des groupements carbonyle de la tête polaire des lipides est sensible à la formation de liaisons hydrogène et permettra d’observer les changements au niveau de l’hydratation à la surface de la bicouche. La résonance magnétique nucléaire en phase solide du phosphore (RMN 31P) sera aussi mise à profit afin d’observer
l’intégrité des membranes modèles. Les intensités relatives et la largeur du spectre de poudre contiennent de l’information sur la déformabilité des vésicules et sur la dynamique des têtes polaires. Des résultats préliminaires de résonance magnétique nucléaire en phase solide du deutérium (RMN 2H) ont été enregistrés
afin d’observer les variations de l’ordre des chaînes acyle des phospholipides.
Dans le Chapitre 4, Dynamiques d’agrégation, nous tenterons de reproduire la capacité du peptide à induire l’agglomération des bactéries via notre modèle membranaire. D’abord, la diffusion dynamique de la lumière (DLS) nous permettra de confirmer la synthèse de vésicules unilamellaires de tailles homogènes et d’observer l’effet de l’ajout de thanatine. L’agrégation sera observée dans différentes conditions afin de comparer avec des résultats in vivo de la littérature. Finalement, la cinétique de l’agrégation suivant l’introduction du peptide sera suivie par mesure de la turbidité par spectrophotométrie UV-visible (UV-vis).
17
Chapitre 2 Synthèse peptidique
2.1 Synthèse peptidique en phase solide
La synthèse de la thanatine a été réalisée avec l’aide de l’équipe du Pr Normand Voyer du département de chimie de l’Université Laval. La méthode utilisée est la synthèse peptidique en phase solide (SPPS).24 L’idée
est d’attacher le premier acide aminé du peptide désiré, en commençant du côté C-terminal (ici la Met-21), à une résine solide fonctionnalisée par un alcool 4-benzyloxybenzylique appelée résine de Wang. La résine, sous forme de petites billes, est contenue dans une seringue munie d’un filtre grossier, assez fin pour retenir les billes. Après avoir évalué le taux de substitution des sites disponibles sur la résine, les sites non substitués sont bloqués. À ce stade, l’amine primaire de l’acide aminé est toujours protégée par un groupement protecteur 9-fluorénylméthyloxycarbonyl (Fmoc) afin d’éviter les réactions indésirables. L’amine est ensuite déprotégée en milieu basique, puis, après lavage, le mélange réactionnel contenant l’acide aminé avec groupe protecteur Fmoc suivant (ici la Arg-20) est aspiré dans la seringue. Le couplage est confirmé par un test qualitatif et rapide de colorimétrie, ce qui nous évite d’obtenir un mélange de peptides de différentes longueurs. On répète ensuite les cycles de déprotection/couplage jusqu’à l’obtention de la séquence primaire complète. Le peptide final est clivé de la résine en milieu acide pour être récupéré. Dans notre cas, le pont disulfure est formé en dernier par oxydation en milieu basique. On obtient le peptide solide par lyophilisation du solvant. Le produit final est caractérisé par sa masse et sa pureté. Les protocoles sont détaillés à la section
2.2, Matériel et méthode.
Cette méthode de synthèse offre de nombreux avantages techniques. Comme le peptide en croissance est fixé à la résine qui est elle-même confinée dans la seringue, il est très facile de séparer les produits intermédiaires et les réactifs en excès des mélanges réactionnels. En comparaison, la synthèse en phase liquide aurait nécessité la séparation et la purification par chromatographie du produit désiré entre chaque étape de déprotection et de couplage, travail qui aurait été extrêmement fastidieux. L’utilisation du groupement protecteur Fmoc, qui est labile en milieu basique, permet de déprotéger l’amine sans toucher à l’ester entre la résine et le carboxyle terminal du peptide. De plus, les chaînes latérales des acides aminés concernés sont protégées par des groupes protecteurs labiles en milieu acide, comme l’arginine protégée par le pentaméthyldihydrobenzofurane (Pbf). Ces groupements sont clivés à la toute fin, en même temps que le peptide est clivé de la résine. Les chaînes latérales sont donc protégées tout au long de la synthèse.
2.2 Méthodologie
La résine, les acides aminés Fmoc et les réactifs de couplage ont été achetés chez Matrix Innovation (Québec, QC). Les différents solvants, acides et bases proviennent de chez Sigma-Aldrich (Oakville, ON) ou Fisher Scientific (Ottawa, ON).
2.2.1 Couplage du premier acide aminé
La résine est d’abord pesée (0,350 g) puis transférée dans la seringue. Différentes résines de Wang sont disponibles dépendamment du taux de substitution visé. Ici, comme le peptide à synthétiser est relativement long, nous avons choisi une résine avec un taux plutôt bas, soit 0,46 mmol/g, afin de minimiser l’encombrement stérique entre les chaînes peptidiques et ainsi favoriser les couplages. Avec 350 mg de résine, on peut donc fixer 0,161 mmol de Fmoc-Met. La solution d’activateurs et d’agents de couplages25 (voir
Tableau 2.1) est préparée dans un ballon, sur bain de glace. L’acide aminé est en excès à 3 équivalents (éq.),
soit ici 0,483 mmol. Les produits sont ensuite dissouts dans environ 10 mL de diméthylformamide (DMF).
Produits Nombre d’éq. Fmoc-Met 3 HOBt 3 DIC 3 DMAP 0,1 DIEA 4
Tableau 2.1 : Solution d’activation pour le couplage de la Fmoc-Met sur la résine de Wang.
La résine est d’abord gonflée avec du dichlorométhane (DCM) puis la solution d’activation est ensuite insérée. La seringue est placée sur une plaque agitatrice pendant 3 heures. Après avoir évacué la solution d’activation, la résine est lavée. À chaque fois qu’il sera question de lavage, le procédé est toujours le même : on rince avec environ 10 mL de DMF, trois fois, puis avec la même quantité de méthanol (MeOH), trois fois, puis encore au DMF (3x) et encore au MeOH (3x). La résine est finalement séchée sur rampe à vide.
Le taux de substitution est évalué par spectrométrie UV-vis en dosant le dibenzofulvène (DBF) relargué par un échantillon de résine substituée traitée par la base 1,8-diazobicycloundec-7-ène (DBU).26 Un taux de
substitution de 0,21 mmol/g a été mesuré, signifiant que moins de la moitié des sites disponibles de la résine ont réagi. La réaction a été lancée une seconde fois, sur la résine déjà substituée, dans les mêmes conditions.
19 Un taux final de 0,30 mmol/g a été mesuré et jugé satisfaisant. Les sites restant sont inactivés par acétylation. La seringue est remplie d’une solution d’anhydride acétique est de DMF en ratio 1 : 1 avec 10 % de N,N’-diisopropyléthylamine (DIEA) et agitée pendant 1 heure. La résine est lavée, puis séchée.
2.2.2 Couplage des acides aminés suivants
Les vingt acides aminés suivants ont tous été couplés de la même manière. D’abord, environ 10 mL de solution de déprotection sont aspirés dans la seringue. Cette solution consiste en un mélange de pipéridine et de DMF dans un ratio 1:4. La seringue est agitée pendant 10 minutes après quoi la solution est évacuée. Cette étape est répétée une seconde fois. Finalement, la résine est lavée, en finissant ici avec le DMF.
On prépare la solution de couplage dans un vial, soit 3 éq. d’hyrdroxybenzotriazole (HOBt), 3 éq. de O-(benzotriazol-1-yl)- tetraméthyluronium hexafluorophosphate (HBTU) et 3 éq. de l’acide aminé désiré. Le tout est dissout dans environ 10 ml de DMF et 3 éq. de DIEA sont ajoutés juste avant l’insertion dans la seringue. Le tout est agité une heure, la résine est finalement lavée, puis séchée.
Afin de s’assurer du bon fonctionnement du couplage, on effectue le test de Kaiser sur quelques grains de résine.27 Ce test qualitatif utilise la ninhydrine, qui réagit avec les amines libres en induisant une coloration
violet intense. Si aucune coloration n’est observée, on commence le couplage suivant, et ainsi de suite jusqu’à l’obtention du peptide final.
Figure 2.1 : Schéma réactionnel des étapes de couplages de la synthèse peptidique. La résine est
2.2.3 Clivage et récupération du peptide
Avant de cliver le peptide de la résine, le dernier groupe protecteur est retiré. Le clivage ce fait en milieu acide, dans une solution d’acide trifluoroacétique (TFA) concentré en présence de triisopropylsilane (TIS). On prépare environ 10 mL de TFA : H2O : TIS dans un ratio 95 : 2,5 : 2,5. La solution est aspirée dans la
seringue, qui est agitée pendant 3 heures. La solution de clivage contenant le peptide déprotégé est récupérée dans un ballon et la résine est rincée quelques fois au DCM. Le peptide est précipité par l’ajout de quelques millilitres d’éther et le ballon est placé sur l’évaporateur rotatif. Cette étape est répétée cinq fois en tout. Finalement, le peptide est dissout dans un minimum d’eau distillée et est lyophilisé.
Le peptide récupéré a été caractérisé par spectrométrie de masse sur un chromatographe liquide LC1200 couplé à un spectromètre de masse MS-TOF 6210 (Agilent Technology, Santa Clara, CA). On retrouve sur le spectre à la Figure 2.2a, en plus du pic de la thanatine (masse attendue 2434,29 m/z, pic [M + 3H]3+ à 812,10
m/z), un pic assez intense (32 % du pic de Th) avec exactement la masse d’un atome d’oxygène en trop (pic [M + O + 3H]3+ à 817,77 m/z). Effectivement, la méthionine est sensible à l’oxydation et peut être oxydée en Met-sulfone ou, dans ce cas-ci, en Met-sulfoxyde (Met(O)). Nous avons tenté une réduction par l’iodure d’ammonium en milieu acide selon une méthode publiée28 mais nous n’avons pas été en mesure de récupérer
le produit. Nous n’avons eu d’autre choix que de refaire la synthèse au complet. Afin d’empêcher l’oxydation de la 21-Met, de l’éthanedithiol (EDT) est ajouté à la solution de clivage, qui est maintenant TFA : H2O : EDT :
TIS dans un ratio 94 : 2,5 : 2,5 : 1. Le spectre de masse montre encore quelques traces du signal de la thanatine oxydée, mais ce dernier a presque complètement disparu (voir Figure 2.2b). Ce résultat a été considéré comme satisfaisant et ce produit a été utilisé pour la suite de ce travail.
21
Figure 2.2 : Spectres de masse de la thanatine. a) Première synthèse. b) Deuxième synthèse, avec EDT.
2.2.4 Formation du pont disulfure
La dernière étape avant l’obtention du peptide final consiste à former le pont disulfure entre la 11-Cys et la 18-Cys par oxydation en milieu basique. Le peptide est dissout dans une solution de carbonate d’ammonium 0,1 M. On fait ensuite tranquillement buller de l’air dans la solution. Après 3 heures, un spectre de masse nous confirme le départ de deux protons, signe que l’oxydation a réussie. Aucun pic ne semble indiquer la présence de ponts intermoléculaires.
2.2.6 Spectroscopie infrarouge
Ici, la spectroscopie IRTF est utilisée afin d’observer la présence de sels de TFA résiduels. En effet, une bande intense centrée à 1672 cm-1 est associée à l’élongation du carbonyle du trifluoroacétate.29 Ces sels sont
retirés par plusieurs cycles de dilutions dans l’eau distillée puis lyophilisation. Après cinq cycles, un second spectre IR a été enregistré et la bande a effectivement disparue. On voit que, sur la Figure 2.3, la courbe en bleu ne présente plus que la bande amide I’ du peptide, qui nous informera sur la structure secondaire du peptide.
Figure 2.3 : Région de la bande amide I’ du spectre IR de la thanatine avant et après la purification par cycles
23
Chapitre 3 Structures et organisation
3.1 Spectroscopie IRTF
Bien que de moins en moins populaire dans les laboratoires de synthèse organique et de chimie analytique, la spectroscopie infrarouge à transformée de Fourrier reste un outil très utile pour l’étude des biomolécules. Elle sera ici mise à profit pour obtenir de nombreuses informations sur la structure de la thanatine, l’organisation des phospholipides dans la bicouche et des interactions entre ces composés.
La plage IR du spectre électromagnétique peut être arbitrairement divisée en trois parties, soit le proche IR (14000-4000 cm-1), l’IR moyen (4000-400 cm-1) et l’IR lointain (400-10 cm-1). La spectroscopie IRTF est basée
sur le phénomène d’absorption par des transitions vibrationnelles. La lumière incidente est absorbée par les liaisons moléculaires à des énergies quantifiables correspondant ici à l’élévation d’un niveau vibrationnel fondamental vers des niveaux vibrationnels excités. La position de la bande d’absorption sur le spectre IR nous informe donc sur la nature et la force d’une liaison chimique alors que son intensité relative et l’aire sous la courbe permettent certaines mesures quantitatives.30 La Figure 3.1 nous montre un spectre IR typique de
vésicules multilamellaires en présence de thanatine ainsi que les régions spectrales d’intérêt pour ce travail.
Figure 3.1 : Spectre IR de vésicules de DMPC en présence de thanatine. a) Mode d’élongation symétrique
des groupements CH2 des chaînes acyle. b) Mode d’élongation des groupements C=O des phospholipides. c)
Tel que mentionné plus tôt, la spectroscopie IR nous informe sur l’organisation des phospholipides dans la bicouche. Plus précisément, la position de la bande d’élongation symétrique des groupements CH2 (νsym(CH2),
Figure 3.1a) est sensible à la conformation adoptée par la chaîne. Si les groupements s’alignent
principalement de manière anti-périplanaire, les chaînes sont ordonnées et auront la capacité de s’empiler efficacement. On parle ici d’une phase gel. Sous l’effet d’une augmentation de la température, on observe l’apparition de conformères dits gauche, qui nuisent à l’empilement. On parle alors de la phase fluide. La présence de ces conformères gauche se traduit sur le spectre par une augmentation de la νsym(CH2). Comme
ce phénomène se produit de manière concertée, on peut mettre cette fréquence en fonction de la température et mesurer la température de transition de phase (Tm). Le but ici est de mesurer cette température en
présence de thanatine ou non et ainsi mieux comprendre l’impact du peptide sur l’organisation lipidique.
Figure 3.2 : Comparaison entre les phases gel et fluide. a) Projections de Newman. b) Modélisations
computationnelles avec les têtes polaires en noir et les chaînes acyle en blanc. Adaptées de [31].
Une autre bande d’intérêt du spectre IR propre aux phopholipides est la bande de l’élongation du groupement carbonyle (ν(C=O), Figure 3.1b) de la fonction ester formée par l’attache des acides gras au glycérol. Cette bande est en fait la superposition de deux contributions, l’une provenant des C=O libres et l’autre des C=O hydratés. Ces derniers montrent une fréquence d’élongation plus basse car le nuage électronique de la liaison double est partiellement délocalisé vers les ponts hydrogène formés avec les molécules d’eau. La liaison se trouve ainsi affaiblie et la fréquence diminue. Encore une fois, l’étude de cette bande avec ou sans thanatine
25 dans le milieu apporte de nouvelles informations sur les interactions présentes, ici plutôt dans la région de la tête polaire.
Le spectre IR contient aussi de l’information sur le peptide. La nature répétitive du squelette des peptides et des protéines est responsable de l’apparition de plusieurs bandes caractéristiques appelées bandes amides A, B et I à VII. De ces bandes, les bandes amides I et II sont les plus proéminentes. Nous nous concentrerons ici principalement sur la bande amide I entre 1700 et 1600 cm-1 qui émane principalement de l’élongation de la
liaison C=O du lien peptidique avec une légère contribution de l’élongation C-N (Figure 3.1c). Ce mode vibrationnel est sensible aux angles de torsion qui séparent les résidus.32 Il est aussi sensible aux interactions
dipôle-dipôle avec les C=O voisins. Il peut y avoir des couplages entre les moments de transition en fonction des distances et des orientations qui entraîneront le dédoublement de certaines bandes.33
Comme ces angles et ces interactions sont caractéristiques pour chaque structure secondaire adoptée par la chaîne peptidique, ces dernières peuvent être identifiées par la position de la bande amide I. Si plusieurs structures secondaires sont présentes, comme dans la majorité des cas, la bande observée correspond à la sommation proportionnelle des différentes contributions.
Notons ici que le mode vibrationnel de torsion H-O-H de l’eau possède un forte absorbance à 1640 cm-1 qui
peut fortement compliquer l’analyse de la bande amide I. Afin de contourner ce problème, tous les spectres sont enregistrés dans l’oxyde de deutérium (D2O).34 Les atomes de deutérium étant plus lourds, la vibration se
fait à plus basse fréquence. Par convention, nous parlerons donc de la bande amide I’, indiquant que le spectre est enregistré dans le D2O.
Les fréquences principales correspondantes aux différentes structures sont présentées dans le Tableau
3.134 :
Structures
secondaires la bande amide I’ (cmPlage de fréquence de -1)
Feuillet-β 1620 - 1640 1675 ± 5
Désordonnée 1645 ± 4
Hélice-α 1653 ± 4
Coude-β 1659 - 1674 1681 - 1696
3.1.1 Méthodologie
Les spectres IR ont été enregistrés avec un spectromètre Nicolet Magna 560 à transformée de Fourier (Thermo Scientific, Waltham, MA) à détecteur mercure-cadmium-tellure (MCT). Le contrôle de la température est effectué par un montage à élément Peltier. Pour chaque spectre, 128 interférogrammes sont enregistrés à une résolution de 2 cm-1 et une apodisation de Happ-Genzel est appliquée. L’échantillon est contenu entre
deux fenêtres de CaF2 (BioTools) avec un parcours optique de 35 μm. Les spectres sont enregistrés entre 650
et 4000 cm-1.
Les échantillons sont préparés afin d’obtenir des vésicules multilamellaires. Les lipides sont achetés chez Avanti Polar Lipids (Alabaster, AL) et arrivent dissouts à une concentration de 25 mg/mL dans une solution de CHCl2/MeOH. Le volume requis pour obtenir 7 mg de lipides, ici 280 µL, est transféré avec une seringue dans
un microtube Eppendorf, qui est ensuite placé sous un jet d’azote afin d’évaporer la majorité du solvant. Dans un autre microtube, on place 50 µL d’une solution tampon d’acide 4-(2-hydroxyéthyl)-1-pipérazine éthane sulfonique (HEPES) 10 mM avec 5% d’acide éthylène diamine tétraacétique (EDTA) à pH 7,4. Les microtubes sont trempés dans l’azote liquide et placés au lyophilisateur pour la nuit afin de retirer toutes traces de solvant. Lorsque vient la journée des mesures de spectroscopie, 50 µL de D2O sont utilisés pour réhydrater le tampon
sous atmosphère d’argon. Ensuite, 28 µL de tampon sont transférés dans le microtube avec les phopholipides afin d’obtenir un taux d’hydratation de 80 %. Afin de former les vésicules, l’échantillon est agité sur un appareil Vortex, congelé dans l’azote liquide puis chauffé cinq minutes à 50 ºC. Ce cycle agitation-gel-dégel est répété cinq fois. L’échantillon est prêt à être inséré entre les fenêtres.
Pour les échantillons qui contiennent de la thanatine, cette dernière est ajoutée au tampon avant la lyophilisation. Le peptide est dissout dans de l’eau distillée à une concentration de 10 mg/mL. La quantité adéquate de cette solution est ensuite placée dans le microtube afin d’obtenir au final le ratio molaire phospholipides/thanatine désiré.
Les spectres enregistrés sont traité avec le logiciel Grams/AI 8.0 (Thermo Electron Corporation). On soustrait d’abord le signal de référence, puis le spectre du tampon HEPES afin de ne conserver que le signal émanant des vésicules et du peptide. À cette étape, il est conseillé de faire une analyse visuelle des spectres pour confirmer la qualité des résultats, en s’assurant par exemple que les bandes d’intérêt ne saturent pas le détecteur et qu’il n’y ait pas de traces de vapeur d’eau.35 Pour l’analyse de chaque bande une ligne de base
représentée par une fonction quadratique a été appliquée sur une fenêtre spectrale appropriée, soit entre 3050 et 2750 cm-1 pour νsym CH2, 1850 et 1675 cm-1 pour νC=O et 1685 et 1550 cm-1 pour la bande amide I’.
27
3.1.2 Résultats
La première analyse qui a été réalisée a été de déterminer si la structure secondaire de la thanatine change lorsque cette dernière entre en contact avec les vésicules. On peut voir la bande amide I’ de la thanatine seule dans le tampon HEPES ou en présence des vésicules du premier modèle sur la Figure 3.3.
Pour la thanatine en solution, le maximum de la bande amide I’ est à 1642 cm-1. Cette valeur est mitoyenne
entre les fréquences associées aux feuillets-β et celles des structures désordonnées, ce qui concorde parfaitement avec la structure proposée par RMN en solution (Figure 1.3).
En présence de vésicules de DMPG, on observe un déplacement de la bande vers les plus faibles nombres d’ondes, suggérant une proportion de feuillets-β plus importante. Avec le DMPC, le déplacement de la valeur maximale semble causé par un élargissement de la bande, associé à une distribution plus large de structures adoptées. Ces changements, qui suggèrent une certaine interaction avec les phospholipides, sont toutefois plutôt mineurs. La thanatine conserve donc en grande partie sa structure secondaire lorsqu’elle entre en contact avec les vésicules de ces deux modèles.
Notons que les épaulements à 1610 et 1585 cm-1 sont probablement associés aux vibrations ν
sym(CN3H5+) et
Figure 3.3 : Région spectrale de la bande amide I’ de la thanatine seule ou en présence de vésicules
multilamellaires du premier système de modèles. Les bandes sont normalisées par rapport à la hauteur maximale de la bande amide I’. Les spectres sont enregistrés à 37 ºC.
Cette analyse a aussi été menée avec les vésicules du second système de modèles et les résultats sont présentés à la Figure 3.4. On remarque des modifications plus importantes qu’avec les lipides saturés du premier système. En présence des trois modèles, la bande amide I’ est plus étroite que celle de la thanatine
29 seule. Tel que mentionné plus haut, la largeur de la bande est fonction de la distribution statistique des fréquences vibrationnelles. En d’autres termes, plus la bande est étroite, plus la structure adoptée par les chaînes peptidiques est homogène dans la population. Il est possible que la plus grande fluidité des bicouches permette ici à la thanatine de s’ancrer plus fermement aux vésicules, stabilisant ainsi la structure secondaire. Avec le modèle Eu, il semble que l’amincissement de la bande dévoile une autre composante plus faible à 1670 cm-1 qui peut être attribuée à un coude-β. Dans le cas des modèle G- et G+, on note aussi une
modification importante de la forme générale de la bande amide I’. Le déplacement vers les plus hautes fréquences peut s’expliquer par la présence d’une composante importante centrée à 1652 cm-1. Il est difficile
d’associer avec certitude cette bande avec une structure précise, quoique cette fréquence soit plutôt associée aux hélices-α. Il est assez fréquent qu’un segment peptidique adopte une structure en hélice-α suite à une insertion dans la bicouche et il est possible que ça soit le cas ici. Comme la densité de charge des vésicules du modèle G+ est semblable à celle des vésicules de DMPG, on aurait pu s’attendre à ce que cette bande soit présente dans les deux modèles si elle était causée par ce facteur, ce qui n’est pas le cas. Il semble donc que la fluidité de la membrane ait un impact sur la structure secondaire adoptée par la thanatine, puisque le modèle G+ contient la plus grande quantité de phospholipides insaturés.
Figure 3.4 : Région spectrale de la bande amide I’ de la thanatine seule ou en présence de vésicules
multilamellaires du deuxième système de modèles. Les bandes sont normalisées en intensité. Les spectres sont enregistrés à 37 ºC.
Notons finalement que la bande à 1585 cm-1, qui avait été associée plus haut à la chaîne latérale des
arginines, disparaît en présence des modèles contenant des phospholipides anioniques. On ne peut pour l’instant expliquer ce phénomène, mais cela suggère tout de même que ces résidus interagissent avec ces phospholipides et que la charge positive qu’ils portent y soit sûrement pour quelque chose.
La seconde analyse effectuée par spectroscopie IR est la mesure de la Tm. Notons d’abord que cette mesure
n’a pu être obtenue pour les modèles du deuxième système car les Tm de la majorité de ces lipides sont sous
la barre du 0 ºC et que l’appareillage utilisé ne peut refroidir à des températures aussi basses. Les courbes de thermotropisme de la bande νsym CH2 pour le modèle procaryote sont montrées à la Figure 3.5a. La Tm
mesurée pour le DMPG seul est de 22 ºC, ce qui concorde bien avec la valeur de 23 ºC reportée dans la littérature.36 Bien qu’elle semble légèrement augmentée sur le graphique, la Tm calculée par dérivée première
après l’ajout de thanatine reste la même, soit 22 ºC, et ce pour tous les rapports lipide:peptide étudiés. La
Figure 3.5b montre des résultats semblables pour le premier modèle eucaryote. La Tm mesurée du DMPC
seul est de 23 ºC, concordant aussi bien à la valeur de 24 ºC reportée dans la littérature.37 Une légère
diminution de 1 ºC est entraînée par l’ajout de thanatine. Les mesures à plus hautes concentrations de thanatine n’ont pas été jugées pertinentes.
31
Figure 3.5 : Fréquence du mode de vibration νsym CH2 en fonction de la température de vésicules
multilamellaires du premier système de modèles, seules ou en présence de thanatine à différents rapports molaires. Les barres d’erreurs représentent l’écart-type sur deux réplicas. a) Modèle procaryote. b) Modèle eucaryote.