Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR des sciences fondamentales et appliquées
Institut de chimie des milieux et matériaux de Poitiers - IC2MP (Diplôme National - Arrêté du 7 août 2006)
École doctorale : Sciences pour l'environnement - Gay Lussac (La Rochelle) Secteur de recherche : Chimie organique, minérale et industrielle
Présentée par :
Marielle Tamigney Kenfack
Développement d'un vaccin glycoconjugué semi-synthétique contre la mélioïdose et la morve
Directeur(s) de Thèse : Yves Blériot, Charles Gauthier
Soutenue le 04 décembre 2015 devant le jury
Jury :
Président Stéphane Vincent Professeur, CBO, Université de Namur, Belgique
Rapporteur Boris Vauzeilles Directeur de Recherche, ICMMO, CNRS, Université Paris-Sud Rapporteur Laurence Mulard Directeur de recherche, Institut Pasteur, Paris
Membre Yves Blériot Professeur, IC2MP, Université de Poitiers Membre Charles Gauthier Maître de conférences, Université de Poitiers
Pour citer cette thèse :
Marielle Tamigney Kenfack. Développement d'un vaccin glycoconjugué semi-synthétique contre la mélioïdose et la morve [En ligne]. Thèse Chimie organique, minérale et industrielle. Poitiers : Université de Poitiers, 2015.
THÈSE
Pour obtention du grade de
DOCTEUR DE L’UNIVERSITÉ DE POITIERS
(Faculté des Sciences Fondamentales et Appliquées) (Diplôme National – Arrêté du 7 août 2006)
École doctorale : Sciences Pour l’Environnement – Gay Lussac Secteur de Recherche : Chimie Organique, Minérale et Industrielle
Présentée par :
Marielle TAMIGNEY KENFACK
°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°
DÉVELOPPEMENT D’UN VACCIN GLYCOCONJUGUÉ
SEMI-SYNTHÉTIQUE CONTRE LA MÉLIOÏDOSE ET LA MORVE
°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°° Directeurs de Thèse :
Pr. Yves BLÉRIOT, Professeur, Université de Poitiers
Dr. Charles GAUTHIER, Maître de Conférences, Université de Poitiers °°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°
Soutenue le 4 décembre 2015 devant la Commission d’Examen
°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°°
JURY
Dr. Boris VAUZEILLES Directeur de Recherche CNRS, Université Paris-Sud Rapporteur Dr. Laurence MULARD Directeur de Recherche, Institut Pasteur, Paris Rapporteur Pr. Stéphane VINCENT Professeur, Université de Namur Examinateur
Pr. Yves BLÉRIOT Professeur, Université de Poitiers Examinateur
À mes parents, à Ronan.
Remerciements
Ce projet de thèse a été financé par l’agence Nationale de la Recherche (ANR-JCJC MELIVAC). Il a été principalement réalisé au sein de l’Institut de Chimie des Milieux et Matériaux de Poitiers (IC2MP), CNRS-UMR 7285, Équipe 5 Synthèse Organique.
Ce travail a été effectué sous la direction du Pr Yves Blériot et du Dr Charles Gauthier. Je tiens sincèrement à vous remercier pour l’opportunité qui m’a été donnée de travailler au sein de votre laboratoire et de faire partie de votre équipe. Un merci particulier à Charles qui m’a pris en charge depuis mon stage de Master 2 alors que j’étais novice dans le domaine. Merci pour l’encadrement, les conseils et les encouragements. J’avoue que cela n’a pas toujours été facile, qui plus est lorsqu’on est l’étudiante d’un « maniacochimiste » ! Mais tout compte fait, honnêtement, je suis satisfaite de la formation que j’ai reçue à tes côtés. Un GRAND MERCI à toi Charles et je te souhaite aussi le meilleur pour ta nouvelle vie professionnelle au Canada !
Je souhaite remercier le Pr Stéphane Vincent de l’Université de Namur en Belgique qui a accepté d’être l’examinateur de ce travail. Un sincère remerciement au Dr Laurence Mulard de l’Institut Pasteur de Paris et au Dr Boris Vauzeilles de l’Université de Paris Orsay, qui ont accepté d’être les rapporteurs de cette thèse. Je suis aussi reconnaissante au Dr Laurence Mulard qui nous a permis de réaliser les réactions d’hydrogénolyse sur H-Cube à Paris.
Je tiens également à exprimer ma gratitude à nos collaborateurs qui contribuent à valoriser ce projet de thèse. Je tiens donc à remercier le Pr Antonio Molinaro et le Dr Alba Silipo de l’Université de Naples en Italie pour les analyses de RMN-STD, le Pr Paul Brett de l’University of South Alabama aux États-Unis pour les tests ELISA et le Pr David AuCoin de l’University of Nevada School of Medecine aux États-Unis pour les analyses de SPR pour ne citer qu’eux.
Un merci aussi au Dr Jérôme Désiré pour ses conseils et son humour. Merci également à tous les permanents de l’équipe E5.
Je tiens à remercier les amis que je me suis fait durant ces trois années de thèse : Naima, Hanitra et Jagadeesh. Je vous remercie pour tous les bons moments passés ensemble, pour les restos, le ciné, les sorties, … Merci de m’avoir supporté car je n’ai pas toujours été facile avec vous !
J’adresse également un remerciement chaleureux à l’ensemble des non-permanents (anciens et nouveaux) de l’équipe E5 : Jagadeesh, Hanitra, Naima, Barbara, Marcelina, Alexandra, Longin, Jaufret, Ugo et Patrick. Un merci aussi à mes amis et anciens camarades de M2 BCE de Poitiers : Samuel, Yaovi, David, Kérim, Mark-Arthur et Kiu.
Sincères remerciements à tous les stagiaires qui ont participé à l’avancement de ce projet de thèse : Aurélien, Abba, Jimmy, Barbara et Anaïs.
Un énorme merci à mon cher papa et ma tendre maman (au Cameroun) qui m’ont encouragé et qui m’ont supporté, par téléphone, quand j’étais au bout de mes forces durant ces trois années. Merci aussi à ma tante Marie-Pascal pour ses encouragements que je recevais tous les jours par courriel durant ma période de rédaction.
Merci à ma grande famille ici en France. Tout d’abord un gros merci à toi, tata Margo, pour m’avoir accueillie et pris en charge. Je te suis totalement reconnaissante pour tout ce que tu as fait pour moi. Tu es la meilleure ! Merci à Mireille et Léonie, mes grandes sœurs. Vous êtes juste formidables ! Merci est bien trop petit pour vous exprimer ma profonde gratitude. Soyez bénies ! Merci à ma meilleure amie et sœur Nadège (actuellement au Canada). Je te souhaite aussi beaucoup de courage dans ta dernière année de thèse ! Et un grand merci pour tes conseils, ton soutien et tes prières ! À toi aussi Annick ma chérie, un courage pour ta thèse au Cameroun. Merci à Marcelle, à mon ami et grand frère Paul, à mon petit frère Wilfried, à Lyes, à mes cousins Franck et Éric pour leur soutien ainsi qu’à tous mes amis du GBU. À toi aussi, tonton Martial que j’espère voir bientôt.
Un chaleureux merci à ma famille d’accueil de Poitiers, qui a su me prendre comme une des leurs et qui a toujours été là à mes côtés. Un grand merci à toi, Jules Clément, qui m’a tout appris ici, y compris la conduite ! Merci pour ces cinq années passées ensemble, pour tous tes conseils et ta gentillesse. Un GROS merci également à toi, Marie-Pierre Legrand, pour ma famille, les conseils et les encouragements. Merci aussi pour les weekends et voyages partagés ensemble.
Je ne saurai terminer sans avoir une énorme pensée pour toi, Ronan mon chéri. En réalité, tu es la seule personne qui était présente et qui a vécu mes moments de stress et de panique durant ce dernier parcours de fin de thèse. Je tiens à te dire un GRAND merci pour ta patience, ton soutien, tes encouragements, ton aide précieuse et ton amour. Tu es mon Champion à moi ! Un énorme merci pour tout.
Enfin, je rends grâce à Dieu pour tout ce qu’Il a fait, qu’Il fait et qu’Il fera encore dans ma vie. Merci Seigneur pour la force et le courage que tu m’as donnés pour l’accomplissement de ce travail.
Table des Matières
Remerciements……… i
Table de matières……….. iii
Liste des abréviations………. vii
Chapitre I – Introduction générale………... 1
1.1. Mélioïdose et morve………. 2
1.1.1. Découverte……… 2
1.1.2. Répartition géographique………. 3
1.1.3. Formes et manifestions cliniques………. 5
1.1.4. Facteurs de risque………. 6
1.1.5. Modes de contamination……….. 7
1.1.6. Arme potentielle du bioterrorisme……… 8
1.1.7. Moyens diagnostiques……….. 9
1.1.8. Traitements existants……… 9
1.2. Polysaccharides de surface du genre Burkholderia……… 11
1.2.1 Polysaccharide capsulaire (CPS)………. 12
1.2.2 Lipopolysaccharide (LPS)……… 13
1.2.3 Exopolysaccharide (EPS)………. 15
1.3. Vaccins expérimentaux contre la mélioïdose et la morve……….. 16
1.3.1 Vaccins basés sur les bactéries atténuées (mutantes)……….. 16
1.3.2 Vaccins basés sur les bactéries désactivées……… 17
1.3.3 Vaccins basés sur les polysaccharides de surface……… 18
1.3.3.1 Vaccins de première génération (polysaccharides)……….. 18
1.3.3.2 Vaccins de deuxième génération (glycoconjugués)………. 20
1.3.3.3 Vaccins glycoconjugués semi-synthétiques (« vaccins de troisième génération »)………. 24
1.4 Présentation des objectifs de thèse……….. 27
Chapitre II – Synthèse des 2-O-acétyl-6-désoxy-β-D-manno-heptopyranoses liés en 1→3, mimes du CPS naturel de B. pseudomallei et B. mallei……….. 29
2. Introduction……… 30
2.1 Les dérivés manno-heptopyranoses naturels……….……...………. 31
2.2 Les dérivés manno-heptopyranoses synthétiques……….. 32
2.2.2 Synthèse des D-glycéro-D-manno-heptopyranoses……….. 34
2.2.3 Synthèse des 6-désoxy-D-manno-heptopyranoses……….. 35
2.3 Glycosylation intermoléculaire………. 37
2.3.1 Synthèse des dérivés -D-manno-heptopyranosides……… 37
2.3.2 β-Mannosylation……….. 38
2.3.3 Synthèse des dérivés β-D-manno-heptopyranosides……… 44
2.4 Glycosylation intramoléculaire ou Intramolecular Aglycon Delivery (IAD). 46 2.5 Présentation du projet……… 50
2.6 Résultats et discussion……… 53
2.6.1 Synthèse du 4,6-O-benzylidène-1-thio--D-mannopyranoside de phényle (65) ……….. 53
2.6.2 Synthèse régiosélective des dérivés mannoses protégés 67 et 69……….... 54
2.6.3 Ouverture régiosélective des acétals de benzylidène 67 et 69………. 55
2.6.4 Homologation des alcools 70 et 71……….. 56
2.6.5 Réduction des nitriles 78 et 79………. 57
2.6.6 Benzylation de la position C–7………. 59
2.6.7 Glycosylation intermoléculaire………. 59
2.6.8 Formation des acétals mixtes……… 64
2.6.9 Glycosylation intramoléculaire………. 66
2.6.10 Synthèse du disaccharide 117………. 69
2.6.11 Déprotection des mono- et disaccharides………... 70
2.7 Étude de l’antigénicité des monosaccharides et disaccharides………... 73
2.7.1 Introduction………... 73
2.7.2 Objectifs………. 73
2.7.3 Analyses de Western Blot……….. 74
2.7.4 Analyses de RMN-STD (Saturation Transfert Difference)……….. 74
2.7.5 Analyses de SPR (Surface Plasmon Resonance)……… 75
2.7.6 Analyses de RMN-STD avec les mono- et disaccharides synthétiques mimes du CPS………. 76
2.8 Conclusion……… 78
Chapitre III – Synthèse des di- et trisaccharides mimant le fragment [→3)-β- D-glucopyranosyl-(1→3)-6-désoxy--L-talopyranosyl-(1→] du LPS-antigène O naturel de
B. pseudomallei et B. mallei………...
79
3. Introduction……… 80
3.1 Structures du LPS–AgO de B. pseudomallei et B. mallei………. 82
3.2 Évaluation du potentiel vaccinal du LPS–AgO……… 84
3.3 Synthèse des dérivés 6-désoxy- -L-talopyranoses………. 85
3.4 Synthèse des dérivés 6-désoxy- -L-talopyranoses du LPS–AgO de B. pseudomallei……… 92
3.5 Présentation du projet………. 95
3.6 Analyse rétrosynthétique des di- et trisaccharides de B. pseudomallei et B. mallei……… 95
3.7 Résultats et discussions……… 97
3.7.1 Synthèse du 6-désoxy-2,3-isopropylidène- -L-rhamnopyranoside d’allyle (178) ………. 97
3.7.2 Synthèse des dérivés taloses 179–181……… 97
3.7.3 Tentatives de synthèse des dérivés taloses 183 et 184………... 99
3.7.4 Protection régiosélective des diols 180 et 182 via l’utilisation des acétals stanniques………101
3.7.5 Synthèse du dérivé talose 196……… 102
3.7.6 Synthèse des taloses donneurs trichloroacétimidates 169–173………. 103
3.7.7 Synthèse de l’accepteur de glucosyle 174 et des donneurs de glucosyle 175–177 ………. 104
3.7.7.1 Synthèse de l’accepteur de glucosyle 174………... 104
3.7.7.2 Synthèse des donneurs de glucosyles 175–177………... 106
3.7.8 Synthèse des disaccharides 207–211……….. 108
3.7.9 Synthèse des trisaccharides 217 et 218 et tentatives de synthèse du trisaccharide 216………... 111
3.7.10 Nouvelles voies de synthèse du trisaccharide 216……… 115
3.7.10.1 Tentatives de synthèse de l’accepteur 222………. 116
3.7.10.2 Glycosylation régiosélective des diols 180 et 182 en présence du catalyseur de Taylor : tentative de synthèse du TCA 223………... 117
3.7.10.3 Tentative de synthèse du donneur TCA 224 via la synthèse des disaccharides 237 et 238……….. 119
3.7.10.4 Synthèse du donneur TCA 225 : formation de l’orthoester tricyclique
246………... 120
3.7.11 Synthèse des trisaccharides 250–252……….. 123
3.7.12 Synthèse des trisaccharides 253–255………124
3.7.13 Synthèse des cibles trisaccharidiques 164–166……… 125
3.7.14 Synthèse des cibles trisaccharidiques 162, 163 et 166 et disaccharidiques 167 et 168………... 126
3.8 Étude de l’antigénicité des disaccharides et trisaccharides obtenus………... 128
3.8.1 Objectifs……….. 129
3.8.2 Analyses de Western Blot………... 129
3.8.3 Test ELISA (Enzyme-Linked ImmunoSorbent Assay)……… 131
3.9 Conclusion………. 133
Chapitre IV – Conclusions & perspectives………. 135
Chapitre V – Partie expérimentale………. 140
5.1 Experimental part of Chapter II……… 142
5.2 Experimental part of Chapter III……….. 184
Liste des Abréviations
Ac : AcétyleAcCl : Chlorure d’acétyle
AcrA : Acriflavine resistance
Ac2O : Anhydride acétique AcOEt : Acétate d’éthyle AcOH : Acide acétique
AcONH4 : Acétate d’ammonium ADH : Acide dihydrazine adipique AgOTf : Triflate d’argent
AIBN : Azobisisobutyronitrile AllBr : Bromure d’allyle
AllocCl : Chloroformate d’allyle AllOH : Alcool allylique
Ara : Arabinose
BDMA : Acétal de benzaldéhyde diméthyle BF3.OEt2 : Trifluorure de bore diéthyl éthérate
BH3.THF : Tétrahydrofurane borane
BnBr : Bromure de benzyle BnNH2 : Benzylamine
BSA : Bovine Serum Albumin BSP : 1-Benzènesulfinyl pipéridine BuLi : n-Butyl lithium
Bu3SnH : Hydrure de tributyl étain
Bu2SnO : Oxyde de dibutyl étain
BzCl : Chlorure de benzoate CAN : Cérium ammonium nitrate CCl3CN : Trichloroacétonitrile
CCM : Chromatographie sur couche mince
CDC : Centers for Disease Control and Prevention CF3COOH : Acide trifluoroacétique
(ClAc)2O : Anhydride chloroacétyle
CPS : Polysaccharide capsulaire
CRM-197 : Toxine diphthérique mutante CSA : Acide camphor sulfonique
DABCO : 1,4-Diazabicyclo[2.2.2]octane DAST : Trifluorure de soufre de diéthylamine DBU : 1,8-Diazabicycloundec-7-ène
DCC : Dicyclohexylcarbodiimide DCE : 1,2-Dichloroéthane
DCM : Dichlorométhane
DDQ : 2,3-Dichloro-5,6-dicyano-1,4-benzoquinone DEAD : Azodicarboxylate de diéthyle
DIBALH : Hydrure de diisobutylaluminium DMAP : 4-Diméthylaminopyridine DMF : Diméthylformamide 2,2-DMP : 2,2-Diméthoxypropane DMSO : Diméthylsulfoxyde DMTST : Triflate de diméthyl(méthylthio)sulfonium DT : Anatoxine diphthérique DTBMP : 2,6-Di-tert-butyl-4-méthylpyridine DTBS : Di-tert-butylsilylène
ELISA : Enzyme-Linked ImmunoSorbent Assay EPS : Exopolysaccharide équiv : Équivalent Et2O : Éther diéthylique Et3N : Triétylamine EtSH : Thioéthanol FLA : Flagelline Gal : Galactose
HAS : Human Serum Albumin
HMQC : Heteronuclear Multiple Bond Correlation HRMS : High Resolution Mass Spectroscopy
HSQC : Heteronuclear Singular Quantum Coherence IAD : Intramolecular Aglycon Delivery
IDCP : Iodure de dicollidine perchlorate IgG : Immunoglobuline G IgM : Immunoglobuline M IM : Inter membrane Im : Imidazole j : Jour
Kdo : Acide 3-désoxy-D-mannosyl-2-octulosonique
KLH : Keyhole Limpet Hemocyanin
LCMS : Low Resolution Mass Spectroscopy Lev2O : Anhydride lévulinique
LOS: Lipooligosaccharide LTA: Acide lipotéichoïque LPS: Lipopolysaccharide
LPS–AgO: Lipopolysaccharide antigène–O mAb : Anticorps monoclonal spécifique Man : Mannose
MeOTf : Triflate de méthyle Me2S2 : Disulfure de diméthyle
MS : Molecular Sieves
NAPBr : Bromure de 2-naphthylméthyle NBS : N-Bromosuccinimide
NIS : N-Iodosuccinimide
p-NO2BzOH : Acide p-nitrobenzoïque
p-NO2PhSCl : Chlorure de p-nitrobenzènesulfényle
p-NO2PhSOTf : Triflate de p-nitrobenzènesulfényle
nr : Non réagi OM : Membrane externe O-PS : O-Polysaccharide PCC : Chlorochromate de pyridinium PDC : Dichromate de pyridinium PDCP : Phényl dichlorophosphate PG : Peptidoglycane PhSH : Thiophénol Ph2SO : Diphényl sulfoxyde
PhSeOTf : Triflate de phénylsélényle PMBCl : Chlorure de p-méthoxybenzyle PPh3 : Triphénylphosphine
PS : Polysaccharide
PTFACl : Chlorure de N-phényl trifluoroacétimidoyle PTSA : Acide p-toluènesulfonique
Py : Pyridine rdt : Rendement Rf : Rapport frontal
RMN : Résonance magnétique nucléaire sat. : Saturée
Sc(OTf)3 : Triflate de scandium (III)
SDS-PAGE : Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis SN2 : Substitution nucléophile de type 2
SPR : Surface Plasmon Resonance STD : Saturation Transfer Difference
STDD : Saturation Transfer Double Difference T : Température
Ta : Température ambiante TA: Acide téichoïque
TBAB : Bromure de tétrabutylammonium TBAF : Fluorure de tétrabutylammonium
TBAHS : Hydrogénosulfate de tétrabutylammonium TBAI : Iodure de tétrabutylammonium
TBSCl: Chlorure de tert-butyldiméthylsilyle TBSOTf : Triflate de tert-butyldiméthylsilyle TFA : Acide trifluoroacétique
Tf2O : Anhydride triflique
TfOH : Acide triflique THF : Tétrahydrofurane
TMSOTf : Triflate de triméthylsilyle Tol : Toluène
TREAT.HF : Triéthylamine fluorure d’hydrogène TsCl : Chlorure de tosyle
p-TsOH : Acide p-toluènesulfonique TT : Anatoxine tétanique
TTBT : 2,4,6-Tri-tert-butylpyrimidine WTA : Wall Teichoic Acid
Abréviations signaux RMN
br s : singulet large d : doublet
dd : doublet dédoublé
ddd : doublet dédoublé dédoublé ddt : doublet dédoublé triplé dt : doublet triplé
m : multiplet s : singulet t : triplet
-Chapitre
1.1 Mélioïdose et Morve
Les maladies infectieuses qu’elles soient d’origine bactérienne, virale, parasitaire ou même fongique constituent un problème majeur de santé publique dans le monde et ont un impact négatif réel sur l’espérance de vie et le développement sanitaire, économique et social d’un pays.1 Elles sont responsables de 26 % des décès dans le monde avec un taux de
mortalité de 17 millions par an.1 La grande majorité (90 %) de ces infections surviennent dans
les pays en voie de développement et les enfants en bas âge constituent la population la plus à risque. En France, les maladies infectieuses sont encore la troisième cause de mortalité (soit 12 % des décès annuels)2 avec par exemple 1800 cas de septicémie par an. À ce problème de santé mondiale s’ajoute la résistance aux antibiotiques due à leur utilisation de façon inappropriée et non justifiée les rendant ainsi inefficaces. Il s’ensuit alors le phénomène de résurgence de ces maladies infectieuses et l’émergence de nouveaux microorganismes ubiquitaires avec une capacité notoire d’adaptation à leur environnement. Enfin, il est important de noter que les traitements existants sont très coûteux, présentent des résultats peu satisfaisants et ne sont pas toujours accessibles. Pour toutes les raisons mentionnées précédemment, ces dernières décennies ont été le théâtre d’importantes recherches scientifiques dans le domaine de l’antibiothérapie et de la vaccinologie visant ainsi à développer de nouvelles méthodes diagnostiques et des traitements efficaces pour pouvoir s’immuniser contre ces infections.
1.1.1 Découverte
Burkholderia pseudomallei est un bacille à Gram négatif responsable de la mélioïdose, une zoonose bactérienne émergente hautement sévère avec un taux de mortalité très élevé de l’ordre de 20 à 50 %. Cette maladie a été découverte et décrite en 1912 par Whitmore (Figure 1) et Krishnaswami, lesquels avaient isolé, à partir de pus prélevés sur des abcès développés chez les habitants très dénutris de Rangoon en Birmanie, un bacille autrefois inconnu.3 La maladie fut alors connue primitivement sous le nom de « la maladie de Whitmore ».4,5 Cette bactérie présente des similitudes avec B. mallei, agent causal de la morve animale. En 1921,
1
Wikipédia. Maladies infectieuses, [en ligne]. https://fr.wikipedia.org/wiki/Maladie_infectieuse (Page consultée 28 Août 2015).
2
Jougla, E.; Hatton, F.; LE Toullec, A. Méd. Mal. Infect. 1997, 27, 492.
3
Whitmore, A.; Krishnaswami, C.S. Indian Med. Gazette. 1912, 47, 262.
4
Knapp, H. H. G. Indian Med. Gaz. 1915, 50, 287.
5
Stanton et Fletcher lui donnèrent le nom définitif de mélioïdose, étymologiquement « qui ressemble à la morve ».6
Figure 1 : Alfred Withmore (gauche), un cheval atteint de la morve (droite)
La morve, quant à elle, a été identifiée pour la première fois par Aristote au troisième siècle. En 1664, elle est reconnue comme maladie infectieuse et mortelle qui touche essentiellement les animaux,7 et plus particulièrement les chevaux, ânes ou mulets mais peut aussi être transmissible aux humains, tandis que la mélioïdose est pathogène chez l’homme.
Les bactéries B. pseudomallei et B. mallei sont issues d'une même espèce sur la base de leurs caractères génomiques, mais sur les plans pathogénique et épidémiologique des différences sont notées. Des études récentes ont permis l’identification d’une nouvelle bactérie, B. thailandensis, non pathogène chez l’homme mais très proche génétiquement de B. pseudomallei.8,9
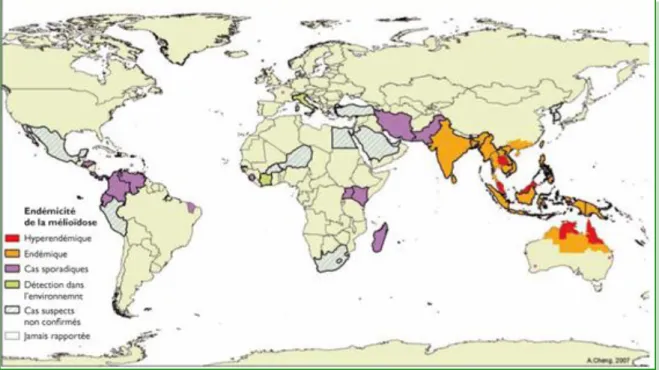
1.1.2 Répartition géographique
La mélioïdose est constamment endémique dans le nord-est de la Thaïlande, dans le nord de l’Australie et dans le Pacifique ouest, globalement entre les latitudes 20° Nord et 20° Sud.10,11 C’est la première cause de pneumonie communautaire bactérienne fatale acquise en
Australie. Elle représente aussi 20 % des cas de septicémies dans le nord-est de la
Thaïlande.17 Des cas sporadiques ont été notifiés dans divers endroits du monde notamment
en Amérique du sud, dans les Caraïbes, dans les îles du Pacifique, en Malaisie, en Iran et en
6
Stanton, A. T.; Fletcher, W. John Bale & Sons and Danielson Ltd. 1932, 21.
7
Neubauer, H.; Meyer, H.; Finke, E. J. Int. Rev. Armed Forces Med. Serv. 1997, 70, 258.
8
Brett, P. J.; De Shazer, D.; Woods, D. E. Int. J. Syst. Bacteriol. 1998, 48, 317.
9
Thibaut, F. M.; Valade, E.; Vidal, D. R. J. Clin. Microbiol. 2004, 42, 5871.
10
Cheng, A. C.; Currie, B. Clin. Microbiol. Rev. 2005,18, 383.
11
Afrique.12,13 La morve, quant à elle, sévit dans les pays d’Asie, du Moyen-Orient, d’Afrique et d’Amérique du Sud avec notamment l’apparition d’un foyer au royaume de Bahreïn au Moyen-Orient en avril 201014 (Figure 2).
Figure 2: Répartition géographique des cas officiels de mélioïdose dans le monde10
B. pseudomallei est une bactérie saprophyte, hydrotellurique retrouvée dans la boue, les eaux stagnantes, les sols argileux et les rizières des régions tropicales chaudes et humides. Les facteurs climatiques jouent un rôle prépondérant dans la répartition géographique de la bactérie : la température, le niveau des précipitations et l’exposition solaire. Les risques d’infections sont accrus pendant les saisons de moussons et inondations.10 Ainsi, dans ces
conditions environnementales favorables, B. pseudomallei s’avère être un germe peu exigeant et doté d’une grande résistance, capable de survivre pendant plusieurs années dans un milieu extérieur très pauvre en nutriments.15 Cela pourrait d’ailleurs expliquer le réveil des formes latentes de la mélioïdose rencontrées chez l’homme. Les agriculteurs, les riziculteurs et les soldats de guerre constituent donc la population à risque (Figure 3).16
12
Olive, C.; Loetitia, G.; Desbois, N.; Roche, B.; Jouanelle, J.; Dodin, A. Press. Med. 1995, 24, 1270.
13
Perez, J. M.; Petiot, A.; Adjide, F.; Jerry, F.; Goursaud, R.; Juminer, B. Clin. Infect. Dis. 1997, 25, 164.
14
Code sanitaire pour les animaux terrestres (OIE). Morve, [Fiche d’information générale sur les maladies].
http://web.oie.int/fr/ressources/GLA-FR.pdf (Page consultée le 20 Août 2015).
15
Keluangkhot, V.; Pethsouvanh, R.; Strobel, M. Med. Maladies Infect. 2005, 35, 469.
16
Chiquet, B. La Ferme « le village »-AMAP de Goussonville, [en ligne].
Figure 3: Des riziculteurs en contact direct avec la boue et l’eau stagnante de la rizière16
1.1.3 Formes et manifestations cliniques
Chez l’homme, les symptômes liés à la mélioïdose sont très polymorphes allant de la forme septicémique disséminée gravissime à la forme localisée, voire inapparente (latence sur plusieurs années),17 d’où le terme de « great mimicker »18 qui a été conféré à la bactérie. Les
formes de septicémies aigües traduisent le caractère virulent et invasif de la bactérie avec un taux de mortalité de 25 à 68 %.10En ce qui concerne la forme localisée, n’importe quel organe peut être atteint. Le poumon est l’organe le plus touché; puis viennent les abcès touchant les reins, la rate, la prostate, les tissus sous-cutanés, les infections cutanées et les parotidites suppurées notamment chez les enfants des pays d’Asie du Sud-est (Figure 4).19,20 La forme
latente constitue la forme la plus remarquable de la mélioïdose.15 De façon générale, le délai de récurrence est de quatre à huit mois,21 mais des cas cliniques ont été rapportés dans lesquels 62 ans séparent l’infection du développement de la maladie : c’est l’exemple de l’épisode des vétérans de la guerre du Vietnam après leur retour d’Indochine. De ce fait, la bactérie fut qualifiée de « Vietnam time bomb », en référence à celles larguées en Indochine.22 La période d’incubation de la mélioïdose n’est pas clairement définie mais, selon les données
17
White, N. J. Lancet 2003, 361, 1715.
18
Poe, R. H.; Vassallo, C. L.; Domm, B. M. Am. Rev. Respir. Dis. 1971, 104, 427.
19
Dance, D. A.; Davis, T. M. E.; Wattanagoon, Y.; Chaowagul, W.; Saiphan, P.; Looreesuwan, S.; Wuthiekanun, W.; White, N. J. J. Infect. Dis. 1989, 159, 654.
20
Valade, E.; Thibault, F. M.; Biot, F. V.; Vidal, D. R. Med. Trop. 2009, 69, 437.
21
Chaowagul, W.; Suputtamongkol, Y.; Dance, D. A. B.; Rajchanuvong, A.; Pattara-Arechachai, J.; White, N. J. J. Infect. Dis. 1993, 168, 1181.
22
actuelles, elle varie de 1 à 21 jours et peut s’étendre sur plusieurs mois voire plusieurs années.23
Chez l’animal, la morve provoque la formation de nodules et d’ulcères dans les voies respiratoires (notamment sur les parois nasales avec écoulement d’un liquide jaune et collant) et les poumons.14,24 Parfois, cela s’accompagne de toux et de diarrhée. La forme cutanée plus connue sous le nom de « farcin » existe aussi.24 Les formes aigües, quant à elles, sont surtout
observées chez l’âne et le mulet qui présentent une forte fièvre et une atteinte respiratoire. Ces nodules sont aussi régulièrement présents dans le foie et la rate conduisant à un
amaigrissement considérable et à la mort de l’animal.La période d’incubation pour le cas de
la morve varie de quelques jours à plusieurs mois en fonction de l’intensité de l’exposition.24
Figure 4: Mélioïdose chez un diabétique avec abcès pulmonaire (gauche),20 parotidite suppurée (droite)20
1.1.4 Facteurs de risque
Il s’agit des pathologies susceptibles de favoriser la survenue de la maladie. En effet, la mélioïdose est une maladie dite opportuniste, car l’association à d’autres maladies favorise son développement et augmente sa gravité. Ces maladies sont : le diabète, les infections pulmonaires chroniques, les insuffisances rénales chroniques, l’alcoolisme, les déficits immunitaires, les thalassémies, le cancer et la cirrhose. Le diabète apparaît comme le facteur de risque majeur. On note par exemple que 50 % des patients qui développent la mélioïdose sont diabétiques.17 La mucoviscidose est à ce jour également considérée comme facteur de
risque pour cette infection.25,26 Par contre, l’infection par le VIH ne semble pas favoriser la
23
Currie, B. J.; Fisher, D. A.; Howard, D. M.; Burrow, J. N.; Selvanayagam, S.; Snelling, P. L.; Anstey, N. M.; Mayo, M. J. Acta Trop. 2000, 74, 121.
24
Wilson, G. S.; Miles, A. 6th. London: Edward Arnold, 1975, 1855.
25
Holland, D. J.; Wesley, A.; Drinkovic, D.; Currie, B. J. Clin. Infect. Dis. 2002, 35, E138.
26
maladie.9,15L’âge moyen des personnes infectées est compris entre 40 et 60 ans, avec un ratio homme/femme de 3 pour 2. Cependant, la mélioïdose peut survenir à tout âge, y compris chez les jeunes enfants avec notamment près de 15 % des cas observés en Thaïlande avec cependant un faible taux de mortalité.27
1.1.5 Modes de contamination
Chez l’homme, il existe deux principaux modes de contamination : la voie
transcutanée17 (majoritaire) illustrée par la souillure de plaies par des eaux de surface, des boues ou des sols infectés. C’est ainsi qu’après les inondations causées par le tsunami de 2004, des cas de mélioïdose ont été détectés avec une fréquence accrue autant chez la population locale que chez les touristes ayant regagné leur pays d’origine. Ce mode de contamination est principalement observé chez les agriculteurs, les riziculteurs et les blessés de guerre en Indochine. Le deuxième mode est l’inhalation des poussières contaminées (aérosols),28 comme ce fut le cas des équipages d'hélicoptères pendant la guerre du Vietnam. D’autres modes de contamination secondaires ont été recensés : la voie digestive10 possible
mais très peu observée; la voie néonatale (de la mère à l’enfant) par l’infection probable du liquide amniotique.29 Les contaminations par voie sexuelle, nosocomiale ou lors des manipulations dans les laboratoires restent anecdotiques.15 Très peu de cas de contamination par transmission interhumaine et de l’homme à l’animal ont été décrits. De ce fait, la mélioïdose n’est pas contagieuse chez l’homme.
Chez l’animal, la voie de contamination la plus répandue est l’ingestion d’aliments contaminés.30 Le matériel contaminé mis en contact avec l’animal comme les accessoires de
toilettage sont aussi source d’infection. La voie de contamination cutanée n’est pas écartée car la bactérie peut pénétrer dans l’organisme par contact avec les lésions de la peau ou des muqueuses. Des cas de transmission de l’animal à l’homme, par contact direct avec les animaux infectés et par contact indirect avec le matériel souillé, ont très souvent été observés.30
27
Suputtamongkol, Y.; Hall, A. J.; Dance, D. A. B.; Chaowagul, W.; Rajchanuvong , A.; Smith, M. D.; White, N. J. Int. J. Epidemiol. 1994, 23, 1082.
28
Sheehy, T.; Deller, J. J.; Weber, D. Ann. Intern. Med. 1967, 67, 897.
29
Blanc, G.; Balthazard, M. Ann. Inst. Pasteur 1942, 68, 281.
30
1.1.6 Arme potentielle du bioterrorisme
Compte tenu de la haute virulence de la bactérie par inhalation (utilisation des aérosols), de la facilité avec laquelle sont obtenues les souches des bactéries, de la dissémination facile des germes, de la résistance accrue aux antibiotiques, du taux de morbidité et de mortalité élevés, du caractère opportuniste et du pouvoir de résurgence de la mélioïdose, B. pseudomallei et B. mallei sont répertoriées comme agents potentiels du bioterrorisme et des guerres biologiques de la catégorie B par le CDC (Centers for Disease Control and Prevention) aux États-Unis. D’où il est nécessaire de posséder et de travailler dans des laboratoires équipés de niveau de confinement P3.31 L’emploi de B. pseudomallei à des fins de guerre biologique ou du bioterrorisme n’est pas connu à ce jour, même si l’union soviétique, les États-Unis et probablement l’Égypte, l’Iran, la Corée du Nord et la Syrie ont tenté d’expérimenter la bactérie en tant que telle.32,33 Cependant, il a été rapporté que B.
mallei fut utilisée comme arme biologique durant la première guerre mondiale pour décimer les animaux en Europe, en Russie et aux États-Unis.34
En Octobre 2012, B. pseudomallei et B. mallei ont été ajoutées sur la liste « Tier 1 Select Agents and Toxins », par le gouvernement fédéral américain.35 Sur cette liste, sont fichés les virus, les bactéries (Tableau 1) et les toxines susceptibles d’être utilisés en tant qu’armes biologiques et de poser des problèmes majeurs pour l’agriculture et la santé publique d’un pays. De façon générale, les critères requis pour qu’un microorganisme soit répertorié sur cette liste sont : 1) l’aptitude à produire des effets dévastateurs sur la population et l’économie du pays, 2) la possibilité d’être transmis par voie aérienne, 3) le risque d’infection à faible dose, 4) le fait d’avoir déjà été utilisé ou expérimenté comme arme biologique dans le passé.
31
Rotz, D. L.; Khan, A. S.; Lillibridge, S. R.; Ostroff, S. M.; James M. Hughes, J. M. Emerg. Infect. Dis. 2002, 8, 225.
32
Kortepeter, M.; Christopher, G.; Cieslak T.; Culpepper, R.; Darling, R.; Pavlin, J.; Rowe, J.; Mc Kee, K.; Eitzen, E. eds. USAMRIID’S Medical Management of Biological Casualties Handbook. Fort Detrick, MD : US Army Medical Research Institute of Infectious Diseases. 2001, 44.
33
Shoham, D. Nonproliferation Rev. 1998, 5, 48.
34
United States Medical Research Institute of Diseases. USAMRIID’s Medical Management of Biological Casualties. 5th edn. Fort Detrick, MD: USAMRIID, 2004.
35
Wikipédia. Select agent, [en ligne] https://en.wikipedia.org/wiki/Select_agent (Page consultée le 28 Septembre 2015).
Tableau 1 : Liste de quelques virus et bactéries répertoriés dans la liste « Tier 1 Select Agents »
Virus Bactéries Gram négatif
Ebola Francisella tularensis (tularémie) Marburg Bacillus anthracis (maladie du charbon) Smallpox et Alastrim (variole) Yersinia pestis (peste)
Rinderpest Virus (peste bovine) B. pseudomallei (mélioïdose) Food-and-mouth disease virus
(fièvre aphteuse)
B. mallei (morve)
1.1.7 Moyens diagnostiques
B. pseudomallei est un petit bacille à Gram négatif, bipolaire, très mobile grâce à ses flagelles (contrairement à B. mallei qui n’en possède pas), aérobie stricte, oxydase positif et catalase positif. Ce germe est aisément cultivable à partir de prélèvements de pus, de sang, de crachat, d’urine, de liquide pleural, de la moelle osseuse ou même d’un simple frottis de la gorge.15 La culture sur milieu sélectif de type gélose d’Ashdown permet d’obtenir un meilleur rendement et d’améliorer la rapidité du diagnostic. Des petites colonies opaques, rugueuses et pigmentées en pourpre foncé sont observées.36 Environ 90 % des spécimens poussent entre 48 et 72 h.15 Cependant, ce délai est beaucoup trop long pour détecter une maladie
potentiellement mortelle. La sérologie classique est sans valeur en pays endémique. Un test rapide permettant la détection des IgG et des IgM a été développé en Australie avec une meilleure sensibilité de l’ordre de 79 %.10 Les techniques de PCR aussi permettent un
diagnostic rapide, mais très peu ont été testées.10
B. mallei est une bactérie à Gram négatif, bipolaire, aérobie et immobile. Son isolement est quelque peu fastidieux et l’obtention de meilleures cultures nécessite l’utilisation d’un milieu bien spécifique.
1.1.8 Traitements existants
Tel que mentionné précédemment, l’une des principales caractéristiques de B. pseudomallei est sa multi-résistance effective et latente à de nombreux antibiotiques, ce qui rend donc le traitement de la mélioïdose difficile.15 Aujourd’hui encore, le traitement repose essentiellement sur l’utilisation d’antibiotiques, parfois doublement ou triplement associés à d’autres antibiotiques. La longue durée du traitement rend celui-ci très onéreux,15 surtout pour
les pays en voie de développement où la maladie sévit de façon endémique.
36
Walsh, A. L.; Smith, M. D.; Wuthiekanun, V.; Supputamongkol, Y.; Chaowagul, W.; Dance, D. A.; Angus, B.; White, N. J. Clin. Infect. Dis. 1995, 21, 1498.
Le traitement de référence est la ceftazidime37 qui permet de réduire de moitié le taux de mortalité. Comme alternative, les carbapénèmes : imipénème-méropénème sont préconisés.37 Le traitement peut être associé à l’amoxicilline-acide clavulanique (amoxiclav)
(Figure 5). La ceftazidime et l’amoxicilline sont des antibiotiques bactéricides de la famille des β-lactamines. L’effet bactéricide de ces antibiotiques repose sur l’inhibition des transpeptidases nécessaires à la synthèse de la paroi cellulaire des bactéries à Gram négatif et Gram positif entrainant ainsi leur mort cellulaire. De nombreux germes sont résistants à l’amoxicilline du fait de la sensibilité de cet antibiotique aux β-lactamases produits par les bactéries. De ce fait, l’amoxicilline est parfois utilisé en association avec l’acide clavulanique, inhibiteur des β-lactamases. Cette inhibition protectrice permet ainsi à l’amoxicilline d’effectuer pleinement son effet antibiotique.
Le traitement d’entretien est le cotrimoxazole :37 10 mg/kg/j et/ou la doxycycline 4
mg/kg/j pendant 3 à 5 mois par voie orale. Le chloramphénicol peut être prescrit mais pour une durée limitée à 8 semaines.37 Chez la femme enceinte et l’enfant, un traitement par l’amoxiclav est recommandé.
En ce qui concerne la morve, aucun traitement médicamenteux vétérinaire n’est capable de guérir l’infection.14
Figure 5: Structures chimiques des antibiotiques utillisés pour le traitement de la mélioïdose
En conclusion, il n’existe pas de médicaments permettant d’acquérir une immunité durable et totale contre ces bactéries sans risque de rechute à l’issue du traitement et aucun vaccin n’est disponible ou en phase d’essais cliniques pour pouvoir immuniser les hommes et les animaux. La prévention consisterait en une meilleure connaissance des maladies, une détection et un diagnostic précoces des cas suspects. Tout ceci contribuerait à limiter le risque
37
Aubry, P.; Gaüzère, B.-A. Mélioïdose, Médécine Tropicale. [en ligne]
d’exposition aux bactéries et, par la même occasion, à réduire le taux de mortalité encore élevé aujourd’hui.
1.2 Polysaccharides de surface du genre Burkholderia
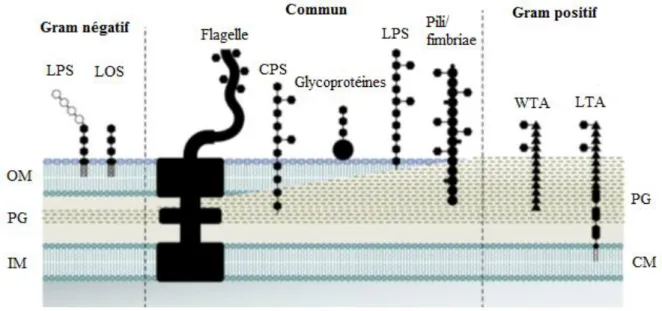
Il a été montré que B. pseudomallei et B. mallei possèdent et/ou sécrètent un certain nombre de substances qui leur donnent la possibilité de pouvoir s'attacher à la surface de la cellule-hôte, de se mouvoir grâce à leurs flagelles, de survivre, de résister et de se multiplier dans différents environnements (hôte) quand elles progressent pendant l’infection. Ces substances constituent les facteurs de virulence des bactéries. Elles comprennent les surfactants, les facteurs d’adhérence (adhésine, pili ou fimbriae), les enzymes (coagulase, hémolysine,…), les toxines (exotoxines et endotoxines) et une énorme variété structurelle de glycoconjugués surexprimés à la surface des bactéries. Les principaux glycoconjugués présents sur la paroi des bactéries Gram négatif sont les polysaccharides capsulaires (CPS), les lipopolysaccharides (LPS), les lipooligosaccharides (LOS), les exopolysaccharides (EPS) et les glycoprotéines (Figure 6).38 Contrairement aux bactéries à Gram négatif, les bactéries à Gram positif ne possèdent pas de LPS ni de LOS mais peuvent présenter des acides téichoïques (TA). Ces acides permettent au peptidoglycane (PG) de s’attacher à la membrane de la bactérie. Le PG, aussi présent chez la bactérie Gram négatif (plus fin) que chez la bactérie Gram positif (plus épais), sert d’édifice pour la fixation d’autres molécules. Les bactéries ont également en commun le flagelle, les pili, les CPS, les EPS et les glycoprotéines. Les polysaccharides de surface sont de haut poids moléculaire car ils sont constitués de quelques centaines d’unités répétitives, linéaires ou ramifiées.39
38
Tygat, H. L. P.; Lebeer, S. Microbiol. Mol. Biol. Rev. 2014, 78, 372.
39
OM : membrane externe, PG : peptidoglycane, IM : membrane interne, PG : pepdidoglycane, CM : membrane cytoplasmique, WTA : acide téichoïque cellulaire, LTA : acide lipotéichoïque.
Figure 6: Caractéristiques structurelles des bactéries Gram (+) et Gram (-)38
1.2.1 Polysaccharides capsulaires (CPS)
Les CPS sont les composants majeurs de l’enveloppe cellulaire bactérienne. Ces antigènes de surface assurent un bon nombre de fonctions biologiques incluant la résistance à la déshydratation, l’adhésion aux cellules de l’hôte et la protection contre les mécanismes du système de défense immunitaire innée/acquise de l’organisme.40 Par exemple, les CPS
forment un slime protecteur15 pour les bactéries jouant ainsi un rôle antiphagocytaire leur permettant ainsi de survivre dans les macrophages et autres cellules phagocytaires de l'hôte. Presque toutes les souches virulentes de B. pseudomallei et B. mallei, qu’elles soient d’origine humaine ou animale, expriment le même CPS à leur surface. D’un point de vue chimique, le CPS est un homopolymère de 200 kDa présentant une section peu commune de type [ →3)-2-O-acétyl-6-désoxy-β-D-manno-heptopyranose-(1→] comme unité répétitive (Figure 7).41,42
40
Bazaka, K.; Crawford, R. J.; Nazarenko, E. L.; Ivanova, E. P. Adv. Exp. Med. Biol. 2011, 715, 213.
41
Knirel, Y. A.; Paramonov, N. A.; Shashkov, A. S.; Kochetkov, N. K.; Yarullin, R. G.; Farber, S. M.; Efremenko, V. I. Carbohydr. Res. 1992, 233, 185.
42
Figure 7: Structure du CPS de B. pseudomallei et B. mallei
1.2.2 Lipopolysaccharides (LPS)
Les LPS, spécifiques des bactéries Gram négatif, sont des antigènes immunodominants, capables de stimuler la réponse immunitaire chez l’homme. Ils sont constitués de trois parties : une partie lipidique (lipide A) ancrée dans la membrane qui constitue la composante endotoxique, un polysaccharide spécifique O-antigène (LPS-AgO) exposé au milieu extérieur et constitué d’une dizaine d’unités répétitives reliées au lipide A par un oligosaccharide appelé core.39 La plupart des activités biologiques des LPS ont été associées au fragment lipidique de la molécule. Le lipide A du genre Burkholderia est composé de deux D-glucosamines liés en β-(1→6), substituées en position C–2, C–3, C–2’ et
C–3’ par une chaîne (R)-3-acyloxyacyl et/ou (R)-3-hydroxyacyl et de deux phosphates en position C–1 et C–4’ (Figure 8).43 Dans certains LPS, les phosphates anomériques sont
substitués par différents composés tels l’éthanolamine, le 4-amino-4-désoxy-β-L-arabinose (β-L-Ara4N) ou la D-galactosamine. Ces modifications covalentes contribuent à l’accroissement
de la virulence de la bactérie.43
Figure 8: Lipide A du genre Burkholderia43
43
a) Hollaus, R.; Ittig, S.; Hofinger, A.; Haegman, M.; Beyaert, R.; Kosma, P.; Zamyatina, A. Chem.-Eur. J.
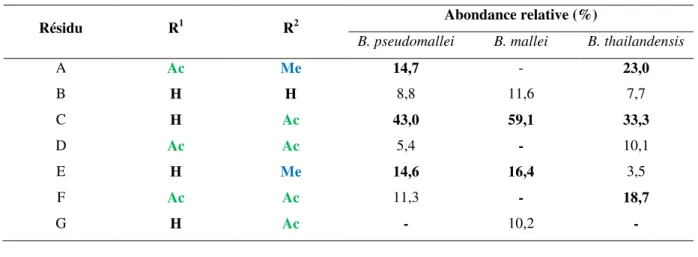
La section O-antigène de B. pseudomallei et B. mallei a été caractérisée comme étant un hétéropolymère linéaire dont l’unité répétitive est un disaccharide de type [→3)-β-D
-glucopyranosyl-(1→3)-6-désoxy- -L-talopyranose-(1→].41,42 Le résidu 6-désoxy- -L
-talopyranose peut être non substitué ou substitué par un groupe acétyle ou un groupe méthyle en position C–2; la position C–3 peut être glycosylée avec un β-D-glucopyranose ou
méthylée (à l’extrémité non réductrice pour terminer la chaîne), et enfin la position C–4 peut être non substituée ou acétylée44 (Figure 9). B. mallei ne possède pas d’acétyle en position C– 4 sur le résidu talopyranose. Par ailleurs, le LPS–AgO de B. thailandensis a exactement la même structure que B. pseudomallei (Tableau 2).45
Figure 9: Structure du LPS de B. pseudomallei
Tableau 2: Abondance relative (%) des résidus chez B. pseudomallei, B. mallei et B. thailandensis45
Résidu R1 R2 Abondance relative (%)
B. pseudomallei B. mallei B. thailandensis
A Ac Me 14,7 - 23,0 B H H 8,8 11,6 7,7 C H Ac 43,0 59,1 33,3 D Ac Ac 5,4 - 10,1 E H Me 14,6 16,4 3,5 F Ac Ac 11,3 - 18,7 G H Ac - 10,2 - 44
Heiss, C.; Burtnick, M. N.; Roberts, R, A.; Black, I.; Azadi, P.; Brett, P. J. Carbohydr. Res. 2013, 381, 6.
45
1.2.3 Les exopolysaccharides (EPS)
Les EPS jouent un rôle déterminant dans la virulence des bactéries et forment une barrière protectrice pour ces dernières. Il a été mis en évidence que ces polymères, de masse moléculaire de plus de 150 kDa, sont également exprimés de manière constitutive par toutes les souches virulentes de B. pseudomallei et de B. mallei 46. L’EPS est un hétéropolymère linéaire présentant comme unité répétitive un tétrasaccharide composé de trois galactoses et de l’acide 3-désoxy-D-manno-2-octulosonique (Kdo). Sa structure est définie comme suit :
[→3)-2-O-acétyl-β-D-galactopyranose-(1→4)- -D-galactopyranose-(1→3)-β-D
-galactopyranose-(1→5)-β-D-Kdo-(2→] (Figure 10).47,48 En 1995, Steinmetz46 a montré que le
EPS est très réactif avec le sérum des patients atteints de la mélioïdose et est exprimé par différentes souches bactériennes de B. pseudomallei. De plus, l’anticorps monoclonal IgG (mAb 3015) spécifique de l’EPS a été isolé. De manière intéressante, cet anticorps n’a montré aucune affinité avec les autres espèces du genre Burkholderia excepté avec B. mallei. Tout comme le CPS et le LPS, l’EPS semble être un candidat vaccin potentiel pour lutter contre la mélioïdose et la morve.48,49 Il est important de noter que cet EPS a également été identifié chez la souche E0147 de la bactérie B. oklahomensis (pathogène pour l’homme)50 tout comme
chez quatre autres espèces du complexe B. cepacia (Bcc) qui sont : B. ambifaria, B. cepacia, B. dolosa et B. stabilis.51,52 Les patients atteints de la mucoviscidose sont facilement exposés aux infections à Bcc, connues sous le nom du syndrome de Cepacia. Cette maladie entraîne une mort rapide des patients infectés dans 20 % des cas. À ce jour, aucun vaccin n’est commercialement disponible pour prévenir des infections à Bcc.53 Notre équipe a récemment rapporté la synthèse de l’unité répétitive de cet EPS.54
46
Steinmetz, I.; Rohde, M.; Brenneke, B. Infect Immun.1995, 63, 3959.
47
Masoud, H.; Ho, M.; Schollaardt, T.; Perry, M. B. J. Bacteriol. 1997, 179, 5663.
48
Nimtz, M.; Wray, V.; Domke, T.; Brenneke, B.; Häussler, S.; Steinmetz, I. Eur. J. Biochem. 1997, 250, 608.
49
Steinmetz, I.; Reganzerowski, A.; Brenneke, B.; Häussler, S.; Simpson, A.; White, N. J. J. Clin. Microbiol.
1999, 37, 225. 50
Stone, J. K.; Heiss, C.; Wang, Z.; Black, I.; Grasso, S. A.; Koppisch, A. T.; Azadi, P.; Keim, P.; Tuanyok, A. Carbohydr. Res. 2014, 386, 68.
51
Cescutti, P.; Impallomeni, G.; Garozzo, D.; Sturiale, L.; Herasimenka, Y.; Lagatolla, C.; Rizzo, R. Carbohydr. Res. 2003, 338, 2687.
52
Cuzzi, B.; Herasimenka, T.; Silipo, A.; Lanzetta, R.; Liut, G.; Rizzo, R.; Cescutti, P. PLoS One 2014, 9, e94372.
53
Choh, L. C.; Ong, G. H.; Vellasamy, K. M.; Kalaiselvam, K.; Kang, W. T.; Al-Maleki, A. R.; Mariappan, V.; Vadivelu, J. Front. Cell. Infect. Microbiol. 2013, 3, 1.
54
Laroussarie, A.; Barycza, B.; Andriamboavonjy, H.; Tamigney Kenfack, M.; Blériot, Y.; Gauthier, C. J. Org.
Figure 10: Structure de l’EPS de B. pseudomallei
1.3 Vaccins expérimentaux contre la mélioïdose et la morve
Face à la difficulté à obtenir des résultats satisfaisants pour s’immuniser durablement contre les infections à Burkholderia, principalement due à la résistance des germes à un grand nombre d’antibiotiques, au mode de contamination par voie respiratoire et à l’utilisation de ces bactéries comme armes biologiques, le meilleur moyen de protéger les hommes (et les animaux) reste le développement de vaccins efficaces. Une étude réalisée en Thaïlande révèle que, parmi la grande majorité d’enfants testés séropositifs à la mélioïdose, aucun d’entre eux ne développaient la maladie.55 Ceci dénote l’existence d’une immunité naturellement acquise ouvrant donc la possibilité de développer des vaccins contre la mélioïdose. De ce fait, plusieurs vaccins expérimentaux ont été testés chez la souris et le singe. Il s’agit de vaccins issus de bactéries atténuées et de bactéries désactivées par la chaleur et de vaccins sous-unitaires à base de protéines ou de polysaccharides conjugués ou non.
1.3.1 Vaccins basés sur les bactéries atténuées (mutantes)
Ce type de vaccin est encore largement utilisé aujourd’hui pour prévenir des infections telles que le choléra, la tuberculose, les oreillons et la rougeole. Le principe repose sur l’atténuation (voir l’annulation) de l’agressivité de l’agent infectieux soit par des cultures en série, soit par passage sur culture cellulaire, par réassortiment ou par délétion génétique. L’avantage des vaccins à base de bactéries mutantes est qu’ils induisent très souvent une immunité à long terme, voir à vie. En ce qui concerne la mélioïdose, plusieurs souches bactériennes mutantes de B. pseudomallei ont été testées sur les souris. Les résultats obtenus ont révélé, d’une part, que les bactéries demeuraient présentent dans les organes (pas de
55
Kanaphun, P.; Thirawattanasuk, N.; Suputtamongkol, Y.; Naigowit, P.; Dance, D. A.; Smith, M. D.; White, N. J. J. Infect. Dis. 1993, 167, 230.
protection) et, d’autre part, que seule une protection partielle était observée.56,57,58,59 Dans une autre étude, Garcia-Quintanilla et al.60 ont mis au point un vaccin glycoconjugué recombinant pour l’évaluation de son potentiel immunogène et protecteur. La particularité de leur méthode réside dans le fait que le glycoconjugué est obtenu biosynthétiquement en exploitant le processus de N-glycosylation de la bactérie E. coli mutée, en présence d’une enzyme. En effet, le couplage covalent du LPS de B. pseudomallei à une protéine accepteur (AcrA) par l’oligosaccharyltransférase de la bactérie Campylobacter jejuni (OTase) au sein d’une souche mutée de E. coli a permis d’obtenir le glycoconjugué LPS-AcrA N-lié recombinant. Ce glycoconjugué inoculé dans les souris par voie intrapéritonéale (i.p.) a généré une réponse immunitaire IgG, et une protection partielle a été observée après infection par la bactérie B. pseudomallei par voie intranasale. De même, Moustafa et al.61 ont utilisé la bactérie Salmonella enterica serovar Typhimurium de la souche SL3261 mutée qui exprime le LPS– AgO de B. pseudomallei et B. mallei pour étudier son pouvoir protecteur sur des modèles murins infectés par B. thailandensis E264 par voie intranasale. Cette étude a montré que toutes les souris immunisées avec la souche recombinante SL3261 ont développé des anticorps spécifiques anti-LPS–AgO de B. pseudomallei, B. mallei et de B. thailandensis. De plus, une protection significative contre la mélioïdose et la morve a été observée chez ces souris. Une autre étude a montré que les souris immunisées avec des souches mutantes de B. mallei étaient partiellement immunisées.62
1.3.2 Vaccins basés sur les bactéries désactivées
Les bactéries sont inactivées (ou tuées) généralement sous l’effet d’un produit chimique ou par la chaleur. Les vaccins inactivés sont utilisés pour la prévention des maladies telles que le tétanos, la diphtérie, la poliomyélite et la coqueluche. Ce type de vaccin est relativement facile et moins cher à produire, et tout comme le vaccin atténué, l’immunité
56
Atkins, T.; Prior, R.; Mack, K.; Russell, P.; Nelson, M.; Prior, J.; Oyston, P. C.; Dougan, G.; Titball, R. W. J. Med. Microbiol. 2002, 51, 539.
57
Cuccui, J.; Easton, A.; Chu, K. K.; Bancroft, G. J.; Oyston, P. C.; Titball, R. W.; Wren, B. W. Infect. Immun.
2007, 75, 1186. 58
Rodrigues, F.; Sarkar-Tyson, M.; Harding, S. V.; Sim, S. H.; Chua, H. H.; Lin, C. H.; Han, X.; Karuturi, R. K.; Sung, K.; Yu, K.; Chen, W.; Atkins, T. P.; Titball, R. W.; Tan, P. J. Bacteriol. 2006, 188, 8178.
59
Atkins, T.; Prior, R. G.; Mack, K.; Russell, P.; Nelson, M.; Oyston, P. C.; Dougan, G.; Titball, R. W. Infect. Immun. 2002, 70, 5290.
60
Garcia-Quintanilla, F.; Iwashkiw, J. A.; Price, N. L.; Stratilo , C.; Feldman, M. F. Font. Microbiol. 2014, 5, 1.
61
Moustafa, D. A; Scarff, J. M.; Garcia, P. P.; Cassidy, S. K. B.; DiGiandomenico, A.; Waag, D. M.; Inzana, T. J.; Goldberg, J. B. PLoS One 2015, DOI:10.1371/journal.pone.0132032.
62
Bandara, A. B.; Deshazer, D.; Inzana, T. J.; Sriranganathan, N.; Schurig, G. G.; Boyle, S. M. Microb. Pathog.
acquise peut s’étendre sur plusieurs années.63 Les études menées par Sarkar et al.64 ont montré
que les souches désactivées par la chaleur de B. pseudomallei induisaient chez les souris une réponse immunitaire protectrice à 60 % contre la mélioïdose. De même, les souches désactivées de B. thailandensis déclenchent une protection semblable à celle de B. pseudomallei.65 Concernant la morve, une réponse immunitaire protectrice significative induite par les souches désactivées de B. mallei a été observée lorsque les souris ont été vaccinées par voie i.p.66
1.3.3 Vaccins basés sur les polysaccharides de surface
Les polysaccharides (CPS, LPS ou EPS) exposés à la surface des bactéries pathogènes font l’objet aujourd’hui d’un regain d’intérêt dans le cadre de la mise en place de nouvelles stratégies visant à développer des vaccins efficaces contre les infections de diverses origines (bactéries, virus, parasites et champignons). Tel que souligné plus haut, ces polysaccharides de surface sont reconnus comme étant des facteurs de virulence chez B. pseudomallei et B. mallei, car ils jouent un rôle clé dans les interactions hôte-pathogène.39 De plus, de récentes études ont montré qu’ils induisent la production d’anticorps spécifiques et protecteurs chez l’homme.67 En effet, des anticorps anti-LPS ont été trouvés chez des patients qui ont survécu
à la mélioïdose.68 Ainsi les CPS, LPS et EPS apparaissent comme étant de potentiels vaccins candidats pouvant servir à prévenir la mélioïdose et la morve.
1.3.3.1 Vaccins de première génération (polysaccharides)
Dans les années 80, certains vaccins à base de CPS purifiés à partir de cultures bactériennes ont vu le jour : ce sont les vaccins de premières génération. Ils sont encore largement utilisés aujourd’hui chez les adultes et enfants en bas âge.39 C’est le cas du vaccin
tétravalent contre les méningites à Neisseria meningitidis sérogroupes A, C, Y et W135 composés des quatre polysaccharides capsulaires purifiés qui fut commercialisé dès 1982
63
Peacock, S. J.; Limmathurotsakul, D.; Lubell, Y.; Koh, G. C.; White, L. J.; Day, N. P.; Titball, R. W. Trop Dis. 2012, 6, e1488.
64
Sarkar-Tyson , M.; Thwaite, J. E.; Harding, S. V.; Smither, S. J.; Oyston, P. C.; Atkins, T. P.; Titball, R. W. J. Med. Microbiol. 2007, 56, 1005.
65
Sarkar-Tyson, M.; Smither, S. J.; Harding, S. V.; Atkins, T. P.; Titball, R. W. Vaccine 2009, 27, 4447.
66
Whitlock, G. C.; Lukaszewski, R. A.; Judy, B. M.; Paessler, S.; Torres, A. G.; Estes, D. M. BMC Immunol. 2008, 9, 55.
67
Mond, J. J.; Lees, A.; Snapper, C. M. Annu. Rev. Immunol. 1995, 13, 655.
68
Charuchaimontri, C.; Suputtamongkol, Y.; Nilakul, C.; Chaowagul, W.; Chetchotisakd, P.; Lertpatanasuwun, N.; Intaranongpai, S.; Brett, P. J.; Woods, D. E. Clin. Infect. Dis. 1999, 29, 813.
(Figure 11).69 C’est aussi le cas du vaccin contre la fièvre typhoïde, composé du CPS de Salmonella enterica sérotype Typhi, commercialisé en 1989. Il a été observé que ces vaccins sont antigènes T indépendants, i.e. qu’ils activent les cellules B sans mobiliser l’immunité cellulaire. De ce fait, l’immunité est uniquement dirigée par la production d’IgM reconnaissants les antigènes saccharidiques.39 Cependant, les vaccins polysaccharidiques de génération I présentent certaines limites : ils sont non immunogènes chez les enfants de moins de 3 ans, les personnes âgées et les sujets qui présentent des déficiences immunitaires. Leur succès limité (études et vaccins) est principalement dû à l’absence de stimulation des lymphocytes T.
Figure 11: Polysaccharides capsulaires de quelques bactéries pathogènes69
Une étude menée par Nelson et al.70 a montré que des souris BALB/c vaccinées avec le LPS ou le CPS des souches NCTC 4845 de B. pseudomallei présentent un taux de survie plus élevé. Celles injectées avec le LPS ont produit majoritairement des anticorps spécifiques IgM et IgG3 avec un taux de survie de 80 % tandis que, chez les souris qui ont été vaccinées avec le CPS, des anticorps IgG2b ont été détectés avec une réponse immunitaire protectrice moyenne estimée à 40 %. Au terme de cette étude, il en ressort que le LPS offre une meilleure protection comparé au CPS. Ngugi et al.71 ont récemment démontré que chez les souris
immunisées avec le LPS des souches E264 de B. thailandensis, la protection immunitaire était similaire à celles immunisées par le LPS de B. pseudomallei. Bien que B. thailandensis soit non pathogène chez l’homme, des résultats satisfaisants ont montré que cette bactérie est
69
Astronomo, R. D.; Burton, D. R. Nat. Rev. Drug Discov. 2010, 9, 308.
70
Nelson, M.; Prior, J. L.; Lever, M. S.; Jones, H. E.; Atkins, T. P.; Titball. R. W. J. Med. Microbiol. 2004, 53, 1177.
71
Ngugi, S. A.; Ventura, V. V.; Qazi, O.; Harding, S. V.; Kitto, G. B.; Estes, D. M.; Dell, A.; Titball, R. W.; Atkins, T. P.; Brown, K. A.; Hitchen, P. G.; Prior, J. L. Vaccine 2010, 28, 7551.
capable d’induire une immunité protectrice contre la mélioïdose chez les souris. Scott72 a
montré que la souche E555 de B. thailandensis, mutée pour exprimer la capsule manno-heptose similaire à celle de B. pseudomallei K96243, offrait une meilleure protection et efficacité comparée à la souche CDC2721121 de B. thailandensis ne possédant pas cette capsule antigénique. En effet, l’immunisation des souris avec les souches E555 et CDC2721121 a montré une production d’anticorps IgG plus élevée dans le sérum des souris E555 (34 ng/mL) que dans celui des souris CDC2721121 (5,7 ng/mL). Par la suite, le test de protection a été réalisé après infection des souris par voie i.p. avec B. pseudomallei (souche K96243). Il a été montré que l’immunisation des souris avec E555 induisait une meilleure protection, au bout de 35 jours, que celle des souris immunisées avec CDC2721121. Ce résultat observé fut attribué à la présence de la capsule antigénique manno-heptopyranose qui est une molécule immunogène et un facteur clé de virulence72 chez les bactéries telles que B. pseudomallei. Dans une autre étude, une série d’anticorps monoclonaux qui reconnaissent le CPS, le LPS ou des protéines virulentes de B. pseudomallei a été évaluée in vivo. Il s’agissait de déterminer le potentiel protecteur de ces anticorps sur des souris vaccinées par voie i.p avec des souches virulentes de B. pseudomallei.73 Il en résulte que seuls les anti-CPS présentent une bonne réponse immunitaire protectrice avec un taux de survie élevé.
1.3.3.2 Vaccins de deuxième génération (glycoconjugués)
Les vaccins de première génération peuvent être considérés comme étant des haptènes, i.e. des antigènes incomplets pas assez ou non immunogènes. Un haptène (du grec haptein, « se fixer à ») est une molécule qui, seule, est incapable de susciter une réponse immunitaire mémoire (IgG) mais qui, associée ou chimiquement couplée à une macromolécule biologique ou synthétique qui lui sert de porteur, pourra induire une telle réponse. Ainsi, la conjugaison covalente de CPS purifiés à une protéine immunogène porteuse (BSA, TT, KLH, CRM-197, …) est une approche prometteuse car elle leur confère les propriétés d’antigènes T dépendants. Il en résulte une coopération efficace entre les lymphocytes T et les lymphocytes B induisant ainsi la production d’immunoglobulines d’isotype G (IgG) et A (IgA ) avec une grande affinité pour l’antigène polysaccharidique (réponse mémoire immunitaire accrue).39 Ils
constituent donc les vaccins de deuxième génération ou vaccins glycoconjugués. Ce type de vaccin a par exemple révolutionné la prévention des méningites à Haemophilus influenzae de
72
Scott, A. E.; Laws, T. R.; D’Elie, R. V.; Stokes, M. G. M.; Nandi, T.; Williamson, D. E.; Tan, P.; Prior, J. L.; Atkins, T. P. Clin. Vaccine Immunol. 2013, 20, 1041.
73
type b chez les enfants, et trois des quatre vaccins monovalents développés ont été autorisés pour une administration dès l’âge de deux mois. Le Prevnar, un vaccin heptavalent où chaque CPS est conjugué de façon indépendante sur une protéine porteuse, préconisé pour la prévention des infections à pneumocoques (Streptococcus pneumoniae), a été commercialisé en 2000. Depuis, plusieurs autres vaccins de seconde génération ont été développés et commercialisés (Tableau 2).69 S’agissant des vaccins glycoconjugués à base de LPS ou EPS,
aucun vaccin n’a encore été commercialisé,39 mais plusieurs sont à l’étude. Tableau 2 : Exemples de quelques vaccins glycoconjugués commercialisés69
Bactéries Vaccins Laboratoires pharmaceutiques
Haemophilus influenzae type b (Hib)
Polysaccharide glycoconjugué
avec l’anatoxine tétanique (TT) Sanofi Pasteur (Act HIB), GlaxoSmithKline Biologicals (Hiberix)
Hib conjugué (à la protéine à
méningocoque) Merck & Co (PedvaxHIB) Hib conjugué (à la protéine à
méningocoque) et vaccin à base de l’Hépathite B (recombinée)
Merck & Co (Comvax))
Neisseria meningitidis A, C, et W-135
Polysaccharide à méningocoque conjugué à DT
Sanofi Pasteur (Menactra) Polysaccharide à méningocoque Sanofi Pasteur
(Menamune-A/C/Y/W-135) Salmonella typhi Polysaccharide capsulaire de
l’antigène Vi Sanofi Pasteur (TYPHIM Vi) Streptococcus pneumoniae 4, 6B,
9V, 14, 18C, et 23F
Polysaccharide à pneumocoque, 7-antigènes capsulaires conjugué avec CRM197
Wyeth Pharmaceuticals (Prevnar)
Streptococcus pneumoniae 1 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19F, 19A, 20, 22F, 23F, et 33F
Polysaccharide à pneumocoque,
23-antigènes capsulaires Merck & Co (Pneumovax 23)
Afin de développer des vaccins candidats efficaces contre la mélioïdose et la morve, plusieurs études ont été menées pour évaluer le potentiel immunogène et protecteur des antigènes CPS et LPS de B. pseudomallei conjugués à une protéine porteuse. Brett74,75 a réalisé des tests d’immunogénicité et de protection avec le CPS glycoconjugué. Au cours de la première étude, le CPS purifié de B. pseudomallei a été couplé à une protéine porteuse cationique, la bovine serum albumine (cBSA). La réaction chimique de couplage est une amination réductrice après activation de l’extrémité réductrice du polysaccharide par NaIO4
pour former l’aldéhyde correspondant. L’imine obtenu est réduit en présence de NaBH3CN
74
Burtnick, M. N.; Heiss, C.; Roberts, R. A.; Schweizer, H. P.; Azadi, P.; Brett, P. Front. Cell. Infect. Microbiol.
2012, 2, 108. 75
Scott, A. E.; Burtnick, M. N.; Stokes, M. G.; Whelan, A.O.; Williamson, E.D.; Atkins, T. P.; Prior, J. L.; Brett, P. J. Infect. Immun. 2014, 82, 3206.