Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR de médecine et de pharmacie
Laboratoire Inflammation, tissus épithéliaux et cytokines - LITEC (Poitiers) (Diplôme National - Arrêté du 7 août 2006)
École doctorale : Biologie-santé - Bio-santé (Limoges) Secteur de recherche : Biologie, médecine, santé
Présentée par : Hanitriniaina Rabeony
Étude de l'implication des cytokines dans l'inflammation cutanée et application à l'identification de cibles thérapeutiques
pertinentes Directeur(s) de Thèse : Franck Morel, Jean-Claude Lecron Soutenue le 13 mai 2014 devant le jury Jury :
Président Bernhard Ryffel Directeur de recherche CNRS, Orléans Rapporteur Frédéric Blanchard Chargé de recherche, INSERM de Nantes Rapporteur Khaled Ezzedine Professeur associé, INSERM de Bordeaux Membre Franck Morel Professeur des Universités, Université de Poitiers Membre Jean-Claude Lecron Professeur des Universités, Université de Poitiers Membre François-Xavier Bernard Président de "BIOalternatives", Gençay
Pour citer cette thèse :
Hanitriniaina Rabeony. Étude de l'implication des cytokines dans l'inflammation cutanée et application à l'identification de cibles thérapeutiques pertinentes [En ligne]. Thèse Biologie, médecine, santé. Poitiers : Université de Poitiers, 2014. Disponible sur l'Intranet de l'Université de Poitiers <http://theses.univ-poitiers.fr>
THESE
pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
Faculté de Médecine et Pharmacie
(Diplôme National - Arrêté du 7 août 2006)
École Doctorale : BioSanté N°524
Champ disciplinaire : Biologie, Médecine, Santé
Secteur de Recherche : Aspects moléculaires et cellulaires de la biologie
ETUDE DE L’IMPLICATION DES CYTOKINES DANS
L’INFLAMMATION CUTANÉE
ET
APPLICATION À L’IDENTIFICATION DE CIBLES
THÉRAPEUTIQUES PERTINENTES
Présentée par :
HANITRINIAINA RABEONY
Directeurs de Thèse : Pr Franck MOREL et Pr Jean-Claude LECRON
Soutenue le 13 mai 2014,
devant la Commission d’Examen du Jury :
Rapporteurs :
Dr F. BLANCHARD
DR2 HDR, INSERM Nantes
Pr K. EZZEDINE
PU-PH HDR, INSERM Bordeaux
Examinateurs :
Dr B. RYFFEL
DR1, CNRS Orléans
Dr F.X. BERNARD
Directeur Bioalternatives, Gençay
Pr. J.C. LECRON
PU-PH, Poitiers
Remerciements
Ce travail de thèse a été effectué au sein du Laboratoire Inflammation, Tissus Épithéliaux et Cytokines (LITEC, EA4331) dirigé par le Pr. Jean-Claude Lecron. Au terme de ce travail,
c’est avec émotion que je tiens à remercier tous ceux qui, de près ou de loin, ont contribué à la
réalisation de ce projet.
Je remercie chaleureusement le Dr F. Blanchard et le Pr K. Ezzedine d’avoir fait l’honneur
d’être rapporteurs de ce travail et de le juger. Veuillez trouver ici l’expression de ma
gratitude.
Je remercie le Dr B. Ryffel d’avoir accepté d’évaluer mon travail. Je vous remercie infiniment
de votre forte implication dans la réflexion du projet IL-1 et de m’avoir accueilli au sein de
votre laboratoire pour la réalisation des travaux y afférents.
Je remercie le Dr F.X. Bernard d’avoir également accepté de juger mon travail. Je vous suis
reconnaissant pour les aides que vous et votre équipe m’avez apportées notamment sur le
projet kératinocytes et différenciation. Outre la recherche, je garderai aussi les bons moments passés au Croisic où je vous ai laissé gagner au babyfoot !
Je tiens à remercier tout particulièrement mon directeur de thèse, Franck Morel. Je vous
remercie de m’avoir proposé ce projet de thèse car nous nous sommes rencontrés sur une circonstance particulière qui m’a amené à prendre une décision dont je n’ai jamais regretté.
Ces quelques phrases ne suffiront pas à témoigner combien je vous suis reconnaissant pour le
soutien et la confiance que vous m’avez accordés. J’ai grandi chaque jour
professionnellement et personnellement à vos cotés; merci pour vos conseils, votre
disponibilité, votre compréhension tout le long de cette aventure. Je garderai dans mon cœur
votre générosité et votre amabilité.
Un grand merci à mon co-directeur de thèse et Directeur du laboratoire LITEC, Mr Lecron,
pour m’avoir accueilli et permis de réaliser ce travail dans les meilleures conditions. Je vous
remercie d’avoir eu confiance en moi et de m’avoir encadré. La manière dont vous gérez et vous investissez corps et âme pour le Litec représente pour moi une source permanente de motivation. Merci pour votre soutien en ayant toujours su valoriser mon travail et vos précieux conseils dans mes moments de stress notamment au cours de la dernière phase de rédaction car vous avez toujours su trouver les bons mots.
A Philippe Vasseur ou encore « el chico », mon premier « collaborateur » et bien plus
(j’épargne les détails). C’est grâce à l’imiquimod que notre destin s’est croisé. Nous sommes devenu les Rois du rasage et d’application d’IMQ. On a découvert ensemble certaines manip maudites qu’on a vaincu. C’était vraiment agréable de travailler avec toi et apprendre à deux à
voir la biologie moléculaire autrement, on sait tous « par avance » que l’IMQ induit un Ct de
β8 pour l’IL-βγ, n’est-ce pas ? Merci pour avoir identifié les tubes notés « A.R » pendant des
heures les vendredis après-midi et dans la bonne humeur ; et de préparer les fameuses
« étiquettes », je t’en suis reconnaissant. Par ailleurs je sais qu’en ce moment tu penses à J6
VAS2 dont on connaît son devenir. Je te souhaite de réussir pleinement ton projet.
A Jean-François Jégou, merci pour les précieuses aides techniques et de m’avoir montré la
manipulation des souris. Tu as fait en sorte de me récupérer des heures d’enseignements pour
me laisser du temps libre afin de terminer la rédaction de ma thèse et j’en suis très reconnaissant. J’ai une pensée toute particulière à nos discussions entre papa.
A Isabelle PARIS, je te remercie de m’avoir initié à la manipulation des souris. Malgré ton
emploi du temps chargé, tu as toujours été disponible pour m’aider dans mes manips souris
(week-end compris) et je t’en suis très reconnaissant. Je regrette déjà tes « Aina fais du sport
… Aina arrêtes de grignoter… » et je te remercie même si je suis un cas désespéré. Merci
pour les supers cadeaux destinés à mon fils déposés à mon bureau. Je ne te remercierai jamais assez de tout ce que tu as fait à mon épouse.
A Laure Favot, merci pour ta gentillesse, pour tes conseils de maman et tes innombrables
cadeaux pour mon fils. J’ai une pensée toute particulière à ce jour de 4 janvier β011 où tu m’as grondé car « c’est déjà à γcm et qu’est-ce que tu fais au labo ??? Vas rejoindre ta femme… ». C’est grâce à toi que j’ai appris toutes les bonnes astuces pour bébé et tes petites
phrases restent à jamais dans mes pensées : « Aina, il faut le laisser dormir tout seul, tu
appliques cette crème, c’est maintenant qu’il faut lui apprendre la propreté… » Bref tu as été
ma conseillère particulière dans le labo.
J’exprime mes remerciements aux membres du LITEC pour leur aide et leur disponibilité, à
Adriana pour ton aide technique en ELISA, à Thierry qui a toujours été là pour résoudre les
problèmes techniques, à Sandrine qui fait régner la loi sur paillasse et merci de m’avoir initié
dans le labyrinthe de la RT-qPCR et je suis très heureux pour toi et Jonathan car une nouvelle vie pleine de surprise vous attend dorénavant !
Merci également à toute l’équipe microbiologie du LITEC pour leur convivialité, Christophe,
à Julie, à Hristo et à Nicolas, à Martine et à Charles (pour ces discussions scientifiques ou pas
et tu sais que j’ai une pensée toute particulière pour toi tous les 17 févriers)
A Elodie Couderc, félicitations pour ta thèse, merci pour ta collaboration et je te souhaite plein de réussite pour ton projet futur.
A Mathilde Pohin, ma petite sœur, ma première stagiaire devenue doctorant au labo. Tu
emmènes de la joie dans le labo par ton dynamisme, je regrette déjà nos discussions sur la passerelle (scientifique ou pas). Merci pour les petites réunions secrètes dans notre bureau et ta bonne humeur même quand tu laisses tomber ton unique suspension cellulaire par terre ! Je te souhaite de réussir pleinement dans ton projet.
A Pascale Mustapha, mon ancien colocataire du bureau, merci pour tes conseils, tu as été mon
premier compagnon de galère. Merci pour les mots libanais que tu m’as appris, à ces « C… de
manips » un vendredi après-midi, je souhaite que ton projet aboutisse. Tes mots trônent
toujours sur le mur de mon bureau et je suis fier de t’avoir connu.
À mes collègues de l’IBMIG, merci à Jacques Frères, Yann Héchard, Jean-Marc Berjeaud,
Julien Verdon et Mohamad Koubar. Je remercie tout particulièrement Mohamad « Momo »,
(si tu as l’occasion de lire ces quelques phrases) pour ton optimisme invincible, j’ai emmené avec moi en thèse ta méthode lors de mon Mβ et j’en suis fier. Je ne t’oublierai jamais.
Je remercie également Renaud Bigot, mon compagnon de galère, pour tes conseils dans
l’enseignement de la microbiologie et tes plaisanteries de plus ou moins de mauvais goût. Je
te souhaite avant tout la santé et que ton projet se réalise !
Merci à tous les thésards croisés durant ma thèse, Mahmoud, Sylvain, Nicolas, Djamel, Clémence, Émilie et tous ceux que je pourrai oublier. A Mahmoud, merci pour ces moments
de complicité qui n’appartiennent qu’à nous. À Djamel, tu sais à quel point je t’admire car tout n’a pas été facile pour toi.
Je tiens à remercier ma famille, en particulier mes parents. A mon père, je te dédie cette thèse
car je sais que ton rêve était d’assister à ma soutenance mais ta santé a décidé autrement et tu
ne pourras pas venir. Merci papa pour ton amour, pour tes conseils et pour ton soutien malgré
la distance. Merci à ma chère maman, je te répète toujours qu’il y a une différence entre
docteur en biologie et « médecin qui soigne ». Merci à mon grand frère, tu as toujours pris soin de moi-même en étant éloigné.
Enfin je remercie ma petite femme, Bellinda, qui a toujours été d’un immense soutien. Je te remercie de t’être occupé de Nathaniel et de moi pendant ces dures années de thèse, de m’avoir attendu toutes ces soirées où les manips ne semblent jamais finir et surtout merci
Abréviations
A
ACTB Actine
APRIL A Proliferation Inducing Ligand
ASC Apoptosis-associated Speck-like protein Containing
B
B2M -2microbulin
BAFF B Cell Activating Factor
BSA Body and Severity Index
C
CANP Calcium-Activated Neutral Protease
CARD Caspase Recruitment Domain
CK Cytokératine
CLA Cutaneous Lymphocyte-associated Antigen
CLC Cardiotrophin-like Cytokine
CMH Complexe Majeur d’Histocompatibilité
CNTF Ciliary Neurotrophic Factor
D
DC Cellule Dentritique
DLQI Dermatology Life Quality Index
DTT Dithitréitol
E
EDA Ectodysplasin A
EDTA acide Ethylène Diamine Tétra-Acétique
EGF Epidermal Growth Factor
ERK Extracellular signal-Regulated Kinases
F
FCAS Familial Cold Autoinflammatory Syndrome
FPRL Formyl Peptide Receptor-like
GAPDH Glycéraldéhyde-3-phosphate Déshydrogénase
H
HBD Human Beta Defensin
hCAP Human Cathelicidin Antimicrobial Protein
HD Human Defensin
HLA Human Leukocyte Antigen
HNP Human Neutrophil Defensin
I
IFN Interféron
IGF Insulin-like Growth Factor
IL Interleukine
IMQ Imiquimod
IRAK IL-1R-Associated Kinase
IRF Interferon Regulatory Factor
ISGF IFN-Stimulated Gene Factor
J
JAK Janus tyrosine Kinase
JDE Jonction Dermo-Épidermique
JNK c-Jun N-terminal Kinase
K
KGF Keratinocyte Growth Factor
KIF Filaments Intermédiaires de Kératine
L
LC Cellules de Langerhans
LCE Late Cornified Envelope
LIF Leukemia Inhibitory Factor
LPS Lipopolysaccharide
LRR Leucine-Rich Repeat
LTh Lymphocytes T helper
M
MAPK Mitogen-Activator Protein Kinase
MIP Macrophage Inflammatory Protein
MMP Métalloprotéinases Matricielles
MyD88 Myeloid Differentiation factor 88
N
NACTH Nucleotide-binding and oligomerisation
NALP NACHT-, LRR- and PYD- containing proteins
NFκB Nuclear Factor kappa B
NHEK Natural Human Epidermal Keratinocyte
NK Natural Killer
NLRP Nod like receptor containing a PYRIN
NLRs NOD-like Receptors
NLS Nuclear Localization Sequence
NOD Nucleotide-binding Oligomerization Domain
NP Neuropoïétine
O
OSM Oncostatine M
P
PAMPs Pathogen Associated Molecular Patterns
PASI Psoriasis Activity and Severity Index
PBS Phosphate Buffer Saline
R
RAGE Receptor for Advanced Glycation End Products
RANKL Receptor Activator of NF-B Ligand
RANTES Regulated upon Activation, Normal T cell Expressed and Secreted
RHE Reconstituted Human Epidermis
S
SCID Severe Combined ImmunoDeficiency
SPRR Small Proline Rich Protein
STAT Signal Transducer and Activator of Transduction
SVF Sérum de Veau Fœtal
T
TACE TNF- Converting Enzyme
Tgases Transglutaminases
TGF Transforming Growth Factor
TLR Toll-Like Receptor
TNF Tumor Necrosis Factor
TRAF TNFR-Associated Factor
TRAIL TNF-Related Apoptosis Inducing Ligand
TWEAK TNF-Related Inducer Of Apotosis
U
UV Ultraviolet
V
VAS Vaseline
VEGF Vascular Endothelial Growth Factor
Sommaire
INTRODUCTION ... 1
CHAPITRE I : le système cutané ... 1
1. L’épiderme ... 1
1.1. Les kératinocytes ... 2
1.2. Les marqueurs associés à l’adhésion et à la différenciation des kératinocytes 4 1.2.1. Les cytokératines ... 4
1.2.2. Les protéines d’adhésion ... 6
1.2.3. Les intégrines ... 10 1.2.4. La filaggrine ... 10 1.2.5. La loricrine ... 12 1.2.6. L’involucrine ... 12 2. La jonction dermo-épidermique ... 12 3. Le derme ... 13 4. L’hypoderme ... 13
5. Les cellules immunitaires cutanées ... 14
5.1. Généralités ... 14
5.2. Les kératinocytes ... 15
5.3. Les cellules de Langerhans ... 15
5.4. Les cellules dendritiques du derme ... 16
5.5. Les lymphocytes T ... 16
5.6. Les fibroblastes ... 17
5.7. Les mastocytes ... 17
CHAPITRE II : les effecteurs innés de la défense cutanée ... 18
1. Les peptides antimicrobiens ... 18
1.1. LL-37... 20 1.2. Les défensines ... 21 1.2.1. Généralités ... 21 1.2.2. HBD1 ... 23 1.2.3. HBD2 ... 23 1.2.4. HBD3 ... 24 1.3. La famille des S100... 25 1.3.1. Généralités ... 25 1.3.2. S100A7 ... 29 1.3.3. S100A15 (S100A7A) ... 30 1.3.4. S100A8/S100A9 ... 31 2. Les chimiokines ... 32 2.1. Généralités et nomenclature ... 32
2.2. Les chimiokines de la famille CXCL dans le système cutané ... 36
2.3. Les chimiokines de la famille CCL dans le système cutané ... 38
CHAPITRE III : Le psoriasis ... 40
1. Généralités ... 40
2. Caractéristiques histologiques et cliniques du psoriasis ... 41
3. Les infiltrats leucocytaires présents dans les lésions psoriasiques ... 43
4. Rôles des cytokines proinflammatoires dans les lésions psoriasiques ... 46
4.1. L’axe Th IFN- γ/TNF ... 47
4.1.1. Les cytokines de la famille de l’IFN ... 47
4.2.1. L’IL-23 ... 51 4.2.2. L’IL-17A ... 53 4.2.3. L’IL-22 ... 56 4.3. La famille de l’IL-6 ... 63 4.3.1. Généralités ... 63 4.3.2. Oncostatine M ... 65
4.4. Les cytokines de la famille de l’IL-1 ... 67
4.4.1. Généralités ... 67
4.4.2. L’IL-1α ... 70
4.4.3. L’IL-1 ... 71
4.4.3.1. Généralités ... 71
4.4.3.2. Maturation de l’IL-1dépendante de l’inflammasome ... 72
4.4.3.2.1. Les « Toll-Like Receptors » (TLRs) ... 72
4.4.3.2.2. Les « Nod-Like Receptors » NLRs et l’inflammasome NLRP 3... 73
4.4.4. L’IL-1α et L’IL-1 dans la physiopathologie du psoriasis ... 76
4.4.5. L’IL-36 ... 77
5. Immunopathogenèse du psoriasis ... 78
6. Traitements ... 80
CHAPITRE IV : Modèles de psoriasis ... 85
1. Modèles in vitro ... 85
2. Modèles murins de psoriasis ... 86
2.1. Modèles de xénotransplantation ... 87
2.2. Les souris transgéniques ... 87
2.3. Les souris KO ... 88
2.4. Modèles d’injection de cytokines ... 89
2.5. Modèles d’inflammation cutanée induit par l’imiquimod ... 90
OBJECTIFS DE LA THÈSE ... 91
MATERIELS ET METHODES ... 93
1. Isolement des kératinocytes primaires humains ... 94
2. Culture des kératinocytes en monocouche ... 94
3. Modèle murin de psoriasis induit par l’imiquimod ... 95
3.1. Les animaux et conditions d’hébergement ... 95
3.2. Traitement des souris ... 95
3.3. Évaluation de la sévérité de la maladie ... 96
4. Étude histologique de la peau de souris par coloration H&E ... 96
5. Extraction d’ARN ... 97
6. Transcription inverse ... 98
7. Quantification de l’expression des ARNm par PCR quantitative ... 98
8. Tests statistiques ... 99
RESULTATS ... 100
CHAPITRE I : Études des effets synergiques de cytokines proinflammatoires sur la différenciation des kératinocytes ... 101
1. Présentation de l’article « Inhibition of keratinocyte differentiation by the synergistic effect of IL-17A, IL-22, IL-1, TNF and Oncostatin M » ...101
2. Étude des effets des mélanges des cytokines sur l’inhibition de la différenciation des kératinocytes ...129
3. Conclusion ...130
CHAPITRE II : Implication des cytokines proinflammatoires dans l’inflammation cutanée induite par l’imiquimod ... 132
1. Mise en place du modèle d’inflammation cutanée induite par l’imiquimod...132
1.2. Analyse du profil transcriptionnel des lésions induites par l’IMQ... 134
2. Discussion et conclusion ...136
CHAPITRE III : Étude du rôle de l’OSM dans l’inflammation cutanée induite par l’IMQ ... 138
1. Phénotype des souris déficientes en OSMR traitées par l’IMQ ...139
2. Profil transcriptomique des souris déficientes en OSMR traitées par l’IMQ ...141
3. Discussion et conclusion ...143
CHAPITRE IV : Étude du rôle de l’IL- dans l’inflammation cutanée induite par l’IMQ ... 145
1. Caractérisations des lésions cutanées des souris déficientes en IL-22 dans le modèle d’inflammation cutanée induite par l’IMQ ...145
2. Analyse du profil transcriptionnel des lésions induites par l’IMQ chez les souris déficientes en IL-22 ...147
3. Discussion et conclusion ...149
CHAPITRE V : Étude du rôle de l’IL- dans l’inflammation cutanée induite par l’IMQ ... 152
1. Présentation de l’article: « Role of Interleukin-1 and in imiquimod-induced psoriasis-like skin inflammation ». ...152
2. Étude de la perte des poids des souris durant l’application topique d’IMQ ...184
DISCUSSION ET CONCLUSION ... 186
BIBLIOGRAPHIE ... 194
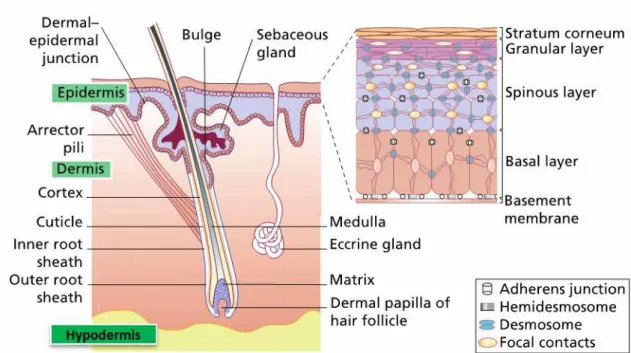
CHAPITRE I : le système cutané
La peau est un organe complexe enveloppant la surface du corps humain. Elle représente
environ 15% du poids total d’un adulte. Elle joue un rôle important de barrière face aux
agressions physiques, chimiques et biologiques, grâce notamment à sa structure complexe
organisée en 3 couches comprenant de l’extérieur vers l’intérieur (Figure 1) :
l’épiderme et ses appendices d’origine ectodermique
le derme (séparée de l’épiderme par la jonction dermo-épidermique) qui est une couche de tissu conjonctif d’origine mésodermique
l’hypoderme qui est un tissu conjonctif sous cutané
La peau est associée à de nombreuses annexes telles que les poils, les ongles et les glandes exocrines.
Figure 1. Schéma de la peau et de ces appendices. Modifié d’après (McGrath et al., 2010)
1. L’épiderme
L’épiderme est formé par un épithélium stratifié qui s’étend de la lame basale à l’interface
avec le derme à la couche cornée. Il se renouvelle continuellement grâce à des mécanismes de prolifération, différenciation, mort cellulaire et élimination. Il est composé de divers types
production de cellules aplaties et anucléées nommées cornéocytes. Les 5 à 10% restant sont
composés d’autres populations cellulaires telles que les cellules de Langerhans (LC), les
mélanocytes, les cellules de Merkel, mais également de cellules immunitaires comme les
lymphocytes (<1,3 %) (Kanitakis, 2009). L’épiderme est subdivisé en une série de couches
qui se distinguent histologiquement et qui correspondent à différents stades de différenciation des kératinocytes (Figure 1) :
La couche basale composée d’une seule couche de kératinocytes indifférenciés de forme
cylindrique mesurant 6 à 10 m est adjacente à la jonction dermo-épidermique avec
laquelle elle interagit via des jonctions hémidesmosomales. Les cellules possèdent un cytoplasme basophile, un noyau large et sont disposées perpendiculairement à la membrane basale. Cette couche contient des cellules souches épidermiques qui subissent des divisions mitotiques donnant naissance à des cellules filles permettant de maintenir un
état dynamique d’auto-renouvellement de l’épiderme (Wysocki, 1999).
La couche épineuse est située au-dessus de la couche basale. Les kératinocytes sont
connectés entre eux par des jonctions intercellulaires dont les desmosomes (Figure 1). Ils adoptent une forme polyédrique à noyau arrondi. Cette couche est composée de plusieurs couches de kératinocytes en cours de différenciation.
La couche granuleuse est formée de plusieurs couches de kératinocytes différenciés. Ils
sont aplatis et sont disposés parallèlement à la jonction dermo-épidermique. Ces cellules sont caractérisées par la présence de granules de kératohyalines contenant principalement des protéines telles que profilaggrine et la loricrine, nécessaires à la formation des cornéocytes.
La couche cornée est formée par des kératinocytes différenciés appelés cornéocytes et correspond à la couche la plus externe de l’épiderme. Les cornéocytes sont des cellules
mortes, complètement aplaties et anucléées et sont moins étroitement associés les uns aux autres provoquant leur détachement par desquamation.
1.1. Les kératinocytes
La différenciation épidermique débute par la migration des kératinocytes de la couche basale, et se termine par la formation de la couche cornée. La morphologie des kératinocytes varie en fonction de leur stade de différenciation. Il a été montré que les cellules souches ainsi que les kératinocytes de la couche basale expriment des antigènes de prolifération comme
Ki67 et le « Proliferating Cell Nuclear Antigen » (PCNA) (Kanitakis, 2009). Dans la peau
normale, le renouvellement permanent de l’épiderme est alors basé sur un équilibre entre la
prolifération cellulaire, la différenciation et la mort, chaque procédé étant caractérisé par
l’expression de protéines spécifiques (Candi et al., 2005).
Dès la première étape de la différenciation épidermique, les kératinocytes expriment des filaments intermédiaires de kératine (KIF) qui forment un réseau indispensable pour
l’organisation cellulaire et l’intégrité structurale du cytosquelette à résister au stress
mécanique. Les cytokératines CK5 et CK14 sont exprimées dans la couche basale épidermique et sont remplacés par les CK1 et CK10 dans les couches suprabasales différenciées (Figure 2).
Figure 2. Différenciation terminale et apoptose dans l’épiderme.
Modifié d’après (Candi et al., 2005; Lopez-Pajares et al., 2013)
Les kératinocytes migrent ensuite vers la couche épineuse, perdent leur activité mitotique et commencent à synthétiser des protéines de structure et des enzymes caractéristiques de la cornification. A ce stade, ils produisent des desmosomes qui sont des complexes protéiques,
comprenant en surface des protéines d’adhésion cellulaire reliées aux filaments intermédiaires
du cytosquelette intra-cytoplasmique afin de générer une adhésion cellule-cellule. Au fur et à mesure que les kératinocytes progressent vers la surface, ils acquièrent des granules de
couche cornée, se transforme en filaggrine, nécessaire à l’agrégation des filaments de kératine
induisant un aplatissement des cornéocytes. Les kératinosomes (ou corps d’Oadland) sont des
organites ovalaires contenant des lamelles lipidiques nécessaires à la compaction de la couche cornée. Le stade final de différenciation des kératinocytes se situe au niveau de la couche
cornée. Un des premiers éléments de l’enveloppe cornée identifié a été l’involucrine, qui
commence à s’accumuler tôt dans la couche épineuse. D’autres précurseurs sont impliqués dans la formation de l’enveloppe cornée telles que la cystatine, les « Small Proline Rich
Protein » (SPRR), la loricrine, les KIF et l’élafine (Candi et al., 2005; Lopez-Pajares et al.,
2013). Par conséquent, chaque étape de la différenciation des kératinocytes peut être associée
à l’expression de marqueurs spécifiques.
1.2. Les marqueurs associés à l’adhésion et à la différenciation des kératinocytes
1.2.1. Les cytokératines
Les cytokératines appartiennent à la famille des protéines de filaments intermédiaires et représentent plus de 30% des protéines totales de la couche basale et 70% de la couche cornée (Sun and Green, 1978). La molécule de cytokératine est hélicoïdale et fibreuse, elle s'enroule autour d'autres molécules de kératine pour former des filaments intermédiaires. Ces
filaments assurent la résistance des kératinocytes et permettent l’attachement aux
desmosomes et aux hémidesmosomes (section 1.2.2).
Récemment, les analyses génomiques ont montré que l’homme possède 54 gènes
fonctionnels qui codent pour les kératines et qui sont subdivisés en 2 groupes dont 28 de type I (cytokératines de type acide) et 26 de type II (cytokératines de type basique-neutre). Les gènes de ces deux groupes sont répartis sur le chromosome 12q (toutes les cytokératines de type II et une cytokératine de type I, CK18) et le chromosome 17q (toutes les cytokératines de
type I sauf CK18) (Tableau 1). Elles possèdent un domaine central composé d’environ γ10
acides aminés présentant une conformation en hélice- entouré par des domaines N et C
terminaux non hélicoïdaux de longueur variable (Moll et al., 2008). Le poids moléculaire des cytokératines varie de 44 à 66 kDa. Une caractéristique unique des CK est leur assemblage
par paire. Une cytokératine de type I et une de type II s’alignent parallèlement pour former un
hétérodimère qui se polymérise pour former un filament d’environ 10nm de diamètre. Par
exemple la CK5 s’associe avec la CK14 au niveau de la couche basale d’une peau normale, et
Tableau 1. Les cytokératines de type I et II et leur localisation.
Modifié d’après (Moll et al., 2008)
Comme évoqué ci-dessus, les profils de cytokératines exprimées par les kératinocytes changent au cours de leur différenciation.
La CK5 est produite en même temps que son partenaire CK14 au niveau de la couche
basale de l’épiderme (Pekny and Lane, 2007). Sa production est corrélée avec l’activité
mitotique des cellules épithéliales, mais pas avec leur différenciation parce que les cellules
suprabasales de l’épithélium stratifié peuvent encore produire CK5 à condition que ces
cellules n’aient pas commencé le processus de différenciation (Byrne et al., 1994).
La CK1 s’associe avec son partenaire CK10 et constituent des marqueurs de
Localisation Type I Type II
Kératines épithéliales humaines K9
K10 K12 K13 K14 K15 K16 K17 K18 K19 K20 K23 K24 K25 K26 K27 K28 K1 K2 K3 K4 K5 K6a K6b K6c K7 K8 K71 K72 K73 K74 K75 K76 K77 K78 K79 K80
Kératines des follicules pileux K31
K32 K33a K33b K34 K35 K36 K37 K38 K39 K40 K81 K82 K83 K84 K85 K86
les couches stratifiées. L’expression de CK1 précède celle de CK10, ensuite CK1 s’associe
premièrement avec le filament CK5/CK14 préformé. Après l’expression de CK10, l’hétérodimère CK1/CK10 sont intégrés dans le réseau de filament de kératine (Kartasova
et al., 1993).
La CK6 s’associe avec un de ces partenaires CK16/CK17a et leurs expressions sont
augmentées dans diverses maladies cutanées associées à une hyperproliferation des kératinocytes.
CK2 est un composant régulier du cytosquelette des cellules épidermiques et est exprimée
dans les couches suprabasales de la couche épineuse (Smith et al., 1999). Son expression
est augmentée lors d’un stress mécanique de l’épithélium.
CK4 et son partenaire CK13 sont produites dans les cellules suprabasales en cours de
différenciation de l’épithélium buccal (Pekny and Lane, 2007). De faible quantité de CK4
est produite dans les cellules épithéliales du pelvis rénal, de l’uretère et de la vessie. CK75 (type II) dont la séquence peptidique est proche de celle de CK5 (80%), est
spécifiquement exprimée dans une fine couche du follicule pileux (Moll et al., 2008).
1.2.2. Les protéines d’adhésion
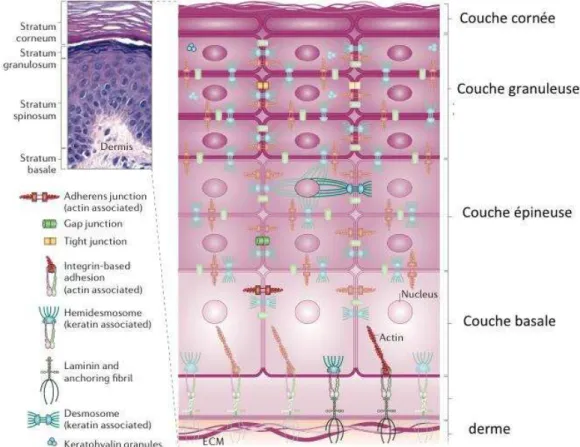
L’adhésion cellule-cellule joue un rôle important dans la morphogenèse des tissus et dans la régulation de la migration et de la prolifération cellulaire. Ainsi l’adhésion interkératinocytaire est importante dans l’architecture de la peau et, par conséquent, pour la
fonction épidermique. Les kératinocytes sont interconnectés par 3 types fonctionnels de
structure de jonctions (Figure 3) : les jonctions d’ancrage comprenant les jonctions
d’adhérence, les desmosomes et les hémidesmosomes, les jonctions serrées et les jonctions
communicantes de type Gap.
Ce sont des complexes protéiques dont l’expression est modulable au cours de la
différenciation des kératinocytes. Les jonctions adhérentes localisées au niveau de l’épiderme sont un assemblage de protéines d’adhésion transmembranaire de la famille des cadhérines
dont la fonction est dépendante du calcium. Elles sont responsables des adhérences fortes entre les kératinocytes.
Figure 3. Les protéines d’adhésion (Simpson et al., 2011)
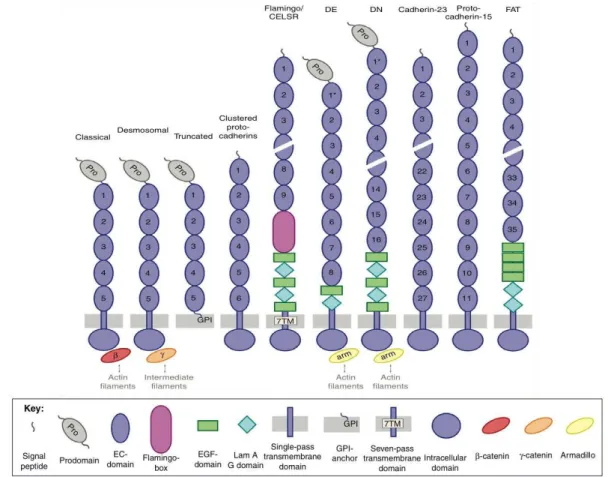
Les membres de la superfamille des cadhérines comportent un domaine structural extracellulaire commun, caractérisé par un domaine conservé extracellulaire (CE)
d’environ 110 résidus. Les cadhérines peuvent être classées en plusieurs sous-familles selon
le nombre et la disposition de ces domaines CE : les cadhérines classiques, les cadhérines desmosomales, les cadhérines tronquées (T-cadhérines), les protocadhérines, les cadhérines à 7 tours membranaires et les cadhérines de la famille FAT (Brasch et al., 2012) (Figure 4).
Les jonctions adhérentes sont formées de cadhérines qui s’associent avec des filaments d’actine via d’autres protéines de liaison à l’actine telle que la vinculine ou l’α-actinine. Les caténines (α, ou ) permettent l’association entre les cadhérines et ces protéines de liaison à l’actine. Deux types de cadhérines classiques sont exprimés au niveau de l’épiderme : la P-cadhérine (ou cadhérine 3) qui est principalement exprimée au niveau de
la couche basale et autour des follicules pileux, et la E-cadhérine (ou cadhérine 1), localisée
Figure 4. Représentation schématique des membres de la superfamille des cadhérines.
Modifié d’après (Brasch et al., 2012)
Les cadhérines desmosomales présentent une organisation structurale similaire aux cadhérines classiques. Cependant elles sont reliées aux filaments intermédiaires de kératine, au niveau de son domaine cytosolique, via différentes protéines telles que la desmoplakine, la plakoglobine et la plakiphiline, en formant des jonctions spécialisées nommées desmosomes.
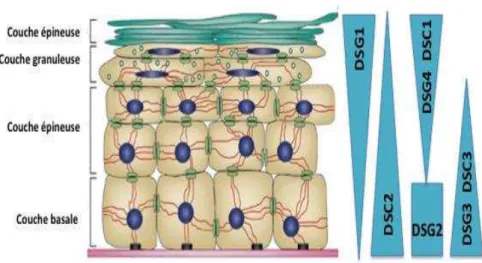
Au niveau de l’épiderme, les cadhérines desmosomales comprennent 4 isoformes de
desmogléines (DSG1, DSG2, DSG3 et DSG4) et 3 isoformes de desmocollines (DSC1, DSC2 et DSC3). Durant le processus de différenciation des kératinocytes, les DSG2 et DSG3
exprimées au niveau des couches basales de l’épiderme sont remplacées par les DSG1 et
DSG4 au niveau des couches supérieures. De la même manière, la DSC2 et DSC3 qui sont abondantes dans la couche basale sont remplacées par la DSC1 (Figure 5). Au stade final de la différenciation, les desmosomes deviennent des cornéodesmosomes qui relient les cornéocytes. Ils contiennent principalement les DSG1, DSC1 et de la cornéodesmosine, une glycoprotéine qui est exprimée au niveau de la couche granuleuse et de la couche cornée. Sa dégradation par des enzymes protéolytiques au niveau de la couche cornée déclenche la desquamation.
Figure 5. Expression des cadhérines desmosomales dans l’épiderme
Modifié d’après (Dusek et al., 2007)
Les hémidesmosomes jouent un rôle fondamental dans l’ancrage des kératinocytes
basaux à la membrane basale et au derme sous-jacent (Figure 3). Les molécules de cet échafaudage rassemblent de nombreuses molécules telles que les filaments intermédiaires de
CK5 et CK15, la plectine, l’intégrine α6 4, la laminine 5 et les collagène de type VII et XVII.
Les jonctions serrées constituent une barrière de perméabilité sélective au niveau de
l’espace paracellulaire entre β cellules voisines (Figure γ). Elles se situent au niveau de la
portion apicale de la membrane latérale des cellules où les membranes cytoplasmiques des cellules adjacentes fusionnent le long des crêtes linéaires formées par une succession de protéines intra-membranaires engrenées les unes les autres. Elles sont constituées de plusieurs
protéines transmembranaires dont les deux principaux représentants sont l’occludine et les
membres de la famille des claudines. La jonction formée permet aux cellules adjacentes
d’adhérer les unes des autres, de constituer une barrière qui régule le flux de molécules à travers l’espace paracellulaire et enfin d’empêcher la diffusion des lipides et des protéines
entre les domaines apical et baso-latéral.
Les jonctions communicantes de type Gap présentes entre les kératinocytes, jouent un
rôle dans les échanges intercellulaires d’ions et de molécules hydrophiliques de faible poids
moléculaire (Figure 3). Les cellules adjacentes sont unies entre elles par des petits canaux
intercellulaires tubulaires. Un canal intercellulaire est formé de l’aboutement de β connexons,
chacun faisant partie de la membrane de chacune des 2 cellules adjacentes. Les connexons sont formés de 6 sous-unités protéiques de la famille des connexines.
1.2.3. Les intégrines
Les intégrines constituent une famille des récepteurs transmembranaires
hétérodimériques comprenant une sous-unité α et une sous-unité et leur extrémité interagit
spécifiquement avec des protéines de la matrice cellulaire. Cette spécificité est obtenue par
l’existence d’une grande variété de sous-unité α et , qui peuvent s’associer selon différentes
combinaisons. Les intégrines exprimées par les kératinocytes peuvent être placées dans
différentes catégories : celles dont l’expression est faible ou abondante, constitutive ou induite
suite à une blessure ou en condition pathologique (Tableau 2). Lors de la différenciation des
kératinocytes, les premières intégrines exprimées sont 21 (collagène de type I), 31
(récepteur de la laminine 5), αv 5 (récepteur de la vibronectine et de la tenascine) et 64
(récepteur de la laminine 5) (Watt, 2002). Les intégrines 51 (récepteur de la fibronectine)
et αv 6 sont induite en culture ou suite à une blessure. L’intégrine αv 6 est souvent exprimée
dans les carcinomes épidermoïdes. L’intégrine 91 (récepteur de la tenascine) est exprimée dans l’épiderme sain mais elle est surexprimée pendant la cicatrisation des plaies. L’intégrine αv 8 (récepteur de la vibronectine) est absente dans la couche basale de l’épiderme mais elle
est retrouvée exclusivement dans les couches suprabasales contrairement aux autres intégrines
de l’épiderme sain dont l’expression est limitée à la couche basale et aux follicules pileux
(Watt, 2002).
Tableau 2. Les intégrines kératinocytaires. D’après (Watt, 2002)
Intégrine Ligand Expression
21 31 64 αv 5 51 αv 6 91 αv 8 Collagène Laminine Laminine Vibronectine Fibronectine Fibronectine, Tenascine Tenascine Vibronectine Constitutive Constitutive Constitutive Faible
Induite en culture, des blessures, en conditions pathologiques
Induite en culture et lors des blessures, en conditions pathologiques
Surexprimée pendant la cicatrisation des plaies
Suprabasale
1.2.4. La filaggrine
La filaggrine (37 kDa) est une protéine structurale majeure de la couche cornée. Elle est produite sous forme de précurseur : la profilaggrine. La profilaggrine (PM > 400kDa) est
exprimée au cours de la différenciation terminale des kératinocytes et est le principal composant des granules de kératohyaline localisés au niveau de la couche granuleuse. Elle se compose de multiples répétitions de monomère de filaggrine bordée en N-terminale et en
C-terminale par des séquences répétées imparfaites de filaggrine. L’extrémité N-terminale est
aussi composée deux domaines de liaison au calcium S100, nommés A et B (Figure 6).
Figure 6. Structure de la profilaggrine d’après (Irvine et al., 2011)
Pendant la différenciation terminale et notamment lors de la transition entre la couche granuleuse et la couche cornée, la profilaggrine est déphosphorylée puis clivée par plusieurs
endoprotéases dont la caspase-14, la matripase, la prostatine, la kallikréine 5 et l’élastase β
afin de générer 10, 11 ou 12 monomères de filaggrine fonctionnelle (McAleer and Irvine, 2013). Par la suite, la filaggrine agrège les filaments intermédiaires de kératines des cellules
de l’enveloppe cornée et contribue à la compaction des squames assurant l’intégrité
mécanique de cette couche (Figure 7).
Figure 7. Structure schématique de l’enveloppe cornée.
Dans les couches supérieures, les monomères de filaggrine sont ensuite dégradés par des
protéases répandant ainsi leurs acides aminés hydrophiles. Ceux-ci participent à l’hydratation
épidermique, contribuent à la fonction de barrière et aident à maintenir le gradient de pH de
l’épiderme (McAleer and Irvine, 2013).
1.2.5. La loricrine
La loricrine (26 kDa) est exprimée au niveau de la couche granuleuse pendant la cornification (Figure 2). Elle est riche en glycine, leucine et cystéine. Elle est hautement
insoluble et basique, et constitue le principal composant de l’enveloppe cornée (Hohl et al.,
1991). Elle provient des granules de kératohyalins et exprimée au niveau de la couche granuleuse. Elle fait partie des protéines jouant un rôle important dans la structuration des
cornéocytes et dans la formation de l’enveloppe cornée et des jonctions entre les cornéocytes.
La loricrine participerait au soutien des cellules de l’enveloppe cornée en se liant à
l’échafaudage d’élafine, de cystatine A, d’involucrine, de protéines desmosomales et de
protéines de liaison au calcium (Candi et al., 2005). La loricrine est un marqueur associé à la différenciation tardive durant laquelle son expression est fortement augmentée.
1.2.6. L’involucrine
L’involucrine prédomine dans la partie externe de la couche cornée (Figure 2 et 7). Tout comme la loricrine, elle participe à la structuration des cornéocytes. C’est une protéine
cytoplasmique soluble et est un substrat des transglutaminases (Tgases), une enzyme qui
catalyse l’établissement de liaisons covalentes peptidiques covalentes du type ε-(- -glutamyl)-lysine entre divers précurseurs protéiques. Durant l’assemblage de l’enveloppe cornée, l’involucrine s’associe entre elle mais aussi avec d’autres composants de l’enveloppe tels que la desmoplakine et l’envoplakine (Candi et al., 2005). Son expression est augmentée lorsque
la différenciation des kératinocytes est induite par le calcium.
2. La jonction dermo-épidermique
La jonction dermo-épidermique (JDE) est la région qui sépare le derme de l’épiderme.
Elle est formée par une membrane basale complexe synthétisée par les kératinocytes basaux
et les fibroblastes dermiques (Kanitakis, 2009). De l’épiderme vers le derme elle est
de la membrane cellulaire du pôle basal des kératinocytes basaux qui contient les
hémidesmosomes. Ceux-ci contiennent des protéines telles que la plectine et l’intégrine
α6 4 associées aux filaments intermédiaires du cytosquelette des kératinocytes.
de la membrane basale proprement dite faite de 2 feuillets, la lamina lucida (40 nm et
contenant plusieurs isoformes de laminines) et la lamina densa (50-70 nm, contenant du
collagène de type IV). Dans cette zone, les filaments d’ancrages relient les
hémidesmosomes à la lamina densa à travers la lamina lucida.
d’une région située sous la lamina densa, la sublamina densa, contenant des fibrilles
d’ancrage et des faisceaux de collagène microfibrillaires.
La JDE assure plusieurs fonctions fondamentales dans le support mécanique pour l’adhésion de l’épiderme au derme et contrôle les échanges moléculaires et cellulaires entre les β
compartiments. De plus, elle assure la réépidermisation lors de la cicatrisation cutanée en servant, au travers des glycoprotéines qui la constituent (principalement des laminines) de
support pour l’adhésion et la migration des kératinocytes.
3. Le derme
Le derme est un tissu conjonctif fibro-élastique dont l’épaisseur varie en fonction de sa
localisation anatomique. Il est composé de fibres d’élastine et de collagène, et de cellules au
sein de la substance fondamentale qui est constituée de matrice extracellulaire. (Kanitakis, 2009). Au sein du derme sont retrouvés majoritairement les fibroblastes mais également des cellules immunitaires (section 5). Les fibroblastes secrètent des molécules constituant la matrice extracellulaire ainsi que des métalloprotéinases matricielles (MMPs) responsables de la dégradation et du remodelage de cette matrice. Il contient un système vasculaire assurant la thermorégulation, la régulation de la tension artérielle mais aussi la défense immunitaire de
l’organisme. Il héberge en plus des vaisseaux sanguins et lymphatiques, des terminaisons
nerveuses spécialisées et des annexes épidermiques incluant les glandes sudoripares et les follicules pileux.
4. L’hypoderme
L’hypoderme est un tissu adipeux jouant un rôle important dans la thermorégulation, l’isolation, l’apport en énergie et dans la protection contre les blessures mécaniques. Les
(triglycérides, acides gras) comprimant le noyau contre la membrane cytoplasmique (Kanitakis, 2009). Il est richement vascularisé et un lieu de passage pour les nerfs à destination du derme.
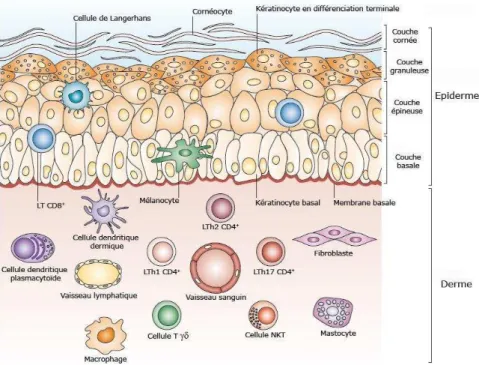
5. Les cellules immunitaires cutanées
Dans cette partie seront décrites les cellules immunitaires présentes dans la peau en condition normale. Leur recrutement ainsi que leur activation seront décrit dans le chapitre 3.
5.1. Généralités
La peau forme une interface entre l’organisme et son environnement. Elle assure la
première ligne de défense contre les stress physiques, chimiques et biologiques.
L’immunosurveillance d’un tel organe large et exposé, présente un défi unique pour les
acteurs de l’immunité.
Plusieurs cellules immunitaires sont localisées dans la peau normale. En plus de leur rôle de structure et de barrière physique, les kératinocytes eux-mêmes, jouent un rôle dans la
réponse immunitaire. Conjointement, d’autres cellules immunitaires spécialisées sont présentes dans l’épiderme, telles que les cellules de Langerhans (LC) et des lymphocytes T
(LT). Les cellules immunitaires résidentes du derme sont constituées de cellules dendritiques
(DC), de LT auxiliaire (LTh), de LT et de lymphocytes « Natural Killer T» (NKT). De
plus, des macrophages et des mastocytes sont retrouvées dans la peau normale (Nestle et al., 2009a) (Figure 8).
Figure 8. Effecteurs cellulaires de la peau. Modifié d’après (Nestle et al., 2009a)
5.2. Les kératinocytes
Les cellules eucaryotes utilisent des récepteurs qui reconnaissent des composés microbiens conservés nommés « Pathogen Associated Molecular Patterns » (PAMPs), comme par exemple les lipopolysaccharides (LPS), le peptidoglycane, la flagelline ou les acides nucléiques bactériens et viraux. Parmi ces récepteurs, les « Toll Like Receptor » (TLR) sont
les mieux décrits. La reconnaissance des PAMPs par les TLRs conduit à l’activation des voies
de signalisation de la cellule hôte et entraine l’induction des réponses immunitaires innée puis
adaptative (Nestle et al., 2009a). Les kératinocytes expriment plusieurs TLR à la surface cellulaire tels que TLR1, TLR2, TLR4, TLR5 et TLR6 et dans les endosomes tels que TLR3 et TLR9 (Nestle et al., 2009a). De plus les kératinocytes jouent un rôle dans la production
d’effecteurs immunitaires innés tels que des peptides antimicrobiens, des chimiokines et des
cytokines, qui conduisent au recrutement et à l’activation de cellules immunitaires, reliant
ainsi les kératinocytes à l’immunité adaptative (Albanesi et al., 2005).
5.3. Les cellules de Langerhans
« sentinelles » chargées de présenter les antigènes exogènes déposés sur la peau aux lymphocytes T, induisant ainsi une réponse immunitaire de type cellulaire. Elles représentent
γ à 6 % des cellules totales de l’épiderme (Girolomoni et al., 2002). Le TGF1 est un facteur
essentiel pour le développement des LC puisque les souris déficientes en TGF1 sont
dépourvues de LC (Borkowski et al., 1996). Elles expriment un panel d’antigènes dont les
plus spécifiques sont le CD1a, les antigènes associés aux granules de Birbeck, le CD207/langérine et aussi le « Cutaneous Lymphocyte-associated Antigen » (CLA) (Hunger et
al., 2004; Kanitakis, 2009). Au cours d’une inflammation, l’induction de la migration des LC
par des allergènes vers les ganglions lymphatiques semble dépendre de la production locale
d’IL-1 et de TNFα par les kératinocytes, et que ce processus peut être inhiber par l’IL-10
(Kissenpfennig et al., 2005; Roake et al., 1995; Wang et al., 1999).
5.4. Les cellules dendritiques du derme
Les DC dermiques sont capables de capter des antigènes cutanés, de migrer vers les
ganglions lymphatiques et de présenter ces antigènes aux LB et LT. Il n’y a pas de marqueur unique et spécifique de ces cellules, bien que l’intégrine CD11c semble être le meilleur outil
pour les identifier. Les deux populations présentes dans le derme sont les DC myéloïdes (mDC) ou conventionnelles et les DC plasmacytoïdes (pDC) (Zaba et al., 2009). Les mDC sont très mobiles et migrent en permanence dans le derme, suggérant leur rôle immunitaire de surveillance (Ng et al., 2008). Les pDC sont caractérisées par leur capacité à produire une
grande quantité d’interféron de type I pendant une infection (Zaba et al., 2009). Cette capacité
est liée à leur expression intracellulaire de TLR7 et TLR9 (Kadowaki et al., 2001), qui
reconnaissent l’ARN simple brin et l’ADN viral par les virus infectant la cellule. Dans la peau
saine, ces cellules sont en faible quantité, mais un grand nombre de pDC est localisé dans les patients souffrant de psoriasis, que nous détaillerons dans le chapitre 3.
5.5. Les lymphocytes T
Dans le derme, les LT sont groupés autour des veinules post-capillaires et sont souvent
situés juste en dessous de la JDE ou à côté des appendices cutanés. Les LT sont CD4+ ou
CD8+, en proportion équivalente, et la plupart expriment le « Cutaneous
Lymphocyte-Associated Antigen » (CLA). Au cours de la réponse inflammatoire cutanée, d’autres LTh
réponse induite (Détaillé dans le chapitre 3). Les LT et les NKT constituent la majorité des LT non conventionnels du derme (Hayday and Tigelaar, 2003; Kronenberg, 2005). Ces
derniers représentent 1 à 10 % de la totalité des LT présents dans le derme et l’épiderme.
Toutefois, peu de données décrivent le rôle de ces LT dans la peau. Il semble que leur nombre est augmenté dans les pathologies cutanées telles que les mélanomes, le psoriasis ou le lupus érythémateux chronique (Nestle et al., 2009a).
5.6. Les fibroblastes
Les fibroblastes sont d’origine mésenchymateuse et constituent les cellules fondamentales
du derme normal. Ils sont essentiellement localisés dans le derme papillaire proche de
l’épiderme et sont la source de fibres dont le collagène et l’élastine. Ils produisent ou dégradent la matrice extracellulaire avec laquelle ils interagissent par l’intermédiaire de molécule d’adhésion de type intégrine. Les fibroblastes sont des cellules douées d’activité
phagocytaire tandis que les fibrocytes sont la forme inactive, quiescents et exempte d’activité
métabolique (Kanitakis, 2009). Dans une inflammation cutanée comme le psoriasis, une
interaction entre les kératinocytes produisant du TNFα, de l’IL-1 ainsi que « transforming
growth factor- » (TGF ), et les fibroblastes qui en réponse libèrent du « keratinocyte growth
factor » (KGF), de l’« epidermal growth factor » (EGF) et du TGF , contribuent à la
réorganisation tissulaire et au dépôt de la matrice (Nestle et al., 2009a).
5.7. Les mastocytes
Les mastocytes sont des cellules mononuclées dérivant de la moelle osseuse et se trouvent à proximité immédiate des vaisseaux sanguins du derme. Ils sont traditionnellement connus pour leur rôle effecteur important dans la réponse immunitaire Th2, telles que les maladies inflammatoires allergiques ; dans lequel les allergènes environnementaux déclenchent la libération de molécules inflammatoires préformés comme l'histamine, un puissant vasodilatateur (Metcalfe et al., 1997). De plus, ils participent également à la défense cutanée
contre les parasites pluricellulaires, aux réponses d’hypersensibilités de contacts, et à la
cicatrisation des plaies, au cours de laquelle ils exercent des fonctions à la fois pro et anti-inflammatoires (Galli et al., 2005).
CHAPITRE II : les effecteurs innés de la défense cutanée
De par ses composants, la barrière cutanée protège l’organisme contre des contraintes
externes telles que les facteurs physico-chimiques et environnementaux. Les cornéocytes avec leur enveloppe cornée et les lipides bilamellaires intercellulaires représentent les principaux composants de la barrière épidermique. La peau est constamment exposée à un large éventail de microorganismes potentiellement pathogènes. Cependant il est remarquable que la peau ne soit généralement infectée. En plus de la barrière physique citée ci-dessus, des travaux ont mis
en évidence l’existence d’un système de défense « chimique » consistant à la libération de
molécules possédant une activité directe ou indirecte contre ces pathogènes, telles les peptides antimicrobiens (PAM) et les chimiokines.
Dans ce chapitre, nous nous intéressons plus particulièrement à ces effecteurs de
l’immunité innée de la défense cutanée. Dans ce contexte, les kératinocytes participent
directement à la défense innée par la production de PAM ou indirectement par le biais du
recrutement d’effecteurs immunitaires à l’aide de production de chimiokines.
1. Les peptides antimicrobiens
Les PAM représentent un groupe varié de petites protéines endogènes qui exercent une
activité antimicrobienne contre les bactéries, les champignons et les virus; bien que d’autres
peptides cutanés, tels que les inhibiteurs de protéases, les chimiokines, et des neuropeptides montrent également des activités antimicrobiennes (Braff et al., 2005; Schröder and Harder,
2006). Plus de 1β00 PAM d’origines différentes ont été identifiés incluant des PAM produits
dans des tissus et cellules très divers de bactéries, d’invertébrés, de plantes et d’animaux
(Maróti et al., 2011; Wang and Wang, 2004; Wang et al., 2009). L’expression de la plupart
des PAM peut être induite in vitro par des cytokines proinflammatoires ou des bactéries, mais
sont aussi exprimés constitutivement dans la peau en absence d’inflammation. Il existe
plusieurs familles de PAM classées selon un certain nombre de propriétés structurales ou fonctionnelles mais aussi selon leur provenance. Ils sont produits principalement par les
kératinocytes dans la peau saine (Schröder and Harder, 2006). D’une manière générale, les
kératinocytes expriment constitutivement des PAM tandis qu’ils les produisent rapidement en
forte quantité en présence de microorganismes ou de stimuli endogènes tels que les cytokines proinflammatoires ou facteurs de croissance.
Plusieurs modèles de perméabilisation de la membrane des bactéries cibles par les PAM ont été proposés (Brogden, 2005). Dans ces modèles, la présence de PAM à forte concentration au niveau de la membrane externe des bactéries à Gram négatif ou de la membrane plasmique des bactéries à Gram positif et négatif entraine la formation de pores transmembranaires engendrant la destruction de la cellule cible (Figure 9).
Figure 9. Mode d’action des peptides antimicrobiens. Modifié d’après (Brogden, 2005).
(à gauche) modèle « barrel-stave », (au milieu) modèle toroïdal et (droite) modèle en tapis. En rouge : les régions hydrophiles, en bleue : les régions hydrophobes
Dans le modèle « barrel slave », les PAM s’insèrent dans la bicouche lipidique. Leurs
résidus hydrophobes s’alignent avec les régions hydrophobes de la bicouche tandis que les régions hydrophiles s’orientent et constituent la lumière du pore. Dans le modèle toroïdal, les
régions hydrophiles des PAM vont se fixer au niveau de la tête polaire de la couche lipidique qui engendre une distorsion de la membrane. Ainsi la lumière du pore est composée des têtes polaires de lipides mais également des régions hydrophiles des PAM. Dans le modèle en
tapis, les PAM ne s’insèrent pas dans la bicouche lipidique. A de forte concentration, ils forment un tapis de PAM entrainant l’effondrement de la membrane à la manière d’un détergent qui perfore la membrane accompagné d’une libération du contenu cytoplasmique de
la cellule cible.
Dans cette partie, nous nous pencherons sur les PAM de la peau les plus importants et sur leur rôle dans la défense cutanée : la cathélicidine (LL-37), les défensines et les protéines de la famille S100.
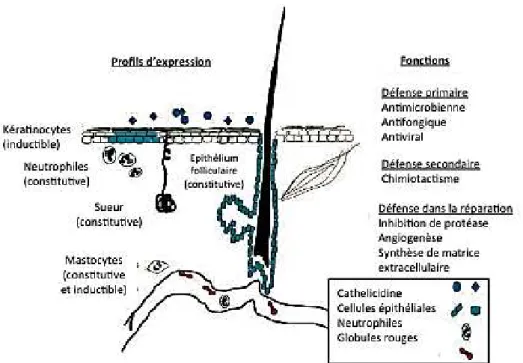
1.1. LL-37
Le LL-37 est un PAM cationique appartenant à la famille des cathélicidines. Les cathélicidines ont en commun un domaine N-terminal très conservé, portant le nom de cathéline et un domaine antimicrobien C-terminal. Un seul gène codant pour les cathélicidines est présent dans le génome humain (Gudmundsson et al., 1996). Ce gène code pour un précurseur protéique de 18 kDa, la hCAP-18 « Human Cathelicidin Antimicrobial Protein » qui est clivée en peptide par la sérine-protéase-protéinase 3 pour générer le LL-37 doué
d’activité antimicrobienne (Sørensen et al., 2001).
Figure 10. Profils d’expression et fonctions des cathélicidines humaines cutanée.
Modifié d’après (Braff et al., 2005)
Le LL-γ7 est sécrété dans la sueur ce qui suggère qu’il joue une fonction de barrière
contre les infections locales, notamment contre Staphylococcus aureus et Candida albicans
(Murakami et al., 2004). De plus, LL-37 peut agir en synergie avec d’autres PAM, doué
d’activité chimiotactique pour les neutrophiles, les monocytes, les mastocytes et lymphocytes
T, stimule la prolifération des cellules endothéliales par liaison avec le « Formyl Peptide
Receptor-like I » (FPRL-1) et joue un rôle dans l’angiogenèse (Figure 10) (Koczulla et al.,
Une étude a montré que LL-γ7 peut agir en synergie avec l’IL-1 pour induire
l’expression d’effecteurs inflammatoires cytokiniques tels que l’IL-6 et l’IL-10 et de
chimiokines telles que CCL2 et CCL7 par les cellules mononucléées (Yu et al., 2007). En
outre, notre groupe a montré que les kératinocytes cultivés en présence d’IL-17A, d’IL-22,
d’IL-1α ou du TNFα surexpriment LL-37 (Guilloteau et al., 2010). Ensuite LL-37 et les
cytokines Th17 (IL-17 et IL-22) exercent une activité synergique en induisant la production
d’IL-6 et de CXCL8, lesquelles contribuent à l’inflammation cutanée dans le psoriasis (Chen
et al., 2013).
Une expression différentielle de LL-37 semble jouer un rôle dans la susceptibilité des patients atteints de maladies inflammatoires cutanées vers des complications infectieuses. Il est induit dans les kératinocytes des patients atteints de psoriasis, de lupus érythémateux, ou de dermatite de contact (Frohm et al., 1997). Sa surexpression dans le psoriasis est corrélée
avec un faible taux d’infection secondaire. En revanche, LL-γ7 n’est pas surexprimé chez les
patients souffrant de dermatite atopique, qui sont susceptibles à des infections virales ou bactériennes (Ong et al., 2002).
1.2. Les défensines 1.2.1. Généralités
Les défensines sont des PAM cationiques de poids moléculaire compris entre 3 et 5 kDa et résistantes aux protéases (Hoffmann et al., 1999). Chez les vertébrés, il existe 3
familles : les α, et θ-défensines. Elles ont un spectre d’activité très large allant des bactéries
à Gram positif au Gram négatif, aux champignons, aux virus enveloppés et aux protozoaires
(Jonard et al., 2006). Les - et -défensines auraient un gène ancestral commun et sont
présentes chez l’Homme (Hoffmann et al., 1999; Izadpanah and Gallo, 2005), tandis que les -défensines se trouvent seulement chez le singe (Rhésus macaque) et diffèrent des 2 autres
par leur structure (Diamond et al., 2009). Les défensines ont une structure commune
composée de trois feuillets plissés , incluant une hélice . Elles sont riches en arginine et
possèdent 6 résidus cystéines conservés qui forment 3 ponts disulfures intramoléculaires
(Chen et al., 2006). Leur classification est conditionnée par l’emplacement des ponts
disulfures (Selsted and Ouellette, 2005; Wiesner and Vilcinskas, 2010).
2006). Elles sont constituées de 29 à 50 acides aminés et sont caractérisées par la présence de ponts disulfures entre les résidus 1 et 6, 2 et 4, et 3 et 5 (Figure 11). HNP-2 est une forme tronquée des peptides HNP-1 ou HNP3 et dérive donc des gènes codants HNP-1 ou HNP-3.
Figure 11. Structure primaire et emplacement des ponts disulfures des α-, β-défensines humaines (Wiesner and Vilcinskas, 2010).
HNP-1, HNP-2 et HNP-3, et en faible quantité, HNP-4, sont principalement présents dans les granules azurophiles des polynucléaires tandis que HD-5 et HD-6 sont sécrétées par
les cellules de Paneth de l’intestin grêle (Wiesner and Vilcinskas, 2010). HNP-1, HNP-2 et
HNP-3 sont également produits par les NK, les lymphocytes T, les lymphocytes B et les
monocytes (Agerberth et al., 2000; Lehrer and Lu, 2012). Ces trois PAM sont doués d’activité
antimicrobienne vis-à-vis d’Escherichia coli, de Staphylococcus aureus et de Pseudomonas
aeruginosa (Harder and Schröder, 2005). Dans les maladies inflammatoires comme le
psoriasis, l’expression de ces trois défensines est augmentée dans la peau lésionnelle par
rapport à la peau normale, probablement produits par les polynucléaires neutrophiles (Harder and Schröder, 2005).
Les -défensines humaines (« Human Beta Defensin », HBD) sont constituées de 41 à 50 acides aminés et les ponts disulfures sont localisés au niveau des résidus 1 et 5, 2 et 4, et 3
et 6 (Figure 11). Actuellement il y a plus de 17 HBD chez l’Homme et elles ont une
distribution plus large dans l’organisme que les α-défensines dans l’organisme (Chen et al.,
2006). Les -défensines les plus décrites sont HBD-1 à 4 et elles ont été identifiées dans la
peau, les cellules épithéliales des voies respiratoires, le cœur ou encore dans les reins (Chen
-défensines
et al. 2006). Enfin elles ont un spectre d’activité très large contre une sélection de
microorganismes : des bactéries Gram positif comme Staphylococcus aureus et Streptococcus
pyogenes ; des bactéries Gram négatif comme Escherichia coli et Pseudomonas aeruginosa ;
et des champignons comme Candida albicans (Jonard et al., 2006).
Au niveau cutané, les -défensines sont, d’une part, d’importants effecteurs directs de
l’immunité innée afin de protéger l’organisme contre des infections locales et d’autre part,
modulent la réponse inflammatoire. Dans cet exposé, nous nous intéresserons plus
particulièrement aux rôles des -défensines HBD-1, HBD-2 et HBD-3 en physiologie mais
aussi à leur implication en situation pathologique.
1.2.2. HBD1
HBD1 est un PAM cationique composé de 36 acides aminés et de poids moléculaire
d’environ 4-5 kDa. Son spectre d’activité antimicrobienne est encore peu étudié mais elle agit
contre Escherichia coli et une bactérie à Gram positif : Streptococcus pyogenes (Jonard et al.,
2006). Elle a été initialement isolée à partir d’hémofiltrat de patients dyalisés (Bensch et al.,
1995). Elle a ensuite été retrouvée dans les épithéliums qui sont directement exposés à
l’environnement ou à la flore microbienne notamment au niveau du tissus cutané, des
poumons, des glandes sécrétoires ou du pancréas (Bensch et al., 1995; De Smet and Contreras, 2005). Au niveau cutané, HBD1 est constitutivement exprimée par les kératinocytes des couches supérieures (couche épineuse et couche cornée) et très faiblement
dans les couches basales indifférenciées, supportant l’hypothèse qu’elle participe à la défense
antimicrobienne de la peau (Ali et al., 2001).
1.2.3. HBD2
HBD2 est un PAM cationique de 43 acides aminés, de faible poids moléculaire (4 kDa) et a été isolée pour la première fois dans la peau de patients psoriasiques (Harder et al., 1997). Chez les sujets sains, elle est localisée en faible quantité au niveau de la couche épineuse et de la couche cornée (Ali et al., 2001). En situation inflammatoire comme par exemple le psoriasis, elle est retrouvée en grande quantité dans le cytoplasme des cellules de la couche épineuse et de la couche granuleuse (Harder et al., 2004; Huh et al., 2002; Liu et al.,