T H E S E
Présentée et publiquement soutenue devant LA FACULTE DE PHARMACIE DE MARSEILLE
Le Vendredi 16 Mars 2018
Par Fanny GRIMAUD Née le 2 juin 1979 à MarseilleEN VUE D’OBTENIR
LE DIPLOME D’ETAT DE DOCTEUR EN PHARMACIE
Stratégies thérapeutiques innovantes
dans la maladie de Crohn :
place de la thérapie cellulaire
JURY :
Président : Pr. Françoise DIGNAT-GEORGE, Aix Marseille Université
Membres :
Dr. Martine BUES-CHARBIT, Assistance Publique des Hôpitaux de Marseille
Pr. Bruno LACARELLE, Aix Marseille Université
Dr. Pierre-Charles ORSONI, Assistance Publique des Hôpitaux de Marseille
Pr. Florence SABATIER, Aix Marseille Université
27 Boulevard Jean Moulin – CS 30064 - 13385 MARSEILLE Cedex 05
Tel. : 04 91 83 55 00 – Fax : 04 91 80 26 12
ADMINISTRATION :
Doyen : Mme Françoise DIGNAT-GEORGE
Vice-Doyens : M. Jean-Paul BORG, M. Philippe CHARPIOT, M. Pascal RATHELOT
Chargés de Mission : M. David BERGE-LEFRANC, M. François DEVRED, Mme Caroline
DUCROS, Mme Pascale BARBIER
Conseiller du Doyen : M. Patrice VANELLE
Doyens honoraires : M. Jacques REYNAUD, M. Pierre TIMON-DAVID, M. Patrice VANELLE
Professeurs émérites : M. José SAMPOL, M. Jean-Pierre REYNIER
Professeurs honoraires : M. Guy BALANSARD, M. Jacques BARBE, M. Yves BARRA,
Mme Claudette BRIAND, M. Jacques CATALIN, Mme Andrée CREMIEUX, M. Aimé CREVAT, M. Bernard CRISTAU,
M. Gérard DUMENIL, M. Alain DURAND, Mme Danielle GARÇON, M. Maurice JALFRE, M. Joseph JOACHIM, M. Maurice LANZA, M. José MALDONADO, M. Patrick REGLI, M. Jean-Claude SARI
Chef des Services Administratifs : Mme Florence GAUREL
Chef de Cabinet : Mme Sandrine NOURIAN
Responsable de la Scolarité : Mme Myriam TORRE
DEPARTEMENT BIO-INGENIERIE PHARMACEUTIQUE Responsable : Professeur Philippe PICCERELLE
PROFESSEURS
BIOPHYSIQUE M. Vincent PEYROT
M. Hervé KOVACIC
GENIE GENETIQUE ET BIOINGENIERIE M. Christophe DUBOIS
PHARMACIE GALENIQUE, PHARMACOTECHNIE INDUSTRIELLE,
MAITRES DE CONFERENCES
BIOPHYSIQUE M. Robert GILLI
Mme Odile RIMET-GASPARINI Mme Pascale BARBIER
M. François DEVRED Mme Manon CARRE M. Gilles BREUZARD Mme Alessandra PAGANO
GENIE GENETIQUE ET BIOTECHNOLOGIE M. Eric SEREE-PACHA
Mme Véronique REY-BOURGAREL PHARMACIE GALENIQUE, PHARMACOTECHNIE INDUSTRIELLE, M. Pascal PRINDERRE
BIOPHARMACIE ET COSMETOLOGIE M. Emmanuel CAUTURE
Mme Véronique ANDRIEU Mme Marie-Pierre SAVELLI
NUTRITION ET DIETETIQUE M. Léopold TCHIAKPE
A.H.U.
CULTURE ET THERAPIE CELLULAIRE M. Jérémy MAGALON
ENSEIGNANTS CONTRACTUELS
ANGLAIS Mme Caroline MONTET
DEPARTEMENT BIOLOGIE PHARMACEUTIQUE Responsable : Professeur Philippe CHARPIOT
PROFESSEURS
BIOCHIMIE FONDAMENTALE, MOLECULAIRE ET CLINIQUE M. Philippe CHARPIOT
BIOLOGIE CELLULAIRE M. Jean-Paul BORG
HEMATOLOGIE ET IMMUNOLOGIE Mme Françoise DIGNAT-GEORGE
Mme Laurence CAMOIN
Mme Florence SABATIER-MALATERRE
MICROBIOLOGIE M. Jean-Marc ROLAIN
M. Philippe COLSON PARASITOLOGIE ET MYCOLOGIE MEDICALE, HYGIENE ET
ZOOLOGIE
Mme Nadine AZAS-KREDER
MAITRES DE CONFERENCES
BIOCHIMIE FONDAMENTALE, MOLECULAIRE ET CLINIQUE Mme Dominique JOURDHEUIL-RAHMANI M. Thierry AUGIER
M. Edouard LAMY
Mme Alexandrine BERTAUD Mme Claire CERINI
Mme Edwige TELLIER M. Stéphane POITEVIN
HEMATOLOGIE ET IMMUNOLOGIE Mme Nathalie BARDIN
Mme Dominique ARNOUX Mme Aurélie LEROYER M. Romaric LACROIX
MICROBIOLOGIE Mme Michèle LAGET
M. Michel DE MEO
Mme Anne DAVIN-REGLI Mme Véronique ROUX M. Fadi BITTAR
Mme Isabelle PAGNIER Mme Sophie EDOUARD PARASITOLOGIE ET MYCOLOGIE MEDICALE, HYGIENE ET Mme Carole DI GIORGIO
ZOOLOGIE M. Aurélien DUMETRE
Mme Magali CASANOVA Mme Anita COHEN
BIOLOGIE CELLULAIRE Mme Anne-Catherine LOUHMEAU
A.H.U.
HEMATOLOGIE ET IMMUNOLOGIE Mme Sylvie COINTE
DEPARTEMENT CHIMIE PHARMACEUTIQUE Responsable : Professeur Patrice VANELLE
PROFESSEURS
CHIMIE ANALYTIQUE, QUALITOLOGIE ET NUTRITION M. Henri PORTUGAL Mme Catherine BADENS CHIMIE PHYSIQUE – PREVENTION DES RISQUES ET
NUISANCES TECHNOLOGIQUES
M. Philippe GALLICE
CHIMIE MINERALE ET STRUCTURALE – CHIMIE THERAPEUTIQUE
M. Pascal RATHELOT M. Maxime CROZET
CHIMIE ORGANIQUE PHARMACEUTIQUE M. Patrice VANELLE
M. Thierry TERME PHARMACOGNOSIE, ETHNOPHARMACOLOGIE, HOMEOPATHIE Mme Evelyne OLLIVIER
PROFESSEURS ASSOCIES A TEMPS PARTIEL (P.A.S.T.) GESTION PHARMACEUTIQUE, PHARMACOECONOMIE M. Jean-Pierre CALISSI ET ETHIQUE PHARMACEUTIQUE OFFICINALE
MAITRES DE CONFERENCES
BOTANIQUE ET CRYPTOGAMIE, BIOLOGIE CELLULAIRE Mme Anne FAVEL
Mme Joëlle MOULIN-TRAFFORT
CHIMIE ANALYTIQUE, QUALITOLOGIE ET NUTRITION Mme Elisabeth SCHREIBER-DETURMENY Mme Catherine DEFOORT
M. Alain NICOLAY Mme Estelle WOLFF Mme Elise LOMBARD CHIMIE PHYSIQUE – PREVENTION DES RISQUES ET M. David BERGE-LEFRANC
NUISANCES TECHNOLOGIQUES M. Pierre REBOUILLON
CHIMIE THERAPEUTIQUE Mme Catherine DIANA
Mme Sandrine FRANCO-ALIBERT Mme Caroline DUCROS
M. Marc MONTANA
CHIMIE ORGANIQUE PHARMACEUTIQUE M. Armand GELLIS
HYDROLOGIE M. Christophe CURTI
Mme Julie BROGGI M. Nicolas PRIMAS M. Cédric SPITZ M. Sébastien REDON PHARMACOGNOSIE, ETHNOPHARMACOLOGIE, HOMEOPATHIE M. Riad ELIAS
Mme Valérie MAHIOU-LEDDET Mme Sok Siya BUN
Mme Béatrice BAGHDIKIAN MAITRES DE CONFERENCE ASSOCIES A TEMPS PARTIEL (M.A.S.T.)
CHIMIE ANALYTIQUE, QUALITOLOGIE ET NUTRITION Mme Anne-Marie PENET-LOREC CHIMIE PHYSIQUE – PREVENTION DES RISQUES ET M. Thierry ATHUYT
NUISANCES TECHNOLOGIQUES
DROIT ET ECONOMIE DE LA PHARMACIE M. Marc LAMBERT
DROIT ET COMMUNICATION PHARMACEUTIQUES A L’OFFICINE M. Philippe BESSON ET GESTION DE LA PHARMAFAC
AHU
CHIMIE ORGANIQUE PHARMACEUTIQUE Mme Manon ROCHE
ATER
CHIMIE ANALYTIQUE Mme Camille DESGROUAS
DEPARTEMENT MEDICAMENT ET SECURITE SANITAIRE Responsable : Professeur Benjamin GUILLET
PROFESSEURS
PHARMACIE CLINIQUE Mme Diane BRAGUER
PHARMACODYNAMIE M. Benjamin GUILLET
TOXICOCINETIQUE ET PHARMACOCINETIQUE M. Athanassios ILIADIS
TOXICOLOGIE GENERALE M. Bruno LACARELLE
TOXICOLOGIE DE L’ENVIRONNEMENT Mme Frédérique GRIMALDI
MAITRES DE CONFERENCES
PHARMACODYNAMIE Mme Suzanne MOUTERDE-MONJANEL
PHYSIOLOGIE Mme Sylviane LORTET
Mme Emmanuelle MANOS-SAMPOL
TOXICOCINETIQUE ET PHARMACOCINETIQUE M. Hot BUN
M. Joseph CICCOLINI
Mme Raphaëlle FANCIULLINO TOXICOLOGIE GENERALE ET PHARMACIE CLINIQUE M. Pierre-Henri VILLARD
M. Stéphane HONORÉ
Mme Caroline SOLAS-CHESNEAU Mme Marie-Anne ESTEVE
A.H.U.
PHARMACODYNAMIE M. Philippe GARRIGUE
ATER
PHARMACODYNAMIE M. Guillaume HACHE
Mme Ahlel BOUHLEL
CHARGES D’ENSEIGNEMENT A LA FACULTE
Mme Nathalie AUSIAS, Pharmacien-Praticien hospitalier M. Pierre BERTAULT-PERES, Pharmacien-Praticien hospitalier Mme Martine BUES-CHARBIT, Pharmacien-Praticien hospitalier M. Gérard CARLES, Pharmacien-Praticien hospitalier
Mme Nicole FRANCOIS, Pharmacien-Praticien hospitalier Mme Sophie GENSOLLEN, Pharmacien-Praticien hospitalier Mme Christine PENOT-RAGON, Pharmacien-Praticien hospitalier M. Stéphane PICHON, Pharmacien titulaire
M. Alain RAGON, Pharmacien-Praticien hospitalier
M. Badr Eddine TEHHANI, Pharmacien – Praticien hospitalier
Mise à jour le 1er décembre 2015
Remerciements
Cet ouvrage est le fruit d’une recherche bibliographique menée dans le cadre de la préparation d’une thèse d’exercice en pharmacie à l’Université d’Aix-Marseille sur le thème de la thérapie cellulaire dans la maladie de Crohn.
De nombreuses personnes ont participé, de différentes manières, à la réalisation de ce travail. Je leur en saurai gré toute ma vie et l’expression de ma reconnaissance passe également par l’impression de leurs noms et qualités dans ce travail.
A Madame le Professeur Françoise Dignat-George,
pour ses précieux conseils, ses encouragements et sa bienveillance constants.
Très sensible à l’intérêt que vous n’avez cessé de me témoigner tout au long de mon parcours, c’est un honneur pour moi que vous ayez accepté de prendre la présidence du jury de ma thèse. Je vous adresse ici ma très respectueuse considération.
A Madame le Professeur Florence Sabatier,
pour m’avoir permis de conduire ce travail de recherche à son terme et avoir accepté d’en prendre la direction.
Dès vos premiers enseignements en thérapie cellulaire, vous m’avez contaminée et communiqué votre passion pour cette discipline innovante et prometteuse. Depuis, en m’intégrant au LCTC, vous m’avez ouvert la voie de l’excellence et je vous en sais gré.
A Monsieur le Professeur Bruno Lacarelle, pour son écoute, son soutien et sa disponibilité.
Grâce à la confiance que vous m’avez témoignée, mon stage au sein du LCTC s’est transformé en missions plus longues m’offrant par là-même la chance de m’impliquer davantage. Je vous dois une grande part de mes connaissances en thérapie cellulaire et ma gratitude est immense.
A Madame le Docteur Martine Bues-Charbit et Monsieur le Docteur Pierre-Charles Orsoni Pour avoir accepté d’être membres de ce jury et de juger ce travail de thèse.
Je ne peux manquer d’exprimer avec tendresse toute ma reconnaissance à mes proches.
A ma famille d’abord,
Et plus particulièrement à mes parents, Isabelle et Jean-Charles, qui m’ont encouragée et accompagnée dans cette reprise d’études.
A l’instar de l’astre qui nous donne vie, ma mère est mon soleil. Elle illumine mon existence, réchauffe mon être et éclaire ma route. Tandis qu’infailliblement mon père évolue autour de moi, diffusant sa douceur et sa sagesse, en veillant à ce que jamais je ne brûle mes ailes ni ne me laisse aveugler.
Merci Maman pour ta présence quasi-quotidienne, pour ta générosité qui frôle l’abnégation et pour ce rôle de grand-mère dans lequel tu es sublime.
Merci Papa pour tes conseils inestimables, pour les heures de relecture et pour ton soutien sans faille. Ta passion pour la médecine, ton amour pour tes patients et ton acharnement à rendre le monde meilleur coulent dans mes veines.
A Alice, ma grande sœur, que j’aime et à qui je ne le dis pas assez,
Merci pour ta disponibilité sans faille et tes conseils aiguisés de coach (pas sportif évidemment) dans les (rares) moments de doute,
Et bravo pour ton nouveau départ professionnel et ta réussite. Ton courage et ta détermination sont une source d’inspiration.
A Eve, ma fille, ma cellule souche, qui a su se faire microscopique dans les phases de travail intense, sans rien perdre de ses capacités à me régénérer.
A Yohann, qui sait… que je sais… que nous savons…
Yohann, Eve, ensemble, vous formez ma thérapie cellulaire personnelle. Je vous aime.
A Dany et Paul, pour la munificence qui enveloppe chacun de leurs gestes.
Merci pour votre présence et vos repas chaleureux au coin du feu ou sous un parasol.
Mais aussi,
A Maxime, Loulou et Agathe, du plus grand à la plus petite, avec tout mon amour, A Jean-David, avec ses éternels 40 ans et ses pivoines aux mille couleurs
A mes amies et mes amis,
Pour leur frivolité, leur légèreté et leur capacité à m’insuffler de grandes doses d’oxygène pur. Vous ne lirez certainement pas ma thèse et passerez donc à côté de votre minute de gloire mais… ne changez rien !
A toutes les personnes qui ont joué un rôle déterminant dans la genèse de cette histoire : Pascal Vignally, Stéphanie Gentile et Patrice Vanelle,
et aux jurys de la commission des admissions passerelle qui ont cru en moi et m’ont offert la chance de reprendre mes études à (un peu) plus de 30 ans, j’adresse mes plus sincères remerciements.
Je tiens aussi à partager la haute estime, teintée parfois d’admiration, que je porte à l’ensemble des éminents professeurs de la faculté de Pharmacie de Marseille, pour la pertinence et la rigueur de leurs enseignements. Durant toutes ces années, j’ai eu à cœur de me hisser à la hauteur des cours qui m’ont été dispensés. Et dans ce labyrinthe hermétique, au-delà des
connaissances qui jalonnent et encadrent ce parcours, la justesse, la clarté et l’énergie de chaque chaire a été mon fil d’Ariane.
Sur ce chemin, j’ai eu grand plaisir à partager mon quotidien avec les étudiants de ma promotion, qui ne m’ont jamais fait sentir que nous ne partagions pas la même génération. Qu’il me soit encore permis de porter mon regard reconnaissant au-delà de ces quatre années pour remercier ces femmes et ces hommes qui ont posé les fondations de ma vie professionnelle, desquels se distinguent mes trois premiers mentors :
Sophie Tardieu qui ne s’est pas contentée de diriger mon premier stage de fin de Master en m’initiant aux démarches qualité dans la santé, tant son ouverture d’esprit et son esprit d’initiative sont contagieux ;
Olivier Blin à qui je dois mes premiers pas dans l’industrie pharmaceutique, qui m’a donné le goût des challenge et le courage d’aller au-delà de mes réserves ;
Et Nathalie Lesavre qui m’a transmis son penchant pour la recherche clinique hospitalière, tel le moine Shaolin avec son apprenti. Je serai toujours son petit scarabée.
Enfin, ma gratitude s’adresse à toute l’équipe du LCTC qui a su m’accueillir en son sein : Florence, Julie, Jéremy, Laurent, Houssein, Chloé, Ignacio, ainsi que les internes et externes qui participent au quotidien du labo, notamment Mélanie, Pauline et Hajer.
Chaque jour depuis plus d’un an, je suis fière d’appartenir à cet essaim dynamique, dévoué aux patients, bourdonnant d’idées neuves, mu par l’enthousiasme et la bonne humeur et nourri, entre autre, par le chocolat noir.
« Stabilité et adaptabilité sont les deux mamelles de l’ordre homéostasique. (…) Constance du milieu intérieur ne signifie pas fixisme mais au contraire possibilité d’évoluer tout en résistant aux contraintes imposées par le milieu extérieur. »
Jean-Didier Vincent, neurobiologiste Il y a cinq ans, je luttais contre nature pour maintenir l’homéostasie de mon existence, coincée dans l’ankylose d’un système professionnel avide de titres plus que de compétences.
Confrontée à la rigidité grandissante qui menaçait ma vie, j’ai bouleversé l’équilibre, bien décidée à investir toute mon énergie dans l’obtention d’un doctorat, alors sésame de mon évolution.
Contre toute attente, je n’ai alors rencontré aucunes résistances, internes ou externes, qui soient de taille à mettre à mal ce défi. Dopée par le soutien sans faille de mes proches, j’ai parcouru le chemin que traçait ce choix, franchi chaque obstacle pour parvenir aujourd’hui à cet immense carrefour qui ouvre sur de nombreux débouchés.
Et je fais mienne la réflexion de Joël de Rosnay : « Dans la pensée actuelle, influencée par
l’approche systémique, la notion de fluide remplace celle de solide. Le mouvant remplace le permanant. Souplesse et adaptabilité remplacent rigidité et stabilité. »
« L’université n’entend donner aucune approbation, ni improbation aux opinions émises dans les thèses. Ces opinions doivent être considérées comme propres à leurs auteurs. »
INTRODUCTION
PARTIE I : LA MALADIE DE CROHN
I. La maladie de Crohn ... 21
1. La physiopathologie ... 22
a. La prédisposition génétique ... 22
b. Le microbiote intestinal ... 24
c. Les facteurs environnementaux ... 26
d. Le dysfonctionnement du système immunitaire ... 28
2. La localisation ano-périnéale de la MC ... 32
II. Les traitements de la maladie de Crohn ... 34
1. Les traitements conventionnels ... 36
2. Les anticorps monoclonaux ou la révolution de l’immunothérapie ... 40
3. Les médicaments en cours d’évaluation ... 51
4. Le traitement des fistules ... 54
5. Les greffes fécales ... 58
PARTIE II : THERAPIE CELLULAIRE & MALADIE DE CROHN I. La Thérapie Cellulaire ... 61
1. Définition... 61
2. Classification ... 62
II. Thérapie Cellulaire et Maladie de Crohn ... 69
1. La greffe de cellules souches hématopoïétiques dans la MC ... 69
a. Le rationnel ... 69
b. La procédure de greffe de CSH ... 70
c. Les données cliniques ... 72
d. Conclusion ... 78
2. La greffe de cellules souches mésenchymateuses dans la MC ... 79
a. Les cellules souches mésenchymateuses ... 79
b. Le rationnel ... 82
c. Les données cliniques ... 83
d. Conclusion ... 90
3. La fraction vasculaire stromale ... 92 CONCLUSION
REFERENCES BIBLIOGRAPHIQUES ANNEXE 1
Liste des abréviations
ADN : Acide DésoxyriboNucléique GvHD : Graft vesus Host Disease AD-MSC : Adipose Derived Mesenchymal Stem Cell GVL : Graft Versus Leukemia
AGA : American Gastroenterology Association GWAS : Genome-Wide Association Study AIEC : E. Coli entéro-Adhérents et Invasifs HE : Hospital Exemption
AINS : Anti-Inflammatoire Non Stéroïdien HLA : Human Leucocyte Antigen
AMM : Autorisation de Mise sur le Marché IBDQ : Inflammatory Bowel Disease Quality of life
ANSM : Agence Nationale de Sécurité des
Médicaments et des produits de santé IC : Intervalle de Confiance
ARN : Acide RiboNucléique IDO : Indoleamine 2-3 DiOxygenases 5-ASA : 5-AminoSAlicylés IFN γ : InterFéroN gamma
ASC : Adipose-derived Stem Cell Ig : Immunoglobuline ASMR : Amélioration du Service Médical Rendu IL : InterLeukine ASTIC : Autologous Stem Cell Transplantation
International Crohn’s disease IMC : Indice de Masse Corporelle ATG : Anti-ThymoGlobuline iPS : induced Pluripotent Stem cells ATMP : Advanced Therapy Medicinal Product IRM : Imagerie par Résonance Magnétique ATU : Autorisation Temporaire d’Utilisation ISCT : International Society for Cellular
Therapy
BM-MSC : Bone-Marrow Mesenchymal Stem Cell ITT : Intention To Treat CARD : Caspase Recruitment Domain IV : IntraVeineux(se) CDAI : Crohn’s Disease Activity Index JAK : Janus Kinase CHMP : Committee for Medicinal Products for
Human Use LB : Lymphocyte B
CMF : CytoMétrie en Flux LEEM : Les Entreprises du Médicament CMH : Complexe Majeur d’Histocompatibilité LEMP : LeucoEncéphaloPathie Multifocale CS : Cellules Souches LIFT : Ligation of the Intersphincteric Fistula
Tract
CSH : Cellules Souches Hématopoïétiques LPS : LipoPolySaccharide CSM : Cellules Souches Mésenchymateuses LT : Lymphocyte T CSP : Code de Santé Publique LTh : Lymphocyte T helper
CT : Commission de Transparence MadCAM-1 : Mucosal vascular addressin Cell Adhesion Molecule 1
DHFR : DiHydroFolate Réductase MAI : Maladie Auto-Immune et Auto-Inflammatoire
EBMT : European Society for Blood & Marrow
Transplantation MATHEC :
Maladie Auto-immune et THErapie Cellulaire
ECCO : European Crohn’s and Colitis
Organisation MDP : Muramyl-DiPeptide
EIG : Effet Indésirable Grave MICI : Maladie Inflammatoire Chronique de l’Intestin
EMA : European Medicine Agency mITT : modified Intention To Treat FDA : Food & Drug Administration MC : Maladie de Crohn
FVS : Fraction Vasculaire Stromale MM : Masse Moléculaire GALT : Gut-Associated Lymphoid Tissue 6-MP : 6-MercaptoPurine
GCSF : Granulocyte Colony Stimulating Factor MTC : Médicament de Thérapie Cellulaire GETAID :
Groupe d’Etude Thérapeutique des Affections Inflammatoires du Tube Digestif
MTI : Médicament de Thérapie Innovante RTU : Recommandation Temporaire d’Utilisation
MTI PP : Médicament de Thérapie Innovante
Préparé Ponctuellement SC : Sous-Cutanée
NFκB : Nuclear Factor-kappa B SDR : Sustained Disease Remission NOD : Nucleotide-binding Oligomerization
Domain SEP : Sclérose En Plaques
NS : Non Significatif SFGM-TC : Société Francophone de Greffe de Moelle et Thérapie Cellulaire OR : Odds Ratio SMAD7 : Mothers Against Decapentaplegic homolog 7 PDAI : Perineal Disease Activity Index SMR : Service Médical Rendu
PEG : PolyEthylène Glycol SNP : Single-Nucleotide Polymorphism
PGE 2 : ProstaGlandine E2 S1P : Sphingosine-1-Phosphate
PIIT : Produit Issu de l’Ingénierie Tissulaire SSc : Sclérodermie Systémique
PGN : PeptidoGlycaNe STAT : Signal Transducers and Activators of Transcription PHRC : Programme Hospitalier de Recherche
Clinique
SVF : Stromal Vasculaire Fraction
PNMR : Plan National des Maladies Rares TC : Thérapie Cellulaire
PP : Per Protocol TGF ß : Transforming Growth Factor bêta
PPARγ : Peroxisome Receptor gamma Proliferator-Activated TLR : Toll Like Receptor
PTC : Préparation de Thérapie Cellulaire TNF-α : Tumor Necrosis Factor alpha
qPCR : quantitative Polymerase Chain Reaction TSG-6 : TNF-α Stimulated gene/protein 6
RCH : RectoColite Hémorragique USD : United States Dollar
Liste des figures Figure 1 : Pathogénèse des MICI
Figure 2 : Loci associés au risque de développer une MICI
Figure 3 : Situation au niveau d’une paroi intestinale saine
Figure 4 : Situation au niveau d’une paroi intestinale enflammée
Figure 5 : Classification de Parks
Figure 6 : Fistule simple
Figure 7 : Fistule complexe
Figure 8 : Progression des lésions digestives et de l’activité inflammatoire chez un patient théorique atteint de la maladie de Crohn
Figure 9 : Mode d’action des aminosalicylés (5ASA)
Figure 10 : Immunosuppresseurs et inhibition des signaux d’activation lymphocytaire
Figure 11 : Anticorps monoclonaux Infliximab et Adalimumab
Figure 12 : Certolizumab pegol
Figure 13 : Processus normal de migration des leucocytes circulants vers les tissus
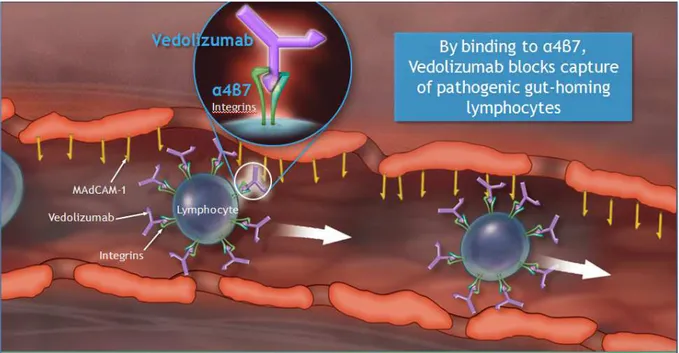
Figure 14 : Mode d’action du vedolizumab
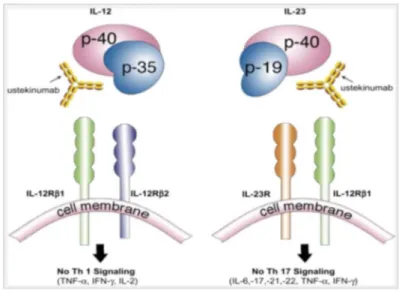
Figure 15 : Sous-unités p-40 des IL-12 et IL-23
Figure 16 : Mode d’action de l’etrolizumab
Figure 17 : Mode d’action de l’ozanimob
Figure 18 : Drainage d’une fistule par mise en place d’un séton
Figure 19 : Fistulotomie ou mise à plat d’une fistule
Figure 20 : Schéma du tracé d’incision du lambeau d’avancement rectal
Figure 21 : Schéma de l’aspect après confection des sutures latérales
Figure 22 : Réponse clinique de 4 séries de cas (méta-analyse) chez 59 patients MC
Figure 23 : Les différents types de biothérapies
Figure 24 : Génération des iPS
Figure 25 : Définition des cellules souches mésenchymateuses selon l’International Society for Cellular Therapy (ISCT, 2006)
Figure 26 : Efficacité clinique. Valeurs du CDAI pré et post-greffe (Oyama et al., 2005)
Figure 27 : Efficacité clinique. Valeurs du CDAI pré et post-greffe (Cassinotti et al., 2008)
Figure 28 : Valeurs du CDAI pré et post-greffe (Burt et al., 2010)
Figure 29 : Valeurs du CDAI avant et après la phase de mobilisation et la greffe de CSH (Hasselblatt et al., 2012)
Figure 30 : Pourcentage de patients en rémission clinique ou endoscopique ou présentant une amélioration de la qualité de vie à 1 an post-greffe (IC 95%) (Lindsay et
al., 2017)
Figure 31 : La multipotence des CSMs
Figure 32 : Effets des CSMs sur la réponse immunitaire.
Figure 33 : Taux de rémission à la semaine 24 (Panes et al., 2016)
Figure 34 : Taux de rémission à la semaine 24 selon la stratification par traitements concomitants (Panes et al., 2016)
Figure 35 : Résultats d’efficacité à long-terme (52 semaines) dans la population mITT
(Panes et al., 2017)
Liste des tableaux Tableau 1 : Anti-métabolites utilisés dans la MC
Tableau 2 : Les anticorps monoclonaux indiqués dans la MC et disponibles sur le marché
Tableau 3 : Résultats d’efficacité sur le critère de jugement principal composite (sustained disease remission) et sur les critères de jugement secondaires (Hawkey et al., 2015)
Tableau 4 : Evolution des valeurs des scores CDAI et IBDQ entre le début de l’étude (baseline) et 1 an post-greffe (Lindsay et al., 2017)
Tableau 5 : Cicatrisation des fistules à 8 semaines dans le groupe colle + ASCs versus le groupe colle seule (Garcia-Olmo et al., 2009)
Tableau 6 : Cicatrisation des fistules aux semaines 12 et 24 (Herreros et al., 2012)
Tableau 7 : Résultats d’efficacité sur la cicatrisation des fistules dans la MC à la semaine 8 (Lee et al., 2013)
Tableau 8 : Résultats d’efficacité à long terme (Cho et al., 2015)
Tableau 9 : Effets des CSMs (issues du tissu adipeux AD-MSC ou de la moelle osseuse BM-MSC) dans la maladie de Crohn fistulisante (Hawkey et al., 2017)
Tableau 10 : Résumé des caractéristiques patient, des spécifications des traitements injectés et des résultats obtenus (Garcia-Olmo et al., 2009)
La maladie de Crohn est une maladie inflammatoire chronique du tube digestif alternant des phases d’activité (ou « poussées ») d’intensité variable avec des phases de rémission plus ou moins complète et prolongée. Les fistules ano-périnéales sont des lésions fréquemment associées à l’évolution de la maladie et concernent plus d’un tiers des patients. De ce fait, il s’agit d’une pathologie invalidante responsable d’une altération marquée de la qualité de vie tant au niveau physique, psychique et social.
Bien que de mieux en mieux comprise, l’étiologie précise de la maladie est encore inconnue. Il n’existe pas, de ce fait, de traitement curatif de la maladie. Cependant, ces quinze dernières années, l’avènement des biothérapies avec notamment les anti-TNFα, a permis de modifier l’histoire naturelle des maladies inflammatoires chroniques intestinales.
Malheureusement, des patients restent en échec thérapeutique avec persistance des symptômes, de l’inflammation voire des lésions fistuleuses. Dans ce dernier cas, des traitements chirurgicaux peuvent être proposés mais sont limités par un risque d’incontinence anale.
Devant ce besoin médical non satisfait, le développement de traitements alternatifs reste encore un défi. Dans ce contexte, la thérapie cellulaire constitue une approche thérapeutique innovante permettant de prendre en charge à la fois la composante luminale de la maladie de Crohn mais aussi les lésions ano-périnéales, comme les fistules.
Au sein de l’Assistance Publique des Hôpitaux de Marseille (APHM), le Laboratoire de Culture et de Thérapie Cellulaire (LCTC) est reconnu pour son expertise dans le domaine de la thérapie cellulaire innovante. Depuis plusieurs années, en collaboration étroite avec les équipes médicales, le LCTC s’intéresse à l’évaluation en pratique clinique de la Fraction Vasculaire Stromale (FVS) issue du tissu adipeux autologue dans différentes pathologies. L’essai ADICHRON (NCT 02520843), évaluant la tolérance, la sécurité et l’efficacité de la micro réinjection de tissu graisseux autologue et de la fraction vasculaire stromale autologue extraite du tissu adipeux dans le traitement des fistules anales réfractaires au traitement médico-chirurgical conventionnel, est à l’origine du sujet de cette thèse.
Dans une première partie, nous présenterons la maladie de Crohn et les traitements actuellement ou prochainement disponibles. Compte-tenu de la complexité de la pathogénèse et de l’étendue des données publiées, nous ne détaillerons que les aspects qui font l’objet d’une
actualité ou qui ont marqué un tournant dans la compréhension de la maladie. Nous traiterons ensuite des spécificités que représentent les lésions ano-périnéales et notamment les fistules et aborderons les traitements médico-chirurgicaux proposés.
Dans une seconde partie, nous développerons les approches de thérapie cellulaire utilisées dans le traitement de la maladie de Crohn en se concentrant sur la greffe de cellules souches hématopoïétiques et l’administration de cellules souches mésenchymateuses. L’objectif de ce travail est de réaliser une synthèse du potentiel clinique de ces approches à travers une revue de la littérature des données cliniques publiées à ce jour.
PARTIE I :
Burill B CROHN (1884-1983)
La MC a été décrite officiellement pour la première fois par le Dr Burill B. CROHN.
December 11, 1931: “I have an important scientific contribution Iwould like to present before the AGA next May. Ihave discovered, I believe, a new intestinaldisease, which we have named Terminal Ileitis"”
JAMA 1932:99:1323-29: “…The ulceration of the mucosa is accompanied by a
disproportionate connective tissue reaction of the remaining walls of the involved intestine, a process which frequently leads to stenosis of the lumen of the intestine, associated with the formation of multiple fistulas…”
I.
La maladie de Crohn
La maladie de Crohn (MC) est une maladie inflammatoire chronique de l’intestin (MICI) qui peut toucher n’importe quel segment du tube digestif « de la bouche à l’anus », mais qui affecte préférentiellement la partie iléo-caecale (1) (2).Elle se différencie de l’autre MICI, la rectocolite hémorragique (RCH), par sa topographie, son histologie et son évolution.
Elle se caractérise par une réponse inflammatoire excessive, évoluant par poussées, alternant avec des phases de rémission, de fréquence et de gravité très variables d’un patient à l’autre et chez le même patient. Elle peut se manifester cliniquement par une diarrhée chronique, des douleurs abdominales récurrentes, une importante perte de poids et des signes systémiques comme des malaises ou de la fièvre. La MC n’augmente pas la mortalité mais, en raison de sa survenue tôt dans la vie et de sa chronicité, elle induit une morbidité importante qui altère la qualité de vie des patients.
Dans la majeure partie de la population, la MC est diagnostiquée entre 15 et 30 ans et affecte également les 2 sexes.
Les incidences les plus élevées de MC sont observées en Europe occidentale et nordique, en Amérique du Nord et en Nouvelle-Zélande (3). En Europe, elle est estimée à 3,9-7 cas pour
100 000 habitants et par an ce qui correspond à 23 000 à 41 000 nouveaux cas de MC par an
pour l’ensemble de l’Europe (4). En France, le nombre de nouveaux cas chaque année est compris entre 4 et 5 pour 100 000 habitants. Une augmentation de l’incidence de la MC est observée depuis 50 ans et a touché presque toutes les régions du globe, notamment des pays où, il y a encore 15 ans, la maladie était peu répandue comme la Corée du Sud, la Chine, l’Inde, l’Iran, l’Afrique du Nord ou encore la Thaïlande et le Japon (5) (6). Parallèlement, les études montrent une augmentation des formes pédiatriques. Dans le Nord de la France, par exemple, l’incidence des MICI est passée de 4,6 cas pour 100 000 enfants sur la période de 1990-1995 à 8,8 cas pour 100 000 enfants sur la période de 2003-2005 (7).
La prévalence de la MC varie géographiquement, avec les plus hauts chiffres rapportés aux USA, Canada et Europe, où des prévalences autour de 300 cas pour 100 000 habitants ont été décrits. En 2015, on dénombrait 120 000 personnes atteintes de la MC en France (8) (9). On remarque par ailleurs l’existence d’un gradient Nord-Sud avec une incidence plus élevée dans le tiers Nord, sans que l’on puisse pour le moment y apporter d’explications (10).
1. La physiopathologie
L’étiologie des MICI, et plus particulièrement de la MC, reste inconnue mais l’atteinte de la muqueuse intestinale est liée à un dysfonctionnement de l’immunité. L’hypothèse actuelle décrit la MC comme une réponse inflammatoire et immunitaire anormale vis-à-vis du microbiote intestinal déclenchée ou aggravée par des facteurs environnementaux, chez des individus génétiquement prédisposés (Figure 1).
Figure 1 : Pathogénèse des MICI
(source : Shouval et Rufo, 2017 (11)
a. La prédisposition génétique
Le rôle du terrain génétique a été mis en évidence lors d’études sur des jumeaux. Les études ont montré que le taux de concordance chez les jumeaux monozygotes (« les vrais jumeaux ») était de 36 % alors qu’il n’était que de 4 % chez les jumeaux dizygotes (12) (13). Ces études ont montré non seulement l’intervention de facteurs génétiques dans l’apparition de la maladie mais aussi dans le phénotype de celle-ci (14). Ces résultats ont été confirmés dans des études de prévalence dans des familles atteintes de MC. Selon l’origine géographique ou ethnique, entre 2 et 22 % des patients ont un membre apparenté au premier degré atteint de MC.
développement de la MC et a conduit à rechercher des gènes impliqués dans cette pathologie.
Des études génétiques (GWAS : Genome-Wide Association Studies) de patients atteints de MICI ont montré que 163 loci différents sont associés à la RCH, la MC, ou les 2 (Figure 2) (15). La majorité d’entre eux ne sont pas spécifiques des MICI, et peuvent être retrouvés dans d’autres maladies. La plupart de ces SNPs (Single-Nucleotide Polymorphisms) n’augmente cependant que très modérément le risque relatif mais apporte d’importantes informations dans les mécanismes qui sont dérégulés dans les MICI. Plus récemment, une analyse a identifié 38 nouveaux loci associés aux MICI (16). Ces gènes de susceptibilité codent, notamment, pour des protéines impliquées dans diverses fonctions biologiques telles que l’immunité, l’autophagie, le stress du réticulum endoplasmique, l’intégrité de la barrière intestinale.
Figure 2 : Loci associés au risque de développer une MICI
CD : Crohn’Disease ; UC : Ulcerative Colitis ; IBD : Intestinal Bowel Disease (source : Jostins L et al., 2012 (15))
Focus : La mise en évidence du rôle du gène CARD15/NOD2 dans la MC en 2001 (17) (18) marque un tournant décisif dans la compréhension de la MC en attribuant un rôle fondamental à l’immunité innée. Plus de 30 mutations du gène CARD15/NOD2 ayant potentiellement un effet biologique ont été répertoriées chez des sujets malades et des sujets sains. La plupart d’entre elles sont rares et ne concernent qu’un petit nombre de malades. A l’inverse, trois mutations dites « perte de fonction » apparaissent fréquentes (variants R702W exon 4, G908R exon 8 et 1007fs exon 11) et sont exclusivement associées à la MC. Dans la MC, la fréquence cumulée des trois principales mutations est de 29%, donc beaucoup plus
élevée que chez les sujets sains (7%). Cependant, une mutation du gène CARD15/NOD2 n’est non seulement pas une condition suffisante mais ce n’est pas non plus une condition nécessaire ; être porteur d’une mutation ne signifie pas forcément être malade.
Le gène NOD2, porté par le chromosome 16, code pour un récepteur intra-cellulaire impliqué dans la reconnaissance des motifs muramyl-dipeptide (MDP), constituants du peptidoglycane (PGN) de la paroi cellulaire de certaines bactéries. NOD2 est majoritairement exprimé par les cellules immunitaires (macrophages, lymphocytes, cellules dendritiques) mais également par les cellules épithéliales intestinales (cellules de Paneth). Ogura et al. (18) ont pu montrer que CARD15/NOD2 était capable de répondre au lipopolysaccharide (LPS) bactérien en activant les voies de NFκB (Nuclear Factor-kappa B) et de l’apoptose. Ainsi, les mutations principales associées à la MC entraînent un défaut d’activation de NFκB liée à une perte de réponse au PGN.
Le génotypage de CARD15/NOD2 n’est pas utilisé dans la pratique courante pour 3 raisons essentielles : 1) le calcul du risque relatif dépend non seulement de CARD15/NOD2 mais aussi de nombreux autres facteurs génétiques et environnementaux actuellement encore inconnus pour certains, 2) aucune mesure préventive efficace ne peut être proposée à un éventuel sujet dépisté porteur de mutations sur le gène CARD15/NOD2 et 3) il n’existe pas de corrélation génotype/phénotype. La valeur diagnostique du génotypage de CARD15/NOD2 ne permet donc pas aujourd’hui de remettre en question les outils diagnostiques classiques que sont la clinique, l’endoscopie, l’histologie, la biologie ou la radiologie.
La découverte de CARD15/NOD2 a, d’une part, recentré la physiopathologie de la MC sur l’immunité innée non spécifique et, d’autre part, relancé les recherches sur le rôle de la flore digestive, suspectée depuis longtemps dans la MC.
b. Le microbiote intestinal
Il est aujourd’hui clairement établi que le microbiote intestinal joue un rôle dans certaines pathologies du système digestif (cancer colorectal, maladies inflammatoires chroniques de l’intestin) mais également dans les cas d’obésité, de diabète et d’autisme (19).
Le microbiote intestinal humain contient, entre autres micro-organismes, environ 1014
bactéries et représente un écosystème extrêmement complexe. Ces 1014 bactéries sont réparties
proportions sont régulées en permanence. Les Firmicutes et les Bacteroidetes constituent les deux phyla dominants du microbiote avec une représentativité respective de 60–75 % et 30–40 %.
En raison d’une diminution des coûts du séquençage haut-débit de l’ADN et de l’amélioration des outils d’analyse bio-informatique, il est aujourd’hui possible de comparer la composition des communautés bactériennes du tractus digestif des individus. L’analyse de l’ensemble des génomes bactériens présent dans un écosystème donné est appelée analyse
métagénomique. De grands programmes d’analyse du métagénome intestinal humain ont été
entrepris ces dernières années (MetaHIT).
Des études moléculaires, indépendantes de la culture*, basées pour la plupart sur le séquençage du gène codant pour l’ARN ribosomal 16S, ont permis de mettre en évidence certaines anomalies du microbiote intestinal au cours des MICI. Ces anomalies sont à la fois de nature qualitative (instabilité du microbiote au cours du temps, présence de bactéries inhabituelles, restriction de la biodiversité) et quantitative (augmentation de la concentration bactérienne muqueuse). Ces anomalies peuvent être regroupées sous le terme de dysbiose.
* Plus de 90% des espèces du microbiote intestinal ne peuvent pas être cultivées en laboratoire. Vivant dans la plupart des cas en absence d’oxygène, dans un environnement dont les propriétés physicochimiques sont souvent difficiles à caractériser et à reproduire.
La dysbiose correspond à un déséquilibre entre la quantité des bactéries dites « protectrices » (Bifidobacteria, Lactobacilli) et de bactéries dites « délétères » (Bacteroides, Escherichia coli, Enterobacter). Il a été montré que les bactéries « protectrices » possèdent des propriétés anti-inflammatoires, d’une part en inhibant la sécrétion de cytokines pro-inflammatoires par les cellules du système immunitaire et d’autre part en favorisant la sécrétion de cytokines anti-inflammatoires.
De nombreuses études ont montré l’existence de ce déséquilibre chez les patients atteints de MICI dont les principales caractéristiques sont : i) une restriction de la biodiversité des bactéries appartenant au phylum des Firmicutes ; ii) une diminution de la proportion de certains groupes bactériens tels que Clostridium leptum et notamment Faecalibacterium prausnitzii, dont le rôle protecteur a clairement été mis en évidence (20) ; iii) et une augmentation de la proportion des Entérobactéries comme certains E. coli entéro-adhérents et invasifs (AIEC) associée à la muqueuse iléale. Par ailleurs, la dysbiose observée chez les patients MICI ne se limite pas aux espèces bactériennes mais concerne également la composition mycologique et
virale.
En comparant le profil du microbiote intestinal obtenu par qPCR (quantitative Polymerase Chain Reaction) sur les selles de patients atteints de MICI, la dysbiose, et plus particulièrement le déficit en F. prausnitzii, semble plus marquée chez les patients en poussée par rapport à ceux en rémission. Ainsi, une dysbiose plus marquée pourrait être prédictive de rechute. Récemment, une étude microbiologique, insérée dans la cohorte STORI du GETAID (Groupe d’Etude Thérapeutique des Affections Inflammatoires du Tube Digestif), a permis de mettre en évidence la dysbiose associée à la MC comme facteur prédictif de récidive clinique après arrêt du traitement par infliximab au cours d’une MC bien contrôlée (21).
Au-delà de l’étude de sa composition, il a été mis en évidence que le microbiote intestinal exerce des fonctions majeures pour la physiologie de l’hôte à la fois métaboliques mais aussi d’effet barrière et de maturation du système immunitaire. En considérant le rôle fondamental que le microbiote intestinal joue dans la réponse immunitaire ainsi que dans différentes voies métaboliques essentielles de l’hôte, on peut facilement imaginer l’impact fonctionnel d’un déséquilibre de celui-ci sur le développement de différentes pathologies immunitaires et métaboliques.
La dysbiose est donc un élément clé dans la physiopathologie des MICI. Cependant, il n’est pas encore clairement établi si les changements de microflore observés sont la cause ou la conséquence (ou les deux) de l’inflammation observée chez ses patients.
c. Les facteurs environnementaux
Des études épidémiologiques analysant les incidences et les prévalences de la MC dans l’espace et dans le temps sont en faveur de l’implication de facteurs environnementaux dans son apparition (22). La répartition géographique ainsi que l’augmentation de l’incidence observée dans certains pays font penser qu’il existe un lien avec les pays occidentaux industrialisés, et notamment avec le mode de vie et/ou l’émergence de facteurs environnementaux depuis une cinquantaine d’années. L’étude de population migrant vers ces pays industrialisés a permis de montrer une forte augmentation des cas de MC chez les nouveaux arrivants par rapport à la population résidente. Pour exemple, l’étude des populations émigrantes a montré que si les parents qui ont émigré conservent l’incidence de leur pays d’origine, leurs enfants, quant à eux, présentent l’incidence du pays d’accueil.
être impliqués dans l’altération de la composition et des fonctions qualitative et quantitative du microbiote intestinal. Le microbiote pourrait ainsi être le lien entre le risque de développer une MC et l’environnement.
A ce jour, seul le tabagisme a été clairement été identifié comme facteur d’exposition environnemental associé avec le déclenchement et l’évolution de la MC. En effet, fumer, d’une part, augmente le risque de développer une MC (odds ratio [OR], 1.76; Intervalle de Confiance [IC] 95%, 1.40-2.22) et d’autre part aggrave son évolutivité en augmentant le risque de récidive et le recours aux interventions chirurgicales (23). A contrario, l’arrêt du tabac améliore de manière significative l’évolution de la MC en diminuant le risque de poussées, le recours à la corticothérapie et le besoin d’augmenter les posologies d’immunosuppresseurs. Chez l’enfant, l’exposition au tabagisme maternel in utero ou pendant l’enfance augmente le risque de développer une MC à l’âge adulte. Paradoxalement, il est à noter que fumer a un effet protecteur dans le développement des RCH (OR, 0.58; IC 95%, 0.45-0.75).
De nombreux autres facteurs environnementaux ont été envisagés pour expliquer l’émergence des MICI dans les pays développés : les antibiotiques, les contraceptifs oraux, les anti-inflammatoires non stéroïdiens (AINS), les infections, le mode de vie occidental (stress, anxiété, dépression, activité physique, sommeil), la vaccination, l’alimentation, la pollution. Toutefois, leur réelle implication reste controversée actuellement et n’a pas été clairement démontrée.
Parmi les agents infectieux suspectés on retrouve, par exemple, Listeria (L.
monocytogenes) et Yersinia (Y. enterocolitica), à l’origine de la théorie de « la chaine du froid »
développée par Hugot et al., (24). Les auteurs ont, en effet, mis en évidence de nombreuses coïncidences géographiques, temporelles et épidémiologiques entre l’accroissement important de l’utilisation des réfrigérateurs, favorisant le développement des espèces bactériennes psychotrophiques (capables de survivre et de se développer à des températures comprises entre -1°C et +10°C) dans les aliments, et l’incidence de la MC.
Les bonnes conditions sanitaires dans les pays développés sont également de plus en plus suspectées. L’amélioration des conditions d’hygiène, en réduisant l’exposition à des agents microbiens et parasitaires, pourrait contribuer à une fragilisation de l’immunité par défaut d’apprentissage. Cette défaillance instaure alors une réponse immunitaire excessive lors de l’exposition ultérieure à des antigènes environnementaux. Cette hypothèse « hygiéniste » est
notamment renforcée par l’augmentation des allergies et des maladies auto-immunes dans ces pays.
Plus largement, les scientifiques parlent aujourd’hui d’exposome qui regroupe l’accumulation des expositions environnementales, commençant in utero et se poursuivant tout au long de la vie.
d. Le dysfonctionnement du système immunitaire (22)
Dans la MC, comme dans un contexte auto-immun, l’inflammation est initialement médiée par l’immunité innée puis maintenue par l’activation du système immunitaire adaptatif responsable de la chronicité et de la progression de la maladie.
Compte tenu de son contact direct avec le microbiote intestinal, la muqueuse intestinale est caractérisée par une défense immunitaire innée importante afin de préserver son intégrité. En plus de systèmes de barrières limitant l’invasion bactérienne, il existe au sein du tube digestif des tissus lymphoïdes associés aux muqueuses appelées GALT (Gut-Associated Lymphoid Tissue), situés dans la lamina propria sous forme diffuse ou dans les plaques de Peyer sous forme de sites organisés. Leur fonction principale est la discrimination entre les antigènes commensaux (microbiote naturel, antigènes alimentaires,…) et les antigènes pathogènes afin d’assurer une réponse immune rapide et efficace.
Situation au niveau d’une paroi intestinale saine (Figure 3)
L’épithélium intestinal constitue une barrière entre la lumière intestinale et le milieu interne.
Pour protéger la muqueuse, une couche de mucus recouvre toute la surface de l’épithélium sécrété par les cellules épithéliales des villosités (cellules caliciformes ou en gobelet). Le mucus constitue à la fois une barrière physique et chimique face aux agents pathogènes et permet de séquestrer les micro-organismes (commensaux ou pathogènes) de la lumière intestinale. Des
peptides antimicrobiens (comme les défensines et les lectines) sont synthétisés dans le mucus
par les cellules épithéliales des cryptes (cellules de Paneth) et dégradent les membranes bactériennes tout en préservant les cellules intestinales. Les cellules de Paneth sont connues pour jouer un rôle important dans l’homéostasie de l’épithélium intestinal. Des altérations génétiques causant des anomalies fonctionnelles ou quantitatives de ces cellules de Paneth sont responsables de dysbioses et augmentent la susceptibilité aux réactions inflammatoires. Il est
d’ailleurs connu que les patients atteints de MICI ont souvent des anomalies fonctionnelles des cellules de Paneth. Des jonctions serrées entre les cellules épithéliales maintiennent également l’intégrité en contrôlant les flux au travers de l’épithélium intestinal. Par ailleurs, la paroi intestinale est dotée d’une grande capacité de renouvellement qui permet le remplacement rapide des cellules endommagées.
Les antigènes présents sur les bactéries luminales peuvent être détectés et internalisés grâce à un mécanisme d’endocytose par les cellules M présentes dans l’épithélium puis transférés aux cellules dendritiques de la plaque de Peyer. Lorsque des bactéries réussissent à envahir la muqueuse, leurs antigènes peuvent également être reconnus par les lymphocytes T (LT)
diffus des GALT et/ou les cellules dendritiques au niveau de la lamina propria. Après
migration vers les ganglions lymphatiques mésentériques, elles présentent les antigènes aux LT
CD4+ naïfs (immatures) pour induire leur différentiation. Les cellules dendritiques jouent un
rôle majeur dans la nature de la réponse immunitaire. En fonction du signal perçu, elles conditionnent leur maturation et leur orientation fonctionnelle.
Les lymphocytes B (LB) sont également activés afin de sécréter des Immunoglobulines A (IgA) qui vont protéger les muqueuses.
Les cellules épithéliales intestinales sont également capables de reconnaître certains micro-organismes (commensaux ou pathogènes) via des récepteurs extracellulaires (les TLR Toll Like Receptors) et intracellulaires (notamment NOD2/CARD15) et faire la présentation antigénique aux LT CD4+ naïfs grâce à leurs molécules de complexe majeur d’histocompatibilité (CMH).
L’épithélium intestinal est en contact avec la flore commensale et tous les antigènes apportés par l’alimentation. Contre eux l’organisme ne doit pas développer d’immunité, ce qui se traduit par une tolérance locale finement régulée.
Dans ce contexte physiologique non inflammatoire, la reconnaissance des protéines alimentaires et/ou des antigènes des bactéries commensales, induit la sécrétion de TGF-β (transforming growth factor bêta) et de PGE2 (prostaglandine E2), par les cellules épithéliales,
les cellules mésenchymateuses et les macrophages. Sous l’influence de ces cytokines, les
cellules dendritiques des plaques de Peyer ou de la lamina propria ayant reconnu ces antigènes
non pathogènes vont avoir une maturation partielle et migrer vers les ganglions lymphatiques mésentériques pour synthétiser un fort taux d’IL-10 (interleukine) anti-inflammatoire. L’IL-10
va alors orienter la différentiation des LT CD4+ naïfs en LT régulateurs qui vont synthétiser de l’IL-10 et de l’IFN-γ pour d’une part, inhiber l’activation des LT effecteurs LTh (helper) 1, LTh2 et LTh17 responsables de l’augmentation du taux de sécrétion de cytokines pro-inflammatoires et d’autre part, inhiber les macrophages qui permettent l’élimination des agents pathogènes et le recrutement des polynucléaires neutrophiles responsables des lésions intestinales. Ainsi, cet équilibre entre les mécanismes effecteurs et régulateurs permet de maintenir l’homéostasie intestinale et une tolérance fonctionnelle.
Figure 3 : Situation au niveau d’une paroi intestinale saine (source : présentation Vedolizumab – Takeda – 22 septembre 2014)
Situation au niveau d’une paroi intestinale enflammée (Figure 4)
Des défauts au niveau de la barrière intestinale ont été rapportés chez les patients atteints de MC et notamment une diminution de la sécrétion de mucus et de peptides antimicrobiens par les cellules épithéliales. Ces facteurs sont à l’origine d’une dysbiose intestinale marquée par une diminution de la quantité de bactéries « protectrices » et une augmentation des bactéries « délétères », comme déjà dit plus haut. De plus, l’altération des jonctions serrées intercellulaires observée chez ces patients augmente la perméabilité de la barrière physique intestinale. Ainsi, les bactéries pourront être en contact direct et de manière prolongée avec l’épithélium intestinal et envahir la lamina propria.
Comme déjà abordé dans le chapitre I.1.a, plusieurs gènes de susceptibilité à la MC codent pour des molécules impliquées dans les processus de défense immunitaire décrits ci-dessus. Ces altérations génétiques menant notamment à des défauts de production de mucus et de perméabilité intestinale sont associées à une augmentation du risque de développer une MC par défaut de reconnaissance des antigènes, réduction de l’élimination microbienne, et stimulation antigénique persistante avec une sur-production de cytokines pro-inflammatoires.
Cette perte de fonction de la barrière intestinale a pour conséquence une activation excessive du système immunitaire muqueux, puis l’apparition d’une inflammation chronique pour aboutir finalement à l’apparition des lésions observées chez les patients.
Les cellules épithéliales, les cellules mésenchymateuses et les macrophages vont synthétiser des cytokines pro-inflammatoires comme IL-1β, IL-6 et IL-8 au lieu de TGF-β et de PGE2. Ainsi, contrairement à ce qui se passe dans la muqueuse saine, sous l’influence de ces
cytokines pro-inflammatoires, les cellules dendritiques, qui ont reconnu les antigènes, vont subir une maturation complète. Après migration vers les ganglions lymphatiques mésentériques, les cellules dendritiques matures synthétisent un fort taux d’IL-2 pro-inflammatoire au lieu de l’IL-10 qui oriente la différenciation des LT CD4+ naïfs en lymphocytes T effecteurs LTh1, LTh2 et LTh17. Finalement ces LT effecteurs vont amplifier l’inflammation en sécrétant à leur tour des cytokines pro-inflammatoires comme : IFN-γ,
TGF-β, IL-4 et IL-17. En effet, les LTh1 permettent l’expansion de la réponse cellulaire en activant les LT cytotoxiques CD8+ et les macrophages qui vont permettre l’élimination des bactéries pathogènes. Les LTh2 permettent la mise en place d’une réponse immunitaire humorale qui active les LB sécrétant des IgA et IgG pour combattre l’infection. Quant aux LTh17, ils sont impliqués à la fois dans le recrutement massif des cellules de l’immunité innée comme les polynucléaires neutrophiles responsables des lésions intestinales mais également dans l’amplification de l’inflammation.
Figure 4 : Situation au niveau d’une paroi intestinale enflammée (source : présentation Vedolizumab – Takeda – 22 septembre 2014)
2. La localisation ano-périnéale de la MC
Les lésions ano-périnéales concernent la partie interne de l'anus et de la partie basse du rectum et constituent une entité clinique à part entière, incluant toutes les manifestations péri anales : fissures, fistules, abcès ou sténose. Cette distinction tient au fait de sa situation anatomique à la partie terminale du tube digestif, constituée d’un cylindre musculaire tonique contrôlant l’exonération fécale (sphincter anal), personnalisant ainsi son expression clinique et son traitement, mais aussi son évolution propre parfois en décalage avec la maladie intestinale sus-jacente.
Les symptômes de ces lésions regroupent des douleurs invalidantes, des saignements, des écoulements purulents, ainsi qu’une incontinence fécale. Tous ces symptômes ont un retentissement majeur sur la qualité de vie des patients et notamment sexuelle.
L’incidence de l’atteinte ano-périnéale dans la MC est estimée selon les études entre 25 et 80% (25) et celle des fistules entre 17 et 43% (26), soit en moyenne 1 patient sur 3. La pathogénie exacte de ces lésions est mal connue. Le risque de développer des fistules ano-périnéales est d’autant plus important que la maladie est distale et implique une atteinte rectale. Les localisations rectales s’accompagnent dans 92% des cas de lésions ano-périnéales alors qu’en cas d’atteinte iléale isolée, celles-ci sont retrouvées dans seulement 12% des cas.
La classification des fistules peut se faire selon la localisation anatomique (classification de Parks) (27) ou selon la complexité (28). Une fistule associe un orifice primaire intra canalaire, un trajet fistuleux variable dans sa hauteur et sa longueur et un ou plusieurs orifices secondaires cutané, périanal ou endorectal pour les fistules ano recto périnéales, et au niveau vaginal, vestibulaire ou vulvaire pour les fistules ano recto vaginales.
La classification de Parks distingue en fonction des trajets 5 types de fistules : superficielles, inter-sphinctériennes, trans-sphinctériennes, supra sphinctériennes et extra sphinctériennes (27). L’AGA (American Gastroenterology Association) a proposé une classification plus simple avec seulement 2 catégories : les fistules simples et complexes (28).
Les fistules simples sont basses (superficielles, basses inter sphinctériennes ou basses trans
sphinctériennes), ont un seul orifice externe et ne sont associées ni à un abcès ni à une communication avec le vagin ou la vessie, et le rectum est sain. Les fistules complexes correspondent à tous les autres cas (fistules hautes, trajet ramifié, orifices secondaires multiples, atteinte des organes adjacents, rectum inflammatoire).
Figure 5 : Classification de Parks
(selon la localisation anatomique des fistules)
A. Superficielle
B. Inter-sphinctérienne
C. Trans-sphinctérienne
D. Supra-sphinctérienne
Figure 6 : Fistule simple Figure 7 : Fistule complexe
Les fistules sont, pour le thérapeute, un véritable défi, pouvant rendre la chirurgie locale délétère pour la continence, ou obligeant parfois, en raison de complications évolutives cicatricielles rétractiles graves, à une chirurgie lourde et mutilante de dérivation fécale ou de protectomie alors même que la maladie intestinale semble cliniquement contrôlée.
II.
Les traitements de la maladie de Crohn
Il n’existe pas de traitement médical curatif de la MC. L’objectif du traitement de la MC est d’obtenir la rémission clinique qui se traduit par un contrôle des symptômes de la maladie et une qualité de vie satisfaisante (29).
La prise en charge médicale d’un patient atteint de MC doit prendre en compte l’activité de la MC(inflammation faible, modérée ou sévère), sa localisation ainsi que son évolution.
Le choix approprié d’un traitement médical est influencé par différents facteurs : la balance bénéfices / risques (efficacité attendue / effets secondaires potentiels), une réponse antérieure à un traitement et la présence de manifestations extra-intestinales ou de complications. De plus, certaines molécules exercent une activité locale (mesalazine ou budesonide) ce qui les rend plus adaptées à certaines localisations.
Comme toute maladie inflammatoire chronique, la prise en charge repose sur un
traitement de la poussée, qui permet d’écourter la durée des poussées inflammatoires et de
limiter les symptômes, et un traitement de prévention de la récidive, destiné à prévenir l’apparition des poussées et prolonger les phases de rémission.
Le traitement de la poussée dépend de la gravité : minime, modérée, sévère. Lors des poussées minimes, les dérivés des aminosalicylés (5-ASA) sont prescrits chez la majorité des
patients (en cas d’atteinte colique exclusive) en raison de leur bonne tolérance. Sinon, les corticoïdes sont largement utilisés lors de poussées modérées à sévères de la maladie. Ils sont plus efficaces mais présentent un certain nombre d’effets secondaires.
En traitement de prévention de la récidive, les immunomodulateurs sont utilisés pour
réguler l’immunité des patients et réduire l’inflammation à long terme (azathioprine, mercaptopurine et méthotrexate). Les biothérapies, arrivées en 1999, ont amélioré la prise en charge. Elles bloquent spécifiquement le TNF-α (Tumor Necrosis Factor alpha), facteur d’inflammation présent dans la maladie. Parmi ces molécules, on retrouve l’infliximab (Remicade®) et l’adalimumab (Humira®) réservées aux formes sévères et résistantes aux autres traitements. Depuis, de nouvelles cibles thérapeutiques ont été explorées et ont permis d’élargir l’arsenal thérapeutique disponible.
Enfin, un traitement chirurgical est réservé aux malades résistants à un traitement bien suivi ou encore suite à l’apparition de complications. Après 10 ans d’évolution, plus d'un malade sur deux a subi une intervention chirurgicale permettant d’enlever le segment le plus atteint du tube digestif.
Dans les recommandations, la stratégie thérapeutique est basée sur une intensification
progressive, après une période de traitement appropriée et une évaluation clinique adaptée.
Cette stratégie est cependant remise en cause depuis quelques années puisqu’elle n’améliore pas les résultats à long terme de la MC et expose le patient à des risques de lésions intestinales irréversibles, nécessitant le recours à un traitement chirurgical. Une nouvelle approche thérapeutique, dénommée la théorie du « treat to target », et développée initialement pour le traitement de la polyarthrite rhumatoïde, est aujourd’hui de plus en plus utilisée en pratique clinique (30). Il s’agit d’avoir recours à un traitement très actif, comme par exemple un anti-TNF-α, à une phase précoce de la prise en charge de la MC avant l’apparition de lésions intestinales irréversibles (Figure 8). Le traitement initial est ajusté en fonction d’un objectif clinique évalué à l’aide de critères d’évaluation préétablis (ex. la cicatrisation de la muqueuse intestinale) de l’activité inflammatoire de la maladie.
Figure 8 : Progression des lésions digestives et de l’activité inflammatoire chez un patient
théorique atteint de la maladie de Crohn
(Source : Pariente B, 2011 (31))
1. Les traitements conventionnels
Les anti-inflammatoires intestinaux : traitement des poussées (32)
Les dérivés de l’acide aminosalicylique ou aminosalicylés (5-ASA) sont utilisés depuis de très nombreuses années dans le traitement des maladies inflammatoires chroniques intestinales, MC et RCH.
Ils exercent une action anti-inflammatoire locale directe sur les muqueuses du côlon des patients. Les 5-ASA exercent leurs effets via l’activation du PPARγ (Peroxisome Proliferator-Activated Receptor), récepteur nucléaire, présent sur les cellules intestinales, impliqué dans la régulation de l’inflammation et de la prolifération cellulaire (Figure 9).
Du fait de leur bonne tolérance et de leur faible toxicité, ils peuvent être utilisés en première intention dans les poussées légères coliques et sont principalement recommandés dans la prévention des rechutes après intervention chirurgicale.
Figure 9 : Mode d’action des aminosalicylés (5ASA)
Les corticostéroides : traitements des poussées
Les corticostéroides sont le traitement de première intention des poussées inflammatoires. Les doses de prednisolone sont ajustées à la réponse thérapeutique sur une période de plusieurs semaines suivi d’un arrêt à dose dégressive quand une amélioration est observée. A forte dose, ils diminuent la réponse immunitaire en inhibant la prolifération lymphocytaire (par blocage du signal 1 impliqué dans la reconnaissance de l’antigène et la synthèse d’IL-2 – Figure 10).
En cas de traitement au long cours, la décroissance doit être lente et progressive. L’obtention d’un sevrage est le but recherché même si le maintien d’une dose d’entretien (dose minimale efficace) est parfois un compromis nécessaire. Le rythme du sevrage dépend principalement de la durée du traitement, de la dose de départ et de la maladie. En général, l’arrêt se fait par paliers avec réduction de 10% tous les 8 à 15 jours en moyenne.
A noter que l’utilisation des corticoïdes est aussi parfois l’occasion de débuter un traitement immunosuppresseur et/ou une biothérapie en traitement d’entretien pour éviter les rechutes de la maladie.
Les effets secondaires des corticoïdes administrés au long cours sont nombreux : troubles du métabolisme osseux (ostéoporose et retard de croissance) et énergétique (glucidique,
protéique et lipidique) ; cutanés ; ophtalmiques ; etc. De ce fait, des efforts particuliers sont faits pour minimiser l’exposition aux corticostéroïdes dans la MC.
Par ailleurs, on observe pour un certain nombre de patients une cortico-résistance, qui se définit comme une MC toujours active (Crohn Disease Activity Index CDAI > 150) malgré la prise de corticoïdes à dose suffisante (dose de prednisolone > 1 mg/kg/jour) pendant 4 semaines ; une cortico-dépendance chez des patients chez lesquels il est impossible de réduire la dose de corticoïdes au-dessous d’un certain seuil dans les 3 mois après le début du traitement (sans perte d’efficacité) ou chez les patients présentant une rechute dans les 3 mois après l’arrêt du traitement par corticoïdes. Elle est observée chez environ 30 % des patients atteints de MC et traités par des corticoïdes. Le diagnostic d’une résistance ou d’une cortico-dépendance justifie le relai des corticoïdes par des médicaments immunosuppresseurs.
Les immunosuppresseurs
La découverte et l'application clinique de drogues immunosuppressives ont, dans la deuxième moitié du XXème siècle, autorisé le développement des greffes d'organes et de cellules mais aussi permis le contrôle de certaines maladies auto-immunes et inflammatoires. L’utilisation des immunosuppresseurs est parfaitement justifiée dans la MC qui est associée à une activation excessive du système immunitaire. En raison d’un délai d’action relativement long (2 à 3 mois), ils sont indiqués pour le traitement de fond et le maintien des rémissions (la prévention des rechutes).
Les immunosuppresseurs ont trois effets majeurs :
- un effet thérapeutique direct qui diminue l’efficacité des réponses immunitaires non souhaitées à l’origine du rejet d’allogreffes et des maladies inflammatoires et auto-immunes,
- un immunodéficit induit conduisant à l’augmentation du risque infectieux et tumoral,
- et leur toxicité propre.
Les immunosuppresseurs utilisés agissent principalement au niveau de l’immunité à médiation cellulaire en bloquant la prolifération lymphocytaire par inhibition de la synthèse des acides nucléiques. On parle d’anti-métabolites (Tableau 1).