HAL Id: hal-02817937
https://hal.inrae.fr/hal-02817937
Submitted on 6 Jun 2020
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
et de saprothie
Vincent Berthon
To cite this version:
Vincent Berthon. Evolution de l’abondance de différents traits biologiques de diatomées en rivières le long de gradients de trophie et de saprothie. [Stage] Université Jean Monnet (Saint-Etienne) (UJM), FRA. 2009, 45 p. �hal-02817937�
A l’intention des lecteurs de ce manuscrit,
Le document suivant est une version non corrigée de mon rapport de stage
de Master 2 réalisé à l’UMR-CARRTEL. C’est la version notée par mes
enseignants de la Faculté de Sciences et Techniques de Saint-Etienne
(Université Jean Monnet).
Pour retrouver la méthode et les résultats définitifs de mon travail de stage,
je vous renvoie plutôt à la lecture de l’article écrit dans la foulée :
Berthon V., Bouchez A. and Rimet F. 2011. Using diatom life-forms and
ecological guilds to assess organic pollution and trophic level in rivers: a
case study of rivers in south-eastern France. Hydrobiologia 673: 259-271.
Pour toutes questions, je reste à votre entière disposition
(
vincentberthon@me.com
).
Master 2 Ecologie Ethologie Université Jean Monnet de Saint-Etienne
2009
Rapport de stage
Evolution de l'abondance
de différents traits biologiques de diatomées
en rivières
le long des gradients de saprobie et de trophie
Vincent Berthon
Sous la direction de
Frédéric Rimet et d'Agnès Bouchez
I.N.R.A. – Station d'Hydrobiologie lacustre 75, avenue de Corzent
Remerciements
Je remercie Jean Marcel Dorioz, Directeur de la Station d'Hydrobiologie lacustre de Thonon-les-Bains (I.N.R.A.) pour m'avoir accueilli une nouvelle fois à la station.
Je remercie Frédéric Rimet et Agnès Bouchez… Je ne saurais dire combien j'ai été heureux de travailler avec eux. Tout d'abord, parce que le sujet sur lequel ils ont bien voulu que je travaille était passionnant ensuite parce qu'ils ont su me conseiller, répondre à mes questions, m'aider à organiser mon travail, m'encourager tous les jours, … Heureux donc et chanceux d'être tombé en de si bonnes mains !
Je remercie Frédéric Rimet et Jean Claude Druart (ah ! que je suis fier !) pour m'avoir initié à la détermination des diatomées. Merci pour leur bonne humeur, tous ces conseils, toutes ces informations, toutes ces explications fusant non-stop pendant ces (courtes) heures de microscopie.
Merci à l'équipe de chimie d'avoir accepté mon "squattage" de paillasse durant quelques semaines, merci à Niouma pour le matériel.
Merci à Jean-Marcel, Marie et Christian pour leurs remarques et leurs conseils qui m'ont permis de préparer au mieux ma soutenance.
En restant au château sept mois, j'ai croisé pas mal de compagnons d'infortune et ensemble, on aura bien rigolé alors merci à eux pour tous ces moments. Merci à Ludwig et Benjamin, merci à Chiara pour m'avoir appris à faire cuire les pâtes, merci à Malgo, merci à Noor, et puis merci à la relève : Magalie que je serai heureux de revoir en septembre, Isabelle et Jennifer pour leurs gâteaux surtout le poire-noix de coco trop rare, mais bon, on dira rien… à Guillemette pour les McFlurry super chargés à 23 h, merci à Clément, compagnon de chambrée extra qui supporte tout de mes insomnies à mes… non, je ne ronfle pas ! Merci au petit dernier, Raphaël avec qui je vais enfin pouvoir aller à la pêche… Merci aux satellites : Aurélie, Niouma, ce cher Luc, Toto et Lyria, Lenaig,…
Merci à Orlane d'avoir bien voulu me garder dans ces petits papiers. Merci aussi à Yamin, mon ami de longue date, avec qui je repartage enfin le bureau et qui m'a hébergé au début de mon stage. Merci à Anne d'avoir bien voulu m'occuper certains soirs et même certains week-ends…
Merci à mes amis stéphanois : Sandra pour avoir bien voulu me prendre en main avant mon stage, Jean-Christophe, Sandrine, Claire, Guillaume, et François qui me manquent si souvent.
Merci enfin à mon papa, ma maman et ma grande sœur pour leur soutien. Merci à Julie pour tout son amour et sa patience.
Sommaire
Introduction ... 1!
1. Matériels et méthodes ... 3!
1.1. Prélèvements, préparations, et comptages des échantillons de diatomées ... 3!
1.1.1. Prélèvements du matériel biologique ... 3!
1.1.2. Traitement des échantillons au laboratoire ... 5!
1.1.3. Comptages ... 6!
1.2.! Bancarisation des données diatomées et des paramètres physicochimiques ... 7!
1.2.1. Bancarisation des données diatomées ... 7!
1.2.2. Bancarisation des mesures physicochimiques et minéraux ... 7!
1.3.! Traitement des données ... 9!
1.3.1. Transformation des données diatomées ... 9!
1.3.1.1. Classes de biovolumes des différentes espèces ... 9!
1.3.1.2. Formes de vie des différentes espèces ... 11!
1.3.1.3. Guildes écologiques ... 11!
1.3.2. Détermination des classes de qualités ... 14!
1.3.2.1. Définition de la saprobie et de la trophie ... 14!
1.3.2.2. Indices SEQ-EAU ... 14!
1.3.2.3. Analyse Canonique des Correspondance ... 15!
1.3.3. Indice de Shannon ... 15!
1.3.4. Indices diatomiques IPS et IBD ... 16!
1.3.5. Corrélation entre saprobie et trophie ... 16!
1.3.6. Mise en relation des classes de saprobie et trophie avec les formes de vie et les guildes écologique ... 17!
1.3.6.1. Box Plots ... 17!
1.3.6.2. Kruskal-Wallis et comparaisons multiples ... 17!
2. Résultats ... 18!
2.1. Résultats des inventaires ... 18!
2.2. Définition des classes de qualité ... 18!
2.2.1. Utilisation des classes de l’indice SEQ-EAU ... 18!
2.2.2. Définition de classes par ACC ... 18!
2.3. Evolution des paramètres physico-chimiques en fonction des gradients de saprobie et de trophie ... 22!
2.3.1. Saprobie ... 22!
2.3.3. Corrélation entre la saprobie et la trophie ... 24!
2.4. Evolution de la diversité en fonction des gradients de saprobie et de trophie. ... 25!
2.4.1. Saprobie ... 25!
2.4.2. Trophie ... 25!
2.5. Evolution des indices diatomiques IBD et IPS en fonction des gradients de saprobie et de trophie. ... 26!
2.5.1. Saprobie ... 26!
2.5.2. Trophie ... 26!
2.6. Répartition des différentes classes de taille, formes de vie guildes écologiques ... 27!
2.6.1. Suivant le gradient de saprobie ... 27!
2.6.1.1. Classes de tailles ... 27!
2.6.1.2. Formes de vie ... 28!
2.6.1.3. Guides écologiques ... 29!
2.6.2. Suivant le gradient de trophie ... 30!
2.6.2.1. Classes de tailles ... 30!
2.6.2.2. Formes de vie ... 30!
2.6.2.3. Guides écologiques ... 32!
2.7. Comparaison de l'utilité des différents traits biologiques dans la discrimination des différentes classes de qualité ... 33!
2.7.1. Discrimination des classes de saprobie ... 33!
2.7.2. Discrimination des classes de trophie ... 34!
3. Discussion ... 35!
3.1. Evolution de la diversité diatomique et des indices diatomiques en fonction des niveaux trophiques et saprobiques ... 35!
3.1.1. Diversité ... 35! 3.1.2. Qualité ... 35! 3.2. Classes de taille ... 36! 3.3. Formes de vie ... 37! 3.4. Guildes écologiques ... 39! Conclusions et perspectives ... 41! Bibliographie ... 42!
1
Liste de tableaux
Tableau 1 : Les différentes étapes du traitement des échantillons et montages des lames pour les comptages ... 5!
Tableau 2 : Paramètres physicochimiques et minéraux retenus. ... 8!
Tableau 3: Les différentes formes géométriques correspondantes aux espèces de diatomées retrouvées dans les comptages et les formules mathématiques utilisées pour calculer le biovolume de chacune d’elles. (d : diamètre ; d1 : longueur ; d2 : largeur ; h : hauteur) ... 10!
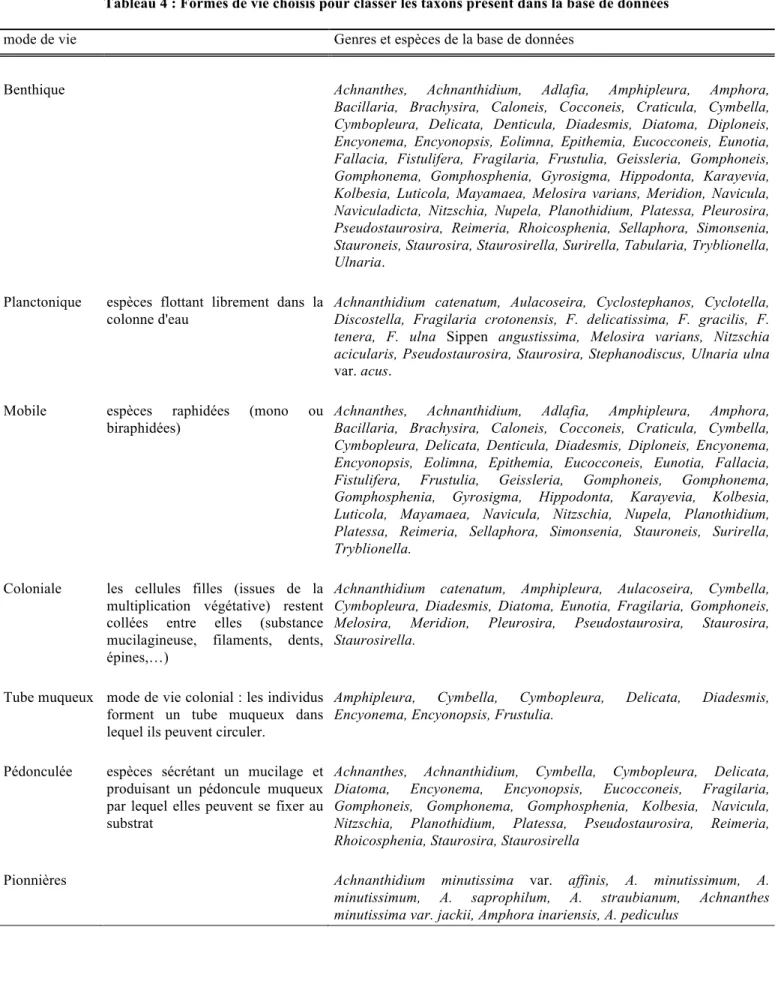
Tableau 4 : Formes de vie choisis pour classer les taxons présent dans la base de données .... 12!
Tableau 5 : Guildes choisies pour classer les taxons présent dans la base de données. ... 13!
Tableau 6 : Note des indices IPS et IBD et qualité correspondante ... 16!
Tableau 7 : Répartition des stations selon le SEQ-EAU. ... 18!
Tableau 8 : Valeurs moyennes des paramètres de saprobies et de trophie pour chacun des groupes de stations constitués (les valeurs entre parenthèses indiquent le nombre de stations par classes). ... 21!
Tableau 9 : Valeur moyenne des paramètres de saprobie pour chacun des nouveaux groupes de stations constitués (les valeurs entre parenthèses indiquent le nombre de stations par classes). ... 22!
Listes des figures
Figure 1: Les différentes classes de biovolumes. ... 10!
Figure 2 : Répartition des différentes stations selon leur niveau de saprobie (triangles) et des différents taxons de l'étude (codes) suivant les deux premiers axes de l'ACC ... 19!
Figure 3 : Répartition des différentes stations selon leur niveau de trophie (triangles) et des différents taxons de l'étude (codes) suivant les deux premiers axes de l'ACC ... 20!
Figure 4 : Concentration en oxygène dissous des différentes stations suivant l’axe 1 de l’ACC. ... 21!
Figure 5 : Evolution des différents paramètres de saprobie selon l'axe 1 de l'ACC saprobie .. 23!
Figure 6 : Evolution des différents paramètres de trophie selon l'axe 1 de l'ACC trophie ... 24!
Figure 7 : Coordonnées des prélèvements sur l'axe 1 de l'ACC trophie de chaque station en fonction de leurs coordonnées sur l'axe 1 de l'ACC saprobie. ... 24!
Figure 8 : Valeur moyenne de l'indice de Shannon pour les cinq classes de saprobie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence significative – P<0.05, No : pas de différence significative – P>0.05, - : test non réalisé) ... 25!
Figure 9 : Valeur moyenne de l'indice de Shannon pour les cinq classes de trophie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de
Dunn, Yes : différence significative – P<0.05, No : pas de différence significative – P>0.05, : test non réalisé) ... 25!
Figure 10 : Valeur des indices IPS et IBD pour les cinq classes de saprobie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence significative – P<0.05, No : pas de différence significative – P>0.05, : test non réalisé) ... 26!
Figure 11 : Valeur des indices IPS et IBD pour les cinq classes de trophie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence significative – P<0.05, No : pas de différence significative – P>0.05, : test non réalisé) ... 26!
Figure 12 : Répartition des 5 classes de tailles sur les cinq classes de saprobie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence significative – P<0.05, No : pas de différence significative – P>0.05, : test non réalisé) ... 27!
Figure 13 : Répartition des formes de vie et des formes tératologiques sur les cinq classes de saprobie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence significative – P<0.05, No : pas de différence significative – P>0.05, - : test non réalisé) ... 28!
Figure 14 : Répartition des guildes écologiques sur les cinq classes de saprobie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence significative – P<0.05, No : pas de différence significative – P>0.05, - : test non réalisé) ... 29!
Figure 15 : Répartition des 5 classes de tailles sur les cinq classes de trophie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence significative – P<0.05, No : pas de différence significative – P>0.05, - : test non réalisé) ... 30!
Figure 16 : Répartition des formes de vie et des formes tératologiques sur les cinq classes de trophie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence significative – P<0.05, No : pas de différence significative – P>0.05, - : test non réalisé) ... 31!
Figure 17 : Répartition des guildes écologiques sur les cinq classes de trophie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence significative – P<0.05, No : pas de différence significative – P>0.05, - : test non réalisé) ... 32!
Figure 18 : Valeur H du test de Kruskal-Wallis pour chaque forme de vie, guilde écologique, classe de taille et pour les indices IBD et IPS différenciant les 5 classes de saprobie (NS : non significatif P > 0.05 ; * : P < 0.05 ; ** : P < 0.01 ; *** : P ! 0.001). ... 33!
Figure 19 : Valeur H du test de Kruskal-Wallis pour chaque forme de vie, guilde écologique, classe de taille et pour les indices IBD et IPS différenciant les 5 classes de trophie (NS : non significatif P > 0.05 ; * : P < 0.05 ; ** : P < 0.01 ; *** : P ! 0.001). ... 34!
1
Introduction
Aujourd'hui, dans le cadre de la DCE, la Directive Cadre sur l'Eau du 23 octobre 2000, demandant d'atteindre le bon état des eaux d'ici 2015, l'état écologique des cours d'eau est à connaître et pour cela, comme le demande cette directive, l'accent est mis sur l'utilisation d'espèces bioindicatrices. Les espèces animales ou végétales utilisées comme bioindicateurs répondent à plusieurs exigences :
- abondance dans le milieu,
- répartition géographique étendue,
- détermination possible au niveau de l'espèce, - échantillonnage facile et normé.
Les diatomées peuvent ainsi être utilisées comme bioindicateur, les indices déjà développés utilisent les optima et les tolérances de certaines espèces pour différents paramètres biotiques et abiotiques :
- la lumière : les diatomées sont photosynthétiques, la lumière peut influer directement sur leur développement,
- le pH qui contrôle beaucoup de paramètres physico-chimiques : disponibilité des nutriments, solubilités des métaux, activités enzymatiques,… (Battarbee et al., 2001), - la salinité,
- la teneur en silice, indispensable à la constitution du squelette des diatomées, mais il est à noter que la silice est rarement limitante dans les rivières,
- la trophie : le phosphore inorganique sert à la constitution d'un bon nombre de molécules : ADN, ARN, ATP, sucres phosphatés, phospholipides (Wetzel et Likens, 2000) tandis que l'azote rentre dans la synthèse des protéines, mais en excès ces éléments deviennent toxiques.
- la saprobie : les diatomées sont en partie hétérotrophes et peuvent donc utiliser la matière organique pour se développer mais passé une certaine concentration, cette dernière devient toxique.
Mais, il est possible d’étudier d’autres relations que celles existant entre les espèces et les descripteurs environnementaux du milieu. En effet, les différents taxons peuvent être, par exemple, regroupées selon des traits biologiques c'est-à-dire des variables décrivant une caractéristique morphologique, physiologique ou comportementale (Archaimbault).
2
Nous pouvons tout d'abord regrouper les diatomées en différentes formes de vie basées sur leur morphologie, leur place au sein des biofilms, leur mode d'attachement au substrat ou encore leur mobilité. Le développement de ces formes de vie au sein des biofilms en fonction de paramètres environnementaux a déjà été étudié dans le cadre d’expérimentations particulières (par exemple : Pringle (1990), Hoagland et al.(1982)). Mais peu d’études sur un nombre important de données on été menées sur les diatomées benthiques des cours d’eau.
Nous pensons que les intérêts d'utiliser les formes de vie peuvent être multiples : - la détermination des individus peut être arrêtée au niveau du genre (sauf dans quelques
cas rares), les formes de vie étant spécifiques du genre à l'exception de certaines espèces indentifiables.
- les profils écologiques obtenus sont plus robustes que ceux tiré de la présence d'espèces : la robustesse des profils établis à partir des espèces est tributaire de leur abondance et de la fréquence à laquelle elles ont été retrouvées dans les milieux, elle diminue donc pour les espèces rares,
- l'utilisation des formes de vie permet d'avoir des informations précises sur la structure des biofilms échantillonnés.
Nous pouvons ensuite les regrouper selon leur taille. Des travaux en macroécologie, montrent les relations existant entre les différentes classes de tailles des cellules et leur abondance (Li, 2002) ou encore la quantité de ressources disponibles dans les milieux (Finkel et al., 2009).
Enfin, il est possible de regrouper les différents taxons dans des guildes écologiques comme ceux utilisé par Passy (2007).
L'étude présentée ici vise à mettre en évidence les relations entre l’abondance de certains traits biologiques de diatomées benthiques de rivières et les charges saprobique et trophique de l’eau.
L’objectif de cette étude préliminaire est de permettre par la suite l'élaboration d’indices multimétriques (caractéristique des indices demandés par la DCE) basés sur ces traits biologiques, chacun d'entre eux pouvant être le témoin d'un type de perturbation.
3
1. Matériels et méthodes
1.1. Prélèvements, préparations, et comptages des échantillons de diatomées
Les prélèvements diatomiques ainsi que le traitement des échantillons et les comptages ont été réalisés selon la norme NF T 90 354 (Association Française de Normalisation - A.F.N.O.R., 2007).
1.1.1. Prélèvements du matériel biologique
Les prélèvements ont été réalisés dans des cours d'eau du bassin versant Rhône Méditerranée et Corse (R.M. & C.) qui regroupe tous les fleuves et leurs affluents qui se jettent en Méditerranée. Il est étendu sur 9 régions et 30 départements soit 130000 km2, 25 % du territoire national. Ce bassin est assez hétérogène : paysages et eaux de différentes natures, démographie très variable, concentration des activités agricoles et industrielles dans certains départements d'où une concentration des utilisateurs de la ressource en eau ainsi qu'une concentration de leurs rejets.
Ce bassin contient :
- 44 % du ruissellement national, - 6500 cours d'eau de plus de2 km,
- plusieurs grands plans d'eau (Léman, Bourget, Annecy), - 7000 km2 de zones humides,
- 400 systèmes aquifères répertoriés, - des Glaciers (15.5 milliards de m3 d'eau).
D'après le recensement de 1999, ce bassin compte 13.9 millions d'habitants dont la répartition est très hétérogène : important phénomène d'urbanisation, désertification de certaines zones montagneuses, attractions du sud si bien qu'il y a concentration des usages et des rejets et d'importantes infrastructures à mettre en place dans les régions montagneuses.
L'agriculture est importante dans le bassin : 60 % de la production nationale de vigne, il contient également 20 % des surfaces irriguées françaises. Le taux de boisement atteint 34 %. L'élevage se situe surtout en Rhône-Alpes et en Franche-Comté. L'activité industrielle est assez diversifiée et concentrée sur cinq départements (Rhône, Isère, Bouche du Rhône, Doubs et Haute-Savoie).
4
Les prélèvements ont été réalisés de février à novembre 2007 dans 328 stations sur 212 cours d’eau des régions Rhône-Alpes, Provence-Alpes-Côte d’Azur et Languedoc-Roussillon. Notre intérêt s'est porté sur ces trois régions car elles représentent une surface importante au sein du bassin RMC et que diverses données concernant ces régions étaient à notre disposition. Les prélèvements ont été réalisés par les DIREN (Direction Régionale de l’Environnement) Rhône-Alpes et Languedoc-Roussillon respectivement pour les régions Rhône-Alpes et Languedoc-Roussillon. La région Provence-Alpes-Côte d’Azur a été prélevée par un bureau d’étude privé.
Les prélèvements doivent être réalisés dans des conditions stables du milieu c'est-à-dire qu’il faut laisser après un événement hydrologique (crues, inondation, exondation) un laps de temps dont la durée dépend de l’intensité de l’événement hydrologique.
Le prélèvement doit être réalisé de préférence en zone lotique (radier par exemple). Un échantillon est issu d’un seul type de support. La surface à échantillonner est au minimum de 100 cm2. Il faut réaliser le prélèvement en priorité sur des supports durs naturels les plus stables possible (par ordre de préférence : pierre, bloc, cailloux), à défaut sur des supports durs artificiels (tuiles, briques, bloc de béton, carrelage). Si aucun support dur n’est disponible, il est possible d’échantillonner sur un support végétal. Sont à éviter les sédiments meubles ou instables (vase, sable) et le bois. Il est important de préciser le type de support sur lequel l’échantillon a été prélevé. Il n’y a qu’un seul échantillon par station (mélange de tous les sous échantillons).
Les échantillons sont à fixer tout de suite pour une bonne conservation avec du formol (entre 4 et 10%) ou avec de l’éthanol (70%).
Une fiche par prélèvement est à remplir pour assurer la traçabilité des prélèvements, elle doit comporter les éléments suivants :
- données administratives : nom complet de la station, code, date, heure de prélèvement, agents préleveurs,
- description du site,
- description de l’opération de prélèvement : nature, et nombre de supports prélevés, observations.
Le détail de ces opérations de prélèvement est donné dans les modes opératoires de l’INRA de Thonon (Druart et Rimet, 2008, Rimet, 2009)
5
1.1.2. Traitement des échantillons au laboratoire
Le traitement consiste à éliminer la matière organique et le carbonate calcium, d’inclure les échantillons dans une résine et de les monter sur lame en vue du comptage.
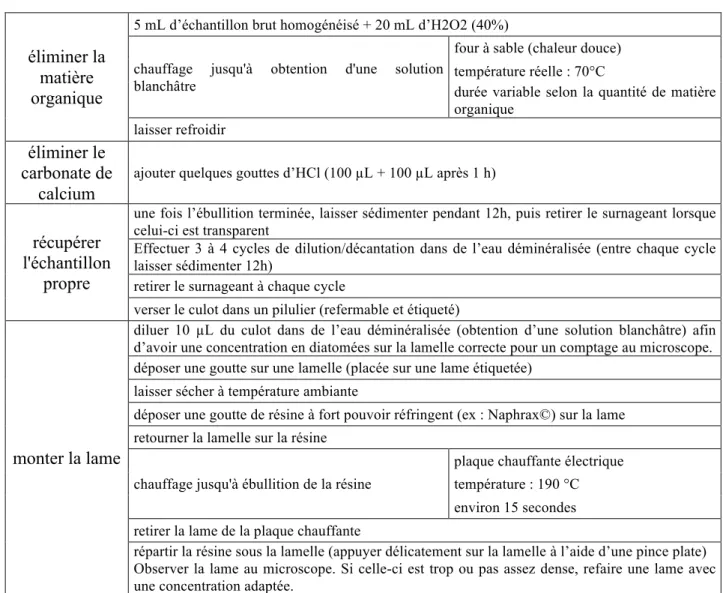
Les différentes étapes du protocole sont présentées dans le tableau 1.
Tableau 1 : Les différentes étapes du traitement des échantillons et montages des lames pour les comptages
éliminer la matière organique
5 mL d’échantillon brut homogénéisé + 20 mL d’H2O2 (40%) chauffage jusqu'à obtention d'une solution
blanchâtre
four à sable (chaleur douce) température réelle : 70°C
durée variable selon la quantité de matière organique
laisser refroidir
éliminer le carbonate de
calcium
ajouter quelques gouttes d’HCl (100 "L + 100 "L après 1 h)
récupérer l'échantillon
propre
une fois l’ébullition terminée, laisser sédimenter pendant 12h, puis retirer le surnageant lorsque celui-ci est transparent
Effectuer 3 à 4 cycles de dilution/décantation dans de l’eau déminéralisée (entre chaque cycle laisser sédimenter 12h)
retirer le surnageant à chaque cycle
verser le culot dans un pilulier (refermable et étiqueté)
monter la lame
diluer 10 "L du culot dans de l’eau déminéralisée (obtention d’une solution blanchâtre) afin d’avoir une concentration en diatomées sur la lamelle correcte pour un comptage au microscope. déposer une goutte sur une lamelle (placée sur une lame étiquetée)
laisser sécher à température ambiante
déposer une goutte de résine à fort pouvoir réfringent (ex : Naphrax©) sur la lame retourner la lamelle sur la résine
chauffage jusqu'à ébullition de la résine
plaque chauffante électrique température : 190 °C environ 15 secondes retirer la lame de la plaque chauffante
répartir la résine sous la lamelle (appuyer délicatement sur la lamelle à l’aide d’une pince plate) Observer la lame au microscope. Si celle-ci est trop ou pas assez dense, refaire une lame avec une concentration adaptée.
Il est à noter que toute la verrerie et tous les ustensiles doivent être nettoyés à l’eau déminéralisée avant toute manipulation (l’eau du robinet pouvant contenir des diatomées, elle pourrait être source de contamination). De plus, à chaque étape, il faut manipuler différents échantillons, il est donc indispensable de rincer et nettoyer la verrerie, les pinces, et tout autres matériels pour éviter tous risques de contamination entre eux. L’étape de chauffage visant à améliorer l’action de l’H2O2, peut être, elle aussi, source de contamination, il faut
6
bien surveiller la température dans les tubes pour prévenir toutes réactions trop rapides et les projections qu’elles entraîneraient.
Pour chaque échantillon, il faut préparer deux ou trois lames à différentes concentrations, afin d’améliorer les chances d’obtenir au moins une lame à une concentration en diatomées dont le comptage sera possible facilement.
1.1.3. Comptages
Il s’agit de compter et identifier, 400 valves pour chaque échantillon au microscope optique (objectif 100).
Un premier balayage de la lame permet d’identifier les espèces dominantes présentes. La détermination se fait en grande partie à l’aide du Guide Méthodologique IBD (Prygiel and Coste (1998)) et la Sü#wasserflora (Krammer and Lange-Bertalot (1986);Krammer and Lange-Bertalot (1988);Krammer and Lange-Bertalot (1991a);Krammer and Lange-Bertalot (1991b)). Il s’agit d’identifier au niveau spécifique (voire infra-spécifique) les valves de tous les taxons de diatomées présents.
Le microscope peut être équipé d’un dispositif vidéo relié à un ordinateur. Certains logiciels de capture d’image permettent ainsi de mesurer les dimensions des valves à déterminer et de compter facilement le nombre de stries pour 10 "m (dans le sens de la longueur), mesures utiles pour une détermination précise. Si ce genre de dispositif n’est pas disponible, il est indispensable d’équiper le microscope d’une règle graduée en "m pour l’objectif 100 sur le réticule de l’oculaire.
Le comptage se fait par avancée, verticale ou horizontale, de champs en champs successifs qui ne se recoupent pas afin de ne pas compter deux fois une même valve. Seules les valves dont au moins les $ sont visibles et qui sont identifiables sont comptées.
Une fois le comptage terminé, les données sont rentrées dans le logiciel Omnidia. Omnidia est un programme informatique multifonction développé sur CLCI (Lecointe et al. (1993)). La liste floristique pour un échantillon est rentrée en indiquant simplement les noms des espèces rencontrées codées par quatre caractères et le nombre de valves comptées pour chacune d’elle. D’autres informations doivent être indiquées comme le nom du cours d’eau, la commune de la station d’échantillonnage, le code de la station (code de l’Agence de l’Eau) et la date de prélèvement. Le logiciel permet ensuite de calculer différents indices biotiques (IBD, IPS, etc.). Omnidia permet ainsi de conserver les données ; également de les exporter vers d’autres logiciels d’analyses dans le cadre d’études comme celle-ci.
7
1.2. Bancarisation des données diatomées et des paramètres physicochimiques
1.2.1. Bancarisation des données diatomées
Les données des comptages réalisés fournies par les Diren Rhône-Alpes et Languedoc-Roussillon au format Omnidia. Les tableaux d’abondance ont été exportés du logiciel Omnidia. Ce logiciel donne pour chaque comptage (pour chaque station) le nombre de valves comptées pour chaque taxon. Les taxons synonymes ont été regroupés sous la dénomination la plus récente. Les listes floristiques donnent une abondance relative de chaque taxons en nombres de valves ; ces valeurs ont été donc été converties en pourcentages pour chaque station.
1.2.2. Bancarisation des mesures physicochimiques et minéraux
Les données ont été fournies par l’Agence de l’Eau Rhône Méditerranée et Corse sur l’ensemble des stations où ont été réalisées les prélèvements diatomées. L’Agence de l’Eau fait réaliser des mesures des différents paramètres tout au long de l’année.
Pour chaque prélèvement diatomées, ses caractéristiques physico-chimiques lui ont été associées. Les paramètres physico-chimiques ont été rassemblés en 2 groupes :
Groupe 1 :
Pour les caractéristiques physicochimiques correspondant au groupe 1 (tableau 2), les prélèvements diatomées ayant été réalisés tout au long de l’année, suivant s’ils l’ont été pendant la période d’étiage ou non, les caractéristiques du milieu ont étés déterminés différemment :
- pour la période d’étiage, de juin à septembre compris, les valeurs antérieures à la date de prélèvement diatomées ont été sélectionnées même si la date de mesures physicochimiques la précédait de plus de 30 jours (la date de mesure devant bien sûr être également à l'étiage),
- hors de la période d’étiage, les mesures antérieures ont été choisies préférentiellement. Mais si celles-ci étaient inexistantes ou plus éloignées de la date de prélèvement qu’une date de mesure postérieure nous avons choisi les valeurs de la date postérieure même si cette dernière pouvait sembler assez éloignée (39 jours au maximum, rencontré seulement pour 1 station pour laquelle aucunes mesures antérieures n’étaient
8
disponibles, et 35 pour 2 stations pour lesquelles les mesures antérieures étaient encore plus éloignées). Cette démarche est bien sûr discutable, les caractéristiques des biofilms étant déterminées par les conditions antérieures du milieu, mais hors étiages, les conditions étant plus changeantes, nous augmentons nos chances de trouver des conditions proches entre date de prélèvement diatomées et date de mesures physicochimiques si ces dernières ne sont pas trop éloignées dans le temps.
Tableau 2 : Paramètres physicochimiques et minéraux retenus.
groupe altérations paramètres
1 PARAMETRES PHYSICO CHIMIQUES matières organiques et oxydables
C.O.D. : Carbone Organique Dissous en mg de C/l de C
D.B.O.5 : Demande Biologique en Oxygène (durée du test 5 jours) en mg /l d’O2
D.C.O. : Demande Chimique en Oxygène en mg d’O2 /l d’O2
O2 dissous : Oxygène en mg/l d'O2
KMnO4 : Oxydabilité au permanganate en mg/l d'O2
Oxygène dissous (saturation) : en % matières azotées Nkj ( ou NTK) : Azote Kjeldhal en mg/l de N NO2- : Nitrites en mg /l de NO2 NH4+ : Ammonium en mg/l de NH4 nitrates NO3- : Nitrates en mg/l matières phosphorées PO43- : Orthophosphate en mg/l de PO4 PT : Phosphore total en mg de P /l de P acidification Al : Aluminium en mg/l pH
température T : Température en °Celsius MINERAUX minéralisation Conductivité en "S/cm 2 MINERAUX minéralisation H2CO3 : bicarbonate en mg/l Ca2+ : Calcium en mg/l Cl- : Chlorure en mg/l K+ : Potassium en mg/l Mg2+ : Magnésium en mg/l Na+ : Sodium en mg/l SO42- : Sulfates en mg/l
TAC : Titre alcalimétrique complet d°F dureté : dureté d°F
9 Groupe 2 :
Pour les paramètres physicochimiques correspondant au groupe 2 (minéralisation) du tableau 2, une moyenne annuelle pour chacun d’entre eux a été calculée. En effet ces paramètres sont principalement caractéristiques du substrat géochimique du cours d’eau et donc ne présentent pas de fluctuations saisonnières trop marquées
1.3.Traitement des données
1.3.1. Transformation des données diatomées
A chaque taxon, il est possible de lui associer une appartenance à une classe de biovolume, à un type de forme de vie ou encore à une guilde écologique. De cette façon, les données spécifiques des listes floristiques ont été transformées en utilisant les traits biologiques suivants :
- selon les biovolume spécifiques répartis en classes de tailles (cf § 1.3.1.1.), - selon les formes de vie spécifiques (cf § 1.3.1.2.),
- selon les guildes écologiques (cf § 1.3.1.3.)
L’évolution de l’abondance de ces différents traits biologiques a ensuite été évaluée en fonction de gradients trophiques et saprobiques.
1.3.1.1. Classes de biovolumes des différentes espèces
Les biovolumes des différentes espèces de diatomées présentes dans les comptages ont été en partie trouvés dans la base de données du logiciel Omnidia, sinon ils ont été calculés à partir des mesures de longueur, largeur, épaisseur, indiquées dans la bibliographie (e.g. Susswasserflora) en prenant en compte la forme géométrique simple correspondant le mieux (tableau 3). Ces données sont regroupées dans le fichier « biovolume » du mode opératoire de l’INRA sur le phytoplancton (Druart and Rimet (2008)).
Les espèces ont ensuite été réparties dans 5 classes selon l’importance de leur biovolume (figure 1).
10
Tableau 3: Les différentes formes géométriques correspondantes aux espèces de diatomées retrouvées dans les comptages et les formules mathématiques utilisées pour calculer le biovolume de chacune d’elles.
(d : diamètre ; d1 : longueur ; d2 : largeur ; h : hauteur)
11
1.3.1.2. Formes de vie des différentes espèces
Chaque espèce a été classée selon sa forme de vie (tableau 4).
Les informations nécessaires pour caractériser chaque espèce ne sont pas aisées à retrouver dans la bibliographie récente, il faut souvent utiliser des sources anciennes. Ainsi les ouvrages ayant donné ce type d’informations sont les suivants : Krammer and Lange-Bertalot (1986) ; Krammer and Lange-Bertalot (1988) ; Krammer and Lange-Bertalot (1991a) ; Krammer and Lange-Bertalot (1991b), Germain (1981), ainsi que des articles plus spécifiques tels : Hoagland et al. (1982), Katoh (1992), Pringle (1990), Robinson and Rushforth (1987), Allanson (1973).
C’est un classement binaire qui distingue les espèces remplissant et celles ne remplissant pas un critère mais qui ne distingue pas les espèces qui remplissent un critère et celles qui peuvent le remplir ou non selon les conditions du milieu.
Les tableaux d’abondance répertoriant les formes tératologiques présentes dans les échantillons, la présence et la répartition de ces formes ont elles aussi été étudiées. La présence de ces formes anormales indique la présence de micropolluants (hydrocarbure, métaux lourds,…) dans les milieux (Dorigo (2009), Falasco (2009)).
1.3.1.3. Guildes écologiques
Une guilde est un ensemble de taxons qui coexistent dans un même milieu et qui peuvent posséder des adaptations différentes aux facteurs abiotiques (Devito et al. (2004)).
Nous avons donc utilisés les appariements de modes de vie déterminés par Passy (2007) (tableau 5) et basés sur le potentiel des espèces à utiliser les ressources en nutriments et à résister aux perturbations physiques (courant). 3 guildes sont ainsi définies :
Les espèces « low profile » (LP)
Ce sont des espèces capables de vivre dans des milieux aux faibles ressources en nutriments et capables de résister aux perturbations physiques du milieu. Ce groupe rassemble des espèces de petites tailles, accrochées directement au substrat par la valve entière ou prostrées (« prostrate »), accrochées par l’apex et disposée parallèlement au substrat (« adnate ») ou accrochées perpendiculairement (érigées, « erect »), des espèces centriques solitaires et des espèces se déplaçant lentement. On retrouve donc les genres Achnanthes, Achnanthidium, Amphora, Cocconeis, Cyclotella, Cymbella, Hannaea, Meridion, Opephora et Remeria.
12
Tableau 4 : Formes de vie choisis pour classer les taxons présent dans la base de données
mode de vie Genres et espèces de la base de données
Benthique Achnanthes, Achnanthidium, Adlafia, Amphipleura, Amphora, Bacillaria, Brachysira, Caloneis, Cocconeis, Craticula, Cymbella, Cymbopleura, Delicata, Denticula, Diadesmis, Diatoma, Diploneis, Encyonema, Encyonopsis, Eolimna, Epithemia, Eucocconeis, Eunotia, Fallacia, Fistulifera, Fragilaria, Frustulia, Geissleria, Gomphoneis, Gomphonema, Gomphosphenia, Gyrosigma, Hippodonta, Karayevia, Kolbesia, Luticola, Mayamaea, Melosira varians, Meridion, Navicula, Naviculadicta, Nitzschia, Nupela, Planothidium, Platessa, Pleurosira, Pseudostaurosira, Reimeria, Rhoicosphenia, Sellaphora, Simonsenia, Stauroneis, Staurosira, Staurosirella, Surirella, Tabularia, Tryblionella, Ulnaria.
Planctonique espèces flottant librement dans la colonne d'eau
Achnanthidium catenatum, Aulacoseira, Cyclostephanos, Cyclotella, Discostella, Fragilaria crotonensis, F. delicatissima, F. gracilis, F. tenera, F. ulna Sippen angustissima, Melosira varians, Nitzschia acicularis, Pseudostaurosira, Staurosira, Stephanodiscus, Ulnaria ulna
var. acus. Mobile espèces raphidées (mono ou
biraphidées)
Achnanthes, Achnanthidium, Adlafia, Amphipleura, Amphora, Bacillaria, Brachysira, Caloneis, Cocconeis, Craticula, Cymbella, Cymbopleura, Delicata, Denticula, Diadesmis, Diploneis, Encyonema, Encyonopsis, Eolimna, Epithemia, Eucocconeis, Eunotia, Fallacia, Fistulifera, Frustulia, Geissleria, Gomphoneis, Gomphonema, Gomphosphenia, Gyrosigma, Hippodonta, Karayevia, Kolbesia, Luticola, Mayamaea, Navicula, Nitzschia, Nupela, Planothidium, Platessa, Reimeria, Sellaphora, Simonsenia, Stauroneis, Surirella, Tryblionella.
Coloniale les cellules filles (issues de la multiplication végétative) restent collées entre elles (substance mucilagineuse, filaments, dents, épines,…)
Achnanthidium catenatum, Amphipleura, Aulacoseira, Cymbella, Cymbopleura, Diadesmis, Diatoma, Eunotia, Fragilaria, Gomphoneis, Melosira, Meridion, Pleurosira, Pseudostaurosira, Staurosira, Staurosirella.
Tube muqueux mode de vie colonial : les individus forment un tube muqueux dans lequel ils peuvent circuler.
Amphipleura, Cymbella, Cymbopleura, Delicata, Diadesmis, Encyonema, Encyonopsis, Frustulia.
Pédonculée espèces sécrétant un mucilage et produisant un pédoncule muqueux par lequel elles peuvent se fixer au substrat
Achnanthes, Achnanthidium, Cymbella, Cymbopleura, Delicata, Diatoma, Encyonema, Encyonopsis, Eucocconeis, Fragilaria, Gomphoneis, Gomphonema, Gomphosphenia, Kolbesia, Navicula, Nitzschia, Planothidium, Platessa, Pseudostaurosira, Reimeria, Rhoicosphenia, Staurosira, Staurosirella
Pionnières Achnanthidium minutissima var. affinis, A. minutissimum, A. minutissimum, A. saprophilum, A. straubianum, Achnanthes minutissima var. jackii, Amphora inariensis, A. pediculus
13 Les espèces « high profile » (HP)
Elles peuvent proliférer dans des milieux pollués (riches en nutriments, matières organiques) mais sont sensibles aux perturbations physiques : espèces de plus grandes tailles érigées, filamenteuse, branched, formant des chaines, formant des tubes, pédonculées et des centriques coloniales. On y retrouve les genres Diatoma, Ellerbeckia, Eunotia, Fragilaria, Gomphoneis, Gomphonema, Melosira et Synedra. C’est la capacité de ces espèces à former des colonies qui leur permet d’exploiter les ressources non disponibles pour les espèces Low Profile mais qui les rendent plus vulnérables au courant et au broutage.
Les espèces « motile » (M)
Elles prolifèrent dans des milieux riches en nutriments et sont capables de se déplacer rapidement. Ce groupe rassemble les genres Navicula, Nitzschia, Sellaphora et Surirella. Passy pensait ces espèces résistantes au courant au début de l’étude mais il s’est avéré qu’elles ne l’étaient pas.
Les guildes de Passy ont été adaptées en ajoutant des genres qui n’étaient pas présents dans l’article de Passy mais qui présentaient des caractéristiques communes. Elles ont été nommées "high profile adapté"(HPA), "low profile adapté" (LPA) et "motile adapté" (MA) (tableau 5).
Tableau 5 : Guildes choisies pour classer les taxons présent dans la base de données.
Guildes écologiques Genres et espèces présents dans la base de données Low
Profile
espèces vivant dans des milieux pauvres en nutriments et résistant au courant
Achnanthes, Achnanthidium, Amphora, Cocconeis, Cyclotella, Cymbella, Hannaea, Meridion, Opephora et Remeria.
High Profile
espèces polluotolérantes et sensibles au courant
Diatoma, Ellerbeckia, Eunotia, Fragilaria, Gomphoneis, Gomphonema, Melosira et Synedra
Motile espèces polluotollérantes et capables de se déplacer rapidement
Navicula, Nitzschia, Sellaphora et Surirella
Low Profile Adapté
Achnanthidium, Achnanthes, Amphora, Brachysira, Cymbella, Cyclotella, Cymbopleura, Cocconeis, Cyclostephanos, Delicata, Diploneis, Discostella, Encyonema, Encyonopsis, Eucocconeis, Fragilaria, Karayevia, Kolbesia, Meridion, Nupela, Planothidium, Platessa, Rhoicosphenia, Reimeria, Stephanodiscus
High Profile Adapté
Aulacoseira, Achnanthidium catenatum, Diadesmis, Diatoma, Eunotia, Fragilaria, Gomphonema, Gomphoneis, Gomphosphenia, Melosira, Pleurosira, Pseudostaurosira, Staurosira, Staurosirella, Tabularia, Ulnaria
Motile Adapté
Adlafia, Bacillaria, Caloneis, Craticula, Delicata, Denticula, Eolimna, Epithemia, Fallacia, Fistulifera, Geissleria, Gomphoneis, Gyrosigma, Hippodonta, Luticola, Mayamaea, Navicula, Navicula(dicta), Nitzschia, Nupela, Sellaphora, Simonsenia, Stauroneis, Surirella, Tryblionella
14
1.3.2. Détermination des classes de qualités
1.3.2.1. Définition de la saprobie et de la trophie
La saprobie est le taux de matières organiques du milieu. Afin de la caractériser, nous avons utilisé les paramètres suivants :
- concentration en oxygène dissous, - taux de saturation en oxygène dissous,
- concentration carbone organique dissous (COD), - DBO5,
- concentration en ammonium, - concentration en nitrites.
La trophie est la concentration en nutriments azotés et phosphorés, nous avons donc utilisé les concentrations en :
- nitrates, - phosphates, - phosphore total.
1.3.2.2. Indices SEQ-EAU
Le Système d’Evaluation de la Qualité des Eaux (SEQ-EAU) est basé sur les altérations présentées dans le tableau 2. Le SEQ-EAU permet de regrouper les cours d’eau en 5 classes de qualité (très mauvaise, mauvaise, passable, bonne et très bonne) et en 5 classes d’aptitude (inaptitude, aptitude mauvaise, aptitude passable, aptitude bonne, aptitude très bonne) à la biologie ou aux usages (production d’eau potable, loisirs et sports aquatiques, irrigation, aqua-culture) (Agence de l'eau).
La classe de qualité d’un cours d’eau sur un prélèvement est déterminée pour chaque paramètre. La classe obtenue pour le paramètre le plus déclassant est attribuée pour le type d’altération entier. La classe de qualité est ainsi déterminée pour chaque altération et on retient la classe du type d’altération le plus déclassant pour classer le cours d’eau.
15
1.3.2.3. Analyse Canonique des Correspondance
Les stations ont été réparties en cinq classes de saprobie et de trophie en utilisant l'Analyse Canonique des Correspondances (ACC). Les classes de saprobie ont été définies par une ACC ente les paramètres de saprobie et les abondances en diatomées ; les classes de trophie définies par une ACC entre les paramètres de trophie et les abondances en diatomées. Cette méthode est la meilleure pour révéler les relations entre des paramètres écologiques et la répartition d’espèces : elle maximise les distances entre les optima écologiques des espèces et s’arrange pour que l’ordination des sites soit la meilleure combinaison linéaire possible avec les paramètres écologiques disponibles (Dufrêne, 2003). Cette méthode est également proche de celle employée lors du développement de l'Indice Biologique Diatomique par Lenoir et Coste (1996). Nous avons donc pu chercher les combinaisons des paramètres de saprobie et la combinaison des paramètres de trophie qui expliquent le mieux la répartition des espèces présentes dans les stations de la base de données. Les mesures de paramètres de saprobie et trophie de chaque station ont été centrées et réduites, les ACC ont été réalisée avec le logiciel PC-ORD 5© (McCune et Mefford 2006).
1.3.3. Indice de Shannon
Nous avons cherché à mettre en évidence la diversité taxonomique de chaque échantillon. Nous avons pour cela calculé l'indice de Shannon H, le plus utilisé parmi les indices de diversité mis au point :
! ! ! !!! !"#!!!! où fi est la fréquence relative de l'espèce i dans l'échantillon :
!! !!! !
où Ni est le nombre d'individus de l'espèce i allant de 1 à S (nombre total d’espèces) et N est le nombre total d'individus.
H est minimal (égal à 0) si tous les individus d'un peuplement appartiennent à une même espèce et est maximal si le nombre d'individus est identique au sein de chaque espèce (Frontier, 1983).
16 1.3.4. Indices diatomiques IPS et IBD
Le logiciel Omnidia permet de calculer les indices IBD (Indice Biologique Diatomique) et IPS (Indice de Polluo-sensibilité Spécifique).
L'IPS (Cemagref, 1982) et l'IBD (Lenoir et Coste, 1996, AFNOR 200 et 2007) permettent une évaluation de la qualité des cours d'eau. A chacune des espèces utilisées pour calculer ces indices (plus de10000 pour l'IPS et 1488 pour l'IBD) est attribué un degré de tolérance aux excès de matières organiques et de nutriments. La valeur des indices, comprise entre 1 et 20 (tableau 6), est obtenue en utilisant l'abondance de chaque espèce et sa polluotolérance.
Tableau 6 : Note des indices IPS et IBD et qualité correspondante
note qualité entre 17 et 20 très bonne entre 13 et 17 bonne entre 9 et 13 moyenne entre 5 et 9 mauvaise entre 1 et 5 très mauvaise
1.3.5. Corrélation entre saprobie et trophie
Afin de connaître la relation entre le niveau de saprobie et le niveau de trophie nous avons cherché à savoir s'il y a avait une corrélation entre les valeurs de l'axe 1 de l'ACC saprobie et celles de l'axe 1 de l'ACC trophie. Nous avons calculé le coefficient de corrélation de Pearson rp (logiciel SigmaStat 3.1©) :
!! ! !! ! ! ! !!!! !! ! !!! !! ! ! ! ! !!! ! !!!! !! ! ! !
Ce coefficient est compris entre -1 et 1, pour ces deux valeurs, la relation est maximale respectivement décroissante et croissante. Il n'y a aucune relation s'il est égal à 0.
17
1.3.6. Mise en relation des classes de saprobie et trophie avec les formes de vie et les guildes écologique
1.3.6.1. Box Plots
Nous avons représenté pour chaque classe de saprobie et de trophie la répartition des différents traits biologiques étudiés ici sous forme de box plot avec le logiciel Sigmaplot 9.0©.
De la même manière, nous avons représenté les valeurs des indices IPS et IBD, les valeurs de l'indice de Shannon pour chaque classe.
Le box plot est un bon moyen de représenter certaines caractéristiques d’une série quantitative (médiane, quartiles, minimum, maximum).
Nous avons pu ainsi commencer à apprécier la différence de répartition des traits biologiques entre les différentes classes de saprobie et entre les différentes classes de trophie.
1.3.6.2. Kruskal-Wallis et comparaisons multiples
Il est apparu que les différentes variables quantitatives (proportion des différentes formes de vie, proportions des guildes écologiques, valeurs des indices IBD et IPS, valeurs de l'indice de Shannon) calculées sur les différentes classes de trophie et saprobie ne répondaient pas à la condition de normalité nécessaire à l’application des tests usuels (paramétriques comme l’ANOVA). Ainsi ces valeurs calculées pour ces classes ont été comparées entre elles à l’aide du test non paramétrique de Kruskal-Wallis grâce au logiciel Sigmaplot 9.0©.
Pour préciser les différences entre chaque classe dans les différences globales détectées par le test de Kruskal-Wallis, nous avons utilisé la méthode de Dunn.
18
2. Résultats
2.1. Résultats des inventaires
328 stations ont été échantillonnées dans les régions Languedoc-Roussillon, Provence Alpes Côte d’Azur et Rhône-Alpes au cours de l’année 2008 dans le cadre du Réseau de Contrôle de Surveillance (RCS). Un total de 510 taxons a été identifié sur ces 328 stations. Les taxons pour lesquels moins de 5 valves avaient été comptées sur l’ensemble des stations ont été retirés de la base ainsi nous avons travaillé sur un ensemble de 315 taxons.
2.2. Définition des classes de qualité
Les stations ont été divisées en cinq classes de qualités afin de pouvoir représenter la répartition des différentes formes de vie suivant la qualité du milieu.
2.2.1. Utilisation des classes de l’indice SEQ-EAU
Nous avons calculé l’indice SEQ-EAU de chaque station selon les paramètres pris en compte pour la saprobie et selon ceux pris en compte pour la trophie. Nous avons obtenus des répartitions en termes de nombre de stations très hétérogènes (tableau 7) qui ne nous semblaient pas correspondre à nos besoins pour l’étude puisque pas assez discriminante.
Tableau 7 : Répartition des stations selon le SEQ-EAU. qualité saprobie trophie
très mauvaise 10 6
mauvaise 4 11
passable 36 28
bonne 143 152
très bonne 135 131
2.2.2. Définition de classes par ACC
Nous avons ordonné les stations selon le premier axe de l’ACC (figures 2 et 3) et fragmenté l’axe en 5 groupes contenant le même nombre de stations (66 stations pour les 4 premiers et 64 pour le cinquième). A noter que l’on retrouve dans le groupe 1, les milieux de moins bonnes qualité et inversement, dans le groupe 5, les milieux de meilleures qualités.
19
Figure 2 : Répartition des différentes stations selon leur niveau de saprobie (triangles) et des différents taxons de l'étude (codes) suivant les deux premiers axes de l'ACC
20
Figure 3 : Répartition des différentes stations selon leur niveau de trophie (triangles) et des différents taxons de l'étude (codes) suivant les deux premiers axes de l'ACC
21
Mais en comparant les moyennes des différents paramètres physico-chimiques à l’intérieur de chacun de ces groupes pour la saprobie, nous n’observions pas de différences significatives entre eux (tableau 8).
Par contre, ce type de regroupement nous a semblé convenir pour la trophie (tableau 8).
Tableau 8 : Valeurs moyennes des paramètres de saprobies et de trophie pour chacun des groupes de stations constitués (les valeurs entre parenthèses indiquent le nombre de stations par classes).
1 (66) 2 (66) 3 (66) 4 (66) 5 (64)
saprobie
Oxygène dissous 8.0 8.4 9.0 9.7 11.9
Oxygène dissous (saturation) 92 92 95 97 102
DBO5 1.9 1.3 1.2 1.3 1.3
Carbone organique dissous 3.4 2.2 1.6 1.4 1.3
Ammonium 0.8 0.1 0.1 0.1 0.1 Nitrites 0.35 0.05 0.04 0.04 0.03 trophie Nitrates 13.53 4.47 2.59 1.49 0.75 Phosphates 0.73 0.10 0.03 0.02 0.01 Phosphore total 0.30 0.06 0.03 0.02 0.02
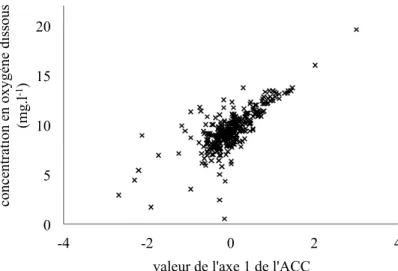
En observant la répartition des stations sur l’axe 1 de l’ACC (figure 4) en utilisant les valeurs de concentration en oxygène dissous, nous avons pu regrouper les stations d’une façon plus représentative des gradients des différents paramètres de saprobie.
Figure 4 : Concentration en oxygène dissous des différentes stations suivant l’axe 1 de l’ACC. 0 5 10 15 20 -4 -2 0 2 4
concentration en oxygène dissous
(mg.l
-1)
22
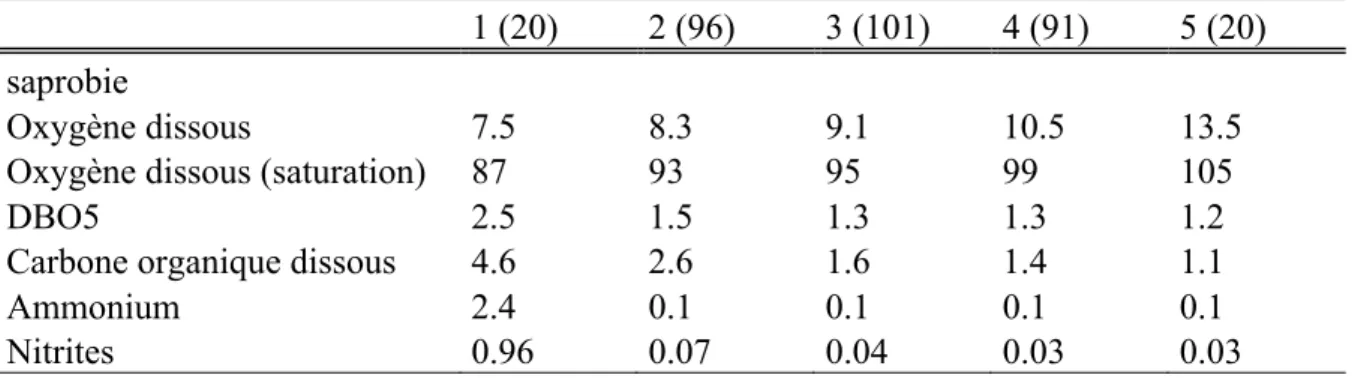
Nous avons réduit le nombre de stations des deux groupes extrêmes à 20, ce qui nous a permis d’attribuer plus de stations aux groupes 2 (96 stations), 3 (101) et 4 (91) et ainsi mieux les différencier. Nous avons obtenus des valeurs moyennes pour chaque paramètre de saprobie plus étalées sur les cinq groupes (tableau 9).
Tableau 9 : Valeur moyenne des paramètres de saprobie pour chacun des nouveaux groupes de stations constitués (les valeurs entre parenthèses indiquent le nombre de stations par classes).
1 (20) 2 (96) 3 (101) 4 (91) 5 (20)
saprobie
Oxygène dissous 7.5 8.3 9.1 10.5 13.5
Oxygène dissous (saturation) 87 93 95 99 105
DBO5 2.5 1.5 1.3 1.3 1.2
Carbone organique dissous 4.6 2.6 1.6 1.4 1.1
Ammonium 2.4 0.1 0.1 0.1 0.1
Nitrites 0.96 0.07 0.04 0.03 0.03
2.3. Evolution des paramètres physico-chimiques en fonction des gradients de saprobie et de trophie
2.3.1. Saprobie
Nous avons représenté l'évolution des différents paramètres de saprobie en fonction des l'axe 1 de l'ACC saprobie (figure 5).
Nous observons ainsi que lorsque la position sur l'axe 1 de l'ACC saprobie est élevée, la concentration en oxygène dissous est plus importante. A l'inverse, la DBO5, les concentrations en carbone organique dissous, ammonium, et nitrite sont faibles alors. Il apparaît ainsi que les milieux dont la position est élevée sur l'axe sont ceux de meilleure qualité.
2.3.2. Trophie
Nous avons représenté l'évolution des différents paramètres de trophie en fonction des l'axe 1 de l'ACC trophie (figure 6).
Nous observons ainsi que lorsque la position sur l'axe 1 de l'ACC trophie est élevée, les concentrations en phosphate, phosphore total et nitrate sont faibles. Il apparaît ainsi que les milieux dont la position est élevée sur cet axe sont ceux de meilleure qualité.
23
24
Figure 6 : Evolution des différents paramètres de trophie selon l'axe 1 de l'ACC trophie
2.3.3. Corrélation entre la saprobie et la trophie
Le calcul du coefficient de Pearson en utilisant la position des différentes stations sur les axes des deux ACC trophie et saprobie a permis de mettre en évidence la corrélation entre la saprobie et la trophie : rp = 0.484 et p < 0.01 (1.12E-20). Il apparaît (figure 7) que la trophie
est élevée dans les milieux où la saprobie est forte.
Figure 7 : Coordonnées des prélèvements sur l'axe 1 de l'ACC trophie de chaque station en fonction de leurs coordonnées sur l'axe 1 de l'ACC saprobie.
-4 -3 -2 -1 0 1 2 -3 -2 -1 0 1 2 3 4 axe 1 ACC trophie
25
2.4. Evolution de la diversité en fonction des gradients de saprobie et de trophie.
2.4.1. Saprobie
Il y a une différence significative entre les cinq classes de saprobie selon leurs valeurs moyennes d'indice de diversité de Shannon (test de Kruskal-Wallis : H=38,605 et P<0,001). La figure 8 présente les valeurs des indices ainsi que les résultats des comparaisons multiples .
Figure 8 : Valeur moyenne de l'indice de Shannon pour les cinq classes de saprobie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence
significative – P<0.05, No : pas de différence significative – P>0.05, - : test non réalisé)
2.4.2. Trophie
Il y a une différence significative entre les cinq classes de trophie selon leurs valeurs moyennes d'indice de Shannon (test de Kruskal-Wallis : H=20.49 et P<0.001). La figure 9 présente les valeurs des indices ainsi que les résultats des comparaisons multiples.
Figure 9 : Valeur moyenne de l'indice de Shannon pour les cinq classes de trophie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence
26
2.5. Evolution des indices diatomiques IBD et IPS en fonction des gradients de saprobie et de trophie.
2.5.1. Saprobie
Il y a une différence significative entre les cinq classes de saprobie selon leurs valeurs moyennes d’IBD et IPS (H=121.378 et P<0.001pour l’IPS, H=118.346 et P<0.001 pour l’IBD). La figure 10 présente les valeurs des indices ainsi que les résultats des comparaisons multiples.
Figure 10 : Valeur des indices IPS et IBD pour les cinq classes de saprobie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence significative
– P<0.05, No : pas de différence significative – P>0.05, - : test non réalisé)
2.5.2. Trophie
Il y a une différence significative entre les cinq classes de saprobie selon leurs valeurs moyennes d’IBD et IPS (test de Kruskal-Wallis : H= 94.852 pour l'IPS, H = 117.692 pour l'IBD et P<0.001). La figure 11 présente les valeurs des indices ainsi que les résultats des comparaisons multiples.
Figure 11 : Valeur des indices IPS et IBD pour les cinq classes de trophie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence significative
27
2.6. Répartition des différentes classes de taille, formes de vie guildes écologiques
2.6.1. Suivant le gradient de saprobie 2.6.1.1. Classes de tailles
Il y a une différence globale observée pour les classes de taille c2, c3, c4, c5 entre les cinq classes de saprobie (P toujours inférieur à 0.05). La figure 12 présente la répartition des cinq classes de tailles dans les cinq classes de saprobie ainsi que les résultats des comparaisons multiples.
Figure 12 : Répartition des 5 classes de tailles sur les cinq classes de saprobie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence significative
28 2.6.1.2. Formes de vie
Il y a une différence globale observée entre les cinq classes de saprobie dans la répartition des formes de vie étudiées ici (P<0.001 pour les formes de vie tube muqueux, benthique, pédonculée, pionnières et planctonique, P=0.001 pour la forme de vie mobile, P=0.028 pour la forme de vie coloniale). Il n’y a pas de différence entre les cinq classes de saprobie dans la répartition des formes tératologiques (P=0.627). La figure 13 présente la répartition des différentes formes de vie et la répartition des formes tératologiques dans les cinq classes de saprobie ainsi que les résultats des comparaisons multiples.
Figure 13 : Répartition des formes de vie et des formes tératologiques sur les cinq classes de saprobie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes
29 2.6.1.3. Guides écologiques
Il y a une différence globale observée pour chaque guildes écologiques de Passy entre les cinq classes de saprobie (P toujours inférieur à 0.001). Les guildes adaptées présentent elles aussi des différences globales significatives exceptée la guilde 'high profile adapté" (P = 0.646). La figure 14 présente la répartition des différentes guildes écologiques dans les cinq classes de saprobie ainsi que les résultats des comparaisons multiples.
Figure 14 : Répartition des guildes écologiques sur les cinq classes de saprobie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence
30 2.6.2. Suivant le gradient de trophie
2.6.2.1. Classes de tailles
Il y a des différences globales observée dans la répartition des diatomées appartenant aux classes de tailles c2 et c3 (P<0.001) mais pas dans la répartition de celles appartenant aux classes c1 (P=0.748), c4 (P=0.46), c5 (P = 0.103). La figure 15 présente la répartition des cinq classes de tailles dans les cinq classes de trophie ainsi que les résultats des comparaisons multiples.
Figure 15 : Répartition des 5 classes de tailles sur les cinq classes de trophie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence significative
– P<0.05, No : pas de différence significative – P>0.05, - : test non réalisé)
2.6.2.2. Formes de vie
Il y a une différence globale observée entre les cinq classes de trophie dans la répartition des formes de vie étudiées ici (P<0.001 pour les formes de vie tube muqueux, coloniale, pédonculée, P=0.002 pour la forme de vie benthique) mais pas de différence dans la répartition des formes de vie mobile (P=0.736), pionnière (P=0.064), planctonique (P=0.217).
31
Il n’y a pas de différence entre les cinq classes de saprobie dans la répartition des formes tératologiques (P=0.604). La figure 16 présente la répartition des différentes formes de vie et la répartition des formes tératologiques dans les cinq classes de saprobie ainsi que les résultats des comparaisons multiples.
Figure 16 : Répartition des formes de vie et des formes tératologiques sur les cinq classes de trophie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes
32 2.6.2.3. Guides écologiques
Il y a une différence globale observée pour chaque guildes écologiques (P toujours inférieur à 0.001) entre les cinq classes de trophie. La figure 17 présente la répartition des différentes guildes écologiques dans les cinq classes de trophie ainsi que les résultats des comparaisons multiples.
Figure 17 : Répartition des guildes écologiques sur les cinq classes de trophie (box plot), différence globale entre ces classes et comparaison multiple entre les classes (méthode de Dunn, Yes : différence significative
33
2.7. Comparaison de l'utilité des différents traits biologiques dans la discrimination des différentes classes de qualité
2.7.1. Discrimination des classes de saprobie
Les tests de Kruskal-Wallis ont révélé une différence globale entre les cinq classes de saprobie pour chaque forme de vie, guilde écologique (exceptée la guilde "high profile adapté") et classe de taille (exceptée c1). La répartition des formes tératologiques ne présente pas de différence entre les cinq classes. Les variables les différenciant le mieux sont les indices IPS et IBD (figure 18).
Figure 18 : Valeur H du test de Kruskal-Wallis pour chaque forme de vie, guilde écologique, classe de taille et pour les indices IBD et IPS différenciant les 5 classes de saprobie (NS : non significatif P > 0.05 ; *
34
2.7.2. Discrimination des classes de trophie
La répartition des différentes guildes écologiques (P<0.001 pour chacune) permettent de différencier les classes de trophie ainsi que les formes de vie pédonculée, tube muqueux, coloniale et benthiques (P = 0.002) et les classes de tailles c2 et c3. La répartition des formes de vie pionnière, planctonique et mobile, des formes tératologiques et des classes de tailles c1, c4 et c5 ne montre pas de différence entre les classes de trophie. Les indices IBD et IPS montrent aussi des différences entre les cinq classes. A noter que la répartition des diatomées pédonculées et des diatomées mobiles rapides montrent des différences globales supérieures aux différences globales mise en évidence par les valeurs des indices IBD et IPS (IBD et IPS pour la forme de vie pédonculée et IPS pour la guilde motile adapté) (figure 19).
Figure 19 : Valeur H du test de Kruskal-Wallis pour chaque forme de vie, guilde écologique, classe de taille et pour les indices IBD et IPS différenciant les 5 classes de trophie (NS : non significatif P > 0.05 ; * :
35
3. Discussion
3.1. Evolution de la diversité diatomique et des indices diatomiques en fonction des niveaux trophiques et saprobiques
3.1.1. Diversité
Plusieurs études ont montré un effet de la concentration en nutriment sur la diversité en diatomées (Pringle 1990), ou plus généralement en milieu aquatique (Russel-Hunter 1970, Schelske & Stoermer 1971) et terrestre (Beadle 1966)
La diversité diatomique, évaluée avec l’indice de Shannon, augmente significativement lorsque les niveaux trophiques et saprobiques augmentent. Ceci peut s'expliquer par le fait que les diatomées sont des organismes mixotrophes c'est-à-dire qu'elles sont hétérotrophes et à la fois autotrophes et tirent donc leurs ressources à partir de la matière organique et des nutriments. Il nous apparaît donc normal que la diversité augmente quand la saprobie et la trophie, c’est à dire les quantités de ressources, augmentent. Nous pouvons observer une augmentation de la diversité entre la classe 1 (très forte concentration en matière organique) et la classe 2 (forte concentration en matière organique) de saprobie, bien que non significative ; en effet il semble qu‘un nombre plus faible de taxons puissent résister aux plus forts niveaux de matière organique. Ici lorsque le milieu ne contient pas assez de matière organique (classes 4 et 5), peu d'espèces peuvent se contenter de ce faible niveau de ressources, et lorsque le milieu contient trop de matières organiques, ce type de ressource semble devenir un stress pour de nombreuses d'espèces. C’est dans les niveaux de matières organique intermédiaire que la diversité est maximale (classes 3 et surtout classe 2).
3.1.2. Qualité
Comme nous pouvions nous y attendre les indices biotiques IPS et IBD permettent de discriminer les cinq classes de saprobie et les cinq classes de trophie. Les valeurs de H du test de Kruskal Wallis étaient les deux plus élevées dans le cas de la saprobie et parmi les quatre plus élevées dans le cas de la trophie.
Prendre en compte les valeurs de ces deux indices dans les différentes classes de qualité nous a permis de mettre en évidence les différences qu'il pouvait y avoir entre elles.