Identification de biomarqueurs afin de personnaliser le
traitement suivant une chirurgie de résection d’un
adénocarcinome pulmonaire de stade I
Mémoire
Alisson Clemenceau
Maîtrise en Médecine Moléculaire
Maître ès Sciences (M. Sc.)
Québec, Canada
© Alisson Clemenceau, 2018
Identification de biomarqueurs afin de personnaliser le
traitement suivant une chirurgie de résection d’un
adénocarcinome pulmonaire de stade I
Mémoire
Alisson Clemenceau
Résumé
OBJECTIF : Le cancer du poumon est la principale cause de décès par cancer au Canada. L’objectif de ce
projet est d’identifier des biomarqueurs d'expression génique dans la tumeur, associés à la survie des patients suivant une résection chirurgicale d’un adénocarcinome de stade 1.
MÉTHODES : Des gènes candidats ont été sélectionnés grâce à une revue de littérature, ainsi qu’à l’analyse
de bases de données publiques (PRECOG). L’un de nos jeux de données, dans lequel l'expression des gènes a été quantifiée à l'aide de biopuces à ADN dans la tumeur et le parenchyme pulmonaire non-tumoral a également été analysé. L’expression des gènes sélectionnés a ensuite été mesurée par qPCR sur 233 échantillons d’adénocarcinomes de stade 1. Des analyses de Kaplan-Meier ont été réalisées pour évaluer leur valeur pronostique. L’expression de deux de ces gènes a ensuite été testée dans une deuxième cohorte indépendante de 210 adénocarcinomes de stade 1.
RÉSULTATS : Onze gènes ont été sélectionnés selon leur capacité à prédire une récidive ou une rémission
grâce aux données publiques. Les analyses complémentaires sur notre jeu de données ont permis de réduire la liste à 3 gènes associés à un mauvais pronostic (RRM1, EZH2 et FOXM1) et 3 gènes associés à un bon pronostic (BTG2, SELENBP1 et NFIB). Les analyses de EZH2 et de RRM1 par qPCR ont révélé des courbes de survies significativement différentes entre les patients avec des niveaux d'expression génique élevés et faibles (EZH2 Kaplan-Meier log-rank p=3.2e-02, RRM1 Kaplan-Meier log-rank p=5.9e-04). La valeur pronostique de EZH2 et RRM1 n’a pas été confirmée dans la deuxième cohorte.
CONCLUSION : Le rôle des gènes EZH2 et RRM1 comme biomarqueurs afin de prédire la récidive des
adénocarcinomes de stade 1 a été confirmé dans une première cohorte, mais pas dans une deuxième cohorte équivalente sur la base clinique et pathologique.
Abstract
OBJECTIVE: Lung cancer is the leading cause of cancer-related death. The objective of this study is to
identify tumor-based gene expression biomarkers associated with survival after curative resection for stage 1 adenocarcinoma.
METHODS: Candidate genes were selected based on literature review, analyses performed in public
databases (PRECOG), and using our own microarray gene expression dataset of lung cancer and non-tumor lung parenchyma. The selected genes were measured by quantitative real-time PCR (qPCR) in the tumors of 233 patients with stage 1 adenocarcinoma. Kaplan-Meier analyses were performed to establish the discriminatory performance of these biomarkers. The expression of two of these genes was then tested in an independent cohort of 210 stage 1 adenocarcinomas.
RESULTS: Based on literature, we have selected 11 candidate genes that showed promising prognostic
value. Complementary analyses with PRECOG and our own microarray dataset enabled us to choose three genes associated with poor outcome (RRM1, EZH2 and FOXM1) and three genes associated with favourable outcome (BTG2, SELENBP1 and NFIB). Results for EZH2 and RRM1 revealed significant difference in survival curves between patients with low compared to high gene expression (EZH2 Kaplan-Meier logrank p=3.2e-02, RRM1 Kaplan-Meier logrank p=5.9e-04). The prognostic values of EZH2 and RRM1 were not replicated in the second set of patients.
CONCLUSION: Adenocarcinoma-specific mRNA expression levels of EZH2 and RRM1 were associated with
post-surgical survival in the first set of patients, but not replicated in a clinically and pathologically matched independent set.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations ... x
Remerciements ... xii
Avant-propos ... xiii
CHAPITRE 1 : INTRODUCTION ... 1
1.1Définition du cancer ... 1
1.2
Épidémiologie du cancer du poumon ... 1
1.2.1
Incidence et mortalité ... 1
1.2.2
Impact économique ... 2
1.3
Facteurs de risques et comorbidités du cancer du poumon ... 3
1.3.1
Le tabagisme ... 3
1.3.1.1
En chiffre ... 3
1.3.1.2
L’arrêt tabagique ... 4
1.3.2
Âge et sexe ... 4
1.3.3
Maladie pulmonaire obstructive chronique (MPOC) ... 7
1.3.4
Autres facteurs de risques ... 8
1.4
Diagnostic du cancer du poumon ... 9
1.4.1
Symptômes ... 9
1.4.2
Syndrome ... 10
1.4.3
Imagerie médicale ... 10
1.4.3.1
Radiographie ... 10
1.4.3.2
Tomodensitométrie ... 11
1.4.3.3
Tomographie par émission de positrons (TEP) ... 11
1.4.3.4
Imagerie par résonnance magnétique (IRM) ... 12
1.5
Anatomopathologie du cancer du poumon ... 12
1.5.1
Anatomie générale ... 12
1.5.2
Histologie ... 13
1.5.2.1
Les bronches ... 13
1.5.2.2
Bronchioles ... 14
1.5.2.3
Alvéoles pulmonaires ... 15
1.5.3
Classification histologique et moléculaire des tumeurs pulmonaires ... 16
1.5.3.1
Classification des adénocarcinomes ... 17
1.5.3.1.1
Lésion pré-invasives ... 17
1.5.3.1.2
Adénocarcinomes à invasion minime ... 19
1.5.3.1.3
Adénocarcinomes invasifs ... 20
1.5.4
Stades pathologiques ... 24
1.6
Traitement des adénocarcinomes ... 27
1.6.1
Chirurgie ... 27
1.6.2
Radiothérapie ... 28
1.6.3
Chimiothérapie ... 28
1.6.4
Pathologie moléculaire ... 29
1.6.4.1
Mutations ... 29
1.6.4.2
Immunologie ... 31
CHAPITRE 2 : BIOMARQUEURS EN CANCER DU POUMON ... 32
2.1Qu’est ce qu’un biomarqueur ? ... 32
2.1.1
Biomarqueurs de prédispositions ... 32
2.1.2
Biomarqueurs de diagnostic ... 33
2.1.3
Biomarqueurs de pronostic ... 33
2.1.4
Thérapies ciblées et pharmacogénomique ... 35
2.2
Limites des études existantes sur le cancer du poumon ... 35
2.2.1
Petits échantillons ... 35
2.2.2
Hétérogénéité ... 35
2.2.2.1
Interindividuelle ... 35
2.2.2.2
Intratumorale ... 36
2.2.3
Biomarqueurs d’expression ... 36
2.3
Biopsie liquides ... 37
CHAPITRE 3 : OBJECTIF ET HYPOTHÈSE ... 38
CHAPITRE 4 : MATÉRIEL ET MÉTHODES ... 39
4.1Sujets à l’étude ... 39
4.2
Extraction et réverse transcription des ARN ... 40
4.3
Sélection des gènes ... 40
4.4
Amplification en chaine par polymérase en temps réel ... 41
4.5
Statistiques ... 42
CHAPITRE 5. TUMOR-BASED GENE EXPRESSION BIOMARKERS TO PREDICT SURVIVAL
FOLLOWING CURATIVE INTENT RESECTION FOR STAGE I LUNG ADENOCARCINOMA ... 43
CHAPITRE 6. CONCLUSION ET PERSPECTIVES ... 68
Liste des tableaux
CHAPITRE 1
Tableau 1.1 Cancers les plus prévalents au Canada en 2017 et leurs taux de survie à 5 ans………..………….2 Tableau 1.2 Coûts médicaux associés au cancer du poumon selon le genre et l’âge en dollars américains aux États-Unis en 2010………...3 Tableau 1.3 Classification selon l’invasion des nœuds lymphatiques régionaux………25 Tableau 1.4. Grille de stadification des tumeurs pulmonaires………27
CHAPITRE 2
Tableau 2.1 Gènes candidats sélectionnés dans la littérature pour leur potentielle valeur pronostic contre la récidive du cancer du poumon………...………..34
CHAPITRE 5
Table 1. Clinical characteristics of the patients that underwent curative intent resection for stage I adenocarcinoma……….………57 Table 2. Investigation of selected prognostic tumor-based gene expression biomarkers in PRECOG………...58 Table 3. Univariate and multivariate Cox regression analyses of prognostic genes for overall survival in validation set 1………59 Supplementary Table 1……….64
Liste des figures
CHAPITRE 1
Figure 1.1 Taux d’incidence normalisé selon l’âge (TINA) par cancers chez les hommes (A) et les femmes (B), au Canada entre 1988 et 2017………...……….……..………6 Figure 1.2 Taux de mortalité normalisé selon l’âge (TMNA) par cancers chez les hommes (A) et les femmes (B), au Canada entre 1988 et 2017..………...………..7 Figure 1.3 Anatomie pulmonaire………..13 Figure 1.4 Paroi bronchique en microscopie optique x250 (1) et x600 (2) colorée à l’hématoxyline-éosine….………...………..14 Figure 1.5. Coupe d’une grande bronchiole (1) et d’une bronchiole terminale (2) en microscopie optique x175 colorée à l’hématoxyline-éosine………...……….…………..………...15 Figure 1.6. Alvéoles pulmonaires en microscopie optique x450 (1) et x1000 (2) colorée à l’hématoxyline-éosine……….………...…………..16 Figure 1.7. Répartition des nouveaux cas de cancer selon le type-histologique au Canada en 2017……….…17 Figure 1.8. Hyperplasie adénomateuse atypique au microscope optique x60 (A) et x325 (B), coloration à l’hématoxyline-éosine.………...………..………..18 Figure 1.9. Adénocarcinome in situ au microscope optique x50, coloration à l’hématoxyline-éosine ………...19 Figure 1.10. Adénocarcinome minimalement invasif au microscope optique x50, coloration à l’hématoxyline-éosine..……….………...20 Figure 1.11. Adénocarcinome invasif à prédominance acinaire au microscope optique x325, coloration à l’hématoxyline-éosine………..………..21 Figure 1.12. Adénocarcinome invasif à prédominance papillaire au microscope optique x80 (A) et x325 (B), coloration à l’hématoxyline-éosine ……...………..…22 Figure 1.13. Adénocarcinome invasif à prédominance micropapillaire au microscope optique x175 (A) et x650 (B), coloration à l’hématoxyline-éosine ………...………...……….…….…….23 Figure 1.14. Adénocarcinome invasif à prédominance solide au microscope optique x80 (A) et x175 (B), coloration à l’hématoxyline-éosine ………...………..…………24
CHAPITRE 4
CHAPITRE 5
Figure 1. Flowchart for gene expression biomarkers selection, filters, and analysis………..61 Figure 2. Boxplots of gene expression levels of selected prognostic genes, NFIB (A), SELENBP1 (B), BTG2 (C), FOXM1 (D), RRM1 (E), EZH2 (F), in tumor and adjacent non-tumor lung tissues at different distances from the tumor……….62
Figure 3. Kaplan-Meier analysis of overall survival in the validation set 1 according to median-derived risk categories for RRM1 (A), EZH2 (B) and combination of RRM1 and EZH2 (C) and in the validation set 2 for RRM1 (D), EZH2 (F). Kaplan-Meier analysis comparing overall survival between the two validation sets (G)..63 Figure 4. Forest-plot of hazard ratios for overall survival in categories of age, sex and pathological stage in validation set 1………64 Figure 5. Kaplan-Meier analysis of overall survival in the combined set according to median-derived risk categories for RRM1 (A), EZH2 (B) and combination of RRM1 and EZH2 (C)………65 Supplementary Figure 1. Kaplan-Meier analysis of overall survival according to median-derived risk categories for BTG2 (A), SELENBP1 (B), NFIB (C), and FOXM1 (D)………..66 Supplementary Figure 2. Forest-plot of hazard ratios for overall survival in categories of age, sex and pathological stage in validation set 2………..………67
Liste des abréviations
ADN Acide désoxyribonucléique
ADNc Acide désoxyribonucléique complémentaire AIS Adénocarcinome in situ
ALK Anaplastic lymphoma receptor tyrosine kinase ARNm Acide ribonucléique messager
ATS American thoracic society
BRAF B-Raf proto-oncogene, serine/threonine kinase CV Coefficient de variation
EGFR Epithelial growth factor receptor
EML4 Echinoderm microtubule associated protein like 4 ERS European respiratory society
EZR Ezrine
GTPase Guanosine triphosphate hydrolase GWAS Genome-wide association study HAA Hyperplasie adénomateuse atypique
IASLC International Association for the study of lung cancer
IUCPQ Institut universitaire de cardiologie et de pneumologie de Québec KRAS Kirsten rat sarcoma viral oncogene homolog
MPOC Maladie pulmonaire obstructive chronique NCCN National comprehensive cancer network
NSCLC Non-small cell lung cancer OMS Organisation mondiale de la santé PD-1 Programmed cell death 1
PD-L1 Programmed death-ligand 1
PRECOG PREdiction of Clinical Outcomes from Genomic profiles qPCR Quantitative polymerase chain reaction
ROS1 ROS proto-oncogene 1, receptor tyrosine kinase SCLC Small cell lung cancer
SDC4 Syndecan 4
SLC34A2 Solute carrier family 34 member 2
SLFT Stratégie de lutte fédérale contre de tabagisme SNP Single nucleotide polymorphism
TINA Taux d’incidence normalisé selon l’âge TMNA Taux de mortalité normalisé selon l’âge TTF-1 Thyroid transcription factor-1
Remerciements
Je commence ce mémoire en exprimant toute ma gratitude pour le soutien, la bienveillance et tout l’amour que j’ai reçu durant ces deux belles années de maîtrise, par mes collègues, mes amis, ma famille, et tous ceux qui, de près ou de loin, ont contribué à mes réussites, mes progrès et mes moments de joie. Merci à Nathalie, Cyndi, JC et Maxime de m’avoir supportée au quotidien, de m’avoir accompagnée dans ma vie professionnelle comme personnelle, et d’avoir tout fait pour que je me sente bien. Vous avez été d’un grand soutien, alors merci d’être vous et de nous avoir supportés, moi, mes émotions et mes petits moments de doutes.
Évidemment, merci à toi Yohan, de m’avoir donné ma chance, de me faire confiance, et de tout mettre en œuvre pour que je devienne la meilleure version de moi-même. Je suis très admirative de ton travail, de la ferveur et de la ténacité avec lesquelles tu mènes tes projets. C’est avec une grande joie et beaucoup d’excitation que je reste dans ton équipe pour la suite.
Merci à mon Titi, Marine, de m’accompagner dans mes joies, mes peines, mes rires aux larmes et mes pleures. J’ai eu beaucoup de chance de vivre l’aventure canadienne avec toi, tu es un soutien sans faille, et souvent, une vraie petite maman pour moi.
Marion, Lucie et Marie, vous êtes toujours auprès de moi après toutes ses années, malgré les kilomètres. Merci de toujours croire en moi, et de m’apporter autant de joie et d’amour. Vous me donnez une rage de vaincre sans limite !
Je termine en exprimant tout mon amour aux deux personnes les plus importantes dans ma vie, ma Maman et mon Papa. Aucun mot ne pourrait décrire à quel point je vous aime et à quel point je vous admire. Je vous serai éternellement reconnaissante pour tout ce que vous m’avez inculqué, pour tout ce que vous m’avez permis de faire, votre soutien sans faille et votre amour inconditionnel. Vous êtes les meilleurs parents de la galaxie.
Avant-propos
Ce mémoire résulte de travaux de recherche réalisés à l’Institut universitaire de cardiologie et de pneumologie de Québec (IUCPQ) dans le cadre d’une maîtrise. Il est composé d’une introduction en deux chapitres sur le cancer du poumon, ainsi que sur l’état des connaissances sur l’adénocarcinome pulmonaire et les besoins cliniques urgents concernant sa prise en charge. Il contient également un manuscrit « Tumor-based gene expression biomarkers to predict survival following curative intent resection for stage I lung adenocarcinoma », qui sera soumis après la révision des co-auteurs. Enfin, une conclusion générale du projet ainsi qu’une discussion s’ouvrant sur les limites et perspectives clôturent ce mémoire.
L’auteure du mémoire est également la première auteure du manuscrit, et a effectué la sélection des patients de l’étude, la réalisation des manipulations biologiques et la production des données d’expression génique et a assuré les analyses statistiques. Cette dernière a également interprété les résultats, les a présentés lors de divers évènements scientifiques locaux, nationaux et internationaux et a écrit le manuscrit scientifique. Nathalie Gaudreault et Cyndi Henry, professionnelles de recherche dans le laboratoire du Dr Yohan Bossé ont participé à la préparation des échantillons et à la production des données d’expression génique. Dr Paula A Ugalde, chirurgienne thoracique à l’IUCPQ, Dr Catherine Labbé et Dr Michel Laviolette, pneumologues et chercheurs à l’IUCPQ et Dr Philippe Joubert, anatomopathologiste à l’IUCPQ ont participé à la création de la cohorte de cette étude, à la classification des tissus tumoraux, ainsi qu’au rassemblement des données cliniques nécessaires à la réalisation de ce projet. En tant que co-auteur du manuscrit, ils ont révisé ce dernier et participé à l’optimisation de cette étude. Dr Yohan Bossé, professeur agrégé au département de médecine moléculaire de la faculté de médecine de l’université Laval et chercheur à l’IUCPQ, a conçu et veillé au bon déroulement de ce projet, il a également participé à la sélection des patients, à l’interprétation des résultats ainsi qu’à la rédaction du manuscrit.
CHAPITRE 1 : INTRODUCTION
1.1 Définition du cancer
Le cancer est une maladie touchant les cellules de l’organisme. Cette dernière est souvent décrite selon 3 facteurs clés : altérations génétiques, invasion et métastases.
Premièrement, les cellules subissent des altérations génétiques au cours du temps et au contact d’agents cancérigènes telle que la fumée de cigarette. Certaines de ces mutations induisent la multiplication excessive et l’immortalisation des cellules, ce qui engendre la formation de tumeurs.
Le deuxième point définissant une cellule cancéreuse est l’invasion. En effet, la tumeur primaire croît puis s’étend, d’abord localement au sein du même organe puis parfois dans les ganglions lymphatiques régionaux.
Le troisième point clé : l’infiltration métastatique. Lorsque les cellules tumorales infiltrent la circulation sanguine, elles ont la capacité d’atteindre puis de se multiplier au sein de n’importe quel organe, formant ainsi des tumeurs secondaires qui endommageront à leur tour les fonctions de l’organisme.
1.2 Épidémiologie du cancer du poumon
1.2.1 Incidence et mortalité
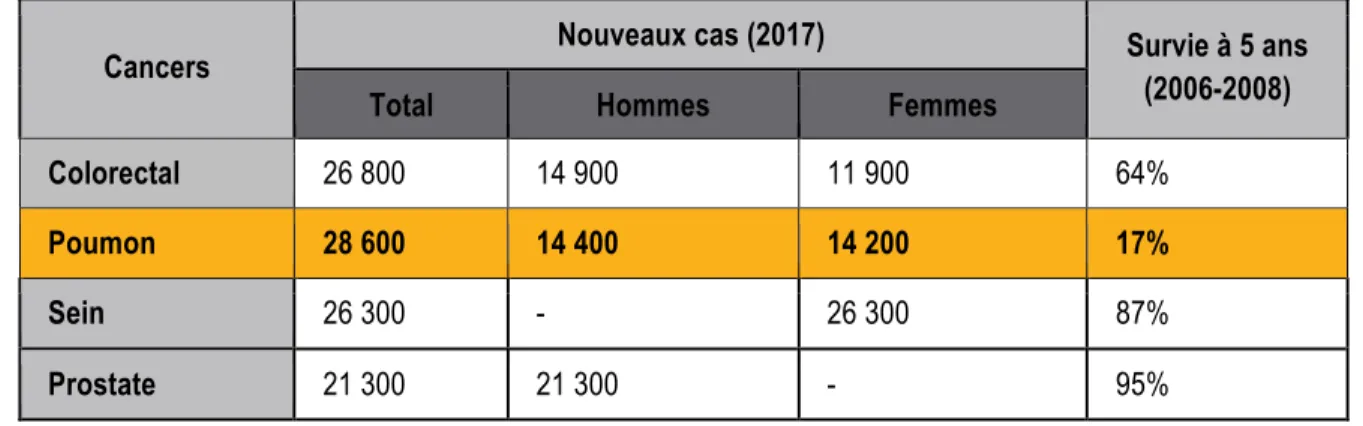
Selon la Société canadienne du cancer, 206 200 personnes recevront un diagnostic de cancer au Canada en 20171. Parmi les nouveaux cas diagnostiqués, 80 800 mourront des suites de leur maladie, soit près de 39%. Au total, 30% des décès au Canada en 2017 seront attribuables au cancer. Toujours parmi ces nouveaux cas de cancer, 28 600 seront des cancers du poumon, soient 14% des cancers totaux. Ces chiffres placent le cancer du poumon en tête des cancers les plus prévalents, avec le cancer colorectal, le cancer du sein et celui de la prostate. Ces derniers représentent à eux seuls, plus de la moitié de l’ensemble des cancers qui seront diagnostiqués au Canada en 2017. Bien qu’il y ait un déclin de l’incidence globale du cancer du poumon de 1,7% chaque année depuis 2006, il faut s’attendre à une hausse significative des besoins associés aux tumeurs pulmonaires dans les prochaines années. En effet, la probabilité de développer un cancer pulmonaire invasif passe de 0,2% avant 50 ans, à plus de 6% après 70 ans. Ceci est d’autant plus important à considérer que le nombre annuel moyen de canadiens de 65 ans et plus devrait plus que doubler, passant ainsi de 4,2 millions en 2003-2007 à 9,4 millions en 2028-2032. Le tableau ci-dessous (Tableau 1.1) répertorie les 4 cancers les plus prévalents au Canada en 2017. Si leurs incidences sont du même ordre de grandeur, le taux de survie à 5 ans est quant à lui extrêmement inquiétant chez les patients atteints d’un cancer du poumon. En effet, ces derniers ont à peine 17% de chances de survivre plus de 5 ans à leur maladie. Cela signifie que le cancer du poumon entraine plus de décès que les 3 autres cancers réunis1.
Cette différence est principalement due aux difficultés d’établir un diagnostic précoce. En effet, une étude américaine démontre que plus de 57% des cas de cancer du poumon sont diagnostiqués à un stade métastatique2. Or, le taux de survie à 5 ans des patients ayant développé des métastases issues d’une tumeur pulmonaire est de 4% seulement contre 55% pour des tumeurs localisées. À titre de comparaison, la détection du cancer de la prostate se fait dans 80% des cas à un stade local, son taux de survie à 5 ans est donc de plus de 99%2, 3. Cela démontre l’importance des besoins cliniques en matière de prévention, diagnostic, pronostic, et traitements des patients atteints d’un cancer du poumon.
Tableau 1.1 Cancers les plus prévalents au Canada en 2017 et leurs taux de survie à 5 ans.
Tableau adapté de Statistiques Canadiennes sur le Cancer 20171
Cancers Nouveaux cas (2017) Survie à 5 ans
(2006-2008)
Total Hommes Femmes
Colorectal 26 800 14 900 11 900 64%
Poumon 28 600 14 400 14 200 17%
Sein 26 300 - 26 300 87%
Prostate 21 300 21 300 - 95%
1.2.2 Impact économique
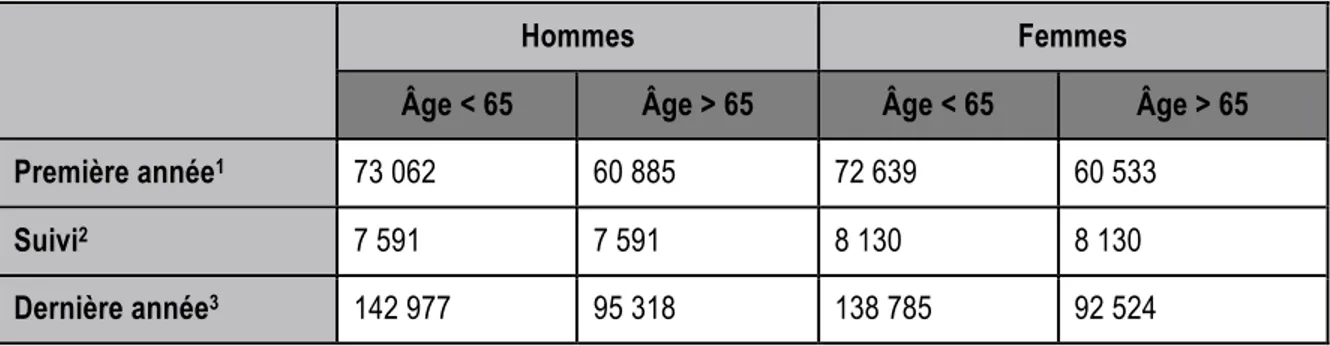
L’agence de la santé publique estimait à 4,4 milliards de dollars les coûts liés au cancer au Canada en 2008, parmi lesquels 586 millions étaient attribuables aux pertes de productivité indirecte1. Non seulement les frais afférents aux soins médicaux sont extrêmement importants, mais les traitements induisent, dans la majorité des cas, une diminution des capacités physiques, et même dans certains cas une perte d’autonomie nécessitant l’accompagnement quotidien des malades. Une estimation des coûts moyens annuels aux États-Unis a été stratifiée en trois catégories chez les hommes et les femmes âgés de plus ou moins 65 ans. Voir tableau 1.2 ci-dessous. La première catégorie « initial », inclut les 12 premiers mois après le diagnostic, soit dans la majorité des cas, la prise en charge, le diagnostic, la chirurgie de résection partielle ou totale, les thérapies adjuvantes pré et post-opératoires ainsi que le suivi des patients. La charge économique moyenne engendrée par la première année de soins d’un homme de moins de 65 ans était de 73 062 US$ en 2010. À titre de comparaison, la catégorie « last year », considérant les douze derniers mois avant le décès, coute en moyenne 142 977 US$. Ces douze derniers mois sont quant à eux marqués par des traitements de radiothérapie et de chimiothérapie ainsi que des soins palliatifs extrêmement couteux, des hospitalisations de longue durée et une perte de productivité importante attribuable à la diminution physique des patients. La dernière catégorie « suivi », est la période entre les deux décrites
précédemment, soit une période de suivi, qui coute en moyenne 7 591 US$ par an pour un homme4. Autrement dit, le cancer du poumon est un fardeau économique magistral pour les pays occidentaux. Il est donc primordial de prévenir la maladie par le contrôle de la consommation tabagique d’une part, mais aussi de trouver des solutions cliniques afin de diagnostiquer la maladie de façon précoce et de lutter contre la récidive des patients après traitement d’une tumeur pulmonaire primaire.
Tableau 1.2 Coûts annuels médicaux associés au cancer du poumon selon le sexe et l’âge en dollars américains aux États-Unis en 2010.
Tableau adapté de Projections of the cost of cancer care in the United States: 2010-20204
Hommes Femmes
Âge < 65 Âge > 65 Âge < 65 Âge > 65
Première année1 73 062 60 885 72 639 60 533
Suivi2 7 591 7 591 8 130 8 130
Dernière année3 142 977 95 318 138 785 92 524
u 1 Douze premiers mois après le diagnostic de la maladie u 2 Période entre la première et dernière année
u 3 Douze derniers mois précédents le décès du patient
1.3 Facteurs de risques et comorbidités du cancer du poumon
Les poumons sont en interface directe avec l’environnement via le processus respiratoire. Les cellules tapissant notre arbre bronchique sont mises à rude épreuve par les nombreux agents nocifs et cancérigènes présents dans l’air que nous respirons. Ainsi, l’environnement dans lequel nous évoluons a un impact majeur sur le développement des maladies pulmonaires.
1.3.1 Le tabagisme
1.3.1.1 En chiffre
Le cancer du poumon est la conséquence du tabagisme dans plus de 80% des cas5. Il est essentiel de lutter contre ce fléau sociétal et de diminuer la consommation de tabac. Celle-ci augmente par 20 les risques de développer une tumeur pulmonaire au cours de sa vie, ce risque augmente avec la quantité et la durée d’exposition au tabac. À noter que l’exposition à la combustion tabagique de manière passive engendre plus de 250 cas de cancer du poumon chaque année au Canada également1, 5, 6. La prévalence du tabagisme était de 13% en 2015 au
Canada soient 3,9 millions de fumeurs. Santé Canada prévoit que 9% de la population canadienne fumera toujours en 20366. Face à cela, le gouvernement canadien a mis en place la « Stratégie de lutte fédérale contre le tabagisme (SLFT) » en 2001. Force est de constater que la diminution du nombre de fumeurs est insuffisante face aux conséquences sociales et économiques désastreuses que cela engendre. La fin du mandat de la SLFT en mars 2018 annonce une refonte des objectifs majeure. En effet, le gouvernement du Canada annonce un taux de tabagisme de 5% seulement d’ici 20357, qui devrait par conséquent s’en suivre d’une diminution significative du nombre de nouveaux cas de cancer du poumon.
1.3.1.2 L’arrêt tabagique
La lutte contre le tabagisme est déterminante pour diminuer la prévalence et l’incidence du cancer du poumon. Même si le meilleur scénario est de ne jamais commencer, il est important de comprendre et de promouvoir les bienfaits de l’arrêt tabagique. En effet, cela permet non seulement de prévenir la perte accélérée de ses capacités pulmonaires, mais aussi de limiter la perturbation des caractéristiques histologiques et moléculaires du tissu pulmonaire. L’arrêt tabagique induit un assainissement progressif des voies respiratoires et diminue significativement les risques de développement et de progression de la maladie. En revanche, cette récupération est lente et souvent incomplète8, 9. Il a d’ailleurs été mis en évidence que les fumeurs, ex-fumeurs et non-fumeurs ont des profils moléculaires bien distincts10. L’âge de l’arrêt a une importance considérable sur la récupération pulmonaire et sur le pronostic vital. En effet, une personne qui arrête de fumer entre 25 et 34 ans retrouve une courbe de survie pratiquement superposable à celle de quelqu’un qui n’a jamais fumé. Entre 35 et 44 ans, l’arrêt du tabac peut faire gagner jusqu’à 9 ans de vie comparativement aux fumeurs, alors qu’arrêter entre 45 et 55 ans permet de gagner 4 à 6 ans seulement. Autrement dit, l’arrêt tabagique doit-être fait le plus tôt possible afin de limiter le développement de maladies associées au tabac comme le cancer du poumon11.
1.3.2 Âge et sexe
L’âge a un impact important sur le développement des tumeurs pulmonaires, notamment parce que la quantité de tabac consommée augmente au cours du temps1 et que comme décrit précédemment, l’âge de l’arrêt tabagique influe directement sur les probabilités de survie11. En effet, c’est à partir de 50 ans que l’incidence du cancer du poumon « explose ». Entre 50 et 69 ans, 14% des nouveaux cas de cancers sont des cancers pulmonaires. Cette population est touchée majoritairement par les cancers hormono-dépendants tels que les cancers du sein et de la prostate. En revanche, entre 70 et 84 ans, le cancer du poumon devient le cancer le plus incident représentant ainsi plus de 18% du total des nouveaux cas de cancers diagnostiqués, avant de redescendre à 14% chez les plus de 85 ans1. L’âge diminue également la probabilité de survie de la population générale en raison d’un déclin des capacités physiologiques. Logiquement, il diminue également les chances de survie des patients atteints
d’un cancer du poumon de façon significative. En effet, le nombre de comorbidités augmente avec l’âge, et la possibilité de subir des traitements agressifs diminue12, 13. Les patients de plus de 65 ans reçoivent significativement moins de traitements adjuvants suite à une résection chirurgicale que les patients de moins de 65 ans12. De plus, ces derniers bénéficient moins souvent d’ablations chirurgicales que les patients plus jeunes, même lorsqu’il s’agit de tumeurs localisées13.
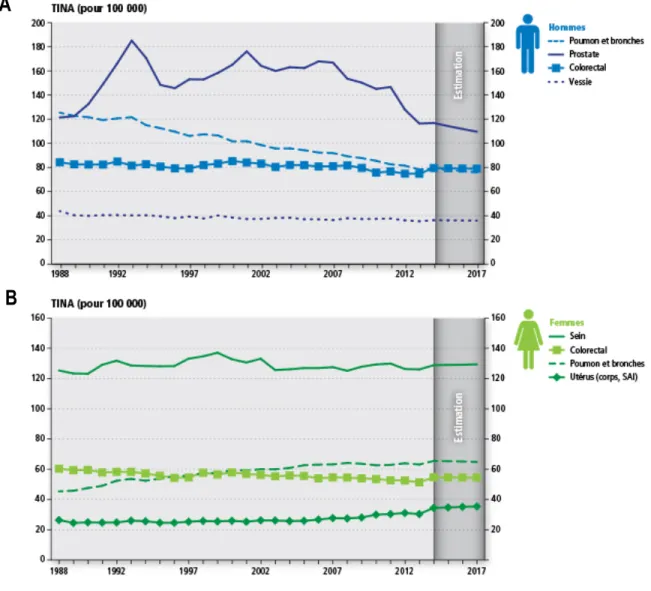
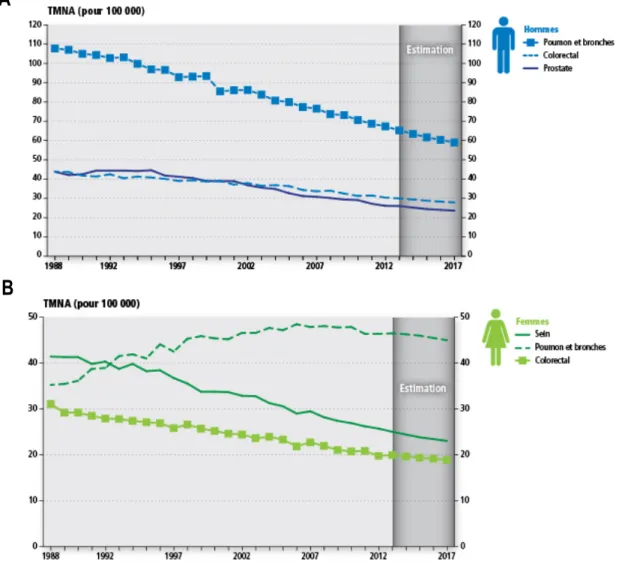
Comme pour l’âge, la relation entre le sexe et le cancer du poumon est plus d’ordre indirect que d’ordre intrinsèque. En effet, le rapport au tabac est la composante majeure de la différence de prévalence et de mortalité entre les hommes et les femmes. En effet, la figure ci-dessous (Figure 1.1) démontre que l’incidence du cancer du poumon chez les hommes diminue de façon continue depuis 1988 alors qu’elle augmente chez la femme. Cela corrèle avec l’augmentation de la consommation tabagique tardive chez la femme. Fatalement, la mortalité par cancer du poumon augmente chez les femmes depuis 1988 alors qu’elle chute chez les hommes. Le taux de mortalité tend à se stabiliser depuis 2013 autour de 60 pour 100 000 chez l’homme et 45 pour 100 000 chez la femme (Figure 1.2)1.
Figure 1.1 Taux d’incidence normalisé selon l’âge (TINA) par cancers chez les hommes (A) et les femmes (B),
au Canada entre 1988 et 2017. Figure adaptée des Statistiques canadiennes sur le cancer 20171
A
Figure 1.2 Taux de mortalité normalisé selon l’âge (TMNA) par cancers chez les hommes (A) et les femmes (B), au Canada entre 1988 et 2017.
Figure adaptée des Statistiques canadiennes sur le cancer 20171
1.3.3 Maladie pulmonaire obstructive chronique (MPOC)
Les comorbidités sont des pathologies concomitantes à la maladie d’intérêt, directement ou indirectement causées par cette dernière, ou agissant comme un facteur de risque. Dans le cas du cancer du poumon, l’âge avancé des patients ainsi que leur statut tabagique ont une influence non-négligeable sur les comorbidités. Ces dernières sont d’autant plus importantes qu’elles influencent les stratégies thérapeutiques des cliniciens, et impactent de façon conséquente les chances de survie des patients12, 14.
B
A
La MPOC est caractérisée par une dégénérescence et une obstruction en partie irréversible des voies respiratoires induisant des difficultés à acheminer l’air des voies aériennes supérieures jusqu’aux bronchioles terminales. Cette pathologie englobe aussi bien les bronchites chroniques obstructives que l’emphysème pulmonaire. Le cancer du poumon est la première cause de décès chez les patients souffrant de MPOC légère ou chronique. En effet, 40 à 70% des patients atteints d’un cancer du poumon souffrent également de MPOC15. Cela n’a rien d’étonnant puisqu’en moyenne, 20% des fumeurs développent de la MPOC au cours de leur vie, et 80% des cancers du poumon sont attribuables à la consommation tabagique5, 15. De plus, la prévalence de la MPOC augmente avec l’âge des patients, tout comme celle du cancer du poumon. De nombreuses études ont donc remis en cause l’association entre la MPOC et le cancer du poumon, en soulignant les facteurs confondants tel que l’âge et le statut tabagique. La prévalence du cancer du poumon chez les patients atteints de MPOC, est significativement augmentée, indépendamment du statut tabagique, faisant de cette pathologie, un des plus importants facteur de risque de développement d’une tumeur pulmonaire après le tabac15. De plus, la MPOC diminue de façon significative les chances de survie des patients atteints d’une tumeur pulmonaire, quel que soit le stade pathologique16. Plusieurs raisons sont évoquées. D’abord, la présence de comorbidités influence la stratégie thérapeutique établie par les cliniciens. De manière générale, les patients atteints de MPOC subissent moins de résections chirurgicales que les patients sans comorbidités. En effet, l’ablation partielle ou complète d’un lobe pulmonaire diminue les capacités respiratoires. Selon la sévérité de la MPOC, la chirurgie risque d’empirer la qualité de vie des patients. De plus, le risque de développer des complications post-opératoires suivant la résection chirurgicale est plus important chez un patient atteint de MPOC. Lorsque la chirurgie est réalisée, il a été mis en évidence que les patients atteints de MPOC recevaient l’opération seule, sans thérapie adjuvante dans une plus grande proportion que les patients sans comorbidités, et qu’ils recevaient des traitements significativement moins agressifs12. Autrement dit, il est difficile de comprendre dans quelle mesure la MPOC et le cancer du poumon sont associés, et s’il existe vraiment une relation cause à effet entre les deux. L’un des défis de la recherche biomédicale de demain sera donc de réussir à optimiser la prise en charge des patients MPOC ayant une tumeur pulmonaire.
1.3.4 Autres facteurs de risques
Outre les facteurs de risques et comorbidités cités ci-dessus, nous recensons une multitude d’agents toxiques et autres facteurs associés, bien qu’en moindre mesure au cancer du poumon. La première cause de développement d’un cancer du poumon chez les non-fumeurs est le radon. Il s’agit d’un gaz radioactif, inodore, incolore et invisible. Le radon est présent en petite quantité dans notre environnement car il est issu de la désintégration de l’uranium présent dans la roche et le sol. Il est inoffensif lorsque l’exposition est infime. En revanche, lorsque celui-ci est présent en quantité plus importante dans un espace clos comme une maison, l’exposition prolongée des poumons aux radiations peut augmenter significativement les risques de développement d’un cancer du poumon. L’amiante,
est une autre substance toxique connue pour son association avec le cancer du poumon, notamment chez les travailleurs des mines, des industries automobiles, des chantiers navals ou encore de la construction. Il s’agit d’un composant minéral naturel, qui était utilisé autrefois dans de nombreux matériaux. L’amiante est une matière constituée de longues fibres capables de s’infiltrer dans les voies respiratoires et d’y rester emprisonnées. La pollution et l’exposition à de multiples agents toxiques tels que l’arsenic que l’on peut retrouver dans l’eau potable, les gaz d’échappement de moteurs diésel ou encore la combustion du charbon dans l’industrie ou simplement pour la cuisson des aliments sont également des agents de nocifs5.
Les facteurs de risque ne sont pas exclusivement liés à des composants chimiques. L’histoire personnelle et familiale a un impact prépondérant sur le développement et l’évolution des maladies, et notamment des cancers. Les personnes ayant déjà développé une tumeur pulmonaire ont plus de chance de développer une néoplasie après leur rémission comparativement aux personnes n’ayant jamais eu de cancer pulmonaire5. De plus, les radiations thoraciques associées au traitement du cancer du sein augmentent significativement le danger de développer un cancer du poumon5, 17. Les antécédents familiaux de tumeur pulmonaire et notamment lorsqu’il s’agit d’un membre de la famille au premier degré sont un bon indicateur de risque également. En effet, des habitudes de vie communes et un environnement partagés peuvent être liés au développement de la maladie5.
Pour terminer, l’affaiblissement du système immunitaire, notamment par la présence d’une maladie auto-immune (VIH, sida, lupus etc.) ou suivant une transplantation augmente le risque de développer tout type de cancer5.
1.4 Diagnostic du cancer du poumon
1.4.1 Symptômes
L’une des principales causes du faible taux de survie associé au cancer du poumon réside dans la difficulté de réaliser un diagnostic précoce de la maladie1, 2. En effet, une grande majorité des cancers pulmonaires précoces sont asymptomatiques18. Bien que non-spécifiques au cancer du poumon, certains signes sont à prendre en considération et la consultation associée à ces troubles peut mener à un diagnostic. En effet, les toux sévères engendrant des expectorations sanguinolentes ou anormales sont des indices majeurs. De même, des infections pulmonaires de type bronchite à répétition avec détresse respiratoire et essoufflements anormaux doivent être signalés. Plus généralement associé à tout type de cancer, une perte de poids rapide, conséquente et inattendue ainsi qu’une fatigue importante peuvent-être induites par un développement tumoral. D’autre part, une fois que le cancer atteint un stade métastatique, les symptômes évoluent en fonction des organes touchés par les tumeurs secondaires. Ainsi, des métastases osseuses peuvent donner lieu à des douleurs intenses dans l’os touché par les cellules cancéreuses alors que les métastases ayant atteint le cerveau peuvent causer des troubles neurologiques
majeurs1, 18. Il est également important de noter que ces symptômes permettent la détection de la maladie, mais pas le diagnostic précis. Autrement dit, les symptômes, lorsqu’ils sont existants, sont les mêmes pour tout type histologique et stade de la maladie18. Cela met en évidence l’importance cruciale de la prévention, ainsi que le besoin de développer des outils adaptés, afin de réaliser un diagnostic précoce et ainsi administrer un traitement adapté à chaque patient, le plus rapidement possible.
1.4.2 Syndrome
Si les symptômes sont inexistants ou aspécifiques, certains syndromes sont souvent responsables de la détection fortuite de la maladie. Un syndrome est un ensemble de symptômes, dont aucune maladie n’est la cause directe. Le plus connu dans le cas du cancer du poumon est le syndrome de Horner, qui est causé dans la grande majorité des cas par les tumeurs pulmonaires à petites cellules1. Il s’agit d’un envahissement des nerfs faciaux présents à l’extrémité supérieure des lobes pulmonaires, par les cellules tumorales. Ainsi, des symptômes visibles comme l’affaissement d’une paupière, une réduction du diamètre de la pupille et une absence de transpiration du même côté du visage peuvent apparaitre18.
Dans d’autres cas, il s’agit d’une pression physique exercée par la masse tumorale, pouvant devenir des urgences médicales majeures. Prenons l’exemple du syndrome de la veine cave supérieure, dans ce cas, la compression empêche le retour veineux des bras et de la tête de se faire correctement vers le cœur, entrainant ainsi des gonflements faciaux et brachiaux et des complications neurologiques graves si ce n’est pas pris en charge à temps1, 18.
1.4.3 Imagerie médicale
Lorsqu’il y a symptômes, syndromes ou simplement suspicions dues aux habitudes de vie ou à l’histoire du patient, les cliniciens peuvent suggérer un examen physique par imagerie médicale. Celui-ci permet d’identifier la/les masse(s) tumorale(s), de caractériser leur position ainsi que leur taille. Depuis quelques années, l’imagerie médicale est également étudiée comme potentiel outils préventif contre le cancer du poumon.
1.4.3.1 Radiographie
Le test le plus courant en clinique dans le cadre d’une suspicion de tumeur pulmonaire est la radiographie de la poitrine, qui est actuellement la technique d’imagerie la plus abordable en matière de coûts et d’infrastructures. Il s’agit d’une technique d’imagerie médicale courante, permettant d’observer la grande majorité des organes. Le principe est simple : le corps est traversé par des rayons X jusqu’à atteindre une pellicule photosensible ainsi qu’un détecteur électronique. Le corps humain, en fonction de son épaisseur et de son coefficient d’atténuation, absorbe
plus ou moins ces rayons, laissant ainsi apparaitre des différences d’intensité de marquage sur la pellicule. Le tissu tumoral étant plus dense que le tissu pulmonaire sain, il laisse apparaitre des tâches blanches intenses à l’endroit de la lésion. La radiographie a également été étudiée comme outil de prévention contre le développement du cancer du poumon. En effet, l’une des principales difficultés de la prise en charge des tumeurs pulmonaires est la détection tardive de ce dernier. Des chercheurs se sont donc demandés s’il serait avantageux de réaliser des examens préventifs radiographiques chez les patients à risques, afin de déceler la formation des carcinomes le plus tôt possible19, 20. Les conclusions les plus récentes démontrent que la radiographie n’offre pas une qualité d’image, ni une quantité d’informations suffisantes pour apporter un véritable bénéfice en tant qu’outil préventif contre le cancer du poumon21, 22. En revanche, la tomodensitométrie (tomographie axiale) semble être plus prometteuse.
1.4.3.2 Tomodensitométrie
Cette technique utilise, tout comme la radiographie, les rayons X ainsi que les propriétés d’absorbance des différents tissus. Cette fois-ci, le patient est placé dans un tube qui tourne tout autour du patient réalisant ainsi des coupes multiples du tronc qui seront éventuellement reconstituées par ordinateur en images en 3 dimensions. Cette technique est plus performante que la radiographie puisqu’elle est capable d’estimer la probabilité qu’un nodule soit cancéreux chez les patients à risques23. Autrement dit, il s’agit d’un potentiel outils de détection précoce des lésions pulmonaires malignes. Toujours dans le cadre de la détection précoce du cancer du poumon, cette technique permet également de multiplier par 4 le taux de vrais positifs comparativement à la radiographie. Bien qu’augmentant légèrement le taux de faux positifs, la tomodensitométrie permettrait de diminuer le taux de mortalité de près de 7% comparativement à la radiographie24. En revanche l’étude du rapport entre les bénéfices et les coûts engendrés par cette technologie ne semble pas encourager l’utilisation d’une telle méthode à des fins préventives25, 26.
1.4.3.3 Tomographie par émission de positrons (TEP)
Cette technique est utilisée en grande majorité accompagné d’une tomodensitométrie, certains tomodensitomètres combinent même désormais les deux technologies en un seul test. Cet outil ne s’appuie pas sur les principes d’absorption des rayons X par le corps humain mais sur les variations de l’activité métabolique des cellules en contact avec une matière radioactive administrée au patient. La TEP, met en évidence l’absorption accrue du fluorodéoxyglucose (18-FDG) par les cellules dont le métabolisme est accéléré, notamment à cause des divisions cellulaires excessives. Autrement dit, cela permet de caractériser l’activité de la tumeur, et donc son agressivité. En revanche, la TEP n’est pas capable de faire la distinction entre des cellules tumorales et d’autres types cellulaires dont le métabolisme peut être accéléré pour des raisons physiologiques normales27. Récemment, les données quantitatives issues des images de TEP ont été mises en corrélation avec le stade pathologique ainsi que le type histologique de la tumeur. De plus, ces données sembleraient être associées au pronostic des patients atteints d’un
adénocarcinome pulmonaire28. L’utilisation des données métaboliques issues de la TEP semble donc être prometteuse afin de personnaliser le traitement des patients et ainsi, améliorer leur pronostic vital29.
1.4.3.4 Imagerie par résonnance magnétique (IRM)
L’IRM est une technique plus sécuritaire que les scanners, elle n’utilise pas de rayons X mais un champ magnétique créé par de gros aimants. Comme pour la tomodensitométrie, le patient est allongé dans un tube alors que le champ magnétique est administré tout autour de lui. Grâce aux propriétés atomiques des molécules d’eau présentes dans notre organisme sous l’action d’un champ magnétique, l’IRM produit des images en coupes permettant l’obtention par ordinateur d’une reconstitution en 3 dimensions du corps, des organes et des tissus27. Les techniques de TEP et d’IRM semblent avoir les mêmes capacités de détection et d’évaluation des nodules cancéreux30, 31. Des études supplémentaires sont nécessaires afin de déterminer quelle technique, entre le TEP et l’IRM serait la plus efficiente et économique en fonction des besoins cliniques31.
1.5 Anatomopathologie du cancer du poumon
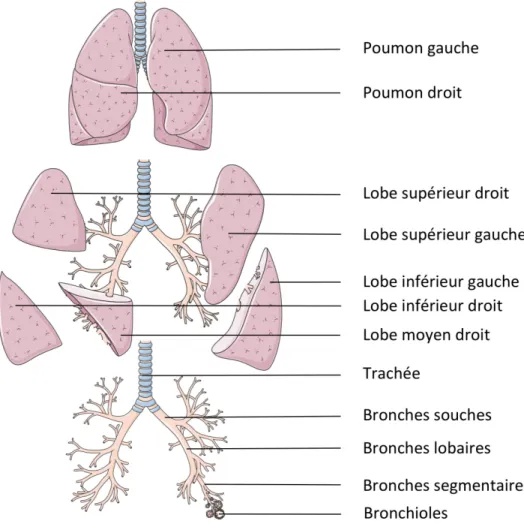
1.5.1 Anatomie générale
Les poumons sont un organe spongieux, remplissant les cavités pulmonaires de part et d’autre du cœur dans le thorax. Le poumon droit est composé de 3 lobes, supérieur, moyen et inférieur alors que le poumon gauche est divisé en deux lobes seulement, les lobes supérieur et inférieur. Poumons droit et gauche sont reliés à la trachée grâce à l’arbre bronchique ou racines bronchiques. Ce pédicule pulmonaire se divise progressivement de la trachée jusqu’aux bronchioles qui s’ouvrent sur les alvéoles pulmonaires (Figure 1.3). C’est au sein de ces alvéoles que se réalise la fonction pulmonaire primaire, la respiration. L’air est acheminé à l’intérieur des poumons par des inspirations. D’abord, les parties supérieures de l’arbre bronchique réchauffent, humidifient et nettoient l’air, avant qu’il atteigne les parties inférieures au sein desquelles le sang se charge en oxygène, et se décharge en dioxyde de carbone qui sera ensuite expulsé par expiration32-34.
Figure 1.3 Anatomie pulmonaire.
Figure adaptée de Medical Servier Art.
1.5.2 Histologie
L’arbre bronchique est un organe complexe et hétérogène. Sa composition cellulaire diffère à mesure que nous nous déplaçons de la trachée vers la périphérie de l’arbre bronchique. Ainsi, la trachée est recouverte d’un épithélium pseudo-stratifié cilié contenant des cellules calciformes. Celui-ci devient de moins en moins épais jusqu’aux bronchioles terminales dans lesquelles l’épithélium est simple, cylindrique, non-cilié et dépourvu de cellules calciformes. Les alvéoles pulmonaires quant à elles, sont tapissées d’une monocouche de pneumocytes de types I et II ainsi que de cellules de Clara.
1.5.2.1 Les bronches
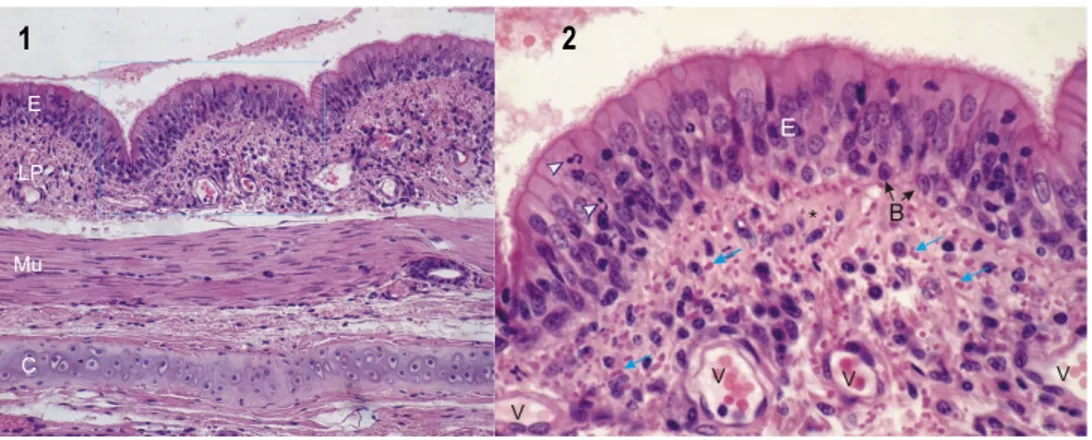
Les bronches sont constituées, de la couche la plus distale à luminale : d’un support cartilagineux, de glandes et de cellules glandulaires, de muscle lisse, de la lamina propria et enfin d’un épithélium pseudo-stratifié cilié (Figure
Les glandes et autre cellules glandulaires quant à elles produisent des mucines, constituant un mucus épais qui capture les poussières, polluants et autres substances indésirables qui pénètrent nos poumons par le processus respiratoire. Ensuite, la couche de fibres musculaires lisses joue un rôle prépondérant pendant l’expiration. En effet, sa disposition en spirales tout autour de la bronche permet la réduction luminale lors de la contraction des fibres, induisant l’expulsion de l’air. Cette couche devient de plus en plus importante à mesure des ramifications. La lamina propria est quant à elle, une couche élastique contenant de nombreux vaisseaux sanguins irrigant les poumons. Pour terminer, l’épithélium pseudo-stratifié cilié est la couche luminale, en contact direct avec l’air issu de la respiration. Cela signifie également qu’il est exposé aux substances cancérigènes et toxiques, et subit donc des dommages qui laissent place à la formation de tumeurs. Cette couche de cellules est dite pseudo-stratifiée, toutes les cellules sont accrochées à la même lame basale, en revanche, elles n’atteignent pas toutes la lumière, donnant ainsi un aspect de couches multiples. De plus, elles possèdent, sur leur extrémité luminale, des cils de quelques microns. Ces cils ont une utilité primordiale puisqu’ils permettent de « balayer » le mucus emprisonnant les entités indésirables contenues dans l’air respiré, les acheminant ainsi jusqu’au système digestif où elles seront détruites32-35.
Figure 1.4 Paroi bronchique en microscopie optique x250 (1) et x600 (2) colorée à l’hématoxyline-éosine. C. Cartilage hyalin, Mu. Muscle lisse, LP. Lamina propria, E. épithélium pseudo-stratifié cilié, B.
Cellules épithéliales basales, V. Vaisseaux sanguins.
Figure adaptée de ATLAS D'HISTOLOGIE EN MICROSCOPIE OPTIQUE35
1.5.2.2 Bronchioles
La paroi des bronchioles (Figure 1.5) est dépourvue de cartilage hyalin, en effet leur diamètre étant plus restreint et les ramifications plus nombreuses, la quantité d’air y est moins importante est nécessite moins de résistance et plus de souplesse. Les fibres musculaires sont au contraire plus abondantes car la force générée pour expulser l’air doit être plus importante à ce niveau de ramifications. Les bronchioles terminales mesurent moins de 1mm de diamètre. Leur composition évolue à mesure des ramifications et les cellules calciformes laissent place aux cellules de Clara dans les bronchioles respiratoires, branches terminales de l’arbre bronchique. Les cellules de Clara sont des cellules ciliées ayant une activité indispensable. Elles produisent le surfactant qui empêche les bronchioles
de se collapser pendant l’expiration, agissent également comme cellules souches afin de réparer les lésions et produisent des enzymes agissant dans la détoxification du système respiratoire32-35.
Figure 1.5. Coupe d’une grande bronchiole (1) et d’une bronchiole terminale (2) en microscopie optique x175 colorée à l’hématoxyline-éosine. M. Muscle lisse, E. Épithélium pseudo-stratifié cilié, G. Petites glandes, D. Canal
reliant la bronchiole à la glande, RB. Bronchiole respiratoire, Cl. Cellule de Clara, Al. Alvéoles pulmonaires. Figure adaptée de ATLAS D'HISTOLOGIE EN MICROSCOPIE OPTIQUE35
1.5.2.3 Alvéoles pulmonaires
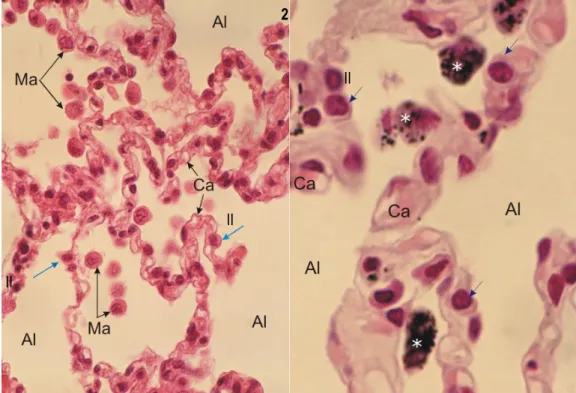
La composition des alvéoles pulmonaires est beaucoup plus simple (Figure 1.6). La paroi se résume à une mince monocouche de cellules appelées pneumocytes, sur une couche basale. Il existe 2 types de pneumocytes, les pneumocytes de type I et de type II. Les premiers représentent environ 40% des pneumocytes composant la paroi alvéolaire, mais en raison de leur grande taille, ils recouvrent environ 95% de la surface de cette dernière. Il s’agit de grandes cellules squameuses dont le cytoplasme proéminant ne laisse apparaitre que très rarement le noyau en coupe histologique. Les pneumocytes de type II quant à eux, représente 60% du nombre de pneumocytes alvéolaires, mais ne recouvrent que 5% de la paroi. Ce sont des petites cellules épithéliales dont la fonction principale est semblable à celle des cellules de Clara, soit de sécréter du surfactant. Les pneumocytes de type II sont capables de se différencier en pneumocytes de type I le cas échéant. De nombreux macrophages libres patrouillent dans la lumière des alvéoles pulmonaires également afin de protéger leur intégrité32-35.
Figure 1.6. Alvéoles pulmonaires en microscopie optique x450 (1) et x1000 (2) colorée à l’hématoxyline-éosine. Al. Alvéoles pulmonaires, II. Pneumocytes de type II, Ca. Lumières des capillaires, Ma. Macrophages libres,
* macrophages libres chargés de carbone.
Figure adaptée de ATLAS D'HISTOLOGIE EN MICROSCOPIE OPTIQUE35
1.5.3 Classification histologique et moléculaire des tumeurs pulmonaires
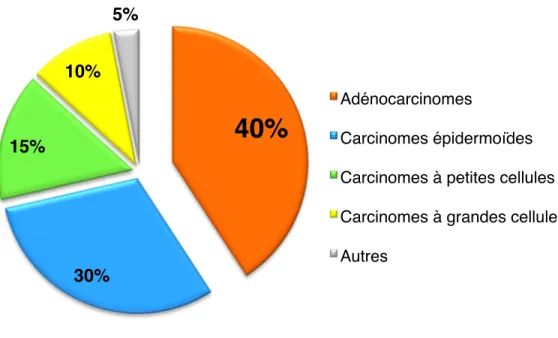
Les tumeurs sont notamment classées en fonction du type cellulaire à partir duquel elles se sont développées. Les principaux types histologiques de cancer du poumon connus sont des carcinomes. Il s’agit de tumeurs d’origine épithéliale. Selon l’Organisation mondiale de la santé (OMS) ainsi que l’International Association for the Study of Lung Cancer (IASLC), il existe 4 types histologiques de tumeurs pulmonaires, divisé en deux groupes : les carcinomes à petites cellules (SCLC), ainsi que les carcinomes non-à petites cellules (NSCLC) parmi lesquels nous trouvons les adénocarcinomes, les carcinomes épidermoïdes et enfin, les carcinomes à grandes cellules. Les NSCLC représentent plus de 80% des cancers du poumon qui seront diagnostiqués en 2017 au Canada. Parmi les NSCLC, 40% sont des adénocarcinomes, ceux-ci étant le type-histologique le plus fréquent (Figure 1.7)1. L’adénocarcinome étant le sujet de ce projet de maîtrise, et l’hétérogénéité au sein de cette catégorie étant importante, nous nous concentrerons exclusivement sur celui-ci pour la suite de ce mémoire.
II
II
II
Figure 1.7. Répartition des nouveaux cas de cancer selon le type-histologique au Canada en 2017.
Figure adaptée des Statistiques canadiennes sur le cancer 20171
1.5.3.1 Classification des adénocarcinomes
Les diagnostics histologiques et moléculaires sont d’importantes pistes de progrès concernant la prise en charge personnalisée des patients atteints d’un cancer du poumon. En effet, l’insertion progressive d’outils pronostics et diagnostics associés à des traitements ciblés, a amélioré le taux de survie des patients36-40. Le développement de ces outils s’accompagne d’une meilleure caractérisation des tumeurs pulmonaires sur le plan architectural et histologique. En effet les adénocarcinomes sont désormais stratifiés en lésions pré-invasives, adénocarcinomes à invasion minime et adénocarcinomes invasifs. De plus, ces sous catégories de tumeurs pulmonaires sont classées en fonction de leur prédominance cellulaire lorsque le niveau de différenciation de la lésion est suffisant. Cela permet une classification des tumeurs en fonction de leur agressivité, et donc de personnaliser le traitement des patients autant que possible36-40.
1.5.3.1.1 Lésion pré-invasives
Les lésions pré-invasives ont un taux de survie à 5 ans de près de 100%. Selon la nouvelle classification des adénocarcinomes pulmonaires de l’International Association for the Study of Lung Cancer (IASLC), American Thoracic Society (ATS) et European Respiratory Society (ERS), cette catégorie regroupe les hyperplasies atypiques adénomateuses (HAA) ainsi que les adénocarcinomes in situ (AIS). Les deux trouvent leurs origines dans les
40%
30%
15%
10%
5%
Adénocarcinomes Carcinomes épidermoïdes Carcinomes à petites cellules Carcinomes à grandes cellules Autrescellules des unités terminales respiratoires, et plus spécifiquement des pneumocytes de type II et/ou des cellules de Clara des alvéoles pulmonaires. Les HAA (Figure 1.8) sont des tumeurs localisées mesurant souvent moins de 5 mm. En microscopie optique, on peut apercevoir des pneumocytes atypiques avec des noyaux proéminents hyper-chromatiques, certaines cellules peuvent même être multi-nucléées. Nous pouvons également apercevoir des espaces entre les cellules de la paroi alvéolaire. À noter que la composition cellulaire au sein même de cette sous-catégorie d’adénocarcinomes est associée à la survie des patients. En effet, plus la composition est homogène, et en grande proportion de cellules lépidiques, et plus le pronostic vital est bon38, 39. Les AIS (Figure 1.9) quant à eux mesurent moins de 3 cm de diamètre, sans invasion lymphatique ni métastatique. En microscopie, nous observons une multiplication cellulaire excessive de proche en proche cohésive et non-invasive. Dans la majorité des cas, ces lésions sont non-mucineuses, et de prédominance lépidique, ce qui explique leur bon pronostic vital33, 41-43 HAA et AIS sont donc des adénocarcinomes de stade 1, dont la stratégie thérapeutique se résume à une ablation totale et potentiellement curative de la masse, et un suivi médical sans thérapie adjuvante44.
Figure 1.8. Hyperplasie adénomateuse atypique au microscope optique x60 (A) et x325 (B), coloration à l’hématoxiline-éosine.
Photographie par Dr Philippe Joubert, IUCPQ.
Figure 1.9. Adénocarcinome in situ au microscope optique x50, coloration à l’hématoxyline-éosine.
Photographie par Dr Philippe Joubert, IUCPQ.
1.5.3.1.2
Adénocarcinomes à invasion minime
Les adénocarcinomes à invasion minime (Figure 1.10) sont des lésions solitaires mesurant moins de 3 cm avec un foyer d’invasion inférieur à 5 mm. L’invasion ne doit s’étendre qu’au niveau du tissu conjonctif de la matrice extracellulaire. Autrement dit, les tumeurs envahissant la plèvre, le réseau lymphatique ou sanguin ne peuvent être considérées comme des adénocarcinomes à invasion minime. Ces lésions peuvent être mucineuses, non-mucineuses ou mixtes33, 41-43. Une fois de plus, il s’agit de tumeurs de stade précoce dont l’ablation totale seule peut demeurer curative. En revanche, 30 à 50% des patients ayant subi une résection chirurgicale récidivent dans les 5 ans suivant l’opération3. À ce jour, aucun outil clinique ne guide les cliniciens dans le choix thérapeutique associé aux adénocarcinomes de stade précoce, expliquant ainsi un taux de survie à 5 ans de 45 à 50% chez les patients atteints d’une tumeur pulmonaire de stade 11-3.
Figure 1.10. Adénocarcinome minimalement invasif au microscope optique x50, coloration à l’hématoxyline-éosine. TS : Tissu sain, TT : Tissu tumoral, Flèche noire : invasion
Photographie par Dr Philippe Joubert, IUCPQ.
1.5.3.1.3
Adénocarcinomes invasifs
Ce sous-type histologique représente entre 70 et 90% des résections chirurgicales pulmonaires. Dans cette catégorie aussi, les chercheurs ont mis en évidence une association significative entre le pronostic vital des patients et l’architecture histologique prédominante36-40. Les adénocarcinomes invasifs sont stratifiés en 5 sous-catégories selon leur architecture (voir ci-dessous), permettant de grader les tumeurs de I à III36, 45-48. De plus, cette classification permet de différencier les adénocarcinomes métastatiques des adénocarcinomes multiples. Cela a un impact prépondérant sur la stadification des tumeurs et donc sur les stratégies thérapeutiques40, 42. En effet, la chirurgie est privilégiée chez les patients de stade précoce alors que les traitements de radiothérapie et de chimiothérapie sont employés pour les stades avancés. À noter qu’aucun outil ne permet de guider le suivi des stades précoces, en revanche, quelques tests moléculaires permettent d’accompagner le clinicien dans le choix de la chimiothérapie44.
TS TT
- les adénocarcinomes à prédominance lépidique : anciennement carcinomes bronchio-alvéolaires, ont le meilleur pronostic vital. En effet, le taux de survie à 5 ans, sans récidive d’un adénocarcinome à prédominance lépidique de stade 1 est de 96%, il s’agit donc de tumeurs de grade I36, 45. De plus, plus le pourcentage en cellules lépidiques est élevé, meilleur est le pronostic vital des patients38, 39.
- les adénocarcinomes à prédominance acinaire : ce sous-type histologique a une concordance de 42% entre le type cellulaire prédominant au sein de la tumeur primaire et celui des métastases. Il s’agit donc d’un grade II, moyennement métastatique36, 45, 46, 48. En microscopie optique (Figure 1.11), nous observons des glandes acineuses simples ovales à rondes ou multiples, mais les phénotypes sont variables et complexes à identifier en microscopie optique.
Figure 1.11. Adénocarcinome invasif à prédominance acinaire au microscope optique x325, coloration à l’hématoxyline-éosine. Encerclé : glande formée par les cellules tumorales
- les adénocarcinomes à prédominance papillaire : 23% de ces adénocarcinomes ont une prédominance cellulaire identique dans la tumeur primaire et les métastases, ce qui signifie qu’il s’agit d’un sous-type peu agressif et métastatique de grade II36, 45, 46, 68. En microscopie optique, nous observons la formation de structures papillaires avec un centre fibrovasculaire (Figure 1.12).
Figure 1.12. Adénocarcinome invasif à prédominance papillaire au microscope optique x80 (A) et x325 (B), coloration à l’hématoxyline-éosine.
Photographie par Dr Philippe Joubert, IUCPQ.
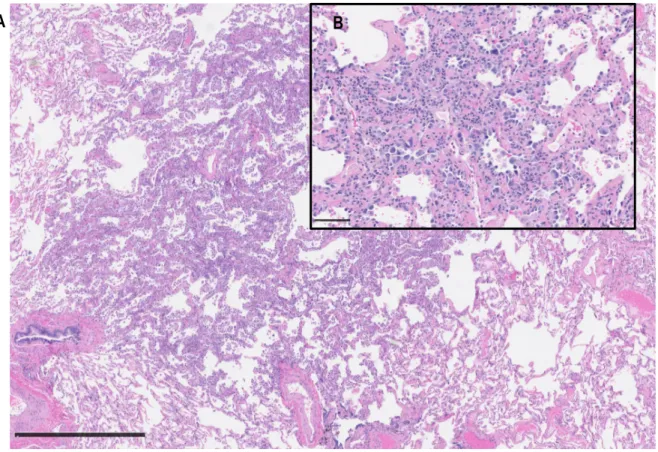
- les adénocarcinomes à prédominance micropapillaire : dans cette catégorie, la concordance entre le type histologique majoritaire de la tumeur primaire et celui des métastases dans le cadre des stades avancés est de 100%, il s’agit donc d’un sous-type agressif, métastatique36, 45-48. En microscopie optique, nous pouvons apercevoir des îlots de cellules éosinophiles atypiques entourés d’espaces plus clairs, il s’agit de micropapilles sans axe fibrovasculaire qui prennent leur origine dans la paroi de l’alvéole pulmonaire. Les cellules sont parfois vacuolisées mais non mucineuses (Figure 1.13).
Figure 1.13. Adénocarcinome invasif à prédominance micropapillaire au microscope optique x175 (A) et x650 (B), coloration à l’hématoxyline-éosine.
Photographie par Dr Philippe Joubert, IUCPQ.
A
- les adénocarcinomes à prédominance solide : dans 86% des cas, le type histologique prédominant dans la tumeur primaire est identique à celui retrouvé dans les métastases, il s’agit du sous-type histologique le plus agressif, de grade III36, 45, 46, 48. En microscopie optique, nous observons un tissu dense, les cellules ont perdu toute inhibition de contact si bien qu’il est difficile de les distinguer les unes des autres. Les adénocarcinomes solides se distinguent des autres tumeurs car ses cellules possèdent des mucines intra-cytoplasmiques. (Figure 1.14).
Figure 1.14. Adénocarcinome invasif à prédominance solide au microscope optique x80 (A) et x175 (B), coloration à l’hématoxyline-éosine.
Photographie par Dr Philippe Joubert, IUCPQ.
1.5.4 Stades pathologiques
L’IASLC propose une classification des tumeurs pulmonaires du stade le plus précoce au plus avancé, en fonction de 3 descripteurs principaux, que l’on appelle communément T, N et M. Cette classification permet de guider les cliniciens dans la mise en place d’une stratégie thérapeutique optimale. Cette classification est principalement basée sur l’association des caractéristiques de la tumeur à la survie des patients.
- T : cette variable prend en considération la taille et la localisation de la tumeur primaire. Dans la dernière mise à jour de cette classification, chaque centimètre compte. En effet, T1, correspondait dans la septième édition aux tumeurs dont la plus grande dimension était comprise entre 1 et 3 cm44, 49-51. Force est de
constater que chaque centimètre est significativement associé à une diminution de la probabilité de survie des patients, T1 est désormais divisé en T1a, T1b et T1c. En effet, la survie des patients N0M0, diminue à mesure que la masse tumorale grandit. Pour un stade T1a ayant une tumeur d’une taille inférieure à 1 cm, la probabilité de survie est de 92% alors que pour un T1b ayant une tumeur comprise entre 1 et 2 cm, le taux de survie est de 86%. Un patient T4N0M0 n’a que 47% de chance de survie à 5 ans49, 50.
- N : cette variable traite de l’invasion des cellules tumorales dans les nœuds lymphatiques régionaux. Il est important de préciser que cette dernière n’est pas systématique, et que même si elle est retrouvée dans une grande partie des cas avancés, il se peut que l’invasion métastatique soit antérieure à l’invasion des nœuds lymphatiques régionaux. L’absence de cellules tumorales dans ces ganglions ne justifie donc pas l’absence de métastases. Les nœuds lymphatiques ont été regroupés en 14 zones de la plus centrale, autour de la trachée, à la plus périphérique au sein des bronches terminales. Ainsi, N0 correspond à l’absence d’invasion dans les nœuds lymphatiques et donc à un meilleur pronostic vital à T et M égaux. N1 correspond à la présence de cellules cancéreuses dans les nœuds lymphatiques périphériques alors que N2 comprend les invasions plus centrales. À noter que les catégories N1 et N2 sont elles-mêmes divisées en N1a, N1b, N2a1, N2a2 et N2b. La différence entre ces stratifications résident, après la localisation, dans la multiplicité des zones touchées (Tableau 1.3)49, 52.
Tableau 1.3 Classification selon l’invasion des nœuds lymphatiques régionaux.
Tableau adapté de The IASLC Lung Cancer Staging Project52
N Caractéristiques
NX Nœuds lymphatiques non-accessibles
N0 Aucune invasion des nœuds lymphatiques régionaux
N1a Une zone N1 envahie
N1b Multiples zones N1 envahies
N2a1 Une zone N2 envahie sans N1
N2a2 Une zone N2 envahie avec N1
N2b Multiples zones N2 envahies
N3 Nœuds lymphatiques controlatéraux
- M : cette variable traite de l’infiltration métastatique, c’est à dire l’atteinte de la circulation sanguine puis l’installation de tumeurs secondaires au sein d’organes multiples. Lorsqu’il n’y en a pas, M0, il s’agit d’un bon pronostic vital. Lorsqu’il y a découverte de métastases, le patient est diagnostiqué stade IV, quelques