AVERTISSEMENT
Cette thèse d’exercice est le fruit d’un travail approuvé par le jury de soutenance et réalisé dans le but d’obtenir le diplôme d’Etat de docteur en médecine. Ce document est mis à disposition de l’ensemble de la communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l’auteur. Ceci implique une obligation de citation et de référencement lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite encourt toute poursuite pénale.
Code de la Propriété Intellectuelle. Articles L 122.4
UNIVERSITÉ PARIS DESCARTES
Faculté de Médecine PARIS DESCARTES
Année 2017
N° 207
THÈSE
POUR LE DIPLÔME D’ÉTAT
DE
DOCTEUR EN MÉDECINE
Évaluation radiologique dans le cancer bronchique non à petites
cellules métastatique sous anti-PD1 et anti-PD-L1 : comparaison
des critères RECIST 1.1, irRECIST et iRECIST
Présentée et soutenue publiquement
le 10 octobre 2017
Par
Mélodie TAZDAÏT
Née le 9 novembre 1988 à Meulan-en-Yvelines (78)
Dirigée par Mme Le Docteur Caroline Caramella, radiologue
Jury :
Mme Le Professeur Marie-Pierre Revel, PU ……….. Président Mme Le Professeur Nathalie Lassau, PU-PH
M. Le Professeur Benjamin Besse, PU-PH
REMERCIEMENTS ... 3
INTRODUCTION ... 6
GENERALITES ... 8
1. Epidémiologie ... 8
2. La place des inhibiteurs de points de contrôle dans le CBNPC ... 8
a. Concept d’immunité anti tumorale ... 8
b. La voie PD1-PD-L1 ... 9
3. Anti PD-1 et anti-PD-L1 dans le CBNPC ... 11
a. Nivolumab ... 11
b. Pembrolizumab ... 12
c. Atezolizumab ... 13
d. Durvalumab ... 14
4. Réponses non conventionnelles sous immunothérapie ... 14
a. La pseudo-progression ... 14
b. La réponse dissociée ... 16
c. Autres spécificités sous immunothérapie ... 16
5. Critères d’évaluation radiologique ... 17
a. irRC (immune related Response Criteria) ... 19
b. irRECIST ... 20
c. iRECIST ... 21
PATIENTS ET METHODES ... 24
1. Modèle de l’étude et critères d’exclusion ... 24
2. Evaluation radiologique ... 24
3. Comparaison de l’évaluation tumorale selon RECIST 1.1, irRECIST et iRECIST ... 25
4. Réponses non conventionnelles ... 25
5. Analyse statistique ... 26
RESULTATS ... 27
1. Caractéristiques de la population ... 27
2. Réponse au traitement ... 27
3. Réponses non conventionnelles ... 28
a. Pseudo-progressions ... 28
b. Réponses dissociées ... 29
4. Comparaison de RECIST 1.1, iRECIST et irRECIST à la 1ère suspicion de progression 30 DISCUSSION ... 32
1. Pseudo-progression ... 32
2. Réponses dissociées ... 33
3. Critères RECIST 1.1 ... 33
4. Critères irRECIST et iRECIST ... 34
CONCLUSION ... 36
BIBLIOGRAPHIE ... 37
FIGURES ... 43
ICONOGRAPHIE ... 55
REMERCIEMENTS
A Madame le Professeur Marie-Pierre Revel,
Vous me faites l’honneur d’accepter de présider le jury de cette thèse. C’est, entre autre, auprès de vous que j’ai appris mes premières notions de radiologie pendant mes cours d’externat et vous avez accepté de juger mon travail de fin d’internat, je vous en remercie.
A Monsieur le Professeur Benjamin Besse,
Vous me faites l’honneur de bien vouloir juger cette thèse. Merci pour votre aide, indispensable à la réalisation de ce travail.
A Madame le Professeur Nathalie Lassau,
Merci d’avoir accepté de juger cette thèse. Merci pour ta bienveillance, ta disponibilité et ta passion pour les travaux de recherche.
A Madame le Docteur Corinne Balleyguier,
Merci d’avoir accepté de juger cette thèse. Merci pour ton aide, ta disponibilité et de me permettre de poursuivre cette belle expérience au sein de Gustave Roussy.
A Madame le Docteur Caroline Caramella,
Merci d’avoir accepté d’être ma directrice de thèse et de m’avoir fait confiance pour ce travail, merci pour ton aide, ton soutien et ta disponibilité.
A ma famille et amis,
A mes parents, mes piliers, parce que je vous dois tout et que sans vous rien ne serait possible.
A ma maman, mon modèle, on se ressemble tellement, merci d’être toujours là pour moi et pour tout ce que tu nous apportes chaque jour.
A mon papa, merci d’être là dans toutes les étapes importantes de ma vie, et de m’avoir accompagné jusqu’au bout de ce travail.
Merci pour votre amour, soutien et encouragement pendant toutes ces années. Vous avez toujours été là pour moi et je serai toujours là pour vous. Merci pour les valeurs que vous m’avez transmises et de m’avoir permis d’être là où j’en suis. Les mots ne suffisent pas à exprimer à quel point je vous admire et je vous aime.
A Sophie, ma grande sœur, merci de m’avoir montré la voie. Merci pour tous ces moments qu’on a partagé depuis que je suis née, je t’aime.
Merci Filipe et Milan pour votre soutien psychologique ! Milan, merci d’avoir résisté à l’appel du clavier du Mac, je t’expliquerai ce travail quand tu seras sorti des couches.
Merci Stan pour ton affection et ton soutien.
A toute ma famille, ceux qui sont partis trop tôt et ceux qui sont présents dans les moments importants.
A mon petit loir, une merveilleuse rencontre -improbable- riche en complicité et connivence… Merci d’être la personne que tu es, dont je suis fan. Merci d’être là pour moi et de m’avoir soutenue pendant ce travail.
A Souha, ma « sœur libanaise », une des plus belles rencontres de mon internat. Merci pour ton amitié qui m’est si précieuse, ton écoute et tes conseils.
A Baptiste -mich mich- une très belle rencontre, “sur la même longueur d’onde” merci pour tous ces fous rires ;)
A Gabriel, Michael et Salma, nous avons fait nos premiers pas ensemble à l’IGR et vous avez été des cointernes en or. Je suis impatiente de vous retrouver, pour reformer cette équipe et continuer à écrire cette belle histoire!
Merci à Myriame, Stéphanie et Marion pour votre amitié et votre soutien durant ces 5 dernières années.
Merci Audrey, pour ton amitié et ton soutien pendant cette cinquième année d’internat ! Merci Marie et Fadila pour votre soutien et vos précieux conseils, je suis contente que nous nous retrouvions très bientôt!
Merci à tous mes cointernes pour ces moments inoubliables de mon internat, en particulier Simon, Stéphanie, Rodger, Valeria, Adrien, Florian, Noémie, Lucas, Hicham, Inès, Ahmad, Claire et Marie.
Merci à tous ceux que je n’ai pas cités mais qui m’ont aidée et soutenue pendant ce travail, et de façon plus générale pendant ces études de médecine.
A tous les médecins et équipes paramédicales ayant participé à ma formation,
A toute l’équipe de Gustave Roussy, en particulier Caroline, Corinne, Samy, Francois, Sandra, Julia, Nathalie, Leila, Edwige, Salima. Merci pour ce semestre d’internat déterminant que j’ai passé parmi vous.
A toute l’équipe de Poissy, en particulier Oliv, Pénélope, Sarkis, Georges, Yves et Ali. C’est parmi vous que j’ai fait mes premiers pas en radiologie pendant un semestre inoubliable, je vous en suis infiniment reconnaissante. Merci Oliv pour ta générosité et ta gentillesse, on t’aime ! Merci aussi au reste de l’équipe, Anne Laure et Moustapha ;)
Merci à l’équipe de Bichat, en particulier à Agathe, Géraldine, Nicoletta et Olivier.
Merci à l’équipe de médecine nucléaire de Trousseau et plus particulièrement au Dr Aline Sebag.
Merci à l’équipe de radiologie pédiatrique de Trousseau, en particulier François, Eléonore et Chiara.
Merci à toute l’équipe de médecine nucléaire du Val de Grâce, en particulier à Séverine et Sabrina.
Merci à l’équipe de radiologie de Mondor, en particulier au Pr Luciani et au Dr Francois Legou.
Merci à tout l’équipe de neuroradiologie de Mondor, en particulier au Dr Pierre Brugières et à la meilleure équipe féminine de manip de tout mon internat.
Un grand merci à toute l’équipe de Saint Joseph, en particulier au Pr Zins, Isabelle, Lucie, Wassef, Sarah , Sophie B et Sophie G, Véronique , Arshid et Aurore !
Merci à l’équipe de Saint Antoine, en particulier à Céline et John pour votre aide jusqu’à la dernière minute et à mes cointernes en particulier de la team os, Sarah et Joseph.
INTRODUCTION
Le cancer du poumon demeure la principale cause de décès par cancer dans le monde (1,2). Encore souvent diagnostiqué à un stade tardif, son pronostic reste sombre avec un taux
de survie à 5 ans inférieur à 10% pour le cancer bronchique non à petites cellules (CBNPC) au stade métastatique. L’immunothérapie a récemment révolutionné le traitement des patients atteints de CBNPC de stade avancé, en démontrant une augmentation de la survie globale en 2ème ligne en comparaison de la chimiothérapie à base de sels de platine. Ainsi depuis 2015, le nivolumab (3,4) est indiqué en 2ème ligne thérapeutique pour les carcinomes épidermoïdes et les adénocarcinomes (en cas de surexpression du programmed death ligand 1 PDL1) et plus récemment le pembrolizumab en 2eme ligne en cas de surexpression de PDL1 et même en 1ère ligne en cas de surexpression > 50% (5, 6). En bloquant la liaison des ligands L1 et PD-L2 exprimés par les cellules tumorales au récepteur PD1 à la surface des lymphocytes T activés, ces immunomodulateurs empêchent l’inactivation lymphocytaire permettant la restauration de la réponse immunitaire anti tumorale (7). Mais la réponse radiologique sous immunomodulateurs est parfois différente de celle observée sous chimiothérapie, avec notamment l’apparition de réponses dites « non conventionnelles», comme la pseudo-progression (8), initialement décrite dans le traitement du mélanome par immunomodulateurs (9), et les réponses dissociées. Les critères radiologiques habituellement utilisés (RECIST 1.1 pour Response Evaluation Criteria In Solid Tumors version 1.1) peuvent sous-estimer le bénéfice thérapeutique de ces nouveaux traitements et entrainer un éventuel arrêt trop précoce du traitement. Deux types de critères radiologiques spécifiques à l’immunothérapie ont ainsi été développés afin de mieux définir la réponse tumorale en essayant de prendre en compte ces spécificités. Les critères irRC (immune-related Response Criteria) furent initialement proposés à partir de données rétrospectives d’une cohorte de patients traités par ipilimumab (un autre inhibiteur de point de contrôle immunitaire) dans le mélanome métastatique en 2009
(9), suivis par les critères irRECIST (immune-related Response Evaluation Criteria in Solid Tumors) se basant sur les mêmes principes, simplifiés (10) . Plus récemment, le groupe de travail RECIST a proposé d’autres critères nommés iRECIST (pour immune Response Evaluation Criteria in Solid Tumors) en mars 2017 (11). Ils diffèrent par plusieurs aspects de l’évaluation radiologique.
L’objectif de cette étude est d’étudier et de décrire les différents profils de réponse sous immunothérapie anti-PD1 ou anti-PD-L1 dans le CBNPC avancé et de comparer les évaluations radiologiques selon que l’on applique les critères RECIST 1.1, irRECIST et iRECIST.
GENERALITES
1. Epidémiologie
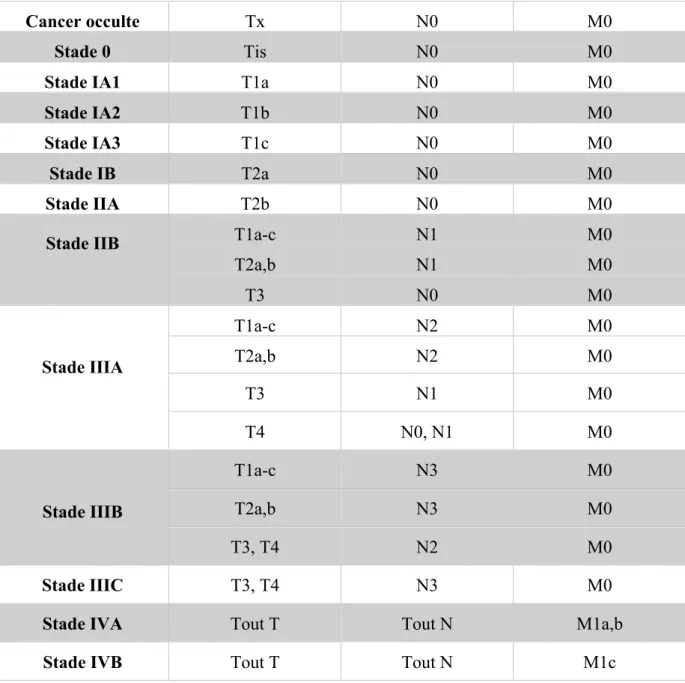
Le cancer du poumon est la première cause de décès par cancer en France et dans le monde. (1,2). Il occupe le 2ème rang chez l’homme et le 3ème rang chez la femme des cancers les plus fréquents et est responsable d’environ 30 000 décès par an en France. Le tabac en est le principal facteur de risque. Les cancers bronchiques non à petites cellules (CBNPC) représentent le type histologique le plus fréquent, environ 85% des cas, contre environ 15% pour le cancer bronchique à petites cellules. Parmi les CBNPC, les sous types histologiques les plus fréquents sont l’adénocarcinome (50 à 65 %) et le carcinome épidermoïde (environ 25 à 30 %). Le pronostic reste mauvais, avec une survie relative à 5 ans estimée à environ 14% quel que soit le stade TNM. Un rappel de la stadification TNM 2017 est donné en tableau 1 à 4. Liée au stade, la survie peut atteindre 50% dans les formes localisées mais du fait d’une maladie longtemps asymptomatique, la majorité des patients est diagnostiquée à un stade localement avancé ou métastatique où la survie à 5 ans chute alors respectivement à environ 24% et 4% (12).
Pendant longtemps, le principal traitement des CBNPC métastatiques disponible était la chimiothérapie à base de sels de platine. Mais depuis quelques années, la recherche a ouvert de nouvelles perspectives thérapeutiques, notamment dans le domaine de l’immunothérapie anti-tumorale.
2. La place des inhibiteurs de points de contrôle dans le CBNPC
a. Concept d’immunité anti tumorale
l’invasion tumorale. Suspectés dès le 19ème siècle, ces concepts d’immunosurveillance et de réponse immunitaire anti-tumorale sont désormais plus clairement établis (13, 14). Parmi les cellules effectrices, les lymphocytes jouent un rôle majeur dans la réponse anti-tumorale. Une fois activés, les lymphocytes T CD8+ (LT-CD8) vont être capables de lyser les cellules tumorales en libérant des granules cytotoxiques (tels que la perforine ou le granzyme) ou entrainer l’apoptose de la cellule ciblée. Les lymphocytes T CD4+ (LT-CD4) peuvent également avoir une action cytotoxique anti-tumorale directe, mais leur principale fonction est la production de cytokines (IFNγ) permettant l’induction et la persistance des LT-CD8 anti tumoraux.
Les antigènes tumoraux sont d’abord capturés par les cellules présentatrices d’antigène qui migrent ensuite dans les ganglions lymphatiques drainants ou elles vont activer les lymphocytes naïfs. Une fois activés, les LT effecteurs migrent vers les tissus périphériques ou leur récepteur TCR (T Cell Receptor) sera capable de reconnaitre l’antigène tumoral à la surface des cellules cancéreuses, ce qui aura pour effet de les activer en lymphocytes cytotoxiques, capable de lyser ces dernières.
b. La voie PD1-PD-L1
Les points de contrôle immunitaires (aussi appelés checkpoints immunitaires) sont un ensemble de voies de signalisation récepteurs/ligands intervenant dans la modulation de la réponse lymphocytaire T. Leur rôle physiologique est de maintenir la tolérance du soi en contrôlant l’intensité et la durée de la réponse immunitaire par le biais d’activation ou au contraire d’inhibition des lymphocytes T. Mais les cellules tumorales vont être capables d’agir sur ces voies de contrôle du système immunitaire et de les détourner afin d’échapper à la réponse immunitaire anti-tumorale (15,16). Des molécules ont donc été développées, ciblant ces points de contrôle immunitaire afin d’éviter ce phénomène d’échappement (17).
Les premiers essais thérapeutiques chez l’homme ciblant les points de contrôle immunitaire ont débuté dans les années 2000, et concernaient la voie du cytotoxic T lymphocyte-associated antigen 4 (CTLA4). Le CTLA4 est un récepteur exprimé à la surface des LT-CD8 et des LT-CD4 qui module leur activation à la phase précoce. L’ipilimumab est le premier anticorps monoclonal ciblant cette voie de rétrocontrôle inhibiteur qui a été approuvé par la FDA (Food and Drug Administration) et l’EMA (European Medecine Agency) en 2011 pour les patients atteints de mélanome métastatique (18).
La voie PD-1/PD-L1 est une autre voie de rétrocontrôle négatif de l’activation des lymphocytes T, plus tardive, au niveau des tissus périphériques et du microenvironnement tumoral (19). Le récepteur Programme death 1 (PD-1) est un récepteur exprimé à la surface des LT-CD8 et LT-CD4 activés, des lymphocytes T régulateurs (LT-Reg) et également d’autres cellules immunitaires telles que les cellules Natural killer (NK), dendritiques, lymphocytes B et monocytes. Ses ligands, le Programmed cell Death Ligand 1 (PD-L1 aussi appelé B7-H1) et Programmed cell Death Ligand 2 (PD-L2 ou B7-DC) sont exprimés à la surface des cellules présentatrices de l'antigène, des cellules tumorales et d'autres cellules du microenvironnement tumoral. La liaison de PD-L1 ou PD-L2 au récepteur PD-1 va entraîner une inhibition de l’activation des cellules T et de la sécrétion de cytokines (20). Les cellules tumorales vont être capables de détourner ces points de contrôle immunologiques en surexprimant ces ligands de rétrocontrôle inhibiteur soit de façon constitutive, soit en réponse à des signaux inflammatoires sécrétés par le microenvironnement tumoral afin d’échapper à cette réponse immunitaire anti-tumorale (figure 1).
Les anti-PD-1, tels que le nivolumab et le pembrolizumab, sont des anticorps monoclonaux qui ont pour rôle de se fixer sur le récepteur PD1 à la surface des LT activés, afin d’empêcher la fixation des ligands PD-L1 et PD-L2 et donc d’empêcher l’inactivation lymphocytaire. Les
anticorps anti-PD-L1, tels que l’atezolizumab et le durvalumab, vont se fixer au ligand PD-L1 et ainsi empêcher sa fixation au récepteur PD-1.
3. Anti PD-1 et anti-PD-L1 dans le CBNPC
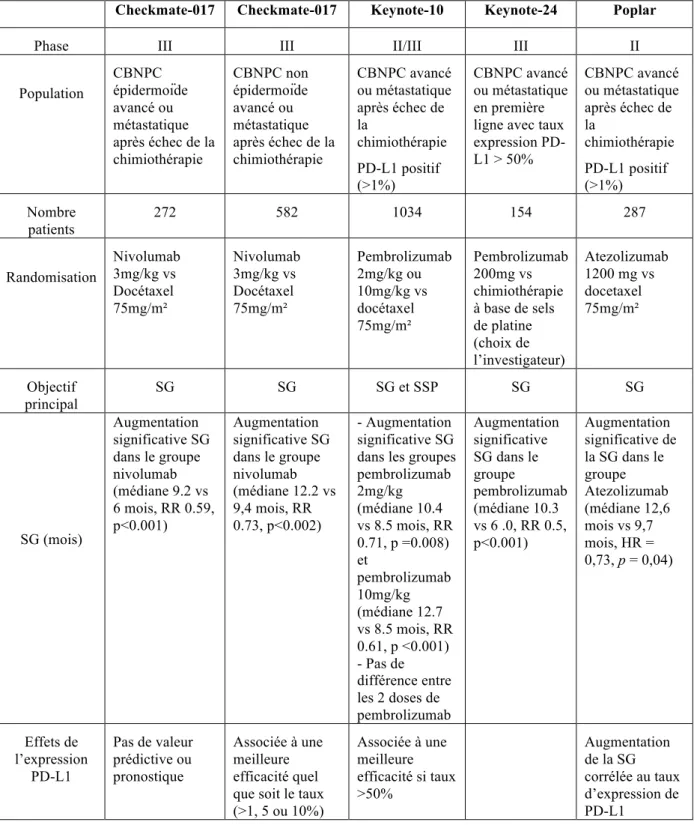
Le tableau 5 récapitule les principaux essais thérapeutiques randomisés des anti PD-1 et anti PD-L1 dans le CBNPC .
a. Nivolumab
Le nivolumab (Opdivo®, Bristol-Myers Squibb) est un anticorps monoclonal IgG4 humanisé dirigé contre le récepteur PD-1 (21). C’est la première immunothérapie ciblant l’axe PD-1/PD-L1 ayant obtenu une autorisation de mise sur le marché par la Food and Drug Administration FDA) et l’European Medicines Agency EMA) en deuxième ligne dans le traitement du CBNPC épidermoïde et non épidermoïde localement avancé ou métastatique après échec de la chimiothérapie en 2015.
Plusieurs études de phase 1 puis de phase 2, dont celles conduites respectivement par Gettinger et al (22) et Rizvi et al (23) ont démontré des réponses objectives significatives et des taux de survies encourageants dans le CBNPC après échec de la chimiothérapie. C’est sur ces bases qu’a été menée l’étude CheckMate-017 (3), conduisant à l’AMM du nivolumab dans le CBNPC épidermoïde avancé et métastatique en deuxième ligne en octobre 2015, démontrant sa supériorité sur le docetaxel en terme de survie globale (SG), quel que soit le seuil d’expression de PDL-1 (1 %, 5 % ou 10 %). Il s’agissait d’un essai randomisé de phase III comparant l’efficacité et la tolérance du nivolumab à celles du docetaxel sur une cohorte de 272 patients. L’étude a été interrompue prématurément après une analyse intermédiaire révélant une différence significative de la SG en faveur du bras nivolumab. La médiane de SG
était de 9,2 mois [IC 95 % : 7,3-13,3] dans le groupe nivolumab vs 6 mois [IC 95 % : 5,1-7,3] dans le groupe docetaxel (HR = 0,59, IC 95 % : 0,44-0,79 ; p = 0,00025). Le taux de réponse était de 20% [IC 95% : 14-28] pour le nivolumab vs 9% [IC 95% : 5-15] pour le docetaxel. Le niveau d’expression de PD-L1 n’a pas été identifié comme marqueur prédictif du bénéfice sur la survie globale.
Le nivolumab a secondairement obtenu l’AMM dans le CBNPC non épidermoïde au vu des résultats de l’étude CheckMate-057 (4), essai thérapeutique de phase III sur 582 patients suivant le même schéma thérapeutique. La survie globale était significativement supérieure chez les patients traités par nivolumab avec une médiane de survie de 12,2 mois [IC95% : 9,7-15,0] vs 9,4 mois [IC95% : 8,1-10,7] pour le docetaxel (HR = 0,73 ; IC 95 % : 0,59- 0,89 ; p = 0,002), quel que soit le seuil d’expression de PDL-1. Par ailleurs, cette étude montrait également une association entre le taux d’expression de PD-L1 et l’efficacité du traitement avec une augmentation de la SG chez les patients dont la tumeur exprimait PD-L1 (sur >1% des cellules tumorales).
Le nivolumab en monothérapie en première ligne dans le CBNPC avancé exprimant le PD-L1
n’a néanmoins pas démontré d’augmentation significative de la survie sans progression en comparaison d’une double chimiothérapie dans l’essai CheckMate-026 (24).
b. Pembrolizumab
Le pembrolizumab (Keytruda®, Merck), est également un anticorps monoclonal IgG4 humanisé dirigé contre le récepteur PD-1. Il a est aujourd’hui indiqué en deuxième ligne dans le CBNPC avancé ou métastatique exprimant le PD-L1 à la surface des cellules tumorales et en première ligne dans le CBNPC avancé ou métastatique surexprimant le PD-L1> 50%.
comparant le pembrolizumab à la dose de 2 mg/kg et de 10 mg/kg au docetaxel en deuxième ligne chez 1034 patients présentant un CBNPC avancé dont au moins 1 % des cellules tumorales exprimaient le PD-L1. La SG était significativement augmentée dans les bras traités par pembrolizumab en comparaison du bras docetaxel quel que soit le pourcentage de d'expression du PD-L1 : de 10,4 mois dans le groupe pembrolizumab de 2 mg/kg (HR = 0,71 ; IC 95 % : 0,58-0,88 ; p = 0,0008), 12,7 mois dans le bras 10 mg/ kg (HR=0,61 ; IC 95% : 0,49-0,75 ; p<0,0001) contre 8,5 mois dans le groupe docetaxel. Il n’y avait pas de différence de SG entre les deux doses de pembrolizumab.
Par ailleurs, la survie sans progression était significativement plus élevée chez les patients traités par pembrolizumab lorsque le pourcentage de cellules tumorales exprimant le PD-L1 était supérieur à 50 %.
Il a ensuite été approuvé par la commission européenne en première ligne dans le CBNPC localement avancé ou métastatique surexprimant PD-L1 (sur ≥ 50 % des cellules tumorales) sur les données de l’étude Keynote-024 (6). Cette étude de phase III, compare le pembrolizumab en monothérapie à une chimiothérapie à base de platine chez 305 patients dont la tumeur surexprime PD-L1 (pourcentage de cellules tumorales exprimant PD-L1 ≥ 50 %) et sans traitement systémique préalable. Cet essai a été arrêté précocement en raison d’une survie sans progression médiane significativement supérieure dans le groupe pembrolizumab comparativement au bras chimiothérapie, respectivement de 10.3 mois vs 6 mois (HR = 0.50; IC 95% :0.37 - 0.68; P<0.001). La SG à 6 mois était également supérieure dans le bras pembrolizumab comparativement au bras chimiothérapie (HR= 0.60; IC 95%, 0.41- 0.89; p=0.005), tout comme le taux de réponse (44.8% versus 27.8%).
c. Atezolizumab
suite à plusieurs études ayant démontré une augmentation de la SG en comparaison de la chimiothérapie conventionnelle (26).
L’essai thérapeutique POPLAR (27) est une étude de phase II/III comparant l’atezolizumab au docetaxel en deuxième ligne chez 287 patients présentant un CBNPC épidermoïde et non épidermoïde localement avancé ou métastatique dont au moins 1 % des cellules tumorales exprimaient le PD-L1. Les résultats intermédiaires mettaient en évidence un bénéfice en terme de SG dans le groupe atezolizumab par rapport au docetaxel chez l’ensemble des patients traités (respectivement 12,6 mois versus 9,7 mois, HR = 0,73, p = 0,04). Par ailleurs, le bénéfice en terme de SG chez les patients traités par atezolizumab augmentait avec le pourcentage d’expression de PDL-1 par les cellules cancéreuses et/ou les cellules immunitaires : 15,5 mois en cas d’expression forte (HR = 0,60 ; 95 % CI 9,8–NE) vs. 9,7 mois (HR = 1,12 ; 95 % CI 6,7–16,4) en cas d’absence d’expression (IC à 95 % ; 9,7-16,4). Les patients qui n’exprimaient pas PD-L1 avaient le même bénéfice sur la SG qu’ils aient reçu l’atezolizumab ou le docetaxel (9,7 mois versus 9,7 mois, HR = 1,04).
d. Durvalumab
Le durvalumab (MEDI4736, Astra Zeneca), un autre anti PDL1, a été approuvé dans le cancer urothélial métastatique (28), mais un essai thérapeutique très récent de phase III, l’étude MYSTIC (encore non publiée) dans le CBNPC en 1ere ligne semble être négative sur l’objectif principal de survie sans progression.
4. Réponses non conventionnelles sous immunothérapie
a. La pseudo-progression
n’existaient pas ou de façon anecdotique au cours des traitements par chimiothérapies. Initialement constatés sur la discordance entre un état clinique préservé et une aggravation radiologique, ils ont été décrits pour la première fois dans le mélanome métastatique sous ipilimumab, un anticorps monoclonal anti CTLA-4 en 2009 (9). Quatre profils de réponse ont ensuite été décrits (figure 2): 1) une réponse radiologique d’emblée, 2) une stabilité suivie d’une diminution lente de la masse tumorale, 3) une réponse après une augmentation initiale de la masse tumorale, et 4) une diminution de la masse tumorale concomitante à l’apparition de nouvelle(s) lésion(s).
Ainsi le phénomène de « pseudo-progression » correspond à une réponse secondaire après progression radiologique significative initiale qui peut être soit une augmentation de la masse tumorale (lésions cibles ou non cibles), soit l’apparition de nouvelle(s) lésion(s) (9,29). Des observations sur pièces anatomopathologiques après immunothérapie permettent d’expliquer en partie ce phénomène par un infiltrat oedémato-inflammatoire ou des remaniements nécrotiques tumoraux transitoires induits par la réactivation lymphocytaire au niveau tumoral liés au traitement (30, 31).
Dans le mélanome métastatique, plusieurs études montrent une proportion d’environ 10% des patients qui présenteraient une pseudo-progression (9,32). Dans les autres types tumoraux, dont le CBNPC, ce chiffre est moins important (autour de 5%) (8, 22) mais il faut souligner que la majorité des patients qui présentent une progression radiologique ne poursuit pas le traitement dans les études publiées ce qui suggère une très probable sous -évaluation du phénomène.
Jusqu’à maintenant, aucun paramètre radiologique, biologique ou clinique prédictif de pseudo-progression n’a été identifié. On ne peut donc identifier une pseudo-progresssion que rétrospectivement. Le délai d’apparition d’une éventuelle pseudo-progression n’est pas non
plus clairement défini. La plupart des pseudo-progressions décrites dans la littérature sont définies comme « précoces » dans les 12 premières semaines de traitement, mais des cas de pseudo-progressions « retardées » ont également été décrits (29).
b. La réponse dissociée
Une réponse dissociée correspond à une diminution de certaines lésions tumorales alors que d’autres augmentent en taille ou que des nouvelles lésions apparaissent simultanément. Ce type de réponse n’est pas spécifique à l’immunothérapie, parfois observé dans les chimiothérapies conventionnelles, ou encore des thérapies ciblées comme les inhibiteurs de BRAF dans le mélanome (33). Une des hypothèses explicatives est que le microenvironnement tumoral diffère en fonction des organes. Par exemple, le foie présente un microenvironnement intrinsèque immunosuppressif (34), pouvant expliquer une moindre immunité anti-tumorale. Au contraire, la richesse en cellule immunitaire des ganglions ou le rôle d’immunomodulation de l’axe hypothalamique-pituitaire-surrénal et la synthèse de cytokine des glandes surrénales (35) peuvent expliquer une meilleures réponse immunitaire anti-tumorale des lésions tumorales ganglionnaires ou surrénaliennes.
c. Autres spécificités sous immunothérapie
Le délai d’apparition d’un effet anti tumoral mesurable peut être plus long dans les traitements par inhibiteurs de points de contrôle que dans les chimiothérapies cytotoxiques conventionnelles.
Par ailleurs, une stabilité persistante de la maladie sous immunothérapie peut également traduire une activité anti-tumorale.
particulièrement dans le mélanome mais également dans le CBNPC avec des suivis prolongés (36).
Enfin, un phénomène d’hyper-progression (d’accélération de la maladie) a été récemment identifié au cours des traitements par immunothérapie (37).
5. Critères d’évaluation radiologique
L’utilisation de critères radiologiques d’évaluation tumorale joue un rôle primordial aussi bien dans le domaine de la recherche qu’en pratique clinique quotidienne en fournissant une évaluation objective et quantitative de la réponse tumorale aux traitements anticancéreux. Ils permettent en effet de créer un langage international commun en standardisant les évaluations et facilitant la comparaison de résultats des essais thérapeutiques. D’autre part dans la pratique clinique quotidienne, ils sont indispensables à la décision thérapeutique.
Les premiers critères internationaux ont été proposés en 1979 par l’Organisation mondiale de la Santé (OMS), appelés critères OMS (38) dans le cadre d’une conférence de consensus plus globale sur la prise en charge des malades atteints de cancers. Au plan radiologique, les experts ont proposé une évaluation bidimensionnelle de la taille des tumeurs (produit du plus grand axe et du plus grand diamètre perpendiculaire à celui-ci) et un principe de comparaison du pourcentage d’évolution entre 2 évaluations radiologiques.
Néanmoins, c’est avec l’établissement des critères RECIST (Response Evaluation Criteria In Solid Tumors) que l’évaluation radiologique a été rendue plus simple et universelle.
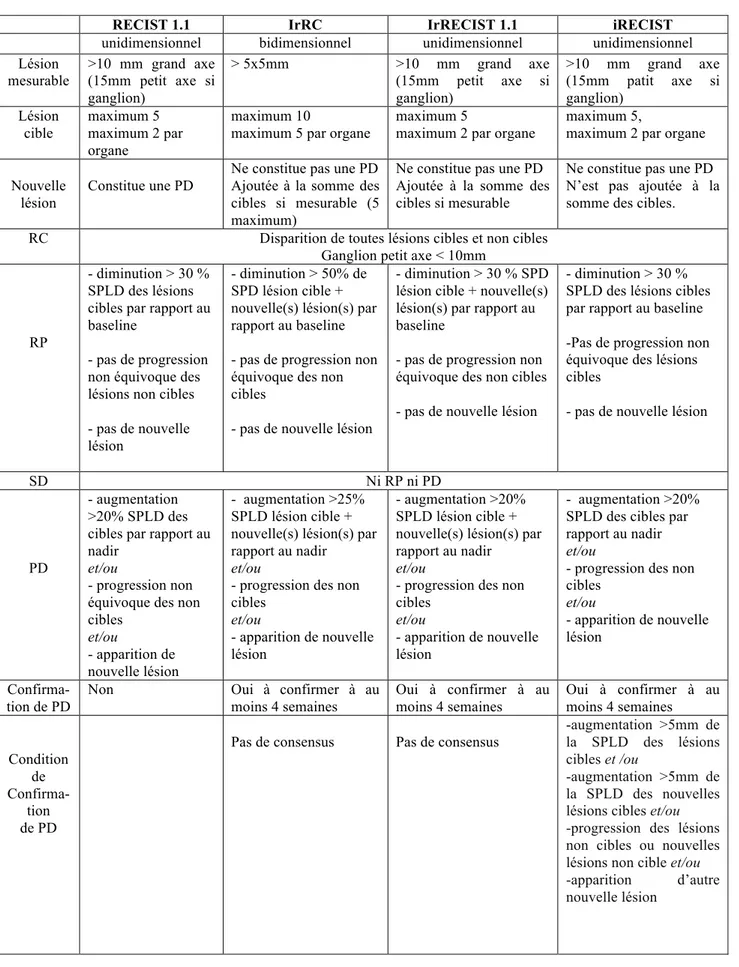
Publiés initialement en 2000 (39) et révisés en 2009 (RECIST version 1.1) (40), ces critères ont été validés sur de larges cohortes de patients recevant des chimiothérapies cytotoxiques. Les principes de base régissant RECIST 1.1 sont résumés dans le tableau 6.
On parle de ‘baseline’ pour le scanner réalisé juste avant le début du traitement et de ‘Nadir’ en cas de meilleure réponse. On définit des lésions cibles (maximum 5 au total, maximum 2 par organe) et des lésions non cibles éventuelles correspondant soit aux lésions non choisies comme cibles, soit aux lésions tumorales non mesurables (épanchements, lymphangite, miliaires…). On compare à chaque évaluation radiologique les mêmes cibles et le pourcentage d’évolution de la somme des mesures des lésions cibles. On évalue ensuite l’évolution qualitative des non cibles et l’apparition éventuelle de nouvelle lésion. La progression est définie par une augmentation de plus de 20% des lésions cibles et/ou une augmentation non équivoque des lésions non cibles et/ou l’apparition d’une ou plusieurs nouvelle lésion indiscutablement tumorale.
Les réponses observées avec ces critères (réponse complète ou CR pour complete response, réponse partielle ou PR pour partial response, stabilité ou SD pour stable disease et progression ou PD pour progressive disease) définissent dans les essais thérapeutiques les taux de survie sans progression et les meilleures réponses globales (best overall responses), indispensables pour les validations des molécules à l’échelle administrative. A noter que de nombreux autres critères radiologiques ont été proposés par la suite, la plupart basés sur la mesure de la taille des lésions, mais également sur la densité des lésions en particulier pour l’évaluation des traitements anti-angiogéniques pour lesquels la taille des lésions ne diminuait pas toujours initialement alors que l’on pouvait observer une dévascularisation (critères de CHOI) (41), ainsi que des critères spécifiques à certaines maladies (glioblastomes par exemple avec les critères RANO applicables à l’imagerie IRM) ( 42).
Mais l’évaluation de la réponse tumorale sous immunothérapie par inhibiteurs de point de contrôle selon ces critères a montré des limites dès les premiers essais thérapeutiques. En effet, ne nécessitant pas de scanner de confirmation, ces critères sont incapables de
différencier les pseudo-progressions des vraies progressions et risquent d’entraîner un arrêt précoce injustifié du traitement. Des critères d’évaluation spécifiques à l’immunothérapie ont alors été proposés afin d’essayer de détecter ces réponses atypiques sous immunothérapie.
a. irRC (immune related Response Criteria)
Basés sur une étude multicentrique rétrospective dans le mélanome métastatique sous Ipilimumab, les critères irRC sont les premiers critères spécifiques de l’immunothérapie à être proposés en 2009 (9). Ces critères proposent une mesure bidimensionnelle des lésions, basés sur les critères OMS, prenant en compte la somme des produits des deux plus grands diamètres perpendiculaires des lésions cibles. Les lésions cibles sont au nombre maximum de 10 pour les lésions viscérales (maximum 5 par organe) et 5 pour les lésions cutanées et doivent mesurer plus de 5x5mm. Ces critères font alors intervenir deux notions inédites : 1) les nouvelles lésions ne signent pas la progression et sont ajoutées à la masse tumorale si elles sont mesurables (taille supérieure à 5 x 5 mm, maximum 10 nouvelles lésions viscérales et 5 cutanées), 2) l’évaluation doit être confirmée sur un second scanner réalisé à au moins quatre semaines d’intervalle.
Si la progression initiale n’est pas confirmée par cet examen, le traitement peut être poursuivi et le principe de ‘reset baseline’ c’est-à-dire de modification de la date du scanner de référence pour le suivi thérapeutique ultérieur doit être appliqué. En pratique, le scanner qui avait constitué la première progression (ou suspicion de progression) devient le nouveau ‘baseline’ pour le reste de l’évaluation. Cette dernière complexité, en dehors du fait qu’elle permet in fine d’identifier les pseudoprogressions, pose des questions pratiques insolubles en routine clinique et est contraire aux principes de RECIST 1.1 qui reste la référence dans l’immense majorité des essais thérapeutiques.
grandes cohortes et l’utilisation de mesures bidimensionnelles augmente la variabilité interindividuelle et rend difficile les comparaisons aux études utilisant les critères unidimensionnels RECIST 1.1. De plus, les conditions de « confirmation ou non de la progression » ne sont pas clairement définies (pas de valeur chiffrée d’augmentation de la masse tumorale), et laisse place à une part importante de subjectivité dans l’évaluation.
b. irRECIST
Afin de simplifier les critères irRC qui se sont montrés extrêmement fastidieux pour une utilisation en routine clinique, les critères irRECIST (immune-related RECIST 1.1) ont été proposés en 2013 (10), intégrant à la fois les principes des critères RECIST et d’irRC. Deux études rétrospectives de Nishino et al. (43,44) dans le mélanome métastatique sous ipilimumab ont montré d’une part une grande concordance entre les évaluations radiologiques bidimensionnelle et unidimensionnelle, en diminuant la variabilité interindividuelle et d’autre part que la diminution du nombre de lésions prises comme cible (5 au lieu de 10 comme dans irRC) ne montrait pas de différence significative dans la classification finale de la réponse au traitement.
Ainsi, de la même façon que RECIST 1.1 ces critères sont unidimensionnels, utilisant la somme des plus longs diamètres (SPLD) d’au maximum 5 lésions cibles mesurables (>10mm, 15mm de petit axe pour les ganglions). Et comme les critères irRC, les nouvelles lésions apparues sont ajoutées à la somme des lésions cibles si elles sont mesurables (>10mm, 15mm de petits axes pour les ganglions). Par ailleurs la progression tumorale doit aussi être confirmée par une seconde imagerie réalisée à au moins 4 semaines d’intervalle. En cas de non confirmation, le principe de ‘reset baseline’ est généralement appliqué mais il est à souligner que les critères irRECIST sont plus flous sur ce point et qu’il existe un large
éventail de définitions de ces critères selon les essais thérapeutiques et le laboratoire pharmaceutique.
c. iRECIST
Plus récemment, les critères iRECIST ont été proposés pour l’évaluation radiologique des essais thérapeutiques randomisés d’immunothérapie par le RECIST working group en mars 2017 (11).
Tout comme irRC et irRECIST, l’évaluation tumorale doit être confirmée par un second scanner réalisé à 4 à 8 semaines. Cependant, les nouvelles lésions mesurables ne sont pas ajoutées à la somme des lésions cibles mais évaluées séparément, comme « nouvelle lésion cible » (maximum 5, maximum 2 par organe). De même, on ne modifie pas la date du baseline en cours de traitement. L’autre nouveauté est l’apparition d’une nouvelle catégorie d’évaluation de la réponse tumorale en cas de suspicion de progression sur les lésions cibles, non cibles ou nouvelle(s) lésion(s), notée iUPD (immune Unconfirmed Progressive Disease). Le scanner réalisé 4 à 8 semaines plus tard pourra alors soit confirmer la progression en iCPD (immune Confirmed Progressive Disease) soit l’infirmer dans les cas de pseudo-progression avec des critères clairs de confirmation ou non de progression.
Les auteurs précisent bien que ces critères n’ont pas pour but de définir des recommandations cliniques ou thérapeutiques mais plutôt de standardiser les évaluations afin d’établir des bases de recueils de données homogènes et d’en faciliter les comparaisons. Lorsque les patients sont évalués iUPD ou iCPD (autrement dit progressifs selon RECIST 1.1), la poursuite ou non du traitement dépend de la décision du clinicien, en fonction de l’état clinique du patient.
Ainsi, la définition de la réponse complète, de la réponse partielle et de la stabilité de la maladie est la même selon les 3 critères. La réponse complète est définie par la disparition de toutes lésion cible et non cible (petit axe ganglionnaire < 10mm) sans apparition de nouvelle lésion par rapport à l’examen baseline. La réponse partielle est définie par une diminution d’au moins 30% de la SPLD des lésions cible par rapport au baseline sans progression significative des lésions non cible ni apparition de nouvelle lésion. La maladie est considérée stable par rapport au baseline lorsque ni les critères de réponse partielle ni de progression ne sont remplis, soit une modification de la SPLD des lésions cible comprise entre -30% et +20%, sans progression significative des lésions non cible ni d’apparition de nouvelle lésion.
Cependant la définition de la progression diffère entre les critères. Selon RECIST 1.1, une progression est définie par une augmentation de la SPLD des lésions cibles d’au moins 20% (avec un seuil de significativité de 5mm) par rapport au nadir, et/ou une augmentation non équivoque des lésions non cibles et/ou l’apparition de nouvelle(s) lésion(s).
Selon irRECIST, les nouvelles lésions mesurables sont ajoutées à la somme des lésions cibles. La suspicion de progression, notée irPD, est définie par une augmentation d’au moins 20% de la SPLD des lésions cibles auxquelles ont été ajoutées les nouvelles lésions mesurables, en comparaison du nadir. La progression sera alors confirmée en cas d’augmentation des lésions cibles, des lésions non cibles et/ou ou l’apparition d’autres nouvelles lésions en comparaison du nadir. En cas de non confirmation de progression, le scanner de suspicion de confirmation est considéré comme le nouveau scanner baseline (‘reset baseline’ ).
Selon iRECIST, les nouvelles lésions mesurables ne sont pas ajoutées à la somme des lésions cibles mais évaluées séparément, comme « nouvelle lésion cible », ou « nouvelle
lésions non cible » selon les définitions de RECIST 1.1 de lésions cibles et non cibles. La suspicion de progression notée iUPD est définie par une augmentation de plus de 20% des lésions cibles et/ou la progression non équivoque des lésions non cibles et/ou l’apparition de nouvelle(s) lésion(s). Elle sera confirmée en iCPD si : 1) la somme des lésions cibles ou des nouvelles lésions cibles augmente de plus de 5mm, 2) les lésions non cibles ou les nouvelles lésions non cibles continue de progresser, 3) d’autres nouvelles lésions apparaissent en comparaison du scanner de suspicion de progression. Dans tous les autres cas, la progression n’est pas confirmée : 1) si les lésions qui avaient constitué la suspicion de progression sont inchangées, le statut reste iUPD, 2) si elles ont diminué de taille, le statut doit être réévalué en comparaison du nadir en iSD, iPR ou iCR
PATIENTS ET METHODES
1. Modèle de l’étude et critères d’exclusion
Ce travail est une étude rétrospective monocentrique conduite à Gustave Roussy. Nous avons analysé les données radiologiques des patients suivis pour CBNPC métastatique traités par anti PD-1 ou anti-PDL-1, après échec d’au moins une ligne de chimiothérapie, entre février 2013 et octobre 2016. Les données cliniques et histologiques ont été obtenues à l’aide du dossier médical.
Les critères d’exclusion étaient les patients suivis pour un second cancer, ou recevant une chimiothérapie (dont intrathécale) ou radiothérapie concomitantes. Les patients qui ne disposaient pas de scanner baseline ou de scanner d’évaluation ont également été exclus. Les patients qui ne disposaient pas de scanner de confirmation de progression ont été exclus de notre analyse sauf en cas de décès ou d’arrêt de l’immunothérapie liés à une progression clinique, que nous avons considéré comme une confirmation de progression.
2. Evaluation radiologique
L’ensemble des scanners baseline et d’évaluation des patients traités ont été relus par deux radiologues (un junior et un senior). Au scanner baseline a été calculée la somme des plus longs diamètres (SPLD) d’au maximum 5 lésions cibles mesurant plus de 10mm de grand axe, et 15mm de petit axe pour les lésions ganglionnaires (maximum 2 par organes) selon les critères RECIST 1.1. Le nombre et la localisation des lésions cibles et non cibles étaient également relevés. Le bilan baseline comportait systématiquement une acquisition hélicoïdale sur le crâne, le thorax l’abdomen et le pelvis après injection de produit de contraste iodé. Les résultats de ce scanner ont également été confrontés à la scintigraphie par émission de positions lorsque celle-ci était disponible.
Les scanners d’évaluation étaient réalisés suivant les protocoles d’essais cliniques pour les patients inclus dans des essais thérapeutiques ou selon la pratique clinique de routine (soit environ toutes les 6 semaines) avec une acquisition systématique sur le thorax l’abdomen et le pelvis après injection de produit de contraste iodé. L’imagerie cérébrale n’était pas obligatoire et était réalisée sur point d’appel clinique uniquement. A chaque scanner d’évaluation, ont été relevés la SPLD des lésions cibles, l’évolution des lésions non cibles et l’apparition d’éventuelles nouvelles lésions (avec leur localisation et leur taille) afin de définir la réponse tumorale selon les critères RECIST 1.1, irRECIST et iRECIST.
En cas de discordance entre les 2 lecteurs, une relecture conjointe de réconciliation a été réalisée.
3. Comparaison de l’évaluation tumorale selon RECIST 1.1, irRECIST et iRECIST
Selon les critères irRECIST et iRECIST, la progression doit être confirmée sur un second scanner réalisé 4 à 8 semaines plus tard. Le décès ou l’arrêt de l’immunothérapie pour progression clinique étaient considérés comme une confirmation de la progression. Les principes décrits au chapitre précédent ont été appliqués pour chaque patient qui a présenté au cours de son traitement une progression.
4. Réponses non conventionnelles
La pseudo-progression était définie par la diminution ou la stabilité en taille des lésions après une progression initiale ou encore l’apparition de nouvelle lésion associé à une diminution de la masse tumorale par ailleurs.
La réponse dissociée était définie par la concomitance de lésions augmentant en taille et/ou l’apparition de nouvelle(s) lésion(s) alors que d’autres diminuent.
Un bénéfice clinique pour le patient était défini s’il était capable de recevoir au minimum 6 mois d’immunothérapie, sans détérioration de l’état clinique.
5. Analyse statistique
La survie globale (SG) a été calculée en utilisant la méthode de Kaplan Meier. Les courbes de survie ont été comparées en utilisant le test de log-rank. Les valeurs médianes ont été données avec leur étendue.
RESULTATS
1. Caractéristiques de la population
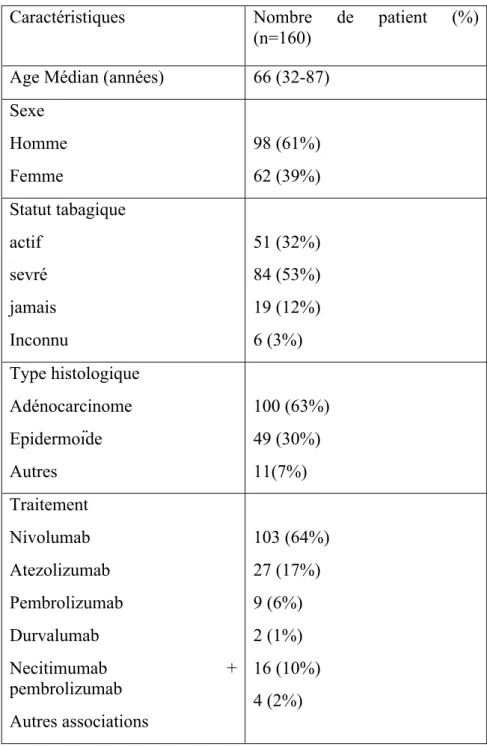
Sur les 182 patients suivis pour CBNPC métastatiques traités par anti-PD1 ou anti-PD-L1 entre février 2013 et octobre 2016, 160 patients ont été analysés. 22 patients ont été exclus de l’analyse : 13 l’ont été pour absence de scanner de confirmation de progression, 2 pour arrêt de l’immunothérapie après suspicion de progression non lié à une progression clinique (un patient pour AVC et un patient pour pneumopathie allergique), 1 patient pour second cancer de la prostate en progression, 3 patients pour chimiothérapie intrathécale ou radiothérapie concomitante et 3 patients pour lésions non évaluables sur le scanner baseline. L’âge médian de la population était de 63 ans, Les types histologiques principaux étaient l’adénocarcinome et le carcinome épidermoïde, respectivement dans 62% et 29% des cas. 80% des patients étaient traités par PD1 (nivolumab, pembrolizumab) et 18% par anti-PD-L1 (atezolizumab, durvalumab). Les caractéristiques de la population étudiée sont résumées dans le tableau 7.
2. Réponse au traitement
La durée médiane du traitement par anti-PD1 ou anti-PD-L1 était de 3,5 mois (0,3 - 43), avec une survie médiane de 11,3 mois (0,7 - 51,2). 29 patients étaient encore sous traitement au moment de l’analyse.
Sur les 160 patients analysés, 37 (23%) étaient en réponse objective : réponse complète (n = 1), réponse partielle (n = 16) ou maladie stable (n = 20) selon RECIST1.1, irRECIST et iRECIST.
Sur ces 37 patients, 1 patient a arrêté le traitement avant 6 mois, pour toxicité (pneumopathie immuno-allergique).
77 patients (48%) ont présenté une progression d’emblée, sur le premier scanner d’évaluation, qui a été confirmée sur le scanner d’évaluation suivant réalisé 4 à 8 semaines après ou par décès lié à une progression clinique (n=25).
26 patients (16%) ont présenté une progression secondaire, dont 21 après stabilité de la maladie, et 5 après réponse partielle.
Le délai médian de progression était de 4,3 mois (0,3- 26,6).
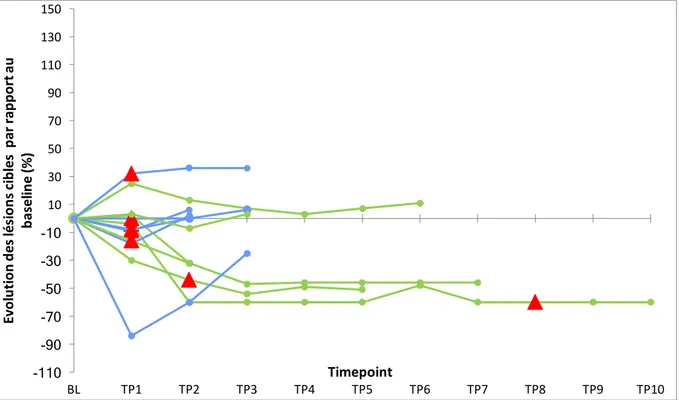
3. Réponses non conventionnelles
Une réponse non conventionnelle a été observée chez 20 (12,5%) patients, comprenant 8 (5%) pseudo-progressions et 12 (7,5%) réponses dissociées (figure 3 et 4). Ces patients ont eu une survie globale médiane statistiquement supérieure à celle des patients en progression confirmée, respectivement de 9.8 mois (3,5 - 33,6) contre 6.1 mois (0,7-51.2), (p < 0,0001,
figure 5). Ces patients présentant une réponse atypique étaient tous jugés progresseurs selon
RECIST 1.1 ; 13 d’entre eux ont pu recevoir au moins 6 mois d’immunothérapie. Ainsi 11% (13 sur 120) des patients jugés progresseurs selon RECIST 1.1 ont finalement eu un bénéfice clinique du traitement.
a. Pseudo-progressions
Le délai médian de pseudo-progression était de 10,2 semaines (2,3 - 84), incluant 2 pseudo-progressions retardées, après 12 semaines. Sept patients étaient traités par anti PD-1 (6 sous nivolumab et 1 sous pembrolizumab), et un par anti PD-L1 (atezolizumab). Sur les 8 pseudo-progressions, tous les patients ont montré un bénéfice clinique, dont un en réponse compète persistante.
Il y avait 2 cas de nouvelles lésions complètement régressives. Les évaluations radiologiques d’une patiente de 72 ans (patient A) traitée par atezolizumab ont montré une stabilité de la
lésion pulmonaire primitive initiale mais une augmentation qualitative de la lymphangite carcinomateuse et de la carcinose péritonéale non cible ainsi que l’apparition de nouvelles métastases pulmonaires à la première évaluation (semaine 6), diminuant de taille sur le scanner d’évaluation suivant et complètement régressives à la semaine 24. Elle est en réponse complète à la semaine 50 de traitement et l’est encore au moment de l’analyse (semaine 136). Chez un patient de 71 ans traité par nivolumab, un nodule pleural solide centimétrique est apparu après 8 semaines de traitement, et était complètement régressif 8 semaines plus tard. Chez un patient de 69 ans (patient B) traité par nivolumab et en amélioration clinique, la SPLD des lésions cibles a augmenté de 133% à la première évaluation (semaine 4) associée à une augmentation significative de la lymphangite carcinomateuse, sans apparition de nouvelle lésion. Au scanner d’évaluation suivant réalisé à 12 semaines, la SPLD des lésions cibles a diminué à -20% avec régression complète de la lymphangite.
Sur les 5 autres pseudo-progressions, 3 patients ont montré une augmentation initiale soit des lésions cibles ou des lésions non cibles, soit l’apparition de nouvelle lésion, suivie d’une stabilité de toutes les lésions sur le scanner suivant. Deux patients ont montré une augmentation initiale des lésions cibles suivie d’une stabilité ou diminution, sans apparition de nouvelle lésion (patient C).
b. Réponses dissociées
Nous avons observé 12 réponses dissociées, dont 6 qui répondaient aux critères de bénéfice clinique. 11 patients étaient traités par anti PD-1 (10 sous nivolumab et 1 sous pembrolizumab), et un par anti PD-L1 (atezolizumab).
Deux patients ont présenté une réponse dissociée surrénalienne. Un patient de 54 ans (patient
D) traité par pembrolizumab a présenté après 7 semaines de traitement une nette diminution
pulmonaire primitive et d'une lésion péritonéale, confirmées sur le scanner d’évaluation à 12 semaines. Une patiente de 60 ans (patient E) traitée par nivolumab a présenté après 13 semaines de traitement une diminution en taille de la lésion surrénalienne contrastant avec l’augmentation de la masse pulmonaire primitive et d’une adénopathie médiastinale. Les autres observations sont une réponse dissociée de deux masses pulmonaires chez le même patient, l’une augmentant de taille et l’autre diminuant ( -40% et +20%) sur les 3 premiers scanners d’évaluation ; une réponse dissociée hépatique avec augmentation significative isolée d’une lésion hépatique tandis que les autres restaient stables chez un autre patient et pour finir une diminution ou stabilité des lésions pulmonaires avec apparition de lésions ganglionnaires augmentant en taille sur les examens consécutifs chez les autres patients.
4. Comparaison de RECIST 1.1, iRECIST et irRECIST à la 1ère suspicion de progression
123 patients ont présenté une suspicion de progression au cours de l'étude. 43 progressions ont été confirmées par le décès du patient ou la décision d’arrêt du traitement lié à une progression tumorale clinique, chez respectivement 30 et 13 patients. Finalement, 80 patients ont pu être évalués radiologiquement selon les critères irRECIST et iRECIST avec un scanner de confirmation de progression. Sur ces 80 patients, 15 évaluations montraient des conclusions discordantes selon irRECIST et iRECIST, mais seulement 3 (3,7%) avec un impact thérapeutique théorique (tableau 8). Ces 3 patients étaient considérés en progression confirmée par irRECIST mais pas par iRECIST (qui les identifiait à nouveau comme iUPD, permettant la poursuite du traitement). Le suivi de ces patients a montré une confirmation de progression à l’évaluation suivante et ils sont tout 3 décédés dans les 6 semaines.
La progression n'a pas été confirmée selon irRECIST et iRECIST chez 17 patients : 9 d'entre eux jugés maladie stable selon irRECIST et en iUPD selon iRECIST ; 3 d'entre eux comme
maladie stable selon irRECIST et iPR selon iRECIST, 5 patients identifiés comme maladie stable selon les 2 critères et 1 patient en réponse partielle selon les 2 critères. Ces 17 patients correspondent à des réponses atypiques :7 répondant à la définition de pseudo-progressions et 10 à une réponse dissociée.
Sur les 60 patients progresseurs confirmés à la fois par irRECIST et iRECIST, 3 patients ont en réalité eu une réponse dissociée, non reconnue par les critères, cela étant lié au choix des lésions cibles sur le scanner baseline.
DISCUSSION
Nous avons effectué une analyse rétrospective des scanners d’évaluation tumorale des patients suivis pour CBNPC métastatique traités par antiPD-1 ou antiPDL-1 afin de décrire les profils de réponses non conventionnelles et de comparer les critères radiologiques RECIST v1.1, irRECIST et iRECIST.
1. Pseudo-progression
La pseudo-progression sous immuno-modulateur est à présent un phénomène connu et documenté, caractérisé par une réponse ou une stabilité après une augmentation initiale de la masse tumorale ou par une diminution de la masse tumorale malgré l'apparition de nouvelles lésions (9). Dans cette étude, 5% (8/160) des patients ont présenté une pseudo-progression, principalement traités avec des anti PD-1. Ce taux est similaire aux données de la littérature dans le CBNPC avancé ou métastatique sous nivolumab ou pembrolizumab. Dans une étude de phase 1 sur le CBNPC avancé sous nivolumab, le taux de pseudo-progression était également de 5% (6/129) (22). Ce phénomène de pseudo-progression est également décrit dans d’autres cancers sous immunomodulateurs. En particulier dans le mélanome, ou le taux semble un peu plus élevé, estimé aux alentours de 10% (entre 6,7 et 12% selon les études) (9,32). D’autres études retrouvaient un taux de 1,5 % (1/ 65) dans les cancers de vessie et de 1,8 % pour les cancers du rein (3 /168) (8). Néanmoins les chiffres rapportés dans la littérature doivent prendre en compte le fait que dans les études, la majorité des patients ne poursuit pas le traitement lors de la première progression RECIST : soit parce que l’état général ne le permet pas, soit parce que la possibilité de poursuivre le traitement malgré la progression n’est pas connue/utilisée. Dans notre étude, à l’inverse, la plupart des patients ont eu la possibilité de poursuivre le traitement pendant les 4 à 8 semaines requises pour réaliser
la nouvelle évaluation scanographique ce qui permet de limiter le nombre de pseudo-progressions « ignorées » par un changement trop précoce de ligne thérapeutique.
2. Réponses dissociées
La réponse dissociée est un autre modèle de réponse non conventionnelle observée dans cette étude, chez 7.5% des patients (12/160). Ce type de réponse suggère un profil de réponse immunitaire différent en fonction des organes. Dans notre étude, les lésions métastatiques surrénaliennes étaient celles qui semblaient mieux répondre à l’immunothérapie. Cela est concordant avec deux études de Nishino et al. dans le CBNPC sous anti-PD1 (45,46), qui démontrent une différence significative dans le taux de réponse et le changement de taille des lésions en fonction du site métastatique. Dans ces études, les lésions surrénaliennes et ganglionnaires sont celles qui répondaient le plus et les lésions hépatiques le moins. Ce type de réponse est peu rapporté dans la littérature mais est probablement sous-estimé car il ne peut souvent pas être détecté par les critères radiologiques s’il n’entraine pas une augmentation significative de la somme des lésions cibles ou si le phénomène implique certaines lésions non cibles (ne permettant pas de juger les modifications « non équivoques »).
3. Critères RECIST 1.1
Dans cette étude, 13 des 120 patients progresseurs selon RECIST 1.1 ont finalement eu un bénéfice clinique du traitement par immunothérapie. Ainsi, les critères RECIST 1.1 ont sous-estimé le bénéfice du traitement par anti PD-1 ou anti PD-L1 chez environ 11% des patients. Ne nécessitant pas de scanner de confirmation, ces critères sont incapables de différencier les pseudo-progressions des vraies progressions. Le risque est alors de sous-estimer l’efficacité du traitement et de conduire à tort à un arrêt trop précoce. Une étude de
Nishino et al comparant les critères RECIST 1.1 et irRECIST1.1 dans le CBPNPC sous
Nivolumab (46) a montré une grande concordance entre les 2 critères, mais il n’y avait aucun cas de pseudo-progressions dans cette étude, ce qui est assez surprenant. Une méta analyse récente de Kazandjian et al (47) a montré que 121 patients sur420 ont continué malgré une progression selon RECIST 1.1, 10 ont finalement présenté une réponse partielle. Basés sur ces observations, il semble licite de proposer une poursuite du traitement par PD1 ou anti-PL1 malgré une progression selon RECIST 1.1 Si l’état clinique du patient le permet.
4. Critères irRECIST et iRECIST
Les critères irRECIST et iRECIST ont été capables de détecter toutes les pseudo-progressions que nous avons identifié dans cette étude rétrospective et la majorité des réponses dissociées (75%). Par ailleurs, la concordance entre ces critères est très élevée (81%), avec seulement 3/80 (3.7%) discordances avec un impact thérapeutique potentiel où l’évaluation selon iRECIST a conduit à une poursuite inutile du traitement. Les autres différences d’évaluation entre les critères étaient principalement liées à l’existence d’une nouvelle catégorie d’évaluation tumorale dans les critères iRECIST, iUPD, qui n’a pas d’équivalent en irRECIST.
La différence principale entre ces 2 critères est l’ajout des nouvelles lésions à la somme des lésions cibles selon irRECIST, pouvant entrainer une perte d’information concernant notamment les différents profils de pseudo-progressions. En effet, l’apparition de nouvelles lésions aura la même traduction finale qu’une augmentation de taille des lésions cibles préexistantes. Par ailleurs le manque de définition claire de confirmation la progression dans les critères irRECIST, d’autant plus qu’ils peuvent différer en fonction des essais thérapeutiques, laisse part à une trop grande subjectivité dans l’évaluation. Ainsi l’utilisation
des critères iRECIST semble plus simple en pratique clinique avec notamment une définition claire des critères de confirmation de progression.
Notre étude présente plusieurs limites : il s’agit d’une étude monocentrique chez des patients dont une partie était issus d’essais thérapeutiques de phase I, qui correspondent à des patients plus sélectionnés sur leur état général que les patients habituels. Bien que s’agissant d’une étude rétrospective, tous les patients consécutifs traités par immunothérapie pour un CBNPC ont été inclus mais le rythme de surveillance scanographique n’est pas homogène et l’imagerie cérébrale n’était pas systématique mais uniquement sur point d’appel clinique. La comparaison des 2 critères actuellement disponibles (irRECIST et iRECIST) n’a porté que sur 80 patients et nécessite une confrontation à de plus larges cohortes de patients et dans d’autres catégories de primitifs.
CONCLUSION
Les patients suivis pour CBNPC métastatique sous immunothérapie présentent fréquemment des réponses non conventionnelles (pseudo-progressions, réponses dissociées), compliquant leur prise en charge. Les critères d’évaluation tumorale classiques RECIST 1.1 ne détectent pas ces nouveaux profils de réponse et sous-estiment le bénéfice du traitement. Les critères d’évaluation tumorale spécifiques de l’immunothérapie tels que irRECIST et iRECIST sont capables de reconnaitre ces réponses non conventionnelles, et montrent une bonne concordance dans leurs conclusions.
BIBLIOGRAPHIE
1. Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69–90.
2. Globocan 2012 v1.0. Disponible sur http://globocan.iarc.fr
3. Brahmer J, Reckamp KL, Baas P et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer. N Engl J Med 2015;373:123-35.
4. Borghaei H, Paz-Ares L, Horn L et al. Nivolumab versus Docetaxel in Advanced Non squamous Non-Small-Cell Lung Cancer. N Engl J Med 2015;22:1627-39.
5. Garon EB, Rizvi N, Hui R. Pembrolizumab for the treatment of non-small cell lung cancer. N Engl J Med 2015;372:2018–2028.
6. Reck M, Rodríguez-Abreu D, Robinson AG. Pembrolizumab versus chemotherapy for PD-L1–positive non–small-cell lung cancer. N Engl J Med 2016;375:1823–1833.
7. Fife, BT, Pauken, KE, Eagar, TN et al. Interactions between PD-1 and PD-L1 promote tolerance by blocking the TCR-induced stop signal. Nat Immunol. 2009;10:1185–1192. 8. Chiou VL, Burotto M. Pseudoprogression and immune-related response in solid tumors. J
Clin Oncol 2015;33:3541–43.
9. Wolchok JD, Hoos A, O'Day S, et al. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. Clin Cancer Res. 2009;15:7412–20.
10. Bohnsack O, Hoos A, Ludajic K. Adaptation of the immune related response criteria: IrRECIST. Ann Oncol 2014;25(suppl 4): iv361-iv372.
11. Seymour L, Bogaerts J, Perrone A. iRECIST : guidelines for response criteria for use in trials testing immunotherapeutics. Lancet Oncol 2017;18:el43–e152.
13. Bui JD, Schreiber RD. Cancer immunosurveillance, immunoediting and inflammation: independent or interdependent pro- cesses? Curr Opin Immunol 2007;19:203–8.
14. Dunn GP, Bruce AT, Ikeda H et al. Cancer immunoediting: from immunosurveillance to tumor escape. Nat Immunol 2002;3:991–998.
15. Yao S, Zhu, Y, Chen L et al. Advances in targeting cell surface signalling molecules for immune modulation. Nat Rev Drug Discov 2013;12:1–17.
16. Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat. Rev Cancer 2012;12 :252–264.
17. Holt GE, Podack ER, and Raez LE. Immunotherapy as a strategy for the treatment of non-small cell lung cancer. Therapy 2011;8:43–54.
18. Hodi FS, O'Day SJ, McDermott DF et al. Improved Survival with Ipilimumab in Patients with Metastatic Melanoma. N Engl J Med 2010:363;711-723.
19. Badoual C, Combe P, Gey A et al. PD-1 and PDL-1 expression in cancer: significance and prognostic value. Med Sci 2013;29: 570–2.
20. Freeman GJ, Long AJ, Iwai Y et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med 2000;192:1027-34.
21. Wang C, Thudium KB, Han M et al. In vitro characterization of the anti-PD-1 antibody nivolumab, BMS-936558, and in vivo toxicology in nonhuman primates. Cancer Immunol Res 2014;2:846–856.
22. Gettinger SN, Horn L, Gandhi L et al. Overall survival and long-term safety of nivolumab (antiprogrammed death 1 antibody, BMS-936558, ONO- 4538) in patients with previously treated advanced non-small-cell lung cancer. J Clin Oncol 2015;33: 2004–2012.
23. Rizvi NA, Mazières J, Planchard D et al. Activity and safety of nivolumab, an anti-PD-1 immune checkpoint inhibitor, for patients with advanced, refractory squamous
non-small-cell lung cancer (CheckMate 063): a phase 2, single-arm trial. Lancet Oncol 2015;16 257-265.
24. Socinski M, Creelan B, Horn L, et al. CheckMate 026: A phase 3 trial of nivolumab vs investigator's choice (IC) of platinum-based doublet chemotherapy (PT-DC) as first-line therapy for stage iv/recurrent programmed death ligand 1 (PD-L1)−positive NSCLC. Ann
Oncol 2016;27: (Supplement 6): vi552–vi587
25. Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016;387:1540-1550.
26. Besse B, Johnson M, Janne P et al. Phase II, single-arm trial (BIRCH) of atezolizumab as first-line or subsequent therapy for locally advanced or metastatic PD-L1-selected non-small cell lung cancer (NSCLC). European Journal of Cancer 2015;51(abstract 16LBA):717-718.
27. Fehrenbacher L, Spira A, Ballinger M et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet 2016;387:1837-46.
28. Massard C, Gordon M, Sharma S et al. Safety and Efficacy of Durvalumab (MEDI4736),
an Anti–Programmed Cell Death Ligand-1 Immune Checkpoint Inhibitor, in Patients With Advanced Urothelial Bladder Cancer. J Clin Oncol 2016;26:3119-3125.
29. Kurra V, Sullivan RJ, Gainor JF, et al. Pseudoprogression in cancer immunotherapy: rates, time course and patient outcomes. Clin Oncol 2016;34: abstr 6580.
30. Hodi FS, Butler M, Oble DA, et al (2008) Immunologic and cli- nical effects of antibody blockade of cytotoxic T lymphocyte- associated antigen 4 in previously vaccinated cancer patients. Proc Natl Acad Sci U S A 2008;105:3005–10.
anti-CTLA-4 monoclonal antibody, in patients with metastatic melanoma unresponsive to prior systemic treatments: Clinical and immunologi- cal evidence from three patient cases. Cancer Immunol Immunother 2009;58:1297- 1306
32. Hodi FS, Sznol M, Kluger HM, et al. Long term survival of ipilimumab-naive patients with advanced melanoma (MEL) treated with nivolumab (anti-PD-1, BMS-936558, ONO-4538) in a phase I trial. J Clin Oncol 2014 (suppl 15s; abstr 9002).
33. Menzies A, HayduL , Carlino M et al. Inter- and Intra-Patient Heterogeneity of Response and Progression to Targeted Therapy in Metastatic Melanoma. PLoS One. 2014; 9(1):e85004.
34. Tagliamonte M, Petrizzo A, Tornesello ML et al. Combinatorial immunotherapy strategies for hepatocellular carcinoma. Curr Opin Immunol. 2016;39:103–13.
35. Kanczkowski W, Sue M, Zacharowski K et al. The role of adrenal gland microenvironment in the HPA axis function and dysfunction during sepsis. Mol Cell Endocrinol. 2015;408:241–8.
36. Schadendorf D, Hodi FS, Robert Cet al. Pooled Analysis of Long-Term Survival Data From Phase II and Phase III Trials of Ipilimumab in Unresectable or Metastatic Melanoma. J Clin Oncol 2015 ;33:1889-94.
37. Champiat S, Dercle L, Ammari S et al. Hyperprogressive Disease Is a New Pattern of Progression in Cancer Patients Treated by Anti-PD-1/PD-L1. Clin Cancer Res. 2017;23:1920-1928.
38. Miller A.B, Hoogstraten B, Staquet M et al. Reporting results of cancer treatment. Cancer 1981; 47:207-214.
39. Therasse P, Arbuck SG, Eisenhauer EA et al. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada J Natl