HAL Id: dumas-01921150
https://dumas.ccsd.cnrs.fr/dumas-01921150
Submitted on 13 Nov 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Évaluation de la pertinence de la prescription des
dispositifs inhalés chez des malades âgés
Mathilde Ollivier
To cite this version:
Mathilde Ollivier. Évaluation de la pertinence de la prescription des dispositifs inhalés chez des malades âgés. Médecine humaine et pathologie. 2018. �dumas-01921150�
UNIVERSITE DE ROUEN
UFR DE MEDECINE ET DE PHARMACIE
Année :
N°
THESE
Pour le DIPLOME D’ETAT DE DOCTEUR EN
MEDECINE
Présentée et soutenue publiquement le 29 octobre 2018
Par
OLLIVIER Mathilde
Né(e) le 30/05/1990 à Mont Saint Aignan
EVALUATION DE LA PERTINENCE DE LA PRESCRIPTION
DES DISPOSITIFS INHALÉS CHEZ DES MALADES AGES
PRESIDENT DU JURY : Monsieur le Professeur P. CHASSAGNE DIRECTEUR DE THESE : Monsieur le Docteur X. GBAGUIDI MEMBRES DU JURY : Madame le Professeur E. MAUVIARD Monsieur le Docteur M. SALAÜN
2
3
4
5
11
Par délibération en date du 3 mars 1967, la faculté a arrêté que les
opinions émises dans les dissertations qui lui seront présentées doivent
être considérées comme propres à leurs auteurs et qu’elle n’entend leur
donner aucune approbation ni improbation.
12
REMERCIEMENTS
A Monsieur le Professeur P. Chassagne,
je vous remercie d’avoir accepté de présider cette thèse.
A Monsieur le Docteur M. Salaün,
je vous remercie d’avoir accepté de juger cette thèse.
A Madame le Professeur E. Mauviard,
je vous remercie d’avoir accepté de juger cette thèse.
A mon directeur de thèse, Monsieur le Docteur X. Gbaguidi,
je te remercie du temps précieux que tu m’as accordé et de tes conseils avisés pour mener à bien ce travail. Je te remercie également de tout ce que tu m’as enseigné depuis l’externat et ce toujours avec rigueur et passion.
A Monsieur le Docteur F. Roca,
je vous remercie d’avoir contribué aux statistiques de cette thèse.
A Antoine,
Merci de m’avoir aidé à l’inclusion et de m’avoir soutenu en cette année difficile, toujours avec le plus grand calme. Merci d’être un collègue et ami fidèle. Je suis très heureuse de continuer à travailler avec toi ces prochaines années.
A mes collègues de gériatrie,
Tout d’abord aux Dr AL. Thiallard, Dr M. Bordage et Dr A. Michel pour m’avoir transmis votre passion pour cette belle spécialité qu’est la gériatrie.
Puis au Dr T. Pesque et Dr P. Suel pour votre bienveillance et votre accueil chaleureux dans votre service.
13
A mes collègues de soins palliatifs/douleur,
merci aux Dr C. Defeuillet et Dr AL. Quesnel pour vos enseignements précieux. Un grand merci Karen Gautier pour le dévouement dont tu as fait preuve en relisant ma thèse et pour nos échanges passionnés sur le cinéma. J’attends la raclette avec impatience.
Merci Gaëlle Soude pour avoir réussi à me faire rire même dans les moments les plus stressants.
Merci Céline Deve, Halima Dembélé et à Delphine pour votre soutient et votre accueil.
Et enfin merci au Dr F. Goy pour son humour légendaire, merci d’avoir toujours eu le mot pour me faire rire.
Au Dr Lambany et au Dr Jeanne qui ont été des formatrices hors paires, qui m’ont tout de suite encouragé dans mes choix professionnels.
A mes parents, merci de votre soutien sans limite, c’est grâce à vous que j’en suis là aujourd’hui, je suis fière d’être votre fille.
A ma sœur, Bertillou tu es toujours présente pour moi quoiqu’il arrive et ce malgré la distance, merci d’être la sœur que tu es.
Au reste de ma famille,
Véronique, Bruno, Lisou, Guillaume, Emma, Arthur, la petite dernière Mona et tante Ben.
A mon autre famille, les Vautier qui m’ont accueilli à bras ouverts dès le début, merci pour votre bienveillance.
A Luc, merci de m’avoir partagé ta passion pour la danse et de m’avoir toujours fait confiance.
14
A Lucie merci pour toute l’aide que tu m’as apporté, j’ai hâte de continuer nos petites sessions à Lille pour d’autres soirées de folies.
A Wafa merci pour ton énergie débordante et ton enthousiasme sans limite.
A Olivia merci pour tous les conseils avisés que tu m’as donnés tout au long de cette année et de ton soutien indéfectible.
A mes amis de toujours,
A Pierre Yves, mon plus vieil ami, merci pour toutes ces années de fous rires à base de thé vert, de Kaamelott et de trivial poursuit.
A Pauline, merci d’être toujours là malgré la grande distance qui nous sépare, pour moi rien n’a changé. Merci pour tous ces moments partagés passés présents et futurs.
A Julien, merci de me connaitre si bien, et de me supporter depuis tant d’années. Merci pour l’ensemble de ton œuvre, change rien.
A Samra, merci pour être là depuis le début de l’externat, pour tous ces fous rires, pour les galères et les bons moments, merci pour tous nos délires passés et futurs.
A tous les autres, Sophie, Juliette, Marine, Paul T, Martin, Tristan, Valentin, Micka, Camille.
Et par-dessus tout merci mille fois à Paul pour ton amour, ton soutien, ta patience, ton humour, ta générosité. Je suis heureuse de partager ma vie avec toi.
15
I. INTRODUCTION 23
A. CARACTERISTIQUE DE LA POPULATION AGEE 23
1. ÉPIDEMIOLOGIE DU VIEILLISSEMENT ET SOINS MEDICAUX 23
2. SYNDROMES GERIATRIQUES 24
B. MALADIES RESPIRATOIRES OBSTRUCTIVES 27
1. BRONCHOPNEUMOPATHIE CHRONIQUE OBSTRUCTIVE 27
2. L’ASTHME 31
C. LES MEDICAMENTS INHALES 33
4. LES CLASSES PHARMACOLOGIQUES 34
2. LA VOIE INHALEE 36
II. OBJECTIFS DE L’ETUDE 51
A. OBJECTIF PRINCIPAL 51
B. OBJECTIFS SECONDAIRES 51
C. CRITERES DE JUGEMENT PRIMAIRE ET SECONDAIRE 51
1. CRITERE DE JUGEMENT PRIMAIRE 51
2. CRITERES SECONDAIRES 52
III. METHODE 53
A. TYPE D’ETUDE 53
B. CRITERES D’INCLUSION 53
C. CRITERES D’EXCLUSION 53
D. CONDITIONS D’EVALUATION DE LA PRISE MEDICAMENTEUSE 54
E. DEROULEMENT DE L’ETUDE 55
F. ERREURS CRITIQUES ET NON CRITIQUES 56
1. ERREURS CRITIQUES 57
2. ERREURS NON CRITIQUES 58
G. PARAMETRES RECUEILLIS 59 1. DONNEES DEMOGRAPHIQUES 59 2. DONNEES DE L’HOSPITALISATION 59 3. COMORBIDITES 59 4. PARAMETRES GERIATRIQUES 59 5. PARAMETRES RESPIRATOIRES 61 IV. STATISTIQUES 63 V. RESULTATS 64 A. CARACTERISTIQUES DE LA POPULATION 64 1. CARACTERISTIQUES DEMOGRAPHIQUES 64 2. COMORBIDITES 64 3. SECTEUR D’HOSPITALISATION 64 4. MOTIF D’HOSPITALISATION 65 B. CARACTERISTIQUES GERIATRIQUES 67 1. STATUT COGNITIF 67 2. DEPENDANCE 67 3. AUTONOMIE 67 4. POLYMEDICAMENTATION 67 5. STATUT NUTRITIONNEL 68 6. DEFICIT SENSORIEL 68 7. FORCE DE PREHENSION 68
16 C. DONNEES PNEUMOLOGIQUES 70 1. DIAGNOSTICS RESPIRATOIRES 70 2. SUIVI PNEUMOLOGIQUE 71 3. ÉDUCATION THERAPEUTIQUE 71
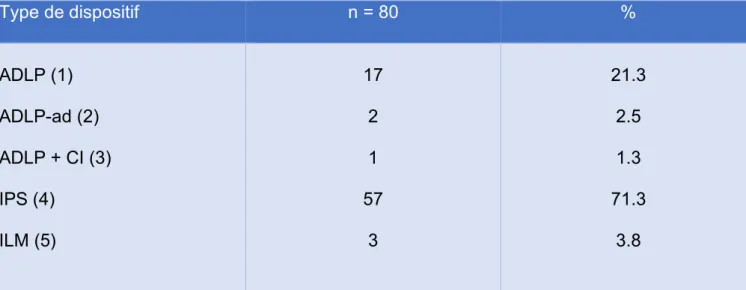
D. DESCRIPTION DES DISPOSITIFS INHALES 74
1. REPARTITION DES CLASSES PHARMACOLOGIQUES 74
2. REPARTITION DES MODELES DE DISPOSITIFS 75
E. DESCRIPTION DES ERREURS DE PRISE DU MEDICAMENT INHALE 77
1. QUALITE TECHNIQUE DES PRISES MEDICAMENTEUSES 77
2. ERREURS CRITIQUES 83
3. COMPARAISON PAR GROUPE 99
VI. DISCUSSION 103
A. QUALITE DE LA PRISE MEDICAMENTEUSE 105
1. QUALITE GLOBALE DE LA PRISE MEDICAMENTEUSE 105
2. QUALITE TECHNIQUE PAR TYPE DE DISPOSITIF ET PHASE D’UTILISATION 106
3. RESULTATS DE L’EVALUATION DE LA QUALITE TECHNIQUE : MISE EN PERSPECTIVE 108
4. DEBIT INSPIRATOIRE 117
5. QUALITE TECHNIQUE : SYNTHESE 121
6. TURBUHALER®,HANDIHALER®,DISKUS® 124
B. DOCUMENTATION DIAGNOSTIQUE 129
C. ÉDUCATION THERAPEUTIQUE 131
D. FACTEURS DES RISQUES DE MAUVAISE QUALITE TECHNIQUE 134 E. DISPOSITIFS D’INHALATION INDIVIDUELS : ASPECTS PRATIQUES 135
VII. LIMITES ET FORCES DE L’ETUDE 137
VIII. CONCLUSION 139
IX. BIBLIOGRAPHIE 141
17
Index des figures et tableaux
Tableau 1 : Classification de la sévérité de l’obstruction bronchique dans la BPCO. Tableau 2 : Critères de contrôle des symptômes de l’asthme.
Tableau 3 : Inventaire des couples molécules / dispositifs d’inhalation disponible en France.
Tableau 4 : Résumé des avantages et inconvénients de chaque catégorie de dispositif.
Tableau 5 : Caractéristiques de la population.
Tableau 6 : Caractéristiques gériatriques de la population. Tableau 7 : Données respiratoires.
Tableau 8 : Répartition des molécules
Tableau 9 : Répartition des dispositifs inhalés selon le mécanisme Tableau 10 : Nombre d’erreurs critiques par patient.
Tableau 11 : Nombre d’erreurs critiques par dispositif. Tableau 12 : Nombre d’erreurs critiques par marque d’IPS. Tableau 13 : Caractéristiques des erreurs critiques : ADLP. Tableau 14 : Caractéristiques des erreurs critiques : IPS.
Tableau 15 : Caractéristiques des erreurs critiques : HANDIHALER®. Tableau 16 : Caractéristiques des erreurs critiques : DISKUS®.
Tableau 17 : Caractéristiques des erreurs critiques : TURBUHALER®. Tableau 18 : Nombre d’erreurs non critiques par dispositif.
Tableau 19 : Nombre d’erreurs non critiques par marque d’IPS. Tableau 20 : Description des erreurs non critiques.
Tableau 21 : Comparaison des patients ne réalisant aucune erreur critique par rapport à ceux réalisant au moins une erreur critique.
18
Tableau 22 : Comparaison des patients ayant un diagnostic validé par rapport à ceux ayant un diagnostic présumé ou un TVO exclu.
19
Figure 1 : Modes de dépôt des particules d’aérosol pénétrant dans les voies respiratoires.
Figure 2 : Relation entre le diamètre des particules d’aérosol, le dépôt au niveau du tractus pulmonaire, les récepteurs et les paramètres fonctionnels respiratoires. Figure 3 : Aérosol doseur de liquide pressurisé.
Figure 4 : Chambre d’inhalation.
Figure 5 : Aérosol doseur auto-déclenché de type AUTOHALER®. Figure 6 : Modèle d’IPS unidose de type AEROLIZER®.
Figure 7 : Inhalateur liquide multidose RESPIMAT®.
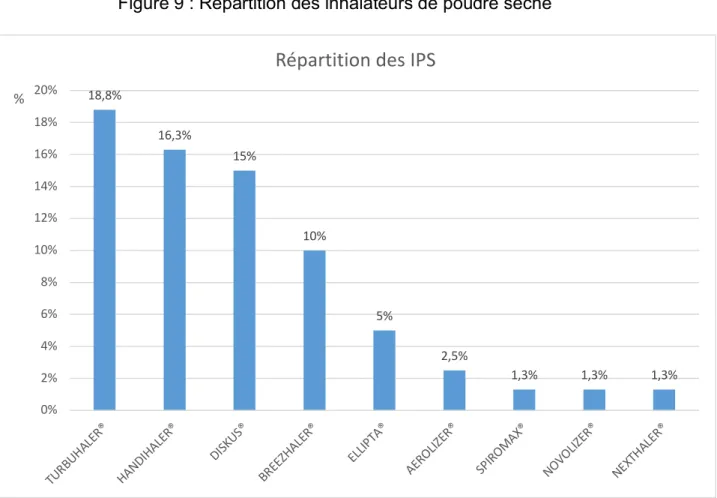
Figure 8 : Répartition des malades selon le diagnostic respiratoire Figure 9 : Répartition des inhalateurs de poudre sèche.
Figure 10 : Répartition des prises médicamenteuses selon leur qualité technique par patient.
Figure 11 : Répartition des prises médicamenteuses selon leur qualité technique par dispositif.
Figure 12 : Répartition des prises médicamenteuses avec ADLP selon leur qualité technique.
Figure 13 : Répartition des prises médicamenteuses avec IPS selon leur qualité technique.
Figure 14 : Répartition des prises médicamenteuses selon la qualité technique pourle HANDIHALER®.
Figure 15 : Répartition des prises médicamenteuses selon la qualité technique pour le DISKUS®.
Figure 16 : Répartition des prises médicamenteuses selon la qualité technique pour le TURBUHALER®.
20
Figure 18 : Catégories des erreurs critiques : IPS.
Figure 19 : Catégories des erreurs critiques : HANDIHALER®. Figure 20 : Catégories des erreurs critiques : DISKUS®.
Figure 21 : Catégories des erreurs critiques : TURBUHALER®. Figure 22 : Nombre d’erreurs non critiques par patient.
Figure 23 : Inhalateurs de poudre sèche disponibles sur le marché français selon les résistances induites par le dispositif.
21
Liste des abréviations
ADL Activities of Daily Living
ADLP Aérosol Doseur de Liquide Pressurisé
ADLP-ad Aérosol Doseur de Liquide Pressurisé auto déclenché ALD Affection Longue Durée
ALT Antileucotriène
AMM Autorisation de Mise sur le Marché AMPc Adénosine Mono-Phosphate cyclique APA Allocation Personnalisée d’Autonomie AVC Accident Vasculaire Cérébral
BD Bronchodilatateur
BDCA Bronchodilatateur de Courte Durée d’Action BDLA Bronchodilatateur de Longue Durée d’Action BNP Brain Natriuretic Peptide
BPCO Broncho Pneumopathie Chronique Obstructive CFC Chlorofluorocarbone
CH Centre Hospitalier
CHU Centre Hospitalier Universitaire
CKD-EPI Chronic Kidney Disease Epidemiology collaboration CPT Capacité Pulmonaire Totale
CSI Cortico Stéroïde Inhalé CV Capacité vitale
22
DLCO Diffusion Libre en Monoxyde de Carbone EFR Exploration fonctionnelle respiratoire FEVG Fraction d’Ejection du Ventricule Gauche
GOLD Global initiative for Chronic Obstructive Lung Disease HAS Haute Autorité de Santé
HFA Hydrofluoroalkane HTA Hypertension Artérielle
HTAP Hypertension Artérielle Pulmonaire IADL Instrumental Activities of Daily Living ILM Inhalateur Liquide Multidose
IMC Indice de Masse Corporelle IPS Inhalateur à Poudre Sèche
MMRC Modified Medical Research Council MMSE Mini Mental State Examination
MTEV Maladie Thrombo-Embolique Veineuse PA Paquet-Année
RGO Reflux Gastro Œsophagien SAU Service d’Accueil et d’Urgence TNC Troubles Neurocognitifs Majeurs TVO Trouble Ventilatoire Obstructif TVR Trouble Ventilatoire Restrictif
23
I.
Introduction
A.
Caractéristique de la population âgée
La population âgée est hétérogène et marquée par les stigmates du vieillissement. Qu’il soit réussi ou non, le vieillissement va être à l’origine de modifications intéressant l’état de santé et la prise en charge des malades. La prise en compte de ces modifications permet d’optimiser les soins proposés et parfois d’en comprendre les limites. L’épidémiologie et la description des principaux syndromes gériatriques expliquent les particularités de la prise en charge de la population âgée dans ce contexte de traitement médicamenteux inhalé.
1. Épidémiologie du vieillissement et soins médicaux
Aujourd’hui en France, les patients de plus de 65 ans représentent 18% de la population et ceux âgés de plus de 75 ans, environ 9% (1).
La population âgée de plus de 60 ans va doubler entre 2000 et 2050 et représentera 23,6 millions de la population française, soit une personne sur trois en 2050 (2). L’espérance de vie, en perpétuelle augmentation, sera de 91,5 ans pour une femme et de 86.3 ans pour un homme en 2060 (2).
Ces données démographiques signifient que la prise en charge des sujets âgés est un enjeu majeur de santé publique. Elle nécessite une réflexion stratégique médicale et socio-économique ; le vieillissement de la population étant associé à une augmentation de la consommation, et donc des coûts liés aux soins médicaux.
La dépense moyenne en soins médicaux des plus de 80 ans est six fois supérieure à celle des 25 – 30 ans. Les plus de 75 ans représentent 8% de la population mais
24
concentrent 20 % des dépenses de soins (3). Les soins hospitaliers constituent le premier secteur de dépense des soins médicaux (4). Dans ce domaine, l’impact démographique est net. En 2009, on estimait à 21 % la part des hospitalisations, (secteurs public et privé) relative à la prise en charge des personnes âgées de 65 à 79 ans et à 15,3 % celle destinée à la prise en charge des sujets âgés de 80 ans et plus (5).
En ce qui concerne les médicaments, en 2000, la dépense pharmaceutique moyenne est d'environ 850 euros par personne âgée de 65 ans et plus. La dépense augmente significativement avec l'âge, passant de 776 euros pour les personnes âgées de 65 à 74 ans, à 971 euros pour les personnes âgées de 75 ans et plus (6). On comprend alors l’importance de stratégies de santé visant à diminuer les hospitalisations et rationnaliser la prescription médicamenteuse. Le thème des médicaments inhalés dans le contexte des maladies respiratoires obstructives semble en être une bonne illustration. En effet, les maladies respiratoires hors tumeurs et pneumonies représentent environ 6% des causes de décès chez les plus de 75 ans (7).
2. Syndromes gériatriques
Un syndrome gériatrique est une situation de santé :
- dont la fréquence est plus élevée avec l’âge ou présente exclusivement chez le sujet âgé,
- qui résulte de facteurs multiples,
- à risque de morbidité accrue, de dépendance, décès ou d’hébergement institutionnel,
25
Ces syndromes gériatriques doivent permettre de définir, comprendre et prendre en charge la santé d’un individu âgé présentant une problématique gériatrique. Ils peuvent pourtant interférer significativement avec une stratégie de soins non gériatrique comme par exemple l’usage des médicaments inhalés. Nous évoquerons donc principalement les problématiques suivantes :
- Altération cognitive, - Autonomie,
- Dépendance,
- Troubles sensoriels visuels ou auditifs
a) Troubles cognitifs
Parmi les syndromes démentiels, la maladie d’Alzheimer est le plus connu et le plus fréquent. On estime à 900 000 le nombre de personnes atteintes avec une perspective de 1,3 millions de malades en 2020 (8). Le pic diagnostic se situe à 80 ans où elle représente alors 15 % de la population. Il est nécessaire d’intégrer à ces chiffres que presque 50 % des syndromes démentiels ne sont pas diagnostiqués, ou alors avec un retard estimé dans la littérature à près de 2 ans. Au stade précoce de la maladie, seul un tiers des malades seraient identifiés formellement (9).
L’altération cognitive peut logiquement interférer sur la prise médicamenteuse en termes d’observance mais également sur la compréhension des objectifs thérapeutiques et la capacité de prise médicamenteuse.
26
b) Dépendance, autonomie et déficit sensoriel
La dépendance se définit comme l’incapacité (partielle ou totale) pour une personne de réaliser sans aide humaine les gestes de la vie quotidienne. Elle touche 1,4 millions de personnes de plus de 65 ans (10). L’autonomie, quant à elle, se définit par la capacité à se gouverner soi-même, à savoir la capacité de prévoir, de choisir, ainsi que la liberté de pouvoir agir, accepter ou refuser en fonction de son jugement. Une altération de l’autonomie peut entraîner une difficulté dans les actes complexes du quotidien (gestion des médicaments, de l’argent, des courses, des repas).
A titre d’exemple, dans une population communautaire normande de 80 ans d’âge moyen, la dépendance évaluée par l’échelle ADL était de 25 %. La perte d’autonomie, quant à elle, atteignait 21,6% selon l’échelle IADL (11).
Lorsqu’il s’agit d’une population de malades hospitalisés d’âge moyen de 86 ans, la prévalence de la dépendance était alors de 28% et de 75 % pour la perte d’autonomie. Dans ce contexte, un tiers des patients bénéficiait à domicile d’une aide à la préparation et à l’administration médicamenteuse (12).
L’enquête Vie Quotidienne et Santé dédiée aux séniors réalisée en 2014 (13) offre un éclairage intéressant sur certaines caractéristiques de la population âgée. Lorsqu’on s’intéresse aux individus de plus de 75 ans, cette enquête révèle les éléments suivants :
- Difficultés visuelles malgré l’usage éventuel de lunettes : 36 % des individus - Déficit auditif malgré un appareillage éventuel : 49 %
- Difficulté à réaliser des gestes fins comme saisir un crayon ou utiliser des ciseaux : 26 %
- Difficulté pour lever les bras : 38 % - Besoin d’une aide pour se laver : 20 %
27
Ainsi, à partir de 75 ans, 2 à 4 individus sur 10 présentent une problématique de dépendance, de perte d’autonomie ou de déficit sensoriel.
B.
Maladies respiratoires obstructives
Les problèmes liés à l’appareil respiratoire constituent le quatrième motif d’hospitalisation en France des patients âgés de plus de 80 ans (14). La prévalence des maladies chroniques respiratoires chez les plus de 65 ans les situent à la troisième place après les maladies cardio-vasculaires et les tumeurs (15).
1. Bronchopneumopathie chronique obstructive
a) Épidémiologie
Dans une étude réalisée au CHU de Rouen chez des patients de plus de 70 ans hospitalisés dans un service de médecine gériatrique ou en chirurgie orthopédique, la prévalence de la BPCO était de 10 à 15 % (16)(17).
La prévalence exacte de la BPCO est difficile à établir dans la mesure où obtenir les données spirométriques définissant cette pathologie n’est pas aisé. Elle est malgré tout estimée à 7,5 % des plus de 45 ans dans une étude avec paramètres spirométriques chez des individus d’âge moyen de 60 ans (18). Dans une autre étude plus récente, la présence d’un trouble obstructif est estimée entre 9,9 et 16 % (19).
Le coût direct de la BPCO est estimé à 3,5 milliards d’euros par an, soit 3,5% de l’ensemble des dépenses de santé (20), réparties de la façon suivante : 60% pour les
28
exacerbations et 40% pour le suivi au long cours de la pathologie. Le coût moyen de prise en charge d’une BPCO est estimé à 4000 euros par malade et par an.
b) Caractéristiques cliniques, physiopathologie
La BPCO est une maladie inflammatoire chronique des voies aériennes. Cette inflammation conduit à un épaississement des parois bronchiques, et à une hypersécrétion réactionnelle de mucus, responsable d’une obstruction progressive et non réversible des voies aériennes. A terme, elle provoque une destruction alvéolaire (emphysème). La BPCO se définit comme un trouble ventilatoire obstructif non réversible après prise de bronchodilatateur. Le principal facteur de risque est le tabagisme.
Les principaux symptômes sont la dyspnée, la toux chronique, les expectorations. L’évolution est marquée par des exacerbations, correspondant à une majoration aiguë des symptômes respiratoires durant plus de 48 h, pouvant aller jusqu’à l’hospitalisation, ou du moins justifiant une modification thérapeutique.
29
c) Diagnostic (21)
Le diagnostic de la BPCO, au-delà d’un tableau clinique évocateur, se fait grâce à une épreuve d’exploration fonctionnelle respiratoire : la spirométrie. Cet examen explore les volumes pulmonaires mobilisables. La spirométrie mesure le volume expiratoire maximum au cours de la première seconde (VEMS) lors d’une expiration forcée et la capacité vitale (CV). La BPCO se définit par un trouble ventilatoire obstructif (TVO), se traduisant par un VEMS / CV inférieur à 0,7 ou 70%. Ce trouble obstructif ainsi défini est non réversible, autrement dit persiste, après un test pharmacologique aux bronchodilatateurs ou aux corticoïdes.
La réversibilité peut être étudiée en comparant les valeurs du VEMS obtenu lors d’une spirométrie avant et quinze minutes après administration d’un bronchodilatateur d’action rapide. Dans la BPCO elle est inchangée, ou seulement de façon non significative. Le rapport VEMS/CV reste donc inférieur à 70%, 15 minutes après l’administration de bronchodilatateur de courte durée d’action. On parle alors de TVO persistant.
d) Stade et sévérité
La sévérité de la BPCO peut être classée en fonction de la sévérité de l’obstruction bronchique ou de l’intensité des symptômes. La sévérité de l’obstruction conduit à une classification en 4 stades. Ils sont résumés dans le tableau 1. L’intensité des symptômes à travers l’évaluation de la dyspnée se résume dans une échelle en 4 stades (annexe 12). Enfin, la sévérité peut résulter d’une combinaison du degré d’obstruction et des symptômes en tenant compte notamment des exacerbations, (annexe 12).
30
Tableau 1 : Classification de la sévérité de l’obstruction bronchique dans la BPCO. (21)
Sévérité́ de l’obstruction bronchique Définition (% de la valeur prédite) grade GOLD 1 légère VEMS ≥ 80 grade GOLD 2 modérée VEMS 50 - 80 grade GOLD 3 sévère VEMS 30 - 49 grade GOLD 4 très sévère VEMS < 30 e) Traitement
Les objectifs du traitement pharmacologique de la BPCO sont : - contrôle des symptômes,
- réduction de la fréquence et de la sévérité des exacerbations, - amélioration de la qualité de vie
- amélioration de la tolérance à l’exercice.
Le traitement médicamenteux de la BPCO fait appel à des médicaments bronchodilatateurs et / ou corticoïdes par voie inhalée en fonction de la dyspnée et des exacerbations et non par le degré d’obstruction (annexe 12).
31
2. L’asthme
a) Épidémiologie
L’asthme est une maladie respiratoire chronique dont la prévalence en France est estimée entre 5 et 7 % tout âge confondu (15).
La morbidité liée à l’asthme est en augmentation régulière et le coût global de la maladie est de 1,5 milliards d’euros par an, majoritairement lié aux hospitalisations, aux soins d’urgences et au retentissement social (22).
La prévalence chez les patients de plus de 65 ans est estimée entre 4 et 8 % (23). L’asthme s’exprime souvent avant l’âge de 40 ans avec un pic d’incidence dans l’enfance. Il peut cependant être diagnostiqué à tous âges. Les patients présentant un asthme à début tardif (au-delà de 65 ans) ont une morbi-mortalité plus importante et des hospitalisations plus fréquentes que les patients présentant un asthme avant l’âge de 40 ans (24).
b) Caractéristiques cliniques, physiopathologie
L’asthme est une maladie inflammatoire chronique des bronches réalisant une obstruction bronchique réversible, en partie ou en totalité responsable de symptômes respiratoires paroxystiques.
L’inflammation de l’épithélium bronchique provoque :
- Une contraction musculaire lisse (bronchoconstriction, hyper réactivité bronchique)
- Un œdème des parois
- Une hypersécrétion de mucus
32
bronchique.
L’expression clinique se réalise sous forme d’épisodes dyspnéiques associant toux, expectoration et sibilants. Entre deux épisodes, la respiration est normale et constitue le caractère paroxystique de la maladie.
c) Diagnostic
Le diagnostic de l’asthme repose sur l’association d'un tableau clinique évocateur (dyspnée paroxystique, sibilants, oppression thoracique, toux expectorations) et d’une obstruction bronchique variable. La spirométrie participe ainsi volontiers au diagnostic. Elle permet de mettre en évidence un trouble ventilatoire obstructif. Il se définit comme pour la BPCO par un rapport VEMS / CV inférieur à 0,7. En revanche, contrairement à la BPCO, ce trouble obstructif est réversible et se traduit lors d’un test de réversibilité par une augmentation du VEMS de plus de 200 ml par rapport à la valeur initiale et de plus de 12 % de la valeur initiale. Cette réversibilité est définie comme complète si l’on observe une normalisation du rapport VEMS/CV (supérieur à sa valeur seuil de 70 %) et du VEMS (supérieur à 80% de la valeur prédite) (22).
d) Stade et sévérité
La sévérité et le stade de l’asthme se définissent rétrospectivement en fonction de l’intensité du traitement nécessaire pour obtenir le contrôle de l’asthme. Les critères cliniques de contrôle de l’asthme sont résumés dans le tableau 2. Les stades de l’asthme sont disponibles en annexe 13
33
Tableau 2 : Critères de contrôle des symptômes de l’asthme. (22) Symptômes bien contrôlés Symptômes partiellement contrôlés Symptômes non contrôlés Symptômes diurnes > 2/semaine
aucun item 1 à 2 items positifs 3 à 4 items positifs Tout réveil nocturne lié à
l’asthme Prise de BDCA >
2/semaine
Toute limitation d’activité́ liée à l’asthme
e) Traitement
Le traitement de l’asthme repose principalement sur le contrôle de l’inflammation. Il va donc faire logiquement appel à des corticoïdes inhalés de façon précoce, ainsi qu’à des bronchodilatateurs. Ces derniers seront de courte durée d’action pour la gestion des crises et de longue durée d’action en prévention de la récidive.
Si l’asthme est contrôlé pendant au moins 3 mois, le même traitement de fond doit être poursuivi. Si l’asthme n’est pas contrôlé, le traitement de fond doit être majoré selon les paliers définis (annexe 14).
C.
Les médicaments inhalés
L’asthme et la BPCO affectent sept millions de personnes en France, engendrant 5,5 milliards d’euros de dépenses dont quasiment la moitié est dédiée aux traitements au long cours (25). Parmi les 10 premiers médicaments délivrés en France, en nombre ou en valeur, se trouvent deux spécialités médicamenteuses inhalées indiquées dans le traitement des bronchopathies obstructives (26).
Le traitement de ces maladies chroniques respiratoires est basé principalement sur des médicaments inhalés.
34
4. Les classes pharmacologiques
Il existe deux types d’actions pharmacologiques : l’effet bronchodilatateur et celui à visée antiinflammatoire. L’effet bronchodilatateur peut être obtenu par des molécules à action béta deux mimétique ou anticholinergique. Les médicaments à effet bronchodilatateur se répartissent en bronchodilatateurs de courte et de longue durée d’action.
L’effet antiinflammatoire est obtenu, quant à lui, par des glucocorticoïdes.
a) Bronchodilatateurs
1) Beta deux mimétiques
Les molécules aux propriétés Beta deux mimétiques se lient à des récepteurs β2 de
localisation bronchique. La fixation à ces récepteurs provoque la relaxation du muscle lisse bronchique et donc la bronchodilatation par l’intermédiaire d’une cascade de réactions de phosphorylation intracellulaire.
(a) β2 mimétiques de courte durée d’action
La fixation des molécules à action béta deux mimétique de courte durée d’action (Salbutamol, Terbutaline) sur leurs récepteurs bronchiques induit en moins d’une minute un effet bronchodilatateur qui va se prolonger 4 à 6 heures (27).
35
(b) β2 mimétiques de longue durée d’action
Les β2 agonistes de longue durée d’action (Salmétérol, Formotérol), se dissolvent
dans les lipides de la membrane cellulaire pour atteindre le récepteur β2 adrénergique où ils se fixent, exerçant une bronchodilatation prolongée d’environ
12 heures.
2) Anticholinergique
Ils bloquent de façon non compétitive les récepteurs cholinergiques des muscles lisses de la paroi bronchique entraînant ainsi une bronchodilatation. Ils sont de deux types :
- les anticholinergiques de courte durée d’action (Ipratioprum) dont l’effet bronchodilatateur est de l’ordre de huit heures
- les anticholinergiques de longue durée d’action (Tiotropium) générant un effet bronchodilatateur de près de 24 heures.
b) Glucocorticoïdes
Les glucocorticoïdes inhalés (Fluticasone, Budesonide) ont une action anti inflammatoire bronchique qui agissent sur les cellules impliquées dans des phénomènes immuno-inflammatoires bronchiques.
36
2. La voie inhalée
Les recommandations nationales et internationales proposent préférentiellement la voie respiratoire comme voie d’administration des médicaments de l’asthme ou de la bronchite chronique obstructive.
Cette voie comporte des avantages certains par rapport à la voie systémique. Elle permet à un médicament sous forme d’aérosol d’agir directement sur sa cible (bronches et alvéoles) et d’obtenir une concentration importante de principe actif au niveau bronchique. L’absorption du médicament est immédiate et se fait sur une grande surface. L’effet et la réponse clinique sont rapides tout en limitant les effets indésirables systémiques. Ainsi les bronchodilatateurs de courte durée d’action de type béta deux mimétiques ou atropiniques vont avoir un effet plus rapide et puissant. Les bronchodilatateurs de longue durée d’action verront, quant à eux, leur durée d’action augmenter par rapport à une prise orale (28).
En résumé, la voie inhalée offre : - une action rapide,
- des doses nécessaires plus faibles, - moins d’effets systémiques.
a) Principes de fonctionnement
La voie inhalée reste une voie d’administration indiscutablement efficace mais complexe à maîtriser et qui se révèle particulièrement technique notamment en termes de galénique. Fondamentalement la voie inhalée implique :
- qu’un principe actif soit produit sous forme d’aérosol
- que la taille des gouttelettes d’aérosol corresponde au calibre des cibles bronchiques distales
37
- que les gouttelettes d’aérosol soient transportées jusqu’à la cible en limitant leur dépôt sur les muqueuses oro-pharyngées et respiratoires proximales
- le dépôt par sédimentation des gouttelettes d’aérosol sur les surfaces cible (apnée)
Figure 1 : Modes de dépôt des particules d’aérosol pénétrant dans les voies respiratoires (29).
Ces différentes conditions nécessaires à l’efficacité d’un médicament pris par voie inhalée vont dépendre et être potentiellement affectés par plusieurs facteurs.
Le dispositif générant l’aérosol doit être en mesure de produire des gouttelettes d’une taille adéquate et en quantité suffisante pour que la cible respiratoire distale soit atteinte malgré les dépôts dans le dispositif, les muqueuses oro-pharyngées et respiratoires proximales. La fraction de médicament atteignant sa cible bronchique ne représentent au mieux que 10 à 50% de la dose initiale (30)(31).
38
Le cheminement du médicament sous forme d’aérosol jusqu’à sa cible dépend du débit inspiratoire qui doit être adapté pour permettre au médicament d’atteindre les bronches distales en limitant les dépôts sur des muqueuses proximales. Ce débit inspiratoire dépend uniquement du patient. Il va impliquer la technique d’utilisation du dispositif d’inhalation, mais également la sévérité de la maladie respiratoire et le degré d’obstruction.
La quantité de dépôt de l’aérosol sur des muqueuses non cibles et donc sans effet clinique va dépendre de la configuration anatomique oro-pharyngée, de l’utilisation mais aussi des sécrétions des voies aériennes.
Enfin, le dépôt par sédimentation du médicament sur les muqueuses bronchiques cibles nécessite l’interruption du flux d’air dans les voies respiratoires, autrement dit une apnée. Cette étape est importante pour la bonne action médicamenteuse et constitue un point essentiel de l’utilisation de l’administration médicamenteuse par voie inhalée à visée bronchique.
En résumé, l’efficacité de la voie inhalée dépend de plusieurs facteurs liés : - Au dispositif générant l’aérosol
- Au patient (technique d’utilisation du dispositif, débit inspiratoire, durée de l’apnée)
- À la maladie respiratoire obstructive chronique (sévérité de l’obstruction bronchique, sécrétions bronchiques)
Ces caractéristiques participant à l’efficience de la voie inhalée permettent de comprendre les problématiques techniques liées à cette voie.
En effet, pour qu’une quantité de produit suffisante atteigne la cible, il ne doit pas se déposer entièrement sur les muqueuses buccales, pharyngées ou des voies
39
respiratoires proximales et la taille des molécules doit être adaptée au calibre des voies aériennes ciblées.
b) Taille gouttelettes et dépôt bronchique (32)(28)
Nous avons décrit plusieurs facteurs intervenant dans l’efficacité des médicaments par voie inhalée. Ils peuvent être liés au patient, au dispositif, à la maladie respiratoire ou à la qualité de l’aérosol. Parmi les facteurs liés à l’aérosol lui-même, le diamètre des particules d’aérosol est le déterminant majeur influençant le dépôt bronchique. On rappelle que le principe de la voie inhalée est de transporter un médicament sous forme d’aérosol par la voie aérienne de la bouche jusqu’aux bronches distales en empruntant le tractus oro-pharyngé, le larynx, puis les bronches proximales avant d’atteindre le réseau bronchique distal. Sur ce trajet, les particules d’aérosol vont d’abord se déposer dans la cavité buccale par impaction. Ce dépôt sera d’autant plus important que l’inspiration est brutale et de fort débit. Ce peut être le cas de l’inhalation à travers des dispositifs offrant une forte résistance intrinsèque comme certains dispositifs d’inhalation de poudre sèche. Il sera également plus important plus le jet généré par un aérosol doseur est rapide. Si la taille des particules d’aérosol est supérieure à 5 µm, alors, le dépôt sera quasiment entièrement buccal et le médicament dégluti (33).
Les particules inférieures à 5 µm sont, elles, capables d’atteindre les bronches en suivant le flux d’air généré par la respiration. Ainsi, plus la fraction de particule inférieure à 5 µm (appelé fraction ou dose de particule fine) générée par le dispositif est importante, plus grande est la probabilité d’atteindre la cible bronchique. Plus les particules seront de faible diamètre (0,5 à 2 µm), plus elles auront la capacité d’atteindre la zone alvéolaire. Plus les zones pulmonaires atteintes sont distales, plus le dépôt de particules se fait par sédimentation et non par impaction sur la
40
muqueuse. Cet élément défend la nécessité d’une apnée pour permettre le dépôt, et donc l’action médicamenteuse. Les particules non sédimentées sont exhalées lors de l’expiration. D’une façon générale, le mécanisme d’impaction et de sédimentation explique pourquoi la prise médicamenteuse par voie inhalée nécessite :
- une expiration profonde préalable - un débit inspiratoire adapté
- une inspiration régulière profonde - une apnée à la fin de l’inspiration
Ces différents éléments constituent les principales problématiques et erreurs concernant l’utilisation des dispositifs inhalés.
Ces éléments expliquent également pourquoi à chaque type de dispositif correspond un débit inspiratoire idéal pour limiter l’impaction bucco-pharyngée et favoriser la déposition distale. Les aérosols doseurs vont, en effet, nécessiter une inspiration lente prolongée à faible débit tandis que les dispositifs à poudre sèche justifient d’un débit inspiratoire fort brutal et profond pour lutter contre la résistance du dispositif, et surtout générer les particules fines (< 5µm)
41
Figure 2 : Relation entre le diamètre des particules d’aérosol, le dépôt au niveau du tractus pulmonaire, les récepteurs et les paramètres fonctionnels respiratoires. (34)
β2 : Récepteurs β2 adrénergiques , M : Récepteurs muscariniques , GR : Récepteurs des glucocorticoïdes
c) Types de dispositifs
Il existe un nombre très important de spécialités et de dispositifs d’inhalation différents permettant d’administrer des médicaments béta deux mimétiques, atropiniques ou corticoïdes utilisés dans l’asthme et la BPCO. En pratique ces dispositifs vont délivrer le principe actif sous forme d’aérosol ou de poudre. Les différents dispositifs existants sont considérés comme équivalents sur le plan thérapeutique (35)(36). Ils ont néanmoins des caractéristiques techniques différentes qui présentent des avantages ou des inconvénients vis à vis du profil de malade les utilisant (enfants, sujets âgés).
Paramètres fonctionnels respiratoires Tailles des particules inhalées Dépôts pulmonaires Recepteurs localisation et densité
42
1) Aérosols doseurs de liquide pressurisé (ADLP)
Introduit en 1950, ce fut la première forme de dispositif inhalé mis sur le marché. C’est aussi le type de dispositif le plus utilisé à travers le monde.
Ce dispositif se compose d’un réservoir en métal qui se glisse dans un manchon plastique disposant d’un embout buccal pour l’inhalation. Le réservoir métallique contient :
- Le principe actif (béta deux mimétique, anticholinergique ou corticoïde) dissous ou dispersé dans un excipient sous forme liquide.
- Un gaz propulseur de type hydrofluoroalkane sous pression.
L’aérosol est généré par pression sur le récipient métallique mettant alors en action une valve doseuse de pulvérisation.
Leur conception implique la coexistence à l’intérieur du dispositif du gaz propulseur et du principe actif. L’agitation du dispositif avant usage est un élément essentiel du bon usage puisqu’il garantit la reproductibilité des doses en assurant le mélange des deux composants qui, sans cela, resteraient séparés en deux phases.
Les aérosols doseurs sont déclenchés par le patient et nécessitent une inspiration adaptée mais surtout coordonnée au déclenchement (coordination main – bouche) sous peine d’une déposition buccale ou proximale importante ou d’une réduction significative de la dose inhalée.
43
Figure 3 : Aérosol doseur de liquide pressurisé.
Pour remédier à cette problématique majeure, deux options existent : - l’utilisation d’une chambre d’inhalation
- le développement d’aérosols doseurs auto déclenchés (ADLP-ad)
La chambre d’inhalation correspond à un réservoir en plastique disposant à une extrémité d’un logement pour insérer l’embout buccal de l’aérosol doseur, et à l’autre d’un embout buccal ou d’un masque. Elle permet de dissocier le déclenchement de l’inhalation (pour lequel la bonne coordination main-bouche est nécessaire) en concentrant dans la chambre l’aérosol pulvérisé qui reste en suspension et sera inhalé secondairement par une respiration normale. La chambre d’inhalation n’est compatible qu’avec les ADLP non auto-déclenchés.
44
Figure 4 : chambre d’inhalation.
Les aérosols doseurs de seconde génération sont dit auto-déclenchés (exemple : Autohaler®). Il s’agit d’un dispositif semblable aux ADLP mais conçu pour que l’inhalation assure automatiquement le déclenchement. Ces ADLP-ad ne requièrent donc pas de coordination main bouche. Le débit inspiratoire nécessaire au déclenchement est, quant à lui, relativement faible et accessible à de nombreux patients (30).
45
2) Les inhalateurs de poudre sèche (IPS)
Ce type de dispositif ne contient pas de gaz propulseur. Ce sont les forces générées par l’inspiration du patient au travers du dispositif depuis son embout, qui vont permettre la mobilisation et la désagrégation de la poudre sèche. La résistance à l’inhalation du dispositif participe à la création des forces nécessaires à la désagrégation de la poudre et à la création des particules fines capable d’atteindre les zones cibles. Ces dispositifs nécessitent un débit inspiratoire minimal (et généralement supérieur à celui nécessaire pour des ADLP ou les ADLP-ad) au-dessous duquel l’effet thérapeutique est réduit, voire inexistant. Selon la résistance induite par le dispositif, le flux inspiratoire requis va varier de moins de 50 L/min pour les plus fortes résistances à plus de 90 L/min pour les plus faibles (39).
Ce débit doit également être régulier et maintenu suffisamment pour éviter le dépôt excessif proximal de poudre. Plus le débit d’inhalation est fort et plus la désagrégation de la poudre qui se fait dans le dispositif sera efficace générant une fraction plus importante de particules fines. En cas d’inhalation partielle de la poudre, il est toujours possible de répéter la phase d’inhalation, sous réserve que l’utilisateur vérifie la présence de résidus éventuels, et s’il s’agit d’un dispositif utilisant de la poudre stockée dans une capsule. Certains modèles disposent de mécanisme d’assistance électrique limitant l’effort inspiratoire nécessaire.
Ces dispositifs, en revanche, offrent l’avantage de ne pas nécessiter de coordination main – bouche car ils sont de fait déclenchés par la respiration.
Tous les modèles de cette catégorie ont cependant en commun la mise à disposition d’une dose de poudre sèche à inhaler. Souffler dans le dispositif ou le tenir d’une façon inappropriée est un risque de dispersion du principe actif avant inhalation et constitue des erreurs potentielles lors de l’utilisation.
46
Le conditionnement de la poudre pour inhalation peut varier selon le modèle d’IPS et peut-être de type uni dose ou multi dose. Les dispositifs uni doses nécessitent de recharger le dispositif avant chaque utilisation, les doses unitaires se présentent sous forme de gélules dont le contenu est libéré par perçage au moment de l’armement du dispositif.
Les dispositifs multi doses comportent, soit un réservoir de poudre à partir duquel une quantité déterminée est prélevée par un mécanisme doseur lors de chaque inhalation, soit un nombre défini de doses unitaires dans les capsules d’un blister ; chaque dose est délivrée du blister lors de l’armement du dispositif avant chaque inhalation.
Figure 6 : Modèle d’IPS unidose de type AEROLIZER®.
47
3) Les brumisateurs RESPIMAT® inhalateur liquide multidose (ILM)
Introduit en 2007, ce dispositif n’est pas pressurisé. L’aérosol est généré à partir d’une solution stockée dans une cartouche. L’énergie nécessaire à l’aérosolisation est produite par un ressort qui force le passage de la solution au travers de buses étroites gérée par puce électronique provoquant ainsi la formation de jets très fins venant se percuter pour produire l’aérosol de médicament. La fraction de particules fines, et donc la délivrance pulmonaire, est plus importante allant jusqu’à 50 % (40)(41)(42).
Il ne requiert ni un débit inspiratoire minimum de déclenchement, ni une coordination main poumon. Il nécessite cependant une inspiration un minimum coordonnée à l’émission d’aérosol et une bonne occlusion des lèvres sur l’embout buccal sous peine de perte de produit. Il doit être activé manuellement.
Figure 7 : Inhalateur liquide multidose RESPIMAT®.
48
Tableau 3 : Inventaire des couples molécules / dispositifs d’inhalation disponible en France. (29) dispositifs molécules Classe pharmacologique Aérosol doseur de liquide pressurisé Aérosol doseur de liquide pressurisé autodéclenché Inhalateur à poudre sèche Inhalateur liquide multidose Bronchodilatateurs anticholinergiques de courte durée d’action Ipratioprum ATROVENT® Bronchodilatateurs anticholinergiques de longue durée d’action Tiotropium SPIRIVA® HANDIHALER® SPIRIVA® RESPIMAT® Bronchodilatateur béta2+ de courte durée d’action Terbutaline Salbutamol BRICANYL® VENTOLINE® AIROMIR® AUTOHALER® BRICANYL® TURBUHALER® Bronchodilatateur béta2+ de longue durée d’action Formotérol Salmétérol FORMOAIR® FORADIL® SEREVENT® FORADIL® AEROLISER® EASYHALER® NOVOLISER® TURBUHALER® DISKUS® DISKHALER® Corticoïdes Béclométasone Budésonide Fluticasone QVAR® BECOTIDE® PULMICORT® FLIXOTIDE® AUTOHALER® QVAR® DISKUS® EASYHALER® NOVOLIZER® AEROLIZER® NOVOLIZER® EASYHALER® SPIROMAX® TURBUHALER® DISKHALER® DISKUS® Associations fixes Béclométasone / Formoterol Fluticasone / Salmétérol Béclométasone / Formotérol Fluticasone / Vilastérol Indacatérol / Glycopyrronium Budésonide / Formotérol INNOVAIR® SERETIDE® FORMODUAL® SERETIDE® DISKUS® RELVAR® / ELLIPTA® ULTIBRO® / BREEZHALER® SYMBICORT® TURBUHALER® DUORESP® SPIROMAX®
49
Tableau 4 : Résumé des avantages et inconvénients de chaque catégorie de dispositif.
Classe dedispositif Types Avantages Inconvénients
Aérosol doseurs de liquide pressurisé Inhalateur de poudre sèche Inhalateur liquide multidose Simple Auto-déclenché Avec chambre d’inhalation - prêt à l’emploi, maniable, compact
- n’impose pas de débit inspiratoire minimal
- adaptation à une chambre d’inhalation possible
- bonne reproductibilité dose émise
- ressentie de la prise - coût réduit
- coordination main bouche non requise
- meilleur dépôt pulmonaire - bonne reproductibilité dose émise
- ressenti de la prise - coût réduit
- pas de coordination main bouche requise
- n’impose pas de débit inspiratoire minimal
- faible dépôt oro-pharyngé
- pas de coordination main bouche requise
- dépôt oro-pharyngé plus faible - compteur de dose
- ressenti de la prise
- s’affranchit du débit inspiratoire
- bonne reproductibilité dose émise
- faible dépôt oro-pharyngé - dépôt pulmonaire optimal - compteur de dose - ressenti de la prise
-coordination main bouche requise
- dépôt oropharyngé important - compteur de dose
généralement absent
- impose un débit inspiratoire minimal
- dépôt oro-pharyngé important
- non compatible avec une chambre d’inhalation - compteur de dose généralement absent - variabilité des doses inhalées
- déperdition dans la chambre - pas de conteur de dose - pas de ressenti de la prise - relativement cher
- difficulté d’armement - impose un débit inspiratoire minimal
- adaptation à une chambre d’inhalation impossible - onéreux
- difficulté à l’armement - coordination requise - onéreux
50
d) Utilisation pratique des dispositifs
L’utilisation des dispositifs inhalés portables nécessite une technique précise, rigoureuse et aboutie ainsi que le respect des protocoles propres à chaque modèle.
Dans la description des différents dispositifs, nous avons souligné des caractéristiques sources d’erreur. Les ADP nécessitent d’être agités pour s’assurer du mélange du principe actif et une bonne coordination main-bouche. Les IPS réclament un bon débit inspiratoire, un armement optimal et de ne pas disperser la poudre en soufflant dans le dispositif.
Un travail portant sur 1644 sujets âgés en moyenne de 70 ans et évaluant plusieurs dispositifs faisait état d’au moins une erreur critique (délivrance nulle ou quasi nulle du médicament) dans 12 à 43 % des cas (43). Parmi les facteurs augmentant le risque d’erreur, l’âge plus élevé augmentait ce risque tandis qu’un meilleur niveau socio-éducatif le diminuait. Enfin, les erreurs commises étaient significativement associées à une augmentation des hospitalisations pour décompensation respiratoire, des passages aux urgences et du recours à l’antibiothérapie ou à la corticothérapie ponctuelle.
En résumé, dans la pratique quotidienne, l’utilisation de médicaments inhalés comporte un nombre important d’erreurs. Ces erreurs peuvent être communes à l’utilisation de la voie inhalée mais aussi liées au type de dispositif choisi. Entre un tiers et la moitié de ces erreurs sont dites critiques, c’est à dire n’entrainant pas d’administration médicamenteuses.
51
II.
Objectifs de l’étude
A.
Objectif principal
L’objectif principal est d’évaluer la technique d’utilisation des dispositifs d’inhalation et de colliger les erreurs commises chez des patients âgés hospitalisés bénéficiant d’un traitement inhalé chronique.
B.
Objectifs secondaires
Les objectifs secondaires sont :
a) Décrire les indications justifiant la prescription chronique de traitements inhalés
b) Rechercher les paramètres associés à une mauvaise prise d’un traitement inhalé chronique dans cette population.
C.
Critères de jugement primaire et secondaire
1. Critère de jugement primaire
A chaque dispositif inhalé correspond une succession d’étapes nécessaires à la préparation et à l’administration médicamenteuse définie par le laboratoire assurant la production du dispositif (Annexe à 1 à 11).
52
la réalisation effective du patient est considérée comme une erreur.
Les erreurs peuvent être considérées comme critiques ou non critiques. Une erreur critique est une erreur affectant significativement la dose délivrée. Une erreur non critique est une erreur diminuant la dose délivrée.
2. Critères secondaires
a) Les traitements inhalés bronchodilatateurs ou corticoïdes sont indiqués dans le traitement de l’asthme et de la BPCO. Le diagnostic de BPCO et de l’asthme repose sur la mise en évidence d’un trouble ventilatoire obstructif diagnostiqué lors d’une exploration fonctionnelle respiratoire.
L’absence de documentation de ces paramètres diagnostiques (comptes -rendus d’EFR ou comptes - -rendus médicaux rapportant les conclusions d’une EFR) conduit à considérer le diagnostic comme présumé et non validé.
b) Association statistique entre des caractéristiques des individus et une technique d’inhalation considérée comme inappropriée par la présence d’erreur critique.
53
III.
Méthode
A.
type d’étude
Il s’agit d’une étude prospective, observationnelle, descriptive, qui inclue les patients âgés de plus de 70 ans, bénéficiant d’une prescription chronique de médicaments inhalés, lors de leur admission hospitalière dans un service de soins aigus (gériatrique, cardiologique, pneumologique, médecine interne ou de soins de suites et de réadaptations gériatriques) au Centre Hospitalier de Dieppe.
Au cours de leur hospitalisation, ces individus ont bénéficié d’une évaluation de leur technique de prise des médicaments inhalés et du recueil de l’ensemble des éléments médicaux et pharmaceutiques permettant d’évaluer l’indication.
B.
Critères d’inclusion
- Age supérieur à 70 ans
- Traitement inhalé prescrit depuis au moins un mois à l’admission - Administration du traitement inhalé par le patient lui même
- Hospitalisation dans les services de médecine gériatrique, médecine interne, pneumologie, cardiologie et SSR gériatrique du centre hospitalier de Dieppe
C.
Critères d’exclusion
• Age inférieur à 70 ans
• Participation d’un tiers dans l’administration des traitements inhalés • Impossibilité médicale ou fonctionnelle secondaire à un(e) :
54
- Trouble locomoteur ou immobilisation prolongé des membres supérieurs d’origine neurologique, orthopédique ou rhumatologique (ex : AVC, fracture, arthrite)
- Trouble de vigilance ou anomalie cognitive aiguë prolongée d’origine neurologique (AVC, syndrome confusionnel selon les critères CAM)
- État médical aigu grave engageant le pronostic vital à court terme • Traumatisme costal compliqué de fracture, drainage pleural • Période post-opératoire d’une chirurgie abdominale
• Surdité profonde ou totale • Cécité
• Prescription récente (< 1 mois) et/ou ponctuelle d’un traitement inhalé
D.
Conditions d’évaluation de la prise médicamenteuse
L’évaluation de la technique de prise médicamenteuse nécessitait une situation
fonctionnelle et médicale stable définie selon les critères suivants :
• Résolution de la problématique aiguë et situation médicale compatible avec une sortie d’hospitalisation du secteur aigu (hors critères d’exclusion)
• Fréquence respiratoire < 20 / min
• Capacité à maintenir une position assise
• Absence de toux provoquée par l’inspiration ou l’expiration profonde
• Absence de syndrome douloureux thoracique, abdominal et des membres supérieurs
55
E.
Déroulement de l’étude
Tous les malades bénéficiant d’une prescription chronique de médicaments inhalés lors de leur admission dans un service de soins aigus gériatriques, pneumologiques, cardiologiques, de médecine interne ou de SSR gériatrique, répondant aux critères d’inclusion et acceptant de participer à l’étude étaient inclus.
Deux examinateurs médicaux étaient formés à l’évaluation de la prise des dispositifs inhalés et procédaient à l’expertise auprès des individus inclus.
L’évaluateur invitait les malades à reproduire la manipulation du dispositif qu’ils réalisaient pour leur prise médicamenteuse habituelle. Pour cela, des dispositifs de démonstration fournis par les fabricants étaient mis à disposition. La qualité de la prise médicamenteuse était objectivement appréciée grâce à des fiches standardisée d’évaluation des gestes propres à chaque dispositif, établies avec les données du fabricant. Toute discordance entre l’énoncé d’une étape et sa réalisation par le patient était considérée comme une erreur.
L’ensemble de ces grilles d’évaluation est disponible en annexe (annexes 1 à 11). Lorsque les malades utilisaient plusieurs dispositifs, ceux-ci étaient évalués successivement.
Il faut noter que l’évaluation de la prise médicamenteuse au cours de cette étude n’a pas pris en compte 3 éléments :
- le chargement initial de la cartouche pour les dispositifs NOVOLIZER® et RESPIMAT®
56
dose
- le déconditionnement par le patient des gélules de leur blister pour les IPS. En effet, les gélules disponibles pour l’évaluation étaient des gélules vides sans blister
Un MMSE et une évaluation de la force de contraction isométrique étaient ensuite effectués.
Le cahier de recueil de données réunissait les caractéristiques sociales cliniques et biologiques du patient. Ces données étaient recueillies après consultation du dossier médical, clinique et informatique.
F.
Erreurs critiques et non critiques
L’évaluation de la prise médicamenteuse distinguait les erreurs critiques qui correspondaient à celle affectant significativement la délivrance totale et effective de la dose, des erreurs non critiques qui correspondaient à la réduction de la quantité de produit délivrée lors de la prise (44)(45).
Ces erreurs étaient définies à partir des caractéristiques de la voie inhalée, des données du fabricant et de la littérature scientifique médicale. On peut répartir ces erreurs en trois catégories : celles communes à tous les dispositifs, celles qui sont spécifiques à l’usage de certains dispositifs et enfin celles liées au patient.
57
1. Erreurs critiques
D’une façon générale, pour l’ensemble des dispositifs, les erreurs critiques étaient constituées par les défauts de préparation du dispositif pour une prise médicamenteuse effective :
- ouverture des bouchons/capuchons/protections, - chargement / armement /perforation de gélule,
- défaut de déclenchement (exemple du CLIC audible pour les dispositifs autodéclenchés).
Lorsqu’il s’agissait d’anomalies spécifiques d’un dispositif ou d’une catégorie de dispositif, on pouvait retenir :
- La mauvaise orientation du dispositif lorsqu’une orientation spécifique était requise, par exemple la mise en position verticale du TURBUHALER® au moment de l’armement avec une tolérance d’inclinaison à 45 degrés.
- L’expiration dans le dispositif pour les IPS (dispersion de la poudre et humidification empêchant sa désagrégation).
Enfin, les erreurs liées au patient répertoriées étaient : - défaut de coordination main / bouche pour les ADLP
- inhalation autre que par la bouche, en dehors de la bouche ou bouche ouverte - expiration immédiate
- inhalation très superficielle
- inspiration brutale et forcée conduisant à une impaction oro-pharyngée du produit actif
58
2. Erreurs non critiques
Pour l’ensemble des dispositifs les erreurs non critiques étaient constituées par les défauts de préparation du dispositif pour une prise médicamenteuse effective :
- mauvaise position du dispositif
- appuis multiples sur le bouchon perforateur
Lorsqu’il s’agissait d’anomalies spécifiques d’un dispositif ou d’une catégorie de dispositif, on pouvait retenir :
- absence d’agitation du dispositif avant utilisation concernant les aérosols doseurs pressurisés simples et autodéclenchés
- tête non penchée en arrière avant l’inspiration concernant le RESPIMAT®
- ne pas vérifier la présence éventuelle de résidus de poudre dans la capsule après utilisation,
- ne pas reprendre les étapes précédentes si la capsule n’est pas vide,
- et ne pas enlever la gélule du dispositif après utilisation pour les modèle d’IPS à dose unique de type HANDIHALER®, l’AEROLIZER® et BREEZHALER®
Enfin, les erreurs liées au patient étaient :
- absence d’expiration préalable à l’inspiration - L’apnée inférieure à 3 secondes après inhalation
59
G.
Paramètres recueillis
Les paramètres recueillis dans le cahier de protocole étaient :
1. Données démographiques
- Date de naissance, sexe
2. Données de l’hospitalisation - Motif et secteur d’admission
- Traitement médicamenteux habituel - Antécédents médicaux
3. Comorbidités
Le score de Charlson élaboré en 1987 est destiné à pondérer le risque relatif estimé de mortalité à 1 an. Un score supérieur à 7 traduit une comorbidité élevée et un score supérieur à 5 témoigne d’une mortalité notable. Ce score a été calculé en utilisant les données du dossier médical.
4. Paramètres gériatriques
a) Statut cognitif
Le statut cognitif du patient était évalué à partir des données du dossier médical ou en réalisant un MMSE® au moment de l’inclusion.
Les antécédents de trouble neurocognitif majeur étaient systématiquement recherchés dans le dossier médical du patient. En l’absence de MMSE® récent disponible, celui-ci était réalisé au décours de l’évaluation de la prise médicamenteuse.
60
b) Dépendance
L’ADL (Activities of Daily Living) mesure la dépendance du patient. Cette échelle comporte 6 items : hygiène corporelle, habillage, capacité à aller aux toilettes, locomotion, continence et repas. Chaque item était coté selon 3 niveaux :
Absence de dépendance (1), dépendance partielle (0,5), dépendance totale (0). Le score total était la somme des différents items et pouvait varier de 0 à 6. Plus le score était faible et plus le patient était dépendant. Un score < 4 définissait un patient comme dépendant.
c) Autonomie
L’autonomie était définie par la capacité à se gouverner soi-même. Elle présupposait de la capacité de jugement, à savoir la capacité de prévoir, de choisir, ainsi que la liberté de pouvoir agir, accepter ou refuser en fonction de son jugement. Elle a été évaluée par l’IADL (Instrumental Activities of Daily Living), composée de 4 items vérifiant l’aptitude à téléphoner, utiliser les moyens de transport, prendre ses médicaments et à manipuler l’argent. Ces informations étaient toujours validées par un tiers. La perte d’autonomie s’appréciait en fonction du nombre d’items altérés.
d) Déficit sensoriel
La présence d’un déficit visuel et/ou auditif était colligée, ainsi que sa compensation par un appareillage. L’information était obtenue à la lecture du dossier médical.