T
T
H
H
È
È
S
S
E
E
Pour obtenir le grade de
D
D
O
O
C
C
T
T
E
E
U
U
R
R
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
DELIVRE PAR L’UNIVERSITE DE TOULOUSE–PAUL SABATIERDISCIPLINE OU SPECIALITE :ECOLOGIE ET EVOLUTION
Soutenue le 24 septembre 2008 devant le jury composé de: Christophe ROUX, Professeur, Université Toulouse III
Laure CIVEYREL, Maître de conférences, Université Toulouse III Peter LINDER, Professeur, Université de Zurich
Thierry GAUQUELIN, Professeur, Université de Provence Trevor HODKINSON, Professeur, Trinity college Dublin
Président
Directeur de thèse Directeur de thèse Rapporteur Rapporteur Présentée et soutenue par
Cyril GUIBERT
M
ACRO-
ECOLOGIE ET EVOLUTION DESC
AREX ENS
UISSE.
Ecole doctorale : Sciences de l’Univers – Ecologie, Environnement Unité de recherche : Laboratoire d’écologie fonctionnelle (EcoLab).
Premièrement, je remercie mes parents pour m’avoir aidé et soutenu aux cours de mes études.
Je tiens à remercier Peter Linder pour m’avoir permis de découvrir le monde des Cypéracées et de réaliser ce projet sur Carex au sein de l’Institut für Systematische Botanik à Zurich. Je remercie très sincèrement tous les membres de l’Institut de Botanique qui ont toujours été présents pour me soutenir dans les différentes phases de ce projet. Je suis particulièrement reconnaissant à Timo van der Niet, Chloé Galley, Alessia Guggisberg, Berit Gehrke, Urs Landergott, Brigitte Marazzi, Julia Born, Reto Nyffeler, Chris Hardy et Peter Endress pour les discussions instructives en botanique et évolution. Mes remerciements vont aussi à Julien Bachelier, Anita Lendel, Philip et Lukas Taxböck, Karina Arroyo, Beatriz Itten, Andre Simoes, Mary Endress, Yannick Städler, Jean-Paul Ghogue, Philip Moline, Guilhem Mansion, Reto Schiltz, Frank Rutschmann, Merran Matthews et Aelys Humphreys pour leurs qualités scientifiques et humaines, de même que Peter Enz et son équipe de Jardiniers/Botanistes de Zurich. Je suis particulièrement reconnaissant à Marlon Machado, Severin Dietschi, Evelyn Pfeiffer et Owi Nandi avec qui j’ai eu le plaisir de partager le bureau.
Ensuite, je tiens à remercier Laure Civeyrel pour le soutien et la confiance dont elle m’a fait preuve en acceptant de me faire continuer ce projet à Toulouse. Je suis particulièrement reconnaissant à Eric Chauvet de m’avoir accueilli au sein du Laboratoire d’écologie fonctionnelle (UMR 5245) et Elise van Campo pour m’avoir accepté dans son équipe. Je remercie Sylvain Mastrorillo, Charles Gers, Eric Campan, Céline Pélissier pour leur intérêt quotidien à l’avancement du projet. Je remercie aussi Oliver Navé, Olivier Navaud, Jérôme Albre, Pauline Rival, Virginie Molinier, Jérôme Pelenc et Charles Marty pour les conversations à la fois constructives et interminables.
Je suis également particulièrement reconnaissant aux Caricologistes et particulièrement à Matthias Hendrichs, Marcia Waterway et Julian Starr qui m’ont aidé à aborder, apprécier et enfin aimer l’un des genres parmi les plus important pour son nombre d’espèce et pourtant si peu enseigné en botanique.
Je remercie les membres du jury, dont son président Christophe Roux et les rapporteurs Thierry Gauquelin et Trevor Hodkinson.
Enfin, mes remerciements vont aussi au support financier de l’Université de Zurich et la bourse de la fondation Claraz pour le travail de terrain.
principalement réparti dans les zones tempérées de l’Hémisphère nord mais est aussi présent dans les zones alpines tropicales. Le but principal de cette thèse est de comprendre d’où vient cette importante richesse spécifique. Cette question a été traitée du point de vue phylogénétique et écologique.
Les relations phylogénétiques chez Carex ont été établies à partir du marqueur nucléaire ITS et de deux loci chloroplastiques trnT-L-F and rpl16. Nous avons utilisé deux régions chloroplastiques et ITS pour tester la validité des 36 sections principales de Carex d’Europe centrale. L’analyse a révélé des incompatibilités entre les phylogénies chloroplastique et nucléaire en particulier pour le sous-genre Vignea. Nous suggérons que les fortes incongruences du sous-genre Vignea proviendraient d’évènements anciens d’hybridation. L’évolution réticulée du sous-genre a montré, par exemple, que les deux espèces dioïque Carex davalliana et Carex dioica
proviendraient d’une hybridation ancienne entre des plantes qui présentaient des morphologies différentes des épis (androcandre et gynécandre). L’hybridation dans le genre a donc pu entraîner l’apparition de nouveaux caractères ainsi que de nouvelles espèces.
Les régions nucléaires et chloroplastiques sont par contre phylogénétiquement congruentes dans le sous genre Carex. La combinaison des données moléculaires pour ce sous genre montre des résultats inattendus comme la section Racemosae (=Atratae) qui est phylogénétiquement voisine de la sect. Digitatae.
Le sous-genre Carex présente un grand nombre d’espèce dans la flore Suisse. Nous l’avons étudié d’un point de vue écologique. L’analyse des habitats sur la topologie de l’arbre phylogénétique montre qu’une lignée de Carex a une capacité limitée de changer d’habitat. De plus, l’analyse des paramètres écologiques montre que les espèces n’ont pas une grande plasticité écologique. Ceci entraîne qu’au cours des cycles de glaciation et déglaciation du Quaternaire, une lignée ne pouvait pas occuper tous les nouveaux habitats. Ces nouveaux espaces étaient occupés par des espèces venant de zones refuges. La diversité floristique et phylogénétique de Carex dans la flore Suisse moderne est le résultat de tous ces changements.
Mots clés : Carex, Cyperaceae, dioécie, hybridation, influences écologiques, incongruence, phylogénie moléculaire
ABSTRACT
Carex (Cyperaceae) is mainly distributed in the Northern hemisphere but is also present in the alpine areas of the tropics. With 1,776 spp. it is one of the biggest genera of Angiosperms. The main purpose of this thesis is to understand why Carex is so species rich. This issue was addressed from the phylogenetic and ecological points of view.
Phylogenetic relationships in Carex have been inferred from the nuclear marker ITS and two
chloroplast loci trnT-L-F and rpl16. We tested the influence of the chloroplast versus ITS phylogenies of the 36 main Central European sections of Carex. The analyses revealed discrepancies between plastid and rDNA phylogenies in the subg. Vignea clade, but it was not demonstrated in subg. Carex. The strong incongruences in subg. Vignea were assessed to come from hybridisation. The reticulate evolution of the subgenus showed that dioecism in Carex davalliana and Carex dioica came from an ancestral hybridisation, between plants that presented opposite spike morphologies (androcandrous vs gynocandrous). Thus hybridisation in the genus can be considered as giving new features and a source of new species.
The nuclear and chloroplast regions have been shown to be phylogenetically congruent in subg. Carex. The combinaison of data in the subg. Carex shows unexpected results like sect. Racemosae (=Atratae)
phylogenetically related to sect. Digitatae.
The high species richness of subg. Carex in Switzerland was more closely investigated from the ecological point of view. The analysis of the habitat on the phylogenetic tree topology shows that species have limited ability to shift their habitats. Moreover, the analysis of ecological parameters shows that species do not have a high ecological plasticity. As a result, during the cycles of glaciation and deglaciation of the Quaternary, one lineage could not occupy all newly available habitats. Instead, pre-adapted clades were recruited from diverse refugial areas; these were determined by the inherited ecological capacities of the clades. The result is a modern Swiss Carex flora that is both floristically and phylogenetically very diverse.
P
P
r
r
é
é
f
f
a
a
c
c
e
e
/
/
F
F
o
o
r
r
e
e
w
w
o
o
r
r
d
d
“It is not the strongest species that survives nor the most intelligent, but the ones most responsive to change.” (attributed to Charles Darwin 1809-1882)
Pourquoi y a-t-il autant d’espèces? Quelle est l’origine de la biodiversité?
Les Cyperaceae sont des Angiospermes monocotylédones qui forment une famille cosmopolite d’herbacées comprenant 5 561 espèces (Govaerts et al., 2006) réparties en 117 genres présents surtout dans les zones humides. Elle compte parmi les 10 plus grandes familles de plantes à fleurs. Cyperaceae est la troisième famille des monocots avec environ 8% des espèces après les Orchidaceae (34%) et les Poaceae (17%) (Goetghebeur, 1998).
Chez les Cyperaceae, environ les trois quart des espèces de la famille appartiennent aux douze genres les plus importants : Carex (1776 spp.), Cyperus (710 spp.), Rhynchospora (276 spp.), Fimbristylis (317 spp.), Eleocharis (260 spp.), Scleria (267 spp.), Bulbostylis (205 spp.), Schoenus (126 spp.), Scirpus (95 spp.), Mapania (87 spp.), Kobresia (74 spp.) et
Uncinia (70 spp.). La plupart des autres genres de Cyperaceae ont presque toujours moins de
trente espèces et beaucoup sont monospécifiques. La circonscription de ces genres reste toutefois mal définie et sujet à controverse (Reznicek, 1990).
La diversité générique des Cyperaceae est beaucoup plus importante dans les zones subtropicales et tropicales que dans les zones tempérées. Les genres sont distribués généralement sur un seul continent, mis à part ceux qui contiennent des plantes invasives largement répandues. Contrairement à la distribution habituelle des Cyperaceae, Carex est principalement un genre des zones tempérées mais peut aussi se rencontrer dans les hautes altitudes sous les tropiques. Beaucoup d’espèces de haute altitude se retrouvent aussi présentes dans l’Arctique.
Dans cette thèse, nous nous concentrerons sur les relations phylogénétiques des Carex du centre de l’Europe. Ensuite, nous étudierons les effets de l’hybridation, de la génétique et de l’environnement sur l’émergence et le maintien de la diversité chez Carex.
Nous aborderons l’étude du groupe à travers l’écologie et la phylogénie. L’écologie concerne les interactions entre l’environnement et les espèces coexistantes, alors que la phylogénie permet de comprendre les relations de parenté entre espèces au cours du temps. Ces deux approches sont nécessaires pour comprendre la spéciation et la persistance des espèces dans le temps.
Why are there so many species?
What is the source of this range and diversity?
The Sedge family, Cyperaceae, belongs to the Monocotyledon group of Angiosperms. This family of grass-like plants accounts 5,561 spp. (Govaerts et al., 2006) and 117 genera found especially in wet areas of the world. It is one of the 10 largest families of flowering plants and the third Monocot family with 8% of the total species after Orchidaceae (34%) and Poaceae (17%) (Goetghebeur, 1998). Within Cyperaceae, the twelve largest genera have nearly three-quarters of the total number of species; Carex is by far the most species rich genus of the family, it has a high rate of species diversification (Magallon & Sanderson, 2001) and 1776 spp. recognised, followed by Cyperus, with 710 spp.; Rhynchospora (276 spp.),
Fimbristylis (317 spp.), Eleocharis (260 spp.), Scleria (267 spp.), Bulbostylis (205 spp.), Schoenus (126 spp.), Scirpus (95 spp.), Mapania (87 spp.), Kobresia (74 spp.) and Uncinia
(70 spp.). Most of the other genera of Cyperaceae are quite small, almost all with less than 30 spp., and many with only a single species. The circumscription of these genera remains somewhat unsettled and controversial (Reznicek, 1990).
Cyperaceae diversity, in terms of genera, is much greater in subtropical temperate and tropical regions than in temperate ones and except for those that are widespread agricultural weeds, the genera are generally confined to a single continent. Contrasting with the general genera distribution, Carex is mainly a temperate genus but is also found at high elevations in the tropics (Ball, 1990). It is nevertheless widespread throughout the world, except in deserts or semi deserts. It is also present in the Arctic and many species of the Northern latitude have circumpolar distributions and occur on several continents.
In this thesis, we will first focus on the phylogenetic relationships of Central European
Carex. Then we will address the effects of hybridisation, genetics and environment on the
emergence and maintenance of Carex species diversity. To answer such questions we must include studies of both ecology and phylogeny. Ecology focuses on the interactions between environment and coexisting species and phylogeny focuses on the species relationships through time. Both approaches are required to understand aspects of environments which promote speciation and species persistence in time.
SOMMAIRE / CONTENT
I
INNTTRROODDUUCCTTIIOON...N 9
A. Introduction aux Carex... 10
1. Histoire de la classification de Carex... 10
a) Classification de Cyperaceae. ... 10
b) Classification des Cariceae... 12
c) Classification infra générique de Carex. ... 14
d) Support moléculaire de la classification... 16
2. Répartition de Carex et de ses genres satellites. ... 18
3. Morphologie du genre type de la tribu: Carex. ... 20
a) Morphologie végétative... 20
b) Morphologie florale... 22
c) Différences morphologiques entre Carex et ses genres satellites. ... 27
4. Evolution de la fleur chez les Cyperaceae et les Cariceae. ... 29
a) Evolution des fleurs chez les Cyperaceae. ... 29
b) Evolution de la fleur chez les Cariceae. ... 30
B. Introduction to Sedges (Carex s.l)... 32
1. Classification history... 32
a) Classification of the family. ... 32
b) Classification of Cariceae... 34
c) Infra-generic classification of Carex... 36
d) Molecular support of the classification. ... 37
2. Distribution of Carex and its satellite genera... 40
3. Morphology of the type genus of the tribe: Carex. ... 41
a) Vegetative morphology. ... 41
b) Floral morphology... 44
c) Morphological differences between Carex and its satellite genera. ... 48
4. Flower evolution in Sedges. ... 50
a) Flower evolution hypotheses in Cyperaceae. ... 50
b) Flower evolution in Cariceae. ... 52
C CHHAAPPIITTRREEII::PPHHYYLLOOGGEENNIIEEDDEECACARREEXX((CCYYPPEERRAACCEEAAEE)...) 53
A. Introduction ... 57
B. Materials and Methods ... 59
1. Taxon sampling and matrix settings... 59
2. DNA extraction, amplification, and sequencing. ... 59
3. Sequence analysis and phylogenetic analyses... 60
a) Matrix A: ... 60
b) Matrix B and C:... 61
4. Incongruence testing. ... 62
C. Results ... 64
1. Characteristics of the matrices. ... 64
2. Phylogenetic analyses and clade supports... 65
3. Incongruence. ... 65
4. The effect of combining the data... 66
D. Discussion ... 67
a) Carex subg. Vignea ... 69
b) Carex subg. Carex ... 70
c) Carex subg. Psyllophora ... 71
3. Phylogenetic relathionships between large section of Carex subg. Carex... 72
a) Early diverged sections of subg. Carex... 72
b) Clade of species of subg. Carex that have bisexual spikes and two or three stigmata. ... 72
c) Clade with pubescent uticles and inferior bract sheath forming. ... 73
d) Carex with two stigmata with a male superior spike. ... 74
e) Large Carex with small distant spikes... 74
f) No pubescent utricle with many male spikes and three stigmata... 74
g) Summary. ... 75
4. Phylogenetic relationships in Carex subg. Vignea and evidence of incongruence in Carex. ... 75
5. Reticulate evolution of subg. Vignea. ... 76
Literature cited ... 99
C CHHAAPPIITTRREEIIII::HHYYBBRRIIDDAATTIIOONNEETTDDIIOOEECCIIE...E 109 A. Introduction ... 112
B. Materials and methods ... 114
C. Results ... 117 D. Discussion ... 120 E. Literature cited ... 126 C CHHAAPPIITTRREEIIIIII::IINNFFLLUUEENNCCEESSEECCOOLLOOGGIIQQUUEESSDDAANNSSLLAASSPPEECCIIAATTIIOONNDDEECCAARREEXX.. ...132 A. Introduction ... 136
B. Materials and Methods ... 138
1. Taxon Sampling ... 138
2. Molecular techniques and phylogenetic reconstruction. ... 138
3. Scoring of ecology. ... 139
4. Test of phylogenetic lability of character states... 142
5. Molecular evolutionary rates and divergence time estimation... 143
6. Ultrametric tree and character optimization... 143
C. Results ... 145
1. Phylogenetic reconstruction ... 145
2. Phylogenetic lability of the ecological characters and habitats... 145
D. Discussion ... 152
1. Ecological character conservatism. ... 152
2. Evolution at the landscape scale (habitats). ... 152
3. Evolution of microscale ecological parameters. ... 152
4. Quaternary fluctuations of glacial and interglacial time. ... 153
5. Speciation during the Quaternary... 154
6. Evolution of communities (Caricetum)... 155
7. Why so many species in Switzerland? ... 156
E. Literature cited ... 160
C COONNCCLLUUSSIIOONN... 167
A. Species tree reconstruction in Carex. ... 168
B. Evolution of the group... 169
C. Perspectives. ... 171
2. Ecology... 172
3. Conservation... 172
A. Reconstruction de l’arbre phylogénétique des espèces de Carex... 173
B. Evolution du groupe. ... 174 C. Perspectives. ... 175 1. Phylogénie de Cariceae. ... 175 2. Morphologie ... 175 3. Hybridation... 176 4. Ecologie... 176 5. Conservation... 176
REFERENCES BIBLIOGRAPHIQUES GENERALES. ...177
ANNEXES ...188
A. Distribution... 188
B. Dispersal mechanisms ... 190
C. Host specificity of parasitizing fungi. ... 191
D. Primers ... 191
E. Pictures and comments... 192
LISTE DES FIGURES
Figure 1. Arbre des Commélinideae condensé (basé sur Soltis et al.(2005)). ... 12
Figure 2. Arbre phylogénétique résumé des Cariceae (Muasya et al., 2000). ... 13
Figure 3. Summary tree of Roalson et al. (2001)... 17
Figure 4. Morphologie des organes végétatifs. ... 20
Figure 5. Morphologie des organes floraux. ... 24
Figure 6. Type d’inflorescence chez Carex... 27
Figure 7. Diagrammes floral des Cariceae. ... 28
Figure 8. Diagramme floral de fleurs ancestrales... 30
Figure 9. Summary tree of commelinids based on Soltis et al (2005). ... 34
Figure 10. Summary phylogenetic tree of Cariceae (Muasya et al., 2000)... 35
Figure 11. Summary tree of Roalson et al. (2001). ... 39
Figure 12. Morphology of vegetative organs. ... 42
Figure 13. Floral organs morphology... 46
Figure 14. Inflorescence type in Carex. ... 49
Figure 15. Floral diagrams of Cariceae. ... 50
Figure 16. Floral diagrams of ancestral flowers... 51
Les dessins des figures 7 et 15 proviennent de Starr et al. (2004) Les dessins des figures 4, 5, 6, 12, 13, 14 proviennent de Deutschlands Flora in Abbildungen (1976) : http://caliban.mpiz-koeln.mpg.de/~stueber/sturm/flora/index.html Chapter I, manuscript 1 Fig. 1. Phylogenetic tree of Carex...82
Fig. 2—23. Subtrees of paraphyletic species...83—90 Fig. 24—32. Subtrees of sections...91—32 Fig. 34. Nuclear and chloroplast phylogenetic trees of Carex...99
Fig. 35. Phylogenetic tree of subg. Carex...100
Fig. 36. Vignea chloroplast phylogeny...101
Chapter II, manuscript 2 Fig. 1. Chloroplast and nuclear phylogenies...122
Fig. 2. Comparison of the nuclear and chloroplast summary phylogenies...125
Fig. 3. ancestral reconstruction of inflorescence character states on the nuclear and chloroplast phylogenies of subg. Vignea. ...127
Chapter III, manuscript 3 Fig. 1. Strict consensus of parsimony analysis...149
Fig. 2. Chronogram...150
LISTE DES TABLEAUX / TABLES
Tableau 1. Classification supragénérique des Cyperaceae... 10
Tableau 2. Classification de la tribu Cariceae... 12
Tableau 3. Etapes principales de l’histoire taxonomique de Carex s.l... 15
Tableau 4. Classification des sous genres de Carex... 15
Tableau 5. Tableau partiel de la distribution des Cariceae (voir Annexe A pour tableau complet)... 19
Table 1. Suprageneric classification of Cyperaceae... 32
Table 2. Classification of tribe Cariceae ... 35
Table 3. Major steps in the History of Carex s.l. taxonomy. ... 37
Table 4. Carex Subgenera classification. ... 37
Table 5. Summary table of the distribution of Cariceae (see Annexe A for complete table). . 41
Chapter I, manuscrit 1 Table 1. Characteristics of Matrix A...98
Table 2. Influence of data combination on CI, RI and bootstrap values...98
Chapter III, manuscrit 3 Table 1. Character states...143
Table 2. Communities...144
Table 3 Ecological states of species along 9 ecological gradients...152-153 Table 4 ci values of the ecological parameters...154
I
I
n
n
t
t
r
r
o
o
d
d
u
u
c
c
t
t
i
i
o
o
n
n
“Gras ist das Haar der Mutter Erde” (Karl Foerster)*
__________________________________________________________________________________________ * Horticulteur allemand, il a utilisé cette phrase poétique (« Les herbes sont les cheveux de notre mère, la terre ») pour montrer la relation intime entre l’herbe et le milieu dont elle est issue/ German horticulturist, he used this poetic phrase (“Grass is the Hair of Mother Earth”) to evoke the intimate bond between grasses and the earthy
A. Introduction aux Carex.
1. Histoire de la classification de Carex.
a) Classification de Cyperaceae.
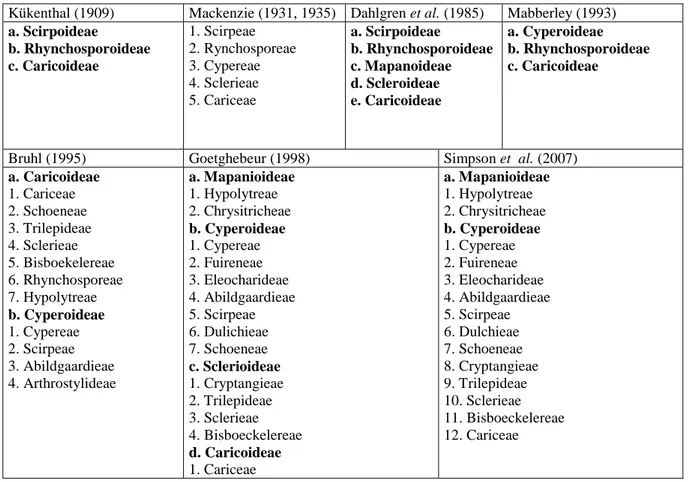
Depuis Jussieu (1789) et Lestiboudois (1819), la sous-famille et la tribu sont les deux rangs taxonomiques les plus important dans la classification des Cyperaceae (Goetghebeur, 1985). En 1909, Kükenthal a publié le premier travail taxonomique complet de la famille entière la divisant en 3 sous-familles. Ceci a été complété en 1931 par MacKenzie qui divisa les Cyperaceae en 5 tribus (Tableau 1).
Tableau 1. Classification supra-générique des Cyperaceae.
Kükenthal (1909) Mackenzie (1931, 1935) Daldgren et al (1985) Mabberley (1993) a. Scirpoideae b. Rhynchosporoideae c. Caricoideae 1. Scirpeae 2. Rynchosporeae 3. Cypereae 4. Sclerieae 5. Cariceae a. Scirpoideae b. Rhynchosporoideae c. Mapanoideae d. Scleroideae e. Caricoideae a. Cyperoideae b. Rhynchosporoideae c. Caricoideae
Bruhl (1995) Goetghebeur (1998) Simpson et al. (2007)
a. Caricoideae 1. Cariceae 2. Schoeneae 3. Trilepideae 4. Sclerieae 5. Bisboekelereae 6. Rhynchosporeae 7. Hypolytreae b. Cyperoideae 1. Cypereae 2. Scirpeae 3. Abildgaardieae 4. Arthrostylideae a. Mapanioideae 1. Hypolytreae 2. Chrysitricheae b. Cyperoideae 1. Cypereae 2. Fuireneae 3. Eleocharideae 4. Abildgaardieae 5. Scirpeae 6. Dulichieae 7. Schoeneae c. Sclerioideae 1. Cryptangieae 2. Trilepideae 3. Sclerieae 4. Bisboeckelereae d. Caricoideae 1. Cariceae a. Mapanioideae 1. Hypolytreae 2. Chrysitricheae b. Cyperoideae 1. Cypereae 2. Fuireneae 3. Eleocharideae 4. Abildgaardieae 5. Scirpeae 6. Dulchieae 7. Schoeneae 8. Cryptangieae 9. Trilepideae 10. Sclerieae 11. Bisboeckelereae 12. Cariceae
Le rang taxonomique des cinq tribus de MacKenzie (1931) n’a pas été accepté par tous les botanistes. Les cinq tribus ont été remplacées par cinq sous-familles (Dahlgren et al., 1985) ou bien ont été réduites à trois sous-familles (Mabberley, 1993). En 1995, Bruhl a utilisé des analyses cladistiques et phénétiques sur des données morphologiques pour proposer un nouveau système de classification des 122 genres qu’il reconnaissait chez Cyperaceae (Bruhl, 1995). Il a divisé la famille en deux sous-familles : les Cyperoideae qui possédent généralement des fleurs bisexuées, et les Caricoideae qui ont des fleurs unisexuées. Les Cyperoideae sont divisées en quatre tribus alors que les Caricoideae sont formés de sept tribus dont les Cariceae (Tableau 1, Tableau 2). Il a admis que seulement trois ou quatre des 11 tribus de son système de classification ont des chances d’être monophylétiques. Il a aussi émis l’hypothèse que les Cariceae formaient un groupe monophylétique. En 1998, Goetghebeur a proposé un système de classification alternatif à celui de Bruhl (1995) avec quatre sous-familles et 15 tribus (Tableau 1). Tous les auteurs ne s’accordent donc pas sur les délimitations des sous-familles et des tribus. De même, les circonscriptions au niveau générique n’ont pas été complètement résolues. Brummitt (1992) a accepté 102 genres et Thorne (2000) en a accepté 104.
Avec un nombre de caractères quasiment illimités, la systématique moléculaire est particulièrement adaptée pour tester les hypothèses d’évolution et les classifications morphologiques. Toutes les études (Waterway et al., 1997; Starr et al., 1999; Yen & Olmstead, 2000; Roalson et al., 2001; Starr et al., 2004; Hendrichs et al., 2004a; Hendrichs et
al., 2004b) révèlent que les classifications des sous-familles et des tribus de Goetghebeur
(1998) mais aussi de Bruhl (1995) ne contiennent pas beaucoup de groupements monophylétiques. Dans la première analyse moléculaire des Cyperaceae basée sur la région chloroplastique rbcL, la famille n’est pas monophylétique (Plunkett et al., 1995), bien que plus tard en combinant des données moléculaires et morphologiques elle est montrée monophylétique par Muasya et al.(1998). La monophylie de la famille est maintenant démontré (Soltis et al., 2005) (Figure 1). En 2007, basé sur une phylogénie rbcL des Cyperaceae, Simpson et al. (2007) ont inclus les trois sous-familles de la classification de Goetghebeur (1998) ; les Cyperoideae, les Sclerioideae et les Caricoideae, dans la sous-famille « Cyperoideae » (Tableau 1).
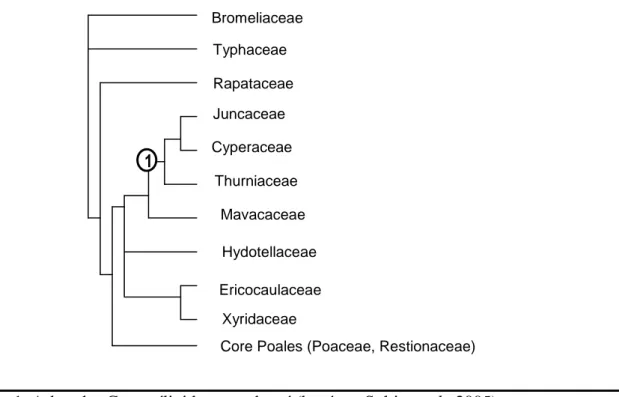
Figure 1. Arbre des Commélinideae condensé (basé sur Soltis et al., 2005).
“1” désigne le clade les caractères apomorphiques suivant: grain d’amidon du type ptéridophyte, aérenchymes septaux, tige anguleuse, feuilles sur 3 rangs, gaine fermée, inflorescence en racème, fleurs petites, pollen en pseudomonades, ovules anatropes, collerette du germe peu visible, avec rhizoides, chromosomes avec centromères diffus.
b) Classification des Cariceae.
Malgré ces changements successifs de rangs taxonomiques (Table 2), de sous-famille à tribu, Cariceae regroupe généralement le même groupe de genres. En 1889, Pax a placé
Carex, Kobresia, Uncinia, Schenoxiphium, Elyna et Hemicarex dans les Cariceae qui est la
seule tribu de la sous-famille des Caricoideae. En 1908, Clarke a transféré quelques espèces de Schoenoxiphium dans le genre Carex. En 1909, Kükenthal a inclus les membres de Elyna et Hemicarex dans les genres Kobresia (épelé “Cobresia”) et Schoenoxiphium (Table 2). Il a ensuite défini la sous-famille Caricoideae avec les quatres genres Kobresia, Uncinia,
Schenoxiphium et Carex. En 1931, Mackenzie a changé le rang taxonomique de la
sous-famille en tribu « Cariceae ». Il a réactualisé la circonscription de la tribu en ajoutant le genre monospécifique Cymophyllus à celle-ci et en enlevant le genre Schoenoxiphium. En 1958, Kern a considéré artificielle la distinction entre Kobresia et Schenoxiphium. En 1961, Koyama a fusionné Uncinia avec Carex et aussi Schoenoxiphium avec Kobresia. En 1995, Bruhl a réutilisé le genre Schenoxiphium et le genre Sud Américain monospécifique Vesicarex dans les Cariceae (Table 2).
1 Bromeliaceae Typhaceae Rapataceae Juncaceae Cyperaceae Thurniaceae Mavacaceae Hydotellaceae Ericocaulaceae Xyridaceae
Tableau 2. Classification de la tribu Cariceae. *Pax n’a pas spécifié de rang taxonomique.
La monophylie des Cariceae a été soutenue par les études moléculaires (Plunkett et al., 1995; Muasya et al., 1998; Muasya et al., 2000). Muasya et al. (2000) ont posé la question de la position des Cariceae et des autres tribus dans les Cyperaceae (Figure 2). Ils ont combiné les données rbcL avec les données morphologiques de Bruhl (1995). Cette étude suggère que Cariceae est le groupe frère de Scirpeae II (qui inclut Eriophorum, Scirpus et Blysmus).
Figure 2. Arbre phylogénétique résumé des Cariceae (Muasya et al., 2000).
“2” désigne le clade avec les caractères apomorphiques suivant : fleur unisexuée avec les fleurs femelles à l’aiselle de la prophylle (périgyne), cristaux de silicate dans l’épiderme, style fortement ramifié, pas de nectaires septés.
Pax (1888) * Kükenthal (1909) Mackenzie (1931, 1935) Bruhl (1995) Cariceae a. Carex b. Kobresia c. Uncinia d. Schoenoxiphium e. Elyna f. Hemicarex Caricoideae a. Carex b. Cobresia c. Uncinia d. Schoenoxiphium Cariceae a. Carex b. Kobresia c. Uncinia d. Cymophyllus Cariceae a. Carex b. Kobresia c. Uncinia d. Cymophyllus e. Schenoxiphium f. Vesicarex 2 Cypereae Scirpeae IV Abildgaardieae I Scirpeae III Abildgardieae II Cariceae Scirpeae II Rhynchosporeae Schoeneae Sclerieae/Bisboeckelereae/Trilepideae Hypolytreae Scirpeae I
c) Classification infra générique de Carex.
L’histoire de la classification de Carex est longue et complexe. Elle reflète les difficultés taxonomiques du groupe. En 1753, Carl Linné a commencé la taxonomie des
Carex en assignant au genre 39 espèces. Ce nombre d’espèces décrites a augmenté jusqu’à
800 en 1909 (Kükenthal, 1909). Kükenthal a donné la première analyse morphologique complète de Carex et a divisé le genre en quatre sous-genres (subgg. Primocarex, Vignea,
Vigneastra et Eucarex) et 71 sections (Tableau 2, Tableau 3) basés principalement sur
l’inflorescence, le rachilla, et la morphologie du périgyne (une structure en forme de sac incluant le gynoecium). Malgré l’augmentation explosive du nombre d’espèces décrites dans le genre, allant jusqu’à 1 776 (Govaerts et al., 2006), la circonscription des sous-genres a été généralement conservée. Le dernier changement de la classification morphologique a été réalisé par Egorova (1999) qui a introduit un nouveau sous-genre Kreczetoviczia Egor. comprenant sept sections (sectt. Phacocystis Durmot., Temnemis (Rafin.) V. Krecz.,
Abditispicae Wheeler, Graciles (Tuck. ex Kuk.) Ohwi ; Forficulae Franch. ex Raymond ; Pragelongae (Kuk.) Nelmes et Tuminescens Y.I. Chang & Y.L. Yang). Ce sous-genre est
défini par des caratères qui sont essentiellement souterrains. Les organes souterrains sont cependant généralement peu collectés ce qui a été déploré par Egorova et Mackenzie. Mackenzie (1935) note que les écailles et les épis varient fortement en forme et en taille dans une même espèce et que les distinctions basées sur ces parties nécessitent des vérifications par une étude basée sur beaucoup de matériel végétal. Aujourd’hui, les sous-genres admis par les caricologistes sont : sous-genre Carex L. (= sous-genre Eucarex Kük.), sous-genre
Psyllophora (Degl.) Peterm. (= sous-genre Primocarex Kük.), sous-genre Vigneastra (Tuck.)
Kük. (= sous-genre Indocarex (Baill.) Kük).
Les botanistes ont suggéré que Carex dérive peut être d’ancêtres ressemblants morphologiquement à Kobresia ou à Schoenoxiphium. Cette suggestion a été mise en doute par Reznicek (1990). Dans le cas de Kobresia, il a même suggéré qu’il ne devait pas exister d’importantes différences phylogénétiques avec Carex. Reznicek (1990) a aussi mentionné que les deux autres sous-genres Carex et Vignea doivent avoir dérivé d’ancêtres ayant des caractères semblables au sous-genre Vigneastra même s’il a admis un manque d’évidence pour le confirmer définitivement. Il n’a pas pu éliminer la possibilité que Vigneastra soit un clade évolutivement séparé qui est plus proche des autres genres de la tribu des Cariceae. De plus, Reznicek (1990) a suggéré que le groupe des Carex à un seul épi (c’est à dire sous-genre
Psyllophora = sous-genre Primocarex) est probablement polyphylétique. Les évènement
répétés d’apparition et de réversion peuvent obscurcir les tendances évolutives (Reznicek, 1990) et avoir ainsi conduit à la reconnaissance de beaucoup de taxa artificiels au niveau des sections mais aussi au niveau des sous-genres de Carex. Récemment, les 71 sections de Carex ont été partiellement révisé par Egorova (1999) et Reznicek (2001).
Tableau 3. Etapes principales de l’histoire taxonomique de Carex s.l.
1753 Linnaeus, 39 espèces de Carex.
1909 Kükenthal a divisé le genre Carex en 4 genres : Psyllophora (= sous-genre Primocarex), sous-sous-genre Vignea, sous-sous-genre Vigneastra (= sous-sous-genre
Indocarex) et sous-genre Carex (= sous-genre Eucarex), ses travaux on fait
de « Pflantzenreich »une référence majeure de la classification de Carex. 1935 Mackenzie a placé Carex, Kobresia, Uncinia et Cymophyllus dans la tribu
Cariceae.
1990 Reznicek : sous-genre Primocarex est polyphylétique. 1999 Egorova redéfinit la circonscription des sections.
2000 Yen et al. analysent les relations de parenté chez les Cariceae avec une phylogénie moléculaire basée sur l’ADN chloroplastique. Le sous-genre
Carex est polyphylétique. Le sous-genre Psyllophora est polyphylétique.
2001 Roalson : Etude moléculaire des Cariceae basée sur de l’ADNnr et de l’ADNcp ; Vignea est un groupe bien soutenu.
Trois clades majeurs chez Carex : sous-genre Vignea, sous-genre Carex (composé de sous-genre Vigneastra et sous-genre Eucarex) et sous-genre
Psyllophora.
2004 Starr suggère que les genres monospécifiques Cymophyllus et Vesicarex ne méritent pas le statut de genre.
Tableau 4. Classification des sous-genres de Carex.
Kükenthal (1909) Egorova (1999) a. Carex 1. Eucarex (30 sections) 2. Vignea (21 sections) 3. Indocarex (6 sections) 4. Primocarex (14 sections) a. Carex 1. Carex 2. Vignea 3. Vigneastra 4. Psyllophora 5. Kreczetoviczia
d) Support moléculaire de la classification.
Yen & Olmstead (2000) ont utilisé l’ADN chloroplastique pour analyser les relations de parenté à l’intérieur des Cariceae. Ils ont ainsi reconnu cinq genres dans cette tribu (Yen & Olmstead, 2000) : Carex, Kobresia, Uncinia, Cymophyllus, et Schoenoxiphium. Ils ont aussi inclus des espèces de Carex de chacun des sous-genres de la classification de Kükenthal :
Primocarex, Vignea, Eucarex, et Indocarex. Les résultats soutiennent l’hypothèse de Bruhl
(1995) confirmant que les Cariceae forment est un groupe monophylétique. Schoenoxiphium est groupe frère du reste de la tribu, suggérant que Carex dérive d’ancêtres ayant des caractères communs avec Schoenoxiphium. Le sous-genre Psyllophora (= sous-genre
Primocarex) se retrouve clairement polyphylétique comme Reznicek (1990) le supposait. Le
sous-genre Vignea forme un groupe monophylétique bien soutenu par cette même étude. Néanmoins, certaines délimitations de genres sont rendues plus imprécises. Carex apparaît polyphylétique et Kobresia comme un groupe qui n’est pas séparé de Carex. Uncinia est un groupe dérivé à l’intérieur de Carex, ce qui montre clairement que le rachilla d’Uncinia caractérisé par sa forme en crochet n’est pas un caractère primitif, comme Reznicek (1990) le suggérait.
Roalson et al. (2001) ont combiné des séquences nucléaires ainsi que chloroplastiques pour augmenter la résolution de l’arbre phylogénétique et donc pour définir plus précisément les relations de parenté entre les genres de la tribu de Cariceae (Figure 3). Ils ont analysé 100 espèces de Carex, et 16 autres espèces appartenant à des genres différents de Cariceae. Ils ont trouvé des résultats similaires mais pas identiques à ceux trouvés antérieurement. Kobresia,
Uncinia et Schoenoxiphium se retrouvent à l’intérieur du genre Carex. Plus précisement, Kobresia serait une groupe ayant divergé tôt comme Yen & Olmstead (2000) le suggéraient et Schoenoxiphium n’est pas le groupe frère du reste de la tribu (Roalson et al., 2001). De plus
au niveau des sous-genres, Yen & Olmstead (2000) ont monté que le sous-genre Vigneastra est inclus dans le sous-genre Carex ; en d’autres termes, les caractères du sous-genre
Vigneastra ne sont pas ancestraux comme le supposait Reznicek (1990). Le sous-genre Vignea forme un groupe bien soutenu.
Figure 3. Arbre phylogénétique résumé de Roalson et al. (2001).
Rouge :Carex genre Carex, bleu : Carex genre Vignea, vert : Carex genre Psyllophora (= sous-genre Primocarex), 1. sect. Indicae (Indocarex), 2. Cymophyllus, 3. Kobresia, 4. Uncinia, 5. Schoenoxiphium.
Les clades majeurs de Cariceae proposés par Roalson et al. (2001) sont donc : un clade basal formé par le sous-genre Vignea, un autre clade avec principalement des espèces appartenant aux sous-genres Vigneastra et Carex, et finalement un troisième clade comprenant beaucoup d’espèces de Carex à un seul épi (c’est à dire sous-genre Primocarex = sous-genre Psyllophora) de même que les quatre autres genres de Cariceae (Figure 3).
Bien que la monophylie des sous-genres Vignea et Carex incluant le sous-genre
Vigneastra ne fasse pas débat, leur place relative demande confirmation. Les relations et les
positions relatives des Cariceae à un seul épi a été plus finement étudié par Starr (2004), il montre que seulement Uncinia et Schoenoxiphium sont des groupes monophylétiques.
Schoenoxiphium n’est pas topologiquement à la base de la tribu. De plus, il a suggéré que les
genres monospécifiques Cymophyllus et Vesicarex ne méritent pas le statut de genre (Starr et
al., 2004). Néanmoins, chacune de ces études a utilisé une petite fraction du nombre total
d’espèce de Cariceae et ces résultats devraient être confirmés dans une étude plus large pour envisager une révision plus générale de la classification par les caricologues.
Beaucoup d’études moléculaires ont aussi posé des questions taxonomiques au niveau de la section (Waterway et al., 1997; Starr et al., 1999; Hendrichs et al., 2004a; Hendrichs et
al., 2004b; Hipp et al., 2006). Beaucoup de sections définies par Kükenthal (1909) ou
MacKenzie (1931, 1935) ne sont pas monophylétiques et un travail important de recirconscription des sections doit être entrepris.
2. Répartition de Carex et de ses genres satellites.
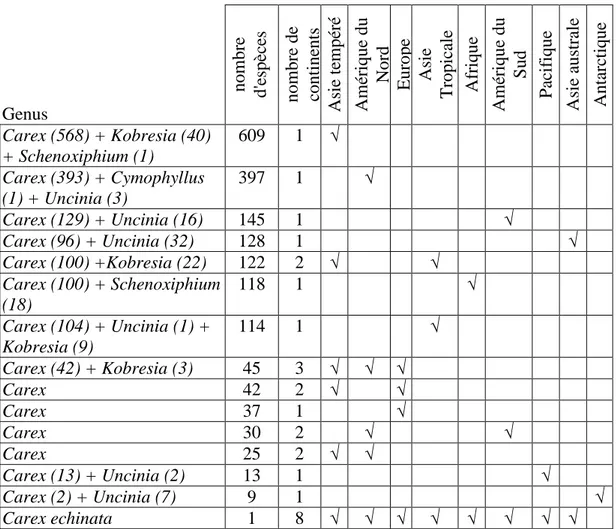
Cariceae a une distribution cosmopolite. Cependant les espèces ne sont pas réparties uniformément sur tous les continents*. La richesse de Cariceae est plus importante dans l’hémisphère nord. Plus de la moitié des 1949 espèces de Cariceae est distribuée en Asie tempérée et en Amérique du Nord (Tableau 5).
La proximité des continents permet le partage d’espèces. Ceci est vérifié selon la longitude entre l’Asie tempérée et l’Asie tropicale ou encore l’Amérique du Nord et l’Amérique du Sud. De même, selon dans les hautes latitudes, la proximité polaire entre l’Amérique du Nord, l’Asie tempérée et l’Europe entraîne 45 espèces communes aux trois continents. Plus généralement, seulement 106 espèces peuvent être considérées comme __________________________________________________________________________________________ * Ici les continents sont définis suivant Govaerts (2004), ils correspondent aux 9 biomes principaux (Asie-tempéré, Amérique du Nord, Europe, Asie tropicale, Amérique du sud, Pacifique, Asie australe, Antarctique).
vraiment cosmopolites telles que Carex echinata qui est distribuée sur les huit continents reconnus (Tableau 5).
La distribution de Cariceae est vraiment distincte suivant les genres. Kobresia Willd. (50 spp.) est largement distribué aux hautes altitudes de l’Himalaya, de la Chine et de l’Asie centrale avec quelques espèces présentes dans les hautes montagnes d’Europe et d’Amérique du Nord (Dahlgren et al., 1985). Schoenoxiphium Nees (17 spp.) est un genre avec peu d’espèces ; présent dans les montagnes de l’est et du sud de l’Afrique ainsi qu’à Madagascar (Kukkonen, 1986). Uncinia Pers. (50 spp.), est largement répandu des hautes altitudes du centre et du sud de l’Amérique, d’Australie, de Nouvelle Zélande, et des îles océaniques de l’hémisphère sud (Kukkonen, 1967). Même les sous-genres de Carex ont différent centre de diversité. Le sous-genre Carex a son centre de diversité en Asie tempéré contrairement au sous-genre Vignea qui a son centre de diversité en Amérique du Nord. Le sous-genre
Vigneastra est quant à lui présent uniquement dans les zones chaudes du sud de l’Asie.
Tableau 5. Tableau partiel de la distribution des Cariceae (voir Annexe A pour tableau complet). Le signe √ signifie « présence ».
Genus nom br e d'e spè ce s nom br e de cont ine nt s A si e t em pé ré A m ér ique du N or d E ur ope A si e T ropi ca le A fr ique A m ér ique du S ud P ac if ique A si e a us tr al e A nt ar ct ique Carex (568) + Kobresia (40) + Schenoxiphium (1) 609 1 √ Carex (393) + Cymophyllus (1) + Uncinia (3) 397 1 √ Carex (129) + Uncinia (16) 145 1 √ Carex (96) + Uncinia (32) 128 1 √ Carex (100) +Kobresia (22) 122 2 √ √ Carex (100) + Schenoxiphium (18) 118 1 √ Carex (104) + Uncinia (1) + Kobresia (9) 114 1 √ Carex (42) + Kobresia (3) 45 3 √ √ √ Carex 42 2 √ √ Carex 37 1 √ Carex 30 2 √ √ Carex 25 2 √ √ Carex (13) + Uncinia (2) 13 1 √ Carex (2) + Uncinia (7) 9 1 √ Carex echinata 1 8 √ √ √ √ √ √ √ √
3. Morphologie du genre type de la tribu: Carex.
a) Morphologie végétative.
•
•
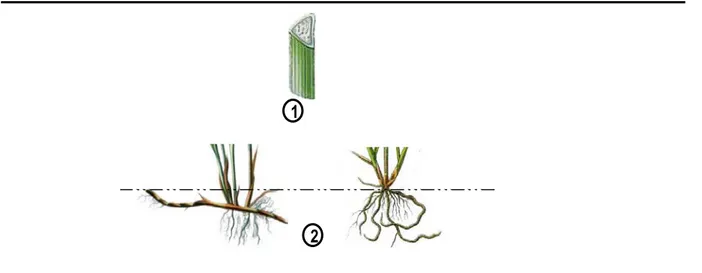
Tiges/ Rhizomes:Les Carex ont deux types de tiges, une tige chlorophyllienne qui est aérienne et une tige non-chlorophylienne, le rhizome, se développant sous le niveau du sol (Figure 4-2 et 4-3)
La tige chlorophyllienne est simple, sans ramification (à l’exception de l’inflorescence). Elle est triangulaire en section transversale (Figure 4-1).
Le rhizome n’est pas chlorophyllien, c’est un système d’exploration du milieu souterrain, qui facilite l’exploitation des ressources du sol (D'Hertefeldt & Jonsdottir, 1999). Le type de rhizome détermine directement la forme de croissance des espèces de Carex (Jonsson et al., 1996). En 1990, Bernard en a décrit deux types corrélés aux trois types de croissance souterraine chez Carex (Figure 4-2). Dans le premier type, les plantes produisent seulement de longs rhizomes; ils se développent sous terre et produisent des tiges aériennes seulement après avoir parcouru une longue distance qui peut atteindre 50 à 100 cm chez les plus grandes espèces. Dans le second type (Figure 4-3), les plantes produisent seulement de courts rhizomes entraînant un port en touffes; le développement souterrain ne dépasse généralement pas 10 cm de longueur, le rhizome peut grandir horizontalement ou verticalement suivant l’espèce. Dans le troisième type, les plantes produisent à la fois de long et de court rhizomes, ils génèrent ainsi de large touffes à tige serrées (Bernard, 1990).
Figure 4. Morphologie des organes végétatifs.
1. Section transversalede d’une portion de tige; Types de rhizomes souterrains : 2. gauche:rhizome long, 2. droite. rhizome court.
1
•
•
Feuilles:Les feuilles sont simples, entières, alternées sur 3 rangs. Elles sont étroites et ressemblent superficiellement aux feuilles des Poaceae. Elles ont des nervures parallèles et sont engainantes à leur base. Elles possèdent parfois une ligule. Leur section peut être en forme de V ou de M en section transversale. Beaucoup d’espèces présentent des cellules bulliformes sur les nervures principales et peuvent plier et déplier leurs feuilles suivant le stress hydrique ou l’incidence lumineuse. Il faut aussi noter que le parenchyme des feuilles n’est jamais palissadique.
Les feuilles sont fortement variables en longueur et largeur entre espèces. Elles sont aussi très variable en couleur (ex. vert, bleu, rouge, panachées blanches et vertes) qui peut changer grâce à l’épicuticule et même grâce à des papilles (Metcalfe, 1969).
Les feuilles sont protégées contre les herbivores par des corps de silicate (verre) qui contribuent à rendre la feuille dure et coupante. Cytologiquement, le silicate est déposé dans les cellules en amas distincts en forme des cônes avec leur base reposant sur la paroi interne des cellules épidermiques et leur sommet dirigé vers l’extérieur. Le nombre des corps de silicate varie dans chaque cellule allant de un à de très nombreux, ils peuvent être séparés ou fusionnés, et avoir des tailles différentes (Metcalfe, 1969).
La feuille est généralement embrassante et forme une gaine, elle protège ainsi les méristèmes intercalaires et donne un support supplémentaire à la tige. La feuille est souvent associées à d’autres structure telle que la ligule (ou collerette membraneuse) et la prophylle (voir glossary). Ces adaptations protégent la tige principale de la plante contre les insectes phytophages.
La bractée est une feuille modifiée à la base du pédoncule des épis. Elle ressemble à une feuille ou à une écaille, elle est toujours libre dans sa partie distale et peut être libre ou embrassante sur la tige florale dans sa partie proximale.
•
•
Schéma de croissance:Les Carex peuvent avoir deux formes de croissance suivant l’espèce, elles peuvent être centrales ou latérales. Dans le premier cas, la tige produite la première année produira une tige fertile à partir de son méristème apical au cours de la seconde année. La plante est alors phyllopodique. La croissance latérale provient dun méristème latéral et c’est de loin la plus fréquente chez les espèces de Carex. Elle entraîne des plantes aphyllopodiques. Dans les deux
cas, Carex a des méristèmes intercalaires protégés par les gaines. Ces méristèmes peuvent se développer en tige florales en cas de destruction (ex. pâture, feu) du méristème apical principal.
•
•
Racines:Embryologiquement, la racine primaire n’est pas le premier organe à se développer au cours de la germination (Alexeev, 1988; Rudall et al., 1995). Elle commence parfois à grandir avec le coléoptile mais sa croissance est généralement reportée jusqu’à ce que le coléoptile soit complètement développé. La racine primaire se développe alors très bien mais reste non ramifiée; elle avorte rapidement et est remplacée par des racines adventives et fibreuses confinées aux noeuds des rhizomes. Quelques Carex ont une structure racinaire particulière avec des tissus aérifères qui permettent la circulation de l’air à l’intérieur de la racine (Bernard et al., 1988; Koncalova et al., 1988). Ces tissus aérifères permettent une adaptation résistance à l’inondation ; cependant ils ne sont pas obligatoirement associés aux espèces poussant dans les zones humides (Visser et al., 2000). Les Carex peuvent aussi avoir des racines latérales gonflées (Davies et al., 1973) appelées racines dauciformes. Ces racines se développent généralement quand la concentration en phosphore assimilable pour la plante est faible (Miller, 2005; Shane et al., 2005). De plus suivant les conditions environnementales, la symbiose mycorrhizienne n’est pas toujours présente chez Carex particulièrement chez les plantes poussant dans des milieux inondables (Miller et al., 1999; Brundrett, 2002; Muthukumar et al., 2004; Rillig & Mummey, 2006).
b) Morphologie florale.
•
•
Structure de l’épillet :Les Cariceae ont des fleurs unisexuées organisées en épillets. L’épillet présente un axe appelé rachis sur lequel peuvent être organisées deux ou trois fleurs. Ces fleurs sont généralement de genres différents avec les fleurs proximales femelles et les terminales mâles. L’épillet est entouré de prophylles. Ces prophylles sont réduites, membraneuses et plus ou moins soudées selon le genre de Cariceae considéré. Chez Carex, cette membrane a ses bords complètement fusionnés elle forme alors un sac appelé utricule. Carex est de plus caractérisé par ses épillets réduits à une seule fleur. L’utricule est présent uniquement chez les épillets à fleur carpellé et est donc appellé aussi périgyne, il renferme l’épillet composé du stipe, de la
fleur et du rachilla (rachis modifié). Chez Carex, comme le périgyne ne renferme qu’une fleur femelle (au sens strict), le périgyne est souvent inclus comme composant intégral de la fleur femelle. Par extrapolation, le terme « périgyne » est plus généralement employé pour toutes les Cariceae. De plus chez les Cariceae, le mot « épillet » devrait être réservé au contenu du périgyne. Cependant, dans les flores, il est souvent remplacé par « fleur femelle » ou bien est utilisé pour désigner des ramifications secondaires de l’inflorescence.
•
•
L’épi de Carex:Les épillets sont organisés en épi. Chez Carex, on trouve trois grands types d’organisation de l’épi :
- L’inflorescence peut être composée d’un seul épi (uni-épi). L’épi porte des fleurs des deux sexes avec les fleurs mâles au sommet et les fleurs femelles à la base, il peut aussi être unisexué. Dans ce cas, les fleurs mâles et femelles peuvent être sur des plantes différentes (dioécie) (Figure 6-2).
- L’inflorescence peut être muti-épi et mono-épi, c’est à dire composée de plusieurs épis (multi-épi) qui sont chacun unisexués (mono-épi).
- l’inflorescence peut être aussi être multi-épi et hétéro-épi, c’est à dire composée de plusieurs épis chacun composé de fleurs carpellées et staminées. Dans ce cas, les fleurs carpellées peuvent être au dessus (androgyne) ou au dessous des fleurs staminées (gynécandre).
La position respective des fleurs mâles et femelles sur l’inflorescence permet dans la majorité des cas une identification rapide des sous-genres. Ainsi le type uni-épi est souvent caractéristique du sous-genre Psyllophora (Figure 6-1), le type multi-épi mono-épi est caractéristique du sous-genre Carex (Figure 6-3) et le type multi-épi hétéro-épi gynécandre est caractéristique des sous-genres Vigneastra (Figure 6-4) et Vignea (Figure 6-5). Cependant certaines espèces ne se plient pas à cette classification par le type d’inflorescence, elles sont la preuve de la plasticité du type d’inflorescence dans le genre.
La tige fertile est toujours saisonnière et meurt après fructification ou dispertion des fruits.
•
•
Fleur staminée :La fleur mâle est nue, sans périgyne (ou utricule) et consiste en trois étamines placées dans l’axe de l’écaille (Figure 5). Les filaments de l’anthère sont longs, fins et principalement libres à l’exception de quelques espèces où ils sont fusionnés. Le connectif se prolonge souvent au delà des anthères en apicule. Les anthères sont basifixes et sont à déhiscence introrse ou latrorse. Bien que les autres angiospermes subissent une méiose post-réductionnelle, les Cyperaceae ont une méiose pré-réductionnelle (c’est à dire que les chromatides soeurs ségrégent au cours de la première division de la méiose et les chromosomes homologues ségrégent lors de la seconde division). Ce phénomène de division pré-réductionnelle est souvent associé à la présence de centromères diffus (Battaglia & Boyes, 1955). La microsporogénèse est simultanée, les quatre microspores sont retenues dans une paroi commune. Trois microspores dégénèrent, donc un seul grain de pollen est produit par cellule mère de microspore (Brown & Lemmon, 2000) ; le pollen produit est caractéristique et connu sous le nom de « pseudomonade ». Ce type de formation du pollen se rencontre aussi dans la tribu Styphelieae (Epacridaceae) (Brown & Lemmon, 2000). Le grain de pollen des
Carex et plus largement des Cyperaceae est trinucléé, il est en forme de poire avec une
aperture distale et une lacune latérale (ce qui est seulement connu chez les Cyperaceae) (Erdtman, 1952).
Figure 5. Morphologie des organes floraux.
1 2 3 4
5 6 7
b
1- fleur mâle protégée par une écaille; 2-section longitudinale d’un périgyne montrant une fleur femelle; 3-fleur femelle; 4- achène (fruit); 5-périgyne (a-corps, b-bec); 6-écaille; 7-bractée
•
•
Fleur carpellée:La fleur carpellée est entourée par le périgyne (Figure 5-2). Bien que chez les Cariceae, le périgyne soit généralement une structure membraneuse ouverte protégeant les fleurs mâles et femelles ; le périgyne de Carex enveloppe seulement la fleur femelle avec son axe (le rachilla) (Kükenthal, 1909).
L’ovaire peut être bi- ou tri-carpellé avec placentation basale. Dans les carpelles, les ovules sont crassinucellés et anatrope. Suivant le nombre de carpelles, les espèces de Carex peuvent avoir deux ou trois stigmates au sommet du stylode qui est fusionné dans sa partie basale en un style unique. Cette base épaissie du style peut être parfois gardée sur le sommet de l’achène (Duhamel, 2004). Au cours de la phase réceptrice les stigmates n’ont pas de sécrétion fluide ce qui caractérise plus largement la pollinisation par le vent.
•
•
Périgyne:Le périgyne est une structure complexe composée d’un corps et d’un bec (Figure 5-5b et 5-5a). Il a une variabilité morphologique très importante avec des adaptations diverses alors que l’achène a une structure morphologique très stable au cours de l’évolution. Chez Carex, le périgyne a principalement un rôle de protection de l’achène (ex. poils pour empêcher les diptères de pondre dans l’achène) et aussi lors de la dispersion quand le périgyne reste attaché à l’achène (Leck & Schutz, 2005).
Le corps du périgyne est membraneux, il enveloppe le stipe, le rachilla et le carpelle. Morphologiquement, il est dérivé d’une prophylle. Il est présent chez toutes les Cariceae, il a une forme de sac fermé chez Carex (appelé utricule). Il est structuré par deux nervures de tissus vasculaires qui irriguent le bec du périgyne. Parfois la structure est complétée par des nervures additionnelles (Zomlefer, 1994).
Le bec du périgyne est une structure complexe composée de deux dents qui peuvent avoir des caratéristiques morphologiques très différente selon l’espèce (ex. longueur, rugosité, etc.).
•
•
Glume/écaille, bractée de l’épi:L’écaille est présente dans les fleurs staminées et carpellées (Figure 5-6 et 5-7). L’écaille peut être considérée comme la bractée de l’épillet. Elle peut avoir différent rôle dans les fleurs carpellées et staminées. Chez les fleurs carpellées l’écaille peut couvrir l’utricule alors que chez les fleurs staminées, elle est la seule protection des anthères. Elle est organisée avec une nervure centrale et deux ailes membraneuses latérales. La nervure et les ailes membraneuses ont souvent des couleurs contrastées. L’écaille a des formes très diversifiées, elle peut être très longue et étroite à courte et large suivant les espèces. L’écaille est souvent caduque après maturation du fruit.
•
•
Morphologie du fruit:Le fruit est un achène (Figure 5-4), il est sec et indéhiscent. Suivant le nombre de carpelles, les fleurs bicarpellées ou tricarpellées se développent respectivement en achène biconvexe ou trigone. L’achène inclus un embryon non-cylindrique particulier à Carex (Alexeev, 1988). Cet embryon est entouré par un endosperme d’amidon et n’a pas de chlorophylle. Bien que l’achène soit une structure particulièrement stable, le fruit présente des caratéristiques propre selon son mode de dispersion (Annexe B) due aux différentiations post-fécondation du périgyne (ex : élaiosome, fruit charnu de Carex baccans).
Figure 6. Types d’inflorescences chez Carex.
1- mono-épi, fleurs mâles au sommet et fleurs femelle à la base de l’épi (Carex sous-genre Psyllophora); 2- mono-épi, fleurs femelles et mâles sur des plantes séparées (Carex sous-genre Psyllophora); 3- multi-épi et homo-épi, épis mâles au sommet (Carex sous-genre Carex) et épis femelles à la base; 4- multi-épi et hétéro-épi, fleurs mâles à la base de l’épi et fleurs femelles au sommet (Carex sous-genre Vignea); 5- multi-épi et hétéro-épi, fleurs mâles au sommet de l’épi et fleurs femelles à la base (Carex sous-genre Vignea, Carex sous-genre Vigneastra).
c) Différences morphologiques entre Carex et ses genres satellites.
Les Cariceae sont habituellement divisées en quatre genres Carex, Kobresia,
Schenoxiphium et Uncinia qui ont une macromorphologie végétative très uniforme (Metcalfe,
1969). La délimitation générique est basée sur les organes se développant à l’intérieur du périgyne (Figure 6-1 voir aussi Starr et al., 2004).
Chez Carex L., la fleur femelle est toujours entièrement incluse dans le périgyne (Figure 7-4). Le rachilla peut être légèrement protubérant comme chez C. microglochin de manière similaire à la morphologie retrouvée chez Uncinia.
1 2 3 4 5 ♀
♂
♂
♂
♂
♂
♀ ♀ ♀ ♀Figure 7. Diagrammes floraux des Cariceae.
1-Schoenoxiphium; 2-Kobresia; 3-Uncinia, a-fleur mâle, b-fleur femelle; 4-Carex, c-fleur mâle, d-fleur femelle.
Kobresia Willd. (50 spp.) a un rachilla droit et aplati qui peut porter une fleur mâle (Figure
7-2).
Schoenoxiphium Nees (17 espèces) a un rachilla quelquefois bien développé qui s’étend
fortement à l’extérieur du périgyne. Il peut porter quelques écailles avec des fleurs mâles axillaires (Figure 7-1).
Uncinia Pers. (50 spp.) est caractérisé par un rachilla se prolongeant fortement au delà du
sommet du périgyne et formant une structure en forme de crochet (Figure7-3). Stigma Etamine Périgyne Ovaire Stipe Rachilla Ecaille le
Schoenoxiphium Kobresia Uncinia Carex Bracté/Ecaille Bractée/Ecailles cale Ecaille Rachis Etamine Périgyne Ovaire 1 2 3 4 a. b. c. a d.
4. Evolution de la fleur chez les Cyperaceae et les Cariceae.
a) Evolution des fleurs chez les Cyperaceae.
Bien que les fossiles les plus anciens de Carex datent de l’Eocène (Cusset, 1996), ils sont d’une faible utilité dans l’interprétation de l’évolution florale chez les Cyperaceae parce qu’ils sont fragmentaires et qu’ils ressemblent très fortement aux groupes modernes. La morphologie uniforme des parties végétatives de la plante ainsi que les fleurs fortement réduites rendent difficile la déduction de schémas d’évolution florale. La plupart des théories de l’évolution des Cyperaceae dérivent d’études de la morphologie et du développement des épis. L’inflorescence pollinisée par le vent a des fleurs mâles avec une production abondante de pollen non collant dans des anthères dirigées vers l’extérieur et des fleurs femelles avec des stigmates secs (Endress, 1994). Néanmoins, quelques espèces de Cyperaceae attirent les insectes pollinisateurs (Dahlgren et al., 1985). Ils sont attirés par des inflorescences de couleur blanches et contractées en têtes denses (ex. Rhynchospora section Dichromena, (Leppik, 1955); Cymophyllus fraseri, (Thomas, 1984)). La pollinisation passive par des insectes voleurs de pollen est occasionnelle (observation pers.). Il est donc particulièrement difficile de décider de la morphologie florale ancestrale du groupe.
Les caractères floraux les plus anciens des fleurs de Cyperaceae sont particulièrement durs à définir et particulièrement l’évolution vers des fleurs unisexuées. Deux écoles s’opposent sur le groupe actuel qui aurait gardé les caractères les plus ancestraux car les fleurs unisexuelles ne présentent apparemment aucun vestige du sexe opposé. Certains auteurs pensent que les espèces tropicales de plaine de la sous-famille Mapanioideae présentent les caractères floraux les plus ancestraux de la famille, d’autres proposent Scirpus (sous-famille des Cyperoideae).
Dans le premier cas, où les Mapanioideae auraient des caractères floraux ancestraux. Ceux-ci se rencontrent dans les inflorescences contractées appelées pseudanthium (Figure 8-1) qui sont composées de petites fleurs unisexuées formées par un trio de fleurs mâles composées chacune d’une anthère et d’une fleur femelle avec un seul pistil. Si le pseudanthium est la forme de base, la « fleur » de Scirpus apparemment simple avec 3 étamines et un seul ovaire est en réalité un pseudanthium composé de quatre fleurs (trois fleurs mâles et une fleur femelle, voir Figure 8-2). Cette hypothèse introduit une forte complexité de la morphologie florale et a peu de support.
Figure 8. Diagramme floral de fleurs ancestrales. 1-Pseudanthia de Mapanioidées; 2- “fleur” de Scirpus
Dans la seconde hypothèse, Scirpus possèderait des caractères floraux ancestraux. Sa fleur n’est pas un pseudanthium mais est composée de trois étamines et d’un carpelle. De plus, Scirpus possède beaucoup d’épis floraux portant des fleurs à l’aisselle de chaque bractée sauf celle située au sommet de l’inflorescence qui ne porte pas de fleurs. De ce type de base, toutes les autres lignées de la famille auraient dérivé par réduction du nombre de fleurs, par stérilisation de fleurs et par l’évolution vers l’unisexualité par la perte d’étamines ou de pistil dans la fleur. C’est cette théorie qui est généralement la plus acceptée chez les cypérologues.
b) Evolution de la fleur chez les Cariceae.
L’épillet des Cariceae est fortement réduit et spécialisé, il porte toujours des fleurs actinomorphiques sans périanthe. Chez les Cariceae, les fleurs sont toujours unisexuées. La fleur femelle est toujours portée à l’intérieur du périgyne qui est partiellement ou complètement fermé. La fleur mâle est toujours à l’aisselle d’une écaille. Celle-ci peut être portée sur l’axe de l’épillet, ou sur le rachilla se prolongeant au delà de l’utricule.
Egorova (1999) a interprété la fleur de Carex comme ayant la morphologie florale la plus dérivée. Elle a proposé une hypothèse pour la réduction de la fleur mâle et de la fleur femelle chez Carex. Les fleurs mâles et femelles proviennent de la réduction d’un épillet, cependant, elles seraient fondamentalement différentes en raison de leur origine. Les fleurs mâles viendraient de la fleur terminale d’un épi, les fleurs femelles viendraient quant à elles d’une fleur basale d’un épillet. La fleur femelle aurait été enveloppée par la prophylle de l’inflorescence devenue par la suite périgyne. De plus, l’axe ancestral de l’épillet aurait subsisté transformé en rachilla qui est toujours présent chez les fleurs femelles (Reznicek, 1990).
En raison du manque de résolution des arbres phylogénétiques, les caractères floraux ancestraux des Cariceae sont encore mal connus et pourraient probablement être similaires aux caractères floraux de Schoenoxiphium ou de Carex. Dans ce dernier cas, les caractères floraux de Schoenoxiphium seraient une complexification subséquente de la fleur.
B. Introduction to Sedges (Carex s.l). 1. Classification history.
a) Classification of the family.
Since Jussieu (1789) and Lestiboudois (1819), subfamily and tribe are the two suprageneric taxonomic ranks dominating infra-familial classification of Cyperaceae (Goetghebeur, 1985). In 1909, Kükenthal gave the first complete taxonomic work of the whole family and classified it into three subfamilies. This work was completed by MacKenzie (1931) who divided Cyperaceae into five tribes (Table 1).
Table 1. Suprageneric classification of Cyperaceae.
Kükenthal (1909) Mackenzie (1931, 1935) Dahlgren et al. (1985) Mabberley (1993) a. Scirpoideae b. Rhynchosporoideae c. Caricoideae 1. Scirpeae 2. Rynchosporeae 3. Cypereae 4. Sclerieae 5. Cariceae a. Scirpoideae b. Rhynchosporoideae c. Mapanoideae d. Scleroideae e. Caricoideae a. Cyperoideae b. Rhynchosporoideae c. Caricoideae
Bruhl (1995) Goetghebeur (1998) Simpson et al. (2007)
a. Caricoideae 1. Cariceae 2. Schoeneae 3. Trilepideae 4. Sclerieae 5. Bisboekelereae 6. Rhynchosporeae 7. Hypolytreae b. Cyperoideae 1. Cypereae 2. Scirpeae 3. Abildgaardieae 4. Arthrostylideae a. Mapanioideae 1. Hypolytreae 2. Chrysitricheae b. Cyperoideae 1. Cypereae 2. Fuireneae 3. Eleocharideae 4. Abildgaardieae 5. Scirpeae 6. Dulichieae 7. Schoeneae c. Sclerioideae 1. Cryptangieae 2. Trilepideae 3. Sclerieae 4. Bisboeckelereae d. Caricoideae 1. Cariceae a. Mapanioideae 1. Hypolytreae 2. Chrysitricheae b. Cyperoideae 1. Cypereae 2. Fuireneae 3. Eleocharideae 4. Abildgaardieae 5. Scirpeae 6. Dulchieae 7. Schoeneae 8. Cryptangieae 9. Trilepideae 10. Sclerieae 11. Bisboeckelereae 12. Cariceae