Effets de fractions d'écorce de cannelle sur Candida
albicans et les cellules épithéliales buccales
Mémoire
Marie-Pier Veilleux
Maîtrise en microbiologie - avec mémoire
Maître ès sciences (M. Sc.)
Effets de fractions d'écorce de cannelle sur
Candida albicans et les cellules épithéliales buccales
Mémoire
Marie-Pier Veilleux
Sous la direction de :
Résumé
Candida albicans est un mycète pathogène opportuniste associé à des infections superficielles et systémiques, en particulier chez les individus immunologiquement ou médicalement compromis. C. albicans est notamment responsable de candidoses buccales et de stomatites prothétiques. De plus, les lésions buccales ulcéreuses (mucosites buccales) résultant de traitements de chimiothérapie et de radiothérapie sont sensibles aux infections secondaires à C. albicans. Ce mycète
possède une multitude de facteurs de virulence lui permettant de coloniser l’hôte,
de déjouer les défenses du système immunitaire et d’induire un phénomène
inflammatoire. Actuellement traitées avec des antifongiques tels que le nystatin et le fluconazole, les infections à C. albicans sont de plus en plus difficiles à guérir, en raison de l’augmentation de la résistance du pathogène à ces molécules. Le but du projet de recherche consiste à évaluer dans un premier temps les effets de l’huile essentielle et des proanthocyanidines de cannelle sur la croissance et les principaux facteurs de virulence de C. albicans. En second lieu, les effets des mêmes composés sur les cellules épithéliales buccales ont été étudiés.
Abstract
Candida albicans is an opportunistic pathogenic fungus associated with superficial and systemic infections, particularly in immunologically or medically compromised individuals. C. albicans is particularly responsible for oral candidiasis and denture stomatitis. In addition, ulcerative oral lesions (oral mucositis) resulting from chemotherapy and radiotherapy treatments are susceptible to secondary infections by C. albicans. This fungus has a multitude of virulence factors allowing it to colonize the host, to counteract the defenses of the immune system and to induce an inflammatory response. Currently treated with antifungals such as nystatin and fluconazole, candidiasis infections are increasingly difficult to cure, due to the increased resistance of the pathogen to these molecules. The purpose of the research project was to evaluate the effects of cinnamon essential oil and proanthocyanidins on the growth and major virulence factors of C. albicans. Moreover, the effect of the same compounds on oral epithelial cells was investigated.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures ... vi
Liste des tableaux ... vii
Liste des abréviations, sigles, acronymes ... viii
Remerciements ... ix
Avant-propos ... x
Introduction ... 1
1) Pathologies buccales à Candida albicans ... 2
1.1) Candidoses buccales ... 2
1.2) Stomatites prothétiques ... 3
1.3) Mucites buccales ... 3
1.3.1) Pathogenèse de la mucite buccale ... 5
1.4) Traitements... 7
2) Muqueuse buccale et jonctions serrées... 8
3) Candida albicans ... 9 3.1) Généralités ... 9 3.2) Facteurs de virulence ... 9 3.2.1) Dimorphisme. ... 10 3.2.2) Formation de biofilms. ... 10 3.2.3) Activité hydrolytique ... 11
3.2.4) Interactions de C. albicans avec les cellules épithéliales ... 11
4) Cannelle et ses composantes ... 13
4.1) Généralités ... 13
4.2) Genre Cinnamomum ... 14
4.3) Huiles essentielles ... 14
4.4) Polyphénols ... 15
5) Propriétés bénéfiques des polyphénols et huiles essentielles dans le contexte de la santé buccodentaire ... 15
5.1) Candidose buccale ... 16
5.2) Carie dentaire ... 16
5.4) Halitose ... 18
6) Hypothèse et objectifs ... 20
6.1) Hypothèse ... 20
6.2) Objectifs ... 20
Chapitre 1 Effects of cinnamon bark fractions on Candida albicans and oral epithelial cells ... 21
Résumé ... 21
Abstract ... 22
1) Introduction ... 24
2) Materials and methods ... 26
2.1) Cinnamon fractions ... 26
2.2) C. albicans and culture conditions ... 26
2.3) Determination of the minimum inhibitory and minimum fungicidal concentrations ... 26
2.4) Membrane permeability ... 27
2.5) Biofilm formation and killing ... 27
2.6) Epithelial cell culture conditions and viability assays ... 28
2.7) Adherence to epithelial cells ... 28
2.8) Oral epithelial barrier integrity ... 29
2.9) Secretion of cytokines by oral epithelial cells ... 30
2.10) Statistical analysis ... 30 3) Results ... 31 4) Discussion ... 42 References ... 46 Discussion et conclusion ... 50 Bibliographie ... 55
Liste des figures
IntroductionFigure 1. Pathogenèse de la mucite buccale ... 6 Figure 2. Candida albicans ... 9 Figure 3. Schéma représentant les différentes voies de signalisation déclenchées par les deux morphologies de C. albicans. ... 13
Chapitre 1
1 Figure 1. Effect of cinnamon bark oil on the membrane integrity of C. albicans ATCC 28266. ... 32 2 Figure 2. Effect of Cinnulin PF® (panel A) and cinnamon bark oil (panel B) on the growth and biofilm formation of C. albicans ATCC 28266. ... 33 3 Figure 3. Scanning electron micrographs of biofilms formed by C. albicans ATCC 28366 grown in the absence (panels A and B) or presence of 62.5 µg/mL of
Cinnulin PF® (panels C and D) ... 34 4 Figure 4. Effect of cinnamon bark oil on the viability and desorption of a C.
albicans ATCC 28366 biofilm.. ... 35 5 Figure 5. Effect of Cinnulin PF® on the adherence of C. albicans ATCC 28366 to GMSM-K oral epithelial cells.. ... 36 6 Figure 6. Effect of Cinnulin PF® (panel A) and cinnamon bark oil (panel B) on the viability of two oral epithelial cell lines (B11 and GMSM-K).. ... 38 7 Figure 7. Effect of Cinnulin PF® (panel A) and cinnamon bark oil (panel B) on the integrity of the epithelial barrier (B11 cell line).. ... 39 8 Figure 8. Effect of Cinnulin PF® on TNF-α-induced IL-6 (panel A) and IL-8 (panel B) secretion by oral epithelial cells (GMSM-K cell line).. ... 41
Liste des tableaux
IntroductionTableau 1. Échelle de classification des mucites buccales selon l’Organisation
mondiale de la santé……….…4
Chapitre 1
Table 1. Minimum inhibitory concentrations (MIC) and minimum fungicidal concentrations (MFC) of cinnamon fractions against C. albicans……….………….31
Liste des abréviations, sigles, acronymes
ADN Acide désoxyribonucléique
Als3 Agglutinin-like protein 3 precursor
ALS Agglutinin-like sequence
CMF Concentration minimale fongicide
CMI Concentration minimale inhibitrice
EGF Facteur de croissance épidermique
ERK1/2 Extracellular signal-regulated protein kinase 1 and 2
HSP Protéine de choc thermique
Hwp1 Hyphal wall protein 1
JNK c-Jun N-terminal kinase
MAPK Mitogen-activated protein kinase
MR Récepteur de mannose
NF-κB Facteur nucléaire-κB
PAMP Motifs moléculaires associés aux pathogènes
PI3K Phosphoinositide 3-kinase
PRR Récepteurs de reconnaissance de motifs moléculaires
ROS Espèces réactives de l'oxygène
SAP Aspartyl protéase sécrétée
STAT3 Signal transducer and activator of transcription 3
TEER Transepithelial electrical resistance
TLR Récepteur toll-like
Remerciements
Je tiens à exprimer ma gratitude en premier lieu à mon directeur de recherche, le Dr Daniel Grenier, pour m’avoir permis de me joindre à son équipe de recherche. Sa disponibilité, sa patience et sa rigueur scientifique ont permis de me guider tout au long de ma maîtrise. Je tiens à souligner également son soutien énorme qui a rendu possible pour moi de saisir une opportunité en or pour ma carrière.
Mes remerciements vont également à mes collègues de laboratoire, que je peux maintenant appeler mes amis, pour leur aide technique, leur transfert de connaissances ainsi que leur soutien tout au long de ces deux dernières années. À Ève, Philippe, Jabrane, Katy et Gaëlle qui ont su alimenter ma réflexion scientifique et divertir mon esprit au besoin. Un merci tout particulier à Amel Ben
Lagha ainsi qu’à Geneviève LeBel, qui m’ont accompagnée du début jusqu’à la
toute fin, qui ont été d’excellentes mentors et exemples de persévérance et qui ont largement contribué à mon cheminement.
Je veux exprimer ma reconnaissance à mes parents, qui m’ont épaulée et
encouragée lors de l’ensemble de mes années d’études et qui ont toujours cru en moi. Un grand merci à mon copain qui m’a grandement appuyé dans les moments plus difficiles et qui a su me motiver à persévérer.
Finalement, j’aimerais remercier mon comité d’encadrement, composé, en plus de mon directeur de recherche, de la Dre Fatiha Chandad et du Dr Michel Frenette, pour leur soutien.
Avant-propos
Ce présent mémoire est présenté comme exigence partielle de la maîtrise en microbiologie de l’Université Laval. Il comprend un article intitulé « Effects of cinnamon bark fractions on Candida albicans and oral epithelial cells » qui a été soumis le 27 mai 2019 à la revue BCM Complementary and Alternative Medicine. L’article est signé par deux auteurs : Dr Daniel Grenier, mon directeur de maîtrise
et moi-même, comme auteure principale. J’ai réalisé l’entièreté des
expérimentations de mon projet, sous la supervision du Dr Grenier. J’ai également
écrit le premier jet de l’article, que le Dr Grenier a corrigé et formaté pour
publication. Le Dr Grenier est professeur titulaire à la Faculté de médecine dentaire de l’Université Laval et chercheur au sein du Groupe de recherche en écologie buccale (GREB). Ses secteurs d’activités concernent entre autres la
microbiologie buccale, les maladies parodontales, le contrôle de l’infection, les
interactions hôtes-pathogènes lors d’infections buccales et les polyphénols de
Introduction
Un vieil adage mentionne que la santé de notre bouche est le miroir de notre santé. Ce dicton ne ment pas. De nombreuses affections buccales et dentaires peuvent avoir des incidences sur le bien-être ainsi que sur la santé globale d’un
individu. D’ailleurs, des soins orthodontiques rudimentaires et des plombages
grossiers ont été retrouvés sur la dentition de personnes ayant vécu 8 000 avant
Jésus-Christ, démontrant ainsi que l’intérêt médical envers la cavité buccale était
déjà présent [1]. Nous sommes aujourd’hui conscients de toute la complexité de la
santé bucco-dentaire. Ainsi, plusieurs spécialités médicales s’y consacrent entièrement.
La cavité buccale est un environnement propice au développement d’une flore
microbienne complexe et diversifiée [2]. Les muqueuses buccales et linguales
abritent principalement des bactéries dites aérobies, alors que les sulcus dentaires
sont plutôt colonisés par des bactéries anaérobies [2]. Plusieurs de ces
microorganismes commensaux peuvent toutefois exprimer un pouvoir pathogène et devenir nuisibles pour l’homéostasie de la bouche, notamment lorsque l’individu devient immunosupprimé. Les causes les plus fréquentes d’immunodépression sont les maladies immunosuppressives et les traitements anticancéreux.
Les cancers font partie des maladies qui marqueront le 21e siècle. Bien que les
traitements aient progressé au fil des ans, ils sont incontestablement reconnus pour leurs nombreux effets secondaires; perte de cheveux, nausée,
vomissements, fatigue [3]. Un effet secondaire légèrement moins connu, mais
aucunement banal et tout aussi fréquent est la mucite. Ces dommages causés par les traitements anticancéreux peuvent affecter plusieurs types de muqueuses,
comme les muqueuses intestinales ou encore celles de la cavité buccale [3,4]. Ce
sont les infections liées aux muqueuses de la cavité buccale qui nous intéressent
particulièrement dans le cadre de ce mémoire [4,5], en particulier celles causées par
1) Pathologies buccales à Candida albicans
1.1) Candidoses buccales
La candidose est une infection provoquée par les levures du genre Candida.
C. albicans est l’espèce la plus souvent associée aux candidoses buccales.
Normalement avirulent chez le sujet en santé et immunocompétent, C. albicans est un commensal qui fait partie entre autres de la flore normale de la cavité buccale,
du tractus vaginal et intestinal [6,7]. C’est un mycète opportuniste qui peut devenir
pathogène lors d’un changement chez l’hôte, tel qu’un déséquilibre du potentiel
hydrogène (pH), un changement nutritionnel ou encore la prise d’un
antibiotique [8,9]. Les nourrissons en sont souvent atteints en raison de leur système
immunitaire qui n’est pas arrivé complètement à maturité [10]. Ces infections
fongiques sont souvent superficielles et plutôt localisées, mais peuvent également
causer des septicémies sévères et des chocs septiques lorsqu’il y a une invasion
des tissus. Ce stade plus sévère est responsable d’un haut taux de mortalité
pouvant atteindre 30-70% [11–13]. On retrouve fréquemment une colonisation par C.
albicans dans le cas de patients immunodéprimés, comme ceux recevant des traitements de chimiothérapie ou chez les personnes atteintes du virus de
l’immunodéficience humaine [11,14]. L’usage de corticostéroïdes, qui ont un effet
immunosuppresseur localisé, peut également mener à une candidose buccale [15].
La candidose buccale est reconnaissable par l’apparition de plaques blanchâtres
sur les surfaces buccales comme la langue, les joues intérieures, les gencives et le palais. La présence de lésions douloureuses et de fendillement aux commissures
des lèvres sont également des symptômes distinctifs [16,17]. De plus, cette infection
peut amener des difficultés à manger ou encore une perte de goût. Lorsque l’infection devient invasive, elle peut causer de la fièvre, une baisse de la pression sanguine et de la production d’urine ainsi qu’un souffle cardiaque. La candidose systémique peut mener jusqu’à l’arrêt du fonctionnement des organes, ce qui
1.2) Stomatites prothétiques
La stomatite prothétique est une inflammation ainsi qu’un érythème des tissus
chez les porteurs de prothèses dentaires partielles ou complètes amovibles. Il s’agit de l’affection buccale la plus commune chez les sujets édentés avec une
fréquence qui varie entre 10 et 75 % [19]. La grande variation dans l’estimation de
sa fréquence est probablement due au fait qu’elle soit sous-diagnostiquée
puisqu’elle est souvent asymptomatique. En effet, seulement une minorité ressent des symptômes comme de la douleur, des démangeaisons, une sensation de brûlure ou encore un enflement des muqueuses. Plusieurs facteurs étiologiques sont associés à la stomatite prothétique, quoiqu’elle demeure encore mal comprise. Un traumatisme des muqueuses causé par à une prothèse dentaire mal
ajustée, une xérostomie, ainsi qu’une hygiène buccale et prothétique déficiente
sont souvent identifiés. Également, lorsque la prothèse est portée de nuit, la formation de biofilm ainsi que la diminution du flux salivaire empêchent l’oxygénation optimale des muqueuses, ce qui diminue la résistance de l’hôte à l’invasion par les microorganismes buccaux. À cet égard, il est souvent rapporté dans la littérature que C. albicans est un facteur étiologique important de cette affection, puisqu’il s’agit du microorganisme le plus souvent isolé des personnes atteintes. De plus, les biofilms de C. albicans sont capables d’adhérer autant à des substances organiques et inorganiques, comme les muqueuses buccales et les
prothèses dentaires [20–23].
1.3) Mucites buccales
Les mucites, également appelées mucosites, sont des stomatites qui entraînent
une inflammation des muqueuses oropharyngées souvent accompagnée d’une
douleur et parfois d’ulcérations (figure 1) [24]. Elles sont, pour la plupart,
considérées comme un effet secondaire chez les patients recevant des traitements
de chimiothérapie [25,26]. Les personnes souffrant d’un cancer dans la région de la
tête et du cou en sont pratiquement toutes atteintes; environ 89 % des patients traités par chimiothérapie combinée avec de la radiothérapie, et 40 % des patients
peuvent différer dans le cas où le patient ne recevrait qu’un seul des deux
traitements [28]. La chimiothérapie est administrée de façon systémique alors que la
radiothérapie agit localement sur une zone précise, ce qui peut impliquer des voies biologiques légèrement différentes. Aussi, l’incidence des mucites peut augmenter de façon significative au cours des différents cycles de traitements puisque ses
effets sont cumulatifs [26].
La mucite peut résulter de deux types d’agressions différentes. La première est l’agression directe sur les cellules des muqueuses par des agents cytotoxiques,
comme les anticancéreux, incluant l’irinotécan [29,30], le fluorouracil [31] ou le
panitumumab, un inhibiteur du récepteur du facteur de croissance épidermique
(EGF) [24,32]. Le deuxième type d’agression, cette fois-ci indirect, est dérivé de la
neutropénie et de la surinfection locale par des agents viraux, fongiques ou
bactériens [24]. Ces patients, immunodéprimés et affaiblis par ces traitements
toxiques, sont plus susceptibles de voir la stomatite primaire infectée par un agent pathogène opportuniste, dont C. albicans. Les symptômes de la mucite sont très variables. Certains patients pourraient ne présenter aucun signe clinique alors que d’autres peuvent ressentir des sensations de brûlure, de picotement ou encore une
altération du goût [33]. L’Organisation mondiale de la santé a mis au point une
échelle de classification des mucites buccales qu’elle a répartie en 5 catégories [34].
Tableau 1. Échelle de classification des mucites buccales selon l’Organisation mondiale de
la santé [34]
Grade Critères
0 Aucune mucite
1 Érythème et douleur
2 Ulcère; capacité à manger solide
3 Ulcère; nécessite un régime liquide
4 Ulcère; alimentation non possible
Cette classification est la plus largement utilisée et se base sur la présence de
lésions, le seuil de douleur ainsi que la capacité du patient à s’alimenter. Plus le
de la difficulté à s’alimenter. Cette échelle permet entre autres de diriger les cliniciens vers les traitements pour une prise en charge optimale.
1.3.1) Pathogenèse de la mucite buccale
À l’état d’homéostasie, la muqueuse se renouvelle constamment. Les cellules basales produisent de nouvelles cellules qui migrent vers le haut pour aller remplacer celles se trouvant au niveau de la couche superficielle. La durée de ce remplacement varie entre 5 et 14 jours.
Lorsque le patient entreprend les traitements de chimiothérapie ou de radiothérapie, la première phase de la pathogenèse s’enclenche. Les agents
anticancéreux ciblent principalement les cellules à division rapide, c’est-à-dire
autant les cellules cancéreuses que les cellules épithéliales. Ces dommages
directs à l’acide désoxyribonucléique (ADN) provoquent la mort cellulaire, soit
mitotique ou apoptotique, ce qui empêche l’épithélium de se renouveler [35]. Ainsi,
la muqueuse buccale s’amincit lentement, ce qui mènera, à terme, à l’ulcération
des tissus [36,37].
La phase d’initiation est également caractérisée par un stress oxydatif causé par la
production d’espèces réactives de l’oxygène (ROS) [38]. La chimiothérapie, la
radiothérapie ainsi que le stress oxydatif amorcent alors une série de cascades de signalisations que l’on appelle la phase de réponse primaire (phase II). Les ROS induisent la transcription de plusieurs facteurs cruciaux dans la réponse inflammatoire, comme le facteur nucléaire-κB (NF-κB) ainsi que le Signal transducer and activator of transcription 3 (STAT3), tous deux associés à l’activation de gènes codant pour des cytokines inflammatoires menant à des
dommages tissulaires [35,38]. Physiologiquement, les deux premières phases de la
pathogenèse de la mucite ont des effets quasi immédiats, alors que les signes
cliniques peuvent prendre de quatre à cinq jours avant de faire leur apparition [35].
La phase III, l’amplification, est directement liée à la précédente. De nombreuses molécules impliquées dans la réponse primaire ont une capacité de rétroaction
positive et négative et peuvent ainsi influencer la réponse tissulaire. Les cellules du système immunitaire libèrent des médiateurs inflammatoires tels que le facteur de nécrose tumorale alpha (TNF-α), qui peut amplifier l’activation de NF-κB et initier d’autre voie, de signalisation ce qui déclenche une cascade inflammatoire et un
effet boule de neige [36,39].
L’accumulation de tous ces facteurs entraîne finalement la phase la plus critique autant pour le patient que son clinicien. La phase d’ulcération résulte en un bris de la barrière épithéliale. C’est la phase la plus symptomatique. Les ulcères peuvent traverser l’épaisseur complète de l’épithélium. De plus, la salive, qui joue des rôles essentiels dans la protection des tissus oraux par ses propriétés antibactériennes
et antifongiques, voit son débit diminué par les traitements du cancer [36,40,41]. La
variété de la flore microbienne additionnée à l’immunodéficience des patients
provoque fréquemment l’infection des plaies par des microorganismes
pathogènes, comme la levure opportuniste C. albicans.
1.4) Traitements
Les traitements des candidoses buccales sont basés sur l’utilisation
d’antifongiques topiques ou systémiques et doivent être prescrits par le clinicien. Les patients asthmatiques qui utilisent des inhalateurs de cortisone peuvent se rincer la bouche après l’inhalation ou encore protéger les muqueuses pendant le traitement pour éviter que les muqueuses soient exposées trop longtemps aux corticoïdes. Pour les stomatites prothétiques infectées par C. albicans, des mesures strictes d’hygiène doivent être instaurées (nettoyage mécanique et chimique de la prothèse et de la bouche). De plus, éviter le port de la prothèse la nuit et l’utilisation de solutions de trempage nettoyantes et désinfectantes est recommandée. Un ajustement adéquat de la prothèse ou encore le remplacement d’une vieille prothèse par une nouvelle peut également être suggéré si l’atteinte
aux muqueuses était due à celles-ci [21].
Les traitements actuels contre les mucites portent beaucoup sur la prévention et le soulagement des symptômes. Une hygiène buccale stricte avec une brosse douce, l’évitement du tabac, des boissons alcoolisées ou acides et des mets épicés ainsi que l’implantation de rinçages avec des solutions douce (eau pure, solution physiologique, solutions de bicarbonate de soude) sont fortement suggérés.
Pendant les traitements, la prise de bains de bouche glacée ou l’usage de la
cryothérapie peut induire la vasoconstriction et ainsi diminuer le risque d’exposition de la muqueuse aux agents toxiques. Concernant la prise en charge de la douleur, les cliniciens peuvent avoir recours entre autres à des antalgiques topiques (lidocaïne, morphine) et au laser à basse énergie. D’autres agents peuvent être également administrés pour protéger au niveau cellulaire, ainsi que pour stimuler
la régénération des muqueuses [24,36,43,44]. C’est lorsque la mucite devient infectée
notamment par C. albicans que le traitement devient plus complexe.
Les molécules thérapeutiques les plus utilisées sont font partie de la classe des polyènes, comme le nystatin et l’amphotéricine B, et de la classe des azoles, comme le fluconazole. Les polyènes se lient de façon irréversible à l’ergostérol de
celle-ci. L’intégrité de la membrane est ainsi perturbée et entraîne la mort du microorganisme. Les molécules de la classe des azoles agissent quant à elles sur une enzyme du cytochrome P-450, ce qui empêche la synthèse de l’ergostérol,
une composante essentielle de la membrane cellulaire [45–48]. Cependant,
l’utilisation de ces agents antifongiques s’avère de moins en moins efficace, en
raison de l’émergence d’un grand nombre de mécanismes de résistance face à
ces molécules [49,50].
2) Muqueuse buccale et jonctions serrées
La muqueuse buccale protège les tissus sous-jacents des dommages physiques, chimiques et microbiens et contribue ainsi activement au maintien d’une santé bucco-dentaire. Outre son rôle protecteur des tissus, on lui attribue également des fonctions gustatives et sensorielles. Elle est composée d’un épithélium malpighien (pavimenteux stratifié) plus ou moins kératinisé selon sa localisation, avec un tissu conjonctif nommé lamina propria ou encore chorion. La lamina propria est
constituée de cellules, de vaisseaux sanguins et de nerfs [51]. Sur la surface
externe des lèvres, le dos de la langue, la gencive et le palais dur, on retrouve un
épithélium kératinisé [52]. La plus large partie de la muqueuse buccale est la
muqueuse bordante, qui revêt entre autres les joues, le palais mou et la face
ventrale de la langue et qui n’est pas kératinisée [53,54]. L’épithélium buccal se
renouvelle constamment. Les cellules basales se divisent puis se différencient et migrent vers le haut du tissu, comme une rotation ou communément appelé en anglais « turnover ». Le temps que nécessite cette rotation est différent selon la région et diffère si l’épithélium est kératinisé ou non; l’épithélium kératinisé prenant
plus de temps [55]. Certains éléments comme la chimiothérapie ou la radiothérapie
peuvent interférer dans ce renouvellement cellulaire. Ce type de traitement anticancéreux diminue grandement ce processus, ce qui provoque et fragilise la muqueuse. Les jonctions serrées scellent les cellules épithéliales entre elles et assurent une étanchéité. Celles-ci délimitent la frontière entre le domaine membranaire apicale et basolatérale. On y retrouve entre autres les protéines nommées claudines et occludines. Ces deux dernières molécules permettent le
rapprochement des deux membranes. Elles constituent une barrière
semi-perméable au transport paracellulaire d’ions, de soluté et d’eau [56,57]. Elles sont
dynamiques et changent de formes constamment selon ses interactions avec différents stimuli internes et externes comme les cytokines ou les
microorganismes [58]. Certains agents pathogènes comme C. albicans peuvent
altérer l’intégrité de ces jonctions, ce qui contribue au phénomène d’invasion
tissulaire [59].
3) Candida albicans
3.1) Généralités
C. albicans est une levure présente dans la flore normale humaine. On la retrouve
chez 45-65% des enfants sains et 30-55% des adultes sains [60]. Tel que mentionné
plus tôt, ce mycète commensal peut exprimer une virulence lors d’un changement chez l’hôte, comme une prise d’antibiotique, un changement nutritionnel, ou encore chez les patients immunocompromis. C. albicans est le mycète le plus souvent impliqué dans les infections fongiques chez l’humain. Sa pathogénicité peut s’expliquer par ses nombreux facteurs de virulence et sa polyvalence.
Figure 2. Candida albicans. Image de Colm (n.d.) [61]
3.2) Facteurs de virulence
Comme tout agent pathogène, C. albicans possède un vaste éventail de mécanismes lui permettant de coloniser et d’infecter son hôte. Son polymorphisme, sa capacité d’adhésion à différentes surfaces, la sécrétion de
protéases et d’hydrolases et la formation d’un biofilm font partie des facteurs de
virulence les plus importants de cette levure [62].
3.2.1) Dimorphisme
C. albicans est une levure polymorphe, c’est-à-dire qu’elle croît sous plusieurs
formes : la forme de levure bourgeonnante ovoïde, l’ellipsoïde allongé
(pseudo-hyphe) ainsi que la forme d’hyphe parallèle. [63]. Le rôle précis de chacune des
formes dans la virulence est encore en exploration. Malgré le fait qu’il y ait
présence des deux formes du mycète lors des infections, il est reconnu que C.
albicans est plus virulent sous sa forme hyphe [64]. La capacité d’adhésion,
d’invasion, ainsi que les dommages causés aux cellules épithéliales ont tous été observés comme étant plus importants lorsque C. albicans était sous sa
morphologie d’hyphes [63,65,66].
3.2.2) Formation de biofilms
Les biofilms consistent en un agrégat de microorganismes enveloppés d’une
matrice polymérique composée d’exopolysaccharides, d’acides nucléiques ainsi
que de protéines [67]. Plusieurs agents pathogènes, tel C. albicans, ont la capacité
de former des biofilms sur plusieurs types de surfaces : abiotiques comme sur des prothèses dentaires, des cathéters, ou des valves cardiaques, et biotiques telles
que les cellules épithéliales [68]. La National Institutes of Health estime qu’environ
80 % de toutes les infections microbiennes seraient causées directement ou
indirectement par la présence de biofilm [9].
De façon simplifiée, la formation de biofilm peut se résumer en trois étapes. La
première étant l’adhérence des premières cellules planctoniques à une surface.
Ensuite, les cellules prolifèrent et s’agrègent entre elles pour former une couche de base où s’ancreront les petites colonies (agrégats de cellules planctoniques). Finalement, il y aura production de la matrice extracellulaire qui viendra encapsuler
et assurer la protection des cellules de C. albicans [69]. Les infections associées
aux biofilms sont plus fastidieuses à traiter que lorsque les microorganismes sont sous leur forme planctonique, puisqu’ils ont une architecture complexe, une
expression accrue des pompes à efflux résultant en une résistance aux
antibiotiques et aux antifongiques, ainsi qu’une souplesse métabolique [68,70]. De
plus, puisque les biofilms agissent comme une communauté complexe, l’expression des gènes varie également. Ainsi, plusieurs gènes associés à ceux-ci se retrouvent exprimés, comme les gènes impliqués dans l’adhésion, la résistance
aux antimicrobiens, ainsi que la dispersion des cellules [71]. La dispersion des
cellules de levures provenant d’un biofilm mature a d’ailleurs été démontrée comme étant directement liée à la virulence. La protéine de choc thermique (HSP) Hsp90 a été récemment identifiée comme étant un élément clé dans la régulation de la dispersion des cellules du biofilm de C. albicans. De plus, cette protéine est
également requise dans la résistance aux antifongiques des biofilms [72].
3.2.3) Activité hydrolytique
C. albicans utilise deux différents mécanismes pour envahir les tissus hôtes :
l’endocytose induite ainsi que la pénétration active [73]. L’endocytose est perpétuée
par des protéines spécialisées nommées invasines exprimées à la surface des levures et servant de médiateurs afin de les lier aux cellules hôtes. C’est ce qui déclenche l’engloutissement du pathogène à l’intérieur de l’hôte. Deux invasines ont été identifiées comme jouant un rôle important, soit l’agglutinin-like protein 3
precursor (ALS3), qui jouait également le rôle d’adhésine, ainsi que Ssa1, qui fait
partie de la famille des heat shock protein 70 (Hsp70) [73,74]. De plus, C. albicans a
la capacité de sécréter des hydrolases, qui sont reconnues pour faciliter la pénétration active dans les cellules qu’il envahit. Trois classes d’hydrolases sont
connues à ce jour : les protéases, les phospholipases et les lipases [75]. Les plus
importantes sont les aspartyls protéases sécrétées (SAPs), qui regroupent 10 membres, soit SAP1 à SAP10. Leurs rôles inclus entre autres l’invasion des tissus et l’évasion de la réponse immunitaire. Dans un contexte d’invasion, ce sont les
SAPS 1-6 qui jouent un rôle prédominant [7,75,76].
3.2.4) Interactions de C. albicans avec les cellules épithéliales
C. albicans possède à sa surface un ensemble de protéines nommées adhésines, qui confèrent un pouvoir d’adhérence aux autres microorganismes, à des surfaces
abiotiques ainsi qu’aux cellules de l’hôte [70,72]. Les plus étudiées sont les agglutinin-like sequence (ALS), une famille de 8 protéines, soit les ALS1-7 et la ASL-9. Particulièrement importante, la protéine ALS-3 joue un rôle déterminant
dans l’adhésion; elle est d’ailleurs surexprimée lors d’infections buccales [77]. Une
autre adhésine importante est appelée Hyphal wall protein 1 (Hwp1). Elle sert de substrat pour les transglutaminases des mammifères et cette réaction peut lier de
manière covalente les hyphes de C. albicans aux cellules hôtes. D’ailleurs,
quelques études ont conclu qu’une mutation de cette protéine réduisait l’adhérence aux cellules épithéliales buccales en plus d’atténuer la virulence dans un modèle
de souris [78–80]. De plus, Hpl1 ainsi que ALS-3 ont aussi été identifiées comme des
contributeurs à la formation du biofilm de C. albicans [81].
Les cellules épithéliales de la muqueuse buccale sont la première ligne de défense contre C. albicans. Malgré le large éventail de réactions biochimiques qui reste à élucider, plusieurs mécanismes de défense ont été observés. La détection par l’hôte de la présence de C. albicans est médiée par les récepteurs de reconnaissance de motifs moléculaires (PRRs) tels que le récepteur de mannose (MR) et les récepteurs toll-like (TLR) 2 et 4, entre autres. Ce sont les motifs
moléculaires associés aux pathogènes (PAMPs) comme les mannans, ou les
β-glucans qui vont venir lier les PRRs. Cela permet le l’activation de plusieurs
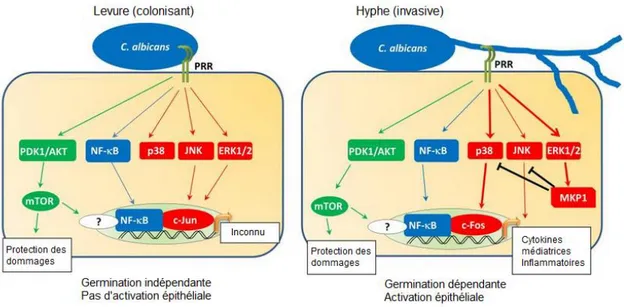
mécanismes de signalisation cellulaire tels que le mitogen-activated protein kinase (MAPK), le NF-κB, et phosphoinositide 3-kinase (PI3K). La voie PI3K est impliquée dans la protection contre le dommage induit par les hyphes. Les hyphes et les levures activent chacune les 3 voies MAPK (p38, c-Jun N-terminal kinase [JNK], extracellular signal-regulated protein kinase 1 and 2 [ERK1/2]), en plus des voies NF-κB et PI3k. Or, à l’instar des levures, les hyphes induisent la transcription d’une protéine nommée c-Fos, en plus d’activer MAPK phosphatase 1 (MKP1) depuis la ERK1/2. C’est la combinaison entre c-Fos et MKP1 qui mène à la libération des
cytokines inflammatoires (Figure 3) [82,83].
Comme C. albicans est généralement faiblement virulent lorsqu’il est sous la forme de levures, cette dernière est reconnue par le système immunitaire sans toutefois
déclencher de fortes réactions inflammatoires, à l’instar de la forme hyphe [82]. Un autre joueur clé dans la réponse immunitaire des cellules épithéliales à C. albicans est la production de peptides antimicrobiens (β-défensines), qui aident à combattre l’infection fongique, déclenchent d’autres réponses immunitaires, et participent à la
réparation de la barrière épithéliale. [82–85].
Figure 3. Schéma représentant les différentes voies de signalisation déclenchées par les
deux morphologies de C. albicans. Image adaptée de Naglik et al. (2014) [82]
4) Cannelle et ses composantes
4.1) Généralités
La cannelle est utilisée depuis des lustres dans de multiples domaines. On en trouve plusieurs références dans la Bible et les Égyptiens l’utilisaient dans leur processus d’embaumement. En médecine traditionnelle, la cannelle était utilisée comme antiémétique, antidiarrhée ainsi que comme antiflatulence. Aujourd’hui, on connaît la cannelle principalement pour son goût ainsi que son odeur distinctive
utilisée en cuisine et en aromathérapie [86]. C’est la partie intérieure de l’écorce qui
est utilisée pour aromatiser les plats, mais elle sert également, avec les feuilles et les racines, à produire les multiples huiles essentielles de cannelle.
4.2) Genre Cinnamomum
Le genre Cinnamomum fait partie de la famille des Lauraceae. Il s’agit d’arbres et d’arbustes chez lesquels les feuilles, les rameaux et l’écorce sont gorgés de
molécules aromatiques [87]. L’espèce la plus connue est Cinnamomum verum,
aussi appelée Cinnamomum zeylanicum ou cannelier de ceylan. C’est l’écorce de cette espèce précise qui donne la cannelle « authentique ». Deux autres espèces sont également utilisées en cuisine, soit Cinnamomum cassia, aussi appelée
cannelle de Chine, qui produit la casse et Cinnamomum burmannii, dont l’écorce
est aussi vendue sous le nom de cannelle, de moindre qualité cependant [87].
4.3) Huiles essentielles
Les huiles essentielles sont des substances aromatiques que l’on retrouve naturellement dans différentes parties des arbres, des plantes et des épices. Elles sont concentrées et très volatiles. Elles ont différentes utilisations telles qu’en aromathérapie, en cosmétique, en médecine traditionnelle et plusieurs autres.
Chaque huile essentielle est reconnue pour avoir ses propres propriétés [88], mais il
est connu qu’une multitude d’huiles essentielles possèdent des activités
antimicrobiennes [89]. Dans le cadre de ce projet, deux huiles essentielles seront
utilisées. L’huile essentielle de l’écorce ainsi que celle provenant des feuilles de cannelle provenant de l’espèce Cinnamomum verum sera utilisée.
Comme ces huiles sont des composés concentrés contenant plusieurs molécules différentes, les substances présentes en plus grande proportion dans ces huiles seront également utilisées. Plus spécifiquement, l’écorce de cannelle contient majoritairement une substance nommée cinnamaldéhyde, composée d’un anneau de benzène rattaché à trois chaînes de carbones, alors que ses feuilles contiennent principalement de l’eugénol, constitué d’un groupement hydroxyle, d’un groupement méthoxyle rattaché à son anneau, et qui sont tous deux des
phénylpropanoïdes [90]. L’eugénol est d’ailleurs retrouvé en grande concentration
dans le clou de girofle. Des études in vivo et in vitro réalisées sur des sujets humains et des animaux ont largement démontré des bénéfices
anti-inflammatoires, antimicrobiens et réducteurs de maladies cardiovasculaires de la
cannelle et de ses composés chimiques [91–93].
4.4) Polyphénols
Les polyphénols sont une classe de molécules présentes dans d’innombrables
substances végétales. Ils ont tous en commun la présence d’un ou de plusieurs noyaux benzéniques incluant des fonctions hydroxyles. Ils sont présents en grande quantité dans notre alimentation et sont reconnus comme d’excellents antioxydants. Les proanthocyanidines, une classe de flavonoïdes, sont des oligomères de flavon-3-ol ou des polymères liés par des liaisons interflavones. Les proanthocyanidines de cannelle ont déjà démontré des bénéfices au niveau du
contrôle de l’hypertension et du taux glycémie [94]. Ils sont également reconnus
pour leurs propriétés anti-inflammatoires, en inhibant la voie de signalisation
NF-κB [92]. De plus, les proanthocyanidines de la cannelle ont démontré des activités
antimicrobiennes vis-à-vis certaines bactéries telles que Bacillus cereus et
Staphylococcus aureus [92]. Les polyphénols de la cannelle, plus précisément la
Cinnulin PFTM qui sera utilisée dans le cadre de ce projet, a également démontré
des bénéfices dans divers champs de la santé comme dans le contrôle du taux de sucre dans le sang, dans la régulation des hormones féminines, ou encore dans la
santé gastro-intestinale [95].
5) Propriétés bénéfiques des polyphénols et huiles essentielles
dans le contexte de la santé buccodentaire
L’intérêt scientifique pour ces molécules dérivées des plantes et des fruits est certainement grandissant dans plusieurs domaines de la santé, comme la nutrition.
De nombreuses équipes de recherche se penchent sur les bienfaits d’une
consommation régulière de ces composés. Dans le domaine buccodentaire, les effets recensés touchent divers aspects des maladies qui affectent la cavité
buccale, notamment la protection des muqueuses dans le cas d’un cancer, la
diminution de l’halitose, la protection contre les caries, contre les biofilms et plus
démontré que les huiles essentielles et les polyphénols pouvaient être non seulement utiles dans la gestion de la santé buccodentaire, mais également dans la santé globale.
5.1) Candidose buccale
Divers extraits de plantes (polyphénols ou huiles essentielles) se sont avérés efficaces sur plusieurs des facteurs de virulence de C. albicans. Une inhibition de la croissance de C. albicans a été démontrée à l’aide de la technique de
microdilution en plaque utilisant entre autres les huiles essentielles d’origan
(Origanum vulgare), de sarriette (Satureja montana), de menthe (Mentha piperita)
et de lavande (Lavandula angustifolia) [100,101]. L’huile essentielle de lavande ainsi
que des fractions de la réglisse ont également démontré qu’à basse concentration, la formation du tube germinatif dans le processus d’élongation en hyphes était inhibée. Ce qui permet de considérer que ces composés pourraient être utiles
contre le dimorphisme de C. albicans [100,102]. Une autre étude a cette fois-ci établi
l’efficacité des proanthocyanidines de canneberges sur certains facteurs de virulence de C. albicans, comme la croissance, la formation de biofilm et l’adhérence de la levure aux cellules épithéliales buccales ainsi qu’à des disques d’acrylique (pour simuler le port de prothèses dentaires). Cette étude a également apporté des évidence que les polyphénols de canneberges pourraient s’avérer
utiles dans le contrôle de l’inflammation des muqueuses buccales causé par
C. albicans [103].
5.2) Carie dentaire
La carie dentaire est une maladie d’origine infectieuse qui détruit progressivement les tissus durs (l’émail, puis la dentine) de la dent et qui, lorsque non traitée, mène à l’inflammation de la pulpe dentaire et ultimement à sa nécrose. Ces lésions
peuvent causer de vives douleurs chez les personnes atteintes. Pour qu’une carie
se forme, trois facteurs sont requis : des bactéries dites cariogènes, des sucres fermentescibles, et bien entendu une dent. Le quatrième facteur est le temps; c’est-à-dire que les bactéries doivent rester en place suffisamment longtemps pour
qu’elles puissent se nourrir et produire de l’acide [104]. Certaines personnes, en dépit d’une bonne hygiène buccale, peuvent être plus sujettes à développer des
caries, que ce soit en raison d’une dominance de bactéries cariogènes présente
dans leur flore buccale normale, ou d’un manque de salivation. Effectivement, pour
deux personnes ayant la même l’hygiène buccale ainsi que la même alimentation,
certaines sont plus à risque de développer des caries [105]. Cela amène un intérêt
des professionnels du domaine à identifier les effets préventifs que pourraient apporter les polyphénols et les huiles essentielles sur le développement des caries. Une étude en Thaïlande a testé quelques huiles essentielles (le basilic
doux [Ocimum basilicum], l’écorce de cannelle [C. zeylanicum], le fenouil doux
[Foeniculum vulgare], le poivre noir [Piper nigrum] et la menthe poivrée [Mentha piperita] sur les bactéries cariogènes Streptococcus mutans et Lactobacillus casei.
Wiwattanarattanabut et al. ont démontré que l’ensemble des huiles choisies avait
un effet antimicrobien sur les deux bactéries. De plus, ils ont établi que jusqu’à 80 % de la formation du biofilm de S. mutans était atténuée, particulièrement avec
l’huile de cannelle [106]. D’autres études se sont penchées sur l’adhérence des
bactéries cariogènes, processus déterminant dans le développement des caries.
La quercétine par exemple, un flavonoïde, a réduit l’adhérence de S. mutans [107].
5.3) Maladies parodontales
Les maladies parodontales sont des maladies infectieuses caractérisées par une
inflammation des tissus de soutien de la dent [108]. Il est estimé qu’une très grande
majorité des adultes souffre d’une parodontite faible ou modérée, mais qu’une proportion d’environ 5 % à 20 % est touchée par ce problème de façon plus
sévère [109]. Bien que ce soit des maladies causées par de multiples facteurs, les
biofilms jouent un rôle déterminant [110]. La forme mineure, la gingivite, peut-être
renversée par une amélioration de l’hygiène buccale alors que la forme la plus sévère (parodontite) ne peut être totalement résorbée. Si non traitée, la parodontite
chronique mène à la destruction des tissus parodontaux et de l’os alvéolaire, à la
perte des dents et jusqu’à des complications systémiques comme des troubles
infections respiratoires [111–113]. Les destructions tissulaires sont le résultat de l’activation de la réponse immuno-inflammatoire de l’hôte par les
lipopolysaccharides (LPS) des bactéries parodontopathogènes comme
Porphyromonas gingivalis et Fusobacterium nucleatum [109–111]. En réponse à la
stimulation par des bactéries parodontopathogènes, les cellules épithéliales et les fibroblastes buccaux peuvent sécréter des cytokines pro-inflammatoires telles que
l'interleukine-6 (IL-6) et l'interleukine-8 (IL-8) [109]. Ces bactéries peuvent également
stimuler les macrophages et induire la sécrétion d’interleukine-1β (IL-1 β), IL-6 et
du facteur de nécrose tumorale alpha (TNF-α) par les macrophages [111]. Outre les
facteurs directs résultants des interactions hôtes–pathogènes, des causes psychologiques ont également été mises en lumière et suspectées d’augmenter les risques de parodontites. Des études ont effectivement montré une prévalence plus élevée de la parodontite sévère chez les individus souffrant de stress
psychologique [108]. Une étude canadienne a évalué l’impact des polyphénols de
bleuets (Vaccinium angustifolium Ait.) sur une des bactéries jouant un rôle crucial
dans les maladies parodontales, soit F. nucleatum [114]. Les auteurs ont démontré
que ces polyphénols arrivaient à inhiber de 87 % la formation de biofilm et que ces molécules possédaient un effet antibactérien en inhibant la croissance de la bactérie, probablement par sa capacité à chélater le fer. Dans un modèle de macrophages humains, les polyphénols de bleuets ont également inhibé l’activation de la voie NF-κB, une voie de signalisation associée à l’inflammation ainsi qu’à l’apoptose cellulaire, et à réduire la sécrétion de l’IL-1β, de TNF-α, et de
l'IL-6 induite par F. nucleatum, des médiateurs de l’inflammation [114].
5.4) Halitose
L’halitose est ce que l’on appelle communément la mauvaise haleine, soit le fait d’avoir une haleine dégageant une odeur désagréable. Il existe plusieurs causes possibles à l’halitose, comme une pauvre hygiène buccale, une inflammation des gencives (maladies parodontales), un désordre du tractus gastro-intestinal ou
encore l’alcool et le tabac [115]. La xérostomie, une sécheresse de la bouche
contribuant à l’halitose. La xérostomie peut être un symptôme d’une maladie ou
encore un effet secondaire lié à la prise de certains médicaments [116,117]. Lorsque
le problème est d’origine bactérienne, Solobacterium moorei, une bactérie Gram positif anaérobie stricte, est le plus souvent impliquée. S. moorei produit du sulfure d’hydrogène, un gaz issu de la dégradation de protéines et responsable en partie
de l’odeur incommodante [118]. Les propriétés anti-S. moorei de
l’épigallocathéchine-3-gallate (EGCG), un composé du thé vert, ont été récemment
rapportées [119]. L’EGCG a démontré des effets sur la formation du biofilm de
S. moorei, ainsi que sur sa capacité d’adhérence aux cellules épithéliales
buccales. De plus, il a également diminué de façon dose dépendante l’activité de
la β-galactosidase, une enzyme clé dans la cascade menant à la production de
composés sulfurés à partir de glycoprotéines. Des résultats semblables ont
6) Hypothèse et objectifs
6.1) Hypothèse
L’hypothèse de ce projet est que les composantes de la cannelle (huile essentielle, proanthocyanidines) auraient un effet antifongique sur C. albicans, en plus d’atténuer ses propriétés pathogéniques et d’exercer un effet protecteur sur les cellules épithéliales de la muqueuse buccale.
6.2) Objectifs
1. Démontrer l’effet de composantes de la cannelle sur la croissance et le biofilm de C. albicans.
2. Évaluer l’impact de composantes de la cannelle sur l’adhérence de C. albicans aux
cellules épithéliales buccales.
3. Déterminer l’activité de composantes de la cannelle sur la sécrétion de cytokines
pro-inflammatoires induite par le TNF-α chez les cellules épithéliales buccales.
4. Étudier l’effet de composantes de la cannelle sur l’intégrité de la barrière
Chapitre 1 Effects of cinnamon bark fractions on
Candida albicans and oral epithelial cells
Résumé
Candida albicans est un agent pathogène opportuniste pouvant causer des infections superficielles ou systémiques chez les individus immunologiquement ou médicalement compromis. Nous avons étudié les effets de deux fractions d’écorce de cannelle, à savoir une huile essentielle et un extrait aqueux enrichi en proanthocyanidines (Cinnulin PF®) sur la croissance, la formation de biofilms et sur les propriétés d’adhérence de C. albicans. Nous avons également utilisé un modèle de cellules épithéliales buccales pour étudier les effets des deux fractions sur l'intégrité de la barrière épithéliale et la réponse inflammatoire. Bien que la Cinnulin PF® n'ait pas réduit la croissance de C. albicans, l'huile d'écorce de cannelle présentait une activité antifongique élevée, avec des valeurs de CMI et de CMF comprises entre 0,039 % et 0,078 % (v/v). L'huile de cannelle était également active contre le biofilm préformé de C. albicans. La capacité de l'huile de cannelle à perturber la membrane cellulaire de C. albicans pourrait expliquer son activité fongicide. Fait intéressant, la Cinnulin PF® a empêché la formation de biofilm par C. albicans et a atténué son adhérence aux cellules épithéliales buccales. À leurs concentrations efficaces, l'huile de cannelle et la Cinnulin PF® ne présentaient aucune cytotoxicité significative vis-à-vis les cellules épithéliales buccales. Dans un modèle in vitro, les deux fractions de cannelle ont renforcé l’intégrité de la barrière épithéliale buccale, tel que démontré par une augmentation de la résistance électrique transépithéliale. Enfin, la Cinnulin PF® a inhibé la sécrétion d'interleukine-6 et d'interleukine-8 par les cellules épithéliales buccales stimulées par le facteur de nécrose tumorale α. En conclusion, les deux fractions de cannelle étudiées dans la présente étude pourraient être des agents thérapeutiques prometteurs pour traiter les infections à C. albicans.
Abstract
Candida albicans is an opportunistic pathogen that can cause superficial or systemic infections in immunologically or medically compromised individuals. We investigated the effects of two cinnamon bark fractions, i.e., an essential oil and an
aqueous extract enriched in proanthocyanidins (Cinnulin PF®) on the growth,
biofilm formation, and adherence properties of C. albicans. We also used an oral epithelial cell model to study the effects of the two fractions on the integrity of the
epithelial barrier and the inflammatory response. Although Cinnulin PF® did not
reduce the growth of C. albicans, the cinnamon bark oil exhibited high antifungal activity, with MIC and MFC values in the range of 0.039% to 0.078%. The cinnamon oil was also active against a pre-formed C. albicans biofilm. The ability of cinnamon oil to perturb the C. albicans cell membrane may explain its fungicidal
activity. Interestingly, Cinnulin PF® prevented biofilm formation by C. albicans and
attenuated its adherence to oral epithelial cells. At their effective concentrations,
the cinnamon oil and the Cinnulin PF® displayed no significant cytotoxicity against
oral epithelial cells. In an in vitro model, both cinnamon fractions reinforced the integrity of the oral epithelial barrier as determined by an increase in transepithelial
electrical resistance. Lastly, Cinnulin PF® inhibited the secretion of interleukin-6
and interleukin-8 by oral epithelial cells stimulated with tumor necrosis factor-α. In conclusion, the two cinnamon fractions investigated in the present study may be promising therapeutic agents for treating C. albicans infections.
Effects of cinnamon bark fractions on Candida albicans and oral
epithelial cells
.Marie-Pier Veilleuxand Daniel Grenier*
Oral Ecology Research Group, Faculty of Dentistry,
Université Laval, Quebec City, QC, Canada
* Corresponding author: Oral Ecology Research Group, Faculty of Dentistry, Université Laval, 2420 Rue de la Terrasse, Quebec City, QC, Canada, G1V 0A6
Telephone: 418-656-7341. Fax: 418-656-2861. E-mail: Daniel.Grenier@greb.ulaval.ca
Keywords: Biofilm, Candida albicans, candidiasis, cinnamon, cytokine, epithelial
1) Introduction
Candida albicans is a commensal fungus that colonizes oral mucosal surfaces and that is normally harmless in healthy individuals as it is maintained at low levels by specific and non-specific salivary and mucosal defense mechanisms as well as by competitive inhibition by oral bacteria [1]. However, under certain circumstances, this opportunistic microorganism can cause a superficial infection called candidiasis. Oral candidiasis is characterized by the appearance of white plaques on inflamed and red mucosa (inner cheeks, tongue, throat) and by pain when eating or swallowing [1, 2]. If the infection becomes invasive, which can occur in immunologically and medically compromised individuals, it can cause septicemia leading to organ failure and eventually death [3]. C. albicans has also been reported to infect oral mucositis lesions [4, 5], causing inflammation of the oropharyngeal mucosa [6, 7]. Patients who suffer from cancer affecting the head and neck and who receive chemotherapy and radiotherapy treatments are almost all affected by oral mucositis [6, 7].
C. albicans produces several virulence factors that play critical roles in the pathogenic process leading to superficial or systemic infections [8]. The cell surface adhesins of C. albicans allow initial adhesion to oral epithelial cells, a key step prior to subsequent tissue invasion and damage [8-10]. C. albicans can form biofilms on biotic and abiotic oral surfaces, which is key to enabling the fungus to accumulate in large amounts and to protecting it from antimicrobial agents and the host immune system [2, 11, 12]. Additional virulence factors produced by C. albicans include its ability to switch from the yeast form to an invasive hyphae morphotype and to secrete proteolytic and lipolytic enzymes [8]. These pathogenic determinants may be potential targets for new antifungal agents that may limit the appearance of strains resistant to conventional antifungals.
Despite the availability of antifungal agents to treat C. albicans-associated oral infections, treatment failures are increasingly common due to the emergence of resistant strains [13-15]. Given this, investigations of the antifungal potential of new molecules are highly relevant. In recent years, plant-derived compounds with
antifungal potential have attracted the interest of researchers [16]. Cinnamon, a spice derived from the inner bark of the cinnamon tree, has been reported to possess a number of therapeutic properties, including antimicrobial activity [17, 18]. In the present study, we investigated the effects of two cinnamon bark fractions, an essential oil and an aqueous extract enriched in proanthocyanidins, on the growth, biofilm formation, and adherence properties of C. albicans. In addition, an oral epithelial cell model was used to study the effects of the two fractions on the integrity of the epithelial barrier and the host inflammatory response.
2) Materials and methods
2.1) Cinnamon fractions
A cinnamon extract commercialized as Cinnulin PF® was kindly provided by IN
Ingredients Inc. (Spring Hill, TN, USA). The aqueous extract, which was prepared
from the bark of Cinnamomum burmannii, contains 531.9 mg/g of
proanthocyanidins according to the datasheet provided by the company. Cinnamon bark is relatively unusual as it contains proanthocyanidins with a high number of A-type bonds [19]. A 20 mg/mL stock solution of the extract was prepared in 50% dimethylsulfoxide and was sterilized by filtration (0.22-μm pore size). Carrier solvent was used as a control in all assays. A cinnamon bark essential oil extracted from Cinnamomum verum, was purchased from Hunzaroma (Longueuil, QC, Canada). Cinnamaldehyde, the major component of cinnamon bark essential oil, was purchased from Sigma-Aldrich Canada Co. (Oakville, ON, Canada).
2.2) C. albicans and culture conditions
C. albicans ATCC 28366 and LAM-1 were isolated from cases of oral candidiasis and systemic candidiasis, respectively. They were cultivated in Sabouraud dextrose medium (BBL Microbiology Systems, Cockeysville, MD, USA) at pH 7 and 37°C.
2.3) Determination of the minimum inhibitory and minimum fungicidal concentrations
The minimum inhibitory concentration (MIC) and minimum fungicidal concentration (MFC) were determined using a microplate dilution assay. To determine the MIC value, a 24-h culture of C. albicans was diluted in fresh culture medium to an
optical density at 660 nm (OD660) of 0.2. Aliquots (100 μL) of C. albicans were
added to an equal volume of serial dilutions in culture medium of the cinnamon fractions in 96-well microplates. Wells without C. albicans or without the cinnamon fractions were used as controls. When testing the cinnamon oil, the microplate was covered with an adhesive film to avoid evaporation of the volatile compounds. After
an incubation at 37°C for 24 h, growth was monitored by recording the OD660 using a microplate reader (Bio-Rad Laboratories, Mississauga, ON, Canada). Lack of growth was also assessed visually. The MIC value corresponded to the lowest concentration of the cinnamon fractions that completely inhibited growth. To determine the MFC, 5 μL from wells showing no visible growth was spotted on Sabouraud dextrose agar plates, which were incubated at 37°C for 3 days. The MFC value corresponded to the lowest concentration of the cinnamon fractions where no colony formation was observed. The antifungal agent nystatin was used as a reference antifungal. The MFC/MIC ratio was calculated, and a compound or fraction was considered fungicidal when the ratio was ≤ 4 and fungistatic when the ratio was > 4. All assays were performed in triplicate to ensure reproducibility.
2.4) Membrane permeability
The ability of the cinnamon oil at MFC to permeabilize the membrane of C. albicans ATCC 28366 was evaluated using SYTOX Green dye (Life Technologies Inc., Burlington, ON, Canada), which binds to DNA once the membrane has been compromised. The assay was performed as previously described [20]. The fluorescence resulting from the binding of the dye to DNA was recorded using a Synergy 2 microplate reader (BioTek Instruments, Winooski, VT, USA) every 15 min for 2 h with the excitation wavelength set at 485 nm and the emission wavelength set at 528 nm. A reaction mixture without essential oil was used as a negative control.
2.5) Biofilm formation and killing
The effect of the cinnamon fractions on biofilm formation by C. albicans ATCC 28366 was determined using a microplate dilution assay as described above. Following growth, the medium and free-floating microorganisms were removed by aspiration using a 26 g needle, and the wells were washed three times with distilled water. Biofilms were stained with 100 μL of 0.01% crystal violet for 15 min. The wells were then washed three times with distilled water and were dried at 37°C overnight, after which 100 μL of 75% ethanol (v/v) was added to each well to
release the dye from the biofilm. Absorbance at 550 nm (A550) was then measured using a microplate reader. The effect of the cinnamon fractions on biofilm formation was also examined by scanning electron microscopy using the protocol previously described by Lagha et al. [21]. Samples were examined using a JEOL JSM6360LV scanning electron microscope operating at 30 kV. The ability of the cinnamon oil to kill a pre-formed C. albicans biofilm was also investigated. Biofilms (24 h) in 96-well plates were treated for 1 h with the cinnamon oil at the MFC value. Biofilm viability was then measured with an XTT [2,3-bis(2-methoxy-4-nitro-sulfophenyl)-2H-tetrazolium-5-carboxanilide sodium salt] assay, as described previously [22].
2.6) Epithelial cell culture conditions and viability assays
The human oral epithelial cell line B11, which was kindly provided by S. Groeger (Justus Liebig University Giessen, Germany) and has already been characterized [23], was cultured in keratinocyte serum-free medium (K-SFM; Life Technologies Inc.) supplemented with growth factors (50 µg/mL of bovine pituitary extract and 5 ng/mL of human epidermal growth factor) and 100 µg/mL of penicillin G-streptomycin. The human oral epithelial cell line GMSM-K [24] was kindly provided by V. Murrah (University of North Carolina, Chapel Hill, NC, USA) and was cultivated in Dulbecco's Modified Eagle's Medium (DMEM) supplemented with 10% heat-inactivated inactivated fetal bovine serum (FBS) and 100 µg/mL of penicillin
G-streptomycin. The cell cultures were incubated at 37 °C in a 5 % CO2
atmosphere. Epithelial cells (1 x 105 cells) were seeded into the wells of a 96-well
tissue culture plate and were cultivated until they reached confluence. The cells
were then treated with either Cinnulin PF® or cinnamon oil in the appropriate
culture medium for 24 h. Their viability was then determined using an MTT (3-[4,5-diethylthiazol-2-yl]-2,5diphenyltetrazolium bromide) colorimetric assay (Roche Diagnostics, Laval, QC, Canada).
2.7) Adherence to epithelial cells
The effect of the cinnamon fractions on the adherence of C. albicans ATCC 28366 to oral epithelial cells was assessed using the human GMSM-K cell line. Epithelial
![Tableau 1. Échelle de classification des mucites buccales selon l’Organisation mondiale de la santé [34]](https://thumb-eu.123doks.com/thumbv2/123doknet/3158739.90018/15.918.239.681.788.974/tableau-échelle-classification-mucites-buccales-organisation-mondiale-santé.webp)
![Figure 1. Pathogenèse de la mucite buccale. Image adaptée de Sonis (2004) [42]](https://thumb-eu.123doks.com/thumbv2/123doknet/3158739.90018/17.918.130.791.586.898/figure-pathogenèse-la-mucite-buccale-image-adaptée-sonis.webp)
![Figure 2. Candida albicans. Image de Colm (n.d.) [61]](https://thumb-eu.123doks.com/thumbv2/123doknet/3158739.90018/20.918.308.610.675.859/figure-candida-albicans-image-de-colm-n-d.webp)