PREVENTION DU DIABETE DE TYPE 2 CHEZ
LES FEMMES AVEC UN ANTÉCÉDENT DE
DIABÈTE GESTATIONNEL: ÉTUDE D'OUTILS
DE DÉPISTAGE ET DE MESURES PRÉVENTIVES
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l'Université Laval dans le cadre du programme de maîtrise en Nutrition
pour l'obtention du grade de Maître es sciences (M. Se.)
DEPARTEMENT DES SCIENCES DES ALIMENTS ET DE NUTRITION FACULTÉ DES SCIENCES DE L'AGRICULTURE ET DE L'ALIMENTATION
UNIVERSITÉ LAVAL QUÉBEC
2012
Les femmes avec un antécédent de diabète gestationnel (DbG) présentent un risque accru de diabète de type 2 (DbT2). Cependant, après leur grossesse, une proportion importante de ces femmes n'adopte pas un mode de vie sain et leur suivi médical est inadéquat. L'objectif de ce mémoire visait d'une part à identifier un outil de dépistage postgrossesse efficace pour détecter les anomalies du métabolisme du glucose chez ces femmes et d'autre part à qualifier leur mode de vie en période postgrossesse et la relation avec les complications métaboliques associées au DbT2. Les résultats démontrent qu'en période postgrossesse, la combinaison de l'hémoglobine A1C et de la circonférence de la taille représente un test sensible pour dépister les anomalies du métabolisme du glucose chez ces femmes. De plus, la majorité de ces femmes n'adopte pas les mesures préventives recommandées et présentent des profils anthropométriques et métaboliques altérés comparativement à celles qui les adoptent.
Abstract
Women with prior gestational diabetes mellitus (GDM) are at increased risk for type 2 diabetes (T2D). However, these women generally do not adopt a healthy lifestyle in the post-delivery period and their medical follow-up is not optimal. The objective of this master thesis was first to identify a simple and sensitive test to detect abnormal glucose metabolism in the post-delivery period and second, to qualify the lifestyle of women with prior GDM and the relationship with metabolic complications associated with T2D. These results demonstrate that the combined use of A1C and waist circumference represents a sensitive test for abnormal glucose metabolism in the post-delivery period. Also, the majority of these women do not adopt the recommended preventive practices following delivery and present altered metabolic and anthropometric profiles compared to women who adopt them.
Ce mémoire présente la majeure partie de mes travaux de maîtrise sous la direction de Dre. Julie Robitaille. Il s'agit de l'aboutissement d'une expérience qui fut des plus enrichissantes d'un point de vue tant professionnel que personnel. Mes travaux de maîtrise ont entre autres mené à l'écriture de deux articles scientifiques qui ont été soumis à des journaux scientifiques et dont je suis la première auteure. Le premier article a pour titre «Glycated hemoglobin and waist circumference for postpartum screening in women with prior gestational diabetes» et est présenté dans le chapitre 2 de ce mémoire. Ce manuscrit a été soumis à la revue American Journal of Obstetrics and Gynecology. J'ai réalisé les analyses statistiques ainsi que la rédaction de cet article et j'ai contribué à la rencontre des participantes du projet de recherche et à la collecte des données. Je remercie les co-auteurs André Tchernof et John Weisnagel qui ont contribué à l'interprétation des données et qui ont révisé et édité le manuscrit ainsi que Julie Robitaille qui a supervisé et contribué significativement à la rédaction de cet article. Le deuxième article s'intitule «Relationship between the adoption of preventive practices and the metabolic profile of women with prior gestational diabetes mellitus» et est présenté dans le chapitre 3 de ce mémoire. Ce manuscrit a été publié dans la revue Applied Physiology, Nutrition and Metabolism. J'ai également réalisé les analyses statistiques et la rédaction de l'article et j'ai participé à la rencontre des participantes du projet de recherche ainsi qu'à une partie de la collecte des données. Je remercie Ann-Marie Paradis pour son aide au niveau de l'analyse et l'interprétation des données ainsi qu'André Tchernof et John Weisnagel qui ont révisé et édité le manuscrit. Finalement, je remercie Julie Robitaille qui a supervisé et contribué à toutes les étapes de la rédaction de ce manuscrit. Je me dois également de remercier les Instituts de recherche en santé du Canada et les Fonds de recherche en santé du Québec pour le financement du projet ainsi que Diabète Québec pour les deux bourses de maîtrise qui m'ont été octroyées. Je remercie également le Réseau de recherche en santé des enfants et des mères (RRSEM), la Société québécoise de lipidologie, de nutrition et de métabolisme (SQLNM), les Fonds Jean-Paul Houle et la Société canadienne de nutrition pour les bourses de voyage qui m'ont permis d'assister à des congrès nationaux.
Ces deux années de maîtrise pendant lesquelles je me suis familiarisée avec le monde passionnant de la recherche ont été riches d'expériences et je tiens à remercier toutes les personnes sans qui la réalisation de mon projet de maîtrise n'aurait pu être possible. Je souhaite d'abord exprimer mes sincères remerciements à ma directrice de maîtrise, Dre. Julie Robitaille qui m'a recrutée au sein de son équipe dès mes études au baccalauréat. Je la remercie de m'avoir permis de travailler sur un sujet passionnant, de m'avoir permis de participer à de nombreux congrès et de m'avoir transmis sa passion pour la recherche. Sa confiance, sa disponibilité et son expérience ont été des atouts majeurs pendant ma maîtrise. Je la remercie également pour ses précieux conseils et enseignements qui me seront plus qu'utiles pour la poursuite de mes études. Bref, merci pour tout!
Je remercie également tous les membres de 1' « équipe Robitaille » qui ont été présents depuis le début ou qui s'y sont joints en cours de route. Je remercie particulièrement Sarah qui a été ma partenaire de maîtrise, mais également une amie incomparable. Un merci particulier également à Ann-Marie Paradis qui a été présente depuis le début et qui a contribué à mon second article. Le soutien de Geneviève Faucher et de Véronique Garneau a également été très apprécié. Je tiens aussi à remercier André Tchernof et John S. Weisnagel, co-chercheurs pour le projet, qui ont contribué aux articles scientifiques et aux résumés de communication que j'ai écrits. Merci également au personnel infirmier de l'Unité clinique qui s'est occupé des prélèvements pour les participantes. Je profite également de l'occasion pour remercier tous mes amis de l'INAF que j'ai eu la chance de côtoyer et avec qui j'ai eu beaucoup de plaisir durant ces deux merveilleuses années.
Je remercie finalement ma famille, c'est-à-dire mes parents et mes frères, qui m'ont soutenue et qui malgré la distance m'ont toujours encouragée. Je tiens également à souligner la quasi-patience de mon copain, Olivier, qui a attendu mon retour à Montréal, qui m'a encouragée tout au long de ma maîtrise et qui soutient mon choix de poursuivre des études doctorales.
Résumé i Abstract ii Avant-propos iii Table des matières vii Liste des tableaux ix Liste des figures x Liste des abréviations xi
Introduction 1 Chapitre 1. Problématique 3
1. Le diabète gestationnel 3 1.1 Définition et pathophysiologie 3
1.2 Épidémiologie du diabète gestationnel 4 1.3 Complications métaboliques associées au diabète gestationnel 6
1.3.1 Diabète de type 2 6 1.3.2 Syndrome métabolique 7 1.3.3 Maladies cardiovasculaires 7 2. Suivi et dépistage postgrossesse 9
2.1 Recommandations actuelles 9
2.2 Taux de suivi 10 2.3 Facteurs associés au suivi postgrossesse 11
2.4 Mesures alternatives 13 2.4.1 Glycémie à jeun 13 2.4.2 Hémoglobine glyquée 14 2.4.3 Circonférence de la taille 16 3. Prévention et habitudes de vie 17
3.1 Interventions 17 3.1.1 Habitudes de vie 17 3.1.2 Pharmacologiques 18 3.2 Recommandations actuelles 18 3.2.1 Alimentation 19 3.2.2 Activité physique 22 3.2.3 Allaitement maternel 23 3.3 Habitudes de vie postgrossesse 26
3.3.1 Alimentation 26 3.3.2 Activité physique 27 3.3.3 Allaitement maternel 27
4. Objectifs et hypothèses 28
5. Méthodologie 29 Chapitre 2: L'hémoglobine glyquée et la circonférence de la taille pour le suivi
postgrossesse chez les femmes ayant eu un diabète gestationnel 31
RÉSUMÉ 32 ABSTRACT 35 INTRODUCTION 36
MATERIALS AND METHODS 36
RESULTS 38 COMMENT 40 REFERENCES 44 Chapitre 3: Association entre l'adoption de mesures préventives et le profil métabolique
chez des femmes ayant eu un diabète gestationnel 51
RÉSUMÉ 52 ABSTRACT 54 INTRODUCTION 55 MATERIALS AND METHODS 56
RESULTS 59 DISCUSSION 60 CONCLUSION 64 REFERENCES 65 Conclusion 73 Bibliographie 79
Chapitre 1
Tableau 1. Facteurs de risque du diabète gestationnel selon l'ACD 5
Tableau 2. Adhésion au suivi postgrossesse selon des études nord-américaines 11 Tableau 3. Recommandations alimentaires canadiennes pour les femmes de 18-50 ans.... 19
Tableau 4. Comparaison d'indices de qualité alimentaire selon les composantes incluses.21 Tableau 5. Effets bénéfiques associés à l'allaitement maternel chez l'enfant et la mère....24
Chapitre 2
Table 1. Characteristics of participants according to A1C concentrations 47 Table 2. Sensitivity and specificity of A1C, waist circumference and the combination of
the two measures to detect impaired glucose metabolism 48 Table 3. Pearson correlation coefficients (r) between A1C and waist circumference and
metabolic measurements 49 Table 4. Relative Odds ratio of being characterized with prediabetes, type 2 diabetes and
any glucose intolerance according to A1C concentrations (< or >5.7%) and waist
circumference (< or >88 cm) 50
Chapitre 3
Table 1. Characteristics of participants 68 Table 2. Adoption of preventive practices 69 Table 3. Anthropometric and metabolic characteristics of participants according to the
number of preventive practices adopted 70 Table 4. Adjusted Pearson correlation coefficients between preventive practices and
Chapitre 1
Figure 1. Relation entre la sécrétion d'insuline et la sensibilité à l'insuline dans une
grossesse normale ou compliquée par un DbG 3 Figure 2. Adipokines associées au DbG pendant et après la grossesse 9
Figure 3. Représentation graphique d'une courbe ROC 15 Figure 4. Mesure de la circonférence de la taille 16 Figure 5. Effets de certains nutriments sur le risque de développer le DbT2 20
Figure 6. Mécanismes liés à la prévention du DbT2 par la pratique d'activité physique ... 22 Figure 7. Théorie de la réinitialisation du métabolisme liée à l'allaitement maternel 25
Liste des abréviations
A1C: Hémoglobine glyquéeACD: Association canadienne du diabète
ADA: American Diabetes Association A-HEI: Alternate Healthy Eating Index AUC: Area under the ROC curve BMI: Body mass index
CDA: Canadian Diabetes Association CI: Confidence interval
DbG: Diabète gestationnel DbT2: Diabète de type 2
DPP: Diabetes Prevention Program DPS: Finnish Diabetes Prevention Study FPG: Fasting plasma glucose
GDM: Gestational diabetes mellitus HEI: Healthy Eating Index
HOMA: Homeostasis model assessment of insulin sensitivity
HGPO: Hyperglycémie provoquée par voie orale
IADSPG: Association internationale des groupes d'études sur le diabète et la grossesse IMC: Indice de masse corporelle
IPAQ: International Physical Activity Questionnaire OGTT: Oral glucose tolerance test
OMS: Organisation mondiale de la santé
OR: Odds ratio PG: Plasma glucose
ROC: Receiver operating characteristics
SCPE: Société canadienne de physiologie de l'exercice SM: Syndrome métabolique
Au Québec, le diabète représente un problème de santé publique majeur tant par l'augmentation de sa prévalence que par les coûts y étant associés. Entre les années 2000 et 2010, la prévalence du diabète a subi une hausse de 91 % (1). Le fardeau financier que représente le diabète pour le système de santé québécois s'accroit également avec une augmentation prévue des coûts de soins de santé liés au diabète de près de 60% entre 2000 et 2016 (2). Le portrait n'est guère plus reluisant dans l'ensemble du Canada avec une prévalence du diabète de 7,6% en 2010, ce qui représente une hausse de 103% en dix ans (1). Le Rapport sur le diabète de 2005 émis par l'Association canadienne du diabète (ACD) recommande que la prévention soit mise de l'avant pour contrer cette problématique de santé publique (3).
Les femmes avec un antécédent de diabète gestationnel (DbG) représentent un groupe unique pour la prévention du diabète de type 2 (DbT2). En effet, le DbG est associé à un nombre important de complications métaboliques pendant et après la grossesse et un antécédent de DbG est reconnu comme étant un facteur de risque important du DbT2 (4). Une méta-analyse a démontré que de 10 à 31% des femmes qui ont eu au moins une grossesse et qui développent un DbT2 avaient précédemment eu un diagnostic de DbG (5). Considérant ces données et sachant qu'environ 50% des cas de DbT2 peuvent être prévenus par des interventions visant l'adoption de saines habitudes de vie combinée à une perte de poids modérée (6-8), Stuebe et coll. suggèrent qu'on pourrait ainsi prévenir près d'un sixième (5 à 16%) des cas de DbT2 chez les femmes en développant des interventions ciblant les femmes qui ont un DbG (9). Cette extrapolation, bien que simpliste, démontre tout de même que d'un point de vue de santé publique, le développement d'interventions efficaces chez les femmes avec un antécédent de DbG est nécessaire. Ainsi, la première partie de la problématique sera consacrée à mieux comprendre ce qui définit le DbG, l'épidémiologie du DbG et les complications métaboliques qui y sont rattachées.
D'autre part, il est primordial d'assurer un suivi adéquat auprès des femmes qui ont eu un DbG afin de prévenir ou retarder la progression vers le DbT2. Cependant, les données
femmes (10,11). La méthode actuelle de suivi est contraignante et coûteuse et aucune alternative adéquate n'est reconnue jusqu'à présent. Le deuxième volet de la problématique s'intéressera donc au suivi postgrossesse des femmes qui ont eu un DbG et traitera des recommandations actuelles, des taux de suivi et des barrières au suivi ainsi que des mesures alternatives pour le suivi postgrossesse.
Tel que mentionné, des interventions ciblant les femmes avec un antécédent de DbG pourraient offrir une opportunité unique pour la prévention du DbT2. Puisque les femmes ayant eu un DbG présentent un risque élevé de développer un DbT2, elles bénéficieraient de l'adoption de saines habitudes de vie, mais peu d'interventions ciblent précisément cette population. Certaines études ont démontré que le mode de vie des femmes en période postgrossesse ne serait pas optimal (12,13), mais l'association entre l'adoption de ces habitudes de vie et le profil métabolique en période postgrossesse chez des femmes avec un antécédent de DbG n'a que très peu été évaluée. Ainsi, la troisième et dernière partie de la problématique traitera de la prévention et des habitudes de vie chez les femmes avec un antécédent de DbG et précisera les recommandations actuelles, les habitudes de vie postgrossesse et l'efficacité des interventions pour la prévention du DbT2. Les objectifs et hypothèses ainsi que la méthodologie générale seront ensuite exposés.
L'objectif général de ce mémoire vise d'une part à identifier un outil de dépistage postgrossesse efficace pour détecter les anomalies du métabolisme du glucose chez les femmes avec un antécédent de DbG et d'autre part à qualifier le mode de vie de ces femmes en période postgrossesse et la relation avec les complications métaboliques associées au DbT2. Deux articles soumis à des revues scientifiques et traitant des deux volets de cet objectif seront présentés aux chapitres 2 et 3. Finalement, une discussion et une conclusion générale suivront.
1. Le diabète gestationnel
1.1 Définition et pathophysiologie
Le DbG est défini par l'ACD comme une intolérance au glucose qui survient ou qui est diagnostiquée pour la première fois pendant la grossesse (4). Une grossesse normale est caractérisée par un état de résistance à l'insuline progressif qui apparaît vers le deuxième trimestre et qui est induit par les hormones placentaires et l'augmentation de l'adiposité maternelle (14). Ce changement métabolique vise à fournir suffisamment de glucose au fœtus et la sécrétion d'insuline par les cellules p du pancréas compense généralement cette résistance à l'insuline associée à la grossesse, sauf dans le cas du DbG (Figure 1). Un DbG survient donc lorsque ce besoin accru en insuline ne peut être comblé, ce qui entraîne une hyperglycémie maternelle. À l'accouchement, la tolérance au glucose retrouve son état normal, mais demeurerait altérée chez certaines femmes dont la grossesse est compliquée par un DbG (15-18). c 0 o ■v /. V —
I
1000 3t o trimestre ♦ Post grossesse
0.0 0.1 0.2 0.3
Index de sensibilité à l'insuline
0 4
Figure 1. Relation entre la sécrétion d'insuline et la sensibilité à l'insuline dans une grossesse normale ou compliquée par un DbG, adaptée de Buchanan 2001 (19)
Au Canada, toutes les femmes enceintes sont dépistées pour le DbG entre la 24eme et la 28eme semaine de grossesse et les femmes présentant davantage de facteurs de risque du DbG doivent être dépistées au premier trimestre (Tableau 1). Il a été démontré que le traitement de l'hyperglycémie pendant la grossesse était fondamental afin de prévenir les
entre autres; l'hyperinsulinémie et l'hypoglycémie fœtales, la macrosomie (poids à la naissance >90eme percentile ou >4000g), l'accouchement par césarienne, la pré-éclampsie et une naissance prématurée (21-24). Même en présence d'hyperglycémie maternelle modérée (sous les seuils diagnostiques du DbG), il y a une forte association entre les niveaux de glucose sanguin pendant la grossesse et le poids du bébé à la naissance ainsi que les concentrations sériques de C-peptide dans le sang du cordon ombilical (24). L'impact clinique du DbG et la nécessité de le traiter ont donc été clairement démontrés.
1.2 Épidémiologie du diabète gestationnel
La prévalence du DbG varie selon la population et la région à l'étude et cette prévalence reflète l'incidence sous-jacente du diabète dans la population (25,26). Les résultats d'études populationnelles canadiennes ont démontré que l'incidence du DbG était en augmentation depuis les dernières décennies et atteignait près de 4% des grossesses (27-29). Selon Feig et coll., l'incidence du DbG en Ontario a augmenté de 3,2% en 1995 à 3,6% en 2001 (27). La prévalence du DbG au Manitoba entre 1999 et 2004 était de 3,7% (28) alors que Dyck et coll. ont démontré une prévalence du DbG similaire (3,5%) en Saskatchewan dans la population générale en 2002 (29). Ces chiffres augmentaient et atteignaient toutefois 11,5% dans la population autochtone (29). D'autres études canadiennes ont également démontré que la prévalence du DbG est nettement plus élevée dans les populations canadiennes autochtones et pouvait atteindre de 8 à 18% (28-32). Les taux de récurrence du DbG sont également élevés (de 30 à 84%) et selon certaines études, ces taux varieraient considérablement selon l'ethnie, avec des taux plus faibles de récurrence observés chez les femmes blanches (33-35).
La prévalence du DbG pourrait continuer d'augmenter dans les prochaines années si les nouveaux critères diagnostiques du DbG proposés par l'Association internationale des groupes d'études sur le diabète et la grossesse (IADPSG) sont adoptés (36). Ces critères sont plus sévères que ceux utilisés actuellement en pratique clinique (4) et ils ont été adoptés par l'Association américaine du diabète (37), mais ne sont pas adoptés au niveau des lignes directrices canadiennes à l'heure actuelle. Selon les critères de 1TADSPG, une
semaine de grossesse (glycémies à jeun >5,1 mmol/L, lh >10,0 mmol/L ou 2h >8,5 mmol/L) mène à un diagnostic de DbG tandis qu'avec les critères canadiens actuels, deux valeurs doivent excéder les seuils déterminés pour l'HGPO de 75g (glycémies à jeun >5,3 mmol/L, lh >10,6 mmol/L ou 2h >8,9 mmol/L) (4,37). Avec l'adoption de ces critères, l'incidence du DbG pourrait doubler (38) et jusqu'à 18% des grossesses pourraient être diagnostiquées avec un DbG (39). Il est important de noter qu'une étude a démontré que les nouveaux critères diagnostiques de 1TADPSG permettent d'identifier un groupe de femmes présentant des caractéristiques métaboliques similaires aux femmes diagnostiquées avec un DbG par les critères en vigueur actuellement, mais qui n'auraient pas été diagnostiquées avec ces derniers (40).
Plusieurs facteurs de risque du DbG ont été identifiés selon l'ACD (Tableau 1) (4). Outre ces facteurs, un gain de poids excessif avant (41) ou pendant (42,43) la grossesse ainsi que certaines composantes nutritionnelles (boissons sucrées, viandes et substituts, desserts, matières grasses totales ou saturées) (44-47) ou un profil alimentaire de type « western » (48) sont associés positivement au risque de DbG. Une pratique régulière d'activité physique prégrossesse est associée à un plus faible risque de DbG (49,50).
Tableau 1. Facteurs de risque du diabète gestationnel selon l'ACD (4)
Facteurs de risque du DbG
DbG antérieur
Accouchement antérieur d'un enfant de poids élevé Groupe ethnique à risque (autochtones, hispaniques, sud-asiatiques, africaines)
Âge (35 ans et plus)
Obésité (Indice de masse corporelle >30 kg/m ) Syndrome des ovaires polykystiques
Acanthosis nigricans Prise d'un corticostéroïde
Le DbG est associé à un nombre important de complications métaboliques pour la mère pendant et après la grossesse. Il est particulièrement important de bien comprendre quelles sont ces complications métaboliques qui guettent les femmes avec un antécédent de DbG en période postgrossesse afin de développer des mesures préventives ciblées et efficaces. Les complications postgrossesse reliées au DbG et dont il sera question dans la présente section sont un risque accru de DbT2, une probabilité accrue d'être caractérisée par le syndrome métabolique (SM) et un risque accru de maladies cardiovasculaires.
1.3.1 Diabète de type 2
Les associations canadiennes et américaines du diabète reconnaissent toutes deux le DbG comme étant un facteur de risque du DbT2 (4,37). Selon une revue de littérature, 17 à 63% des femmes développeront un DbT2 dans les 5 à 16 ans qui suivent une grossesse compliquée par un DbG, selon les populations étudiées (51). Les résultats d'une étude prospective américaine regroupant plus de 2 400 femmes multiethniques ont également démontré que la grossesse en soi ne constitue pas un facteur de risque de DbT2, contrairement au DbG qui lui est fortement associé au développement du DbT2 (52). Une méta-analyse récente regroupant vingt études a démontré que comparativement aux femmes ayant eu une grossesse normoglycémique, les femmes ayant eu un DbG présentaient un risque sept fois supérieur de développer un DbT2 (53). Selon une étude populationnelle canadienne (n=21 823), les taux de DbT2 chez des femmes avec un antécédent de DbG étaient de 13,1% à cinq ans et de 18,9% à neuf ans après la grossesse (27). Ces chiffres sont considérablement élevés considérant que la prévalence du DbT2 chez les femmes canadiennes de 25 à 40 ans dans la population générale est de moins de 3% (54).
Certains facteurs ont été identifiés comme étant associés à un risque accru de développer un DbT2 suite à une grossesse compliquée par un DbG. Un diagnostic précoce de DbG (première moitié de la grossesse), des valeurs de glycémie et d'AlC plus élevées pendant la grossesse, une histoire familiale de DbT2 et le nombre de grossesses antérieures sont des prédicteurs indépendants du DbT2 après une grossesse compliquée par un DbG (55,56). L'utilisation d'insuline pendant la grossesse, l'indice de masse corporelle (IMC) ou plus
cellules P du pancréas (anticorps anti-GAD et anti-IA2) sont aussi associés à un risque accru de DbT2 après un DbG (57-60), tout comme l'âge et l'hypertension postgrossesse (27). Des variations génétiques communes entre le DbG et le DbT2 pourraient également expliquer l'association entre ces deux complications métaboliques (61-63).
1.3.2 Syndrome métabolique
Le SM est caractérisé par l'obésité abdominale, la dyslipidémie athérogénique (concentrations plasmatiques de triglycérides élevées, particules LDL petites et denses, concentrations plasmatiques de cholestérol-HDL faibles), une pression artérielle élevée, la résistance à l'insuline ainsi qu'un état prothrombotique et proinflammatoire (64). Le SM reflète généralement des habitudes alimentaires moins saines et un mode de vie sédentaire ainsi que l'excès d'adiposité qui en découle et cette condition est associée à des risques accrus de maladies cardiovasculaires et de DbT2 (65).
Plusieurs études ont démontré une association entre un antécédent de DbG et le SM (66-70). Un DbG et une intolérance au glucose modérée pendant la grossesse sont associés à une probabilité accrue d'être caractérisée par le SM à 3 mois postgrossesse selon une étude de cohorte prospective réalisée à Toronto (n=487) (70). Les résultats d'une étude américaine regroupant 106 femmes ayant eu un DbG et 101 femmes contrôles ont également démontré un risque accru de développer le SM chez les femmes ayant eu un DbG dans les 4 à 11 ans suivant la grossesse (66). La prévalence du SM serait trois fois plus élevée chez les femmes avec un antécédent de DbG que chez les femmes ayant eu une grossesse normo glycémique à dix ans postgrossesse selon les résultats d'une étude danoise (n=481)(67).
1.3.3 Maladies cardiovasculaires
Les femmes avec un antécédent de DbG présentent donc un risque accru de DbT2 et de SM, deux conditions qui ont été associées au risque de maladies cardiovasculaires (65,71-73). Le DbG représente un facteur de risque de maladies cardiovasculaires, indépendamment ou non de ces deux conditions (74,75). Une étude canadienne regroupant
8 191 femmes avec un antécédent de DbG et 81 262 femmes ayant eu une grossesse normoglycémique a démontré que les femmes ayant eu un DbG (environ 11,5 ans postgrossesse) présentent un risque accru d'événements cardiovasculaires, risque qui serait en partie attribuable au développement du DbT2 (76). Une augmentation similaire du risque de maladies cardiovasculaires a été observée chez des femmes américaines avec un antécédent de DbG et une histoire familiale de DbT2 (n=332) comparativement aux femmes sans antécédent de DbG (n=663) (77).
Outre l'impact associé au DbT2 sur le profil de risque cardiovasculaire chez les femmes avec un antécédent de DbG, le profil inflammatoire altéré présent chez ces femmes pourrait être un médiateur important de l'association entre le DbG et le risque de maladies cardiovasculaires (75). L'inflammation est un mécanisme clé de l'athérosclérose et elle est associée aux maladies cardiovasculaires (78). Plusieurs études ont démontré une élévation des marqueurs inflammatoires chez les femmes avec un antécédent de DbG (68,69,79-82), ce qui pourrait contribuer au risque de maladies cardiovasculaires chez ces femmes. Des niveaux faibles d'adiponectine, un facteur de risque potentiel de maladies cardiovasculaires (83,84), ont également été observés chez des femmes après un DbG (79,85). En plus des marqueurs inflammatoires et de l'adiponectine, plusieurs adipokines (cytokines sécrétées par le tissu adipeux) seraient associées au profil métabolique défavorable pendant et après la grossesse compliquée par un DbG (86) (Figure 2). La présence accrue d'obésité abdominale, de dyslipidémie et d'hypertension artérielle, des composantes du SM et des facteurs de risques reconnus de maladies cardiovasculaires, pourraient également contribuer au risque de maladies cardiovasculaires observé chez les femmes avec un antécédent de DbG (67,77).
Ainsi, un antécédent de DbG est associé à diverses complications métaboliques d'importance et cette condition semble représenter un prélude à un profil métabolique futur fortement altéré.
Visfatine
RBP-4
Figure 2. Adipokines associées au DbG pendant et après la grossesse, adaptée de Vrachnis et coll. 2012(86)
2. Suivi et dépistage postgrossesse
2.1 Recommandations actuelles
Puisqu'elles présentent un risque accru de DbT2 et de complications métaboliques, les femmes avec un antécédent de DbG doivent recevoir un suivi médical approprié. Les lignes directrices canadiennes et américaines recommandent à ces femmes de passer un test d'hyperglycémie provoquée par voie orale (HGPO) de deux heures dans les six premiers mois après l'accouchement (4,37). Ensuite, toujours selon ces recommandations, les femmes devraient recevoir un test de glycémie à jeun ou un test d'HGPO tous les trois ans, selon le profil de risque.
Ce dépistage précoce est important d'une part puisque les dommages métaboliques associés à un DbT2 non diagnostiqué sont majeurs et d'autre part parce que le rapport coût/ efficience du dépistage du DbT2 a été démontré (87). Le dépistage précoce permet également d'identifier les femmes à risque avant qu'elles n'amorcent une grossesse subséquente. Il a été démontré qu'un DbT2 non contrôlé ou non diagnostiqué avant la grossesse était associé à des risques accrus de malformations congénitales (87) et de
complications métaboliques (88) ainsi qu'à un risque accru d'obésité infantile (89). L'adhésion aux recommandations actuelles en matière de dépistage chez les femmes avec un antécédent de DbG est donc primordiale.
2.2 Taux de suivi
Bien que la pertinence du suivi postgrossesse des femmes avec un antécédent de DbG ait été démontrée et que les recommandations actuelles préconisent un suivi précoce, plusieurs études ont démontré que les femmes avec un antécédent de DbG ne reçoivent pas le suivi médical approprié, c'est-à-dire un test d'HGPO, dans les six premiers mois postgrossesse. Selon une revue de littérature incluant les études réalisées dans divers pays, les taux de suivi postgrossesse (glycémie à jeun ou HGPO avant un an postgrossesse) chez les femmes avec un antécédent de DbG varient entre 34 et 73% (90). Des données américaines rapportent une augmentation des taux de suivi (glycémie à jeun ou HGPO avant un an postgrossesse) de 20,7% à 53,8% entre 1995 et 2006 (91). Au Canada, les taux de dépistage postgrossesse seraient similaires avec 48% des femmes avec un antécédent de DbG ayant reçu un test d'HGPO ou de glycémie à jeun dans les six premiers mois postgrossesse (10). Les résultats d'une étude populationnelle canadienne récente ont démontré que bien que les taux de suivi à 6 mois postgrossesse aient augmenté au cours de la dernière décennie (d'environ 0,8% par année), moins d'une femme sur six reçoit un test d'HGPO à l'intérieur des six premiers mois postgrossesse (92). Ces taux de suivi ne seraient pas tributaires d'un désengagement de la femme du système de santé suite à la grossesse. Effectivement, la proportion de femmes avec un antécédent de DbG qui reçoit des soins ambulatoires de diverses spécialités en période postgrossesse (92) et qui reçoit le test de dépistage du cancer cervical (93) est supérieure à 90%.
Ces faibles taux de suivi postgrossesse compromettent l'identification précoce des femmes présentant un risque métabolique élevé et nuisent à l'établissement d'interventions appropriées. Il apparaît donc essentiel de comprendre pourquoi les femmes ne reçoivent pas le suivi médical recommandé et d'identifier de nouvelles approches pour améliorer ces taux de suivi.
2.3 Facteurs associés au suivi postgrossesse
L'adhésion au suivi postgrossesse des femmes avec un antécédent de DbG varie selon certaines caractéristiques démographiques, anthropométriques et métaboliques (Tableau 2). L'âge plus élevé, une plus faible parité, un âge gestationnel au diagnostic de DbG plus faible ont été identifiés comme des prédicteurs de l'adhésion au suivi dans plusieurs études (10,91,94-96). Au niveau des variables anthropométriques, un IMC ou un poids pré ou postgrossesse plus faibles ont été identifiés comme des prédicteurs de l'adhésion au suivi postgrossesse dans certaines études (91,94), alors qu'ils n'avaient aucun impact dans d'autres études (10,94,95,97). Le gain de poids durant la grossesse ne prédit pas l'adhésion au suivi postgrossesse (94), tout comme l'histoire familiale de DbT2 (10,97). Finalement, les données sont incohérentes quant à l'association entre l'usage d'insuline pendant la grossesse, l'ethnie, le niveau d'éducation, le revenu familial, le type d'accouchement, le poids du nouveau-né, la sévérité du DbG (valeurs diagnostiques des tests pendant la grossesse) ainsi que le nombre de grossesses avec DbG et l'adhésion au suivi postgrossesse (10,91,94-97).
Tableau 2. Adhésion au suivi postgrossesse selon des études nord-américaines
Références Stasenko et coll. (2010) (95)
1. Méthodes et 2 . % de femmes avant reçu un suivi
1. Cohorte rétrospective, États-Unis (Californie), n=745, 2002 à 2008 2. 33,7% (glycémie à jeun ou HGPO) de 0 à 6 mois postgrossesse
Prédicteurs de l'adhésion au suivi postgrossesse
Âge plus élevé, parité (nullipare), usage d'insuline pendant la grossesse
Aucun impact: ethnie, IMC maternel >25 kg/m2, niveau d'éducation, assurances
médicales privées ou publiques, statut conjugal, nombre de visites prénatales, type d'accouchement
Lawrence et coll. (2010) (96)
1. Étude rétrospective, États-Unis (Californie), n=l 1 825,
1999 à 2006
2. 50,2%o (glycémie à jeun ou HGPO) de 7 jours à 6 mois postgrossesse
Âge plus élevé, ethnie hispanique, niveau d'éducation plus élevé, revenu familial plus élevé, statut immigrant, parité plus faible, traitement du DbG sans médication ou avec insuline (sans agents oraux), accouchement naturel (sans césarienne) et d'un enfant de poids normal (sans macrosomie), avoir une visite médicale postgrossesse
Ferrara et coll. 1. Cohorte rétrospective, Âge plus élevé, ethnie asiatique ou
(2009) (91) États-Unis (Californie), n=14 hispanique, niveau d'éducation plus élevé, 448, 1995-2006 parité plus faible, âge gestationnel au
diagnostic de DbG plus faible, usage 2. 38,2% (glycémie à jeun ou d'insuline ou de glyburide pendant la HGPO) de 6 semaines à 1 an grossesse, visite médicale postpartum, poids
postgrossesse normal
Aucun impact: valeurs du test d'HGPO pendant la grossesse, accouchement d'un enfant de poids élevé (macrosomie), revenu familial
Kwong et coll. 1. Cohorte rétrospective, Âge plus élevé, parité plus faible, usage
(2009) (10) Canada (Edmonton), n=1006, d'insuline pendant la grossesse
1999 à 2006 Aucun impact: ethnie, antécédent de DbG, 2. 48,2% (glycémie à jeun ou
HGPO) de 6 semaines à 6 mois postgrossesse
histoire familiale de DbT2, valeurs du test d'HGPO pendant la grossesse, glycémie au diagnostic de DbG, A1C pendant la
grossesse, IMC pré-grossesse
Hunt et 1. Cohorte prospective, États- Parité plus faible, pas de DbG antérieur, non
Conway (2008) Unis (Texas), n=707, 2001 à usage d'insuline pour traiter le DbG, poids
(94) 2003 pré-grossesse plus faible, niveaux de glucose au diagnostic de DbG plus faibles, meilleur 2. 57% (glycémie à jeun ou contrôle glycémique pendant la grossesse HGPO) de 4 à 12 semaines Aucun impact: âge, histoire familiale de postgrossesse DbT2, macrosomie antérieure, traitement du
DbG avec glyburide, IMC pré-grossesse, gain de poids durant la grossesse, pré-éclampsie, accouchement prématuré,
césarienne, poids à la naissance, macrosomie
Almario et coll. 1. Étude rétrospective, États- Diagnostic de DbG à <24 semaines de (2008) (97) Unis (Philadelphie), n=745, gestation, usage d'insuline ou de glyburide
2004 à 2006 pendant la grossesse, diagnostic de DbG au test de charge de glucose de 50g
2. 20% (glycémie à jeun ou HGPO) de 5 à 12 semaines postgrossesse
Aucun impact: histoire familiale de DbT2, IMC postpartum, âge, revenu familial, nombre de grossesses avec DbG
Quelques études ont également tenté de déterminer quelles étaient les barrières au suivi postgrossesse ou les éléments facilitants. Selon des analyses qualitatives, les barrières principales au suivi postgrossesse sont reliées aux ajustements nécessaires avec la venue du nouveau-né et à la peur de recevoir un diagnostic de DbT2 lors du suivi, tandis que les éléments facilitants sont la disponibilité des soins au bébé pendant le suivi et le désir de recevoir un bilan de santé avant le retour au travail (98). Du côté des intervenants des soins de santé, le manque de communication et le manque de connaissances relatives aux lignes directrices en terme de suivi postgrossesse chez les femmes ayant eu un DbG sont des barrières à ce dernier (9). Une perception erronée au niveau du risque de DbT2 suite à un DbG pourrait aussi représenter une barrière au suivi postgrossesse (99,100). Les femmes avec un antécédent de DbG reconnaissent que cette condition est un facteur de risque d'un DbT2 subséquent, mais seulement une faible minorité de ces femmes se perçoivent elles-mêmes à risque de DbT2 (100).
Certaines mesures se sont avérées efficaces pour augmenter les taux de suivi chez les femmes ayant eu un DbG, comme un système de rappel adressé aux médecins (101), des rappels postaux aux patientes et aux médecins (102) ou des rappels aux patientes seulement (103). Malgré tout, les taux de suivi postgrossesse demeuraient inférieurs à 60% dans ces études, suggérant l'importance d'établir de nouvelles stratégies et d'identifier des mesures alternatives au suivi actuel (HGPO).
2.4 Mesures alternatives
Les tests d'HGPO sont contraignants et dispendieux et le désagrément associé à ce test serait une barrière au suivi postgrossesse des femmes avec un antécédent de DbG (104). L'identification de tests alternatifs plus simples a été proposée pour faciliter et accroître les taux de suivi chez les femmes avec un antécédent de DbG. Les principales mesures qui ont été évaluées et dont il sera question dans la présente section sont la glycémie à jeun, l'hémoglobine glyquée (A1C) et la circonférence de la taille.
2.4.1 Glycémie à jeun
Bien que cette mesure soit couramment utilisée en pratique clinique pour le dépistage du DbT2 dans la population générale, plusieurs études ont démontré que ce test ne serait pas
suffisamment sensible pour détecter les anomalies du métabolisme du glucose chez les femmes avec un antécédent de DbG en période postgrossesse (105). En effet, la sensibilité du test de glycémie à jeun n'est pas constante et varie de 14 à 100% selon les critères utilisés et le temps qui s'est écoulé depuis la dernière grossesse (105). D'autre part, jusqu'à 40% des cas d'intolérance au glucose et jusqu'à 75% des cas de DbT2 seraient manques si seulement la glycémie à jeun était mesurée plutôt que de réaliser un test d'HGPO (91). Deux autres études ont démontré que 16 à 30% des cas de DbT2 et de prédiabète n'étaient diagnostiqués que par la valeur de glycémie à 2h pendant l'HGPO et auraient donc été manques par le test de glycémie à jeun (94,106). Ces données suggèrent que bien que la glycémie à jeun soit un test simple et courant, le manque de sensibilité de ce test engendre une remise en question de sa pertinence pour le suivi postgrossesse des femmes ayant eu un DbG.
2.4.2 Hémoglobine glyquée
L'AÏC est une mesure simple, peu coûteuse et standardisée qui pourrait représenter une alternative intéressante au test d'HGPO en période postgrossesse. Cette mesure est également plus représentative du contrôle glycémique global et du risque de complications métaboliques à long terme comparativement aux valeurs de glycémie à jeun ou 2h post HGPO (107). L'AÏC présente également comme avantage d'être une mesure rapide qui ne nécessite pas de période déjeune (108) et cette mesure n'est pas influencée par l'ethnicité. Bien qu'une étude américaine ait démontré qu'il y avait une variabilité ethnique dans les niveaux d'AlC selon le statut de tolérance au glucose (109), aucun critère spécifique selon le groupe ethnique pour l'AlC n'a été déterminé (108). Les résultats de l'étude ORIGIN qui regroupe plus de 12 000 sujets de tous les continents ont récemment démontré que la valeur prédictive de l'AlC est adéquate peu importe la région géographique et l'ethnicité des groupes étudiés (110). Certains paramètres sanguins ou certaines conditions médicales (ex. hémoglobinopathie, anémie hémolytique, malaria chronique, perte sanguine majeure ou transfusion sanguine) peuvent toutefois influencer les valeurs d'AlC et doivent être considérés lors de l'utilisation de cette mesure (107). L'adéquation de cette mesure pour la détection d'anomalies du métabolisme du glucose n'a que très peu été étudiée chez les femmes avec un antécédent de DbG. Les résultats de l'étude d'Ekelund et coll. réalisée
chez 174 femmes ayant eu un DbG ont démontré qu'à un an, deux ans et cinq ans postgrossesse, les femmes normo glycémiques avaient des niveaux d'AlC plus faibles que les femmes avec de l'intolérance au glucose ou un DbT2 (56). Aucun test de sensibilité et de spécificité n'a été réalisé dans cette étude. Selon Kim et coll., la concordance de l'AlC avec les valeurs de glycémie postgrossesse compliquée par un DbG serait, au mieux, acceptable (111). Cette étude a été réalisée auprès de 54 femmes entre six semaines et 36 mois postgrossesse. Leurs résultats ont démontré que l'AlC >5,7% avait une sensibilité de 75% et une spécificité de 62% avec une aire sous la courbe ROC (Receiver operating characteristics) de 0,77 pour l'anomalie de la glycémie à jeun (glycémie à jeun >5,6 mmol/L). La courbe ROC est une représentation graphique mettant en relation la sensibilité et la spécificité d'un test et permettant ainsi de déterminer et de comparer les performances diagnostiques de ce dernier. Une aire sous la courbe de 0,5 est représentative d'un test dont le pouvoir discriminatif est nul (Figure 3). L'AÏC >5,7% avait également une sensibilité de 65% et une spécificité de 68% avec une aire sous la courbe ROC de 0,76 pour l'intolérance au glucose (glycémie 2h post HGPO >7,8 mmol/L). L'AÏC n'a cependant pu être étudiée dans un contexte de dépistage du DbT2 dans cette étude puisqu'il y avait un nombre insuffisant de sujets atteints de DbT2.
£
« M O c'E
> QJ ■a X! 2 o.oo B O OJ 1.00 0.75 0.60 0.25Courbe ROC du modèle
Aire sous la courbe=0,7137
Courbe du test Seuil diagnostique diagnostique
*v ^
faiMe
Seuildiagnostique
élevé Courbe de discrimination nulle 0.00 0.25 0.50 0 75 1.00 1-Spécifîcité (Taux de « faux positif »), % Figure 3. Représentation graphique d'une courbe ROCLe nombre limité d'études et le faible nombre de sujets inclus dans ces dernières ne permettent pas de statuer sur la validité de l'AlC comme test diagnostique pour les anomalies du métabolisme du glucose et le DbT2 en période postgrossesse chez les femmes avec un antécédent de DbG.
2.4.3 Circonférence de la taille
La circonférence de la taille est associée à un risque accru de maladies cardiovasculaires et de DbT2 (112-114). Cette mesure a également été associée à la résistance à l'insuline, notamment chez les femmes (115-117). La circonférence de la taille prédit l'incidence du DbT2 indépendamment des facteurs de risque traditionnels et de 1TMC (118). Il s'agit d'une mesure simple et standardisée qui peut facilement être réalisée en contexte clinique (119,120). La mesure de la circonférence de la taille consiste en deux mesures répétées à mi-chemin entre la dernière côte (flottante) et la crête iliaque (Figure 4) (119).
Dernière côte Site de la mesure Crête iliaque
Figure 4. Mesure de la circonférence de la taille, adaptée de la Chaire Internationale sur le Risque Cardiométabolique (121)
Il a été démontré que les femmes avec un antécédent de DbG présentaient une circonférence de la taille plus élevée comparativement aux femmes qui avaient eu une grossesse normo glycémique (122,123). Cependant, aucune étude n'a évalué la relation entre la circonférence de la taille et le profil métabolique spécifiquement chez des femmes avec un antécédent de DbG.
La mesure de la circonférence de la taille pourrait donc présenter un complément ou une alternative intéressante dans le cas du dépistage postgrossesse chez les femmes avec un antécédent de DbG afin de détecter les femmes présentant de la résistance à l'insuline et un risque accru de DbT2.
3. Prévention et habitudes de vie
3.1 Interventions
L'importance de la prévention du DbT2 chez les femmes avec un antécédent de DbG est bien établie. Selon l'ACD, un programme structuré de modifications du mode de vie incluant une perte de poids modérée et la pratique régulière d'activité physique ou un traitement pharmacologique sont efficaces et doivent être mis en place et envisagés pour les personnes à risque de DbT2, incluant les femmes avec un antécédent de DbG (4). Toutefois, certaines études ont démontré que 1'implementation de mesures préventives chez les femmes avec un antécédent de DbG comporte plusieurs difficultés.
3.1.1 Habitudes de vie
Les résultats du Finnish Diabetes Prevention Study (DPS) et du Diabetes Prevention Program (DPP) ont démontré que des interventions au niveau des habitudes de vie s'avèrent hautement efficaces pour prévenir le DbT2 dans la population générale (7,8). Des analyses d'un sous-échantillon du DPP ont permis de démontrer que chez des femmes avec un antécédent de DbG, une diminution de la progression vers le DbT2 de 53% était observée suite à une intervention ciblant une perte de poids modérée induite par des changements alimentaires et une pratique régulière d'activité physique (6).
Autrement, peu d'interventions ont été réalisées spécifiquement chez les femmes ayant eu un DbG. Des interventions visant une augmentation de la pratique d'activité physique ont été réalisées chez des femmes avec un antécédent de DbG, mais les résultats à ce jour ne sont pas concluants. Une intervention de type « centrée sur le patient » réalisée chez 43 femmes ayant eu un DbG ou non s'est avérée inefficace pour augmenter la pratique d'activité physique en période postgrossesse (124). D'autres études basées sur des théories
de changement de comportement (théorie sociale cognitive ou modèle transthéorique) ne sont également pas parvenues à augmenter la pratique d'activité physique sur des périodes de trois mois ou un an (125,126). Ces études indiquent d'importantes difficultés au niveau du recrutement et de la rétention des femmes en période postgrossesse et suggèrent la nécessité de développer de nouvelles approches d'intervention (124-126).
3.1.2 Pharmacologiques
Plusieurs traitements pharmacologiques ont également été évalués pour diminuer la progression vers le DbT2 chez les femmes ayant eu un DbG. La metformine est un biguanide couramment utilisé pour le traitement du DbT2 qui diminue la production hépatique de glucose et diminue la résistance à l'insuline. La metformine serait aussi efficace que des interventions au niveau des habitudes de vie pour prévenir ou retarder le risque de DbT2 chez des femmes avec un antécédent de DbG et présentant de l'intolérance au glucose (6). L'acarbose s'est aussi avéré efficace pour diminuer l'incidence du DbT2, mais il n'a pas été évalué spécifiquement chez des femmes ayant eu un DbG (127). Des agonistes de PPAR-y, les thiazolidinediones, diminuent la résistance à l'insuline et la progression vers le DbT2 chez des femmes avec un antécédent de DbG (128,129). Cependant, des préoccupations au niveau de la sécurité des thiazolidinediones limitent leur utilisation à grande échelle. Malgré l'efficacité de certains traitements pharmacologiques pour prévenir le risque de DbT2 chez les femmes avec un antécédent de DbG, les lignes directrices actuelles préconisent la promotion d'un mode de vie sain.
Ainsi, l'efficacité d'interventions ciblant les habitudes de vie chez les femmes avec un antécédent de DbG est reconnue, mais davantage d'études demeurent nécessaires pour développer des stratégies qui permettent aux femmes d'adopter et de maintenir un mode de vie sain en période postgrossesse.
3.2 Recommandations actuelles
Il a donc été démontré que la prévention du DbT2 et des complications métaboliques y étant associées chez les femmes avec un antécédent de DbG était possible via l'adoption de saines habitudes de vie. À cet égard, l'ACD recommande aux femmes avec un antécédent
de DbG d'adopter un mode de vie sain suite à leur grossesse incluant; la pratique régulière d'activité physique, une saine alimentation et l'allaitement maternel exclusif (4). Les effets bénéfiques associés à chacune de ces habitudes de vie et les recommandations spécifiques qui s'y rattachent seront discutés dans la présente section.
3.2.1 Alimentation
Alors que la thérapie nutritionnelle est reconnue comme étant une composante centrale dans le traitement du DbT2, il n'y a actuellement aucune recommandation nutritionnelle propre à la prévention du DbT2 (4). Le Guide alimentaire canadien représente les recommandations alimentaires, en terme de groupes d'aliments pour les Canadiens afin d'optimiser leur état de santé (130) (Tableau 3).
Tableau 3. Recommandations alimentaires canadiennes pour les femmes de 18-50 ans
Groupe Portions
Légumes et fruits 7-8 Produits céréaliers 6-7
Lait et substituts 2
Viandes et substituts 2
Adapté du Guide alimentaire canadien, 2007 (130)
Plusieurs nutriments, aliments ou profils alimentaires ont été associés à la prévention du DbT2. Certains nutriments ont été associés à une plus faible résistance à l'insuline/risque de DbT2. Par exemple, certaines études ont démontré un effet préventif des fibres alimentaires (131), des acides gras mono et poly insaturés (132-134), du magnésium (131,135) et des antioxydants (136) tandis que les acides gras saturés et trans ont été associés à une résistance à l'insuline plus élevée (132-134). L'effet de ces nutriments sur le risque de DbT2 serait modulé par les effets aux niveaux oxydatif et inflammatoire ainsi que sur la dysfonction endothéliale (Figure 5) (137). Les résultats quant à l'effet des nutriments sur le risque de DbT2 ne sont toutefois pas toujours concluants et il est difficile de cerner
l'effet sur le risque de DbT2 associé à un nutriment unique puisqu'il est généralement inclus dans un aliment ou un régime complexe.
Fibres alimentaires Acides gras mono/poly insaturés
Magnésium Antioxydants
Acides gras saturés Acides gras trans
Résistance à l'insuline Sécrétion d'insuline
DbT2
Génétique
Figure 5. Effets de certains nutriments sur le risque de développer le DbT2, adapté de Salas-Salvadô et coll. 2011 (137)
Au niveau des aliments, la consommation de boissons sucrées (138), de viande rouge (139) et d'aliments riches en matières grasses hydrogénées (132) a été associée à un risque accru de DbT2 tandis que la consommation de produits laitiers (140), de légumes et fruits (141), de produits céréaliers à grains entiers (142) et d'alcool (143) a été associée à une diminution du risque de DbT2. L'étude des profils alimentaires a également permis de définir des combinaisons alimentaires associées à un risque plus faible de DbT2. L'étude des profils alimentaires permet de considérer comment les aliments et les nutriments sont consommés, en combinaisons, et l'effet de ces combinaisons alimentaires sur le profil métabolique (144). L'étude des profils alimentaires offre donc une perspective plus complète de l'évaluation nutritionnelle comparativement à l'étude des nutriments ou des aliments de façon individuelle. Des profils alimentaires à priori peuvent être établis en se
basant sur des index de qualité alimentaire, comme VHealthy Eating Index (HEI) (index de saine alimentation) et son dérivé Y Alternate Healthy Eating Index (A-HEI) (145-147) ou encore le score méditerranéen (148-150) (Tableau 4). L'HEI représente un index de qualité alimentaire adéquat pour évaluer l'alimentation des Canadiens (151). Des scores élevés pour l'HEI (146,152,153) ou l'alimentation méditerranéenne (154-156) ont été associés à une réduction du risque de DbT2. Des profils alimentaires à posteriori peuvent également être dérivés à l'aide de méthodes statistiques. Ces profils sont généralement de type « western », riche en aliments transformés, viande rouge, produits céréaliers raffinés ou de type « prudent », riche en légumes et fruits, produits à grains entiers, légumineuses et poisson (157). Plusieurs études ont démontré qu'une alimentation de type « western » est associée à un risque accru de DbT2 (158-161).
Tableau 4. Comparaison d'indices de qualité alimentaire selon les composantes incluses
Composantes
alimentaires «El A-HE, Méditerranéenne
Produits laitiers -
1
Légumes
T
î
Fruits
î
î
Noix, graines
î
î
Produits céréaliers î (fibres alimentaires)
î
Viande et substituts blanche:rouge) t (ratio viande t poisson l viandeCholestérol -
-Matières grasses l totales et saturées t (ratio poly:sat) J. trans f (ratio mono:sat)
Sodium
l
--Alcool - î (modéré)
T
Multivitamines -
î
-HEI Healthy Eating Index; A--HEI Alternate Healthy Eating Index
3.2.2 Activité physique
Selon la Société canadienne de physiologie de l'exercice (SCPE), « les adultes âgés de 18 à 64 ans devraient pratiquer chaque semaine au moins 150 minutes d'activité physique aérobie d'intensité modérée à élevée en séances d'au moins dix minutes » (163). Selon certaines études, l'activité physique prégrossesse serait associée à un risque plus faible de DbG (50,164,165). L'activité physique est également recommandée pendant la grossesse (166) et serait associée à une diminution du risque de DbG (49).
En période postgrossesse, les femmes avec un antécédent de DbG devraient suivre les recommandations de la SCPE en matière d'activité physique (4). Plusieurs études ont démontré qu'une pratique régulière d'activité physique a un impact positif au niveau du muscle squelettique et de la composition corporelle ce qui en retour, contribue à prévenir la progression vers l'intolérance au glucose ou le DbT2 (Figure 6).
3 15 %-» O < Muscle squelettique î Capacité métabolique Préservation masse musculaire
Composition corporelle
l Tissu adipeux viscéral Gestion/perte de poids ( r > Tolérance au glucose normale J # - Intolérance au glucose $ Diabète de type 2 Génétique et facteurs environnementaux
Figure 6. Mécanismes liés à la prévention du DbT2 par la pratique d'activité physique
Au niveau du muscle squelettique, l'activité physique engendre une amélioration de sa capacité métabolique ainsi qu'une préservation de la masse musculaire (167). Le muscle squelettique représente un organe cible de l'insuline et joue un rôle clé dans la régulation
du métabolisme glucidique. La pratique d'activité physique améliore la capacité oxydative mitochondriale (oxydation optimale des acides gras libres) et la signalisation de l'insuline dans le muscle squelettique, ce qui se traduit en une diminution de la résistance à l'insuline (168). L'effet sur la composition corporelle consiste principalement en une diminution du tissu adipeux viscéral (168) et une meilleure gestion du poids corporel ou sa diminution (167). Les effets de l'activité physique sur la perte de poids sont particulièrement importants chez les personnes préalablement sédentaires (168). Ces changements associés à la composition corporelle influencent les concentrations plasmatiques d'adipokines, molécules ayant un impact sur la signalisation de l'insuline (167). La diminution du tissu adipeux viscéral associée à la pratique d'activité physique est considérablement importante étant donné l'association de cette composante avec le profil athérogénique et la résistance à l'insuline (168).
Conjointement, tous ces effets de l'activité physique contribuent à prévenir ou retarder le risque de DbT2 et justifient la recommandation d'activité physique pour la prévention de cette complication métabolique.
3.2.3 Allaitement maternel
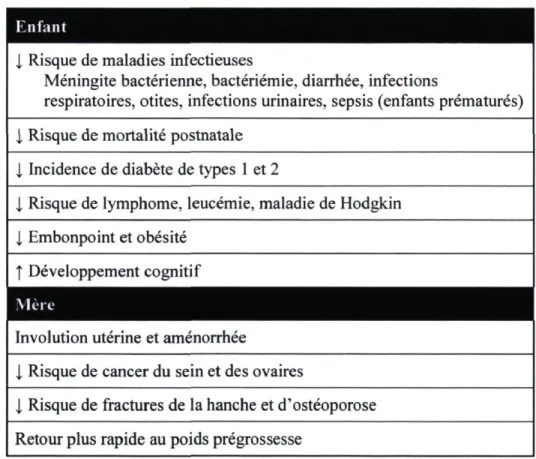
L'allaitement maternel est recommandé aux femmes suite à une grossesse (169). Les effets bénéfiques de l'allaitement maternel, tant pour la mère que pour l'enfant, sont bien reconnus, mais la durée optimale d'allaitement demeure débattue dans la littérature scientifique (170). Actuellement, l'organisation mondiale de la santé (OMS) recommande aux femmes d'allaiter exclusivement pendant six mois (169). Selon ces recommandations, l'allaitement peut ensuite être maintenu jusqu'à deux ans, voire plus, tout en introduisant d'autres aliments. Santé Canada et la Société canadienne de pédiatrie ont également adopté cette recommandation (171,172). L'allaitement exclusif est défini comme l'alimentation d'un enfant avec du lait maternel uniquement, sans eau, substituts de lait et autres liquides ou solides (173). Selon une revue de littérature de Kramer et coll., il n'y a aucun effet néfaste de l'allaitement exclusif jusqu'à six mois et les bénéfices associés à l'allaitement maternel justifient cette recommandation (170). Le Tableau 5 présente certains des bienfaits associés à l'allaitement maternel au niveau de la santé de l'enfant et de la mère et sur
lesquels sont basées les recommandations en matière d'allaitement de la Société canadienne de pédiatrie (172) et de l'Académie américaine de pédiatrie (174).
Tableau 5. Effets bénéfiques associés à l'allaitement maternel chez l'enfant et la mère
l Risque de maladies infectieuses
Méningite bactérienne, bactériémie, diarrhée, infections
respiratoires, otites, infections urinaires, sepsis (enfants prématurés) i Risque de mortalité postnatale
l Incidence de diabète de types 1 et 2
i Risque de lymphome, leucémie, maladie de Hodgkin j, Embonpoint et obésité
î Développement cognitif
Involution utérine et aménorrhée
l Risque de cancer du sein et des ovaires
l Risque de fractures de la hanche et d'ostéoporose Retour plus rapide au poids prégrossesse
Inspiré de Gartner et coll. 2005 (174) et de Boland et coll. 2005 (172) Outre les effets bénéfiques mentionnés ci-dessus, plusieurs études ont également démontré un effet bénéfique de l'allaitement maternel sur le risque de DbT2 et cette association s'avère particulièrement intéressante dans une optique de prévention pour les femmes avec un antécédent de DbG. Plusieurs études se sont intéressées à l'effet de l'allaitement maternel sur le risque de DbT2 chez les femmes en général. Bien que les résultats d'une étude de cohorte prospective n'aient démontré aucune relation dose-réponse entre la durée d'allaitement et les marqueurs métaboliques et inflammatoires trois ans postgrossesse (175), plusieurs études ont démontré une association inverse entre la durée d'allaitement et l'incidence du DbT2 ou de SM (176-179). Les résultats d'une étude populationnelle
américaine ont également démontré que les femmes qui allaitaient moins d'un mois après l'accouchement présentaient un risque accru de DbT2 et ce, indépendamment de la pratique d'activité physique et de 1TMC (180). Chez les femmes avec un antécédent de DbG, la relation entre le développement du DbT2 et l'allaitement maternel demeure incertaine, mais il semble y avoir une amélioration de la tolérance au glucose dans les premiers mois postgrossesse en présence de l'allaitement maternel (181). Les femmes avec un antécédent de DbG qui allaitent présentent une meilleure fonction des cellules P du pancréas (182) et une meilleure tolérance au glucose (183) comparativement aux femmes qui n'allaitent pas.
Les mécanismes associant l'allaitement et le DbT2 demeurent imprécis. La prolactine et les faibles niveaux d'œstradiol associés à l'allaitement pourraient être associés aux effets bénéfiques observés (184). L'hypothèse de réinitialisation du métabolisme maternel par l'allaitement a été suggérée par Stuebe et coll. (Figure 7) (185). Selon cette hypothèse, l'allaitement permettrait un retour plus rapide et complet de certains changements métaboliques défavorables (accumulation de tissu adipeux viscéral, résistance à l'insuline, augmentation des niveaux de lipides et de triglycérides sanguins) qui surviennent pendant la grossesse (185). Résistance à l'insuline, hyperlipidémie, tissu adipeux viscéral Grossesse
C
Métabolisme pré-grossesse Sans l'allaitement, les changements métaboliques liés à la grossesse persistent pendant une pluslongue période
Figure 7. Théorie de la réinitialisation du métabolisme liée à l'allaitement maternel, adaptée de Stuebe et coll. 2009 (185)
Ainsi, l'allaitement maternel, tout comme la saine alimentation et la pratique régulière d'activité physique, doivent être encouragés chez les femmes avec un antécédent de DbG afin de prévenir ou retarder le risque de DbT2. Cependant, bien que l'effet de ces trois composantes individuellement sur le risque métabolique soit bien connu, aucune étude n'a vérifié si les femmes avec un antécédent de DbG qui adoptaient toutes les recommandations établies par l'ACD présentaient un profil métabolique favorable.
3.3 Habitudes de vie postgrossesse
L'importance de l'adoption de saines habitudes de vie pour la prévention du DbT2 est clairement établie. Cependant, plusieurs études ont démontré que le mode de vie des femmes avec un antécédent de DbG n'était pas optimal suite à la grossesse, c'est-à-dire que ces femmes n'atteignaient pas les recommandations actuelles pour la prévention du DbT2 telles qu'énumérées précédemment. Il est important de bien connaître le mode de vie actuel des femmes ayant eu un DbG et les barrières à l'adoption de saines habitudes de vie afin de mieux orienter les interventions chez cette population.
3.3.1 Alimentation
Des séances d'éducation en nutrition pendant une grossesse compliquée par un DbG sont efficaces pour amener des changements alimentaires favorables (consommation accrue de produits laitiers, de protéines, de fibres alimentaires et augmentation de la fréquence de repas), mais ces changements ne semblent pas être maintenus en période postgrossesse (186). Stage et coll. ont toutefois démontré que la proportion de femmes consommant une diète riche en matières grasses en période postgrossesse diminuait (47% vs 74%) comparativement à la période prégrossesse (12). Néanmoins, seulement près d'un quart des femmes avec un antécédent de DbG consommeraient au moins 5 portions de légumes et fruits par jour (13) et ces femmes ne consommeraient pas suffisamment de fibres alimentaires et de calcium (186). Kim et coll. ont démontré qu'en période postgrossesse compliquée par un DbG, l'alimentation des femmes qui développent un DbT2 contient davantage de lipides, principalement des acides gras saturés et monoinsaturés et des protéines animales comparativement aux femmes dont la tolérance au glucose était préservée (187). Ainsi, tout comme les femmes de la population canadienne générale (188),
une proportion importante de femmes n'adopte pas une saine alimentation en période postgrossesse.
3.3.2 Activité physique
Des données canadiennes ont démontré que 52,5% des femmes rapportent être au moins modérément actives dans leurs activités de loisirs alors que des données mesurées indiquent que moins de 15% des femmes adultes atteignent les recommandations en matière d'activité physique (189). Les femmes avec un antécédent de DbG ne font pas exception et leur pratique d'activité physique en période postgrossesse est insuffisante.
En effet, selon Yun et coll., 32% des femmes avec un antécédent de DbG rapportent ne pratiquer aucune activité physique et 57% n'atteignent pas les recommandations d'activité physique (150 minutes/semaine) (44). Des résultats similaires ont été observés chez des femmes danoises alors qu'environ 40% des femmes avec un antécédent de DbG rapportaient ne pratiquer aucune activité physique entre un et quatre ans postgrossesse (12). D'un autre côté, selon Retnakaran et coll., les femmes ayant eu une grossesse compliquée par un DbG augmentent significativement leur pratique d'activité physique entre la période pré-grossesse et un an postgrossesse et ce, seulement en ayant reçu des conseils en groupe pendant la grossesse sur les changements souhaitables au niveau de leurs habitudes de vie (190). Une autre étude a toutefois démontré une baisse de la pratique d'activité physique en période postgrossesse chez les femmes avec un antécédent de DbG (191) et la majorité des études indiquent que ces femmes n'atteignent pas les recommandations en matière d'activité physique (12,13,192).
3.3.3 Allaitement maternel
Les recommandations en matière d'allaitement ne semblent également pas respectées chez les femmes après une grossesse compliquée par un DbG. Selon une revue de la littérature réalisée par Gunderson et coll., il semblerait que les femmes dont la grossesse est compliquée par le diabète ou le DbG allaitent moins que les femmes sans complication métabolique pendant la grossesse (193). Les résultats d'une étude prospective allemande incluant 257 femmes avec et 527 sans antécédent de DbG ont démontré que les femmes
avec un antécédent de DbG, et principalement celles obèses, allaitent significativement moins et pendant moins longtemps que les femmes sans complication pendant la grossesse (194). Une étude observationnelle américaine réalisée par Kjos et coll. dans les années 1990 a également démontré que chez des femmes avec un antécédent de DbG (n=809), 50% des femmes n'initiaient pas l'allaitement après l'accouchement (183). Selon une étude irlandaise regroupant 520 femmes avec ou sans antécédent de DbG, 37% des femmes avaient cessé d'allaiter à 3 mois postgrossesse (18).
Les faibles taux d'allaitement maternel chez les femmes avec un antécédent de DbG pourraient s'expliquer, en partie, par une plus grande difficulté à initier l'allaitement. Il a été démontré que la lactogénèse pouvait être retardée en présence d'obésité ou de diabète maternel (181,195,196).
4. Objectifs et hypothèses
La prévention du DbT2 chez les femmes ayant eu un DbG constitue un enjeu de santé publique majeur. Cependant, les taux de suivi postgrossesse chez ces femmes demeurent nettement trop faibles. À ce jour, aucune alternative aux tests d'HGPO n'a été jugée satisfaisante en période postgrossesse chez ces femmes et aucune étude n'a évalué si des combinaisons de mesures simples, telles que l'AlC et la circonférence de la taille pouvaient adéquatement identifier les femmes présentant un risque métabolique accru. D'autre part, bien que certaines études aient démontré que les femmes avec un antécédent de DbG ne semblaient pas adopter de saines habitudes de vie en période postgrossesse, aucune étude n'a évalué conjointement l'adoption des ces habitudes de vie et la relation avec le profil métabolique chez des femmes ayant eu un DbG.
L'objectif général de ce projet de maîtrise était d'une part d'identifier une méthode de suivi postgrossesse simple et sensible pour détecter les anomalies du métabolisme du glucose chez les femmes avec un antécédent de DbG et d'autre part de qualifier le mode de vie de ces femmes en période postgrossesse et la relation avec les complications métaboliques associées au DbT2. Les objectifs spécifiques étaient :
Objectif spécifique #1 :
L'objectif était d'examiner l'adéquation de deux mesures simples et non dispendieuses, l'AlC et la circonférence de la taille, pour identifier et prédire les anomalies du métabolisme du glucose chez des femmes avec un antécédent de DbG.
Hypothèse spécifique #1 :
Nous avons émis l'hypothèse que l'usage combiné de l'AlC et de la circonférence de la taille permet d'identifier les femmes avec un antécédent de DbG qui présentent une anomalie du métabolisme du glucose.
Objectif spécifique #2 :
L'objectif était d'examiner la proportion de femmes avec un antécédent de DbG qui adopte des mesures préventives suite à leur grossesse.
Hypothèse spécifique #2 :
Nous avons émis l'hypothèse que la majorité des femmes avec un antécédent de DbG n'adoptent pas les mesures préventives recommandées suite à leur grossesse.
Objectif spécifique #3 :
L'objectif était d'examiner la relation entre l'adoption des mesures préventives recommandées suite à la grossesse et les profils anthropométriques et métaboliques.
Hypothèse spécifique #3 :
Enfin, nous avons émis l'hypothèse que les femmes ayant eu un DbG qui adoptent les mesures préventives recommandées suite à leur grossesse ont une probabilité réduite de présenter un profil métabolique altéré comparativement aux femmes qui n'en adoptent aucune.
5. Méthodologie
Ce projet de maîtrise s'inscrit dans le cadre d'un projet plus large intitulé «Déterminants de l'adoption de mesures préventives chez les femmes ayant eu un diabète gestationnel » financé par les Fonds de recherche en santé du Québec et approuvé par le Comité d'éthique médicale de l'Université Laval. Ce projet de recherche est sous la direction de Dre. Julie