Préconcentration de l'uranium et du plutonium dans les
poissons par extraction au point trouble
Mémoire
Alexa Leblanc
Maîtrise en chimie - avec mémoire
Maître ès sciences (M. Sc.)
Préconcentration de l’uranium et du plutonium
dans les poissons par extraction au point trouble
Mémoire
Alexa Leblanc
Sous la direction de :
Résumé
Le développement méthodologique d’une approche simplifiée visant à extraire et à quantifier l’uranium et le plutonium à partir d’échantillons de poisson par l’ICP-MS est l’objectif principal de ces travaux de maîtrise. Pour ce faire, la méthode d’extraction au point trouble (CPE) est utilisée. Cette méthode permet de séparer les actinides de la matrice et de les préconcentrer dans un faible volume de surfactant. L’utilisation d’un agent d’extraction sélectif permet de former des complexes avec l’uranium et le plutonium puis de les incorporer à l’intérieur des micelles. L’agent d’extraction P,P-di (2-éthylhexyle) de l’acide méthanediphosphonique (H2DEH[MDP]) est utilisé car celui-ci a
un potentiel d’extraction élevé pour les actinides. Puisque l’uranium et le plutonium ont de long temps de demi-vie, les analyses peuvent être effectuées par l’ICP-MS pour connaître les ratios isotopiques de ces derniers. Toutefois, avant de procéder à l’extraction au point trouble et de réaliser les analyses, les échantillons de poisson sont traités pour éliminer l’eau et la matière organique qui peuvent interférer avec la formation des micelles. Les diverses étapes nécessaires pour la mise en solution, leurs compatibilités avec l’approche CPE et la mesure par ICP-MS seront présentées pour l’analyse de larges quantités (˃ 500 g) de poissons frais.
Abstract
The methodological development of a simplified approach to extract and quantify uranium and plutonium from fish samples by ICP-MS is the main goal of this master’s work. To do this, the cloud point extraction method (CPE) is used. This method allows the actinides to be separated from the matrix and preconcentrated in a small volume of surfactant. The use of a selective ligand makes it possible to form a complex with uranium and plutonium and then to transfer it inside the micelles. The ligand P, P-di (2-ethylhexyl) of methanediphosphonic acid (H2DEH[MDP]) is used because it
has a high extraction potential for actinides. Since uranium and plutonium have a long-half-life, analyzes can be performed by ICP-MS, to know the isotopic ratios of the latter. However, prior to cloud point extraction and analysis, fish samples are processed to remove water and organic matter that can interfere with micelle formation. The various stages required for dissolution, their compatibility with the CPE approach and ICP-MS measurement will be presented for the analysis of large quantities (˃ 500 g) of fresh fishes.
Table des matières
Résumé ... iii
Liste des tableaux ... vi
Liste des figures ... vii
Liste des abréviations ... viii
Remerciements ... x 1. Introduction ... 1 1.1 Mise en contexte... 1 1.2 Problématique ... 5 1.3 Objectifs du projet ... 5 2. Théorie ... 7 2.1 Uranium ... 7 2.2 Plutonium ... 8
2.3 Mobilité de l’uranium et du plutonium dans le milieu aquatique ... 10
2.4 Méthodes de mise en solution des tissus biologiques de poisson ... 18
2.5 Technique d’extraction au point trouble (CPE) ... 19
2.5.1 Principe de l’extraction au point trouble ... 20
2.5.2 Les réactifs utilisés et leurs rôles pour l’extraction de l’uranium et du plutonium ... 23
2.6 Les instruments d’analyse ... 25
2.6.1 La spectrométrie de masse par plasma à couplage inductif (ICP-MS)... 25
2.6.2 La spectrométrie d’émission optique par plasma à couplage inductif (ICP-OES) .... 27
3. Méthodologie... 30
3.1 Méthode de préparation d’échantillon de tissu biologique de poisson ... 30
3.2 Extraction au point trouble ... 32
4. Résultats et discussion ... 37
4.1 Méthode de préparation d’échantillon de tissu biologique de poisson ... 37
4.1.1 Broyage et déshydratation ... 38
4.1.2 Calcination ... 40
4.1.3 Digestion ... 43
4.2 Extraction au point trouble ... 46
5. Conclusions et perspectives ... 60
6. Travaux futurs ... 62
Bibliographie ... 64
Annexe 1 ... 67
Liste des tableaux
Tableau 1 : Exemple de distribution et de bioaccumulation du plutonium 239 et 240 dans la morue,
le hareng et la plie grise…. ………17
Tableau 2 : Comparaison des méthodes de préparation d’échantillon biologique de la littérature…19 Tableau 3 : La température au point trouble et la concentration micellaire critique selon la longueur de la chaîne de polyéthylène glycol du Triton X...………..22
Tableau 4 : Comparaison de l’extraction de l’uranium et du plutonium par CPE de la littérature…23 Tableau 5 : Paramètres et conditions pour la première et la deuxième CPE pour 0,5 g de cendres..33
Tableau 6 : Conditions instrumentales pour l’analyse de l’uranium et du plutonium par ICP-MS...35
Tableau 7 : Conditions instrumentales pour l’analyse de l’uranium par ICP-OES………36
Tableau 8: Vérification de la récupération d’uranium pour chaque étape de la méthode de préparation d’échantillon………38
Tableau 9 : Récupération d’uranium avec ou sans broyage………...39
Tableau 10 : Perte d’eau pour un échantillon de 50 grammes de chair selon la durée de la déshydratation……….40
Tableau 11 : Récupération d’uranium selon la température de calcination………...40
Tableau 12 : Masse de l’échantillon de poisson après la première calcination selon la durée moyenne………..42
Tableau 13 : Masse de l’échantillon de poisson après la deuxième calcination selon la durée…….42
Tableau 14: Comparaison de la récupération d’uranium avec et sans H2O2………..43
Tableau 15 : Récupération d’uranium et de plutonium dans 50 grammes de chair de saumon et dans une dorade grise entière………..45
Tableau 16 : Concentrations de quelques éléments présents dans les cendres de poisson………….46
Tableau 17 : Paramètres et conditions pour la CPE de Labrecque et ses collègues…...…….47
Tableau 18: Seuil de tolérance de la CPE pour certains anions et cations…….………48
Tableau 19: Résultats pour les CPE avec ajout de K3PO4………..…………52
Tableau 20 : Seuils de tolérance de la CPE pour certains éléments présents dans les cendres de poisson………52
Tableau 21 : Récupération d’uranium pour différentes masses de cendre et dilution………54
Tableau 22 : Paramètres et conditions pour la CPE après optimisation……….56
Tableau 23 : Paramètres et conditions optimisés pour la M-CPE………..58
Liste des figures
Figure 1 : Les pastilles à l’intérieur de la calandre...….1
Figure 2 : Fonctionnement d’un réacteur de type CANDU….……… 2
Figure 3 : Fission d’un noyau d’uranium 235….……….4
Figure 4 : Rapport massique 235U/238U pour des échantillons de blé et de salade prélevés à proximité de l’usine COMURHEX de Malvési………....8
Figure 5 : Comparaison des ratios d’activité de différentes sources de plutonium avec les retombés d’essai d’arme nucléaire. [17] ………..10
Figure 6 : Diagramme de Pourbaix de l’uranium……...………11
Figure 7 : Pourcentage d’espèce d’uranium selon le pH pour différents systèmes :A) UO2-H2O-CO2, B) UO2-H2O-humâtes, C) UO2-H2O-SO4 et D) UO2-H2O……….13
Figure 8 : Diagramme de Pourbaix du plutonium…..………14
Figure 9 : Transfère de l’uranium et du plutonium dans les différents compartiments environnementaux. ………15
Figure 10 : Distribution de l’uranium dans différents organes et tissus du grand corégone nourrit avec une alimentation contenant 10 000 µg U/g pendant 10, 30 et 100 jours……..……….18
Figure 11 : Structure générale de la famille du Triton X…..……….20
Figure 12 : Formation de micelle en solution...…...21
Figure 13 : Agent d’extraction H2DEH[MDP]..………..………...24
Figure 14: Schéma d’un ICP-MS………...27
Figure 15 : Schéma d’un ICP-OES...…...28
Figure 16 : Creusets et verres de montre utilisés lors du traitement des échantillons………31
Figure 17 : Schéma de la méthode de préparation d’échantillon de tissu biologique………32
Figure 18 : Exemple de cendres totalement blanches après la deuxième calcination………32
Figure 19 : Procédure générale de la CPE utilisant un surfactant de type Triton X……..…………34
Figure 20 : Méthode de préparation d’échantillon de tissu biologique de départ………..37
Figure 21 : Comparaison de la méthode de préparation d’échantillon de tissu biologique de départ (A) et celle finale (B)………..44
Figure 22 : Spectre infrarouge expérimental de cendres de poisson (A) et les spectres infrarouges de l’hydroxyapatite (Ca10(PO4)6(OH)2(CO3)x) (B)…….………49
Figure 23 : Effet des phosphates et des sulfates sur l’absorption du Np(IV) par la résine Dipex…..51
Figure 24 : Rétention de l’Am sur la résine Dipex en présence de Ca(II), Al(III), Fe(II) et Fe(III) dans du HCl 1 mol/L, 2 mol/L et 4 mol/L…..………53
Figure 25 : Récupération de l’uranium selon la concentration de TTX-114 et de H2DEH[MDP]…57 Figure 26 : Schéma de la technologie ColdBlock….……….62
Liste des abréviations
CANDU : CANada Deutérium UraniumCCSN : Commission canadienne de sûreté nucléaire CPE : Extraction au point trouble
ICP-MS : Spectrométrie de masse par plasma à couplage inductif
ICP-OES : Spectrométrie d’émission optique par plasma à couplage inductif IRSN : Institut de radioprotection et de sûreté nucléaire
HA : Acide humique FA : Acide fulvique
DLLME : Micro-extraction liquide-liquide dispersive CMC : Concentration micellaire critique
CPT : Température au point trouble TTX-100 : Triton X-100
TTX-114 : Triton X-114
H2DEH[MDP] : P,P-di(2-éthylhexyle) de l’acide méthanediphosphonique
CTAB : Bromure de céthyltriméthylammonium KBrO3 : Bromate de potassium
KBr : Bromure de potassium
D2EHPA : Bis (2-éthylhexyle) phosphate
TBP : 2,4,6-tribromophénole
Br-PADAP : 2-(5-bromo-2-pyridylazo)-5-(diéthylamino) phénole NIST : National Institute of Standards and Technologies
RMN : Résonance magnétique nucléaire M-CPE : Extraction au point trouble multiple
La théorie, c'est quand on sait tout et que rien ne fonctionne. La pratique, c'est quand tout fonctionne et que personne ne sait pourquoi. Ici, nous avons réuni théorie et pratique : Rien ne fonctionne... et personne ne sait pourquoi !
Remerciements
Tout d’abord, j’aimerais remercier mon directeur de recherche, le professeur Dominic Larivière, qui m’a donné l’opportunité de faire mes études supérieures dans son laboratoire ainsi que pour le dévouement, l’aide et le temps qu’il m’a accordé pour mon projet. Je tiens également à remercier Serge Groleau, spécialiste en chimie analytique et instrumentale du département de chimie, pour son aide précieuse ainsi que toutes les personnes qui ont contribuées à ce projet.
J’aimerais également remercier tous les membres du laboratoire de radioécologie du professeur Larivière pour leur complicité ainsi que pour les nombreuses discussions qui m’ont permis d’apprendre davantage et d’avancer dans mon projet de recherche. Et bien sûr, un gros merci à ma famille et mes amis qui m’ont encouragé et soutenu tout au long de mon parcourt scolaire et sans qui cette longue aventure aurait été difficile.
1. Introduction
1.1 Mise en contexte
Le développement de l’industrie nucléaire a permis à plusieurs pays d’exploiter l’énergie produite par la fission des atomes d’uranium afin de générer de l’électricité. L’utilisation du nucléaire civil pour cette fin est, parmi les stratégies de production d’électricité, l’une des plus vertes en matière d’émission de gaz à effet de serre. [1]
Depuis 2001, Bruce Power exploite un complexe de huit centrales de type CANDU (CANada Deutérium Uranium) situé sur la rive Est du lac Huron dans la municipalité de Kincardine (Ontario, Canada). Ces réacteurs utilisent l’uranium naturel comme combustible et l’oxyde de deutérium (eau lourde) comme modérateur. Avec ses huit réacteurs CANDU, le complexe nucléaire de Bruce est l’un des plus puissants dans le monde. Au total, la centrale a une capacité de production de 6 300 mégawatts, c’est-à-dire environ 30 % de l’électricité consommée par les résidents de la province de l’Ontario. [2]
Pour faire fonctionner ses réacteurs, la centrale nucléaire a besoin d’uranium naturel présent dans le sol sous forme de minerai. Ce minerai d’uranium doit être extrait et soumis à plusieurs étapes de traitement afin d’obtenir le dioxyde d’uranium (UO2) avant de pouvoir l’utiliser de façon efficace pour produire de l’électricité.
[3]
La poudre d’UO2 est comprimée et façonnée en forme de petites pastilles de 20 grammes. Une seule
pastille peut produire autant d’énergie que 400 kilogrammes de charbon. Les pastilles d’uranium sont placées à l’intérieur de plusieurs cylindres regroupés ensemble pour former la grappe de combustible (voir figure 1). Les grappes sont insérées dans un tube de force à l’intérieur de la calandre qui constitue le cœur du réacteur nucléaire. Un réacteur CANDU renferme plus de cinq millions de pastille de combustible générant environ 790 mégawatts. [4]
Le cœur du réacteur fait partie du circuit primaire rempli d’eau lourde sous pression et contient le combustible d’uranium (voir figure 2). L’énergie thermique produite lors de la fission induite par le combustible d’uranium est transportée par l’eau lourde. L’eau lourde est acheminée au circuit secondaire, à savoir le générateur de vapeur qui contient de l’eau ordinaire. Par transfert de chaleur, l’eau ordinaire est transformée en vapeur qui est acheminée jusqu’à la turbine à vapeur qui en tournant entraine le rotor de l’alternateur qui transforme le mouvement en énergie électrique. L’énergie électrique produite alimente le réseau électrique qui achemine l’électricité aux consommateurs. [5]
Figure 2 : Fonctionnement d’un réacteur de type CANDU. [4]
Un réacteur CANDU possède trois circuits d’eau distincts et des systèmes de refroidissement. Le circuit primaire contient l’eau lourde maintenue sous pression pour l’empêcher de bouillir et de provoquer une surchauffe à l’intérieur du circuit. L’eau lourde circule en boucle dans le circuit primaire ce qui permet de transférer la chaleur du cœur du réacteur dans le générateur de vapeur et de maintenir un contrôle sur la température. Le circuit secondaire contient l’eau ordinaire, la vapeur et un condenseur. Le condenseur refroidit et transforme la vapeur en eau et permet de maintenir l’écart de température entre l’eau du générateur et celle du cœur du réacteur. Le circuit tertiaire comprend l’eau de refroidissement du condenseur qui provient normalement d’une source d’eau à proximité de la centrale nucléaire. [5] Les liquides utilisés pour les échanges calorifiques à l’intérieur d’un réacteur nucléaire, que ce soit l’eau lourde, l’eau ordinaire ou l’eau de refroidissement du lac, circule à l’intérieur de systèmes isolés. Cette ségrégation réduit le risque de contamination de l’eau
ordinaire et de l’eau de refroidissement du condensateur par les substances radioactives contenues dans l’eau lourde. De plus, un réacteur nucléaire en opération produit une grande quantité d’énergie thermique et il doit être constamment refroidit afin d’éviter des accidents provoqués par la surchauffe.
Le combustible d’uranium naturel est composé de 99,28 % d’uranium 238 et de 0,72 % d’uranium 235. C’est à l’intérieur du combustible d’uranium que l’énergie thermique est produite à partir de la fission induite. La majorité de l’énergie est produite à partir des noyaux fissiles d’uranium 235. En absorbant un neutron, le noyau d’uranium 235 se transforme en uranium 236 instable et celui-ci se fissionne. Le noyau se désintègre, il y a éjection de neutrons et dégagement d’énergie (voir figure 3). Les neutrons éjectés seront absorbés par d’autres noyaux d’uranium qui à leur tour fissionneront. Ce phénomène est appelé réaction en chaîne. L’eau lourde utilisée comme modérateur permet de ralentir les neutrons et de faciliter leur absorption par les noyaux d’uranium. Un noyau dit fissile, comme l’uranium 235, a la capacité de fissionner en absorbant un neutron thermique qui possède moins d’énergie. De plus, les noyaux fertiles d’uranium 238 présents dans le combustible peuvent également produire de l’énergie thermique. Un noyau plus stable est dit fertile et celui-ci doit d’abord absorber un neutron pour se transformer en un noyau plus lourd et instable qui sera fissile. Les noyaux d’uranium 238 vont absorber un neutron et se transformer en plutonium 239 selon l’équation suivante : 238
U + 1n → 239U → 239Np → 239Pu +1n → 240Pu. [6] Les noyaux de plutonium 239 sont fissiles. En absorbant un neutron, le 239Pu peut soit fissionner et produire un apport d’énergie supplémentaire, soit se transformer en plutonium 240. Toutefois, la proportion de noyaux d’uranium 238 pouvant produire de l’énergie est faible. Au totale, deux neutrons doivent être absorbés pour permettre au plutonium 239 de produire de l’énergie thermique. Ces neutrons étant lent, ils ont donc moins d’énergie à transférer aux noyaux. Pour fissionner, les noyaux doivent atteindre une barrière énergétique d’activation. C’est pourquoi une proportion élevée des noyaux de plutonium 239 et 240 se retrouve dans les déchets radioactifs générés dans un réacteur CANDU. [7]
Figure 3 : Fission d’un noyau d’uranium 235. [4]
Les réacteurs nucléaires produisent également des rejets chimiques et radiologiques qui sont libérés dans l’environnement de façon autorisée ou accidentelle. Ces rejets peuvent contenir des éléments radioactifs dont l’uranium et le plutonium qui, une fois relargués dans l’environnement, seront dispersés dans l’eau, les sédiments et le biote selon leur mobilité respective. Dans le cas des rejets accidentels, mentionnons les accidents nucléaires de Tchernobyl en 1986 et de Fukushima en 2011, [8] une surchauffe incontrôlée du cœur des réacteurs a entrainé la fusion du combustible suivi d’explosions. Ces explosions ont libérées dans l’environnement des nuages de vapeurs et de particules hautement radioactifs pendant plusieurs jours. Les déchets radioactifs rejetés dans l’eau de façon autorisée proviennent des eaux de lavage des piscines d’entreposage des combustibles usés, des douches et des lavabos. Ces rejets sont contrôlés par la Commission canadienne de sûreté nucléaire (CCSN). La CCSN s’assure que les concentrations en uranium naturel et en plutonium 239 et 240 rejetées dans l’eau seront en dessous des normes pour l’eau potable émises par Santé Canada de 20 µg/L et de 0,004 µg/L respectivement. [9] Même si ces conditions sont respectées, il est possible de retrouver de l’uranium et du plutonium dans le lac Huron sous l’état d’ultra-trace. Par exemple, la concentration en plutonium 239 et 240 était de 0,62 µBq/L en 1973 et de 0,48 µBq/L en 1981 et originait principalement des essais nucléaires atmosphériques. Le becquerel est l’unité pour décrire l’activité d’un radionucléide et correspond à une désintégration par seconde. La concentration de la plupart des radionucléides dans les Grands Lacs décline à un taux de 2 à 5 % par année. Une fois à l’intérieur du bassin du lac Huron, l’uranium et le plutonium vont y persister dû à leur long temps de demi-vie et au long temps de résidence environnementaux. De ce fait, les contributions des bassins versants ainsi que la décroissance radioactive n’ont pas d’impact sur la concentration des radionucléides dans le lac Huron. La diminution des concentrations en uranium et en plutonium est plutôt attribuée au taux de sédimentation. Ces radionucléides ont une forte affinité
pour les sédiments et le sol. Une fois présents dans le lac, l’uranium et le plutonium vont y persister soit sous forme d’espèce dissoute dans l’eau, soit emprisonnés dans les sédiments. [10]
1.2 Problématique
L’accumulation d’uranium et de plutonium dans les espèces de poisson fait partie des aspects importants d’un programme de surveillance de la contamination environnementale puisque l’absorption de ces éléments radioactifs peut avoir un effet néfaste sur la santé des espèces de poisson et ultimement sur l’humain. Il est donc important de déterminer si les activités de la centrale nucléaire de Bruce ont un impact sur le milieu aquatique du lac Huron. Est-ce que les rejets nucléaires libérés de façon autorisée ou accidentelle seraient mesurables dans les espèces de poisson? Est-ce qu’il y a bioaccumulation de l’uranium et du plutonium? Si oui, est-ce que l’uranium et le plutonium proviennent des réacteurs nucléaires ou d’une source externe. De plus, l’uranium et le plutonium se retrouvent à l’état d’ultra-trace dans l’environnement. Ces concentrations sont, dans la plupart des cas, incompatibles avec les limites de quantification des méthodes instrumentales modernes. L’utilisation d’une technique qui permet de préconcentrer les analytes devra être favorisée.
1.3 Objectifs du projet
L’objectif principal de ce projet est de déterminer s’il y a bioaccumulation de l’uranium et du plutonium dans les espèces de poisson présents dans le lac Huron. Pour ce faire, plusieurs objectifs spécifiques ont été déterminés.
- Développer une méthode de préparation d’une grande quantité de poisson. Cette méthode doit permettre de réduire en cendres des échantillons de poisson de 500 grammes et plus et d’être applicable à différentes espèces de poisson. Cette méthode doit permettre d’éliminer l’eau, la matière organique (protéines, lipides, etc.) et de conserver la matière inorganique (cendres) qui contient l’uranium et le plutonium.
- Avoir une méthode de préparation d’échantillon compatible avec la technique d’extraction au point trouble (CPE). La CPE permettrait d’extraire et de préconcentrer directement dans
un faible volume l’uranium et le plutonium contenu dans les cendres de poisson et ainsi de faciliter les analyses puisque ceux-ci sont à l’état d’ultra-trace dans l’environnement.
- Effectuer les analyses de l’uranium et du plutonium par spectrométrie de masse couplée à un plasma inductif (ICP-MS). Cette technique permettrait, en plus de déterminer les quantités d’analytes présents, d’étudier les signatures isotopiques de ces radionucléides pour établir une origine à la source.
2. Théorie
2.1 Uranium
L’uranium est un métal lourd de la famille des actinides retrouvé naturellement dans la croûte terrestre.L’uranium naturel est composé de trois principaux isotopes soit 99,28 % d’uranium 238, 0,72 % d’uranium 235 et 0,0055 % d’uranium 234. L’uranium 238 est peu radioactif et très abondant dû à son long temps de demi-vie qui est de 4,5x109 années et qui correspond plus ou moins à l’âge de la terre. L’uranium 235 est moins abondant dans l’environnement en raison de son temps de demi-vie plus court de 7,1x108 années. [11] Finalement, l’uranium 234 ayant un temps de demi-vie relativement court sur une échelle géologique (2,5x105 années) est présent sur terre à cause de son lien de filiation avec l’uranium 238. L’uranium 235 possède un noyau fissile exploitable comme combustible pour les réacteurs nucléaires et pour les armes atomiques. L’uranium naturel possède une toxicité radioactive faible. Plus le temps de demi-vie d’un isotope est long moins son activité radioactive est importante. Les activités spécifiques de l’uranium 238 et de l’uranium 235 sont de 1,24x104
Bq/g et de 8,00x104 Bq/g respectivement. [12] Or, cela fait de l’uranium un élément dont la toxicité est davantage attribuable aux caractéristiques chimiotoxiques plutôt que radiotoxiques. Les noyaux d’uranium émettent des particules alpha lors de la désintégration. Ces particules qui correspondent à des noyaux d’hélium chargés ne représentent pas de risque d’irradiation externe. Les particules alpha sont relativement volumineuses à l’échelle nucléaire par rapport aux particules bêta et au rayonnement gamma puisque leurs noyaux contiennent deux neutrons et deux protons. Leur taille fait en sorte que les particules alpha sont facilement arrêtées par une simple feuille de papier. Cependant, la désintégration de l’uranium représente un risque pour la santé si ce radionucléide est ingéré ou inhalé provoquant de l’irradiation interne.
Bien que l’uranium soit naturellement présent dans l’environnement, ce radionucléide est également produit par les activités de l’industrie nucléaire civile (complexe nucléaire) et militaire (armement atomique). Puisque le rapport de masse 235U/238U de 0,72 % est considéré comme constant dans la nature, l’origine de la source de l’uranium peut être déterminée sur la base de variation dans ce ratio. Il existe également d’autres indicateurs tels que 236U, produit par l’activation neutronique de 235U. En produisant de l’énergie à partir de la fission induite de l’uranium 235, les réacteurs nucléaires génèrent des déchets appauvris en uranium 235. Dans un environnement en
vicinité d’installations, le rapport de masse 235
U/238U mesuré à partir de divers échantillons environnementaux pourrait dévier de la valeur normale de 0,72 % indiquant une contamination potentielle. Par exemple, l’Institut de radioprotection et de sûreté nucléaire (IRSN) a mené une étude radioécologique sur des échantillons de blé et de salade situés à proximité de l’usine COMURHEX de Malvési afin d’évaluer les conséquences des rejets d’uranium. [13]
Selon l’étude, les différents échantillons expriment des rapports de masse 235U/238U qui varient grandement. Pour la plupart des échantillons représentés à la figure 4, le rapport de masse 235U/238U est inférieur à la valeur de 0,72 %. Cela suggère que l’uranium absorbé par ces échantillons est appauvri et provient des rejets atmosphériques de l’usine tandis que l’échantillon hors influence aurait absorbé l’uranium naturel qui provient du sol.
Figure 4 : Rapport massique 235U/238U pour des échantillons de blé et de salade prélevés à proximité de l’usine COMURHEX de Malvési. [13]
2.2 Plutonium
Le plutonium est un métal lourd de la famille des actinides. Le plutonium est un élément considéré comme artificiel, car la majorité du plutonium retrouvé aujourd’hui dans l’environnement a été produit via des réactions nucléaires induites. Depuis 1940, le plutonium est introduit dans l’environnement par les retombés d’essai d’armes atomiques ainsi que par les rejets et les pertes accidentels reliés aux activités des installations civiles et militaires. Une très faible concentration d’isotope du plutonium est d’origine naturelle, soit le plutonium 244 et 239 et proviennent
d’explosions de supernova. Le plutonium 239 provient également de l’activation nucléaire de l’uranium 238 présent dans le sol sous forme de minerai par des neutrons cosmiques. [14]
Excepté pour le plutonium 244 qui possède un temps de désintégration de 8,2x107 années, les temps de demi-vie pour les isotopes de plutonium 239 et 240 sont relativement courts soit de 2,4x104 et de 6 563 années respectivement. Puisque les isotopes de plutonium 239 et 240 se désintègrent plus rapidement, leurs activités spécifiques sont plus élevées, à savoir de 2,30x109 et de 8,40x109 Bq/g respectivement. [15] Une activité spécifique élevée signifie que la radiotoxicité va dominer sur la toxicité chimique de l’élément. Cependant, comme pour l’uranium, les isotopes 239, 240 et 244 du plutonium sont des émetteurs alpha. Le rayonnement alpha étant un rayonnement fortement ionisant, une fois absorbé par inhalation ou ingestion, la radiation du plutonium aura des conséquences biologiques néfastes plus importantes que pour les émetteurs bêta et gamma.
De la deuxième guerre mondiale jusqu’à aujourd’hui, plusieurs essais d’arme nucléaire à travers le monde ont été effectués par différents pays. Ces tests ont généré et libéré plus de 2x108 TBq de radioactivité dans l’atmosphère. [16]
Les radionucléides présents dans ces armes se sont propagés par des voies aériennes à l’échelle mondiale. C’est de cette façon que le plutonium s’est retrouvé dispersé dans l’environnement. De nos jours, la concentration des isotopes 238Pu, 239Pu et 240Pu étant constante suite au traité d’interdiction complète des essais nucléaires signé par plus de 180 pays, incluant le Canada et correspond approximativement à la concentration en plutonium des retombés nucléaires après la correction liée à la période de désintégration. Les ratios d’activité du plutonium qui proviennent des retombés nucléaires peuvent être comparés avec les ratios des rejets de diverse installation. Puisque les noyaux d’uranium 238, plus présents dans le combustible que ceux de 235U, vont plutôt produire des noyaux de plutonium 238, 239 et 240, le combustible usé contiendra une plus forte proportion de ces isotopes. Le combustible usé provenant d’un réacteur de type CANDU a des ratios d’activité en plutonium supérieurs à ceux correspondant aux retombés d’essai d’arme nucléaire (voir figure 5). [17] C’est également le cas pour les autres types de réacteurs puisqu’ils utilisent de l’uranium enrichi qui contient une portion plus faible, mais non négligeable d’238U nécessaire à la production de plutonium. Ainsi, il est possible à partir des ratios d’activité du plutonium de déterminer l’origine d’une source pour ce contaminant environnemental.
Figure 5 : Comparaison des ratios d’activité de différentes sources de plutonium avec les retombés d’essai d’arme nucléaire. [17]
2.3 Mobilité de l’uranium et du plutonium dans le milieu aquatique
Tel que mentionné précédemment, l’uranium et le plutonium ont des temps de demi-vie longs. Une fois rejetés dans l’environnement, ces radionucléides vont donc persister et se disperser dans les différents compartiments environnementaux. L’uranium et le plutonium étant des composantes majeures du cycle nucléaire, l’étude de leur devenir dans l’environnement et de leurs effets sur celle-ci est d’une importance capitale. Ces radionucléides peuvent se retrouver dans l’atmosphère, le sol, l’eau et le biote en concentration allant du ng/L jusqu’au mg/L [18] et ils peuvent migrer d’un milieu à un autre selon leur disponibilité. Afin de faciliter la compréhension des mécanismes responsables de la mobilisation de l’uranium et du plutonium, seulement les compartiments des sédiments, de l’eau et des poissons seront abordés. Dans ce texte, les rejets qui contiennent l’uranium et le plutonium dont la concentration est inférieure aux normes émises par Santé Canada concernant l’eau potable [9]
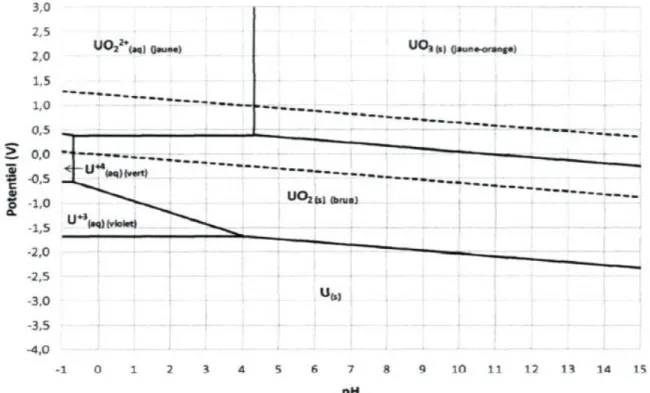
peuvent être rejetés dans les effluents. La mobilité de l’uranium et du plutonium dans l’eau est complexe puisque plusieurs facteurs influencent cette dernière tels que le degré d’oxydation, la solubilité, la capacité d’adsorption et de désorption sur les sédiments ainsi que le pH du milieu et la présence d’agents d’extraction inorganiques et organiques. [19] L’uranium existe à des états d’oxydation de +III, +IV, +V et +VI, mais il est présent majoritairement dans l’environnement sous la forme +IV et +VI. Selon le diagramme de Pourbaix de l’uranium (voir
figure 6), l’uranium (IV) précipite sous la forme d’UO2 à un pH d’environ -0,6. L’uranium (IV) est
donc relativement insoluble dans des eaux naturelles. [20] Pour le maintenir en solution, l’uranium (IV) doit donc être complexé avec un agent d’extraction ou être dans un milieu fortement acide. C’est pourquoi l’uranium tétravalent se retrouve principalement dans la croûte terrestre et dans les minerais. L’uranium hexavalent, plus soluble, se retrouve dans l’eau sous la forme de l’ion uranyle (UO2
2+
). [21] Cependant, à un pH supérieur à environ 4,3, l’uranium (VI) va précipiter sous la forme de l’UO3. La solubilité et la mobilité de l’uranium peuvent varier en fonction de la présence de
molécules inorganiques et organiques dans l’eau.
Figure 6 : Diagramme de Pourbaix de l’uranium. [22]
En l’absence d’agent d’extraction potentiel comme les carbonates, les phosphates et les sulfates, l’ion uranyle (UO2
2+
) domine en milieu acide jusqu’à un pH d’environ 4-5. Si le pH du milieu est plus élevé, l’uranium formera des complexes avec les hydroxydes, soit UO2OH
-, autour de pH 7 et (UO2)3(OH)7
au-dessus de la neutralité (voir figure 7 D). Même s’il y a présence de plusieurs agents d’extraction dans le milieu, les complexes d’uranium (VI) et de carbonates dominent en milieu neutre-basique (voir figure 7 A et B). Ces complexes augmentent la solubilité de l’uranium et par le fait même sa mobilité. Les carbonates ont une meilleure affinité de complexation avec les
ions uranyles comparativement aux phosphates et aux sulfates (affinité : CO3 2+ ˃ PO4 ˃ SO4 2-). [23] À l’inverse, les ions uranyles peuvent aussi s’adsorber sur des minéraux de carbonate (ex : CaCO3
calcite), précipiter et s’immobiliser dans la phase sédimentaire. À des pH plus acides, l’ion uranyle peut former des complexes avec les sulfates pour former des espèces d’UO2SO4 (voir figure 7 A, B
et C) retrouvées majoritairement sous forme de minéraux insolubles. L’uranium (IV) peut également former des espèces avec les sulfates à des pH acides et qui vont persister à des pH plus élevés. Pour ce qui est des complexes uranium-phosphate, leur formation sera favorisée s’il y a absence ou faible concentration de carbonates dans le milieu. Les complexes ainsi formés seront davantage de nature minéral et contribueront à l’enrichissement des sédiments en uranium. De plus, des agents d’extraction organiques comme les substances humiques peuvent faire concurrence avec d’autres agents d’extraction inorganiques afin de former des complexes avec les ions uranyles. Ces substances humiques se retrouvent dans les sédiments et l’eau du lac sous la forme d’acides humiques (HA), d’acides fulviques (FA), d’humines et d’humâtes. Par exemple, les humâtes, des sels d’acides humiques, peuvent complexer les ions uranyles à des pH entre 4 et 6 (voir figure 7 B). La solubilité de l’uranium complexé avec les substances humiques varie en fonction du pH. Les complexes U-FA sont solubles peu importe le pH et permet ainsi une bonne mobilité de l’uranium tandis que les complexes uranium-humine sont insolubles. À des pH acides, l’uranium est sous sa forme d’ion libre, mais plus le pH du milieu augmente plus les complexes U-HA sont favorisés. [24]
Les complexes solubles contribuent donc à la migration de l’uranium dans l’eau et ceux insolubles s’adsorbent sur la phase sédimentaire.
Figure 7 : Pourcentage d’espèce d’uranium selon le pH pour différents systèmes :A) UO2-H2O-CO2,
B) UO2-H2O-humâtes, C) UO2-H2O-SO4 et D) UO2-H2O. [24]
Le plutonium existe sous quatre formes d’oxydation dans l’environnement soit +III, +IV, +V et +VI. Même si les états d’oxydation +IV et V sont dominants en milieu aqueux, les états +III et +VI sont également présents. Le plutonium (III) précipite à un pH d’environ 4,5 sous la forme d’oxyde Pu2O3 instable dans l’eau pour par la suite former l’oxyde PuO2 (voir figure 8). Le diagramme de
Pourbaix montre que le plutonium (IV) précipite à un pH d’environ 0 sous la forme PuO2 très stable
en milieu aqueux acide. Le Pu(IV) a cependant l’affinité de complexation la plus forte avec les surfaces minérales. Le Pu(IV) s’hydrolyse à partir de pH 1 pour former le Pu(OH)4 et à un pH ˃ 4
l’espèce Pu(OH) 4 domine. L’espèce Pu(OH)4 a une forte affinité pour les sédiments et les particules
en suspension ce qui limite son transport dans l’environnement. Pour ce qui est du plutonium (V), il n’est pas thermodynamiquement favorisé et se présente sous la forme d’ion plutonyle PuO2
+
avec une affinité de complexation faible. Pour finir, le plutonium (VI) précipite à un pH d’environ 2 sous forme de PuO2
2+
Comme c’est le cas pour l’uranium, la solubilité et la mobilité du plutonium dans l’eau sont influencées par la présence de divers agents d’extraction. Les carbonates et les hydroxydes sont les deux agents d’extraction inorganiques les plus importants dans les eaux naturelles. [25] Les ions plutonyles forment des complexes solubles avec les carbonates augmentant ainsi leur mobilité. Peu importe l’état d’oxydation, le plutonium va former des complexes solubles avec les sulfates, mais insolubles avec les phosphates qui vont précipiter. [22, 25] La matière organique influence également la mobilité et la solubilité du plutonium dans l’eau. En présence d’une teneur élevée en carbone organique dissous comme par exemple les acides humiques, les teneurs en plutonium (V) et en plutonium (VI) sous la forme de PuO2
+
et de PuO2 2+
respectivement diminuent rapidement dans la phase aqueuse. Ces espèces de plutonium sont réduites en plutonium (IV) hydrolysé et insoluble. [19,
26]
Le produit hydrolytique formé peut être adsorbé sur les solides ou sur les espèces colloïdales dans l’eau ou encore précipiter pour s’incorporer dans la phase sédimentaire.
Figure 8 : Diagramme de Pourbaix du plutonium. [22]
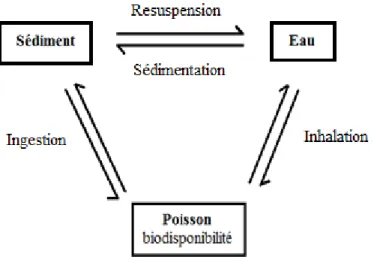
Une fois dissout dans l’eau ou adsorbés sur les sédiments, l’uranium et le plutonium peuvent migrer d’un compartiment à l’autre si les conditions du milieu change (voir figure 9). Les transferts se font après un changement de pH, d’état d’oxydation des espèces, de la force ionique des
complexes et des agents d’extraction présents. Par exemple, l’uranium adsorbé sur les sédiments peut être remis en suspension à la suite d’une oxydation (+IV → +VI) qui facilite la complexation par les carbonates. Une eau fortement carbonatée diminue l’adsorption de l’uranium et du plutonium et à l’inverse, une concentration élevée de phosphates peut entrainer la précipitation et la sédimentation. Pour ce qui est des poissons, ceux-ci peuvent absorber de l’uranium et du plutonium. Cependant, pour être incorporés dans un organisme vivant, les radionucléides doivent être sous une forme chimique assimilable. Ces éléments doivent donc être biodisponibles. Un radionucléide est biodisponible s’il est assimilé et s’il induit à la fois un effet sur l’organisme vivant. [27]
En général, l’uranium et le plutonium sont biodisponibles sous la forme d’ion libre. Au contraire, si ces ions sont complexés avec des agents d’extraction inorganiques ou des substances humiques, le changement dans cet arrangement moléculaire devient beaucoup plus difficile à assimiler par les organismes vivants. [28]
Figure 9 : Transfert de l’uranium et du plutonium dans les différents compartiments environnementaux.
Une fois assimilés par les poissons, l’uranium et le plutonium peuvent être bioaccumulés. La bioaccumulation est la capacité des organismes vivants à absorber une substance chimique présente dans l’environnement et à l’accumuler dans certains tissus et organes. Les radionucléides sont transférés de l’eau, des sédiments et de la nourriture vers les poissons. La concentration d’uranium et de plutonium bioaccumulée va dépendre du niveau de contamination dans l’environnement, du régime alimentaire et du niveau trophique que les poissons occupent. La bioaccumulation d’une espèce chimique prend également en compte la quantité de contaminant ingérée et excrétée par l’organisme. Dans un milieu aquatique, les sédiments ont tendance à accumuler l’uranium et le plutonium.
De ce fait, plusieurs études ont observé qu’en générale les poissons benthiques bioaccumulent davantage d’uranium et de plutonium que les poissons pélagiques. [29, 30, 31]
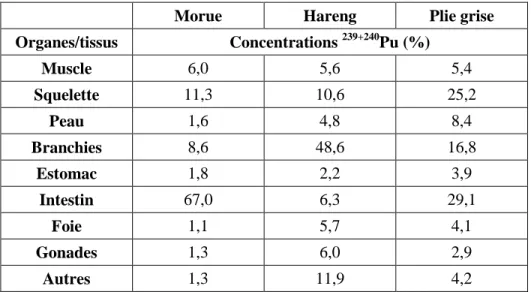
Les poissons benthiques sont les espèces qui vivent de préférence dans les eaux plus profondes des lacs et les poissons pélagiques se retrouvent plutôt en surface. Les poissons benthiques ingèrent des sédiments contaminés avec leur alimentation. L’ingestion de sédiments et d’aliments qui peuvent être contaminés, comme les organismes benthiques inférieurs dans la chaîne alimentaire, constitue la principale voie d’absorption de l’uranium et de plutonium chez les poissons de type benthique.Au contraire, les poissons pélagiques vont absorber l’uranium et le plutonium principalement dans l’eau par inhalation grâce à leurs branchies. De plus, la bioaccumulation et la distribution de l’uranium et du plutonium dans les différents tissus et organes des poissons varient. La concentration de ces radionucléides n’est pas uniforme d’une espèce à l’autre et pour un même individu. En effet, un article paru en 2001 intitulé Bioaccumulation and distribution of plutonium in fish from Gdansk Bay [30], présente ces différences pour plusieurs espèces de poisson provenant de la Baie de Gdansk. Trois espèces ont été étudiées soit la morue, le hareng et la plie grise. Au niveau de l’espèce, la distribution du plutonium 239 et 240 est assez similaire. Que ce soit la morue, le hareng ou la plie grise, l’accumulation de plutonium se fait majoritairement dans l’intestin, les branchies et le squelette (voir tableau 1). Par contre, la bioaccumulation du plutonium est différente et dépend du type de poisson, c’est-à-dire benthique, pélagique et prédateur. Par exemple, la plie grise est un poisson benthique et cette espèce se nourrit de petits organismes benthiques comme les mollusques. La plie grise ingère donc des organismes benthiques qui peuvent être contaminés en plus d’une certaine quantité de sédiments. C’est pourquoi la bioaccumulation de plutonium la plus importante se retrouve dans les intestins et représente 29,1 % de la totalité du plutonium assimilé dans cette espèce. Pour sa part, le hareng fait partie des poissons pélagiques. Le hareng n’est pas en contact direct avec le compartiment sédimentaire et se nourrit dans les eaux peu profondes. La bioaccumulation du plutonium 239 et 240 se fait donc principalement par les voies respiratoires, à savoir les branchies. 48,6 % du plutonium assimilé par le hareng se retrouve dans les branchies. Pour finir, la morue est un poisson prédateur. Puisque la morue est à un niveau plus élevé dans la chaîne alimentaire, la bioaccumulation dans cette espèce sera moins importante. Il y a une certaine perte de matière sous forme d’excrétion et de matière non utilisée lorsqu’il y a transfert d’un niveau à l’autre dans la chaine alimentaire. La morue est une espèce benthique et elle consomme également des espèces benthiques ce qui explique que 67,0 % du plutonium assimilé se retrouve également dans les intestins.
Tableau 1 : Exemple de distribution et de bioaccumulation du plutonium 239 et 240 dans la morue, le hareng et la plie grise. [30]
Morue Hareng Plie grise
Organes/tissus Concentrations 239+240Pu (%) Muscle 6,0 5,6 5,4 Squelette 11,3 10,6 25,2 Peau 1,6 4,8 8,4 Branchies 8,6 48,6 16,8 Estomac 1,8 2,2 3,9 Intestin 67,0 6,3 29,1 Foie 1,1 5,7 4,1 Gonades 1,3 6,0 2,9 Autres 1,3 11,9 4,2
Il en va de même pour la distribution et la bioaccumulation de l’uranium dans les espèces de
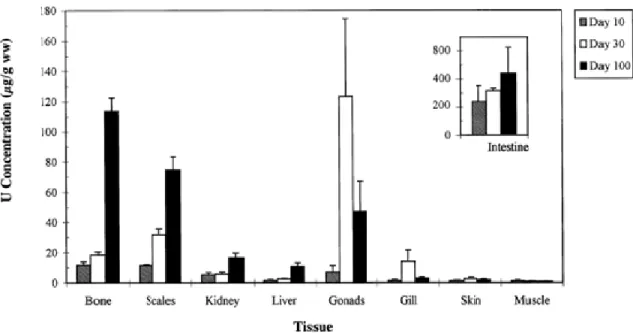
poisson qui sont influencés par les mêmes aspects. En voici un exemple qui est tiré d’un article publié en 2000. [31] Dans cet article, des études ont été menées afin de déterminer l’accumulation d’uranium dans le grand corégone après divers temps d’exposition. Pour ce faire, les chercheurs ont nourri les poissons avec une diète contaminée par de l’uranium. Les concentrations utilisées en uranium représentent la gamme de concentrations observées dans les sédiments des écosystèmes aquatiques canadiens où il y a eu des apports anthropiques d’uranium. Une concentration de 10 000 µg/g d’uranium a été ajoutée à des granulés de truite et les poissons ont été nourrit pendant des intervalles de 10, 30 et 100 jours (voir figure 10). La bioaccumulation de l’uranium dans le grand corégone se fait majoritairement dans les intestins, les os, les écailles et les gonades qui varient selon le temps d’exposition en lien avec la période de maturation sexuelle. La bioaccumulation est de loin la plus intense dans les intestins et cela est dû au fait que le grand corégone est un poisson benthique. De plus, la figure 10 montre une distribution de l’uranium très diversifiée pour un total de neuf organes et tissus.
Figure 10 : Distribution de l’uranium dans différents organes et tissus du grand corégone nourrit avec une alimentation contenant 10 000 µg U/g pendant 10, 30 et 100 jours. [31]
En conclusion, la distribution du plutonium et de l’uranium dans les organes et les tissus est diversifiée. Peu d’organes et de tissus présentent des concentrations négligeables. La bioaccumulation de ces radionucléides dépend du type de poisson (benthique et pélagique), de l’habitat et aussi du niveau occupé dans la chaîne alimentaire. Dans un contexte où il est important de déterminer s’il y a bioaccumulation de radionucléides dans les poissons, ces diversités doivent être considérées. C’est pour cela que cette étude vise à développer une méthode de préparation d’échantillon qui sera applicable sur des poissons entiers peu importe l’espèce. Cette méthode de préparation permettra d’éliminer l’eau et la matière organique des échantillons de poisson afin de conserver la matière inorganique, c’est-à-dire les cendres, qui contiennent l’uranium et le plutonium. À partir des cendres, la technique d’extraction au point trouble permettra d’extraire et de préconcentrer les radionucléides désirés de la matrice pour faciliter les analyses.
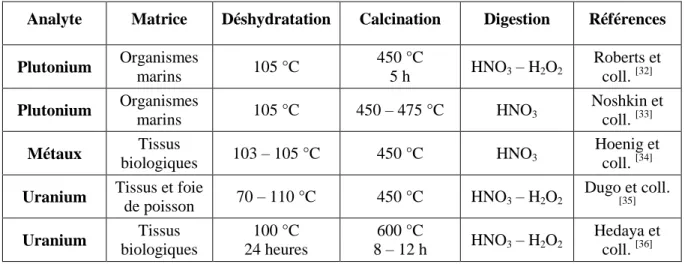
2.4 Méthodes de mise en solution des tissus biologiques de poisson
La méthode de préparation d’échantillons de tissu biologique de poisson permet d’éliminer l’eau et la matière organique afin d’obtenir la matière inorganique appelée cendre. Ces cendres contiennent les radionucléides désirés soit l’uranium et le plutonium.
Tableau 2: Comparaison des méthodes de préparation d’échantillon biologique de la littérature.
Analyte Matrice Déshydratation Calcination Digestion Références Plutonium Organismes marins 105 °C 450 °C 5 h HNO3 – H2O2 Roberts et coll. [32] Plutonium Organismes marins 105 °C 450 – 475 °C HNO3 Noshkin et coll. [33] Métaux Tissus biologiques 103 – 105 °C 450 °C HNO3 Hoenig et coll. [34] Uranium Tissus et foie
de poisson 70 – 110 °C 450 °C HNO3 – H2O2 Dugo et coll. [35] Uranium Tissus biologiques 100 °C 24 heures 600 °C 8 – 12 h HNO3 – H2O2 Hedaya et coll. [36]
Typiquement, la déshydratation de tissu biologique s’effectue à 105 °C et la calcination entre 450 et 500 °C pour éliminer la matière organique. [32, 33, 34, 35] Les échantillons sont déshydratés pendant plusieurs heures voir des jours jusqu’à ce que la masse de l’échantillon demeure constante. Les calcinations se font rarement en dessous de 8 heures et la majorité des laboratoires calcinent leurs échantillons pendant 16 heures. L’augmentation de température favorisée lors des calcinations est celle par paliers. L’augmentation de température se fait de 50 °C ou 100 °C et la température est maintenue pendant un certain temps. Par exemple, la température passe de 150 °C à 200 °C en 15 minutes pour être maintenue pendant 1 heure avant d’être augmentée à nouveau (voir annexe 2). [37]
Si la calcination seule ne suffit pas à éliminer la totalité de la matière organique, une étape de digestion acide peut être ajoutée. La plupart des digestions acide sont effectuées avec de l’acide nitrique, mais il est également possible d’ajouter du peroxyde d’hydrogène qui facilite la digestion de la matière organique. Les étapes de calcination et de digestion se succèdent jusqu’à l’obtention d’échantillon sans carbone. [32]
De plus, une étude publiée en 2015 a démontré que la calcination d’échantillons de sol contenant du plutonium peut former des espèces réfractaires. [38]
À des températures de calcination au-delà de 450 °C, la concentration en plutonium 239 et 240 diminue de plus en plus ce qui est attribuable à la formation d’espèces réfractaires de plutonium insolubles dans les solutions d’acide nitrique.
2.5 Technique d’extraction au point trouble
(CPE)
En chimie analytique, l’analyse d’actinide dans des échantillons environnementaux et biologiques pose problème. La concentration en actinide dans ces échantillons est plutôt faibles soit
à l’état d’ultra-trace ce qui est dans plusieurs cas incompatible avec les limites de quantification des méthodes instrumentales modernes. Rappelons que les normes de Santé Canada concernant les rejets d’uranium et de plutonium dans l’eau potable sont de 20 µg/L et de 0,004 µg/L respectivement. De plus, les limites de détection de l’ICP-MS varient entre 0,01 et 0,6 ng/L. [56]
Au regard de ces informations, les limites de détection sont inférieures aux normes pour l’eau potable. Toutefois, comme expliqué précédemment ce n’est pas la totalité de l’uranium et du plutonium rejetée dans l’eau qui est biodisponible pour les poissons. Seulement une certaine quantité sera assimilée et cette quantité sera inférieure à celle présente dans le lac. En plus, les matrices de ces échantillons contiennent des concentrations élevées en interférents. Pour remédier à ce problème, une méthode utilisée en chimie analytique est celle de l’extraction au point trouble (CPE) qui permet d’extraire l’analyte cible et de le préconcentrer. La CPE est une méthode d’extraction analogue à la micro-extraction liquide-liquide dispersive (DLLME) puisqu’elle utilise également une phase organique micro-dispersée pour l’extraction. L’extraction au point trouble est basée sur la solubilité du surfactant non-ionique utilisé qui varie selon la température. [39] De plus, la CPE offre plusieurs avantages. Elle permet d’extraire une variété d’analyte provenant d’échantillon de différentes natures (sol, eau, biologique) avec des récupérations et des facteurs de préconcentration très élevés. La CPE est peu coûteuse et sécuritaire puisqu’une faible quantité de réactif est utilisée. Les surfactants non-ioniques ont une faible toxicité par rapport aux solvants organiques classiques et ils sont plus faciles à éliminer. [40]
2.5.1 Principe de l’extraction au point trouble
L’extraction au point trouble est basée principalement sur l’utilisation d’un surfactant non-ionique, de sa concentration et de sa solubilité en solution qui dépend de la température. L’une des principales familles de surfactant utilisée pour la CPE est celle du Triton X (Figure 11). Ces surfactants sont des molécules organiques amphiphiliques. Ils possèdent une chaîne de polyéthylène glycol hydrophile et un groupement aromatique hydrophobique leur permettant d’être à la fois soluble en solution aqueuse et dans un solvant organique.
En solution aqueuse et à une certaine concentration, les monomères de surfactant Triton X vont s’assembler entre eux pour former des micelles. Pour assurer la formation de micelle en solution, la concentration de surfactant doit excéder la concentration micellaire critique (CMC). [42] Cette concentration varie selon la structure du Triton X (tableau 2). Plus la chaîne hydrophile de la molécule est longue plus la CMC est élevée. Les micelles et les monomères en solution sont en équilibre dynamique (figure 12). Cet équilibre peut être favorisé en faveur de la formation de micelle en changeant la température de la solution.
Figure 12 : Formation de micelle en solution. [43]
À basse température, les micelles sont solubles en solution aqueuse. Avec l’augmentation de la température, la solubilité de celles-ci diminue et il y a formation d’agrégats de micelle insoluble. À ce stade, la solution va se séparer en deux phases distinctes soit la phase riche en surfactant et la phase aqueuse. La phase riche en surfactant qui représente un faible volume de la solution totale contient l’analyte à extraire si un agent d’extraction avec une bonne affinité pour l’analyte est ajouté au système. La température à laquelle se produit la séparation de phase se nomme la température au point trouble (CPT). [40, 42] Pour la famille du Triton X, cette température dépend du nombre d’unité oxyde d’éthylène présent dans la molécule (tableau 3). Plus le nombre d’unités augmente, plus la CPT augmente. L’ajout de surfactants ioniques et de sels peut également influencer la température au point trouble. [43]Il en sera discuté davantage dans la section suivante.
Tableau 3 : La température au point trouble et la concentration micellaire critique selon la longueur de la chaîne de polyéthylène glycol du Triton X. [44]
Triton X Nombre d’unité oxyde d’éthylène présent (n) CPT (°C) CMC (mg/L) X-114 7,5 25 120 X-100 9,5 66 189 X-102 12 88 267 X-165 16 ˃100 570
Cependant, le mécanisme lors duquel il y a formation de deux phases distinctes fait encore l’objet de débat. Plusieurs théories tentent d’expliquer la diminution subite de la solubilité du Triton X après avoir atteint la CPT. Selon la première, en augmentant la température, il y aurait accroissement de la taille des micelles suite à l’agrégation de celles-ci par collision. [45]
Selon la seconde théorie, puisqu’il devient entropiquement défavorable de stabiliser la forme hydratée des micelles, il y aurait déshydratation de ces dernières suite à l’augmentation de la température. [46, 47]
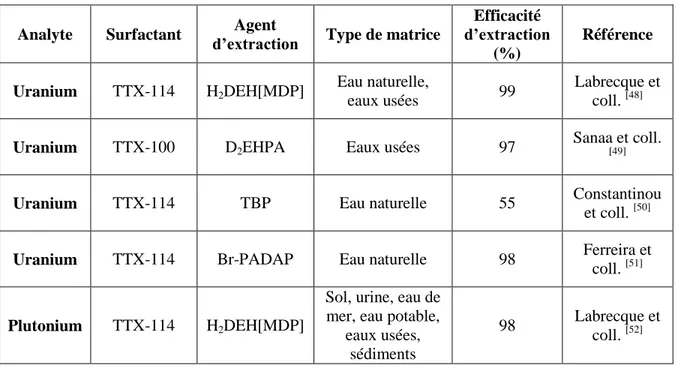
Afin de choisir la technique d’extraction au point trouble la plus adéquate possible pour l’extraction de l’uranium et du plutonium, plusieurs techniques de la littérature ont été comparées (voir tableau 4). Les CPE présentées au tableau 4 utilisent des surfactants de la famille du triton X soit le TTX-114 et le TTX-100 ainsi que différents agents extractants soit le H2DEH[MDP], le
D2EHPA, le TBP et le Br-PADAP. Les extractions avec le H2DEH[MDP], le D2EHPA et le
Br-PADAP permettent d’obtenir des efficacités d’extraction de plus de 97% tandis qu’avec le TBP seulement 55 % d’efficacité d’extraction est obtenue et cela pour des échantillons dont la matrice est aqueuse. Plusieurs CPE permettent donc une bonne récupération en uranium, mais la technique avec l’efficacité la plus élevée est celle du doctorant Charles Labrecque du groupe de recherche du professeur Larivière. L’utilisation du TTX-114 comme surfactant et du H2DEH[MDP] comme
agent d’extraction permet d’obtenir une efficacité d’extraction de l’uranium de 99 %. Pour ce qui est du plutonium, peu d’études sur l’extraction de ce radionucléide par CPE ont été menées. Toutefois, Labrecque et ses collègues ont démontré qu’il est possible d’obtenir des efficacités d’extraction de 98 % pour le plutonium et cela à partir de différents types d’échantillon, soit d’urine, de sol, d’eau de mer, d’eau potable, d’eaux usées et de sédiments. [52]
Il a donc été décidé d’utiliser cette stratégie de la CPE pour ce projet basée sur les travaux de Labrecque et ses collègues. L’extraction de l’uranium et du plutonium par CPE utilisant le TTX-114 et le
H2DEH[MDP] permet d’obtenir des efficacités d’extraction très élevées pour divers échantillons
environnementaux.
Tableau 4 : Comparaison de l’extraction de l’uranium et du plutonium par CPE de la littérature.
Analyte Surfactant d’extraction Agent Type de matrice
Efficacité d’extraction (%) Référence Uranium TTX-114 H2DEH[MDP] Eau naturelle, eaux usées 99 Labrecque et coll. [48]
Uranium TTX-100 D2EHPA Eaux usées 97
Sanaa et coll.
[49]
Uranium TTX-114 TBP Eau naturelle 55 Constantinou
et coll. [50]
Uranium TTX-114 Br-PADAP Eau naturelle 98 Ferreira et
coll. [51]
Plutonium TTX-114 H2DEH[MDP]
Sol, urine, eau de mer, eau potable,
eaux usées, sédiments
98 Labrecque et coll. [52]
2.5.2 Les réactifs utilisés et leurs rôles pour l’extraction de l’uranium et
du plutonium
Dans cette étude, plusieurs réactifs sont utilisés afin d’avoir un système d’extraction au point trouble complet et efficace. Cette section décrira l’ensemble des réactifs utilisés lors des travaux de Labrecque [48, 52] ainsi que leur rôle et leur influence sur la CPE.
Le surfactant non-ionique favorisé pour cette étude est le triton X-114 (TTX-114) car sa température au point trouble théorique est proche de celle de la température ambiante (voir tableau 3). Cette caractéristique permet de faciliter la séparation de phase et minimise la possibilité de resolubilisation de la phase riche en surfactant lors de la centrifugation. Le triton X-114 est aussi utilisé pour sa densité plus élevée que celle de l’eau permettant la récupération de la phase riche en surfactant dans la partie inférieure du tube conique après la centrifugation. En générale, il est préférable d’effectuer l’extraction au point trouble à la CMC puisque la CPT augmente avec la concentration de surfactant non-ionique. Toutefois, il est possible de diminuer la valeur de la CMC du TTX-114 en ajoutant un surfactant ionique dans le système. Avec l’ajout d’un surfactant
ionique, l’efficacité d’extraction est stable pour un intervalle allant de 0,8 à 4 mmol de surfactant non-ionique dans une matrice aqueuse. [48] Le fait d’utiliser la concentration la plus faible possible permet de minimiser le volume de la phase riche en surfactant et d’avoir un meilleur facteur de préconcentration.
Le surfactant cationique bromure de cétyltriméthylammonium (CTAB), est fréquemment ajouté au système d’extraction afin de diminuer la concentration micellaire critique du TTX-114. L’ajout d’un surfactant cationique améliore ainsi l’efficacité de l’extraction pour un composé organique polaire comme le complexe formé entre le H2DEH[MDP] et les radionucléides.
[48]
L’agent d’extraction P,P-di (2-éthylhexyle) de l’acide méthanediphosphonique (H2DEH[MDP],
voir figure 13) est un agent d’extraction possédant une bonne sélectivité pour les actinides particulièrement pour ceux avec des états d’oxydation tétravalent et hexavalent. [53] C’est un agent d’extraction qui peut être utilisé de façon efficace pour l’extraction en milieu acide. De plus, l’utilisation d’un agent d’extraction hydrophobe comme le H2DEH[MDP] permet d’extraire les
radionucléides à l’intérieur de la phase riche en surfactant.
Figure 13 : Agent d’extraction H2DEH[MDP]. [53]
La mise en solution des actinides se fait en milieu fortement acide. Cependant, cette acidité peut affecter et dégrader les micelles du système d’extraction. L’utilisation de sels tels que le bromate de potassium (KBrO3) et le bromure de potassium (KBr) sont ajoutés au système afin de former une
couche de protection qui minimise l’effet de l’acide. En solution acide, les ions BrO3 -
et Br- vont former des molécules de Br2 et ce sont ces molécules qui forment la couche de protection autour des
micelles.
2 𝐵𝑟𝑂3−+ 10 𝐵𝑟−+ 12 𝐻+→ 2 𝐵𝑟
2+ 6 𝐻2𝑂
Le brome est utilisé car il est plus stable dans l’eau, moins corrosif (sauf I2) et plus facile à
élevées que 2 mmol/L de KBrO3, l’efficacité de l’extraction diminue dû à la compétition de
complexation entre les radionucléides et le brome. [52]
2.6 Les instruments d’analyse
Afin d’être en mesure de quantifier l’uranium et le plutonium, l’utilisation de techniques de quantification est nécessaire. Puisque ces éléments sont radioactifs, il est possible de les quantifier par des méthodes radiométriques telles que la spectrométrie alpha. Cette technique d’analyse a longtemps été la technique privilégiée afin d’analyser les radionucléides émetteurs alpha. Cependant, pour l’analyse d’éléments trace ou ultra-trace, une étape de séparation est nécessaire afin de faciliter l’analyse. Les particules alpha parcourent une faible distance et dû à leurs masses importantes, elles sont facilement absorbées par la matière. L’échantillon doit donc être le plus pur et le plus uniforme possible en uranium ou en plutonium pour éviter une diminution du signal. De plus, le temps de comptage est long. Selon la sensibilité, la limite de détection et la précision requise, l’analyse peut durer de quelques heures à quelques jours. Les isotopes 239
Pu et 240Pu sont difficilement discriminable puisque leurs énergies alpha sont similaires (5,24 et 5,25 MeV respectivement). [54] Au contraire, l’analyse par ICP-MS est plus rapide et nécessite moins d‘étape de préparation d’échantillon puisque l’analyse est fait en fonction du rapport masse sur charge. L’ICP-MS possède une meilleur efficacité de détection, des limites de détection basses et permet d’effectuer des mesures du rapport isotopique précis. [55]
2.6.1 La spectrométrie de masse par plasma à couplage inductif (ICP-MS)
L’ICP-MS est l’une des techniques d’analyse les plus employées pour identifier et quantifier les éléments traces et même ultra-traces. Cet appareil est rapide, multiélémentaire, possède d’excellentes limites de détection de l’ordre de 0,01 – 0,6 ng/L [56] et à la capacité d’effectuer des mesures isotopiques relativement précises. De plus, l’ICP-MS est une technique d’analyse qui a l’avantage de requérir peu d’étapes pour la préparation d’échantillon. Un échantillon dissous en milieu légèrement acide peut être analysé directement. Pour leur part, les échantillons solides sont digérés et mis en solution par la digestion acide conventionnelle, par la digestion micro-ondes ou par la fusion boratée. La digestion d’échantillon se fait préférablement dans l’acide pour stabiliser les ions métalliques en solution aqueuse et les échantillons concentrés sont dilués avec de l’eau de haute pureté. Un étalon interne dont la concentration est connue est ajouté à l’échantillon pour corriger les dérives de signal de l’appareil. Cependant, la préparation d’échantillon peut inclure uneétape d’élimination ou de réduction de la matrice car les ICP-MS sont sensibles à la composition matricielle (interférences non-spectrales) et s’encrassent rapidement si l’échantillon contient des matrices chargées. De plus, la présence de certains éléments peut occasionner des interférences isobariques ou polyatomiques. Afin d’éviter ces interférences, des techniques de séparation, d’enrichissement et de préconcentration de l’analyte (ex : CPE) peuvent être employées. [54]
Une fois solubilisés, les échantillons sont aspirés à l’intérieur d’une chambre de nébulisation où le nébuliseur transforme l’échantillon liquide en microgouttelettes par collision avec un flux d’argon. Les microgouttelettes passent ensuite dans le plasma d’argon ionisé à des températures allant de 6 000 à 10 000 degrés Celsius permettant l’atomisation et l’ionisation. L’argon est utilisé pour produire le plasma car ce gaz a un potentiel d’ionisation élevé de 15,8 eV pouvant ioniser la majorité des éléments du tableau périodique. Une fois ionisé, les ions sont dirigés vers la section appelée interface qui comprend deux cônes en nickel ou en platine, à savoir l’échantillonneur et l’écumoire (voir figure 14). Une partie du plasma d’ions est transférée par l’orifice de l’échantillonneur pour se retrouver à l’intérieur d’une chambre sous vide. Cette chambre permet de faire la transition des ions qui sont sous pression atmosphérique vers la section du quadripôle et du détecteur qui sont sous vide. L’écumoire prélève le centre du faisceau ionique et les ions sont focalisés par plusieurs lentilles à leur sortie de l’interface. Les ions passent par un filtre de masse appelé quadripôle. L’ICP-MS est basé sur le principe de la séparation des éléments en fonction de leur charge et de leur masse.Le quadripôle est composé de quatre barres cylindriques dont deux ont des tensions continues et les deux autres des tensions alternatives. Cela crée un champ électrique qui permet de dévier les ions légers ou lourds selon le rapport masse sur charge (m/z) désiré. Pour finir, les ions restants sont transmis au détecteur et comptés par un multiplicateur d’électrons. [57, 58]
Figure14: Schéma d’un ICP-MS. [59]
L’ICP-MS est une technique d’analyse sensible dont les limites de détection très faibles
permettant l’analyse d’élément trace ou ultra-trace. En effet, D’Ilio et ses collègues ont développé une méthode d’analyse par ICP-MS afin de déterminer la composition isotopique de l’uranium, soit le 235 et le 238, contenu dans l’aiguillat commun qui est une espèce de requin. [60]
Les tissus biologiques sont digérés dans un four micro-onde avec de l’acide nitrique et du peroxyde d’hydrogène et la limite de détection obtenue pour l’uranium est de 26,2 ng/L. De plus, dans sa thèse, Sabrina Barillet indique que la limite de détection de l’ICP-MS pour les isotopes d’uranium est de 20 ng/L. [18] Ces analyses ont été effectuées sur des tissus de poisson zèbre digérés à l’acide nitrique et au peroxyde d’hydrogène. Cependant, il est également possible d’analyser l’uranium par ICP-OES (voir section suivante).
2.6.2 La spectrométrie d’émission optique par plasma à couplage inductif
(ICP-OES)
L’ICP-OES est une technique d’analyse qui possède une bonne sensibilité, une large gamme de linéarité, une faible sensibilité aux interférences chimiques, une capacité de détection multiélémentaire et de faibles limites de détection. [61] L’ICP-OES permet d’analyser des éléments traces puisque ses limites de détection sont de l’ordre du µg/L (ppb). [62]
Cette technique d’analyse permet de déterminer tous les éléments du tableau périodique à l’exception des éléments artificiels comme le plutonium en raison de sa faible concentration. [63] La mise en solution et l’injection de



![Figure 12 : Formation de micelle en solution. [43]](https://thumb-eu.123doks.com/thumbv2/123doknet/3662062.108248/31.918.156.787.348.581/figure-formation-micelle-solution.webp)