DÉVELOPPEMENT D’UNE ÉCHELLE DE
CATÉGORISATION DES HÉMOTHORAX RETARDÉS
CHEZ LES PATIENTS AYANT SUBI UN TRAUMATISME
THORACIQUE FERMÉ MINEUR
Mémoire
Douglas Eramian
Maîtrise en épidémiologie – épidémiologie clinique
Maitre ès sciences (M. Sc.)
Québec, Canada
© Douglas Eramian, 2017
DÉVELOPPEMENT D’UNE ÉCHELLE DE
CATÉGORISATION DES HÉMOTHORAX RETARDÉS
CHEZ LES PATIENTS AYANT SUBI UN TRAUMATISME
THORACIQUE FERMÉ MINEUR
Mémoire
Douglas Eramian
Sous la direction de :
Marcel Émond, directeur de recherche
Lynne Moore, codirectrice de recherche
iii
Résumé
Introduction : Les traumatismes thoraciques sont, selon leur sévérité, une cause fréquente
de mortalité, de morbidité, d'hospitalisation et d'incapacité en traumatologie. Les traumatismes thoraciques mineurs fermés (TTM) sont souvent traités dans un contexte ambulatoire. Une complication potentielle est le développement d’un hémothorax retardé. Il n'existe actuellement aucun consensus sur la meilleure façon de classifier les hémothorax retardés. L’objectif de l’étude est d’évaluer l’accord inter et intra-observateur, et donc la fiabilité, de trois méthodes de classification d’hémothorax retardé chez des patients se présentant à l’urgence pour un traumatisme thoracique mineur fermé (TTM) qui développent un hémothorax entre une et deux semaines suivant le traumatisme.
Méthodes : Cette étude est une analyse secondaire d’une étude de cohorte multicentrique
prospective de patients s’étant présentés dans un de quatre départements d’urgence canadiens. Un échantillon aléatoire de 50 radiographies pulmonaires a été sélectionné parmi les patients recrutés suite à un TTM entre novembre 2006 et novembre 2010. Les radiographies pulmonaires postéro-antérieures (PA) et latérales ont été soumises à huit médecins évaluateurs (deux par groupe), de quatre spécialités différentes (urgence, chirurgie, radiologie et médecine familiale), pour interprétation utilisant chacune des trois méthodes de classification mise à l’étude. Ensuite, au moins deux semaines plus tard, un médecin de chacune des spécialités a réinterprété de nouveau les mêmes radiographies pulmonaires, en utilisant ces mêmes trois méthodes de classification. Des coefficients de corrélation intraclasse (ICC) ont par la suite été calculés afin de déterminer l’accord inter et intra-observateur pour chacune des trois méthodes de classification.
Résultats : Nous avons déterminé que deux des trois méthodes de classification, soit celle
utilisée par Misthos et al. (1) - pour les vues radiographiques postéro-antérieures – ainsi que celle basée sur le calcul de ratios – pour les vues latérales – démontraient des accords inter-observateurs plus élevés. La méthode de Misthos et al. (1) démontre, cependant, une meilleure homogénéité, avec des intervalles de confiance plus étroits ICC global 0.56 (0.47-0.64). De plus, nous avons démontré que la troisième méthode de classification à l’étude, soit celle basée sur l’impression subjective du clinicien, qui est aussi celle qui représente la façon actuelle de fonctionner en clinique, démontre le plus faible accord entre observateurs ICC global 0.44 (0.34-0.53). Cependant, nous n’avons pu démontrer de différence
iv
statistiquement significative entre ces valeurs lorsque soumises à des épreuves statistiques (p = 0.7319).
Conclusion : Cette étude n’a pu démontrer une différence statistiquement significative
entre les méthodes de classification évaluées. Cependant, on note des valeurs d’accord plus élevées pour celle basée sur une étude par Misthos et al. (1) ainsi que celle basée sur le calcul des ratios. La troisième méthode, basée sur l’impression subjective du clinicien, démontre la plus faible valeur d’accord au travers différentes spécialités d’évaluateurs. Une future étude, avec un échantillon plus important de radiographies, pourrait déterminer si une différence statistiquement significative existe entre ces méthodes de classification et advenant le cas, la possibilité d’une relation entre la méthode plus fiable de classifier les hémothorax post-traumatiques retardés et des mesures cliniques objectivables, dans le but de valider sa capacité d’aider à prédire quels sont les patients les plus à risque de se détériorer sur le plan fonctionnel et qui bénéficieraient donc d’un suivi plus étroit par leur professionnel de la santé.
v
Abstract
Introduction: Thoracic trauma is, depending on severity, a frequent cause of mortality,
morbidity, hospitalization and incapacity. Minor closed thoracic injuries are often treated on an outpatient basis. One potential complication is the development of a delayed hemothorax.
Currently, there is no consensus on the classification of delayed hemothoraces. The goal of this study is to evaluate the level of inter and intra-rater agreement, and therefore reliability, with respect to three classification methods for delayed hemothoraces in patients presenting to the emergency department for minor closed thoracic trauma who develop a hemothorax between one and two weeks following the trauma.
Methods: This study is a secondary analysis of a prospective multicenter cohort study of
patients presenting to one of four Canadian ED. A random sample of 50 chest x-rays was selected among patients presenting with minor closed thoracic trauma between November 2006 and November 2010. The postero-anterior (PA) and lateral chest x-rays were submitted to eight physicians (two per group), from four different specialties (emergency medicine, surgery, radiology and family medicine), for interpretation using each of the three classification methods under study. One physician from each of the specialties also reinterpreted the same x-rays, using each of the three classification methods, at least two weeks later. Intraclass correlation coefficients (ICC) were then calculated to determine inter and intra-rater agreement for each of the three classification methods.
Results : We determined that two of the three classification methods, one based on a study
by Misthos et al. (1) – for postero-anterior radiographic vues – as well as one based on ratio calculations – for lateral vues – demonstrated the highest inter-rater agreement values. However, the method based on the study by Misthos et al. (1) showed better homogeneity, with narrower confidence intervals Global ICC 0.56 (0.47-0.64). Moreover, we also determined that the third classification method of the study, based on the subjective impression of the clinician, which is also the method currently used in the clinical setting, shows the weakest agreement between observers Global ICC 0.44 (0.34-0.53). These results, however, were not shown to be significantly different from each other, once subjected to statistical testing (p = 0.7319).
Conclusion: This study was unable to demonstrate a statistically significant difference
vi
agreement values for the methods based on a study by Misthos et al, (1) as well as on ratio calculations. The third method, based on the subjective impression of the clinician, shows the lowest inter-rater agreement between evaluators of different specialties. A future study, conducted on a larger sample size, could determine whether there exists a statistically significant difference between these classification methods and if so, the possible relationship between this more reliable method for classifying post-traumatic delayed hemothoraces and objective clinical markers, the goal being to validate its capacity to assist in predicting which patients are most at risk for functional deterioration and whom would benefit from tighter follow up from their healthcare professional.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... ix
Liste des figures ... x
Liste des abréviations ... xi
Remerciements ... xii
CHAPITRE 1 Introduction et revue de littérature ... 1
1 Épidémiologie ... 1
2 Complications tardives des traumatismes thoraciques ... 2
2.1 Syndrome douloureux ... 2
2.2 Pneumonie et atélectasie ... 3
2.3 Pneumothorax retardé ... 4
2.4 Hémothorax retardé ... 5
3 Techniques de mesure volumétrique thoracique ... 7
3.1 Évaluation du volume d’un pneumothorax – Revue des techniques de mesure objectives ... 9
3.2 Évaluation du volume d’un hémothorax – Revue des techniques de mesure objectives ... 11
3.2.1 Points de repère, calculs de ratios et formules mathématiques ... 11
3.2.2 Estimées basées sur l’image radiographique... 13
4 Pertinence de l’étude et retombées attendues ... 14
5 Objectif ... 14
5.1 Hypothèses et résultats attendus ... 14
CHAPITRE 2 Méthodologie ... 16
1 Type d’étude ... 16
2 Population à l’étude ... 16
2.1 Critères d’inclusion ... 16
2.2 Critères d’exclusion ... 17
2.3 Milieux hospitaliers participants ... 18
3 Déroulement du recrutement et suivi pour la détection d’hémothorax ... 18
4 Détection des complications ... 19
viii
5 Mesures des issues ... 21
5.1 Issue principale ... 21
6 Analyses statistiques ... 22
6.1 Issue principale: Accords inter et intra-observateurs ... 22
7 Taille d’échantillon ... 23
CHAPITRE 3 Résultats ... 24
CHAPITRE 4 Discussion ... 27
1 Résumé des résultats principaux en lien avec l’objectif ... 27
2 Discussion des résultats en lien avec la littérature ... 29
3 Forces et limites de l’étude ... 30
4 Implications possibles ... 31
CONCLUSION ... 33
RÉFÉRENCES ... 34
TABLEAUX ET FIGURES ... 37
ANNEXES ... 43
Annexe 1 - Méthode basée sur l’impression du clinicien ... 44
Annexe 2 - Méthode basée sur l’étude de Misthos et al. (2004) ... 45
ix
Liste des tableaux
Tableau 1: Caractéristiques démographiques des patients à l’étude ... 38 Tableau 2: Valeurs d’accord inter-observateur (ICC) globaux et spécifiques aux 4
spécialités, pour chaque échelle de catégorisation ... 39 Tableau 3: Valeurs d’accord intra-observateur (ICC) globaux et spécifiques aux médecins
(un de chaque spécialité) ayant effectué les évaluations à deux reprises,
x
Liste des figures
Figure 1: Valeurs d’accord inter-observateur pour chaque échelle de catégorisation et spécifiques aux 4 spécialités ... 41 Figure 2: Valeurs d’accord intra-observateur par médecin (un de chaque spécialité) ayant
xi
Liste des abréviations
AIS: Abbreviated Injury ScoreAP: Antéro-postérieure ASA: Aspirine
CHIR: Chirurgiens
CHUL: Centre Hospitalier de l’Université Laval CI: Intervalle de confiance (Confidence Interval) Fx: Fracture
HEJ: Hôpital Enfant-Jésus
HSCM: Hôpital du Sacré-Cœur de Montréal HTx: Hémothorax tardif
ICC: Coefficient de Corrélation Intraclasse (Intraclass Correlation Coefficient) ISS: Injury Severity Score
K: Coefficient Kappa de Cohen MD FAM: Médecins de famille
MPOC: Maladie pulmonaire obstructive chronique MSSS: Ministère de la Santé et des Services Sociaux O2: Oxygène
PA: Postéro-antérieure
PACS: Picture archiving and communication system r: Indice de corrélation
RAD: Radiologistes
SF-12: Medical Outcome (12-Item) Short Form Health Survey TDM: Tomodensitométrie
TTM: Traumatisme thoracique mineure URG : Urgentologue
xii
Remerciements
Je tiens à remercier Marcel Émond, mon collègue et directeur de recherche, pour son encadrement, pour sa disponibilité et pour ses précieux conseils tout au long de mon cheminement. Je remercie également Lynne Moore, ma co-directrice de recherche, pour ses commentaires pertinents et constructifs et pour son œil critique. À toute l’équipe de recherche de l’axe de traumatologie et de soins intensifs de l’Hôpital Enfant-Jésus, vous avez toute mon appréciation pour votre support au travers les étapes de ce projet.
Je remercie également Guillaume Lacombe, résident du programme de Médecine d’Urgence spécialisée de l’Université Laval, pour sa disponibilité et précieuse aide lors de la collecte de données.
Je souhaite remercier tout spécialement mon épouse, Lucie, et mes trois enfants, Gabriel, Celeste et Noah, pour leur amour, support moral et encouragement. Vous êtes une grande source d’inspiration pour moi et me poussez toujours à relever mes défis. URG : Urgentologue
1
CHAPITRE 1
INTRODUCTION ET REVUE DE
LITTÉRATURE
1 Épidémiologie
Les traumatismes thoraciques comptent parmi les causes les plus fréquentes de mortalité, de morbidité, d’hospitalisation et d’incapacité en traumatologie (2). La majorité des blessures thoraciques surviennent suite à des accidents de véhicules moteurs ou à des chutes. En Amérique du Nord, les traumatismes thoraciques comptent pour 10 à 15 % de toutes les admissions hospitalières de nature traumatique (3) et on attribue de 20 à 25% des décès en traumatologie à des traumatismes thoraciques (4). On estime que les traumatismes thoraciques sont responsables pour environ 16 000 décès par année aux États-Unis (5).
Les traumatismes thoraciques sont classés en deux catégories, soit les traumatismes pénétrants (où il y a pénétration de la paroi thoracique) et les traumatismes contondants ou fermés (où il y a blessure à la cavité thoracique ou aux organes qu’elle contient sans qu’une pénétration ou perforation en soit la cause) (5).
Les traumatismes thoraciques fermés résultent soit d’un transfert direct d’énergie à la cage et aux organes thoraciques ou d’une décélération différentielle des organes thoraciques lors d’un impact. Les traumatismes fermés peuvent être sous-catégorisés en termes de sévérité, soit majeurs ou mineurs. Cette sous-catégorisation est souvent basée cliniquement, selon l’importance de la blessure (évaluée selon des échelles bien connues, tel le Abbreviated Injury Score (AIS), qui fait partie d’une échelle plus globale, le Injury
Severity Score (ISS) (6) et le besoin d’hospitalisation. Les traumatismes thoraciques
mineurs (TTM) sont l’objet unique de ce projet de recherche.
La majorité des traumatismes thoraciques sont considérés comme mineurs (7). En général, la blessure se limite à la cage thoracique (c’est-à-dire, les côtes et le sternum) et à la peau sus-jacente. La grande proportion (plus de 75%) de ces patients sont vus dans un contexte ambulatoire et ne nécessite pas une hospitalisation (3) (7). Pour ces patients, un des éléments clés du traitement est une bonne analgésie, permettant un soulagement de la douleur reliée au traumatisme et le maintien d’une bonne capacité respiratoire (8) (9). Wisner (10) a même démontré une diminution de la mortalité ainsi que des complications
2
pulmonaires, chez une cohorte de 307 patients âgés de plus de 60 ans admis avec un diagnostic de fracture costale ou sternale, suivant l’administration d’une analgésie épidurale. Un autre élément essentiel dans la prise en charge des patients subissant un TTM est la surveillance et le traitement des complications qui peuvent en découler (11). Les complications associées aux traumatismes thoraciques sont multiples et peuvent être classifiées en deux catégories, soit immédiates ou tardives. Dans cette étude, nous nous attardons à la description des complications tardives.
2 Complications tardives des traumatismes thoraciques
2.1 Syndrome douloureux
Parmi les différents types de complications tardives décrites dans la littérature, on note d’abord la persistance ou même le développement d’un syndrome douloureux
thoracique. Dans une petite étude turque sur 80 patients, Han et al. (12) ont analysé
l’évolution de la douleur secondaire à un TTM ainsi que le temps requis pour un retour au travail ou aux activités normales. Ils ont déterminé qu’avec un traitement adéquat de la douleur, soit avec des anti-inflammatoires ou des analgésiques opioïdes, que l’intensité de la douleur était réduite de façon significative au bout de la première semaine après le trauma et que les patients de l’étude ont pu reprendre leurs activités domestiques ou de travail à ce moment. Ils ont aussi évalué le temps requis pour un retour à une fonction respiratoire adéquate. De façon similaire, ils ont noté une amélioration significative vers le 7e jour suivant le trauma, avec une amélioration optimale au bout d’un mois. Dans une étude de cohorte prospective multicentrique canadienne par Daoust et al. (13), on a analysé 734 patients consécutifs ayant subi un TTM et ayant reçu leur congé de l’urgence dans le but d’identifier de potentiels facteurs de risque de douleur cliniquement significative à 90 jours. Selon une analyse de trajectoire, 18.2% de la population à l’étude a souffert de douleur cliniquement significative, défini par un score de plus de 3/10 sur une échelle visuelle analogue standardisée. Suite à des analyses multivariées, les auteurs ont déterminé les facteurs prédictifs comme étant la présence d’au moins deux fractures de côtes, le tabagisme et une saturation sanguine en oxygène initiale inférieure à 95%.
Émond et al. (14) ont publié une étude canadienne mesurant l’importance de l’impact fonctionnel à 30 et à 90 jours, dans une cohorte prospective de 482 patients ayant subi un TTM. Ils ont défini un TTM par la présence d’une abrasion ou d’une contusion thoracique,
3
ou la suspicion ou confirmation de fractures costales sur des radiographies simples. Les patients de l’étude bénéficiaient d’un suivi médical en externe, une et deux semaines après leur première consultation, ainsi qu’un suivi téléphonique par une infirmière aux jours 30 et 90. Pour mesurer l’impact fonctionnel, les auteurs se sont servis du Medical Outcome Short-Form Health Survey (SF-12), un questionnaire psychométrique validé pour évaluer la santé et le bien-être fonctionnels tels que perçus par le patient. Un objectif secondaire de l’étude était d’évaluer l’importance de la douleur thoracique (à 0, 14, 30 et 90 jours) à l’aide d’une combinaison d’échelles numériques.
Aux évaluations faites à 30 et à 90 jours, 22.8% des patients rapportaient une incapacité modérée et 58.5%, une incapacité sévère. La tendance de déclin observée sur l’échelle différait selon la présence de complications, telles le développement d’un hémothorax retardé et le nombre de côtes fracturées (au moins 2). Le niveau moyen de douleur rapporté était de 7.2/10, avec une diminution significative entre suivis consécutifs.
2.2 Pneumonie et atélectasie
Une autre complication potentielle est le développement d’une pneumonie et l’atélectasie (affaissement d’un segment pulmonaire) secondaire à une faible expansion thoracique. Celle-ci résulte le plus souvent d’une analgésie sous-optimale et donc d’une respiration moins profonde et complète. Il en résulte que les alvéoles pulmonaires ne prennent pas leur expansion normale avec chaque respiration et finissent par se collaber et/ou se surinfecter. Ceci perturbe donc les échanges gazeux, causant une hypoxémie, la diminution du taux d’oxygène dans le sang.
Nous retrouvons dans la littérature plusieurs études faisant état de la relation entre les traumatismes thoraciques modérés à sévères et le développement d’une atélectasie et/ou d’une pneumonie.
Brasel et al. (15) ont analysé un échantillon de 17 308 patients à partir d’une base de données nationale américaine, ayant reçu un diagnostic de fractures de côtes, et ont déterminé que 6% ont développé une pneumonie; l’âge et l’ISS étaient associés de façon significative au développement d’une pneumonie et à la mortalité. Bergeron et al. (16) ont aussi déterminé que des patients plus âgés (65 ans et plus) avec des fractures de côtes étaient plus à risque de développer une pneumonie et avaient un taux de mortalité plus élevé que ceux de moins de 65 ans. Sur un échantillon de 4 325 patients, 405 (9.4%) avaient des fractures de côtes et 69 (17%) ont développé une pneumonie. La pneumonie
4
prédisait de façon statistiquement significative la mortalité tardive (> 72 hres), avec un taux de mortalité de près de 4 fois supérieur à ceux n’ayant pas cette complication. Les patients âgés de 65 ans et plus démontraient une mortalité 5 fois plus élevée lorsque comparés à ceux de moins de 65 ans. En Italie, sur un échantillon de 124 patients, Antonelli et al. (17) ont identifié des facteurs de risque pour le développement d’une pneumonie hâtive ou tardive: 41 patients (33.1%) ont développé une pneumonie, dont 15 étaient tardives (> 4 jours suivant la blessure). Celles-ci étaient associées à une blessure sévère à l’abdomen ainsi qu’à une durée de ventilation mécanique supérieure à 5 jours.
Mais qu’en est-il chez les patients subissant des traumatismes thoraciques fermés mineurs, le sujet de la présente étude? Malheureusement, la littérature sur le sujet est moins développée. Dans une étude de cohorte prospective multicentrique canadienne, Chauny et al. (18) ont analysé 1 057 patients ayant subi un traumatisme thoracique mineur et ayant reçu leur congé de l’urgence avec un traitement et suivi en externe, une et deux semaines plus tard. Seuls 6 patients (0.6%) ont développé une pneumonie pendant le suivi. Le risque relatif de développer cette complication s’élevait à 8.6 (p=0.45; IC 1.05–70.9) en présence d’antécédents de maladie pulmonaire et fractures costales confirmées par radiographie. Les auteurs suggéraient un bénéfice éventuel pour le suivi spécifique de ces patients.
2.3 Pneumothorax retardé
Une autre complication pouvant se présenter de façon tardive est le pneumothorax (présence d’air dans la cavité pleurale, dans l’espace entre le poumon et la paroi thoracique) (1) (19). Le principal muscle sollicité lors d’un effort respiratoire est le diaphragme. Avec chaque inspiration, le diaphragme s’abaisse et créé une pression négative au sein de la cage thoracique, ce qui permet l’entrée d’air et l’expansion des poumons. Lors d’un bris au niveau de la plèvre viscérale (enveloppe du poumon) suite à un traumatisme, l’air inspiré peut s’échapper à travers ce bris et s’accumuler au niveau de l’espace pleural, créant ainsi un pneumothorax. Il en résulte, selon l’importance de ce dernier, une douleur thoracique et une difficulté respiratoire, qui se traduisent par une mauvaise oxygénation et, dans le cas de pneumothorax sévère, la possibilité d’une instabilité hémodynamique.
Dans une étude prospective européenne en 2004, Misthos et al. (1) ont suivi 709 patients consécutifs ayant subi des traumatismes thoraciques fermés et qui rencontraient des critères prédéfinis pour être traités sur une base externe ( 2 fractures costales, 65 ans, absence de blessure pulmonaire, absence de blessure à un autre système, absence de
5
comorbidité) sur une période de 7, 14 et 21 jours. Les auteurs ont démontré que 14 patients (2%) avaient développé un pneumothorax retardé lors de leur réévaluation 24 à 48 heures plus tard. Plourde et al. (19) ont suivi, dans une étude de cohorte prospective canadienne, 450 patients pour déterminer la prévalence, les facteurs de risque ainsi que le délai d’apparition de pneumothorax et d’hémothorax retardés chez des patients ayant subi un TTM. Au total, Plourde et al. (19) ont rapporté le développement d’un pneumothorax retardé chez 4 (0.9%) des patients et d’un hémothorax retardé chez 53 (11.8%) de ceux-ci. Un suivi effectué à 2, 7 et 14 jours suivant le traumatisme a démontré que 87% de ces complications tardives se sont développées au courant de la première semaine. Ils ont déterminé, suite à des analyses multivariées, que le seul facteur de risque relié à l’apparition de ces complications tardives était la localisation de la fracture costale sur la radiographie; les fractures costales supérieures représentant le plus de risque. Il semble donc que l’hémothorax retardé (HTx) soit une complication plus fréquente que celles énumérées précédemment.
2.4 Hémothorax retardé
Une quatrième complication pouvant apparaitre tardivement, pouvant être d’une morbidité non négligeable, est l’hémothorax retardé (1) (19). Il s’agit de la présence de sang dans la cavité pleurale. L’hémothorax retardé résulte le plus souvent d’une blessure au niveau du parenchyme pulmonaire ou au niveau des vaisseaux de la paroi thoracique. Cette présence de sang au niveau de la cavité pleurale est très irritante pour la plèvre et aggrave la douleur à la respiration causée par le traumatisme. De plus, s’il s’accumule un volume assez important de sang autour du poumon, ces facteurs, seuls ou en combinaison, résultent en une mauvaise oxygénation.
Dans une étude américaine rétrospective, Simon et al. (20) ont évalué tous les cas d’hémothorax associés à un TTM s’étant présenté à un centre tertiaire de traumatologie, sur une période de trois ans. Les auteurs ont noté que chez 308 patients admis ayant subi une blessure thoracique osseuse, 36 (11.7%) avaient aussi un hémothorax, dont 12 (33%) étaient de nature retardé (absent sur des radiographies et/ou des tomodensitométries initiales). Ils rapportaient ainsi une incidence de 4% d’hémothorax retardé chez leurs patients victimes d’un traumatisme thoracique contondant, possiblement une valeur sous-estimée de par la nature rétrospective de l’étude. Tous ces patients avaient au moins une radiographie pulmonaire normale entre neuf heures et deux jours suivant la blessure. Le délai de présentation d’hémothorax variait entre 18 heures et 6 jours, avec une moyenne de
6
3.06 jours. Dans l’étude européenne de Misthos et al (1), 52 des 709 patients (7.4%) ont présenté un hémothorax retardé dans les 14 jours suivant la blessure initiale. Cent pourcent des 52 patients avec un HTx avaient au moins une fracture de côte. Ces hémothorax ont été diagnostiqués le plus souvent au 7e jour suivant le traumatisme (78.8%). Aucun patient n’a reconsulté à l’hôpital plus tard que 3 semaines.
L’étude de Misthos et al. (1) portait sur l’incidence des complications suite à un TTM et il n’y a eu aucune tentative de corréler ces résultats avec les états cliniques des patients. En fait, il y a, à ce jour, peu ou pas d’études portant sur l’impact clinique qu’a la complication de l’HTx. Dans une étude de cohorte prospective récemment publiée par Émond et al. (14), les auteurs ont déterminé que sur une cohorte de 482 patients ayant subi un traumatisme thoracique mineur, dont 147 (30.5%) avaient au moins une côte fracturée, que 59 (12.2%) ont développé une hémothorax retardé. À 90 jours de suivi, 22.8% des patients avaient encore une invalidité modérée à sévère lorsqu’évalués sur une échelle globale de santé physique, le Medical Outcome (12-Item) Short Form Health Survey (SF-12). En plus du fait que la sévérité de l’atteinte fonctionnelle semblait proportionnelle au nombre de côtes fracturées, les patients ayant un hémothorax retardé sans évidence de fractures de côtes avaient une atteinte plus significative encore.
Il est donc clair, suite à l’analyse de cette littérature et à notre expérience actuelle, que les TTM ne sont pas une affection rare;
les TTM ne sont pas sans complications;
ces complications ne se limitent pas seulement aux traumas thoraciques majeurs mais peuvent bien survenir suite à des traumatismes considérés comme étant mineurs;
ces complications ne sont pas nécessairement présentes lors du premier contact avec le patient mais peuvent être retardées plusieurs heures ou jours suivant le traumatisme;
la prise en charge de ces complications peut souvent nécessiter plus qu’un simple suivi du patient, et même souvent une intervention invasive;
ces complications et leur traitement ont un impact important sur le fonctionnement quotidien des patients.
7
D’une morbidité significative et sujets de peu d’études, les HTx seront la complication ciblée pour la présente mémoire.
Les décisions que prennent les professionnels de la santé quant à la prise en charge des patients traumatisés dépendent de plusieurs éléments: la nature des blessures (actuelles et aussi, celles qui sont à développement tardif), leur sévérité et l’impact fonctionnel actuel et potentiel que ces blessures ont sur le patient. L’impact fonctionnel que peuvent avoir les blessures sur le patient est parfois difficile à prévoir. Les médecins basent leurs décisions thérapeutiques sur ce que la littérature médicale leur donne comme information. Mais il y a souvent, aussi, une partie de la décision qui est plutôt subjective, basée sur l’expérience personnelle du médecin. Ceci fait en sorte que parfois, les décisions thérapeutiques peuvent varier d’un médecin à l’autre. Dans l’intérêt de trouver un consensus dans nos décisions thérapeutiques, on catégorise les blessures et leurs complications en termes de sévérité, d’une façon la plus objective et fiable possible. Ceci permet aux différents intervenants, lorsqu’ils discutent d’un patient, d’avoir une appréciation la plus représentative possible du patient. Cette catégorisation permet aussi aux intervenants de stratifier non seulement l’importance des blessures actuelles, mais aussi de prévoir la survenue (et l’importance) des complications. Dans le cas des HTx chez des patients ayant subi un TTM, il n’existe présentement aucune façon objective de classifier ces complications en termes de leur importance ou de leur sévérité. Une opinion quant au degré d’importance ou de sévérité est accordée (ex: léger, modéré, sévère; petit, moyen, gros, etc.) par le professionnel qui en fait la lecture, mais celle-ci est souvent émise sur la base de l’expérience personnelle du lecteur et peut donc varier de façon importante d’une personne à l’autre, selon le niveau d’exposition et d’expérience avec de telles pathologies. Cette fiabilité incertaine militerait en faveur de l’évaluation de différentes méthodes de classification de l’HTx, le but étant de déterminer s’il existe une façon plus fiable et reproductible de décrire et de classifier cette pathologie.
3 Techniques de mesure volumétrique thoracique
La cavité pleurale est une cavité quasi virtuelle, située entre la plèvre viscérale (tissu enveloppant le poumon) et la plèvre pariétale (tissu tapissant l’intérieur de la cage thoracique). En temps normal, cette cavité contient une infime quantité de liquide, qui sert de lubrifiant, permettant aux deux plèvres de glisser l’une sur l’autre avec chaque
8
respiration. Spontanément, ou plus fréquemment suite à un traumatisme, il peut s’accumuler une quantité plus ou moins importante d’air ou de liquide dans cette espace. Lorsqu’un patient consulte à l’urgence suite à un traumatisme thoracique, l’évaluation médicale débute toujours par un questionnaire et un examen physique ciblés. À partir des informations obtenues, le médecin peut souvent déterminer cliniquement la nature des blessures qui en ont résulté. Cependant, le médecin voudra, par la suite, confirmer ses suspicions à l’aide d’imagerie. Dans la grande majorité des cas, outre la radiographie des côtes pour détecter la présence de fractures costales, le médecin prescrira au patient une radiographie pulmonaire, ce qui permettra de déterminer, entre autres, s’il y a présence d’air (pneumothorax) ou de liquide - généralement du sang - (hémothorax) dans la cavité pleurale.
Un autre moyen dont dispose le médecin d’urgence pour évaluer la présence de blessures internes suite à un traumatisme thoracique est de demander une tomodensitométrie thoracique (TDM). Celle-ci permet d’identifier, avec plus de précision, la présence et l’importance d’une complication. Cependant, cette plateforme technique n’est pas disponible dans tous les milieux procurant des soins de santé aux personnes subissant un traumatisme, limitant ainsi sa généralisation.
En aigu, et selon l’importance de l’accumulation d’air ou de liquide, le patient peut démontrer une difficulté respiratoire, de la douleur, et dans les cas extrêmes, peut devenir instable sur le plan hémodynamique et nécessiter une intervention invasive immédiate. Parfois, cependant, cette accumulation peut être moins significative et, outre une bonne analgésie, ne nécessiter aucune intervention. Une simple observation et un suivi médical peuvent être tout ce que le patient nécessite. Cette observation et suivi sont d’une grande importance pour permettre au médecin de détecter l’apparition de complications tardives.
La décision thérapeutique que prend le médecin en présence d’un pneumothorax (ou d’un hémothorax) est, entre autres, fondée sur l’importance de l’accumulation aérienne (ou liquidienne) au sein de la cavité pleurale. Différentes méthodes ont été étudiées dans la littérature pour traduire l’image observée sur la radiographie pulmonaire en une valeur numérique ou pour lui accorder un ordre de grandeur.
9
3.1 Évaluation du volume d’un pneumothorax – Revue des techniques de
mesure objectives
Étant donné que le poumon est une structure tridimensionnelle, la mesure de la grosseur d’un pneumothorax (en termes de volume), lorsqu’évaluée sur un rayon-x pulmonaire bidimensionnel, manque souvent de précision. Les guides de pratique se basent souvent sur les distances entre les plèvres viscérale et pariétale pour déterminer la grosseur et ainsi la nature du traitement à envisager lors de la prise en charge des pneumothorax. Rhea et al. (21) ont fait usage de cette méthodologie dans une étude américaine publiée en 1982. Ils ont utilisé des mesures de distance interpleurale à l’apex et aux tiers moyens des moitiés supérieures et inférieures de l’hémithorax où se situait le pneumothorax (qu’ils ont ensuite divisé par 3, pour en faire une moyenne), chez un groupe de 20 patients à partir de radiographies pulmonaires PA et latérales. Ils ont démontré une bonne corrélation entre cette somme moyenne de ces mesures (appelée distance interpleurale moyenne) et le vrai volume de pneumothorax calculé (r=0.94), basée sur une étude de Barnhard et al. (22), où ces derniers avaient développé une formule mathématique permettant le calcul du pourcentage de pneumothorax.
Plusieurs formules ont été décrites pour tenter de mesurer les pneumothorax de façon précise, fiable et reproductible et d’en arriver à une catégorisation de ceux-ci. En Belgique, Noppen et al. (23) ont validé l’utilisation d’un indice, le “Light index” - basé sur l’approximation que le volume du poumon et de l’hémithorax sont sensiblement proportionnels au cube de leurs diamètres - en démontrant une bonne corrélation entre cette indice et la mesure réelle de volume de pneumothorax par aspiration manuelle.
Grosseur pneumothorax primaire spontané (%) = 100 – diamètre moyen poumon3 x 100
diamètre moyen hémithorax3
Misthos et al. (1) utilisent le tiers de la sommation de mesures prises à l’apex, au moitié supérieur et au moitié inférieur sur une radiographie pulmonaire postéro-antérieure pour ensuite établir un pourcentage (sur un nomogramme) et ainsi un niveau de sévérité.
Distance Interpleurale Moyenne = A + B + C 3
10
où A = distance interpleurale maximale au niveau de l’apex pulmonaire;
B = distance interpleurale au point médian de la moitié supérieure du poumon; C = distance interpleurale au point médian de la moitié inférieure du poumon.
En Royaume-Uni, Collins et al. (24) ont tenté, à partir d’une série de 19 patients (20 pneumothorax), de définir une relation entre les mesures de distances interpleurales sur une radiographie pulmonaire postéro-antérieure et la grosseur d’un pneumothorax tel que mesurée par tomodensitométrie hélicoïdale. Par la suite, une analyse régressive a permis d’établir une formule mathématique permettant de calculer de façon plus précise le pourcentage de pneumothorax à partir de ces mesures.
Y = 4.2 + 4.7 x (A + B + C)
où A, B, et C ont la même définition que dans l’article de Misthos et al. (1).
Dans le même ordre d’idée, aux États-Unis, Cai et al. (25) ont développé et validé un outil tomodensitométrique, la mesure de volumétrie par assistance informatique, pour mesurer la grosseur des pneumothorax chez des patients traumatisés.
11
De façon similaire, il existe dans la littérature des études ayant fait l’exercice de décrire différentes méthodes pour mesurer un hémothorax observé, soit sur une radiographie pulmonaire simple ou sur une TDM.
3.2 Évaluation du volume d’un hémothorax – Revue des techniques de mesure
objectives
Dans le cas de l’évaluation d’un hémothorax, la littérature ne démontre guère plus de consensus dans la façon de classifier. Il n’est pas inhabituel de recevoir un rapport d’une lecture faite par le radiologiste d’une radiographie pulmonaire ou d’un TDM thoracique dénotant la présence d’un hémothorax, qualifié de léger, modéré ou sévère, dont la qualification est plutôt basée sur le jugement et l’expérience personnels du radiologiste qui en fait la lecture. Il en est de même lorsque les différents intervenants (urgentologues, chirurgiens) évaluent l’imagerie. Leur interprétation de l’importance de l’accumulation ainsi que leur décision thérapeutique sont souvent basées sur ces éléments subjectifs. Cette différence potentielle de “langage” ajoute donc un degré supplémentaire de complexité à la discussion entre professionnels.
3.2.1 Points de repère, calculs de ratios et formules mathématiques
Dans une étude réalisée Afrique du Sud en 1964, Shnier et al. (26) ont répertorié un échantillon de patients admis à leur centre hospitalier et ayant subi un traumatisme thoracique pénétrant (ici, des traumatismes par arme blanche et donc avec pénétration de la cage thoracique). Ils ont évalué la nature des blessures, le traitement entamé ainsi que l’évolution des patients en termes de mortalité. Dans leur étude, ils adressent la difficulté d’évaluer l’importance de la perte volumétrique ainsi que le volume d’hémithorax occupé par le sang ou du liquide. Ils ont employé une méthode linéaire simple, dont se servaient les chirurgiens comme guide approximatif dans la planification de leurs traitements. Il s’agissait de diviser l’hémithorax horizontalement en dix portions égales entre le diaphragme et l’apex. De façon similaire, ils ont aussi fait dix divisions verticales entre le hile pulmonaire et la périphérie, chacun valant 10%. Ces mesures ne représentent pas des quantités physiologiques ou anatomiques, mais simplement des images radiologiques.
12
Aux États-Unis, en 1999, Mergo et al. (27) ont développé une formule mathématique pour quantifier les épanchements pleuraux évalués par TDM thoracique. Dans un petit groupe de patients, des reconstructions des épanchements pleuraux en 3-dimensions ont été créés, et les volumes calculés. Les volumes des épanchements ont aussi été estimées en appliquant la formule mathématique
d2 x l
où d représente la profondeur maximale de l’épanchement sur une image du TDM, et l, la longueur maximale de celui-ci. En notant les valeurs numériques de la profondeur et de la longueur sur un nomogramme qu’ils ont créé, le volume de l’épanchement pouvait ensuite être estimé. Le coefficient de corrélation entre les estimés par mesure et les volumes calculés était entre 0.849 et 0.908, selon le côté où l’épanchement se situait. Malgré la meilleure précision de cette méthode, cette modalité (TDM) n’est pas offerte dans plusieurs centres où cette population de patients reçoit des soins, rendant donc cette méthode difficilement applicable pour tous.
13
3.2.2 Estimées basées sur l’image radiographique
En 1973, Moskowitz et al. (28) ont publié une étude américaine dans laquelle ils ont déterminé la quantité minimale de liquide pleurale nécessaire pour être visible sur une radiographie. Dans cette étude, ils ont pris des cadavres, qu’ils ont placés en décubitus latéral droit et dans lesquels ils ont inséré un cathéter dans l’espace pleurale. Ils ont par la suite injecté de petites quantités de liquide et pris des radiographies. Ils ont pu démontrer la capacité de détecter des quantités de liquide aussi petites que 5 à 10 ml. D’une façon similaire, Misthos et al. (1) ont estimé l’importance des épanchements pleuraux chez les patients de leur étude en examinant les radiographies pulmonaires en position debout, sur la vue postéro-antérieure. Si la collection liquidienne remplissait l’angle costo-phrénique ipsilatéral (annexe 2), ils estimaient la quantité à 300-400 ml. Un épanchement plus important, dépassant cet angle, était estimé à plus de 500 ml. Par contre, ces mesures furent simplement des estimés et n’ont pas été sujet à une validation objective (ex. par tomodensitométrie ou drainage thoracique). Dans une analyse prospective américaine de 34 patients, Ruskin et al. (29) ont évalué la sensibilité de radiographies pulmonaires prises en clichés antéro-postérieur (AP) et en décubitus latéral pour détecter la présence et l’importance d’épanchements pleuraux. Sur 36 épanchements détectés sur les films en décubitus, seuls 24 ont pu être identifiés sur la radiographie AP, pour une sensibilité de seulement 67%. Aux États-Unis, Blackmore et al. (30) ont développé une règle de prédiction pour estimer le volume d’un épanchement pleural identifié sur des radiographies pulmonaires postéro-antérieures (PA) et latérales. Cette règle a ensuite été testée et validée par un revue rétrospective de patients ayant eu des radiographies pulmonaires et leur étalon d’or, un scan thoracique (TDM), dans l’espace de 24 heures l’une de l’autre. Ils ont démontré des sensibilités de 85-86% et des concordances inter-observateurs entre 88% et 97%. L’épanchement pleural devenait visible sur la radiographie latérale à partir d’un volume de 50 ml; à 200 ml, celui-ci devenait visible sur la radiographie PA; à 500 ml, l’épanchement émoussait l’image du diaphragme.
Eidenberger et al. (31) ont publié une étude autrichienne comparant l’utilisation de l’échographie, versus la radiographie, comme méthode pour quantifier le volume d’un épanchement pleural. Leur étude comportait 51 patients, chez qui ils ont comparé les résultats d’échographie en position couchée et ceux de radiographies prises en décubitus latéral à des volumes actuels d’épanchements pleuraux obtenus par drainage complet. Ils ont déterminé que la mesure sonographique avait une meilleure corrélation avec les volumes actuels, mesurés par drainage (r = 0.80) que les estimations obtenues par
14
radiographies (r = 0.58). Statistiquement, l’échographie présentait, aussi, moins d’erreur dans la prédiction de volume drainé versus la radiographie.
4 Pertinence de l’étude et retombées attendues
Devant l’absence d’un consensus sur la façon de mesurer et de classifier les hémothorax, il serait donc intéressant, comme cliniciens et chercheurs, d’avoir une façon plus objective et fiable pour les décrire. Pour ce faire, nous proposons de comparer trois différentes méthodes pour catégoriser les hémothorax. Celles-ci sont basées sur des mesures obtenues à partir de l’imagerie radiographique utilisée par la plupart des intervenants lors de l’évaluation de ces patients. Les objectifs sont de déterminer si l’une ou plusieurs d’entre elles ont une fiabilité acceptable et d’identifier laquelle a la meilleure fidélité.
Une façon plus standardisée de catégoriser des hémothorax permettrait aux différents intervenants d’avoir une plus grande homogénéité dans la description de leur importance et, possiblement, lors des décisions quant aux options thérapeutiques.
Advenant ceci, une étude ultérieure pourrait être effectuée afin de valider son applicabilité clinique avec des échelles de fonctionnement, tel le SF-12. Cette validation clinique pourrait ensuite servir à cibler quels patients ayant subi un TTM pourraient bénéficier d’un protocole de suivi systématique afin de prévenir une détérioration de leur état fonctionnel.
5 Objectif
L’objectif de cette étude est d’évaluer la fiabilité inter- et intra-observateur de trois méthodes de classification d’hémothorax retardé chez des patients ayant été libérés de l’urgence suite à une visite pour un TTM.
5.1 Hypothèses et résultats attendus
Trois différentes méthodes sont évaluées. La première méthode est basée sur l’opinion subjective de l’évaluateur; une deuxième est basée sur l’étude de Misthos et al. (1); et une troisième repose sur le calcul de ratios à partir de mesures prises par les évaluateurs sur les radiographies pulmonaires. Nous croyons que la méthode la plus souvent utilisée présentement par les différents intervenants impliqués dans les soins de patients subissant des TTM, c’est-à-dire celle basée sur l’opinion et l’expérience personnelles du médecin, est
15
sujet à une grande variabilité, pouvant ainsi faire varier les décisions thérapeutiques qui en suivent.
Nous croyons que l’une des trois méthodes à l’étude, soit celle basée sur les mesures obtenues de radiographies pulmonaires et le calcul de ratios, sera la méthode la plus fiable et reproductible des trois mesures à l’étude.
16
CHAPITRE 2
MÉTHODOLOGIE
1 Type d’étude
Analyse secondaire d’une étude de cohorte multicentrique prospective de 1132 patients évalués à 7 et 14 jours post-TTM, effectuée de novembre 2006 à novembre 2010 et subventionnée par le Fonds de Recherche en Santé du Québec (FRQ-S 14056).
2 Population à l’étude
La population de la présente étude est un échantillon aléatoire de 50 patients parmi les 121 ayant eu le diagnostic radiologique d’HTx sur radiographies pulmonaires simples.
Pour être inclus dans l’étude originale, et donc dans notre échantillon, les participants devaient correspondre aux critères d’inclusion et d’exclusion suivants :
2.1 Critères d’inclusion
Personnes âgées de 16 ans et plus ayant consulté initialement à l’urgence pour un TTM. Un « traumatisme fermé mineur au niveau de la cage thoracique » se définit par la présence d’au moins un des facteurs suivants lors de la consultation initiale à l’urgence:
- Douleur principalement localisée au niveau de la cage thoracique (raison principale de consultation) ;
- Abrasion(s) ou ecchymose(s) au niveau du thorax ;
- Suspicion clinique de fractures de côtes définie par une douleur costale circonscrite à la palpation avec ou sans crépitants osseux, exacerbée par le mouvement ou la respiration (douleur pleurale) ;
- Fracture(s) de côte(s), lorsque présentes, confirmée(s) à la radiographie définie par un bris de la continuité au niveau de l’os cortical.
Des paramètres physiologiques stables et normaux notés par le médecin traitant de l’urgence, lors du congé du patient. À titre de référence, les paramètres suivants sont considérés normaux: pouls inférieur à 100/minute, tension artérielle systolique
17
supérieure à 100 mm Hg, fréquence respiratoire inférieure à 16/minute et une saturation en oxygène de 95% et plus ;
Un score de 15 à l’Échelle de coma de Glasgow à l’arrivée et au congé de l’urgence ; Une radiographie de l’hémithorax affecté et une radiographie pulmonaire, toutes deux interprétées comme normales par le radiologiste, à l’exception de fracture(s) de côte(s) ;
Patient ayant reçu son congé de l’urgence suite à la visite initiale.2.2 Critères d’exclusion
Un patient s’étant présenté à l’urgence plus de 72 heures après la survenue de son traumatisme thoracique mineur ;
Une personne qui a présenté une atteinte traumatique significative lors de la visite initiale et pour laquelle une hospitalisation a été requise ou un suivi par un spécialiste fut nécessaire, à savoir ;
- Une fracture de la première ou de la deuxième côte telle que définie ci-haut ; - Une facture vertébrale cervicale, thoracique, lombaire ou sacrée telle que définie, à la radiographie, par un bris de la continuité au niveau de l’os cortical ;
- Une lésion médiastinale telle que définie à la tomodensitométrie (TDM) par un hématome médiastinal ou une atteinte des gros vaisseaux ;
- Un volet thoracique tel que défini, à la radiographie, par des fractures d’au moins deux côtes à deux endroits différents responsables, à l’examen physique, d’une instabilité au niveau de la paroi thoracique ;
- La présence d’hémothorax, pneumothorax ou contusion pulmonaire sur les images radiologiques ;
- La présence de toute autre blessure non thoracique plus importante pour laquelle un traitement orthopédique ou chirurgical fut nécessaire, et qui a fait l’objet de la plainte principale du patient lors de sa visite initiale (e.g. : fracture des os long ou du bassin) ;
18
- Une personne qui n’a pu se déplacer pour des visites de contrôle à l’urgence ;
- Personne inapte à consentir ;
- Personne n’ayant pu s’exprimer en français ou en anglais.
2.3 Milieux hospitaliers participants
Quatre centres hospitaliers ont participé à cette étude multicentrique. Le Centre Hospitalier Universitaire de Québec - Pavillon Enfant-Jésus fut le site coordonnateur de l’étude. Les autres furent le Centre Hospitalier de l’Hôpital Sacré-Cœur de Montréal; le Centre Hospitalier Charles Lemoyne et le Centre Hospitalier Universitaire de Québec – Pavillon CHUL. Les trois premiers hôpitaux sont des centres de soins traumatologiques désignés par le MSSS. Le dernier, qui n’est pas un centre de traumatologie, voit un nombre annuel significatif de traumas mineurs.
3 Déroulement du recrutement et suivi pour la détection
d’hémothorax
Pour chacun des milieux, les patients ayant consulté à l’urgence pour un traumatisme thoracique mineur ont été approchés par le personnel traitant, soit le médecin urgentologue ayant à charge le patient. Par la suite, les patients ont été référés en clinique de suivi avec l’infirmière de recherche à leur congé. Les patients manqués ont été identifiés via l’analyse des visites journalières à l’urgence et via le système de facturation. Lorsque possible, ils ont été récupérés à posteriori et leur suivi ajusté en conséquence. Compte tenu qu’il s’agissait d’une étude prospective avec suivi, plusieurs procédures ont été implantées afin de minimiser les biais de suivi (i.e. perdus de vue et faux négatifs).
1. Un protocole de « suivi systématique » a été implanté afin de minimiser le temps d’attente des participants lors de leur visite. Plus précisément, le suivi s’est fait dans le local consacré exclusivement à la recherche. Une infirmière de recherche attitrée spécifiquement à ce projet était également responsable de remplir les feuilles de recueil systématique développées à cet effet et s’est assurée du bon cheminement du patient dans le processus. Vu la possibilité d’implication de soins cliniques, le médecin de l’urgence ou un clinicien chercheur désigné a revu le patient avant son départ.
19
2. Un suivi téléphonique 1 et 3 mois après le traumatisme thoracique fut également effectué afin de s’assurer que la fenêtre temporelle fut adéquate pour évaluer l’ensemble des complications retardées associées au traumatisme thoracique mineur.
Suite à leur première visite à l’une des urgences participantes, les personnes qui ont accepté de participer à l’étude ont été suivies par une équipe de recherche et/ou clinique, à une première et ensuite à une deuxième semaine, suivant le traumatisme thoracique. Des fenêtres de suivi ont été établies pour des fins logistiques (suivi 1 = 69 jours, suivi 2 = 13 -16 jours). Si un rendez-vous de contrôle tombait une journée de fin de semaine, le patient a été vu le lundi suivant la fin de semaine. Deux suivis téléphoniques ont été effectués à 1 et 3 mois suivant le traumatisme. Ces périodes de temps ont été choisies, d’abord dans un but de sécurité, voulant s’assurer de ne pas manquer de cas. D’autre part, un des outils cliniques utilisés lors du suivi, le SF-12 (décrit plus loin), se mesure après une période de 90 jours. Les données ont été recueillies via un ensemble de feuilles de recueil standardisées. Un suivi était prévu pour plus de 70% des patients ; dans les faits, environ 85% des patients recrutés ont bénéficié d’un suivi. Les patients présentant une complication significative ont été spécialement suivis sur une période de 6 mois ou jusqu’à résolution de leur affection. Ce suivi s’est fait par des rencontres avec l’infirmière pour les hémothorax retardés.
4 Détection des complications
Lors des contrôles médicaux, la détection d’un épanchement pleural sur les radiographies simples initiales était suivie par une radiographie pulmonaire supplémentaire, en décubitus latéral (couché sur le côté de l’épanchement) afin de déterminer la mobilité du liquide visualisée. Toute investigation ou traitement supplémentaire était laissé à la discrétion du clinicien. Certains patients ont donc eu des tomodensitométries (TDM) thoraciques et certains, un drainage de leur épanchement avec drain thoracique. Les radiographies pulmonaires ont été interprétées, dans chacun des milieux participants, par un radiologiste à l’insu des objectifs de l’étude prospective originale.
20
4.1 Hémothorax retardés, gravité et accord entre évaluateurs: déroulement du
projet actuel
Pour ce projet, nous avons utilisé un échantillon aléatoire de 50 radiographies pulmonaires simples. Cet échantillon a été sélectionné à partir de la cohorte de tous les patients (N=121) ayant présenté un HTx selon l’interprétation par le radiologiste de chaque milieu participant, lors de leur suivi au 7e et/ou 14e jours. Chaque film a été encodé avec un numéro
d’identification (ex: STTM xx-xxxx) afin d’être dénominalisé pour la présente étude avant d’être présenté aux médecins évaluateurs.
Cette sélection s’est faite à l’aide d’un tirage aléatoire sans remise de 50 observations de l’ensemble des consultations à 7 ou 14 jours dans la base de données de la cohorte de l’étude originale, en se servant d’une macro-procédure (tasr) existant dans le programme SAS (http://www.sas.com/offices/europe/france/services/support/faq/genstat.html). Une fois cet échantillon de 50 observations sélectionné, celui-ci a servi ensuite pour créer deux listes de travail dans le système informatisé de notre service de radiologie (PACS); une, listée en ordre croissant selon les identifiants des patients et l’autre, en ordre décroissant, afin de faire varier l’ordre dans lequel les radiographies ont été visualisées lors de la deuxième séance d’évaluation (évaluations intra-observateurs).
Par la suite, nous avons approché 8 médecins (de façon aléatoire) travaillant dans notre milieu (Hôpital Enfant-Jésus) dans les quatre spécialités jugées les plus susceptibles de prendre en charge de tels patients, soit deux urgentologues, deux chirurgiens, deux radiologistes et deux médecins de famille. Ces huit médecins ont ensuite procédé à la lecture et à l'interprétation de ces 50 radiographies, en y appliquant chacun des trois méthodes de classification à l’étude. Par la suite, au moins deux semaines plus tard, un médecin de chaque groupe (quatre MD au total) a procédé de nouveau à l’interprétation de ces 50 radiographies, en utilisant encore une fois les trois méthodes de classification à l’étude. À noter que, lors de cette deuxième série d’évaluations, les films ont été présentés dans un ordre différent de la première évaluation, afin d’éviter un possible biais de rappel chez les évaluateurs.
21
5 Mesures des issues
5.1 Issue principale
L’issue principale est de déterminer si l’une des méthodes de classification des HTx à l’étude, lorsqu’utilisée par les huit médecins évaluateurs des quatre spécialités pour l’interprétation des radiographies pulmonaires, s’avère être plus fiable entre les différents évaluateurs et aussi, pour le même évaluateur à deux occasions différentes.
Trois différentes méthodes de classification ont été évaluées quant à l’interprétation des films (annexes). Pour ce faire, nous avons approché les intervenants des quatre spécialités les plus susceptibles d’être sollicités dans les soins de ce type de patient, soit des urgentologues, radiologistes, chirurgiens et médecins de famille. On leur a demandé de déterminer l’importance de l’épanchement pleural présent sur les films. Pour cette étude, deux médecins de chaque spécialité ont été approchés pour évaluer les films. Une feuille réponse leur a été fournie pour chacune des trois méthodes de classification, détaillant au besoin, les repères utilisés pour faire les évaluations. Ces évaluations ont été faites à l’aveugle, les intervenants n’étant pas informés des évaluations fournies par leurs collègues. La première méthode de classification consiste à simplement demander à ces différents intervenants de déterminer, selon leur impression personnelle, s’il y a présence ou pas d’un épanchement. S’ils déterminent qu’il y a présence d’un épanchement, il leur est demandé de préciser s’il est 1) petit ou 2) gros (annexe 1).
La deuxième méthode de classification suit la dichotomie émise par Misthos et al. (1). Chaque intervenant doit déterminer s’il y a épanchement et si oui, s’il (ou elle) considère que l’épanchement est de moins de 500 ml ou si l’épanchement est de 500 ml ou plus (annexe 2), selon les critères cités dans l’étude de Misthos et al. (1). On se rappellera que dans cette étude, les auteurs ont déterminés que si la collection liquidienne remplissait l’angle costo-phrénique ipsilatéral, ils estimaient la quantité à 300-400 ml. Un épanchement plus important, dépassant cet angle, était estimé à plus de 500 ml.
La troisième méthode de classification (annexe 3), rappelant l’étude de Shnier et al. (26), est basée sur la prise de mesures sur les films, à partir de repères précises. La première mesure s’étend verticalement de la base pulmonaire et se termine à l’apex pulmonaire (“Ligne B”). La deuxième mesure s’étend verticalement de la base de l’épanchement et se termine à sa portion la plus élevée (“Ligne A”). À partir de ces deux mesures, un ratio est calculé (A/B).
22
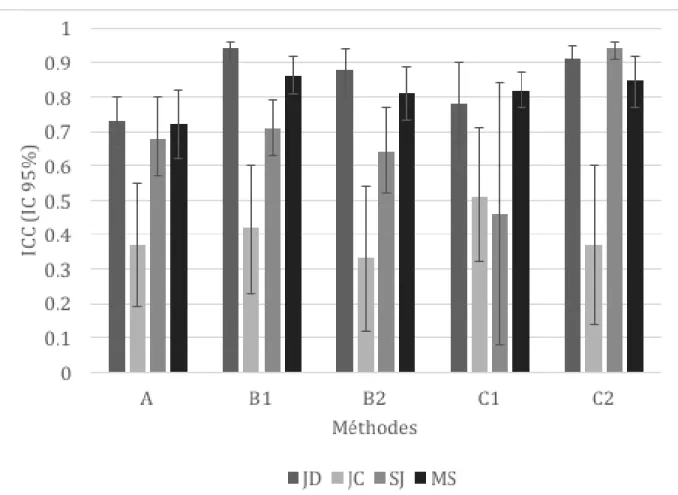
Un membre de chacun de ces quatre groupes de médecins (donc, 4 des 8 médecins au total) a été de nouveau sollicité pour refaire ces mêmes évaluations, à partir de ces mêmes films, au moins deux semaines plus tard. Nous étions, par la suite, en mesure de comparer les réponses entre elles pour chaque médecin sur les deux séances et déterminer un accord “intra-observateur”.
6 Analyses statistiques
6.1 Issue principale: Accords inter et intra-observateurs
Pour les trois méthodes de classification évaluées, nous avons déterminé la fiabilité inter- et intra-observateur en calculant l’indice de corrélation intraclasse (ICC), à l’aide de la macro-procédure SAS “intracc” (http://support.sas.com/kb/25/031.html) (32). Un élément qui rend difficile la comparaison de données ordinales et continues est la différence de leur statistique descriptive. Lorsqu’il s’agit de données ordinales ou catégoriques, les mesures Kappa ou Kappa pondéré sont souvent utilisées. Pour des données continues ou quantitatives, les coefficients de corrélation du produit-moment de Pearson ou intraclasse sont souvent employés. Fleiss et Cohen (1973) ont établi l’équivalence entre le Kappa pondéré et le coefficient de corrélation intraclasse de façon générale.
Cette mesure décrit la force de ressemblance des valeurs dans un même groupe. Variant entre 0 et 1, l’indice de corrélation intraclasse est approprié pour évaluer la concordance (ou la fidélité) entre des juges, tant pour des variables ordinales que pour des variables continues (33) (34), contrairement au Kappa, qui est utilisé pour calculer l’accord seulement lorsque les variables sont ordinales.
Nous avons donc opté pour l’ICC car les résultats obtenus par les deux premières méthodes étaient ordinaux alors que ceux obtenus par la troisième méthode de classification étaient continus. Ainsi, nous pouvions comparer les trois méthodes de classification utilisées dans notre étude.
L’intervalle de confiance des ICC à 95% a été obtenu par la méthode “bootstrap-t”, ou “studentized bootstrap interval”. Mille échantillons de 50 patients ont été tirés aléatoirement à partir de notre échantillon de départ, sur lesquels on calcule pour chacun un ICC. Puis on détermine l’intervalle de confiance en calculant les 2.5e et 97.5e percentiles de la distribution des ICC (35).
23
Un survol de références dans la littérature indique qu’une ICC entre 0.41 – 0.60 représente un accord considéré modéré; entre 0.61 et 0.80, un accord fort et supérieur ou égal à 0.81, presque parfait (33) (36).
7 Taille d’échantillon
Le calcul de la taille d’échantillon est basé sur la détection d’une différence d’au moins 0.2 entre les mesures d’accord pour les trois méthodes de classification. Avec huit médecins, une estimation très conservatrice de la proportion des patients avec un hémothorax “sévère” (10%) et un alpha de 5%, nous estimons qu’avec 50 sujets, nous atteindrons une puissance de 80% (37).
24
CHAPITRE 3
RÉSULTATS
Le tableau 1 démontre les caractéristiques démographiques des patients, dont les radiographies font partie de notre échantillon.
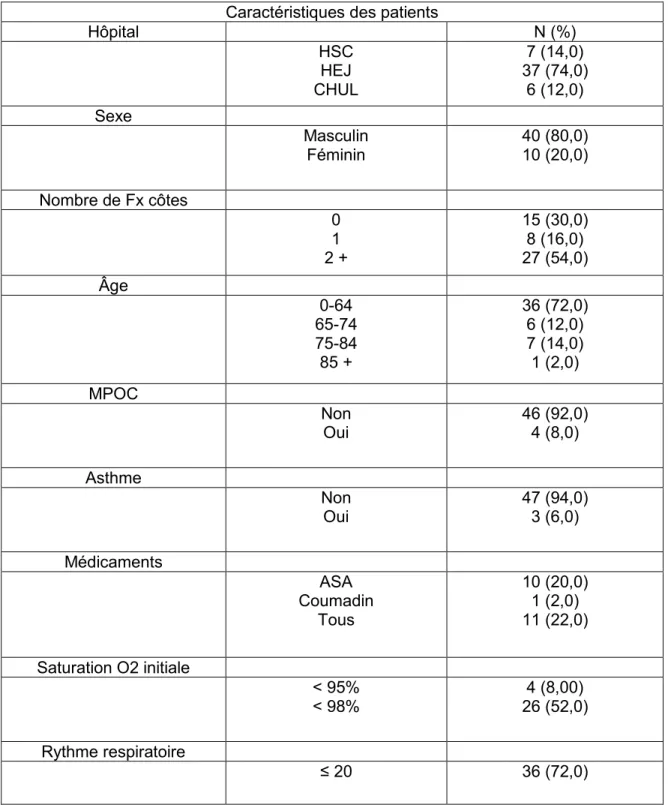
Sur 50 dossiers choisis aléatoirement, 37 (74%) proviennent du site de l’Enfant-Jésus; il n’y a eu aucun dossier, dans notre échantillon, en provenance du site de Charles-Lemoyne. Quarante patients (80%) étaient des hommes, et quasiment le trois quarts de l’échantillon (72%) était des patients âgés de moins de 65 ans. Une faible proportion des patients de notre échantillon souffrait d’une maladie pulmonaire chronique (6% - asthme et 8% - maladie pulmonaire obstructive chronique). Dix patients (20%) prenaient de l’aspirine (un antiplaquettaire) et seul 1 patient prenait du Coumadin (un anticoagulant). Trente-six patients (72%) avaient une fréquence respiratoire inférieure ou égale à 20 respirations par minute. Quarante-six patients (92%), avaient une saturation en oxygène supérieure ou égale à 95%. Plus de la moitié des patients (54%) avaient subi deux fractures de côtes ou plus.
Accords inter-observateurs
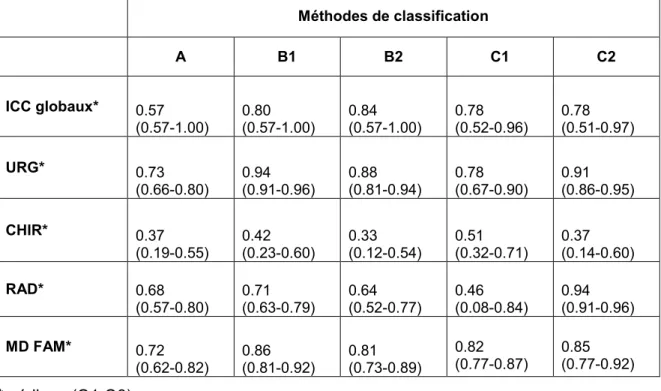
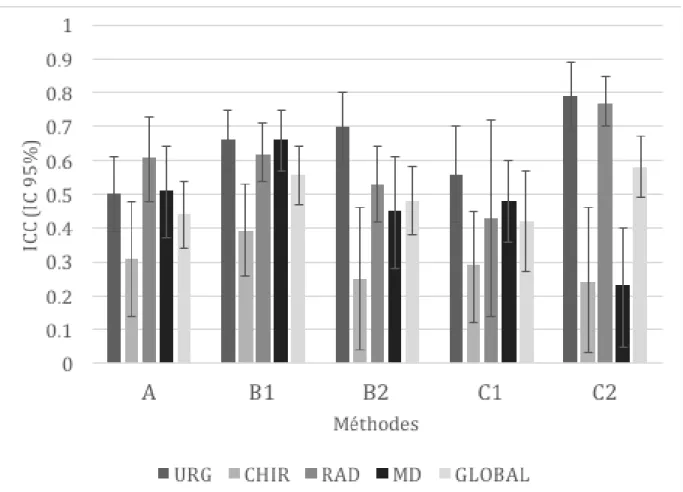
Pour chacune des 4 spécialités, le tableau 2 démontre les indices de corrélation intra-classe (ICC) pour les trois méthodes de catégorisation étudiées (accord inter-observateur). Celles-ci sont aussi représentées graphiquement dans la figure 1.
On remarque d’abord que deux des trois méthodes de catégorisation évaluées, soit celle basée sur l’étude de Misthos et al. (1) (annexe 2) et celle basée sur le calcul de ratios (annexe 3), réussissent à avoir une valeur d’accord inter-observateur globale s’approchant de 0.6.
Méthode basée sur l’étude de Misthos et al. (1) (annexe 2)
On constate, pour cette méthode, un ICC global de 0.56 (0.47-0.64) pour les films évalués en PA (B1). En regardant les résultats pour chaque spécialité de façon individuelle, on observe que l’analyse des radiographies pulmonaires en vue PA (B1) selon la méthode de Misthos et al. (1) démontre une performance plus homogène au travers les différentes spécialités ICCURG 0.66 (0.57-0.75); ICCRAD 0.62 (0.54-0.71); ICCMD 0.66 (0.57-0.75); seuls
les chirurgiens démontrent une ICC plus faible (ICC 0.39; 0.26-0.53). Cependant, l’analyse des films en latéral pour cette méthode (B2), ne démontre pas cette même performance,
25
avec un ICC global 0.48 (0.38-0.58); seuls les urgentologues (et de façon moindre, les radiologistes) démontrent un accord fort, avec une ICCURG de 0.70 (0.59-0.80).
On se rappellera que pour cette méthode, une cote de “0” indique que l’évaluateur détermine qu’il y a absence d’épanchement. Une cote de “1” représente la présence d’un épanchement de < 500 ml (l’épanchement ne déborde pas de l’angle costo-diaphragmatique) et une cote de “2” indique que l’épanchement est 500 ml, débordant ainsi cet angle. Pour les vues en PA, on remarque une discordance globale de 17%, dont 9% entre les cotes “0” et “1 ou 2” et 8% entre les cotes “1” et “2”. Pour les vues en latérale, on remarque une discordance de 18%, dont 11% entre les cotes “0” et “1 ou 2” et 7% entre les cotes “1” et “2”.
Méthode basée sur le calcul de ratios (annexe 3)
La méthode basée sur le calcul de ratios démontre, pour les vues radiographiques latérales (C2), de meilleures valeurs d’ICC; soit des accords forts, 0.79 (0.69-0.89) chez le groupe des urgentologues et 0.77 (0.70-0.85) chez les radiologistes. Les accords sont cependant faibles chez le groupe des chirurgiens 0.24 (0.03-0.46) et chez les médecins de famille 0.23 (0.05-0.40). Globalement, donc, cette méthode s’avère moins homogène au travers les spécialités, quoique, se rapprochant d’un accord considéré comme étant modéré à fort ICC Global 0.58 (0.49-0.67). De plus, on remarque lors de l’évaluation des radiographies PA (C1), des ICC modérées pour les groupes des urgentologues 0.56 (0.42-0.70), des radiologistes 0.43 (0.14-0.72) et des médecins de famille 0.48 (0.36-0.60) mais encore une fois, le groupe des chirurgiens démontre un accord faible 0.29 (0.12-0.45).
Méthode basée sur l’impression du clinicien (annexe 1)
On constate, enfin, un accord modéré pour la première méthode, basée sur l’impression du clinicien, pour l’ensemble des spécialités ICC Global 0.44 (0.34-0.53). Par contre, le groupe des radiologistes fait exception, démontrant un accord fort ICC 0.61 (0.48-0.73). On se rappellera que pour cette méthode, une cote de “0” indique que l’évaluateur détermine qu’il y a absence d’épanchement. Une cote de “1” représente la présence d’un épanchement jugé “petit” et une cote de “2” indique la présence d’un épanchement jugé “gros”. On remarque une discordance globale de 23% pour cette méthode, dont 10% entre les cotes “0” et “1 ou 2” et 13% entre les cotes “1” et “2”.