Comparaison de la structure moléculaire de la soie
d’araignée native et supercontractée : une étude
quantitative
Mémoire
Justine Dionne
Maîtrise en chimie
Maître ès sciences (M.Sc.)
Québec, Canada
© Justine Dionne, 2017Comparaison de la structure moléculaire de la soie
d’araignée native et supercontractée : une étude
quantitative
Mémoire
JUSTINE DIONNE
Sous la direction de :
iii
Résumé
En raison de ses performances mécaniques exceptionnelles, la soie d’araignée constitue un biomatériau qu’il serait intéressant de reproduire industriellement. Il est cependant impératif de mieux connaître les relations existant entre sa structure et ses propriétés. D’ailleurs, en présence d’eau, cette fibre subit une contraction qui altère ses propriétés mécaniques de même que sa structure moléculaire. Comme cette contraction est intimement liée au processus de filage, une meilleure compréhension de la supercontraction mènerait à une meilleure connaissance de la soie elle-même. Toutefois, la quantité d’informations structurales quantitatives sur la soie dans la littérature est insuffisante. Plus précisément, les structures de la soie en solution et des fibres de soie n’ont jamais été comparées et peu d’études comparent la soie de plusieurs espèces d’araignées, autant à l’état natif que supercontracté. Les contributions des différents facteurs dictant la structure finale de la soie et l’amplitude de la supercontraction restent également mal définies, tout comme les impacts de ce phénomène sur la conformation et l’orientation des protéines.
Les objectifs du projet visaient donc à combler ces lacunes en quantifiant la structure moléculaire de la soie dans ses différents états (en solution et fibres natives et supercontractées). Les travaux ont été réalisés à l’aide de la spectromicroscopie Raman sur la soie des araignées Nephila clavipes (NC) et Araneus diadematus (AD).
Les résultats ont montré que la conformation des protéines en solution n’est pas déterminante pour la structure finale des fibres. Une proportion de feuillets β et une orientation plus élevées pour la soie de NC,comparativement à celle d’AD, ont aussi été trouvées, expliquant partiellement les différentes propriétés mécaniques et amplitudes de supercontraction observées pour ces fibres. Nos données suggèrent également que la supercontraction induit une légère augmentation de feuillets β, de même qu’une perte d’orientation significative, principalement au sein de la phase amorphe.
Abstract
Due to its exceptional mechanical performance, spider silk is a biomaterial that would be interesting to reproduce industrially. To this end, the relationships between its structure and its properties have to be known accurately. Moreover, in the presence of water, this fiber undergoes a contraction which alters its mechanical properties as well as its molecular structure. As this contraction is intimately related to the spinning process, a better understanding of supercontraction would lead to a better knowledge of silk itself.
However, several quantitative structural information regarding silk is lacking in the literature. More precisely, the structures of silk in solution and silk fiber have never been compared and only few studies compare the silk of several spider species, whether in its native or supercontracted state. The contributions of the different factors determining the final structure of silk and the amplitude of supercontraction also remain undefined, as are the impacts of this phenomenon on the conformation and orientation of silk proteins.
The aims of this project were thus to overcome these shortcomings by quantifying the molecular structure of silk in its different states (in solution and native/supercontracted fibers). This work was carried out using Raman spectromicroscopy in order to analyze the silk of the spiders Nephila clavipes (NC) and Araneus diadematus (AD).
The results showed that the conformation of the proteins in the dope is not critical for the final structure of the fiber. A higher proportion of β-sheets and orientation level for NC silk compared to that of AD were also found, partially explaining the different mechanical properties and amplitude of supercontraction observed for these fibers. Our data also suggest that supercontraction induces a slight increase in β-sheets, as well as a significant disorientation, mainly within the amorphous phase.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations ... xi
Liste des symboles ... xii
Remerciements ... xiv
Avant-‐propos ... xvi
Chapitre 1 : Introduction ... 1
1.1 Araignées orbitèles et types de soie ... 1
1.2 Propriétés de la soie ... 2
1.2.1 Propriétés mécaniques ... 2
1.2.2 Autres propriétés ... 4
1.3 Structure de la soie d’araignée ... 5
1.3.1 Fibre ... 5
1.3.2 Soie en solution et processus de filage ... 7
1.4 Supercontraction ... 8
1.5 Objectifs ... 9
Chapitre 2 : Spectromicroscopie Raman ... 12
2.1 Effet Raman ... 12
2.2 Spectromicroscopie Raman ... 14
2.3 Déterminant moléculaire ... 16
2.4 Détermination de l’orientation moléculaire ... 17
2.4.1 Fonction de distribution d’orientation ... 18
2.4.2 Détermination des paramètres d’ordre ... 20
2.5 Détermination de la conformation ... 24
2.5.1 Obtention d’un « spectre isotrope » ... 24
Chapitre 3 : Major Ampullate Spider Silk with Indistinguishable Spidroin Dope
Conformations Leads to Different Fiber Molecular Structures ... 28
3.1 Résumé ... 28
3.2 Abstract ... 28
3.3 Introduction ... 29
3.4 Results ... 32
3.4.1 Spidroins conformation in the MA dope ... 32
3.4.2 Molecular structure of the MA fibers ... 34
3.4.3 Sequences analysis ... 40
3.5 Discussion ... 41
3.5.1 The conformation of the spidroins in the dope is not critical for the fiber structure ... 41
3.5.2 Molecular orientation and β-‐sheet content influence silk mechanical properties ... 42
3.6 Materials and Methods ... 44
3.7 Conclusions ... 47
3.8 Supplementary Materials ... 48
3.9 Acknowledgments ... 49
Chapitre 4 : A quantitative analysis of the supercontraction-‐induced molecular disorientation of major ampullate spider silk ... 50
4.1 Résumé ... 50
4.2 Abstract ... 50
4.3 Introduction ... 51
4.4 Materials and methods ... 54
4.5 Results and discussion ... 58
4.5.1 Qualitative analysis of the Raman spectra ... 58
4.5.2 Quantitative analysis of the global amide I band ... 59
4.5.3 Quantitative analysis of the individual components of the amide I band ... 61
4.5.4 Level of orientational order compared to XRD studies ... 65
4.5.5 Molecular characteristics of supercontraction ... 66
4.5.6 Estimation of the shrinking amplitude from molecular disorientation ... 67
4.6 Conclusions ... 71
4.7 Electronic Supplementary Information ... 72
Determination of the Hermans function 𝑓 from 𝑃#$ ... 73
4.8 Acknowledgments ... 76
Chapitre 5 : Conclusions et perspectives ... 77
5.1 Conclusions ... 77
5.2 Perspectives ... 78
vii
Liste des tableaux
Tableau 2.1 Position et attributions des différentes bandes vibrationnelles des protéines de soie (tableau adapté de Lefèvre et coll.1) ... 17
Table 3.1 Qualitative parameter R' = 1 − (Ixx/Izz) and order parameters 𝑃#$ and 𝑃%$ of Nephila
clavipes and Araneus diadematus major ampullate (MA) silk fibers as estimated from the polarized amide I bands and evaluated according to the depolarization constant (DC) and most probable distribution (MPD) methods. ... 38 Table 4.1 Semi-quantitative parameter R' = 1 - (Ixx/Izz), global order parameters 𝑃#$ and 𝑃%$ and
FWHM of the most probable orientation distribution functions 𝑁'( 𝛾 of native and supercontracted (SC) Nephila clavipes (Nc) and Araneus diadematus (Ad) MA silk fibers as determined from the amide I band intensity. ... 60 Table 4.2 Order parameters 𝑃#$ and 𝑃%$ and FWHM of the most probable orientation distribution functions 𝑁'( 𝛾 of the crystalline and amorphous phases of native and supercontracted (SC)
Nephila clavipes (Nc) and Araneus diadematus (Ad) MA silk fibers as determined from the spectral decomposition of the amide I band. ... 64 Table 4.3 Hermans functions in the native 𝑓*+, and supercontracted states 𝑓-. of the global, crystalline and amorphous phases of Nephila clavipes and Araneus diadematus MA silk fibers as determined from XRD and Raman spectromicroscopy. ... 66 Table 4.4 Order parameters 𝑃#$ and 𝑃%$ and FWHM of the most probable orientation distribution functions 𝑁'( 𝛾 of the different secondary structures of Nephila clavipes (Nc) and Araneus diadematus (Ad) MA silk fibers as determined from the spectral decomposition of the amide I band. ... 73 Table 4.5 Order parameters 𝑃/0 of the polypeptide chains calculated from 𝑃
/1 ones for various
values of 𝛼3 proposed by Tsuboi.171 ... 75
Table 4.6 Lagrange multipliers of the orientation distribution function 𝑁'( 𝜃 corresponding to the order parameters 𝑃#0 (Table 4.3) and 𝑃
Liste des figures
Figure 1.1 Fillières de l'araignée, types de soie et leurs applications (figure adaptée de Rising et coll.2). ... 1
Figure 1.2 Courbe de contrainte-déformation de la soie de l’araignée Argiope keyserlingi (figure modifiée à partir de Harmer et coll.7). ... 2
Figure 1.3 Comparaison des courbes de contrainte-déformation de plusieurs matériaux (figure modifiée à partir de Gosline et coll.8). ... 4
Figure 1.4 Modèle structural de la soie Ma composée de feuillets β cristallins (rouge) et de structures amorphes (vert). ... 5 Figure 1.5 Schéma d'une spidroïne typique (figure adaptée de Rising et coll.2). ... 6
Figure 1.6 Structure primaire des spidroïnes de la soie Ma de l’araignée Nephila clavipes (figure modifiée à partir de Gatesy et coll.28). ... 6
Figure 1.7 Structure primaire des spidroïnes de la soie Ma de l’araignée Araneus diadematus (figure modifiée à partir de Gatesy et coll.28). ... 6
Figure 1.8 Glande ampullacée majeure de l'araignée Nephila clavipes (figure adaptée de Lefèvre et coll.42). ... 7
Figure 1.9 Courbes de contrainte-déformation de la soie Ma native (bleue) et supercontractée (rouge) de l’araignée Argiope trifasciata (figure modifiée à partir de Elices et coll.63). ... 9
Figure 1.10 Araignées orbitèles à l’étude : A) Nephila clavipes et B) Araneus diadematus. ... 10 Figure 2.1 Diagramme d’énergie des transitions impliquées durant la diffusion Rayleigh et Raman Stokes et anti-Stokes, où hn0 est l’énergie incidente, hnvib l’énergie vibrationnelle et Dn le
déplacement Raman (figure modifiée à partir de Baker et coll.74). ... 12
Figure 2.2 Configuration du spectromètre Raman. ... 15 Figure 2.3 Systèmes de coordonnées xyz (référentiel de l’unité structurale) et XYZ (référentiel du laboratoire) et les angles d'Euler (figure adaptée de Lefèvre et coll.77). ... 18
Figure 2.4 Orientation de la fibre, d’un feuillet β, d’un groupement carbonyle et du tenseur Raman dans le système d’axes du laboratoire. ... 19 Figure 2.5 Valeurs limites de 𝑃%$ selon 𝑃#$ (figure modifiée à partir de Lefèvre et coll.77). ... 24
Figure 2.6 Décomposition spectrale de la bande amide I d’un spectre typique de soie Ma. ... 27 Figure 3.1 Schematics showing the relationships between the structure of major ampullate (MA) spidroins in the silk dope, the fiber structure, the spinning process and the primary structure. Silk formation corresponds to the transformation converting the spidroins in the dope (initial conformational state) into the silk fiber (final structural state). The spinning process (mechanical constraints applied, physicochemical environment) and primary structure (chemical composition) are the two factors that govern structural changes. On one hand, the spinning process triggers and induces conformational and orientational changes to the polypeptide chains. On the other hand, the response of spidroins and the final secondary structure they adopt are dictated by the sequence. ... 31 Figure 3.2 Raman spectra of the spinning dope contained in the sac of the Nephila clavipes (NC) and Araneus diadematus (AD) MA glands. ... 33 Figure 3.3 Polarized Ixx and Izz Raman spectra of Nephila clavipes and Araneus diadematus MA silk
fibers. Spectra are normalized so that the Ixx peak maximum is equal in the amide I region. They
ix
Figure 3.4 Orientation-insensitive spectra in the amide I region calculated from the average polarized Raman spectra of Nephila clavipes and Araneus diadematus fibers shown in Figure 3.3 and Figure 3.8. The spectra are normalized with respect to the total area of the amide I band. ... 36 Figure 3.5 Relative band areas of the different amide I components of Nephila clavipes and Araneus diadematus fibers. The approximate error on the secondary structure content due to curve-fitting is ± 3 % and is represented by the error bars on the figure. ... 37 Figure 3.6 Most probable orientation distribution (MPD) functions, 𝑁'( 𝛾 of the carbonyl groups as determined from the order parameter values (Table 3.1) of Nephila clavipes and Araneus diadematus MA silk fibers according to the MPD and depolarization constant (DC) methods. ... 39 Figure 3.7 Amino acid sequences for the spidroins composing the MA gland silk of Araneus diadematus (ADF3 and ADF4)27 and Nephila clavipes (MaSp1 and MaSp2).101,102 Single letter
code for amino acids is used to simplify the analysis. The An, GA, GGX, and GPGXX motifs are
inspired from those of Gatesy et al.28 and are indicated in red, orange, blue, and green
respectively, where X represents a small subset of amino acids (X = L, Q, T, S, etc.). Amino acids that have undergone substitution in the motifs are colored in black and those that do not contribute to any motifs are colored in grey. ... 41 Figure 3.8 Polarized Raman spectra of (A) Nephila clavipes and (B) Araneus diadematus MA silk thread. ... 48 Figure 3.9 Representation of the coordinate system used, the alignment of the fiber for the Raman experiments (down) and the corresponding orientation of the β-sheets and carbonyl groups (top). Grey, blue, red and white spheres represent carbon, nitrogen, oxygen and hydrogen atoms of the polypeptide chains, respectively. Red structures in the fiber represent β-sheets while white lines symbolize the amorphous matrix of the silk fiber. ... 49 Figure 4.1 Polarized XX and ZZ spectra of native and supercontracted (SC) (A) Araneus diadematus and (B) Nephila clavipes MA silk fibers. The insets show the amide I region in detail. Spectra in (A) are the average of 13 series (native) and 10 series (SC) while spectra in (B) are the average of 10 series (native) and 10 series (SC). They are all normalized with respect to the XX peak maximum in the amide I region. ... 58 Figure 4.2 Orientation-insensitive spectra of the native and supercontracted (SC) (A) Araneus diadematus and (B) Nephila clavipes MA silk fibers in the amide I region calculated from the average polarized Raman spectra. Spectra in (A) are the average of 13 series (native) and 10 series (SC) while spectra in (B) are the average of 10 series (native) and 10 series (SC). They are all normalized with respect to the total area of the amide I band. ... 61 Figure 4.3 Relative band areas of the different amide I components of Nephila clavipes (Nc) and Araneus diadematus (Ad) MA silk fibers in the native and supercontracted (SC) states. The approximate uncertainty on the secondary structure content is ± 1 %. ... 62 Figure 4.4 Most probable orientation distribution functions 𝑁'( 𝛾 of the Raman amide I tensor of
the crystalline and amorphous phases of native and supercontracted (SC) Araneus diadematus and Nephila clavipes MA silk fibers. ... 63 Figure 4.5 (A) Representation of a typical chain configuration; (B) simplified model considering 𝑛 rigid segments 𝑟7 of length 𝑙 and (C) detail of a peptide bond (number 𝑖) and its modelling by a rigid segment 𝑟7. ... 69
Figure 4.6 Raman polarized spectra of supercontracted (SC) (A) Araneus diadematus and (B) Nephila clavipes MA silk fibers. The spectra presented are the average of 10 experimental spectra. Peaks marked with dotted and full lines refer to amino acid side-chain and backbone vibrations, respectively. ... 72
Figure 4.7 Schematic representation of a semicrystalline MA fiber, a β-sheet and the Raman amide I tensor direction. The angles 𝛼, 𝛽 (𝛽 = 𝛼 + 𝜋/2), 𝛾 and 𝜃 are defined. ... 74
xi
Liste des abréviations
Ad ou AD Araneus diadematus
ADF-3 Spidroïne I de la glande ampullacée majeure d’Araneus diadematus ADF-4 Spidroïne II de la glande ampullacée majeure d’Araneus diadematus
Ala Alanine
C-term C-terminal
DC Depol Constant
DRX Diffraction des rayons X
Gln Glutamine
Leu Leucine
Ma ou MA Soie de la glande ampullacée majeure
MPD Most Probable Distribution
Nc ou NC Nephila clavipes
NCF-1 Spidroïne I de la glande ampullacée majeure de Nephila clavipes NCF-2 Spidroïne II de la glande ampullacée majeure de Nephila clavipes
N-term N-terminal
Phe Phénylalanine
Poly-Ala Polyalanine
Pro Proline
RMN Résonance magnétique nucléaire
Ser Sérine
Liste des symboles
𝑎 Rapport des principaux éléments du tenseur Raman de la bande amide I
𝛼 Tenseur de polarisabilité
𝛼3 Tenseur de polarisabilité à l’état d’équilibre
𝛼′ Tenseur Raman
𝛼′' Tenseur Raman spécifique au mode amide I
𝐸 Module de Young
𝐸 Champ électrique incident du laser
𝐸3 Champ électrique incident à l’état d’équilibre
𝜀 Déformation mécanique
ℎ Constante de Planck
Iij ou 𝐼7FGH Intensité en spectromicroscopie Raman (i, j = x ou z)
𝐼7F Intensité en spectroscopie Raman conventionnelle (i, j =x, y ou z)
𝐼7IJ Intensité isotrope
𝑙3 Longueur initiale d’une fibre
𝑙 Longueur finale d’une fibre
𝜆 Longueur d’onde
𝜆# et 𝜆% Multiplicateurs de Lagrange
NA Ouverture numérique (numerical aperture)
N-H Liaison simple entre un atome d’hydrogène et un atome d’azote dans un lien amide 𝑁 𝛾 Fonction de distribution d’orientation
𝑁'( 𝛾 Fonction de distribution d’orientation la plus probable
𝑁 𝛾, 𝜙, 𝛹 Fonction de distribution d’orientation dépendant des trois angles d’Euler
𝑃 Dipôle induit
𝜌 Rapport de dépolarisation
𝑃ℓ𝓁$ Paramètre d’ordre de degré 𝑛 𝑃ℓ𝓁 cos 𝛾 Polynôme de Legendre
𝑄 Coordonnées du mode normal de vibration
𝑄3 Coordonnées maximales du mode normal de vibration
R1 Rapport d’intensité Izx/Izz
R2 Rapport d’intensité Ixz/Ixx
R’ Paramètre d’ordre semi-quantitatif 1-(Ixx/Izz)
𝜃 Angle entre la chaîne polypeptidique et l’axe Z
𝜎 Contrainte mécanique
Δn Déplacement du nombre d’onde (déplacement Raman)
n3 Fréquence incidente
nW7X Fréquence vibrationnelle
xyz Référentiel de l’unité structurale
xiii
Remerciements
Avant toute chose, j’aimerais remercier Michèle Auger, ma directrice de recherche, de m’avoir accueillie au sein de son laboratoire de recherche pour effectuer mes travaux de maîtrise sur ce super projet. Je te suis très reconnaissante de la confiance et de la liberté que tu m’as accordée pendant mes études graduées. Tu as su m’encadrer tout au long du processus en plus de me permettre de rayonner dans une multitude de congrès. La Nouvelle-Orléans fut une expérience particulièrement mémorable, tant au niveau de la qualité du congrès que des innombrables divertissements de la ville. Je tiens donc à te remercier encore une fois pour tout et j’ajouterais que je suis fière d’avoir fait partie de la team Auger!
Ce projet n’aurait pas été le même sans l’aide précieuse et soutenue du professionnel de recherche Thierry Lefèvre, grand « maistre » des araignées. Blague à part, il m’a assistée à toutes les étapes de ma maîtrise, que ce soit au labo, pour l’analyse de spectres ou encore pour la rédaction d’articles. J’ai été choyée de travailler avec un chercheur aussi passionné et rigoureux. Je me souviendrai longtemps de nos discussions animées sur le projet! Tu m’as réellement transmis un intérêt pour nos amies à huit pattes en plus de faire de moi une scientifique beaucoup plus accomplie. Merci beaucoup M. Thier d’avoir contribué à faire de cette maîtrise une expérience incroyable.
Je voudrais également remercier François-Paquet Mercier pour m’avoir aidé avec le spectromètre Raman et tous ses caprices. Merci aussi à mes stagiaires, Philippe et Mathieu de m’avoir donné un coup de main avec le projet. Ce fut un réel plaisir de travailler avec vous! Merci également aux organismes subventionnaires (FRQNT, CRSNG, PROTEO, CERMA et CQMF) sans qui rien n’aurait été possible. Je souhaiterais également souligner le travail des professeurs évaluant ce mémoire, soit Michèle Auger, Anna Ritcey et Denis Boudreau.
Je tiens aussi à remercier tous mes collègues du groupe Auger d’avoir contribué de près ou de loin à l’ambiance agréable du bureau ces dernières années. En particulier, merci à Matthieu, mon superviseur de stage de 1er cycle, qui est devenu très rapidement mon partner in crime. J’ai appris du
meilleur et on va se le dire, on a eu du fun pas à peu près ensemble! J’espère que ça va continuer comme ça. Merci aussi aux Français, Ben et Maud pour votre amitié et pour avoir partagé avec moi beaucoup de bons moments et de niaiseries autant au bureau, qu’à l’extérieur. J’ai également eu
xv
bien du plaisir avec vous en congrès (surtout avec toi Ben!). Même si je me suis amusée de votre accent français à temps plein, je vous apprécie énormément et j’espère que les soirées sur votre balcon se poursuivront dans le futur! Merci également à MC de partager avec moi une passion commune pour les chiens saucisses et d’avoir fait de moi, conjointement avec Thierry, une personne plus écolo!
Je tiens aussi à remercier mes amis du bac de chimie, Gab, Steve et Joël sans qui ces années n’auraient pas été pareilles. J’en garde des souvenirs mémorables et j’espère que l’on continuera d’en créer ensemble! Merci particulièrement à Joël d’avoir rendu toutes ces longues soirées d’étude et de rédaction moins pénibles. Tu es un ami incroyable sur qui je peux toujours compter. Longue vie à notre friendship!
Les prochains remerciements sont adressés à Pascale, mon amie depuis toujours avec qui je partage tant de choses (voyages, insides, fous rires…). Ton écoute et ta complicité me sont très précieuses. Merci de toujours m’encourager à me dépasser et à me supporter dans mes projets de vie. Ta vocation envers ton travail est d’ailleurs une source d’inspiration!
Un merci spécial à mon joli blond, Sacha, qui m’a épaulé ces deux dernières années. Ton caractère apaisant a su me déstresser plus d’une fois. Merci de partager mon quotidien et de remplir ma vie d’aventures! Je te remercie d’avoir été patient avec moi pendant ma rédaction, et surtout, de croire en moi.
Mes derniers remerciements vont à mes parents et mes bros, pour leur soutien continu pendant tout mon cheminement universitaire et bien avant, tant sur le plan personnel qu’académique. Merci de vous intéresser à mes « affaires » de science même si vous ne comprenez pas tout et de m’encourager à poursuivre mes ambitions, quelles qu’elles soient. Je suis contente de faire partie de cette famille colorée.
Avant-propos
Ce manuscrit est essentiellement basé sur les résultats des travaux de recherche faisant l’objet de deux articles scientifiques. Il est à noter qu’afin d’être homogène dans l’ensemble du mémoire, l’angle 𝜃 initialement utilisé dans l’article présenté au chapitre 3 pour caractériser l’orientation moléculaire a été remplacé par 𝛾. La numérotation des figures et tableaux des deux articles a également été ajustée dans le mémoire. Autrement, le texte et les figures ont été recopiés sans modification.
Le chapitre 3 est consacré à l’article publié dans la revue International Journal of Molecular Sciences en 2016. L’article s’intitule « Major Ampullate Spider Silk with Indistinguishable Spidroin Dope Conformations Leads to Different Fiber Molecular Structures ». Il porte sur la comparaison de la structure moléculaire entre la soie en solution et les fibres de soie, et ce, pour deux espèces d’araignées (Nephila clavipes et Araneus diadematus). Les expériences Raman en lumière polarisée que j’ai réalisées ont été initialement conçues au laboratoire du professeur Michel Pézolet. La professeure Michèle Auger est désormais l’investigatrice du projet. Au cours de ma maîtrise, j’ai effectué les expériences, l’analyse de données et l’écriture du présent article dont je suis d’ailleurs l’auteure principale. Thierry Lefèvre, second auteur, m'a aidée pour l'interprétation des données de même que pour la rédaction.
Le chapitre 4, nommé « A quantitative analysis of the supercontraction-induced molecular disorientation of major ampullate spider silk », a été publié dans le journal Physical Chemistry Chemical Physics en 2017. Il présente les résultats structuraux obtenus pour les fibres de soie d’araignée supercontractées des araignées Nephila clavipes et Araneus diadematus par spectromicroscopie Raman. Ma contribution à cet article a consisté à la prise de mesure en spectromicroscopie Raman, à l’analyse des données et à la rédaction. Mes stagiaires Philippe Bilodeau et Mathieu Lamarre, à l’été 2016 et pendant l’hiver et l’été 2017 respectivement, m’ont aussi aidé au courant de ce travail. J’ai également été épaulé pour l'interprétation des données de même que pour la rédaction par Thierry Lefèvre. Je suis de plus l’auteure principale de l’article en collaboration avec le professionnel de recherche Thierry Lefèvre et la professeure Michèle Auger.
1
Chapitre 1 : Introduction
1.1 Araignées orbitèles et types de soie
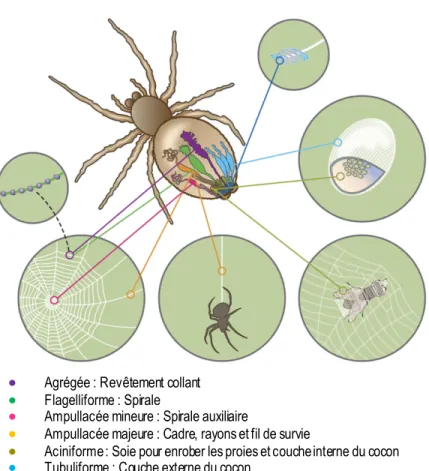
Figure 1.1 Fillières de l'araignée, types de soie et leurs applications (figure adaptée de Rising et coll.2).
La toile en spirale (orbiculaire) des araignées de jardin est sans nul doute le type de toile le plus fascinant et le plus connu. De fait, cette toile d’une géométrie étonnante est renouvelée tous les jours et permet d’absorber une grande partie de l’énergie cinétique d’une proie et de l’immobiliser afin que l’araignée puisse la capturer.3 Ces araignées, dites orbitèles, font partie de la famille des Araneidae
et compte plus de 2 600 espèces.4 Ces araignées peuvent produire jusqu’à sept types de soie
différentes, chacune provenant d’une glande spécialisée, aussi nomée fillière, située dans l’abdomen de l’araignée (Figure 1.1). Chaque soie est dotée de propriétés mécaniques distinctes conçues pour remplir une fonction biologique précise.5 Le rôle de chacune des soies est résumé à la Figure 1.1.
● Agrégée : Revêtement collant
● Flagelliforme : Spirale
● Ampullacée mineure : Spirale auxiliaire
● Ampullacée majeure : Cadre, rayons et fil de survie
● Aciniforme : Soie pour enrober les proies et couche interne du cocon
● Tubuliforme : Couche externe du cocon
1.2 Propriétés de la soie
1.2.1 Propriétés mécaniques
Le comportement mécanique d'un matériau est généralement évalué à l’aide d’un essai de traction. Cette expérience physique consiste à exercer une force de traction longitudinale sur le matériau jusqu’à sa rupture et à porter en graphique la contrainte appliquée en fonction de la déformation engendrée.6 Le diagramme de contrainte-déformation résultant fourni plusieurs valeurs importantes
comme la résistance, l’endurance et l’extensibilité du matériau. Les différentes caractéristiques d’un matériau sont illustrées à la Figure 1.2 pour un exemple typique de soie d’araignée.
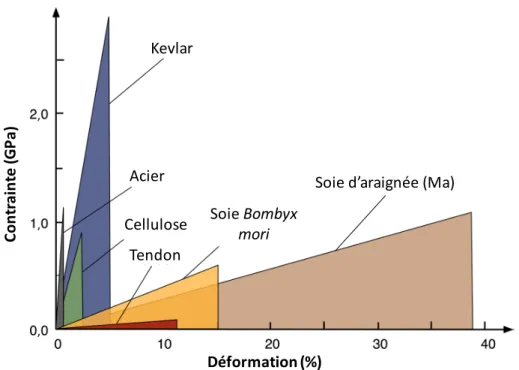
Figure 1.2 Courbe de contrainte-déformation de la soie de l’araignée Argiope keyserlingi (figure modifiée à partir de Harmer et coll.7).
La limite d’élasticité définit le domaine élastique, soit celui pour lequel une déformation est réversible. Le module d’élasticité, aussi nommé module de Young (𝐸), détermine la rigidité d’un matériau. Il consiste en la pente de la zone élastique de la courbe et peut être calculé comme suit :
𝐸 =𝜎 𝜀
1,8
1,5
1,2
0,9
0,6
0,3
Co
nt
ra
in
te
)(Gpa
)
Déformation
0,1
0,2
0,3
0,4
0,5
0
Contrainte3maximale3 (Résistance) Point3de3rupture Déformation3maximale (Extensibilité) Énergie3à3la3 rupture3 (Endurance) Limite3d’élasticité Module3de3Young3 (Rigidité)3
où 𝜎 représente la contrainte et 𝜀 la déformation. La contrainte représente la force appliquée par unité de surface et est souvent donnée en GPa. La déformation s’exprime en pourcentage et est définie selon :
𝜀 =𝑙 − 𝑙3 𝑙3 où 𝑙 et 𝑙3 sont la longueur finale et initiale de l’échantillon.
L’endurance d’un matériau est donnée par l’aire sous la courbe contrainte-déformation et correspond à l’énergie nécessaire à la rupture du matériau.6 À ce point, sont aussi données la contrainte et la
déformation maximales, qui indiquent la résistance et l’extensibilité du matériau respectivement.6
La soie des glandes ampullacées majeures (Ma) est utilisée par l’araignée pour former le cadre et les rayons de sa toile, mais aussi comme fil de survie.8 Les fibres Ma sont les mieux caractérisées dans
la littérature, notamment parce qu’elles présentent des propriétés mécaniques comparables, voire supérieures, à celles des meilleurs matériaux synthétiques présents sur le marché comme le Kevlar.3,9
La courbe schématique de contrainte-déformation de la soie Ma est comparée à celles de plusieurs matériaux à la Figure 1.3. Pour une même densité, la soie d’araignée possède la même force que l’acier et est 8 fois plus extensible et 5 fois plus résistante que le Kevlar.
En raison de ses performances mécaniques et de sa légèreté, la soie d’araignée constitue une fibre très prisée qu’il serait intéressant de reproduire à différentes fins industrielles, notamment comme fibre de technologie avancée (veste pare-balle, cordes de parachute, etc.)10 ou encore comme
Figure 1.3 Comparaison des courbes de contrainte-déformation de plusieurs matériaux (figure modifiée à partir de Gosline et coll.8).
1.2.2 Autres propriétés
Hormis ses incroyables propriétés mécaniques, la soie s’avère également être biocompatible, c’est-à-dire qu’elle n’induit pas de réponse immunitaire et peut supporter la croissance de cellules.12 Les
protéines de soie se dégradent aussi lentement et de manière prévisible.13 En raison de ces
caractéristiques, une utilisation de la soie peut donc être envisagée en biomédecine comme fil de suture,14 comme support pour la régénération de tissus (nerfs,15 ligaments,16 tendons,17 etc.) ou
encore pour le transport de médicaments.18
La production de soie synthétique est également d’un grand intérêt dans le domaine du textile dû à sa grande résistance et au fait qu’elle peut être bio-fonctionnalisée. De fait, des tissus à base de soie d’araignée pourraient entre autres posséder des propriétés autonettoyantes et antibactériennes en plus d’avoir une meilleure protection contre les rayonnements ultra-violets que la soie de vers à soie conventionnelle.19
La soie possède également une morphologie modulable (films, fibres, gels, etc.). Les films de fibroïnes peuvent en plus être transparents dans le domaine du visible, ce qui rend la soie
Soie%d’araignée%(Ma) Kevlar Co nt ra in te )(GP a) Déformation)(%) Acier Cellulose Tendon Soie%Bombyx' mori , , ,
5
intéressante pour des applications en optique, en photonique et en électronique.20 La soie pourrait
par exemple être utilisée dans des dispositifs électroniques bio-intégrés21 (substrat résorbable de
fibroïnes) pour améliorer le contact à l’interface du cerveau et de l’appareil de mesure, pour former des cristaux photoniques organiques ou encore comme réseau de diffraction.20
1.3 Structure de la soie d’araignée
Plusieurs études ont démontré que les propriétés mécaniques de la soie sont fortement reliées à la composition protéique de même qu’au processus de filage.22-24 Ces deux éléments seront donc
approfondis au cours des deux prochaines sections (1.3.1 et 1.3.2).
1.3.1 Fibre
Un premier modèle moléculaire décrivant la soie a été proposé par Termonia.25 La soie Ma y est
représentée par une structure semicristalline formée de courts domaines cristallins très orientés dans l’axe de la fibre et séparés par des régions amorphes (Figure 1.4).
Figure 1.4 Modèle structural de la soie Ma composée de feuillets β cristallins (rouge) et de structures amorphes (vert).
La séquence d’acides aminés variant selon le type de soie et l’espèce d’araignée, la soie Ma de deux araignées orbitèles bien connues, soit Nephila clavipes (NC) et Araneus diadematus (AD), possèdent une structure primaire distincte, mais néanmoins similaire. De fait, la soie Ma est composée de deux protéines fibreuses, communément appelées spidroïnes, de poids moléculaire élevé (250-350 kDa).26 Ces protéines sont nommées respectivement NCF-1/NCF-2 pour NC et ADF-3/ADF-4 pour
AD.27 On retrouve les spidroïnes respectivement en ratio molaire 4:1 pour NC et 3:2 pour AD. Les
spidroïnes comportent un domaine non répétitif N-terminal et C-terminal entre lesquels est comprise une large région répétitive où alternent différents motifs d’acide aminés (Figure 1.5). La section répétitive des spidroïnes pour la soie Ma de NC et AD est détaillée à la Figure 1.6 et Figure 1.7, respectivement.
Figure 1.5 Schéma d'une spidroïne typique (figure adaptée de Rising et coll.2).
Figure 1.6 Structure primaire des spidroïnes de la soie Ma de l’araignée Nephila clavipes (figure modifiée à partir de Gatesy et coll.28).
Figure 1.7 Structure primaire des spidroïnes de la soie Ma de l’araignée Araneus diadematus (figure modifiée à partir de Gatesy et coll.28).
Parmi ces motifs, on retrouve de courtes séquences de polyalanine (Poly-Ala) formant des feuillets β cristallins29,30 qui confèrent un caractère rigide à la soie.22 Des résidus glycine (Gly) peuvent
également s’incorporer à la phase cristalline.31,32 Des études en diffraction des rayons X (DRX) et
résonance magnétique nucléaire (RMN) ont estimé le taux de cristallinité de la soie Ma de NC à 2833
et 34 %34 respectivement. Il a également été démontré que les feuillets β s’alignaient dans l’axe de la
fibre.35,36 D’autres motifs, comme les blocs GlyGlyX ou GlyProGlyXX (où X représente un
sous-Section(répétitive
N.term
C.term
Feuillets( β Structures(amorphes((riche(en(glycine)((
AG(A)
nGGAGQGGYGGLGSQGAGRGGQG
)
xNCF@1
NCF@2
Feuillets( β Structures(amorphes((riche(en(glycine)((
S(A)
nGPGQQGPGGYGPGQQGPGGYGPGQQGPSGPG
)
y Feuillets( β Structures(amorphes((riche(en(glycine)(ADF93
ADF94
Feuillets( β Structures(amorphes((riche(en(glycine)((
SS(A)
nSGPGGYGPGSQGPSGPGGYGPGGPG
)
y(
AS(A)
nGGYGPGSGQQGPGQQGPGQQGPGQQGPYGPG
)
y7
ensemble d’acides aminés (Leu, Gln, Ser, etc.), adoptent plutôt des structures amorphes (hélices 31,
coudes et structures désordonnées) et sont responsables de l’extensibilité du fil Ma.22,37 Il a
également été proposé que la soie comporte une troisième phase située à l’interface des feuillets β et de la zone amorphe.38 Cette interphase est décrite comme une composante amorphe orientée39,40
ou encore comme une phase cristalline faiblement orientée (feuillets β non agrégés).36,41 Elle
contribuerait d’ailleurs aux propriétés mécaniques exceptionnelles de la soie.
1.3.2 Soie en solution et processus de filage
La transformation de la soie en solution en fibre est un processus complexe qui s’effectue dans les filières de l’araignée. La glande Ma est constituée de quatre parties principales, soit la queue, l’ampoule, l’entonnoir et le conduit (Figure 1.8).
Figure 1.8 Glande ampullacée majeure de l'araignée Nephila clavipes (figure adaptée de Lefèvre et coll.42).
Les protéines de soie sont initialement produites dans la queue, puis entreposées dans l’ampoule qui agit à titre de réservoir. La soie en solution, aussi nommée spinning dope, est majoritairement désordonnée43-46 et ne possède pas d’orientation préférentielle.42 Lorsque l’araignée a besoin de
soie, elle exerce une force de traction à l’aide de ses pattes arrières ce qui permet de faire cheminer les spidroïnes le long de la glande. L’entonnoir relie l’ampoule au conduit et permet à la solution concentrée de soie (~50 %)43 de s’écouler dans le conduit. Dans les différents segments du conduit
en S diminuant graduellement en diamètre, les protéines de soie subissent plusieurs modifications chimiques et physiques (diminution du pH, variation de la concentration de certains ions, déshydratation, forces de cisaillement, etc.), ce qui les amène à former des feuillets β et à s’aligner dans la fibre.9,42,47 Le conduit se termine par une valve, qui permet de réguler la quantité de soie
filée.48 Finalement, la fibre quitte la glande via la fusule.
1.4 Supercontraction
Une autre propriété de la soie Ma est qu’en présence d’eau liquide ou d’une humidité relative élevée (> 70 %),49 elle subit une contraction longitudinale spontanée pouvant aller jusqu'à 60 % de sa
longueur initiale de même qu’une augmentation de son diamètre.50 Cette contraction est également
observée avec d’autres matériaux synthétiques, notamment les polymères, mais nécessite la plupart du temps des conditions beaucoup plus extrêmes que pour la soie, soit la présence de solvants forts et/ou d’une température élevée.51 Durant ce phénomène, nommé supercontraction,50 la phase
amorphe est plastifiée par l’eau et son réseau de liaisons hydrogène est rompu.52,53 Il a de fait été
démontré que la région cristalline de la soie n’était pas ou peu affectée par l’eau.36,54 Il en résulte une
augmentation de la mobilité des protéines ce qui déclenche le repliement entropique des chaînes polypeptidiques.55,56 La supercontraction altère directement et radicalement les propriétés
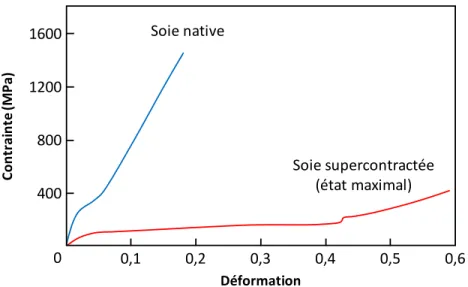
mécaniques de la soie (Figure 1.9), la rendant plus extensible et moins rigide.56,57 Ce phénomène
entraîne également une perte d’orientation au sein de la fibre.35,39,58,59
Une fibre ayant subi une contraction peut toutefois retrouver ses propriétés mécaniques initiales, à condition d’être étirée mécaniquement à sa longeur d’origine.58 Il a d’ailleurs été démontré que l’état
maximal de supercontraction atteint par une fibre était indépendant de l’historique de filage de la fibre.60 Ainsi, cet état peut être considéré comme état de référence à partir duquel il est possible
d’étirer à nouveau le fil à une longueur donnée afin de modeler la soie selon les propriétés désirées.61 La supercontraction ouvre ainsi la voie à de nouvelles applications pour la soie d’araignée
9
Figure 1.9 Courbes de contrainte-déformation de la soie Ma native (bleue) et supercontractée (rouge) de l’araignée Argiope trifasciata (figure modifiée à partir de Elices et coll.63).
1.5 Objectifs
Les propriétés mécaniques uniques de la soie résultent de sa composition en acides aminés et du procédé de filage qui conduisent à l’organisation structurale très hiérarchisée des spidroïnes dans les fibres.26,64,65 Ainsi, avant de pouvoir développer des biomatériaux inspirés de la soie, il apparaît
impératif de mieux comprendre les relations structure-propriétés mécaniques. À cet effet, plusieurs études structurales (RMN, DRX, etc.) et mécaniques y ont été consacrées.8,25,29,66-68 Toutefois, ces
travaux nécessitent plus d’informations claires concernant la phase amorphe. De plus, un manque global de données quantitatives sur la conformation et l’orientation des protéines de soie reste à combler pour bien décrire la soie au niveau moléculaire.
Plus spécifiquement, il existe peu de travaux comparant la soie en solution et les fibres de soie par la même technique et un nombre insuffisant de données structurales sur la solution de soie native.46,69
Également, les contributions relatives de la composition protéique et du processus de filage à la structure finale de la fibre demeurent encore mal définies. En vue de pallier ces lacunes, la première partie de ce manuscrit se consacre à l’investigation, la quantification et la comparaison de la structure moléculaire de la soie Ma à l’état initial (en solution) et à l’état final (fibre). Comme peu d’études comparent la structure moléculaire de la soie Ma de différentes espèces d’araignées,24,53,67 la soie
Ma en solution et sous forme de fibre de deux espèces d’araignées orbitèles, soit Nephila clavipes et Araneus diadematus, sont étudiées.
1600 1200 800 400 0 0,1 0,2 0,3 0,4 0,5 0,6 Soie.native Soie.supercontractée. (état.maximal) Déformation Co ntr ai nte -(MP a)
D’autre part, des informations structurales sur la soie peuvent être apprises de l’effet de l’eau sur ses différentes composantes. De fait, le rôle plastifiant de l’eau lors de la supercontraction ressemble à celui impliqué lors du processus de filage. Rappelons que ce dernier comporte une étape de déshydratation,42 soit une perte des molécules d’eau lors de la conversion de la solution aqueuse de
protéines vers une fibre « mouillée », puis sèche. L’état contracté peut donc être considéré comme un stade antérieur de la formation de la fibre solide lors du processus de filage. Par analogie, mieux comprendre ce qui affecte l’amplitude de contraction revient à en apprendre plus sur les différents facteurs déterminants à la structure moléculaire finale de la soie.
Toutefois, le phénomène de supercontraction n’est pas encore complètement élucidé au point de vue structural. De fait, bien qu’il soit établi que la supercontraction entraîne une perte d’orientation moléculaire des protéines de soie,35,50,67 peu de groupes de recherche ont réussi à quantifier cet
effet.39,59,70 Également, l’impact de la contraction sur la structure secondaire des protéines demeure
controversé.39,54,67,71 Le second volet de ce mémoire s’articule donc autour de ces lacunes et se
concentre sur une comparaison quantitative de la structure de fibres de soie Ma natives et supercontractées. La contribution de différents facteurs (présence de résidus proline,53,64 présence
d’acides aminés chargés3 et niveau d’orientation initial de la fibre72) à la supercontraction reste aussi
mal définie. Ainsi, pour éclaircir ce dernier point, la soie Ma de deux espèces d’araignées (NC et AD) (Figure 1.10) possédant une structure primaire distincte de même qu’une amplitude de supercontraction différente ont été comparées.
Figure 1.10 Araignées orbitèles à l’étude : A) Nephila clavipes et B) Araneus diadematus.
11
Ainsi, l’objectif général des présents travaux de maîtrise est de procéder à l’analyse quantitative des différents états de la soie, soit en solution et sous forme de fibres natives et supercontractées, afin d’obtenir une meilleure compréhension globale, et par le fait même plus complète, de sa structure moléculaire. La spectroscopie Raman est utilisée pour mener à bien les expériences, notamment puisqu’elle permet de sonder les différentes phases d’une fibre de soie unique et qu’elle est sensible à la structure secondaire et à l’orientation des protéines qui la composent.1
Chapitre 2 : Spectromicroscopie Raman
2.1 Effet Raman
La spectroscopie Raman, tout comme la spectroscopie infrarouge, permet d’analyser les modes vibrationnels d’une molécule. Cette technique repose sur l’effet Raman, soit la diffusion inélastique de la lumière. Cet effet, aussi nommé diffusion Raman, fut découvert au même moment par les physiciens Chandrashekhara Raman et Leonid Mandelstam en 192873 et est schématisé à la Figure
2.1.
Figure 2.1 Diagramme d’énergie des transitions impliquées durant la diffusion Rayleigh et Raman Stokes et anti-Stokes, où hn0 est l’énergie incidente, hnvib l’énergie vibrationnelle et Dn le
déplacement Raman (figure modifiée à partir de Baker et coll.74).
Lorsqu’une source monochromatique dans le visible irradie un échantillon, presque toute la lumière est diffusée à la même longueur d’onde que la longueur d’onde d’excitation. Cette diffusion élastique se nomme diffusion Rayleigh. Il arrive toutefois que la lumière diffusée soit plutôt réémise à une longueur d’onde différente (diffusion inélastique), soit lorsqu’il y a un transfert d’énergie entre le photon incident et la molécule. Lors de cette interaction, il y a formation d’un complexe photon-molécule dans un niveau d’énergie virtuel. L’énergie d'excitation n’étant pas suffisante pour induire une transition électronique, un photon est réémis et oscille à une fréquence de plus haute ou de plus basse énergie. C’est ce qu’on appelle respectivement les diffusions Raman anti-Stokes et Stokes. La différence d’énergie entre le photon incident et celui diffusé correspond à la différence d’énergie entre
h!0 h!0 h!0 - h!vib h!0 + h!vib Én er gi e Niveaux,vibrationnels État,électronique,fondamental, État,électronique,excité Niveaux,virtuels Diffusion,Raman,,,, (anti;Stokes) ∆! Diffusion, Raman, (Stokes) ∆! Diffusion, Rayleigh
13
deux états vibrationnels d’un groupement chimique appartenant à la molécule. L’occurrence de ces diffusions inélastiques (Raman anti-Stokes et Stokes) est toutefois largement plus faible que pour la diffusion Rayleigh, et donc, l’intensité du signal détecté pour la diffusion Raman est elle aussi considérablement plus faible. De plus, comme les niveaux vibrationnels n > 0 sont moins peuplés à température pièce que le niveau fondamental, la diffusion Raman Stokes est plus intense que la diffusion anti-Stokes. La première sera donc le type de diffusion étudié dans ce mémoire.
L’effet Raman peut également être décrit dans le cadre de la mécanique classique.75 Lorsque
l’échantillon est irradié, le champ électrique incident interagit avec les électrons du nuage électronique de la molécule et induit un dipôle 𝑃. Cette interaction peut être décrite par l’équation suivante :
𝑃 = 𝛼 ∙ 𝐸
où 𝛼 est un tenseur (de rang 2) représentant la polarisabilité électronique de la molécule et 𝐸 le champ électrique incident.
Plus précisément, la radiation incidente, de fréquence n0, est représentée par un champ électrique
oscillant défini comme suit :
𝐸 = 𝐸3𝑐𝑜𝑠 2𝜋n3𝑡
où 𝐸3 décrit le champ électrique à l’état d’équilibre.
La polarisabilité (𝛼) peut également être décrite comme la facilité avec laquelle le nuage électronique peut se déformer sous l’influence d’un champ électrique. Ainsi, pour une vibration de faible amplitude, 𝛼 peut être exprimée selon :
𝛼 = 𝛼3+ ∂𝛼
∂𝑄 3𝑄3+ ⋯
où 𝛼3 correspond au tenseur de polarisabilité à l’état d’équilibre (statique), 𝛼′ = de
df 3 représente la
variation de la polarisabilité lors d’une vibration (tenseur Raman) et 𝑄 définit les coordonnées du mode normal de vibration.
L’amplitude de 𝑄 varie d’ailleurs avec la fréquence de vibration (nvib) :
𝑄 = 𝑄3𝑐𝑜𝑠 2𝜋nW7X𝑡
où 𝑄3 sont les coordonnées maximales du mode normal de vibration.
Ainsi, pour qu’une bande soit active en Raman, il faut que la vibration entraîne un changement de polarisabilité électronique de la molécule tel que :
∂𝛼
∂𝑄 3 ≠ 0
En remplaçant les expressions de 𝛼 et 𝐸 dans l’expression du dipôle induit 𝑃, on obtient : 𝑃 = 𝛼3∙ 𝐸3𝑐𝑜𝑠 2𝜋n3𝑡 + ∂𝛼
∂𝑄 3𝑄3 ∙ 𝐸3𝑐𝑜𝑠 2𝜋n3𝑡 ∙ 𝑐𝑜𝑠 2𝜋nW7X𝑡
En utilisant l’identité trigonométrique cos 𝑥 cos 𝑦 = cos 𝑥 + 𝑦 + cos 𝑥 − 𝑦 /2, on trouve : 𝑃 = 𝛼3∙ 𝐸3𝑐𝑜𝑠 2𝜋n3𝑡 +1 2 ∂𝛼 ∂𝑄 3𝑄3∙ 𝐸3𝑐𝑜𝑠 2𝜋 n3− nW7X 𝑡 +1 2 ∂𝛼 ∂𝑄 3𝑄3∙ 𝐸3𝑐𝑜𝑠 2𝜋 n3+ nW7X 𝑡
Le premier terme correspond à la diffusion Rayleigh, le second à la diffusion Raman Stokes et le troisième à la diffusion Raman anti-Stokes.
2.2 Spectromicroscopie Raman
Le spectromètre utilisé au laboratoire est couplé à un microscope, ce qui permet d’augmenter sa résolution spatiale et donc de sonder efficacement des échantillons de l’ordre du micromètre comme la soie d’araignée. Un faisceau laser de 514 nm a été choisi comme raie excitatrice pour les analyses. De fait, elle offre un bon compromis entre un faible signal de fond de fluorescence et un rapport signal sur bruit élevé, l’intensité du signal Raman étant proportionnel à 1/𝜆4. De plus, cette
15
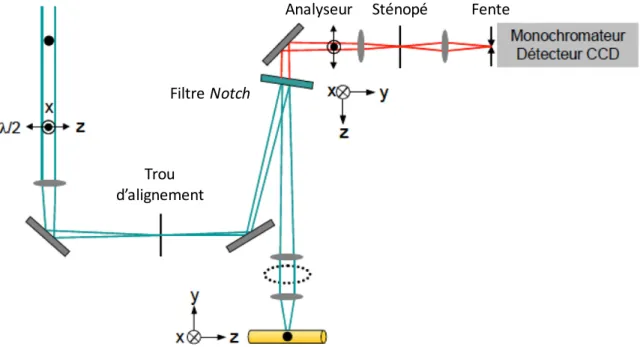
Le parcours optique du spectromètre Raman est illustré à la Figure 2.2. À la sortie du laser, la lumière incidente passe par une lame demi-onde qui la polarise en X ou en Z. Puis, le faisceau rencontre un filtre de type Notch qui réfléchit la lumière incidente vers l’échantillon et transmettre la lumière diffusée par ce dernier. La particularité de ce type de filtre est qu’il bloque la lumière possédant la même longueur d’onde que celle d’excitation (diffusion Rayleigh) et laisse uniquement passer la lumière diffusée à une fréquence différente de celle incidente, soit essentiellement la diffusion Raman. La lumière diffusée est alors polarisée à son tour en X ou en Z par l’analyseur, puis atteint le monochromateur où elle est dispersée et détectée. La présence d’un sténopé et d’une fente tous deux placés devant le détecteur permet d’éliminer le signal provenant hors du plan focal et d’augmenter la résolution spectrale, respectivement.
Figure 2.2 Configuration du spectromètre Raman.
Cette configuration en rétrodiffusion permet de mesurer quatre spectres polarisés linéairement différents, soit Ixx, Ixz, Izz et Izx, où le premier indice indique la direction de la polarisation du faisceau
incident, et le second, celle de la lumière diffusée.
L’appareillage est plus amplement détaillé à la section 3.6 (Materials and Methods). Les divers traitements spectraux effectués sont également décrits aux sections 3.6 et 4.4 (Materials and Methods). Fente Analyseur Sténopé Filtre1Notch Trou1 d’alignement
De plus, la spectromicroscopie Raman en lumière polarisée s’avère particulièrement efficace pour sonder la soie puisqu’elle permet non seulement d’obtenir des informations sur la conformation, mais aussi sur l’orientation des protéines. De plus, cette méthode spectroscopique non destructive requiert peu de matériel et permet notamment d’analyser des fibres uniques de soie.
2.3 Déterminant moléculaire
En spectroscopie des protéines, on s’intéresse particulièrement aux bandes amide, qui sont attribuables aux vibrations de la chaîne peptidique. Les plus étudiées en spectroscopie Raman sont la bande amide I et III, notamment parce qu’elles sont les plus intenses dans les spectres. Essentiellement, le mode amide I est dominé par l’élongation des groupements carbonyle. La bande amide III est quant à elle due à différentes contributions (mode couplé), notamment aux vibrations de déformation N-H et d’élongation C-N du lien peptidique.
La bande amide I a été choisie pour ce mémoire comme déterminant moléculaire pour évaluer la conformation et l’alignement moléculaire des protéines de soie. De fait, elle est sensible aux différentes structures secondaires en plus d’être très intense et bien définie dans les spectres polarisés Raman. Il s’agit également d’une bande de vibration bien documentée dans la littérature pour la caractérisation de protéines.76
En plus de présenter les bandes dépendantes de la conformation des protéines comme les bandes amide décrites ci-haut, les spectres Raman montrent également les bandes dues aux vibrations des chaînes latérales de certains résidus. L’attribution des principales bandes vibrationnelles de la soie est présentée au Tableau 2.1. Ainsi, il est possible de récolter à la fois des informations sur la structure secondaire des protéines et la composition chimique de l’échantillon.
17
Tableau 2.1 Position et attributions des différentes bandes vibrationnelles des protéines de soie (tableau adapté de Lefèvre et coll.1).
Position de la bande (cm-1) Attribution
525 Ala (hélices a)
643 Tyr 702 Composé isoquinoléine 829 Tyr 851 Tyr 875 Pro 904 Poly-Ala 921 Pro 965 Ala (feuillets β) 1003 Phe 1045 Pro 1102 et 1105 (1068 et 1094)* Élongation Ca-Cβ 1207 Tyr, Phe 1260 et 1273 (1228 et 1242)* Amide III 1305 (1315)* Ala 1369 Ala (feuillets β) 1390 Composé isoquinoléine 1399 Ala (feuillets β) 1550 Composé isoquinoléine, Trp 1603 Phe, Tyr 1615 Tyr 1658 (1670)* Amide I
*Les valeurs entre parenthèses correspondent à une conformation en feuillets β
2.4 Détermination de l’orientation moléculaire
La spectroscopie Raman permet, en plus d’obtenir des données sur la structure des protéines, de caractériser leur orientation moléculaire à l’aide d’analyses en lumière polarisée linéairement.
2.4.1 Fonction de distribution d’orientation
Considérons un groupement chimique, décrit par un système de coordonnées xyz, aligné dans un référentiel XYZ lié au laboratoire (Figure 2.3). L’orientation moléculaire de ce groupement peut être définie par une fonction de distribution d’orientation 𝑁 𝛾, 𝜙, 𝛹 . Cette distribution d’orientation représente la probabilité de retrouver cette unité structurale aux angles d’Euler (𝛾, 𝜙, 𝛹). L’angle 𝛾, nommé angle d’inclinaison, correspond à l’angle que forme l’unité structurale par rapport à l’axe Z, l’angle azimutal 𝜙 correspond à la projection du plan XY par rapport à l’axe X et 𝛹 est l’angle décrivant la rotation de l’unité structurale autour de l’axe z.
Figure 2.3 Systèmes de coordonnées xyz (référentiel de l’unité structurale) et XYZ (référentiel du laboratoire) et les angles d'Euler (figure adaptée de Lefèvre et coll.77).
Dans ce référentiel, la fibre est orientée selon l’axe Z (Figure 2.4). Rappelons que les feuillets β s’alignent préférentiellement dans l’axe de la fibre.78,79 Ainsi, dans une structure majoritairement en
feuillets β comme la soie d’araignée, les C=O du squelette polypeptidique se trouvent principalement orientés à 90° par rapport à l’axe de la chaîne peptidique (feuillet β). Le tenseur Raman forme un angle 𝛾 avec l’axe de la fibre (Z). Dans ce mémoire, on suppose initialement que l’orientation du
Unité& structurale ! " # $
19
groupement carbonyle est identique à celle du tenseur amide I, et donc, qu’elle est également décrite par l’angle 𝛾. Bien que cette approximation soit plutôt bonne, elle n’en demeure pas moins inexacte en toute rigueur. Ainsi, à la section 4.5.4, l’angle existant entre le tenseur et le C=O est pris en considération et les mesures d’orientation sont corrigées conformément à la procédure décrite à la section 4.7 (Electronic Supplementary Information). Finalement, l’orientation du feuillet β par rapport à l’axe Z est décrite par l’angle 𝜃.
Figure 2.4 Orientation de la fibre, d’un feuillet β, d’un groupement carbonyle et du tenseur Raman dans le système d’axes du laboratoire.
Comme la bande amide I est le déterminant moléculaire choisi pour cette étude, l’unité structurale dont l’orientation est caractérisée est le groupement carbonyle. La soie d’araignée possède une symétrie uniaxiale. Ainsi, si l’on considère une fibre orientée selon l’axe Z, la distribution d’orientation du groupement carbonyle ne dépend alors plus que de l’angle 𝛾. La fonction 𝑁 𝛾 peut alors être développée en une série infinie des polynômes de Legendre :77
𝑁 g = ℓ𝓁 +1 2 . 𝑃ℓ𝓁$ . 𝑃ℓ𝓁 cosg l ℓ𝓁m3 ! "
où ℓ𝓁 est un entier naturel pair, 𝑃ℓ𝓁 cosg sont les polynômes de Legendre et 𝑃ℓ𝓁$ sont les
coefficients de la série, également nommés paramètres d’ordre. L’expression des premiers polynômes de la suite est la suivante :
𝑃3(cosg) = 1
𝑃#(cosg) =1
2(3 cos#g − 1)
𝑃%(cosg) =18(35 cos%g − 30 cos#g + 3)
Les valeurs de 𝑃ℓ𝓁$ peuvent être déterminées expérimentalement. Les deux premiers paramètres d’ordre peuvent être déterminés par spectroscopie Raman en lumière polarisée linéairement. La méthode fût initialement développée par Bower80 et Jen et coll.81 Par la suite, la technique fût
adaptée à la spectromicroscopie Raman par Turrell et coll. notamment pour compenser les potentielles fuites de polarisation découlant de la grande ouverture numérique du microscope.82,83
Finalement, la procédure fût adaptée au tenseur de la bande amide I par Rousseau et coll. afin de pouvoir caractériser l’orientation moléculaire des spidroïnes contenues dans les fibres.84
2.4.2 Détermination des paramètres d’ordre
En spectroscopie Raman en lumière polarisée, l’intensité dépend de l’amplitude de la variation de polarisabilité mesurée par le tenseur Raman pour la vibration considérée, et de l’orientation du tenseur par rapport à la direction de polarisation de la lumière incidente et diffusée. Ainsi, il est possible de relier les rapports d’intensité des quatre spectres polarisés linéairement (Ixx, Ixz, Izz et Izx)
aux valeurs moyennes des éléments du tenseur :
𝑅t = Ivw Ivv = 𝐴 𝛼′yz # + 𝐵 𝛼′ y| # 𝐴 𝛼′yy # + 𝐵 𝛼′ y| # 𝑅# = Iwv Iww= 𝐴 𝛼′zy # + 𝐵 𝛼′ z| # 𝐴 𝛼′zz # + 𝐵 𝛼′ z| #
21
où 𝛼′7F # (i, j = x, y ou z) représentent les moyennes des éléments du tenseur Raman. A et B sont les constantes reliées à l’objectif déterminées par Turrell et coll.82 et ont pour valeur A=3,759 et
B=0,737 pour un objectif de 100x d’ouverture numérique NA=0,9 et un indice de réfraction de l’échantillon de 1,5. Il est possible de définir un référentiel pour lequel le tenseur Raman (𝛼′) est diagonal, c’est-à-dire que tous les termes non diagonaux de sa matrice sont nuls :
𝛼′ = 𝛼t 0 0 0 𝛼# 0 0 0 𝛼} = 𝛼} 𝑎0t 𝑎0# 00 0 0 1 avec 𝑎t = 𝛼t/𝛼} et 𝑎# = 𝛼#/𝛼}.
Pour décrire le tenseur 𝛼′' dans le référentiel d’un mode de vibration 𝑚 en particulier, la notation 𝛼′' peut être utilisée. Dans le cas présent, le tenseur 𝛼′' est spécifique à l’amide I. Il a d’ailleurs été estimé que ce mode de vibration pouvait être décrit par un tenseur de symétrie cylindrique. On peut alors supposer que deux des éléments du tenseur sont égaux et donc que 𝛼t = 𝛼#. Le tenseur prend alors la forme suivante :
𝛼′'= 𝛼t 0 0 0 𝛼t 0 0 0 𝛼} = 𝛼} 𝑎 0 0 0 𝑎 0 0 0 1 avec 𝑎 = 𝛼t/𝛼}.
Il ne reste donc plus qu’une seule composante du tenseur à déterminer, soit le rapport des principaux éléments du tenseur, nommé paramètre 𝑎. Les valeurs moyennes des éléments du tenseur 𝛼′7F # dépendant de l’orientation moléculaire, peuvent être exprimées selon :
𝛼′zz # = 1 15𝑐 − 2 21𝑑 𝑃#$ + 3 35𝑏 𝑃%$ 𝛼′zy # = 𝛼′ y| # = 𝑏 1 15+ 1 21 𝑃#$ − 4 35 𝑃%$ 𝛼′yy # = 1 15𝑐 + 4 21𝑑 𝑃#$ + 8 35𝑏 𝑃%$
𝛼′z| # = 𝑏 1 15− 2 21 𝑃#$ + 1 35 𝑃%$
où 𝑏, 𝑐 et 𝑑 sont des paramètres reliés au tenseur Raman consistant uniquement en des combinaisons de l’élément du tenseur 𝑎 introduit plus haut. En remplaçant ces expressions de
𝛼′7F # dans les équations des rapports d’intensité R1 et R2, on trouve que :
𝑅t = Ivw Ivv = 𝐴 + 𝐵 𝑏 115 +21 𝑃1 #$ − 435 𝑃%$ 𝐴 115 𝑐 +21 𝑑 𝑃4 #$ + 835 𝑏 𝑃%$ + 𝐵𝑏 115 +21 𝑃1 #$ − 435 𝑃%$ 𝑅# = Iwv Iww= 𝐴𝑏 115 +21 𝑃1 #$ − 435 𝑃%$ + 𝐵𝑏 115 −21 𝑃2 #$ + 135 𝑃%$ 𝐴 115 𝑐 −21 𝑑 𝑃2 #$ + 335 𝑏 𝑃%$ + 𝐵𝑏 115 −21 𝑃2 #$ + 135 𝑃%$
Le système comporte donc 3 inconnus, soit 𝑎, 𝑃#$ et 𝑃%$ , mais ne fournit que deux relations, soit R1 et R2. Pour le résoudre, il est donc nécessaire d’ajouter une troisième équation. Une approche développée au laboratoire du Pr. Pézolet ici à l’Université Laval, dénommée méthode DC pour Depol Constant,84 consiste à déterminer l’élément 𝑎 du tenseur directement à partir du rapport de
dépolarisation 𝜌. Ce dernier peut être calculé pour une vibration donnée à partir d’un échantillon isotrope ( 𝑃#$ = 𝑃%$ , = 0) possédant la même composition chimique et la même organisation conformationnelle que l’échantillon d’intérêt selon l’équation suivante :
𝜌 = 𝑅t = 𝑅# =𝑏 𝐴 + 𝐵
𝐴𝑐 + 𝐵𝑏 =
1 − 𝑎# 𝐴 + 𝐵
𝐴 8𝑎#+ 4𝑎 + 3 + 𝐵 1 − 𝑎#
Obtenir un film isotrope homogène tout à fait représentatif de l’échantillon anisotrope peut toutefois s’avérer difficile. Pour pallier à cette difficulté, une seconde procédure qui ne requiert pas de connaître le rapport de dépolarisation pour déterminer 𝑎, 𝑃#$ et 𝑃%$ , a été développée par l’équipe du Pr. Pellerin à l’Université de Montréal. Cette technique, dénommée méthode MPD pour Most Probable Distribution,85 suppose plutôt que la fonction de distribution 𝑁 𝛾 est gaussienne, ce
qui permet de définir le 𝑃%$ le plus probable à partir de 𝑃#$ selon les équations suivantes, pour un 𝑃#$ positif et négatif respectivement :