FACULTE DES SCIENCES RABAT N° d’ordre : 2738 THESE DE DOCTORAT Présentée par :
CHAFIK
Dahou
Discipline : ChimieSpécialité : Chimie Physique, Nanostructures, Génie des Procédés et Environnement
TITRE :
MODÉLISATION ET OPTIMISATION DE L’ADSORPTION DES
MÉTAUX LOURDS SUR LE PHOSPHOGYPSE
Soutenue le 29/11 /2014 Devant le jury :
Président :
Ahmed BOUHAOUSS : PES, Faculté des Sciences de Rabat Examinateurs :
Rahma BCHITOU : PES, Faculté des Sciences de Rabat
Mohamed KHADDOR : PES, Faculté des Sciences et Techniques de Tanger
Khadija NABIH : PES, Faculté des Sciences de Rabat
Abderrahman NOUNAH : PES, Ecole Supérieure de Technologie de Salé
Faculté des Sciences, 4 Avenue Ibn Batouta B.P. 1014 RP, Rabat – Maroc Tél +212 (0) 37 77 18 34/35/38, Fax: +212 (0) 37 77 42 61, http://www.fsr.ac.ma
2
Dédicaces
A ALLAH LE TOUT PUISSANT
A travers ce travail je te glorifie pour ton amour, ta générosité et ta
miséricorde.
Sans faille, ton soutien dans les moments de tribulations et de solitude.
Merci, car sans Toi ce travail n’existerait pas.
A mes parents : Mon père et ma mère.
A ma famille : ma femme et mes deux filles Rayhana et Yassmine.
A mes frères et mes sœurs chacun avec son nom.
A toute la famille Chafik.
A tous ceux qui sont chers.
A mes collègues les doctorants de LNGPE et
Particulièrement H. Nafai et G. Lamzougui.
A tous ceux que j’ai pu oublier…
3
REMERCIEMENTS
Ce travail a été réalisé au laboratoire Nanostructures, Génie des Procédés et Environnement à la Faculté des Sciences de Rabat, dirigé par Monsieur le Professeur A. BOUHAOUSS.
J’exprime toute ma gratitude et mes vifs remerciements à Mme R. BCHITOU, Professeur à la Faculté des Sciences de Rabat, ma directrice de recherche, j’ai pu tout au long de ce travail de recherche bénéficier de sa grande compétence, mais également de ses encouragements et de ses précieux conseils qui m’ont permis de mener à bien cette étude.
Je remercie également le professeur A. BOUHAOUSS directeur du laboratoire Nanostructures, Génie des Procédés et Environnement, pour l’accueil qu’il m’a préservé au sein du laboratoire et d’avoir accepté de présider le Jury de cette thèse.
Mes vifs remerciements vont également au professeur Mme K. NABIH : Professeur à la Faculté des Sciences de Rabat qui a accepté d’examiner et de faire partie du jury de cette thèse.
Je remercie vivement aussi Monsieur A. NOUNAH : Professeur à l’Ecole Supérieure de Technologie de Salé d’avoir accepté de juger ce travail.
Mes vifs remerciements vont également au professeur M. KHADDOR : Professeur à la Faculté des Sciences et Techniques de Tanger qui a accepté de se déplacer pour examiner et de faire partie des membres du jury de ce travail.
Mes remerciements vont également aux enseignants-chercheurs et mes collègues du laboratoire Nanostructures, Génie des Procédés et Environnement à la Faculté des Sciences de Rabat, qui m’ont aidé directement ou indirectement à réaliser ce travail.
Je remercie tous ceux qui ont contribué de près ou de loin à la réalisation de ce travail.
4
Titre :
MODÉLISATION ET OPTIMISATION DE L’ADSORPTION DES MÉTAUX LOURDS SUR LE PHOSPHOGYPSE
PRENOM ET NOM : Dahou CHAFIK
SPECIALITE : Chimie Physique, Nanostructures, Génie des Procédés et Environnement.
L’objectif de ce travail est d’étudier la possibilité de la valorisation du phosphogypse dans les traitements des solutions aqueuses, contenant des métaux lourds, vue sa grande disponibilité comme sous-produit de l’industrie phosphatière.
La première partie de ce travail est consacrée à la caractérisation des échantillons synthétisés par la diffraction des rayons X et la spectroscopie infrarouge d’une part. D’autre part, pour pouvoir modéliser et optimiser l’élimination de quelques métaux tels que Cd, Zn et Cu, l’apport de la chimiométrie est un choix qui s’est avéré nécessaire en faisant varier quelques paramètres physicochimiques tels que le pH et la température.
En deuxième temps, le procédé d’adsorption de ces métaux sur le phosphogypse a été réalisé dans le but d’éliminer ces métaux qui existent dans des solutions aqueuses. En effet, les isothermes de Langmuir, Freundlich et Temkin ont été déterminés. Quelques modèles et optimums ont été déterminés à l’aide des plans de Box-Behnken. Les facteurs influents sont le temps d’agitation, la concentration de l’ion et la concentration du phosphogypse. Les résultats de cette méthodologie ont montré que l’utilisation du phosphogypse comme agent d’élimination des métaux par adsorption est une méthode très efficace pour le traitement des solutions aqueuses.
Title:
MODELING AND OPTIMIZATION OF ADSORPTION OF HEAVY METALS ON PHOSPHOGYPSUM
First and last name: Dahou CHAFIK
Specialty: Physical Chemistry, Nanostructures, Process Engineering and Environment.
The objective of this work is to study the possibility of the valuation of
phosphogypsum in the treatment of the aqueous solutions containing heavy metals, for its availability as a byproduct of the phosphate industry.
The first part of this work is devoted to the characterization of the synthesized samples by X-ray diffraction and infrared spectroscopy on the one hand. On the other hand, in order to model and optimize the removal of some metals such as Cd, Zn and Cu, the contribution of chemometrics is a choice that has proved to be necessary by varying some physicochemical parameters such as pH and temperature.
In the second time, the adsorption process of these metals on the phosphogypsum was performed in order to remove these metals existing in aqueous solutions. In fact, the isotherms of Langmuir, Freundlich and Temkin were determined. Some models and optimums were determined using Box-Behnken plans. The influential factors are: agitating time, the concentration of the ion and the concentration of phosphogypsum. The results of this methodology showed that the use of phosphogypsum as metal adsorption removing agent is a very effective method for the treatment of the aqueous solutions.
Keywords: Phosphogypsum, Heavy metals, Adsorption, Experimental designs.
5
PUBLICATIONS
1- D. Chafik, R. Bchitou, and A. Bouhaouss, (2014). Modeling and
optimization of the adsorption and the removal of Cd (II) from aqueous solution by phosphogypsum. Asian Journal of Chemistry, 26 (24), 8589-8592.
2- D. Chafik, R. Bchitou, and A. Bouhaouss, (2014). Application of
Box-Behnken Design for the removal of copper in aqueous solutions by phosphogypsum. Journal of Materials and Environmental Science, 5 (5), 1605–1610.
3- D. Chafik, R. Bchitou, and A. Bouhaouss, (2014). The removal of zinc in an
aqueous solution by the phosphogypsum: Modeling and Optimizing. Australian Journal of Basic and Applied Sciences, 8(2), 331–335.
4- D. Chafik, R. Bchitou, and A. Bouhaouss, (2014). Modélisation et
optimisation du procédé de la fabrication de l’acide phosphorique en présence des ions métalliques Cu, Zn, et Cd. Phosphorus, Sulfur, and Silicon, 189, 353– 360.
5- D. Chafik, R. Bchitou and A. Bouhaouss, (2013). Contribution to the study
of the distribution of the uranium from the phosphoric acid and gypsum in the presence of cadmium, lanthanum and clay. Australian Journal of Basic and Applied Sciences, 7(8), 254–257.
COMMUNICATIONS
1- D. Chafik, R. Bchitou et A. Bouhaouss.
L’adsorption du zinc sur le phosphogypse issue de la fabrication de l’acide
phosphorique par voie humide. 3ème colloque International Matériaux, Pollution
et Environnement. Université Abdelmalek Essaidi, Faculté des Sciences et Techniques de Tanger (19-20 Février 2014)
2- D. Chafik, R. Bchitou et A. Bouhaouss.
Modélisation et optimisation de processus d’élimination de quelques métaux lourds d’une solution aqueuse par le phosphogypse. Doctoriales 2014.
6
Université Mohammed-V-Agdal, Faculté des sciences-Rabat (6-7-8 Février 2014).
3- D. Chafik, R. Bchitou et A. Bouhaouss.
Modélisation et optimisation du procédé de fabrication de l’acide phosphorique de voie humide en vue d’élimination de quelques impuretés. Université Mohammed-V-Agdal, Faculté des sciences-Rabat (La semaine de la science du 25 au 03 Mai 2013).
4- D. Chafik, R. Bchitou et A. Bouhaouss.
Modélisation et optimisation de la fabrication de l’acide phosphorique de voie humide. Doctoriales 2013.Université Mohammed-V-Agdal, Faculté des sciences-Rabat.
5- D. Chafik, R. Bchitou et A. Bouhaouss.
Influences de quelques métaux (Cd, Mg, Zn et Cu) sur la pureté du phosphogypse lors de la fabrication de l’acide phosphorique industriel.
Université Mohammed-V-Agdal, Faculté des sciences-Rabat, 3ème colloque:
Maroco-Français en chimie Moléculaire (15-17 octobre 2012)
6- D. Chafik, R. Bchitou, N. Elhrech et A. Bouhaouss.
Procédés de fabrication par voie humide de l’acide phosphorique industriel par attaque sulfurique. Université Mohammed-V-Agdal, Faculté des sciences-Rabat (La semaine nationale de la science : Science et développement durable au quotidien du 23 au 28 Avril 2012).
7
8
Sommaire ……….……….. 7
Introduction générale ………. 12
CHAPITRE I : Synthèse bibliographique ………... 15
I.1/Généralité sur le phosphate ………... 17
I.2/Phosphate du Maroc ………... 25
I.3/Généralité sur l’acide phosphorique et le phosphogypse……….. 26
I.3.1/Quelques utilisations principales de l’acide phosphorique ………. 29
I.3.2/Procédé de fabrication de l’acide phosphorique ………... 30
I.3.2.1/Procédé de fabrication de l’acide phosphorique par voie thermique ………. 30
I.3.2.2/Procédé de fabrication d’acide phosphorique par voie humide ………. 31
I.4/Nature des impuretés dans l’acide phosphorique et le phosphogypse………... 33
I.4.1/ Impuretés dans l’acide phosphorique ………... 33
I.4.2/ Impuretés dans le phosphogypse ………. 35
I.5/Valorisation du phosphogypse ………... 38
I.6/Méthodes de purification de l’acide phosphorique ……….…….. 40
I.6.1/ Extraction liquide-liquide………... 40
I.6.2/ Flottation………... 41
I.6.3/ Précipitation chimique………... 42
I.6.4/ Résines échangeuses d’ions………... 43
I.6.5/ Adsorption ………... 45
I.6.5.1/Types d’adsorption ………... 45
I.6.5.2/Procédés d’adsorption ………... 47
I.6.5.3/Capacité de fixation ou d’adsorption ………... 49
I.6.5.3.1/Facteurs qui agissent sur la capacité d’adsorption ………... 50
9
I.6.5.4/Isothermes d’adsorption ………..…... 51
I.6.6/ Electrolyse ………..……... 54
I.7/Généralités sur les plans d’expériences………... 55
I.7.1/ Principaux avantages des plans d’expériences ……… 55
I.7.2/ Méthodes chimiométriques appliquées à la purification de l’acide phosphorique …………... 56
Conclusion ………..……... 57
CHAPITRE II : Synthèse et caractérisation du phosphogypse par voie humide en présence de Cd(II), Zn(II) et Cu(II) ……….. 58
II.1/Matériels et méthodes ………... 59
II.2/Résultats expérimentaux et discussion ………... 60
II.2.1/ Cas de la synthèse de l’acide phosphorique en présence de Cd (II) ...………..…... 60
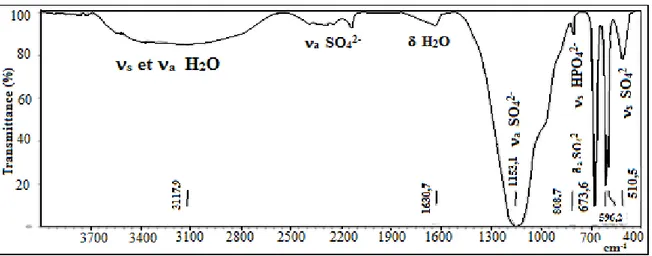
II.2.1.1/Étude par DRX en absence et en présence de Cd (II)………... 60
II.2.1.2/Étude par spectroscopie IR en présence et en en absence de Cd (II)………... 63
II.2.2/ Étude par DRX du phosphogypse en absence et en présence de Zn (II) ………... 68
II.2.3/ Étude par spectroscopie IR en absence et en présence de Zn (II)…………..…...…... 71
II.2.4/ Étude par DRX en absence et en présence de Cu (II)………... 74
II.2.5/ Étude par spectroscopie IR en absence et en présence de Cu (II)………... 77
II.2.6/Etude comparative des différents échantillons analysés par DRX et IR du phosphogypse…. 80 II.2.7/Conclusion ……….………. 82
CHAPITRE III : Modélisation et optimisation de la synthèse de l’acide phosphorique en présence des ions Cd (II), Zn (II) et Cu (II)………. 84
III.1/Modélisation ………..……… 85
III.1.1/Facteurs qui influent la synthèse de l’acide phosphorique par voie humide ………..…... 85
III.1.2/ Modélisation de la synthèse de l’acide phosphorique en présence de Cd (II) ……...…... 86
10
III.1.3/ Modélisation de la synthèse de l’acide phosphorique en présence de Zn (II) ………...….. 90
III.1.3.1/ Validité du modèle en présence des teneurs variables en Zn (II) ………..…….…. 92
III.1.4/ Modélisation de la synthèse de l’acide phosphorique en présence de Cu (II) ………... 93
III.1.4.1/ Validité du modèle en présence des teneurs variables en Cu (II) ………..……... 95
III.1.5/ Conclusion ………...………..………….. 96
III.2/Optimisation ………...……… 97
III.2.1/Optimisation de la synthèse de l’acide phosphorique en présence de Cd (II) ………... 97
III.2.2/Optimisation de la synthèse de l’acide phosphorique en présence de Zn (II) ………...…… 98
III.2.3/Optimisation de la synthèse de l’acide phosphorique en présence de Cu (II) …………... 100
III.3/Conclusion ………...……….. 101
CHAPITRE IV : Approche d’élimination des ions Cd (II), Zn (II) et Cu (II)d’une solution aqueuse par adsorption sur le phosphogypse ………... 103
IV.1/Matériels et méthodes ………..……….………. 104
IV.2/Approche d’élimination de Cd (II) d’une solution aqueuse par adsorption sur le phosphogypse.. 105
IV.2.1/ Influence du temps d’agitation sur l’adsorption de Cd (II) sur le phosphogypse ….……... 105
IV.2.2/ Etude de l’influence de la quantité du phosphogypse sur l’adsorption de Cd (II) …... 106
IV.2.3/ Isothermes de Langmuir, Freundlich et Temkin de l’adsorption de Cd (II) sur le phosphogypse ………... 107
IV.2.4/ Modélisation de l’adsorption de Cd (II) sur le phosphogypse par les plans d’expériences de Box-Behnken ………... 111
IV.2.5/ Optimisation de l’adsorption de Cd (II) sur le phosphogypse ……….…….…… 116
IV.3/Approche d’élimination de Zn (II) d’une solution aqueuse par adsorption sur le phosphogypse.. 118
IV.3.1/ Influence du temps d’agitation sur l’adsorption de Zn (II) sur le phosphogypse ……... 118
IV.3.2/ Influence de la quantité du phosphogypse sur l’adsorption de Zn (II) ………... 119 IV.3.3/ Isothermes de Langmuir, Freundlich et Temkin de l’adsorption de Zn(II) sur le
11
phosphogypse ………... 120
IV.3.4/ Modélisation de l’adsorption de Zn(II) sur le phosphogypse par les plans d’expériences de Box-Behnken ………...………... 124
IV.3.5/ Optimisation de l’adsorption de Zn(II) sur le phosphogypse ………...…… 128
IV.4/ Approche d’élimination de Cu (II) d’une solution aqueuse par adsorption sur le phosphogypse. 130 IV.4.1/ Influence du temps d’agitation sur l’adsorption de Cu(II) sur le phosphogypse …..……... 130
IV.4.2/ Effet de la quantité du phosphogypse sur l’adsorption de Cu(II)………. 131
IV.4.3/ Isothermes de Langmuir, Freundlich et Temkin de l’adsorption de Cu(II) sur le phosphogypse ………... 132
IV.4.4/ Modélisation de l’adsorption de Cu(II) sur le phosphogypse par les plans de Box-Behnken ……… 136
IV.4.5/ Optimisation de l’adsorption de Cu (II) sur le phosphogypse………..…… 140
IV.5/Conclusion ………...……….. 142
Conclusion générale ………..………. 145
Références bibliographiques ………..………... 149
Annexes ………..………... 164
Annexe I : Méthodologie expérimentale ………...………. 165
Annexe II : Diffraction des Rayons X ………...……… 170
Annexe III : Spectroscopie infrarouge ………...………... 174
Annexe IV : ICP AES ………... 177
Annexe V : Procédés de fabrication de l’acide phosphorique ………... 180
12
13
Le Maroc est le troisième producteur et le premier exportateur mondial du phosphate. Il possède les premières réserves mondiales avec 50 000 milliards de tonnes.
Ainsi, la gestion du phosphogypse marocain est un problème environnemental difficile à résoudre vu les quantités produites et la composition chimique du produit. Compte tenu de ce contexte, une valorisation de ce matériau en l’utilisant comme adsorbant des impuretés métalliques, qui se trouvent en solution aqueuse, paraît être possible pour l’élimination de ces métaux.
Généralement, plusieurs procédés utilisent l’acide sulfurique pour son faible coût et sa grande disponibilité. Toutefois, ce dernier présente des inconvénients de formation des précipités lors de la formation de l’acide phosphorique brut à partir du minerai phosphaté. Cette attaque donne l’acide phosphorique et une phase solide appelée phosphogypse. En effet, l’acide produit et le résidu formé contiennent de nombreux cations métalliques qui sont considérés comme des impuretés qui proviennent généralement de la roche phosphatée. Certains peuvent être valorisables comme l’uranium et les terres rares et d’autres peuvent être considérées comme un handicap pour l’utilisation ultérieure de l’acide phosphorique, tels que le cuivre, le zinc et le cadmium. L’élimination de ces éléments, directement des phosphates, est souvent difficile et onéreuse, voire impossible pour certains. Ils peuvent être séparés lorsqu’ils passent dans l’acide phosphorique.
Ainsi, la plus part des études réalisées avait pour but soit d’optimiser et modéliser les réacteurs de production de l’acide phosphorique, soit pour établir des modèles concernant la cuve d’attaque du phosphogypse. Toute fois, aucune recherche n’a été faite sur la modélisation et l’optimisation de l’adsorption des métaux lourds sur le phosphogypse.
14
Aussi, sommes nous intéressés à l’influence de certains ions métalliques (Cd (II), Zn (II) et Cu (II)) sur la formation du phosphogypse au cours de la fabrication de l’acide phosphorique.
Ainsi, la détermination des conditions optimales de la synthèse de l’acide phosphorique a été réalisée en utilisant la méthodologie des plans d’expériences factoriels complets afin de représenter au mieux la synthèse de l’acide phosphorique avec moins d’impuretés. Les facteurs étudiés qui ont une grande influence sont la température et le pH de la solution.
Et pour la valorisation de ce matériau, une étude de l’adsorption des ions
Cd (II), Zn(II) et Cu(II) sur le phosphogypse a été réalisée. Les isothermes de
Langmuir, Freundlich et Temkin ont été étudiés en premier temps. La modélisation et l'optimisation par les plans de Box-Behnken ont été déterminées en deuxième temps. Les facteurs influant sont le temps d’agitation, la concentration du métal et la quantité de phosphogypse.
Ce projet comporte quatre chapitres :
- Le premier chapitre concerne un ensemble de données bibliographiques
nécessaire pour la suite de ce travail.
- Le deuxième chapitre décrit la synthèse et la caractérisation de l’acide
phosphorique par voie humide en présence des ions Cd (II), Zn (II) et Cu (II).
- Le troisième chapitre est consacré à la modélisation et l’optimisation de la
synthèse de l’acide phosphorique en présence des ions Cd(II), Zn(II) et Cu(II).
- Le quatrième chapitre regroupe une approche expérimentale d’élimination des
ions Cd (II), Zn (II) et Cu (II) d’une solution aqueuse par adsorption sur le
15
CHAPITRE I
16
Le Maroc est un pays qui a une réserve mondiale très intéressent de la roche phosphatée. Le minerai de phosphate contient plusieurs impuretés qui
passent dans l’acide phosphorique, et par la suite dans les produits ultérieurs qui utilisent cet acide, comme les engrais, les produits pharmaceutiques et l’industrie alimentaire [1, 2].
La fabrication de l’acide phosphorique par voie humide se base généralement sur l'attaque d’un acide fort (soit chlorhydrique, nitrique ou sulfurique) de la roche phosphatée. Plusieurs procédés utilisent l’acide sulfurique pour des raisons économiques [3].
L’acide phosphorique et le phosphogypse contiennent plusieurs impuretés qui présentent des problèmes pour l’utilisation ultérieure de l’acide et pendant le stockage du phosphogypse. Parmi ces impuretés on peut citer le cadmium, le zinc et le cuivre.
Le cadmium affecte la pression sanguine, la fonction de la prostate et le taux de testostérone [4, 5]. Il provoque des lésions osseuses et l'exposition à cet ion peuvent affecter les systèmes dopaminergiques rénaux chez les enfants. Il peut aussi causer le cancer du pancréas humain [6, 7].
Quant au zinc, il peut provoquer des troubles gastriques et l’arythmie cardiaque [8, 9]. Les taux sériques et urinaires accrus par cet élément ont été observés chez les humains et les animaux par voie orale après inhalation et exposition cutanée [10, 11]. L’organisation mondiale de la santé (OMS) a recommandé que les concentrations de l’ion zinc dans l'eau potable ne doit pas
dépasser 0,5 mg. L-1. La même recommandation s'applique aux effluents
industriels contenant ce métal lourd avant qu'il soit libéré dans l'environnement. Le cuivre, il est considéré comme un oligo-élément essentiel pour le métabolisme humain. La quantité de cuivre nécessaire à l'organisme d'un adulte est d'environ 3 mg/j et de 2 mg/j pour les enfants. Cet élément peut se retrouver dans certaines eaux aux teneurs inférieures à 1 mg. L-1 sous forme ionique ou complexe [12, 13]. En plus des pollutions industrielles, ce métal provient aussi
17
de la corrosion des tuyauteries de distribution [14]. D’après les recommandations de la directive des communautés européennes, au delà de 3
mg. L-1, peuvent apparaître des saveurs astringentes, des colorations et des
corrosions. Cette même directive indique comme niveau guide du cuivre dans
l’eau destinée à la consommation humaine de 0,1 mg. L-1. Par contre, l’OMS
fixe la concentration en cuivre à 2 mg. L-1 [15]. Les normes américaines et
françaises retiennent comme valeur limite 1 mg. L-1 [16].
Les métaux lourds sont toxiques même à faible concentration et ont la capacité de s'accumuler tout au long de la chaîne alimentaire [17, 18]. La connaissance des propriétés du phosphogypse est très importante, ainsi que les procédés de la fabrication de l’acide phosphorique qui sont source de sa contamination par les métaux lourds.
Ce chapitre présente quelques généralités sur l’acide phosphorique, le phosphogypse, les méthodes de purification de cet acide, l’adsorption et les plans d’expériences.
I.1/ Généralité sur le phosphate
Composition de la roche phosphatée
La roche phosphatée peut être de deux types différents, sédimentaire ou d'origine volcanique, qui sont associés avec un grand nombre d'impuretés. Les minerais sédimentaires ont des couches relativement homogènes bien que chacune d'elles a ses propres caractéristiques. Le taux d'impureté dans les phosphates sédimentaires dépend des conditions spécifiques locales. Comparés au phosphate d'origine volcanique, le phosphate sédimentaire contient plus de carbonates, de fluorures et souvent plus d'aluminium et de fer. Étant poreux, les phosphates sédimentaires offrent une plus grande aire pour les réactions chimiques. La majorité des minerais sédimentaires contiennent des matières organiques qui peuvent générer des mousses durant la production de l'acide phosphorique.
18
Par ailleurs, les phosphates d'origine volcanique diffèrent non seulement entre eux, mais peuvent être aussi différents au sein de la même mine.
Il existe aussi d'autres types de phosphates de moindre importance tels que les phosphates métamorphiques qui sont une forme intermédiaire de phosphate et sont plus complexes. Ce sont généralement des roches sédimentaires qui ont subi des altérations dues à la température et la pression, donnant lieu à une recristallisation. A cause de leur origine sédimentaire, ils contiennent les mêmes impuretés que les phosphates sédimentaires.
Les phosphates calcinés sont de nature sédimentaires et ayant subi un métamorphisme artificiel par chauffage, éliminant ainsi certains composés indésirables tels que le dioxyde de carbone et d'autres matières organiques. La calcination affecte la réactivité du phosphate et fait promouvoir la formation de sulfures qui peuvent engendrer une corrosion assez importante dans la section de réaction.
Le tableau I.1 présente les pourcentages massiques de certains éléments présents dans des roches issues de mines de différentes régions à travers le monde et ce pour les deux types, sédimentaire et d'origine volcanique. D'après ce tableau, les roches de phosphate de type volcanique contiennent plus d'acide phosphorique que celles de nature sédimentaire, moins de fluore et moins de SiO2 [19].
19
Tableau I.1 : Pourcentage massique de certains éléments dans différentes roches
de phosphate [20].
Roche de phosphate % % F % % % %MgO
Sédimentaire USA 31, 30 3, 60 3, 70 5, 60 1, 30 0, 50 Maroc 32, 90 4, 10 4, 80 2, 00 0, 40 0, 30 Jordanie 32, 90 3, 70 4, 70 1, 60 0, 50 0, 40 Egypte 30, 00 3, 10 2, 80 2, 10 1, 50 1, 00 Syrie 32, 80 4, 00 3, 90 1, 20 0, 10 0, 20 Chine 31, 90 3, 10 - 14, 70 1, 35 0, 35 Origine volcanique Palfos 80M (Afrique du sud) 36, 50 2, 20 4, 20 0, 71 0, 06 1, 49 Palfos 88S (Afrique du sud) 40, 20 2, 38 1, 30 0, 45 0, 05 0, 53
Palfos 88I (Afrique du sud)
39, 90 2, 35 1, 00 1, 00 0, 35 0, 51
Différents types de phosphates de calcium
Le tableau I.2 regroupe le rapport atomique Ca/P, la structure cristalline et la constante de solubilité pour les différents types d’orthophosphates de calcium. Certains phosphates possèdent la même formule chimique et le même rapport atomique Ca/P mais des structures et des constantes de solubilité différentes, comme le cas des phosphates tricalcique α, β et amorphe [21].
20
Tableau I.2 : Différents types de phosphate de calcium.
Nom Formule chimique Rapport
Ca/P Structure cristalline Pks à 25° C Phosphate tétracalcique TTCP Ca (PO ) O 2 Monoclinique 2 40 Hydroxyapatite HAp
Ca (PO ) (OH) 1, 667 Hexagonal
P6 /m 120 Phosphate tricalcique: β-TCP α-TCP β-Ca (PO ) α-Ca (PO ) 1,5 1,5 Rhomboédrique R3c Monoclinique P2 /a 28, 9 25, 5 Phosphate octocalcique OCP Ca H (PO ) , 5H O 1,333 Triclinique P1 96, 6 Phosphate dicalcique: dihydraté (Brushite)DCPD Anhydre (monétite) DCPA CaHPO , 2H O CaHPO 1 1 Monoclinique Ia Triclinique P1 6, 60 6, 90 Phosphate monocalcique: Monohydraté MCPM MCP ( ) , Ca(H PO ) 0, 5 0, 5 Triclinique P1 Triclinique P1 2, 3 2, 4 Pyrophosphate de calcium PPC 1 Tétragon. P4 ( ) Monoclin. P2 / ( ) Phosphate dicalcique
Il existe deux formes de phosphates dicalciques qui ont le rapport Ca/P égal à 1 : Le phosphate dicalcique dihydraté, (DCPD ou brushite) de formule( CaHPO , 2H O) et le sel anhydre (DCPA ou monétite), de
formule .
21
La brushite (CaHPO , 2H O) se présente sous forme de cristaux monocliniques de groupe d’espace Ia de paramètre cristallins:
a = 5, 812 Å, b = 15,180 Å, c = 6, 239 Å et β = 116°25 [22]. Sa densité est égale
à 2, 32. Le DCPD peut être obtenu en milieu aqueux soit par neutralisation de l’acide phosphorique par la chaux, soit par double décomposition d’un sel de calcium et d’un sel de phosphate.
La structure cristalline de ce composé a été déterminée par diffraction des rayons X et à l’aide de la diffraction des neutrons [23].
ii) Phosphate dicalcique anhydre (DCPA ou monétite)
La monétite CaHPO4 cristallise dans la structure triclinique (groupe spatial:
P1). Les paramètres cristallins sont les suivants :
a = 6, 906 Å, b = 8, 577 Å, c = 6, 634 Å, α = 93,99°, β = 91,50° et γ = 127, 6°.
Le DCPA (ou monétite) peut être obtenu par neutralisation, par double décomposition ou encore par décomposition thermique du DCPD (chauffage à 180°C). Il est difficile d’éviter la formation simultanée du pyrophosphate, en éliminant l’eau de la brushite à l’air sec. Ainsi la déshydratation se fait à 100 °C dans un courant d’air humide [21].
Phosphate tricalcique
Après sa synthèse par précipitation, le phosphate tricalcique est amorphe. Sa formule chimique est Ca9(PO4)6, nH20.
Le phosphate tricalcique amorphe se transforme soit par évolution dans sa liqueur mère, soit par chauffage à 100 °C en phosphate tricalcique apatitique :
Ca9HPO4(PO4)5OH. Il se transforme par calcination à haute température en
phosphate de formule Ca3(PO4)2 qui existe sous trois variétés allotropiques ,
22
La phase , obtenue à une température comprise entre 900 et 1120℃, est
rhomboédrique (groupe d’espace R3c), de paramètre à 25 °C: a = 10,439 Å,
c=37,375 Å. Sa densité est égale à 3,07.
La phase α est obtenue entre 1120 et 1470 °C.
Le phosphate tricalcique de type cristallise dans le système monoclinique
de groupe d’espace P2 /a et de paramètre à 25 °C: a = 12,887 Å, b = 27,280 Å, c
= 15, 219, = 126°12’. Sa densité est égale à 2,86.
La variété α est plus soluble que la variété β. Le rapport de la constante de la solubilité de la variété α par rapport à celle de la variété β est de 2, 51.10 .
La phase est stable entre les températures 1470 et 1800 °C qui sont les températures de fusion du phosphate tricalcique.
Fluorapatite phosphocalcique
La fluorapatite phosphocalcique cristallise dans le système hexagonal de groupe d’espace P63/m. Sa formule Ca10(PO4)6F2, c’est l’apatite la plus simple,
de paramètres cristallographiques : a = 9,375 Å et c = 6,875 Å, est souvent reconnue comme référence [24].
La stabilité du réseau apatitique est assurée par l’assemblage des ions
métalliques et les ions PO4
indépendamment des ions localisés dans les canaux.
L’arrangement compact des groupements PO43- fait apparaître deux types de
tunnels [25].
Le premier, coïncide avec l’axe ternaire de la maille hexagonale, est occupé par 4 ions du métal (CaI) en position z = 0 et z = 1/2.
Ces atomes CaI sont entourés de 9 atomes d’oxygène qui forment dans le
cas de l’apatite phosphocalcique un tunnel dont le diamètre est d’environ 2, 5 Å.
Le second tunnel, coïncide avec l’axe sénaire hélicoïdal du réseau, est occupé par les ions F- dans le cas de la fluorapatite (ou OH- dans le cas de l’hydroxyapatite) [25].
23
Ce type de tunnel est bordé par les oxygènes du tétraèdre PO4
et 6 ions du métal (CaII) qui se positionnent à z = 1/4 et z = 3/4 en formant deux triangles équilatéraux alternés autour de l’axe sénaire. Ce tunnel est de diamètre 3 à 4,5 Å dans l’apatite phosphocalcique. Ces deux tunnels dans la structure apatitique donnent à ces matériaux des propriétés physico-chimiques importantes.
En tenant compte de ces deux sites cristallographiques, on peut donc représenter la fluorapatite par la formule suivante : [CaI]4[CaII]6(PO4)6F2.
Dans le réseau complexe de ces apatites, il y a plusieurs types de liaisons
entre les ions Ca2+ et PO43-, qui sont considérées comme purement ioniques.
Par contre, les liaisons P-O ont un caractère nettement covalent, et celles de Ca-F sont partiellement covalentes [26]. L’ensemble est particulièrement stable et leur point de fusion est très élevé (≥1600 °C).
Hydroxyapatite phosphocalcique (HAP)
Il existe également l’hydroxyapatite phosphocalcique (HAP)
Ca10(PO4)6(OH)2, c’est l’une des formes les plus répandues du phosphate de
calcium. Elle appartient à une grande famille de composés isomorphes. L’hydroxyapatite phosphocalcique cristallise dans le système hexagonal (groupe
spatial P63/m) avec les paramètres cristallographiques suivants:
a = 9,418 Å, c = 6,881 Å, β = 120°.
La structure cristallographique de l’HAP (Figure I.1) consiste en un empilement de groupements phosphate qui forment deux types de tunnels parallèles à l’axe c. Le premier coïncide avec l’axe ternaire de la structure. Ces tunnels sont occupés par des ions calcium notés Ca(I). Le second type de tunnel, dont l’axe coïncide avec l’axe sénaire hélicoïdal du réseau, est bordé par des atomes d’oxygène et les autres ions calcium, notés Ca(II), et est occupé par les ions OH-. La taille de ce type de tunnel (3 Å pour l’HAP) confère aux apatites des propriétés d’échangeurs d’ions et d’accepteur de petites molécules (O , H O, glycine) [25].
24
Figure I.1 : Projection sur le plan de base (001) de la maille de l’HAP [27].
En ce qui concerne les apatites biologiques, les substitutions les plus importantes sont les substitutions des ions de phosphate par les ions carbonate ou par les ions hydrogénophosphate. Ces substitutions conduisent à des phénomènes de non-stœchiométrie des apatites, c'est-à-dire au fait que le rapport atomique Ca/P devient différent de 1,67. Ces phénomènes de non-stœchiométrie sont observés dans le cas des apatites préparées au voisinage de la température
ambiante et dont la composition varie entre celle de l’hydroxyapatite (Ca/P = 1,67) et celle du phosphate octocalcique (Ca/P = 1,33). Les apatites
non-stœchiométriques sont plus solubles que les apatites non-stœchiométriques.
Le minéral de l’os contient à la fois des ions carbonate et des ions hydrogénophosphate. Il est constitué de phosphate octocalcique carbonaté : (Ca (PO ) (CO ) (HPO ) , nH O) avec x+y = 2.
Le phosphate octocalcique (Ca8(HPO4)2,5(PO4)3,5(OH)0,5) peut être
considéré comme une apatite déficiente en ions calcium, qui contient à la fois
des ions et des ions et qui possède la formule chimique :
25
Phosphate monocalcique
Le phosphate monocalcique existe sous deux formes : Le phosphate
monocalcique anhydre Ca(H PO )2 et le phosphate monocalcique
monohydraté Ca((H P0 ) , H O).
i) Phosphate monocalcique anhydre
Sa formule chimique est Ca(H P0 ) . Il cristallise dans le système
triclinique de groupe d’espace et de paramètre :
a = 7,558 Å, b = 8,253 Å, c = 5,55Å. α = 109°52’, β = 93°41’et γ = 109°09’, sa densité est égale à 2,57.
Le phosphate monocalcique anhydre est obtenu en chauffant à une température de 100℃ le phosphate monocalcique monohydraté. Lorsque cette température augmente (150℃ et 200℃), celui-ci se transforme en un mélange de pyrophosphate et d’acide métaphosphate suivant l’équation:
150°C
2Ca(H2PO4)2 Ca2P207 + 2HPO3 + 3H20
j) Phosphate monocalcique monohydraté
Le phosphate monocalcique anhydre se transforme rapidement en
phosphate monocalcique monohydraté Ca((H P0 ) , H O) en présence
d’humidité. Le phosphate monocalcique monohydraté cristallise dans le système
triclinique de groupe d’espace et de paramètre: a = 5,626 Å, b = 11,889Å,
c = 6,473Å et α=90°18’, β=118°16’, γ=83°20’, sa densité est égale à 2, 23.
I.2/ Phosphate du Maroc
Le Maroc dispose des trois quarts de la réserve mondiale en minerais phosphatés et occupe la première place dans l’exportation. Les séries sédimentaires phosphatées marocaines recèlent des quantités relativement importantes de minéraux associés [30].
26
Plusieurs études structurelles ont été réalisées, et ont abouti à la formule chimique pour les phosphates de Sidi Daoui :
Ca (PO ) (CO ) F (OH) (1).
Et pour ceux de Youssoufia la même formule chimique avec y=0
c'est-à-dire: Ca (PO ) (CO ) F (2).
Les formules chimiques des phosphates naturels ont été identifiées grâce à l’analyse chimique, spectroscopie infrarouge et diffraction des rayons X.
Le minerai brut composé d’apatite, de silice, de calcaire et d’argile a une couleur noire à sa teneur plus grande que celle de Sidi Daoui en inclusion organique qui est de nature végétale et animale.
Les principales espèces pouvant se trouver dans le minerai de Youssoufia sont : Ca10(PO4)6F2, Ca10(PO4)6(OH)2, CaCO3 calcite, Aragonite, (Ca, Mg)
dolomite, Ca (Mg0,5Fe0,5)(CO3)2 ankérite, CaSO4 (anhydrite), CaSO4, 2H2O
(gypse), SiO2 quartz, Glauconite (Aluminosilicate, Fe, Al, Mg), Argile: kaolinite
et Montmorillonite.
Il existe également d’autres éléments sous forme de traces qui sont : CO2,
P2O5, SiO2, CaO… [31].
I.3/ Généralité sur l’acide phosphorique et le phosphogypse
Acide phosphorique
L’acide phosphorique est un composé chimique de formule H3PO4, acide
trifonctionnel important en chimie minérale et fondamental en biochimie. Il s'agit d'un acide minéral obtenu par traitement de roches phosphatées ou par combustion du phosphore. À température ambiante, l'acide phosphorique est un solide cristallin de densité 1,83, qui fond à 42,35 °C. Il constitue la matière première de base pour la production de phosphates (ou sels phosphatés).
Pour des solutions aqueuses, l'acide phosphorique est un liquide limpide, incolore, inodore, visqueux et sirupeux. Il n'est pas combustible à haute
27
température, mais il peut se décomposer et former des oxydes de phosphore qui sont toxiques. Certaines réactions chimiques peuvent libérer des gaz dangereux. Le contact avec des métaux libère de l'hydrogène, un gaz inflammable. L'acide phosphorique est corrosif pour les yeux, la peau et les voies respiratoires. Il peut conduire à la cécité et laisser des cicatrices permanentes [32].
Il est utilisé industriellement en solutions aqueuses de concentrations
variables entre 35 et 85 % en masse de P2O5, plus ou moins chargées en
impuretés suivant l'origine des matières premières utilisées et le procédé de fabrication. C'est un triacide dont seule la première acidité est forte.
La formule semi développée de H3PO4 est illustrée dans la figure I.2.
Figure I.2 : Formule semi développée de l’acide phosphorique.
Les différentes propriétés de l'acide phosphorique sont regroupées dans le tableau I.3. [33].
28
Tableau I.3 : Propriétés de H3PO4.
Acide phosphorique pur (solide)
Masse molaire 98 g/mol
Point d’ébullition 260 °C
Point de fusion 42, 4 °C
Densité de vapeur 3, 4
Densité relative 1, 864 à 25 °C
Pression/ Tension de vapeur 4 Pa 16 Pa 177 Pa 487 Pa
20 °C 40 °C 80 °C 100 °C Acide phosphorique à 75 % Point d’ébullition 133 °C Point de fusion -17, 5 °C Densité relatif 1, 57 à 25 °C Densité de vapeur 3, 4
Solubilité eau de mer 100 %
pH < 1
pKa pKa1= 2, 12, pKa2= 7, 21 et
pKa3= 12, 67
Viscosité à 20 °C 24 cp (centipoise)
Caractéristiques générales du phosphogypse
La fabrication d’une tonne d’acide phosphorique engendre environ 5 tonnes de phosphogypse [34].
Le phosphogypse est le sous-produit de la fabrication de l’acide phosphorique, résultant de l’attaque sulfurique d’un minerai de phosphate de calcium naturel. Le phosphogypse se présente sous la forme d’une très fine poudre humide. Il est principalement constitué d’oxydes de soufre et de calcium, et dans une moindre mesure d’oxydes de silicium, de sodium… Les minerais de phosphate utilisés contiennent de nombreuses impuretés, qui dans la plupart des cas se concentrent dans le phosphogypse. C’est par exemple le cas des éléments traces métalliques (strontium, baryum, cuivre, zinc et cadmium) et des
29
Les masses volumiques des grains de phosphogypse
Les masses volumiques des grains de phosphogypse sont légèrement
supérieures à celles du gypse naturel qui est de l’ordre de 2, 32 g/cm3, par contre
il peut atteindre 2, 76 g/cm3 pour quelques phosphogypse. Ceci peut être
expliqué par la forte présence d’impuretés dont les densités qui sont généralement plus élevées que celle du gypse, ou bien par le fait que le phosphogypse est sous forme hémihydrate [41-43].
Solubilité de phosphogypse
La solubilité maximale du phosphogypse dépend du pH de la solution dans laquelle il baigne. Dans l’eau déminéralisée, elle est de l’ordre de 2,40 g/L (2,25 g/L pour le gypse). Le tableau I.4 donne l’évolution de la solubilité en fonction du pH pour le phosphogypse, qui diminue lorsque le pH augmente [44].
Tableau I.4 : Évolution de la solubilité du phosphogypse en fonction du pH pH du filtrat 1, 8 3, 3 3, 4 5, 7 6, 1 11, 8
Solubilité (g/L) 3, 79 2, 84 2, 76 2, 6 2, 41 1, 55
I.3.1/ Quelques utilisations principales de l’acide phosphorique
L'acide phosphorique sous forme liquide est utilisé dans :
– La fabrication d'engrais superphosphates (la matière première peut alors
être sous forme d'acide superphosphorique), et que 90% de l’acide phosphorique sert à la production des engrais.
– La synthèse de détergents et de diverses formes de phosphate.
– Le décapage et le traitement antirouille de surfaces de métal.
– Le nettoyage des surfaces métalliques et autres surfaces dures telles que les
tuiles et la porcelaine.
30
– Les liants pour les matériaux réfractaires et céramiques.
– Les produits de nettoyage tels que les détartrants pour cuvettes et urinoirs et les produits à polir le métal.
– L'industrie alimentaire, comme agent acidifiant, notamment dans le coca
cola.
– Le traitement des eaux usées.
– La synthèse d'ignifugeants pour textiles.
– La coagulation du latex de caoutchouc.
– Les catalyses acides en pétrochimie.
– La synthèse de produits pharmaceutiques [45].
I.3.2/ Procédé de fabrication de l’acide phosphorique
La synthèse de l’acide phosphorique se fait par attaque d’un acide fort de la roche phosphatée selon deux voies : thermique et humide.
I.3.2.1/ Procédé de fabrication de l’acide phosphorique par voie thermique
Le procédé consiste à produire de l’acide phosphorique industriel à partir du minerai phosphaté [46] :
Le phosphore élémentaire est produit à partir de la roche phosphatée, le coke et la silice dans un four électrique à une température qui varie entre 145O °C et 1500 °C selon la réaction suivante:
Chaleur
Ca3 (PO4)2 + 3SiO2 + 5C 3(CaOSiO2) + 5CO + 2P
Après le phosphore élémentaire est oxydé pour obtenir l’anhydride du phosphate P2O5 selon la réaction :
P2 + O2 P205
L’anhydride du phosphate P2O5 est ensuite hydraté pour donner l’acide
31
P2O5 + 3H2O 2H3PO4
Ce procédé présente l’avantage de fournir un acide pur, mais, il est coûteux vue la grande consommation d’énergie [47].
I.3.2.2/ Procédé de fabrication de l’acide phosphorique par voie humide
La fabrication de l’acide phosphorique par voie humide est obtenue à partir des phosphates naturels par attaque d’un acide fort. L’acide d’attaque peut être l’acide sulfurique, l’acide nitrique ou l’acide chlorhydrique.
La teneur en acide phosphorique est exprimée en pourcentage de P2O5.
L’avantage des deux attaques (nitrique et chlorhydrique) est que les deux acides n’engendrent pas la fabrication conjointe de phosphogypse.
i) Attaque du phosphate par l’acide chlorhydrique
L’attaque du phosphate par l’acide chlorhydrique pour produire l’acide phosphorique et le procédé se déroule en trois étapes :
– dissolution de la roche phosphatée.
– contact liquide-liquide (extraction, purification, lavage). – concentration de l’acide.
L’équation de la réaction est la suivante :
Ca10(PO4)6F2 + 20HCl → 6H3PO4 + 10CaCl2 + 2HF
Or, l’acide chlorhydrique (HCl) fait naître le problème potentiel de l’élimination des ions chlores.
ii) Attaque du phosphate par l’acide nitrique
L’attaque de la roche phosphatée par l’acide nitrique peut produire l’acide phosphorique selon la réaction :
32
iii) Attaque de la roche phosphatée par l’acide sulfurique
L’acide phosphorique de voie humide est obtenu à partir des phosphates naturels par attaque acide, le plus souvent l’acide sulfurique (70 % de l’acide phosphorique produit). L’addition de l’acide sulfurique présente un avantage vu son coût moins élevé et sa grande disponibilité. Toutefois, il présente l’inconvénient de former des précipités au contact de l’acide phosphorique brut.
La réaction globale de cette attaque est la suivante :
Ca10(PO4)6 F2 + 10H2SO4 + 10nH2O 10(CaSO4, nH2O) + 6H3PO4+2HF
Ou Ca3(PO4)2 + 3 H2SO4 + 3nH2O 3(CaSO4, nH2O) + 2H3PO4
Les procédés sont classés en fonction de la forme selon laquelle cristallise le phosphogypse. Nous distinguons les procédés conduisant à la formation du phosphogypse anhydre (n = 0), du phosphogypse hémihydrate (n=0, 5) et du phosphogypse dihydrate (n = 2).
Industriellement, seuls les procédés hémihydrate et dihydrate sont utilisés, séparément ou en combinaison, comme le montre le tableau. I.5 [48].
Le phosphate tricalcique dans la roche phosphatée est converti par la réaction avec de l’acide sulfurique concentré dans l’acide phosphorique et le sulfate de sel insoluble de calcium (dans le cas du procédé dihydrate utilisé). Ca3(PO4)2 + 3H2SO4 + 6H2O 2H3PO4 + 3(CaSO4, 2H2O)
Cette réaction globale est en fait la résultante de deux réactions successives qui sont comme suit:
– Réaction de solubilisation de phosphate dans l’acide phosphorique qui
donne une solution de phosphate monocalcique.
Ca3(PO4)2 + 4H3PO4 aq 3Ca(H2PO4)2 aq
– Puis, cristallisation du phosphogypse par réaction de l’acide sulfurique sur
la solution monocalcique.
33
Tableau I.5 : Procédés de fabrication d’acide phosphorique par voie humide. Type de procédé de fabrication Température de cristallisation du phosphogypse en °C Teneur en dans produit Anhydre (n = 0) 110-130 40-50 % Hémihydrate (n = ) 85-100 40-50 % Dihydrate (n = 2) 70-85 26-32 % Hémihydrate- Dihydrate 80-100 26-30 % Dihydrate -Hémihydrate 65-70 35-40%
I.4/ Nature des impuretés dans l’acide phosphorique et le phosphogypse
Le procédé humide utilisé pour la production de l'acide phosphorique comporte trois étapes principales:
– Acidulation ou attaque de la roche de phosphate par l'acide sulfurique.
– Filtration pour séparer les solides, particulièrement le phosphogypse de l'acide
(30 % P2O5).
– Concentration, par évaporation, de l'acide filtré pour engendrer une solution
de concentration variant entre 52 et 54% en masse de P2O5.
La réaction globale qui a lieu entre la fluorapatite et l'acide sulfurique est exprimée comme suit :
Ca10(PO4)6F2 + 10H2SO4 + 10nH2O 10(CaSO4,nH2O) + 6H3PO4 + 2HF
D’après cette réaction nous remarquons que les impuretés de la roche phosphatée se partagent entre l’acide phosphorique et le phosphogypse.
I.4.1/ Impuretés dans l’acide phosphorique
Selon le procédé de fabrication, il peut exister des réactions secondaires comme suit :
– Le fluorure d'hydrogène réagit avec de la silice active présente pour former le
34
– Le SiF4 peut se volatiliser ou subir une hydrolyse pour donner l'acide
fluosilicique, selon la réaction suivante : 3SiF4 + 2H2O→2H2SiF6 + SiO2
– Le fluor peut aussi former des composés insolubles tels que le Na2SiF4 et le
K2SiF4 qui précipitent du système. Les composés fluorés peuvent aussi subir
d'autres réactions avec d'autres espèces présentes.
– L'acide sulfurique réagit aussi avec les oxydes des métaux lourds présents,
pratiquement Dans toute roche de phosphate. A titre d'exemple, les cas du fer et de l'aluminium peuvent être exprimés comme suit :
Fe2O3 + 3H2SO4→Fe2(SO4)3 + 3H2O
Al2O3 + 3H2SO4→Al2(SO4)3 + 3H2O
L’attaque acide des phosphates solubilise, partiellement ou totalement, les impuretés organiques et inorganiques qu’ils contiennent. Ces impuretés affectent par la suite la couleur, la densité et la viscosité de l’acide phosphorique.
– Les impuretés organiques sont généralement présentes sous forme de
suspensions colloïdales. Ainsi, l’acide phosphorique contenant ces matières organiques est noir ou brun, et celui n’en contenant pas est vert.
– Les impuretés inorganiques contiennent des cations métalliques qui peuvent
être valorisés en tant que sous-produits (U, V, Ti …) ou qu’il convient d’éliminer parce qu’ils constituent un danger pour l’environnement (Cd, Zn, Cu, Mo, Se, As…) par suite de l’utilisation des engrais phosphatés. La séparation de ces éléments, directement à partir des phosphates, est souvent difficile et onéreuse, voire impossible pour certains [49, 50]. Néanmoins, lors de la fabrication de l’acide phosphorique par attaque acide des phosphates, leurs majeures parties se retrouvent dans la solution phosphorique et à ce stade, ils deviennent plus faciles à les séparer.
Le tableau I.6 représente les teneurs moyennes des différents éléments contenus dans le cas du phosphate marocain de Youssoufia.
35
Tableau I.6 : Teneur moyenne en ppm des divers éléments métalliques du
phosphate de Youssoufia [47].
Impuretés en éléments métalliques Teneurs en ppm
Arsenic : As 7 Cadmium : Cd 34 Chrome : Cr 306 Cuivre : Cu 28 Strontium : Sr 1300 Thorium : Th 9 Uranium : U 119 Vanadium : V 245 Zinc : Zn 425 Terres rares 460
Plusieurs de ces impuretés précipitent au cours de l’attaque acide. Pour cela, au cours de la production de l’acide phosphorique, la filtration constitue l’étape la plus importante pour obtenir un acide pur. Cependant, ces impuretés gênent cette filtration du fait qu’elle dépend :
– Du taux du solide dans la bouillie. – De la viscosité de l’acide.
– De la nature du sulfate de calcium cristallisé.
De plus, ces impuretés peuvent diminuer la teneur en P2O5 à cause de la
formation du phosphogypse par syncristallisation du phosphore, et la présence de plusieurs composés organiques sous forme de boues [47].
I.4.2/ Impuretés dans le phosphogypse
Il est nécessaire de connaitre la nature et la quantité des éléments secondaires (impuretés) présents dans le phosphogypse avant de l’utiliser dans d’autres procédés.
36
La composition chimique de phosphogypse dépend :
– du type de la roche phosphatée attaquée : les impuretés de la roche
phosphatée se partagent entre l’acide phosphorique et le phosphogypse.
– du procédé utilisé: le procédé dihydrate DH conduit à un phosphogypse
beaucoup plus impur que le procédé hémihydrate HH ou les procédés de recristallisation: hémi-dihydrate HDH, de recristallisation hémihydrate HRC et dihémihydrate DH/HH.
– de la durée de stockage de phosphogypse : Elle influe sur la quantité des
impuretés solubles de phosphogypse à l’eau.
Les impuretés du phosphogypse peuvent être réparties en impuretés solubles, syncristallisées et insolubles [47].
i) Impuretés solubles
Les impuretés solubles sont des sels ou des acides non éliminés lors du lavage.
– le P2O5 soluble sous forme de H3PO4, ou d’ions H2PO4
pouvant se combiner
avec le calcium pour former du phosphate monocalcique Ca(H2PO4)2, H2O.
– le fluor soluble sous forme d’ions SiF6 2−
et F- pouvant se combiner avec les alcalins également présents (ainsi, il est courant de trouver de la malladrite
Na2SiF6 dans le phosphogypse ou bien, plus rarement, NaF, KF, MgSiF6, 6H2O),
ou avec des ions ammonium (NH4F, (NH4)2SiF6). On admet que lors de la
réaction de fabrication d’acide phosphorique, le fluor est dégagé sous forme d’acide fluorhydrique HF qui réagit alors avec la silice pour former du SiF4,
lequel s’hydrolyse en acide fluorosilicique H2SiF6 en solution (phase désormais
peu présente dans le phosphogypse car souvent récupérée lors du procédé de fabrication d’acide phosphorique). Ces composés peuvent réagir lentement sur le phosphogypse en libérant une certaine acidité [34].
37
ii) Impuretés syncristallisées
Les ions SO4
2-
peuvent être facilement substitués, dans le réseau cristallin
du phosphogypse, par certains ions phosphates, en particulier HPO4
ou FPO3
2-car ils ont les mêmes tailles, masses molaires et charges (les ions AlF5
peuvent également prendre la place des ions SO42- lors du procédé de fabrication de
l’acide phosphorique [51].
iii) Impuretés insolubles
Elles représentent la majeure partie des impuretés et sont issues :
du minéral sans transformation pendant l’attaque phosphorique :
L’apatite non attaquée, fluorine : CaF2, silice, carbone organique,
radioéléments, métaux : Fe, Sn, Mg, sous des formes difficilement identifiables (phosphate ou sulfates complexes).
des réactions secondaires dans le milieu d’attaque :
– P2O5 insoluble sous forme de phosphates complexes avec Fe, Al, et alcalins,
brushite: CaHPO4, 2H2O, monétite: CaHPO4, phosphate tricalcique : Ca3(PO4)2,
fluorophosphate de calcium dihydraté: CaFPO3, 2H2O, généralement en très
faible quantité.
– Fluor : ce sont souvent des composés cocristallisés (CaF2, MgF2, K2SiF6,
composés complexes du type chukhrovite: Ca4SO4SiF6AlF6OH, 12H20 ou
cryolithe: Na3AlF6). Les impuretés fluorées insolubles ont une importance
variable : certaines phases sont inertes (CaF2, Na3AlF6).
– impuretés diverses en très faibles concentrations comme des composés
organiques : modificateurs de facies ou floculants introduits lors de la filtration tels que des polyélectrolytes anioniques (comme les polyacrilamides). les impuretés organiques du phosphogypse, caractérisées en général par la teneur en carbone organique, sont difficilement identifiables.
38
– De faibles teneurs en phosphore et fluor soit % P2O5 < 0,4 et % F < 0,4. En ce
qui concerne ces impuretés, évidemment, aucune réglementation n’existe.
– Une faible radioactivité : Les teneurs en éléments radioactifs (et en métaux
lourds) sont soumises à des normes environnementales sur les matériaux de construction.
I.5/ Valorisation du phosphogypse
On peut réutiliser le phosphogypse par la valorisation de quelques procédés industriels. Parmi ces procédés on trouve :
Industrie du plâtre
L’utilisation du phosphogypse dans l’industrie plâtrière ne nécessite pas de broyage comme c’est le cas pour le gypse naturel, mais par contre, il est
nécessaire d’éliminer les impuretés solubles qu’il contient (fluor, P2O5, matière
organique). Une faible quantité de ces impuretés affecte le temps de prise et la résistance.
Fabrication du ciment Portland
Le ciment est un mélange de silicate, d’aluminate et d’aluminoferrités.
Ainsi en absence de gypse, les aluminates tricalciques (C3A) durcissent
spontanément en contact de l’eau conduisant à une fausse prise. En effet, le gypse est utilisé dans l’industrie des ciments en tant qu’ajout (à raison d’environ 5 %) pour régulariser leur prise hydraulique.
Production d’acide sulfurique et de ciment
Le procédé consiste à réduire dans une première phase le gypse en sulfure de calcium. Dans une deuxième phase, le sulfure de calcium réagit avec le gypse pour donner lieu à la formation d’oxyde de calcium et de dioxyde de soufre. Le gaz contenant le dioxyde de soufre est utilisé dans la production d’acide sulfurique alors que l’oxyde de calcium sert à fabriquer du clinker après ajout d’autres additifs (sable et argile).
39
Matériaux de construction
Un potentiel futur d’utilisation de phosphogypse non purifié comme matériau de construction apparaît dans la fabrication de briques et de blocs produits par procédés de compactage statique.
Utilisation en construction routière
Le phosphogypse a été utilisé en France pour la fabrication d’un activant qui porte le nom de ‘gypsonat’ utilisé en technique routière. Cet activant est une combinaison de gypse et d’une base forte (soude ou chaux ou potasse). La formule la plus utilisée est celle correspondant à 7 % de soude. Cependant, les dépenses énergétiques nécessaires au séchage du phosphogypse sont si élevées que la fabrication de ‘gypsonat’ à partir de phosphogypse a été abandonnée au profit d’un procédé par voie sèche utilisant le gypse naturel broyé.
Utilisation en agriculture:
– Comme engrais
Le gypse naturel a été depuis longtemps utilisé comme fertilisant dans plusieurs cultures (légumineuses, blé, …).
– Réhabilitation de sols salins
Les sols salins sont impropres à la culture. Une fois traités au sulfate de calcium, ils retrouvent des caractéristiques physiques et chimiques convenables.
– Amélioration des sous-sols de sols acides chargés d’aluminium
Des applications en surface de phosphogypse permettent de neutraliser
l’action des ions aluminiques Al 3+, toxiques pour les racines des végétaux.
Autres utilisations
Le phosphogypse peut être utilisé comme charge ou pigment de couchage dans l’industrie du papier. Peut être utilisé aussi comme adjuvant de pressage des pulpes [52].
40
I.6/ Méthodes de purification de l’acide phosphorique
Comme l’acide phosphorique contient plusieurs impuretés ceci exige une purification pour avoir un acide pur. C’est pour cette raison quelques méthodes d’éliminations des impuretés sont citées, ou plus correctement les méthodes de purifications de l’acide phosphorique.
I.6.1/ Extraction liquide-liquide
Parmi les méthodes utilisées dans la purification d’acide phosphorique brut, on distingue les procédés basés sur l’extraction liquide-liquide ou par solvant.
L’extraction liquide-liquide consiste à faire passer une espèce chimique d’un solvant duquel il est souvent difficile de l’extraire, à un autre, dont elle est facilement isolable (solvant volatil, appelé solvant d’extraction, éliminé par distillation). Les deux solvants ne doivent pas être miscibles entre eux. Le solvant d’extraction est choisi de telle sorte que l’espèce à extraire y soit beaucoup plus soluble que dans le solvant initial.
Cette extraction correspond à la transformation suivante : Etat initial Etat final
Elle est modélisée par la réaction d’équation : Esolvant1 = Esolvant2, à laquelle
est associée une constante d’équilibre K, appelée coefficient de partage, telle
que : K = [ ]é ,
[ ]é ,
Il s’agit donc de montrer que l’efficacité d’une extraction dépend de la constante d’équilibre K et du fractionnement des extractions (nombre d’extractions réalisées pour un même volume total de solvant d’extraction) [53, 54].
Espèce E: n1 = n0 – x ; Solvant 1, V1
Espèce E : n2 = x Solvant 2, V2
Espèce E: n0 ; Solvant 1, V1
41
Parmi les solvants connus pour l’extraction liquide-liquide utilisée à la purification de l’acide phosphorique, on distingue les dérivés alcoylés de l’acide phosphorique le tributylphosphate (TBP). Un modèle a donné une description satisfaisante de distribution de l’acide phosphorique et de l’eau. La présence des
espèces TBP, H2O; TBP, H3PO4; (TBP) 2, H3PO4, H2O dans la phase organique a
été décelée avec des constantes successives 0, 2130 ; 0, 0294 et 0, 0058. En effet, il s’est avéré que le procédé au tributylphosphate nécessite des débits de solvant importants par rapport au débit du soluté d’acide phosphorique à purifier.
Ceci entraîne comme conséquence de prévoir des installations de très grandes dimensions et donc des investissements particulièrement élevés. Le besoin est d’utiliser les solvants ayant un pouvoir extractant encore plus grand que les dérivés alcoylés, utilisables industriellement et qui permettent d’améliorer le rendement du procédé [55].
I.6.2/ Flottation
La flottation est probablement l’une des technologies ayant le plus marqué
le 20ème siècle dans le domaine minier. Elle est sans aucun doute la technique la
plus importante pour la récupération et la concentration des minerais.
La flottation est surtout utilisée pour épurer les rejets industriels contenant huiles, graisses, fibres et autres contaminants légers. Cependant, elle constitue également un procédé efficace d’épaississement d’une boue activée.
La flottation est une technique très intéressante au niveau de ses applications environnementales. En effet, de nombreux contaminants inorganiques de nature métallique comme le cuivre, le zinc ou le plomb peuvent être facilement concentrés par le principe de la flottation.
L’application à l’acide phosphorique industriel se révèle médiocre car le rendement d’élimination est souvent faible (inférieur à 10% de la teneur initiale) [56].
42
I.6.3/ Précipitation chimique
La précipitation chimique consiste à la formation par action de réactifs appropriés de composés insolubles des éléments indésirables contenus dans une solution.
Dans le traitement des eaux usées, la précipitation est utilisée pour l’élimination des phosphates et des métaux lourds. Ces derniers sont précipités généralement sous forme d’hydroxydes par addition de soude ou de chaux jusqu’au pH de solubilité minimum [57]. En pratique il faut tenir compte d’autres facteurs tels que:
– Le coût du réactif où sur ce plan les carbonates et les hydroxydes ne peuvent
pas être concurrencés.
– La toxicité du réactif dont un excès se retrouvera inévitablement dans les eaux
et où dans ces cas les sulfures sont défavorisés.
– La séparation du précipité qui est généralement médiocre pour tous les
procédés, et ne peut s’effectuer qu’à l’aide de polyélectrolytes.
– Le pH intervient dans la plus part de ces réactions de précipitation de sorte
que le minimum de solubilité n’est pas atteint au même pH pour tous les métaux, ce qui complique l’épuration des eaux contenant plusieurs métaux [58].
La purification de l’acide phosphorique basée sur la précipitation, consiste à précipiter les métaux lourds contenus dans l’acide dans des conditions thermodynamiques bien appropriées.
Cette technique n’a pas connu une réalisation industrielle vue la complexité de la technologie demandée (réacteurs, filtres, agitateurs…). En effet, cette technique nécessite des coûts importants à l’investissement et à la maintenance. Par conséquent, le prix de revient de cet acide sera élevé.
La solution acide à traiter est soumise au cours d’une première étape à l’action d’un composé sulfuré soluble qui forme avec les métaux lourds