Associations entre les apports en légumes et fruits et la présence
d'altérations glycémiques chez les femmes avec un antécédent de diabète
gestationnel
Mémoire
Roxanne Mercier
Maîtrise en nutrition
Maître ès sciences (M. Sc.)
Québec, Canada
© Roxanne Mercier, 2018
Associations entre les apports en légumes et fruits
et la présence d'altérations glycémiques chez les
femmes avec un antécédent de diabète gestationnel
Mémoire
Roxanne Mercier
Sous la direction de :
Julie Robitaille, directrice de recherche
iii
Résumé
Les femmes avec un antécédent de diabète gestationnel (DbG) sont plus à risque de diabète de type 2 (DbT2). Ainsi, certaines études se sont intéressées aux associations entre les apports alimentaires et le risque de DbT2 en période post-partum chez cette population. Par contre, à notre connaissance, aucune étude n’a évalué ces associations avec les apports en légumes et fruits (LF) chez ce groupe. Ainsi, l’objectif général de ce projet de maîtrise est d’évaluer l’association entre la consommation de LF et la présence d’altérations glycémiques chez les femmes avec un antécédent de DbG. Pour ce faire, les apports alimentaires en LF ont été évalués entre les femmes présentant ou non une altération glycémique et l’association entre les apports en LF, en légumes et en fruits et la présence d’altération glycémique a été établie. Les analyses ajustées pour l’âge et l’indice de masse corporelle (IMC) ont démontré que les femmes avec une altération glycémique avaient des apports inférieurs en LF et en légumes et non en fruits comparativement aux femmes sans altération glycémique. En considérant les mêmes cofacteurs, les résultats ont démontré que des apports supérieurs en LF et en légumes étaient associés à un risque inférieur d’avoir une altération glycémique, mais les résultats n’étaient pas significatifs pour les fruits. Bref, des apports supérieurs en LF sont associés à un risque inférieur de présenter une altération glycémique chez les femmes avec un antécédent de DbG. Ces résultats semblent davantage être associés aux apports en légumes. Ces analyses ajoutent à la littérature limitée chez cette population à risque et orientent vers des possibles pistes d’action afin de préciser les recommandations nutritionnelles en période post-partum. Des études d’intervention sur la prévention du DbT2 chez cette clientèle sont maintenant essentielles pour établir les liens de causalité et pour objectiver leurs effets à long terme.
iv
Abstract
Women with prior gestational diabetes mellitus (GDM) are at higher risk of type 2 diabetes (T2D). Therefore, some studies have investigated the association between dietary intake and the risk of T2D in the postpartum period in this population. However, to our knowledge, no studies have evaluated this association with fruit and vegetables (FV) intake in this group. Thus, the general objective of this master’s project is to evaluate the association between FV intake and the presence of glycemic alterations in women with prior GDM. For this purpose, dietary FV intake were assessed in women with and without glycemic alterations and the association between FV, vegetables and fruit intake and the presence of glycemic alterations was evaluated. Adjusted analyses for age and body mass index (BMI) demonstrated that women with glycemic alterations had lower FV and vegetables intake, but not fruit intake compared to women without glycemic alterations. Considering the same cofactors, the results demonstrated that higher intake of FV and vegetables were associated with a lower risk of having glycemic alterations, but the results were not significant for fruits. In summary, higher intake of FV are associated with a lower risk of having glycemic alterations in women with prior GDM. These results appear to be more associated with vegetables intake. Theses analyses add to the limited literature in this higher risk population and possibly help to clarify the nutritional recommendations in the postpartum period. Interventional studies on T2D prevention in this group are now essential to establish a causal relationship and to objectify long-term effects.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières... v
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations et des sigles ... ix
Remerciements ... xi Avant-propos... xiii Chapitre 1 : Introduction ... 1 Chapitre 2 : Problématique ... 3 1. Diabète gestationnel ... 3 1.1 Définition ... 3 1.2 Diagnostic ... 3 1.3 Prévalence ... 7 1.4 Facteurs de risque ... 8
1.4.1 Surplus de poids ou obésité de la mère ... 8
1.4.2 Âge de la mère ... 9
1.4.3 Ethnicité ... 10
1.4.4 Antécédent personnel de diabète gestationnel ... 11
1.4.5 Syndrome des ovaires polykystiques ... 11
1.4.6 Facteurs nutritionnels ... 12
1.5 Conséquences pendant la grossesse et lors de l’accouchement ... 14
1.5.1 Chez les enfants ... 14
1.5.2 Chez les mères ... 15
1.6 Conséquences sur la santé à long terme ... 16
1.6.1 Chez les enfants ... 16
1.6.1.1 Diabète de type 2 ... 16
1.6.1.2 Obésité ... 16
1.6.2 Chez les mères ... 17
1.6.2.1 Maladies cardiovasculaires ... 17
1.6.2.2 Syndrome métabolique ... 18
1.6.2.3 Diabète de type 2 ... 19
vi
1.8 Prévention du diabète de type 2 chez les femmes avec un antécédent de diabète
gestationnel ... 23 1.8.1 Alimentation ... 23 1.8.1.1 Profils alimentaires ... 23 1.8.1.2 Aliments et nutriments ... 25 1.8.1.2.1 Légumes et fruits... 27 1.8.2 Allaitement ... 29 1.8.3 Activité physique ... 30
1.8.4 Interventions sur les saines habitudes de vie ... 31
Chapitre 3 : Objectifs et hypothèses de recherche ... 33
Chapitre 4 : Description de la population à l’étude ... 35
Chapitre 5 : Associations entre les apports en légumes et fruits et la présence d’altérations glycémiques chez les femmes avec un antécédent de diabète gestationnel ... 36
Chapitre 6 : Discussion générale et conclusion ... 56
vii
Liste des tableaux
Chapitre 2
Tableau 1. Critères diagnostiques du syndrome métabolique Adapté des Lignes
directrices de l’ACD de 2013 (1) ... 19 Chapitre 5
Table 1. Subject characteristics of women with prior GDM by their current glycemic
profile ... 48
Table 2. Nutritional intake of women with prior GDM with NGT and with AGT for
energy and FV intake ... 49
Table 3. OR (95% CI), per one serving increase, of having AGT according to FV,
viii
Liste des figures
Chapitre 2
Figure 1. Approche de dépistage alternative de l’ACD pour le DbG effectuée en une
seule étape dans les Lignes directrices de 2013 (1) ... 5
Figure 2. Approche de dépistage privilégiée de l’ACD pour le DbG effectuée en deux
étapes dans les Lignes directrices de 2013 (1) ... 6
Figure 3. Prévalence du DbG dans le monde Tiré et adapté de Zhu et Zhang (50) ... 8 Figure 4. Incidence de DbT2 chez les femmes avec un antécédent de DbG selon
ix
Liste des abréviations et des sigles
A1C: Hémoglobine glyquée (Glycated hemoglobin) ACD : Association canadienne du diabète
ACOG : Collège américain des obstétriciens et gynécologues (American College of
Obstetricians and Gynecologists)
ADA : Association américaine du diabète (American Diabetes Association) AGT : Tolérance au glucose anormale (Abnormal glucose tolerance)
aHEI : Indice de la qualité alimentaire alternatif (Alternate Healthy Eating Index) aMED : Diète méditerranéenne alternative (Alternate Mediterranean diet) BMI : Indice de masse corporelle (Body mass index)
CDA : Association canadienne du diabète (Canadian Diabetes Association) CFG : Guide alimentaire canadien (Canada’s Food Guide)
CHUL : Centre Hospitalier de l’Université Laval
DASH : Approche alimentaire pour arrêter l’hypertension (Dietary Approaches to Stop
Hypertension)
DbG : Diabète gestationnel DbT1 : Diabète de type 1 DbT2 : Diabète de type 2
FFQ : Questionnaire de fréquence alimentaire (Food frequency questionnaire) FV : Légumes et fruits (Fruit and vegetables)
GAC : Guide alimentaire canadien
GDM : Diabète gestationnel (Gestational diabetes mellitus)
HAPO : Hyperglycémie et effets indésirables lors de la grossesse (Hyperglycemia and
Adverse Pregnancy Outcomes)
HbA1c : Hémoglobine glyquée
HGPO : Hyperglycémie provoquée par voie orale
HOMA-IR : Modèle d’homéostasie de la résistance à l’insuline (Homeostasis model
assessment of insulin resistance)
HR : Rapport des risques instantanés (Hazard ratio) IC : Intervalle de confiance
IFG : Anomalie de la glycémie à jeun (Impaired fasting glucose) IGI : Indice insulinogène (Insulinogenic index)
IGT : Intolérance au glucose (Impaired glucose tolerance) IMC : Indice de masse corporelle
INAF : Institut sur la nutrition et les aliments fonctionnels IOM : Institut de médecine (Institute of Medicine)
IPAQ: Questionnaire international sur l’activité physique (International Physical Activity
Questionnaire)
LCD : Diète faible en glucides (Low carbohydrate-diet) LF : Légumes et fruits
MCV : Maladies cardiovasculaires
MED : Diète méditerranéenne (Mediterranean diet)
NGT : Tolérance au glucose normale (Normal glucose tolerance) NIH : Instituts nationaux de la santé (National Institutes of Health)
x
OGTT : Test oral de tolérance au glucose (Oral glucose tolerance test) OMS : Organisation Mondiale de la Santé
OR : Rapport de chances (Odds ratio)
QFA : Questionnaire de fréquence alimentaire RR : Risque relative (Relative risk)
SD : Écart-type (Standard deviation) SM : Syndrome métabolique
SOPK : Syndrome des ovaires polykystiques T2D : Diabète de type 2 (Type 2 Diabetes)
xi
Remerciements
L’ensemble de ces travaux de maîtrise n’aurait pas été possible sans l’encadrement, le soutien et la confiance de plusieurs personnes. Tout d’abord, mes remerciements vont à tous les membres de mon équipe de recherche.
Mes premiers mots s’adressent à ma directrice de recherche, Julie Robitaille. En effet, j’ai senti que j’étais à ma place dès mon emploi comme auxiliaire de recherche au baccalauréat. Julie m’a toute de suite démontré sa confiance en me confiant des tâches très importantes et valorisantes pour une étudiante en me laissant rédiger des documents d’interventions nutritionnelles. Cette confiance s’est poursuivie lors de ma maîtrise. Julie m’a laissé choisir le sujet qui me passionnait au sein de l’équipe de recherche et m’a toujours bien encadrée pour la suite. Merci Julie pour ta patience, ton écoute, ton humanité, ta bonne humeur et ton professionnalisme.
Je tiens aussi à remercier tous les autres membres de l’équipe extraordinaire. Julie Perron qui est une professionnelle de recherche et une femme exceptionnelle. Elle a toujours su bien m’éclairer dans mes moments de questionnements et de doutes. Toujours positive, proactive et très efficace, Julie a été une personne clé dans le bon déroulement de ma maîtrise. Je tiens aussi à remercier les autres étudiantes de l’équipe, soit Camille Dugas, Michèle Kearney et Mélissa Bélanger. Merci les filles pour les discussions très enrichissantes sur notre sujet de recherche et aussi pour les autres sujets! Travailler tous les jours à vos côtés a été très plaisant et enrichissant. J’espère que l’on trouvera des occasions pour continuer à se voir et à partager de bons moments ensemble.
Je remercie également mon codirecteur Dr Weisnagel qui a toujours été présent pour donner des commentaires et des suggestions toujours très constructifs pour mon projet. Je tiens également à remercier tous les organismes subventionnaires qui ont permis le bon déroulement de mes études graduées. Je remercie Diabète Québec pour m’avoir offert à deux reprises la bourse d’été pour les étudiants. Je tiens aussi à remercier les organismes ayant subventionné le projet de recherche GDM, soit les Fonds de Recherche du
Québec-xii
Santé et les Instituts de recherche en santé du Canada, qui m’ont permis d’avoir des données extraordinaires pour mes analyses.
Je tiens aussi à remercier toute la communauté INAFienne avec laquelle j’ai aussi beaucoup de plaisir à travailler et à discuter tous les jours. Vous m’avez permis de me développer dans un environnement toujours agréable et où la discussion et le partage sont toujours enrichissants.
Aussi, je tiens à remercier toute ma famille et mes amis pour leur soutien et leur encouragement au cours de mes études graduées. Mes parents qui ont toujours cru en moi et qui m’ont dit de « foncer » dans la vie. Ma sœur, mon beau-frère, mon frère, ma belle-sœur ainsi que mes trois neveux et nièces qui m’ont toujours encouragée dans mes études et m’ont permis de me changer aussi les idées à plusieurs reprises. J’ai fini de chercher! Je tiens aussi à remercier tous mes amis qui sont toujours là pour moi! Merci pour vos encouragements et votre compréhension de mon horaire chargé. Finalement, je tiens à remercier mon amoureux qui m’a toujours épaulée dans mes décisions et choix de vie. Toujours positif, constructif et fonceur, il me permet de toujours viser à devenir une personne meilleure.
xiii
Avant-propos
L’ensemble des réalisations de ce mémoire a été effectué au sein de l’équipe de recherche du Dre Julie Robitaille. J’ai d’ailleurs eu l’opportunité de travailler au sein de l’équipe avant mes études graduées comme auxiliaire de recherche lors de l’été de ma troisième année au baccalauréat. Pendant cette période, j’ai participé au recrutement et aux rencontres des participants du projet de recherche en plus d’aider à la saisie et à l’analyse des données. Au cours de ma maîtrise, j’ai eu la chance de présenter mes résultats de recherche à plusieurs congrès scientifiques en plus de rédiger un article scientifique. Celui-ci est présenté au chapitre 5 et a été soumis à la revue European Journal of
Nutrition le 9 novembre 2017 et des révisions doivent être faites suite à l’évaluation par
les pairs. Pour cet article, je suis l’auteure principale étant donné que j’ai participé au recrutement, aux rencontres et à la saisie des données et que j’ai effectué l’ensemble des analyses et la rédaction du manuscrit. Pour les coauteurs, ils ont tous révisé l’article avant sa soumission. Dre Julie Robitaille est la chercheure principale du projet et a développé son devis et sa planification. Julie Perron a coordonné le projet concernant le recrutement et les rencontres des participants en plus de la saisie et l’analyse des données. De son côté, Dr S. John Weisnagel a participé à l’élaboration du projet en plus de transmettre les noms de femmes ayant fait du DbG par ses dossiers patients du Centre Hospitalier de
l’Université Laval (CHUL), CHU de Québec. L’article inséré au chapitre 5 peut différer
1
Chapitre 1 : Introduction
Le diabète gestationnel (DbG) est défini comme une intolérance au glucose qui se manifeste ou qui est dépistée pour la première fois lors de la grossesse (1,2). Selon les critères diagnostiques utilisés, la prévalence canadienne du DbG est estimée entre 10 et 28% (1,3-5). Cette complication a des conséquences lors de la grossesse et l’accouchement, mais également sur la santé des mères et des enfants plus tard dans la vie. En effet, les enfants exposés au DbG sont plus à risque de diabète de type 2 (DbT2) (6-8) et d’obésité au cours de leur vie (9-12). De leur côté, les femmes avec un antécédent de DbG sont plus à risque de développer des maladies cardiovasculaires (MCV) (13-15), un syndrome métabolique (SM) (16) et un DbT2 (17,18). Plus précisément, une méta-analyse de 2009 a constaté que les femmes avec un antécédent de DbG étaient sept fois plus à risque de développer un DbT2 comparativement aux femmes sans complication (17). D’ailleurs, différents facteurs de risque ont été identifiés pour le développement d’un diabète post-partum chez cette clientèle, dont un indice de masse corporelle (IMC) élevé, un âge avancé et l’utilisation de l’insuline lors de la grossesse (19).
Considérant l’ensemble de ces conséquences post-partum, certaines organisations et associations recommandent un suivi glycémique à la suite de l’accouchement. C’est le cas de l’Association canadienne du diabète (ACD) qui recommande aux femmes d’effectuer un test d’hyperglycémie provoquée par voie orale (HGPO) entre six semaines et six mois après l’accouchement (1). Par contre, peu de femmes effectuent ce type de suivi suite à leur grossesse (20). Plusieurs barrières à effectuer ce test post-partum ont d’ailleurs été identifiées comme le manque de temps et les contraintes face à l’arrivée d’un nouvel enfant (21,22).
Face à tous ces enjeux, il est essentiel de trouver des stratégies d’intervention pour prévenir ces conséquences au sein de cette population à risque. Par contre, actuellement, les recommandations en période post-partum sont très générales. En effet, il est préconisé d’avoir une saine alimentation, d’effectuer de l’activité physique, d’allaiter et de conserver un poids santé ou de viser une perte de poids lors d’un excès (1,2,23). Aucune recommandation nutritionnelle précise n’a été émise pour ces femmes à risque.
2
Dans le but de préciser les approches nutritionnelles, certaines études se sont intéressées à l’association entre les apports alimentaires et le développement du DbT2 post-partum chez les femmes ayant eu un DbG. Une étude a d’ailleurs évalué l’effet de certains profils alimentaires, outils utilisés pour évaluer l’alimentation globale, sur le développement du DbT2 dans le temps (24). Ces auteurs ont constaté qu’une adhésion plus grande aux scores méditerranéen alternatif (alternate Mediterranean diet, aMED), à l’Approche alimentaire pour arrêter l’hypertension (Dietary Approaches to Stop Hypertension, DASH) et à l’Indice de la qualité alimentaire alternatif (alternate Healthy Eating Index, aHEI) était associée à une diminution du risque de DbT2 chez ces femmes (24). Ces profils alimentaires ont, entre autres, en commun des apports supérieurs en légumes, en fruits et en poissons et des apports faibles en viandes rouges (24). Par contre, à notre connaissance, aucune étude n’a évalué spécifiquement les associations entre la consommation de légumes et fruits (LF) et le développement du DbT2 chez cette population. De plus, les résultats au sein de la population générale démontrent des résultats contradictoires (25-27). Les résultats présentés au chapitre 5 ajoutent d’ailleurs à l’absence de cette littérature scientifique chez cette clientèle spécifique.
Ainsi, l’objectif général de ce projet de maîtrise vise à établir l’association entre la consommation de LF et la présence d’altérations glycémiques au sein d’une population de femmes avec un antécédent de DbG. Les apports alimentaires ont donc été documentés en plus d’évaluer leur association au sein des femmes ayant développé ou non une altération glycémique. Le chapitre 2 de ce mémoire présente l’ensemble de la problématique associée au DbG. Les facteurs de risque, les conséquences chez les mères et les enfants à différentes périodes ainsi que les pistes d’action sur les habitudes de vie pour prévenir le DbT2 sont tous des aspects détaillés dans cette section.
3
Chapitre 2 : Problématique
1. Diabète gestationnel
1.1 Définition
Le DbG est défini comme une intolérance au glucose qui se manifeste ou qui est dépistée pour la première fois pendant la grossesse (1,2). Celui-ci diffère d’un diabète préexistant à la grossesse, c’est-à-dire lorsque la femme a déjà un diagnostic de diabète avant la grossesse, comme un diabète de type 1 (DbT1) ou DbT2. En fait, une résistance à l'insuline se produit à un certain degré lors de toutes les grossesses (28,29). Cette résistance débute au milieu de la grossesse et s’accentue lors du troisième trimestre pour atteindre des niveaux semblables aux personnes atteintes du DbT2 (29). Cette résistance à l’insuline est due, entre autres, à l’augmentation de l’adiposité maternelle et aux hormones du placenta qui induisent une diminution de la sensibilité à l’insuline (29). Ainsi, lors d’un processus normal, les cellules β du pancréas augmentent la sécrétion d’insuline pour contrer cette résistance créée par la grossesse (29). Par contre, les femmes dont la sécrétion d’insuline ne peut compenser suffisamment l’augmentation de la résistance à l’insuline développent le DbG, démontrant un défaut de la réponse des cellules β et de la sensibilité à l’insuline (29-32). Cette altération métabolique se manifeste par une hyperglycémie lors de la grossesse (29).
1.2 Diagnostic
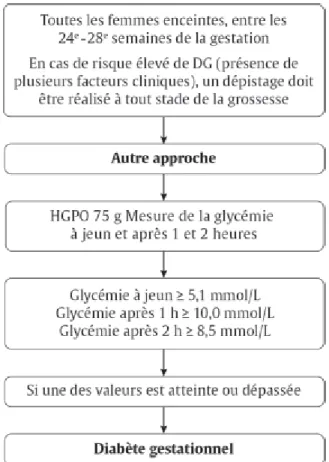
Actuellement, il existe deux principales approches préconisées pour le diagnostic du DbG lors de l’utilisation d’un test d’HGPO (1). En effet, celui-ci peut s’effectuer en une seule ou en deux étapes, comme illustré aux figures 1 et 2. Lorsque l’approche en une seule étape est préconisée, le test d’HGPO s’effectue avec 75 grammes de glucose (Figure 1). Cette approche est, entre autres, préconisée par l’International Association of Diabetes
and Pregnancy Study Groups et par l’Organisation mondiale de la Santé (OMS) (33,34).
L’ACD mentionne également cette approche comme alternative. Les différentes valeurs cibles lors de ce test ont été établies selon les associations observées entre les niveaux de glucose sanguin des femmes et les conséquences négatives reliées à la grossesse lors de
4
l’étude Hyperglycemia and Adverse Pregnancy Outcomes (HAPO) de 2008 (33,35,36). La deuxième approche possible pour diagnostiquer le DbG s’effectue en deux étapes (Figure 2). Un premier test d’HGPO d’une heure avec 50 grammes de glucose est effectué. Si celui-ci démontre des résultats positifs, un deuxième test avec 75 ou 100 grammes est effectué. Cette approche est préconisée par le National Institutes of Health (NIH) (35), l’American College of Obstetricians and Gynecologists (ACOG) (37) et l’ACD (1).
Il existe différentes raisons qui motivent une organisation à privilégier l’une des deux approches. Le manque d’études cliniques démontrant les bénéfices de l’approche en une seule étape, le fait que les résultats sont principalement chez des femmes caucasiennes et les conséquences associées d’un dépistage plus grand, dont une augmentation des coûts et des interventions, sont les principales raisons pour justifier l’approche à deux étapes (1,35,38-40). D’un autre côté, l’approche en une seule étape préconise des critères plus stricts pour prévenir davantage les complications liées à la grossesse (41). Comme mentionné, en utilisant les critères diagnostiques de l’International Association of
Diabetes and Pregnancy Study Groups plus sévères, cela augmente la prévalence du
DbG. En effet, une seule valeur anormale est suffisante pour établir un diagnostic positif comparativement à deux valeurs lors de l’approche en deux temps (2,42). À cet effet, certaines études ont documenté une augmentation de la prévalence du DbG de 1,3 à 2,5 fois lorsque les critères diagnostiques de l’International Association of Diabetes and
5
Figure 1. Approche de dépistage alternative de l’ACD pour le DbG effectuée en une
seule étape dans les Lignes directrices de 2013 (1)
Reproduit de Lignes directrices de pratique clinique 2013 de l’Association canadienne du diabète pour la prévention et le traitement du diabète au Canada, Volume 37 Supplément 5, Comité d’experts des Lignes directrices de pratique clinique 2013 de l’Association canadienne du diabète, Diabète et grossesse, Page S557, Copyright (2013), avec la permission de l’éditeur Elsevier
6
Figure 2. Approche de dépistage privilégiée de l’ACD pour le DbG effectuée en deux
étapes dans les Lignes directrices de 2013 (1)
Reproduit de Lignes directrices de pratique clinique 2013 de l’Association canadienne du diabète pour la prévention et le traitement du diabète au Canada, Volume 37 Supplément 5, Comité d’experts des Lignes directrices de pratique clinique 2013 de l’Association canadienne du diabète, Diabète et grossesse, Page S556, Copyright (2013), avec la permission de l’éditeur Elsevier
7
De plus, le dépistage du DbG peut s’effectuer de façon systématique ou peut être basé sur différents facteurs de risque, aspect approfondi à la section 1.4 (40). Par contre, une méta-analyse de 2017 regroupant 29 études a constaté que le dépistage basé sur les facteurs de risque ne semble pas être efficace pour identifier les femmes avec un DbG (48). Un dépistage systématique serait donc plus efficace pour cibler toutes les femmes ayant cette problématique. À l’heure actuelle, au Québec, l’approche utilisée est celle privilégiée par l’ACD, soit un diagnostic en deux étapes, et le dépistage est effectué systématiquement chez toutes les femmes entre la 24e et 28e semaine de grossesse.
1.3 Prévalence
La prévalence du DbG varie selon les différentes régions du globe. Dans le monde, il est estimé qu’entre 2 et 25% des grossesses présentes cette complication, comme illustré à la figure 3 selon les différents pays (49,50). Évidemment, cette variation est majoritairement due aux différentes origines ethniques au sein des populations, aspect approfondi dans la section 1.4.3 des facteurs de risque (49,51). Cet écart est aussi conséquent au type de dépistage, qu’il soit systématique ou non, la nature de l’étude, qu’elle soit rétrospective ou prospective, et la source des données utilisées (49,50).
En outre, au niveau mondial, plusieurs études constatent une augmentation du DbG au cours des dernières années. Par exemple, une étude rétrospective américaine chez plus de trois millions de femmes avec un DbG a constaté une augmentation de la prévalence de 5,5% entre 1979 et 2010 (0,3 et 5,8%, respectivement) (52). Ce nombre croissant s’explique, entre autres, par l’augmentation de l’obésité au sein de la population mondiale, un facteur de risque important du DbG comme détaillé à la section 1.4.1. En outre, de plus en plus d’organisations utilisent les critères de l’International Association
of Diabetes and Pregnancy Study Groups en une seule étape ce qui augmente aussi la
prévalence, comme mentionné précédemment (47). Cette croissance est aussi liée à une maternité généralement plus tardive, à l’augmentation de la sédentarité ainsi qu’une croissance de l’immigration des populations d’origines ethniques plus à risque (49). Au Canada, la prévalence du DbG est estimée entre 2,5 et 6% des grossesses selon les critères actuels utilisés (1,18,53-57). Par contre, en considérant ceux de l’International
8
Association of Diabetes and Pregnancy Study Groups (36), la prévalence canadienne
augmente entre 10 et 28% (1,3-5).
Figure 3. Prévalence du DbG dans le monde Tiré et adapté de Zhu et Zhang (50)
Traduit avec la permission de Springer Nature License : Springer, Current Diabetes Reports, Prevalence of Gestational Diabetes and Risk of Progression to Type 2 Diabetes : a Global Perspective, Zhu Y et Zhang C, Copyright (2016)
1.4 Facteurs de risque
1.4.1 Surplus de poids ou obésité de la mère
Il existe différents facteurs de risque du DbG. Un de ceux-ci est le surplus de poids ou l’obésité de la mère avant la grossesse. À cet effet, une méta-analyse de 70 études (59 études de cohorte et 11 de cas-témoins) a constaté que le risque de développer un DbG était positivement associé à l’IMC pré-grossesse de la mère (58). Les auteurs ont évalué les associations selon différentes catégories d’IMC : non-obèse (IMC entre 20 et 24,9 kg/m2), surplus de poids (IMC entre 25 et 29,9 kg/m2), obésité modérée (IMC entre 30 et 34,9 kg/m2) et obésité sévère (IMC≥35 kg/m2) (58). Au sein des études de cohorte, en comparant avec les femmes de poids normal, les femmes présentant un surplus de poids étaient près de deux fois (Odds ratio (OR)=1,97; 95% intervalle de confiance (IC) 1,77-2,19), celles avec une obésité modérée trois fois (OR=3,01; IC 2,34-3,87) et celles avec
9
une obésité sévère 5,5 fois (OR=5,55; IC 4,27-7,21) plus à risque de développer un DbG, sans ajustement statistique (58). Les résultats restaient semblables au sein des études ayant considéré certains cofacteurs comme l’âge et l’ethnicité (58).
Un autre facteur de risque à considérer est le gain de poids pendant la grossesse. À l’heure actuelle, les recommandations de gain de poids gestationnel sont basées sur celles de l’Institute of Medicine (IOM) selon l’IMC pré-grossesse de la mère (59). Par contre, aucune recommandation n’a été établie spécifiquement pour les femmes avec un DbG. Ainsi, plusieurs études se sont intéressées à l’association entre le gain de poids gestationnel et le développement du DbG. Une récente méta-analyse, regroupant huit études d’observation auprès de 13 748 sujets, a évalué l’association entre un gain de poids excessif, selon les recommandations de l’IOM, et le développement du DbG (60). Les auteurs ont constaté que les femmes présentant un gain de poids supérieur aux recommandations étaient 40% plus à risque de DbG (OR=1,40; IC 1,21-1,61 sans ajustement) comparativement à celles ne présentant pas de gain de poids excessif (60). L’association restait semblable avec les études ayant ajusté les résultats pour certains cofacteurs, comme l’âge et un antécédent de DbG (OR=1,42; IC 1,20-1,68) (60). Une récente étude californienne a également évalué l’association entre le développement du DbG et le gain de poids par semaine au sein d’une étude cas-témoin imbriquée chez 345 femmes avec un DbG et 800 femmes sans DbG (61). Les auteurs ont observé que les femmes ayant eu un gain de poids entre 0,27 et 1,9 kg par semaine au cours du premier trimestre étaient 82% plus à risque de DbG (OR ajusté=1,82; IC 1,24-2,70) comparativement à celles ayant perdu ou pris peu de poids (intervalle de -1,0 à 0,06 kg par semaine) au cours de la même période (61). Ainsi, il est possible de constater que la prévention du DbG peut cibler le poids des femmes, soit avant la grossesse ou encore un gain de poids optimal lors de celle-ci.
1.4.2 Âge de la mère
Un autre facteur de risque de développer un DbG est l’âge de la mère. Une étude populationnelle allemande chez plus de 640 000 femmes, dont près de 15 000 avec un DbG a d’ailleurs observé que le risque de celui-ci augmentait avec l’âge de la mère (62).
10
Comparativement aux femmes âgées de moins de 20 ans, les femmes de 20 à 25 ans, celles de 25 à 30 ans, celles de 30 à 35 ans et celles de plus de 35 ans étaient, respectivement, 1,8 fois (OR=1,761; IC 1,465-2,118), 2,5 fois (OR=2,564; IC 2,140-3,072), 3,5 fois (OR=3,463; IC 2,889-4,150) et 4,7 fois (OR=4,687; IC 3,908-5,620) plus à risque de DbG (62). Une étude précédente suédoise de 2004 avait également observé, au sein d’une base de données médicale de plus 1,5 million d’accouchements, que le risque de DbG augmentait avec l’âge (63). Les femmes âgées de 40 à 44 ans étaient 3,4 fois (OR=3,43; IC 3,04-3,86) et celles de 45 ans et plus 4,7 fois (OR=4,71; IC 2,87-7,73) plus à risque de DbG que les femmes âgées de 20 à 29 ans (63). Bref, le risque de DbG augmente avec l’âge de la mère lors de la grossesse.
1.4.3 Ethnicité
Un facteur de risque supplémentaire du DbG est l’ethnicité de la mère. En effet, les femmes d’origines autres que caucasiennes sont plus à risque de développer cette complication. Une étude publiée en 2013 effectuée aux États-Unis comptant plus d’un million de grossesses entre 2007 et 2009 a rapporté une prévalence du DbG de 5,6% chez les femmes noires non hispaniques, 11,9% chez celles d’origine asiatique, 7,6% chez celles d’origine indienne et 8,4% chez celles d’origine hispanique comparativement à 5,4% chez les femmes blanches non hispaniques (64). Au Canada, une étude populationnelle réalisée en 2012 chez plus d’un million de grossesses, dont plus de 33 000 avec un DbG, a aussi démontré ces disparités ethniques (57). Une prévalence du DbG était de 5,0% chez les femmes d’origine chinoise et de 6,5% chez celles d’origine sud-asiatique comparativement à 2,9% chez les femmes caucasiennes (57). Plusieurs causes peuvent expliquer les différences ethniques observées au sein des populations. La composition corporelle, les habitudes de vie (incluant l’alimentation et l’activité physique), les composantes génétiques, les soins de santé et le statut socio-économique en sont quelques exemples (50,64,65). Ainsi, les femmes caucasiennes représentent un risque inférieur de développer un DbG comparativement à celles d’autres origines ethniques.
11
1.4.4 Antécédent personnel de diabète gestationnel
Un autre facteur de risque du DbG est d’en avoir développé un lors d’une grossesse précédente. En effet, plusieurs études ont démontré un taux important de récurrence chez les femmes avec un antécédent de DbG. Une revue systématique de 2007 a rapporté des taux de récurrence entre 30 et 84% au sein de 13 études (66). Une méta-analyse de 2015 a d’ailleurs observé des résultats semblables avec un taux de récurrence moyen de 48% (IC 41-54%) au sein de 18 études (67). Ces auteurs ont constaté que les femmes caucasiennes non hispaniques avaient un taux de récurrence plus faible (38%; IC 33-44%) que les femmes avec une ethnicité autre (56%; IC 44-68%) (67). D’autres facteurs de risque ont aussi été associés au taux supérieur de récurrence comme l’utilisation d’insuline lors de la grossesse de même que l’IMC de la mère et le gain de poids entre les grossesses (68). Ainsi, les femmes ayant eu un DbG sont plus à risque d’avoir cette complication à nouveau lors d’une grossesse subséquente et des mesures préventives peuvent être adoptées selon les différents facteurs de risque de récurrence identifiés.
1.4.5 Syndrome des ovaires polykystiques
En outre, les femmes avec un syndrome des ovaires polykystiques (SOPK) sont plus à risque de DbG possiblement par l’accentuation de l’état de résistance à l’insuline qui caractérise le SOPK (69). En effet, une méta-analyse de 15 études a constaté que les femmes avec un SOPK étaient près de trois fois plus à risque de DbG (OR=2,89; IC 1,68-4,98) que les femmes sans SPOK (69). Par contre, les auteurs restent prudents face aux conclusions de l’article étant donné l’hétérogénéité entre les études, dû entre autres aux différentes formes de SOPK, aux caractéristiques des femmes du groupe contrôle ainsi qu’aux différents critères diagnostiques du DbG, rendant difficile la généralisation des résultats de cette méta-analyse à l’ensemble des femmes ayant cette problématique (69). Bref, les femmes avec un SOPK semblent être plus à risque de DbG, mais la littérature demeure limitée.
12
1.4.6 Facteurs nutritionnels
Un facteur de risque modifiable du développement du DbG est l’alimentation de la mère avant et pendant la grossesse. Une récente revue systématique de 21 études observationnelles, dont trois études évaluant les apports alimentaires avant la grossesse, a constaté que certains groupes d’aliments et nutriments étaient associés au développement du DbG (70). En regroupant les différentes études, sans distinguer celles avant ou pendant la grossesse, les auteurs ont constaté que des apports élevés en cholestérol (≥300 mg par jour), en fer hémique (≥1,1 mg par jour), en viandes rouges et transformées (pour chaque augmentation d’une portion par jour) et en œufs (≥7 œufs par semaine) étaient associés à un risque supérieur de DbG (70). L’accroissement des marqueurs inflammatoires et du stress oxydatif est une des hypothèses émises pour expliquer les associations positives observées avec ces aliments (70). D’un autre côté, une alimentation riche en fruits, en légumes, en grains entiers et en poisson de même que faible en grains raffinés et en produits laitiers gras était associée à une diminution du risque de développer cette complication (70). De plus, certaines études ont aussi évalué l’association entre certains profils alimentaires et le DbG. Une adhésion plus élevée aux scores aMED, DASH et aHEI était associée à une diminution du risque de DbG, au sein des études avant ou pendant la grossesse (70,71). Ces profils alimentaires ont, entre autres, en commun des apports plus élevés en fruits, en légumes, en légumineuses, en grains entiers et en poisson et des apports plus faibles en viandes rouges et transformées, en produits céréaliers raffinés ainsi qu’en boissons sucrées (70).
Par contre, les associations observées avec ces facteurs nutritionnels doivent être interprétées avec prudence. Effectivement, le nombre d’études est limité et il y a une grande hétérogénéité entre les résultats de celles-ci (70). Il est également difficile d’évaluer de façon isolée l’association entre certaines composantes alimentaires dues à la présence d’interaction entre les nutriments et de facteurs confondants comme le statut socioéconomique et le gain de poids gestationnel que certaines études n’ont pas considérés (70). Aucun lien de cause à effet ne peut être établi au sein de ces études observationnelles entre les facteurs nutritionnels et le risque de DbG et les différents mécanismes biologiques pouvant expliquant les associations ont été très peu étudiés. De
13
plus, les études évaluant l’alimentation avant la grossesse sont principalement des études prospectives, comme la Nurses’ Health Study II, ne précisant pas le délai entre l’évaluation des apports et la grossesse. Aussi, aucune étude n’a évalué les apports alimentaires avant et après la grossesse pour déterminer si la période influence les associations observées avec le DbG (70).
Des études d’intervention pendant la grossesse se sont également intéressées à l’effet de l’alimentation sur le risque de DbG. Une méta-analyse a évalué l’association entre des interventions nutritionnelles pendant la grossesse et le développement du DbG au sein de six études randomisées et contrôlées (72). Les interventions visaient, entre autres, une alimentation avec un indice glycémique faible et une restriction des apports énergétiques selon les besoins des femmes enceintes (72). En combinant les résultats de ces études, les interventions nutritionnelles n’étaient pas associées significativement à une réduction du risque de DbG (Risque relatif (RR)=0,67; IC 0,39-1,15) (72). Une autre méta-analyse de 2016 a constaté que les études randomisées et contrôlées visant les habitudes de vie, soit l’alimentation et/ou l’activité physique, étaient associées à une diminution du risque de DbG en considérant l’ensemble des 29 études d’intervention pendant la grossesse (RR=0,82; IC 0,70-0,95) (73). Par contre, lorsque les études étaient divisées selon les interventions basées sur l’alimentation (cinq études, RR=0,80; IC 0,58-1,10), sur l’activité physique (dix études, RR=0,77; IC 0,54-1,09) ou sur les deux approches (14 études, RR=0,85; IC 0,70-1,03), les associations n’étaient plus significatives (73).
Ainsi, il est possible de constater que certains aliments semblent être associés à la prévention du DbG au sein des études d’observation avant ou pendant la grossesse. Par contre, les résultats nécessitent d’être validés par des études d’intervention pendant la grossesse avec des cohortes de plus grande envergure, uniformisées et suivies dans le temps.
14
1.5 Conséquences pendant la grossesse et lors de l’accouchement 1.5.1 Chez les enfants
Plusieurs conséquences néonatales ont été identifiées chez les enfants issus d’une grossesse avec un DbG. À ce sujet, une étude récente française basée sur des données médicales et populationnelles a été réalisée avec près de 800 000 naissances, dont plus de 57 000 avec un DbG (74). Comparativement aux grossesses sans diabète, les enfants issus du DbG étaient plus à risque de macrosomie (OR=1,8; IC 1,7-1,8), de malformations cardiaques (OR=1,3; IC 1,1-1,4) et de détresses respiratoires (OR=1,1; IC 1,0-1,3) en ne considérant que les grossesses de 28 semaines ou plus (74). Au sujet du poids à la naissance, une méta-analyse de 2017 incluant neuf études a constaté que les nourrissons exposés au DbG avaient une masse grasse (+61,69; IC 29,09-94,29 grammes) et un pourcentage de gras (+1,73; IC 0,65-2,81%) plus élevés que les enfants issus d’une grossesse sans diabète (75).
Par contre, au sein des études, il est parfois difficile de bien distinguer l’effet indépendant du DbG sur les différentes complications néonatales par la présence de certains facteurs de risque confondants, comme un IMC pré-grossesse de la mère élevé et un gain de poids excessif pendant la grossesse. Ainsi, une méta-analyse de 2015 regroupant 12 études s’est intéressée à cette question et a constaté que le DbG était un facteur de risque de la macrosomie fœtale indépendamment de l’ajustement pour les cofacteurs dont l’âge maternel, l’ethnicité, l’IMC pré-grossesse et le gain de poids gestationnel (OR=1,71; IC 1,52-1,94) (76). Un autre facteur à évaluer dans le développement de ces problématiques est le contrôle glycémique de la mère lors de la grossesse. En effet, la présence de macrosomie s’explique, entre autres, par l’élévation de la glycémie de la mère. Face à cette hyperglycémie, le fœtus augmente sa production d’insuline qui a pour conséquence d’entraîner une croissance rapide et une accumulation de l’énergie excédentaire en graisse (49). Une des plus importantes études ayant évalué les associations entre les glycémies des femmes et les complications néonatales était celle d’HAPO de 2008, c’est-à-dire l’étude utilisée pour établir les critères diagnostiques du DbG de l’International
15
Les auteurs avaient observé une association linéaire entre les niveaux de glucose sanguin des femmes et différentes complications chez le nouveau-né comme un poids à la naissance supérieur au 90e percentile et une hypoglycémie néonatale (33). Ainsi, le DbG est associé à différentes problématiques de santé lors de la naissance des enfants.
1.5.2 Chez les mères
Le DbG a également des conséquences pour la mère lors de la grossesse et l’accouchement. En effet, ces femmes sont plus à risque, entre autres, de prééclampsie et de césarienne. Une étude suédoise réalisée chez plus de 400 000 naissances a observé que les femmes avec un DbG étaient 61% plus à risque de prééclampsie (OR=1,61; IC 1,39-1,86) que les femmes sans DbG même en considérant l’IMC pré-grossesse (77). Une récente étude d’une telle envergure a également été réalisée en utilisant les données de plus de 400 000 naissances en Alberta, au Canada (78). Les auteurs ont constaté que les femmes avec un DbG étaient 90% plus à risque de prééclampsie (OR=1,9; IC 1,7-2,1) que les femmes sans DbG (78). En outre, au cours de l’étude française mentionnée précédemment et évaluant les conséquences néonatales associées aux enfants issus du DbG, les auteurs avaient également rapporté les conséquences de cette condition pour les mères (74). Les femmes avec un DbG étaient plus à risque de pré-éclampsie (OR=1,7; IC 1,6-1,7) et de césarienne (OR=1,4; IC 1,4-1,4) comparativement aux femmes sans DbG en ne considérant que les grossesses de 28 semaines ou plus (74). Une analyse de neuf études utilisant les critères diagnostiques du DbG de Carpenter-Coustan et al. (79) a rapporté que les femmes avec un DbG étaient 32% (RR=1,32; IC 1,17-1,48) plus à risque de césarienne lors de l’accouchement que les femmes sans DbG (80). Comme mentionné précédemment, l’étude HAPO de 2008 a constaté une association linéaire entre les glycémies maternelles et certaines complications lors de la grossesse (33). Le risque de césarienne et de prééclampsie était plus élevé lorsque le glucose sanguin des femmes était considéré comme une variable continue (pour l’augmentation d’un écart-type du glucose à jeun : OR pour césarienne=1,11; IC 1,06-1,15 et OR pour prééclampsie=1,21; IC 1,13-1,29) (33). Bref, les femmes avec un DbG sont plus à risque de prééclampsie et de césarienne que les femmes sans DbG.
16
1.6 Conséquences sur la santé à long terme 1.6.1 Chez les enfants
1.6.1.1 Diabète de type 2
Les enfants exposés au DbG sont plus à risque de développer un DbT2 au cours de leur vie. Cela a été bien démontré dans plusieurs articles scientifiques, dont Clausen et al. (6). Cette étude réalisée au Danemark a évalué la prévalence du DbT2 et du pré-diabète chez près de 600 enfants entre 18 et 27 ans, dont 168 ayant été exposés au DbG traité par l’alimentation (6). Un total de 21% des enfants exposés au DbG présentait un DbT2 et un pré-diabète comparativement à seulement 4% pour le groupe contrôle (p<0,0001) (6). Les auteurs ont d’ailleurs constaté que les enfants exposés au DbG étaient 6,8 fois plus à risque de DbT2 et de pré-diabète (OR=6,83; IC 2,25-20,71) comparativement aux enfants non exposés, malgré l’ajustement statistique, entre autres, pour l’histoire familiale de diabète, le surplus de poids maternel pré-grossesse (IMC ≥25 kg/m2) et l’âge de l’enfant (6). Une étude allemande de 2010 a d’ailleurs observé que les enfants exposés au DbG avaient davantage une résistance à l’insuline à 11 ans, calculée par le modèle d’homéostasie de la résistance à l’insuline (Homeostasis model assessment of insulin
resistance, HOMA-IR) que les enfants non exposés au diabète (p=0,01 ajusté pour le
sexe et l’âge) (7). Bref, l’exposition au DbG rend les enfants plus à risque de DbT2 plus tard dans leur vie et cet effet semble être indépendant d’autres facteurs de risque, tels que l’obésité de la mère et l’histoire familiale de diabète.
1.6.1.2 Obésité
Les enfants exposés au DbG sont plus à risque de présenter un surplus de poids ou une obésité plus tard dans la vie. Une méta-analyse de 2011 compilant les données de six études a révélé que les enfants exposés au DbG, âgés de trois à 16 ans, avaient un score z de l’IMC plus élevé que les enfants sans DbG (+0,28; IC 0,05-0,51) au sein des analyses sans ajustement (9). Par contre, ces observations n’étaient plus significatives lorsque les résultats étaient ajustés pour l’IMC pré-grossesse de la mère (9). Dans le même ordre d’idées, une étude de 2016 regroupant plus de 4 500 enfants exposés au DbG de 12 pays,
17
âgés de neuf à 11 ans, a constaté que le risque d’obésité chez ces enfants n’était plus significatif après avoir ajusté pour l’IMC actuel de la mère comparativement aux enfants non exposés (OR=1,37; IC 0,92-2,04 comparativement à OR=1,53; IC 1,03-2,27 sans ajustement de l’IMC actuel de la mère) (10). Avec ces résultats, il est possible de croire que l’effet associé au DbG sur l’obésité de l’enfant serait régulé majoritairement par le poids de la mère avant ou encore après la grossesse. Par contre, une étude de 2012 a fait des constats différents. En effet, Baptiste-Roberts et al. (11) ont constaté chez plus de 28 000 pairs d’enfants et mères, dont 484 ayant eu un DbG, que les enfants exposés à cette complication étaient 61% plus à risque de surplus de poids à l’âge de sept ans que les enfants non exposés même avec les ajustements statistiques de l’IMC pré-grossesse de la mère, du gain de poids pendant la grossesse ainsi que du poids à la naissance (OR=1,61; IC 1,07-1,28). De même, une étude allemande réalisée chez plus de 7 000 pairs d’enfants et mères a constaté que le DbG était associé indépendamment au surplus de poids des enfants, âgés en moyenne de 5,8 ans (12). Effectivement, les enfants exposés au DbG étaient 81% plus à risque de surplus de poids incluant l’obésité (OR=1,81; IC 1,23-2,65) comparativement aux enfants non exposés malgré l’ajustement statistique pour l’IMC pré-grossesse de la mère, le gain de poids pendant la grossesse et le statut socio-économique (12). Ainsi, il est possible de constater que les enfants exposés au DbG sont plus à risque de surplus de poids et d’obésité au cours de leur vie. La littérature nécessite encore quelques précisions sur l’effet indépendant du DbG sur cette complication étant donné la présence de multiples facteurs, dont l’obésité de la mère avant ou après la grossesse, les facteurs génétiques et environnementaux ainsi que les habitudes de vie des enfants et des mères (81).
1.6.2 Chez les mères
1.6.2.1 Maladies cardiovasculaires
Le DbG est associé à différentes complications chez les mères suite à la grossesse. Effectivement, les femmes avec un antécédent de DbG sont plus à risque de MCV, incluant plusieurs pathologies comme l’infarctus du myocarde, l’accident vasculaire cérébral et l’angioplastie coronaire. À ce sujet, une étude populationnelle française basée
18
sur les données médicales de près de 63 000 femmes avec un antécédent de DbG a été réalisée (13). Les auteurs ont constaté que les femmes avec un antécédent de DbG étaient 25% plus à risque de développer des MCV que les femmes n’ayant pas fait de DbG (OR=1,25; IC 1,09-1,43) au cours des sept années suivant la grossesse (13). Goueslard et
al. (13) ont aussi observé que les femmes avec un antécédent de DbG étaient 2,7 fois plus
à risque d’hypertension (OR=2,72; IC 2,58-2,88). Une récente étude canadienne a également observé des résultats semblables chez 1,5 million de grossesses entre 1994 et 2014 (14). Les auteurs ont observé que les femmes avec un antécédent de DbG, ayant développé ou non un DbT2 plus tard, étaient plus à risque de MCV (Hazard ratio (HR) ajusté pour les femmes avec DbG et DbT2=2,82; IC 2,41-3,30 et HR ajusté pour les femmes avec DbG sans DbT2=1,30; IC 1,07-1,59) (14). Une étude canadienne de 2015 a également observé que les femmes avec un antécédent de DbG étaient plus à risque de MCV (HR=1,4; IC 1,0-1,9) et d’hypertension (HR=2,0; IC 1,8-2,2) même si elles ne présentaient pas de surplus de poids (15). Bref, les femmes ayant un antécédent de DbG sont plus à risque de MCV et d’hypertension même sans avoir développé un DbT2 ni présenté de surplus de poids.
1.6.2.2 Syndrome métabolique
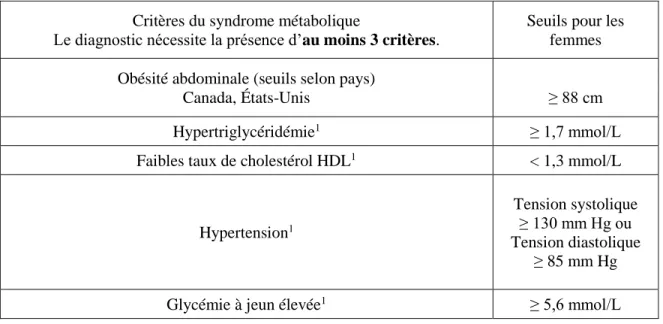
Les femmes avec un antécédent de DbG sont également plus à risque de développer un SM plus tard dans leur vie. Celui-ci se compose de facteurs de risque, tels que le tour de taille et l’hypertriglycéridémie, liés au développement de différentes problématiques de santé (Tableau 1) (1). En effet, le SM est associé au développement du DbT2 et des MCV au sein de la population générale (82-84). Le diagnostic du SM est fait lorsqu’un individu possède trois des cinq critères présentés dans le tableau 1 (1). Ainsi, plusieurs études se sont intéressées au risque de développer un SM chez les femmes ayant eu un DbG étant donné que différents facteurs de risque sont communs entre ces deux complications. Une méta-analyse en 2014 de 17 études a constaté que les femmes avec un antécédent de DbG étaient près de quatre fois plus à risque de développer un SM que les femmes ayant eu une grossesse sans complication (OR=3,96; IC 2,99-5,26) (16). Cet article a également observé que les femmes d’origine caucasienne étaient plus à risque de développer cette problématique que celles d’origine asiatique (Caucasiennes OR=4,54; IC 3,78-5,46 et
19
Asiatiques OR=1,28; IC 0,64-2,56) (16). Cette étude a rapporté que les femmes avec un antécédent de DbG ayant un IMC élevé étaient également plus à risque de SM (OR=5,39; IC 4,47-6,50) (16). Bref, la littérature démontre bien que les femmes avec un antécédent de DbG sont plus à risque de développer un SM et que différents facteurs influencent ce risque.
Critères du syndrome métabolique
Le diagnostic nécessite la présence d’au moins 3 critères.
Seuils pour les femmes Obésité abdominale (seuils selon pays)
Canada, États-Unis ≥ 88 cm
Hypertriglycéridémie1 ≥ 1,7 mmol/L
Faibles taux de cholestérol HDL1 < 1,3 mmol/L
Hypertension1
Tension systolique ≥ 130 mm Hg ou Tension diastolique
≥ 85 mm Hg
Glycémie à jeun élevée1 ≥ 5,6 mmol/L
1Un traitement spécifique à ce trouble peut également servir d’indicateur (ex. médication).
Tableau 1. Critères diagnostiques du syndrome métabolique Adapté des Lignes
directrices de l’ACD de 2013 (1) 1.6.2.3 Diabète de type 2
Les femmes avec un antécédent de DbG sont plus à risque de développer un DbT2 plus tard dans leur vie. En effet, une méta-analyse de 2009 incluant 20 études de cohorte a rapporté que ces femmes étaient sept fois plus à risque de développer un DbT2 comparativement aux femmes ayant eu une grossesse sans cette complication (RR=7,43; IC 4,79-11,51) (17). Une des études de cette méta-analyse a été réalisée au Canada auprès de 21 823 femmes avec un antécédent de DbG (18). Les auteurs ont constaté que les femmes ayant eu un DbG étaient 37 fois plus à risque de développer un DbT2 comparativement aux femmes sans antécédent (HR=37,28; IC 34,00-40,88) (18). Cette étude a également rapporté que près de 4% des femmes ayant eu cette complication avait
20
développé un diabète après seulement neuf mois post-partum et près de 19% d’entre elles après neuf ans post-partum comparativement à près de 2% chez les femmes sans antécédent de DbG (18). Une autre étude récente s’étant déroulée également au Canada a rapporté, après un suivi moyen de 5,5 ans, que 23,5% des 23 363 femmes avec un DbG avaient développé un diabète (85). Ainsi, il est possible de constater que la prévalence du développement du DbT2 varie selon la période post-partum visée par les études et semble augmenter avec le temps (17,86). À cet effet, une revue systématique de 2002 incluant 28 études a rapporté que la prévalence du diabète chez les femmes avec un antécédent de DbG variait entre 2,6 et 70% lors d’un suivi de six semaines à 28 ans post-partum (86). Cet article a observé une augmentation abrupte du risque de développer un diabète post-partum lors des cinq premières années et la formation d’un plateau après 10 ans (86). Cette grande variation de prévalence entre les différentes populations s’explique aussi par l’utilisation de différents critères diagnostiques du DbG et du DbT2, le taux de rétention au sein des études et les différentes caractéristiques des individus au sein des populations (50).
Évidemment, il existe différents facteurs de risque du développement d’un diabète post-partum chez les femmes avec un antécédent de DbG. Une récente méta-analyse de 39 études a constaté qu’avoir un IMC élevé (RR=1,95; IC 1,60-2,31), avoir une histoire familiale de diabète (RR=1,70; IC 1,47-1,97), être d’une ethnicité autre que caucasienne (RR=1,49; IC 1,14-1,94), avoir un âge avancé (RR=1,20; IC 1,09-1,34), avoir des glycémies élevées suite au test d’HGPO (RR=3,57; IC 2,98-4,04), avoir une hémoglobine glyquée (HbA1c) élevée (RR=2,56; IC 2,00-3,17) et utiliser de l’insuline lors de la grossesse (RR=3,66; IC 2,78-4,82) étaient tous des facteurs de risque de développer un DbT2 suite à un DbG (19). Trois revues de la littérature ont d’ailleurs rapporté les mêmes principaux facteurs de risque au sein de cette population (86-88). Quant au poids, Bao et
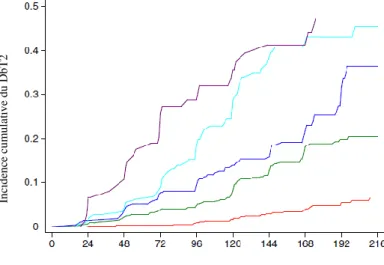
al. (89) ont d’ailleurs constaté une augmentation de l’incidence du diabète post-partum
avec l’augmentation de l’IMC de la mère, comme illustré à la figure 4. Une récente étude s’étant déroulée en Alberta, au Canada, chez plus de 240 000 femmes a également démontré que le poids pré-grossesse de la mère augmentait le risque de développer un DbT2 plus tard (15). En effet, lors d’un suivi moyen de 5,3 ans, les femmes avec un antécédent de DbG et en surplus de poids étaient deux fois plus à risque de DbT2
21
comparativement aux femmes avec un antécédent de DbG sans surplus de poids (HR=40,1; IC 34,4-46,6 et HR=20,3; IC 18,1-22,6, respectivement) (15). Une étude chez 1 263 femmes d’origine asiatique avec un antécédent de DbG a d’ailleurs évalué l’association entre le changement de poids pré-grossesse et celui post-partum et le risque de DbT2 en moyenne 2,3 ans suite à l’accouchement (90). Les auteurs ont constaté que les femmes ayant eu un gain de poids de sept kilogrammes ou plus (≥7 kg) pendant cette période avaient une augmentation du risque de 86% de DbT2 (HR=1,86; IC 1,02-1,71) comparativement à celles ayant maintenu un poids stable (±3 kg) (90). En résumé, les femmes avec un antécédent de DbG sont plus à risque de développer un DbT2 au cours de leur vie et différents facteurs de risque ont été associés au développement de cette complication, dont le surplus de poids ou l’obésité de la mère.
IMC ˂25,0 kg/m2 (ligne rouge); IMC 25,0-29,9 kg/m2 (ligne verte); IMC 30,0-34,9 kg/m2 (ligne bleue); IMC 35,0-39,9 kg/m2 (ligne cyan); IMC ≥40,0 kg/m2 (ligne mauve)
Figure 4. Incidence de DbT2 chez les femmes avec un antécédent de DbG selon
différentes catégories d’IMC Tiré et adapté de Bao et al. (89)
Traduit avec la permission de Springer Nature License : Springer Nature, Diabetologia, Long-term risk of type 2 diabetes mellitus in relation to BMI and weight change among women with a history of gestational diabetes mellitus: a prospective cohort study, Bao W et al., Copyright (2015)
Durée depuis que le DbG a été rapporté (mois)
In ci d en ce c u m u la ti v e d u D b T2
22
1.7 Suivi post-partum
Étant donné les conséquences possibles sur la santé de la femme suite à une grossesse compliquée par le DbG, certaines recommandations ont été émises pour le suivi post-partum. En effet, pour évaluer le statut glycémique des mères, l’ACD recommande d’effectuer un test d’HGPO entre six semaines et six mois suite à l’accouchement (1). De leur côté, l’American Diabetes Association (ADA) (2) et l’ACOG (37) recommandent ce test entre six et 12 semaines suivant l’accouchement.
Cependant, selon les publications scientifiques, une faible proportion des femmes réalise ce suivi. Effectivement, il est estimé qu’entre 17 et 57% des femmes effectueraient une vérification de leur glycémie dans le délai recommandé, soit par le test d’HGPO ou encore par la glycémie à jeun (91-101). Des femmes qui réalisent ce suivi, il est évalué que près du tiers d’entre elles ait un profil glycémique altéré, incluant une intolérance au glucose ou un diabète (96,98-100,102-104). De plus, cette faible proportion de suivi post-partum ne semble pas augmenter au fil des années. En effet, une étude américaine de 2016 réalisée dans 50 états chez plus de 32 000 femmes avec un DbG a constaté que seulement 7% de ces femmes avaient effectué le test d’HGPO entre six et 12 semaines en 2011 (20). À ce sujet, certaines études ont identifié les principales barrières à effectuer ce suivi post-partum. Le manque de temps, le stress émotionnel de l’arrivée d’un enfant, la fatigue, la complexité entourant la logistique du transport et des soins de santé, les responsabilités du travail, les inquiétudes face à effectuer un test à jeun lors de l’allaitement et la peur d’être diagnostiqué avec le diabète sont tous des exemples de barrières identifiées par les femmes (21,22). De plus, celles-ci considèrent peu les risques futurs sur leur santé et misent davantage leurs efforts sur les risques associés à la grossesse (21,22).
Du côté des recommandations d’habitudes de vie en période post-partum, celles-ci sont très générales. En effet, les différentes organisations canadiennes suggèrent aux femmes ayant fait du DbG d’avoir une saine alimentation, d’effectuer de l’activité physique, de favoriser l’allaitement, de conserver un poids santé ou de viser une perte de poids lors d’un excès et d’avoir recours à la médication lors de la présence d’altérations
23
glycémiques (1,2,23). Ces lignes directrices nécessitent des précisions pour cibler davantage les interventions possibles au sein de ce groupe à risque pour prévenir les différentes complications post-partum associées au DbG.
1.8 Prévention du diabète de type 2 chez les femmes avec un antécédent de diabète gestationnel
Étant donné que les femmes avec un antécédent de DbG sont plus à risque de développer un DbT2 suite à leur grossesse, plusieurs études se sont intéressées à prévenir cette complication avec des interventions sur les habitudes de vie. L’alimentation, l’allaitement et l’activité physique sont trois recommandations préconisées. Ces trois composantes ont d’ailleurs été évaluées au sein d’études d’observation et d’intervention chez cette population.
1.8.1 Alimentation
1.8.1.1 Profils alimentaires
Une des façons d’évaluer l’impact de l’alimentation globale sur différentes problématiques de santé est d’utiliser des profils alimentaires. L’association entre l’adhésion à certains profils alimentaires et le développement du DbT2 chez les femmes avec un antécédent de DbG a été évaluée au sein de deux articles scientifiques réalisés dans la même cohorte, Nurses’ Health Study II. Cette grande étude prospective regroupait plus de 115 000 femmes infirmières ayant un suivi de santé périodique avec des questionnaires auto-administrés et une évaluation des apports alimentaires par un questionnaire de fréquence alimentaire (QFA) auto-administré à tous les quatre ans (105,106).
Une des publications a évalué l’impact d’un score faible en glucides (low
carbohydrate-diet, LCD) et le risque de DbT2 à long terme au sein des femmes ayant un antécédent de
DbG. Le LCD est caractérisé par trois catégories : LCD total, LCD animal et LCD végétal (107). Pour calculer le LCD total, les apports alimentaires avaient une attribution de score proportionnellement à l’augmentation des apports en lipides et en protéines et inversement pour ceux en glucides. Le score LCD animal signifiait que les glucides
24
avaient été remplacés par des lipides et des protéines de source animale comparativement au LCD végétal pour lequel la substitution était de source végétale (107). Ainsi, les auteurs ont constaté que les femmes présentant un LCD total et animal élevés (5e quintile) avaient un risque supérieur de DbT2 (HR LCD total=1,36; IC 1,04-1,78 et HR LCD animal=1,40; IC 1,06-1,84) comparativement à celles ayant des scores plus faibles (1er quintile) (107). Pour sa part, un score LCD végétal supérieur (5e quintile) n’était pas associé significativement avec le développement du DbT2 au sein de cette population (HR=1,19; IC 0,91-1,55) comparativement au score inférieur (1er quintile) (107). Avec cette étude, on constate que de la restriction glucidique ne semble pas être bénéfique pour la prévention du DbT2 pour les femmes avec un antécédent de DbG.
Un article précédent des mêmes auteurs avait évalué les associations entre les scores aMED, DASH et aHEI et le développement du DbT2 chez les mêmes sujets. Chacun de ces profils alimentaires avait une attribution de score distincte (24). Par contre, ces trois modèles ont, entre autres, en commun des apports élevés en légumes, en fruits, en grains entiers et en poissons ainsi que des apports faibles en viandes rouges et transformées (24). En comparant les quartiles supérieurs et inférieurs, une adhésion supérieure aux scores aMED (HR=0,60; IC 0,44-0,82), DASH (HR=0,54; IC 0,39-0,73) et aHEI (HR=0,43; IC 0,31-0,59) étaient associés à une diminution du risque de DbT2 (24). Lorsque l’IMC était ajouté au sein des ajustements statistiques, des scores élevés DASH (HR=0,68; IC 0,49-0,94) et aHEI (HR=0,65; IC 0,46-0,92) restaient significativement associés à une réduction du risque de DbT2 alors qu’un score supérieur aMED (HR=0,76; IC 0,55-1,05) ne l’était plus (24). Ainsi, il est possible de croire que la prévention du DbT2 dans cette population pourrait être, en partie, modulée par la gestion du poids des femmes, facteur de risque discuté précédemment (section 1.6.2.3). À ce sujet, les mêmes auteurs ont publié un article en 2016 illustrant que le gain de poids dans le temps après la grossesse était plus faible chez les sujets ayant une plus grande adhésion aux scores aMED, DASH et aHEI (changement de poids par l’augmentation d’un écart-type du score : aMED -0,55; IC -0,71 à -0,39, DASH -0,84; IC -1,02 à -0,67, aHEI -1,24; IC -1,42 à -1,06) (108).