CLAUDINE PELLETIER
IMPACT DE LA PHENYLEPHRINE ET DE LA
NORADRENALINE SUR L'OXYGÉNATION
CÉRÉBRALE CHEZ DES PATIENTS DIABÉTIQUES
SOUS ANESTHÉSIÉ GÉNÉRALE LORS D'UNE
CHIRURGIE CARDIAQUE
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l'Université Laval dans le cadre du programme de maîtrise en kinésiologie
pour l'obtention du grade de Maître es Sciences (M.Sc.)
DEPARTEMENT DE KINESIOLOGIE FACULTÉ DE MÉDECINE UNIVERSITÉ LAVAL QUÉBEC 2012 Claudine Pelletier, 2012
Résumé
Afin de préserver la pression de perfusion des organes vitaux tels que le cœur, les reins et le cerveau durant l'anesthésié générale et la période de circulation extra-corporelle d'une chirurgie cardiaque, la pression artérielle moyenne est maintenue au-dessus de 60 mmHg à l'aide de l'administration de vasopresseurs. Ces agents (phenylephrine et noradrenaline) semblent avoir un impact négatif sur l'oxygénation cérébrale quand ils sont administrés afin de corriger une hypotension induite par l'anesthésie générale. L'hypotension est un effet secondaire fréquent de l'anesthésie générale se produisant plus souvent chez les patients diabétiques. De plus, les diabétiques ont besoin d'une quantité plus importante de vasopresseurs afin de rétablir la pression artérielle moyenne comparativement à des patients non-diabétiques. Par contre, l'influence de la phenylephrine et de la noradrenaline sur l'oxygénation cérébrale durant la période de circulation extra-corporelle chez les patients diabétiques est encore inconnue. L'objectif du travail présenté dans ce mémoire était d'évaluer l'impact de la phenylephrine et de la noradrenaline sur l'oxygénation cérébralechez des sujets diabétiques et des sujets non-diabétiques durant la période de circulation extra-corporelle d'une chirurgie cardiaque. Les résultats suggèrent que les sujets diabétiques subissant une chirurgie cardiaque et recevant de la noradrenaline durant la période de circulation extra-corporelle ont une oxygénation cérébraleréduite, et ce, pendant un plus grand pourcentage de temps comparativement aux sujets non-diabétiques. De plus, il semble que les sujets diabétiques ont besoin d'une plus grande quantité de noradrenaline afin de maintenir la pression artérielle moyenne durant la période de circulation extra-corporelle d'une chirurgie cardiaque.
Avant-propos
Lors de mon baccalauréat en kinésiologie, j'ai toujours dit à mes amis que je voulais étudier au DESS et ensuite faire une maîtrise. Je ne pensais pas que j'allais tenir cette promesse! Trois ans plus tard, me voilà déjà rendu à la fin de cette maîtrise. Un an de DESS, deux ans de maîtrise, c'est toute qu'une aventure! Non mais, il s'en passe des choses durant ce temps! Deux ans de travail, de remise en question, de décisions, de « commencer tôt et finir tard » mais, surtout, deux ans de plaisir!
Cette aventure n'aurait pas pu être si plaisante sans l'apport et le support de nombreuses personnes qui m'ont côtoyé durant ces deux années. Je remercie tout d'abord mon directeur de maîtrise, Pat, qui a su me transmettre son intérêt certain pour la recherche et la physiologie cérébrovasculaire. Merci pour les précieux conseils, les nombreux encouragements et surtout, pour ta disponibilité. Chanceux nous sommes de t'avoir si présent dans la « Team Brassard ». Merci également à Dr. Jean Bussières et à Nathalie Gagné de m'avoir ouvert les portes des salles d'opération. J'ai été choyée d'avoir pu assister à tant de chirurgies à cœur ouvert et de m'être fait expliquer son déroulement de A à Z! Je ne verrai plus les chirurgies de la même façon. Merci également pour vos judicieux conseils, toujours très appréciés et remplis de bon sens. Merci Nathalie d'avoir recruté mes sujets! Un merci spécial également à Mickaël, qui a su prendre en charge bon nombre de prises de données et d'analyses, ainsi qu'aux inhalothérapeutes et aux perfusionnistes qui ont contribué aux recueils des données.
Ces deux années de maîtrise n'auraient pas été les mêmes sans cette superbe ambiance de travail présente au 4e étage du U (et aussi au 1er étage!). Merci à Guillaume qui m'a bien
accueilli en tant que 2e étudiante dans l'équipe Brassard. Merci à Sarah-Maude, Annabelle,
Joanie, Sandrine, Simon, Marjorie, Valérie et Audrey d'avoir alimenté les grandes discussions des dîners à la caf, d'avoir été de grands conseils lors de mes questionnements, et surtout, d'avoir si bien contribué aux partys!
Un gros merci à ma famille de m'avoir toujours supporté et encouragé dans mes études. Finalement, merci à la personne avec qui je partage mon quotidien, Benoit. Merci d'être présent dans ma vie et de m'encourager! Merci d'être là et d'être toi, tout simplement! ©
Ill
A mon père, Continue à si bien veiller sur nous de là-haut.
«Le seul endroit où le mot succès vient avant le mot travail est dans le dictionnaire ».
IV
Table des matières
Résumé i Avant-propos ii Table des matières iv Liste des tableaux vii
Liste des figures viii
Liste des abréviations x
Introduction 1
Chapitre I : Le diabète 3 1.1 Définition, symptômes, critères diagnostics et prévalence du diabète 3
1.1.1 Définition du diabète 3 1.1.2 Symptômes et critères diagnostics du diabète 4
1.1.3 Prévalence du diabète 5 1.2 Historique du diabète 6 1.3 Le diabète de type 1 7
1.3.1 Destruction des cellules du pancréas par une réaction auto-immune 7
1.3.2 Cause idiopathique 8 1.4 Le diabète de type 2 8 Chapitre II : Le diabète et les maladies cardiovasculaires 11
2.1 Le diabète : facteur de risque de la maladie cardiovasculaire 11
2.2 L'athérosclérose 11 2.2.1 Définition de l'athérosclérose 11
2.2.2 Les étapes de l'athérosclérose 12 2.3 La pathophysiologie du vaisseau diabétique 14
2.3.1 La dysfonction endothéliale 14 2.3.2 La dysfonction du muscle lisse vasculaire 15
2.3.3 La dysfonction plaquettaire 15 2.3.4 Anomalies dans la coagulation 16
2.4.1 La maladie coronarienne 16 2.4.2 La maladie artérielle périphérique 17
2.4.3 L'accident vasculaire cérébral 18 Chapitre III : La chirurgie cardiaque 19
3.1 Les chirurgies 19 3.1.1 L'angioplastie 20 3.1.2 Le pontage coronarien 22
3.1.3 Les remplacements de valve 23 3.2 Les étapes de la chirurgie cardiaque 25
3.2.1 Arrivée et installation au bloc opératoire 25
3.2.2 Induction de l'anesthésie 26 3.2.3 Période pré-circulation extra-corporelle 26
3.2.4 Période de circulation extra-corporelle 27 3.2.5 Période post-circulation extra-corporelle 29 Chapitre IV : Les déterminants de la perfusion cérébrale : impact du diabète 30
4.1 Déterminants de la perfusion cérébrale 30
4.1.1 La pression artérielle 30 4.1.2 La résistance vasculaire cérébrale 31
4.1.3 Le débit cardiaque 32 4.1.4 Le dioxyde de carbone 33 4.1.5 L'autorégulation cérébrale 34 4.1.6 Le métabolisme cérébral 36 4.1.7 L'activité du système nerveux sympathique 37
4.1.8 Le glucose 37 4.2 Impact du diabète 38
4.2.1 Autorégulation cérébrale compromise 39 4.2.2 Production d'oxyde nitrique diminuée 40 4.2.3 Vasodilatation endothélium-dépendante altérée 40
4.2.4 Réponse altérée au dioxyde de carbone 41 Chapitre V : Les anesthésiants et les vasopresseurs utilisés en chirurgie cardiaque :
leurs impacts sur la perfusion et l'oxygénation cérébrale 42 5.1 Définitions et mécanismes d'actions des anesthésiants et des vasopresseurs 42
5.1.1 Les agents d'induction de l'anesthésie générale 42
5.1.2 Les anesthésiants en inhalation 43 5.1.3 Les bloqueurs neuromusculaires 44
5.1.4 Les anxiolytiques 44 5.1.5 Les analgésiants opioïdes 45
VI
5.2 Impact des anesthésiants et des vasopresseurs sur la perfusion et l'oxygénation
cérébrale 46 5.2.1 Les agents d'induction de l'anesthésie générale 46
5.2.2 Les anesthésiants par inhalation 47 5.2.3 Les bloqueurs neuromusculaires 48
5.2.4 Les anxiolytiques 48 5.2.5 Les analgésiants opioïdes 48
5.2.6 Les vasopresseurs 49 Chapitre VI : L'étude 52 6.1 Introduction 52 6.2 Méthodologie 54 6.3 Résultats 57 6.4 Discussion 66 Conclusion 74 Bibliographie 75
Liste des tableaux
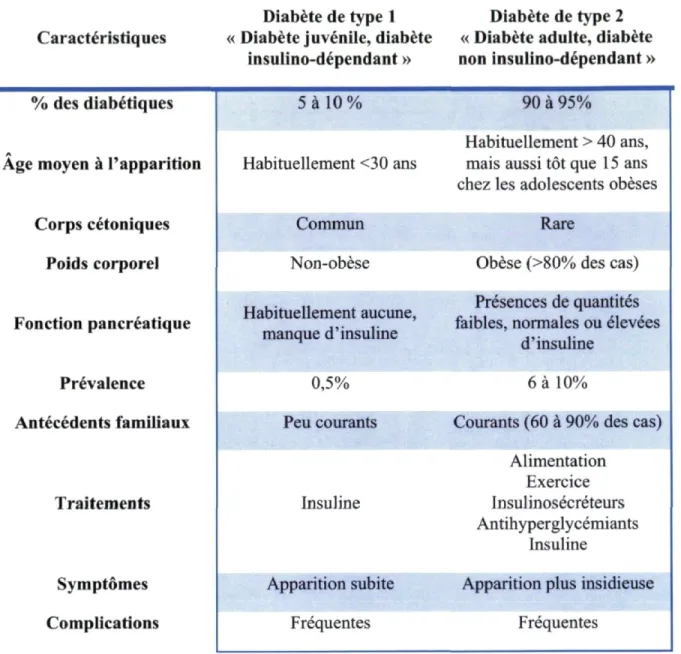
Tableau 1 Résumé des caractéristiques du diabète de type 1 et de type 2 9
Tableau 2 Caractéristiques des sujets de l'étude 59 Tableau 3 Résultats en fonction de la médication et de la condition 61
vin
Liste des figures
Figure 1 Prévalence du diabète (millions d'individus) en l'an 2000 et pour
l'année 2030 5
Figure 2 Développement de la plaque athérosclérotique 12
Figure 3 L'angioplastie 20
Figure 4 L'angioplastie avec pose de tuteur 20
Figure 5 Le pontage artériel (via l'artère mammaire) et le pontage veineux (via
la veine saphène) 22
Figure 6 Valve biologique et valve mécanique 23
Figure 7 Les bases de la circulation extra-corporelle 26
Figure 8 Relation entre le débit cardiaque et le débit sanguin cérébral 31
Figure 9 Changement du débit sanguin cérébral en fonction de la PaCÛ2 32
Figure 10 Autorégulation cérébrale 34
Figure 11 Déterminants de la perfusion cérébrale 37
Figure 12 PAM et débit sanguin cérébral 38
Figure 13 Diminution relative de l'oxygénation cérébrale avec la noradrenaline
Figure 14 Diminution relative de l'oxygénation cérébrale avec la phenylephrine
entre les diabétiques et les non-diabétiques 64
Figure 15 Quantité de noradrenaline administrée aux sujets lors du temps de CEC
passé avec une diminution de 15% de la Sc02 65
Figure 16 Quantité de phenylephrine administrée aux sujets lors du temps de CEC
Liste des abréviations
AVC CBF CEC C 02 D ECG FC HbAïc HTA IMC IRC MCAS M t - A V m0y MPOC NA ND NMDA PAC PaC02 PAD PAM PAS PPC PH Phydro PIC PV Q RVA RVM Sat02s
co
2Accident vasculaire cérébral Débit sanguin cérébral Circulation extra-corporelle Dioxyde de carbone Diabétiques Électrocardiogramme Fréquence cardiaque Hémoglobine glyquée Hypertension artérielle Indice de masse corporelle Insuffisance rénale chronique
Maladie coronarienne athérosclérotique
Vitesse du débit sanguin dans l'artère cérébrale moyenne Maladie pulmonaire obstructive chronique
Noradrenaline Non-diabétiques iV-méthyl-D-aspartate Pontage aorto-coronarien
Pression partielle en dioxyde de carbone Pression artérielle diastolique
Pression artérielle moyenne Pression artérielle systolique Pression de perfusion cérébrale Phenylephrine
Pression hydrostatique Pression intracrânienne Pression veineuse Débit cardiaque
Remplacement de valve aortique Remplacement de valve mitrale
Saturation en oxygène transcutanée périphérique Oxygénation cérébrale au lobe frontal
Introduction
Le diabète touche environ 6% de la population au Canada[l] et ce pourcentage est encore plus élevé chez les patients hospitalisés[2]. Le diabète est maintenant reconnu comme étant un facteur de risque de la maladie cardiovasculaire [3]. Les problèmes cardiovasculaires sont la cause de 55% des décès chez les patients diabétiques, alors que les problèmes cérébrovasculaires en sont la cause dans 10% des cas [4]. Ces problèmes sont reliés à l'état métabolique anormal qui accompagne le diabète, un état d'hyperglycémie et de résistance à l'insuline, causant ainsi des dysfonctions artérielles et menant au développement de l'athérosclérose [5].
Rendu à un certain point, le blocage progressif des artères par l'athérosclérose entraîne des problèmes coronariens. Ces problèmes sont initialement traités par la prévention (nutrition et activité physique) et par la médication [6]. Par contre, chez certains patients, une chirurgie cardiaque sera nécessaire afin d'améliorer leur condition.
Un des effets secondaires fréquents de l'anesthésie générale durant une chirurgie cardiaque est l'hypotension [7]. La prévalence d'hypotension est aussi plus importante chez les patients diabétiques [8]. Des vasopresseurs sont utilisés afin de rétablir la pression artérielle moyenne à un niveau où l'autorégulation cérébrale est fonctionnelle [9]. Les vasopresseurs sont également utilisés durant la période de circulation extra-corporelle de la chirurgie cardiaque afin de maintenir la pression artérielle moyenne. L'utilisation de certains vasopresseurs, dont la phenylephrine et la noradrenaline, semble venir diminuer l'oxygénation cérébrale chez des sujets sains [10, 11]. Cependant, nous ne connaissons pas l'impact de ces agents sur l'oxygénation cérébrale chez des patients diabétiques durant la période de circulation extra-corporelle d'une chirurgie cardiaque sous anesthésié générale.
Les patients diabétiques ont plusieurs altérations dans leurs fonctions cérébrovasculaires, dont l'autorégulation cérébrale, et ont également une incidence de maladies vasculaires cérébrales élevées [12]. Le diabète vient aussi altérer le fonctionnement de plusieurs déterminants de la perfusion cérébrale [13].Les patients diabétiques font partie d'une
vascularisation cérébrale hyper réactive aux agents vasopresseurs [14, 15], d'où l'importance de mieux documenter l'impact de l'utilisation des vasopresseurs sur l'oxygénation cérébrale dans cette population.
Le présent mémoire de maîtrise vise donc, dans le chapitre un, à expliquer ce qu'est le diabète et à dresser un portrait de sa prévalence dans le monde, au Canada ainsi qu'au Québec. Ensuite, le deuxième chapitre permettra de démontrer en quoi le diabète est un facteur de risque de la maladie cardiovasculaire. Aussi, le chapitre trois tracera un portrait détaillé des différentes chirurgies cardiaques effectuées à l'Institut universitaire de cardiologie et de pneumologie de Québec ainsi que des étapes (dont la période de circulation extra-corporelle) de leur déroulement.
Le quatrième chapitre de ce mémoire expliquera quels sont les déterminants de la perfusion cérébrale et en quoi le diabète vient altérer le fonctionnement normal de ces déterminants. Le cinquième chapitre se penchera sur l'impact des médications utilisées en chirurgie cardiaque, plus précisément les anesthésiants et les vasopresseurs, sur la perfusion et l'oxygénation cérébrale. Finalement, la dernière partie de ce mémoire sera consacrée à l'étude. Cette dernière porte sur l'impact de la phenylephrine et de la noradrenaline, deux vasopresseurs permettant d'augmenter la pression artérielle moyenne, sur l'oxygénation cérébrale chez des patients diabétiques sous anesthésié générale lors de la période de circulation extra-corporelle d'une chirurgie cardiaque.
Les résultats de ce mémoire permettront de mieux comprendre l'influence de l'utilisation d'agents vasopresseurs fréquemment utilisés en clinique, en présence d'hypotension artérielle survenant lors d'une anesthésié générale pour une chirurgie cardiaque pendant la période de circulation extra-corporelle, sur l'oxygénation cérébrale de patients diabétiques comparativement à des patients non-diabétiques.
Chapitre I : Le diabète
1.1 Définition, symptômes, critères diagnostics et prévalence du diabète
1.1.1 Définition du diabète
Le diabète est défini comme étant une maladie chronique causée par une carence et/ou un défaut de l'utilisation de l'insuline[16]. L'insuline est une hormone qui permet au glucose d'être utilisé comme carburant par les cellules du corps humain. Si le pancréas ne sécrète pas assez d'insuline, ou si cette dernière n'est pas utilisée adéquatement, le glucose ne sera pas utilisé par les cellules et demeurera dans le sang. Cela entraîne un excès de glucose dans la circulation sanguine (hyperglycémie)[16]. L'hyperglycémie chronique est associée à des dommages et des dysfonctions à long terme de plusieurs organes du corps humain, tels que les yeux, les reins, le cerveau, le cœur et les vaisseaux sanguins[16, 17]. Il existe quatre classes clinique de diabète : diabète de type 1, diabète de type 2, diabète gestationnel et d'autres types de diabète dus à d'autres causes (par exemple : déficience génétique de l'action de l'insuline, endocrinopathies, pancréatite, etc.) [18]. Pour le bien de cet écrit, seuls le diabète de type 1 et de type 2 seront discutés. Une description de chacun d'eux se trouve plus loin dans ce chapitre.
Présentement, les causeset l'étiologie du diabète ne sont pas clairement établies [16]. Par contre, certains facteurs comme la génétique et l'environnement sont corrélés à son développement [19, 20]. Les causes génétiques restent encore mal définies, mais, concernant les causes environnementales, il est démontré que le risque de développer le diabète augmente avec l'âge, l'obésité et l'inactivité physique [19]. Plusieurs personnes ayant le diabète de type 2 ne sont d'ailleurs pas actifs [21]. Aux États-Unis, 39 % des adultes atteints de diabète font de l'activité physique régulièrement, comparativement à 58 % des adultes non-diabétiques [21]. L'activité physique et la modification des habitudes de vie sont d'ailleurs des éléments clés dans la prise en charge du patient diabétique [16]. Des études ont démontré que l'activité physique régulière (plus de 150 minutes par semaine à intensité modérée [16]) pouvait prévenir et retarder l'apparition du diabète et de ses
une intervention en activité physique et nutrition, des gens intolérants au glucose avaient 58% moins de risque de développer le diabète, comparativement au groupe placebo et au groupe ayant consommé de la metformine, un antihyperglycémiant de la classe des biguanides[23]. Par contre, les gens intolérants au glucose doivent rester à l'affût de leurs symptômes afin d'éviter de développer le diabète.
1.1.2Symptômes et critères diagnostics du diabète
Le diabète est une maladie insidieuse qui apparaît très lentement. Ses symptômes sont différents d'une personne à une autre et leur degré d'intensité également.D'ailleurs, certaines personnes peuvent ne pas ressentir les différents symptômes de l'apparition du diabète[16] :
Symptômes :
• La polyurie, c'est-à-dire des urines abondantes, conséquence de la glycosurie (glucose dans les urines);
• La polydipsie, c'est-à-dire une soif excessive, en réponse à la déshydratation;
• La polyphagie, c'est-à-dire une faim excessive, conséquence de la perte excessive de calories, résultat de la glycosurie, et d'un possible effet du diabète sur les signaux de satiété;
• Perte de poids, conséquence de l'incapacité de manger suffisamment de calories pour combler les pertes énergétiques et de l'incapacité à utiliser le glucose comme énergie;
• Fatigue; • Vision trouble.
Également, il faut vérifier certains critères avant de poser le diagnostic de diabète. Ainsi, selon un comité international d'experts [16], la présence d'un des quatre critères suivants est nécessaire afin de déterminer si une personne souffre de diabète :
Critères diagnostics :
• Un taux d'hémoglobine glyquée (HbA]C) supérieur à 6,5 %;
• Un taux de glucose plasmatique à jeun> 7,0 mmol/1 £ 126 mg/dl). La période à
jeun est définie comme une période d'au moins 8 heures sans prise calorique;
• Un taux de glucose sanguin > 11,1 mmol/1 (> 200 mg/dl) 2 heures après un test de tolérance au glucose, à l'aide d'une dose de glucose de 75 g dissoute dans l'eau; • Chez un patient ayant des symptômes d'hyperglycémie, un taux de glucose sanguin
pris de façon aléatoire, > 11,1 mmol/1 (> 200 mg/dl).
Les valeurs de glycémie de certaines personnes ne correspondront pas aux critères nommés ci-haut, mais ces gens présenteront quand même des valeurs de glycémie anormalement élevées (niveau de glucose plasmatique à jeun entre 5,6 et 7,0 mmol/1, ou niveau de glucose plasmatique suite à un test de tolérance au glucose entre 7,8 et 11,1 mmol/1). Ces gens seront considérés comme étant « intolérant au glucose » et feront l'objet d'un suivi serré et d'une modification de leurs habitudes de vie afin de leur éviter de développer le diabète [16].
1.1.3 Prévalence du diabète
En 2010, 285 millions d'adultes âgés entre 20 et 79 ans étaient atteints de diabète, soit 6,4 % de la population mondiale [24]. Ce pourcentage devrait augmenter au fil des années, pour atteindre 7,7% (439 millions d'adultes) en 2030 [24]. La figure 1 montre l'augmentation de la prévalence du diabète au niveau mondial entre les années 2000 et 2030. Au Canada, en 2006, 6,2% de la population était atteinte de diabète, soit 2 millions de canadiens [1]. En 2012, le nombre de personnes atteintes de diabète est estimé à 2,8 millions de canadiens[l]. Au Québec, on estime présentement le nombre de
leur état[25].
Figure 1 : Prévalence du diabète (millions d'individus) en l'an 2000 et pour l'année 2030.
Tiré du site www.bostonscientific-international.com
1.2 Historique du diabète
Le premier écrit concernant le diabète a été rédigé en 1550 avant Jésus-Christ. En effet, le papyrus d'Ebers, un papier médical très complet à l'époque, faisait référence à une maladie caractérisée par des urines abondantes[26]. D'ailleurs, le mot « diabète » provient d'un mot grec, « diabeinein», qui veut dire « passer à travers »[27]. Un des premiers à avoir décrit le diabète est Arétée de Cappadoce, un médecin grec ayant vécu au Icrsiècle après
Jésus-Christ. Il avait exposé un excellent modèle du diabète, soit en mentionnant sa polyurie, sa polydipsie, son amaigrissement et son évolution possible vers le collapsus[27]. Il ne lui
manquait que la description de la glycosurie, découverte au XVIIe siècle par Thomas Willis,
médecin de Charles II d'Angleterre. Willis avait noté que les urines des gens diabétiques étaient « merveilleusement sucrées comme du miel ». C'est à ce moment que la dénomination « diabetes mellitus », utilisée de nos jours, est apparue[28]. Bien que le diabète soit connu depuis longtemps, ce n'est qu'au XXe siècle que des traitements
efficaces sont apparus. En effet, le rôle endocrinien du pancréas et l'existence de l'insuline n'a été clarifiée qu'en 1921, lorsque Sir Frederick Grant Banting et Charles Herbert Best ont répété les travaux de Mering et Minkowski (1889). Ils ont alors réussi à purifier l'insuline à partir de pancréas de bovins pour prodiguer un traitement efficace contre le diabète. Le premier patient a alors été traité en 1922[26-28]. Les gens atteints de diabète de type 1 et de type 2 pouvaient alors espérer avoir une meilleure qualité de vie ainsi qu'une plus grande survie à court et long terme.
1.3 Le diabète de type 1
Deux causes sont à l'origine du diabète de type 1: destruction des cellules du pancréas en raison d'une réaction auto-immune et cause idiopathique[16].
1.3.1 Destruction des cellules du pancréas par une réaction auto-immune
Cette forme de diabète, également appelée « diabète de type 1 », « diabète insulino-dépendant » ou « diabète juvénile », est le résultat d'une destruction de cellules du pancréas par une réaction auto-immune[16, 18,29]. En effet, les cellules B desîlots de Langerhans, responsables de la formation et de la sécrétion d'insuline, sont détruites à un rythme variant d'une personne diabétique de type 1 à l'autre[29]. Le diabète apparaît lorsqu'environ 90% des cellules p sont détruites[18]. Les marqueurs de cette destruction incluent les anticorps des cellules présentes dans les îlots de Langerhans, les auto-anticorps à l'insuline et les auto-anticorps aux tyrosines phosphates IA-2 et IA-2p[16]. Habituellement, un, et souvent, plusieurs de ces anticorps sont présents chez 85 à 90% des enfants chez qui une hyperglycémie a premièrement été détectée[29]. Chez certains jeunes, le premier symptôme de la maladie est l'acidocétose, car le glucose présent dans le sang ne peut pas entrer dans les cellules afin de fournir l'apport énergétique nécessaire pour leur bon fonctionnement.
production de déchets métaboliques : les corps cétoniques. Les corps cétoniques s'accumulent dans le sang, ce qui le rend plus acide. En conséquence, un grand nombre des enzymes qui assurent les processus métaboliques dans l'organisme ne peuvent plus remplir leur rôle correctement. Une augmentation du nombre de corps cétoniques altère donc également les taux de sucre et d'électrolytes dans l'organisme [29].Par ailleurs, d'autres patients présenteront une hyperglycémie modeste à jeun, qui changera rapidement en hyperglycémie sévère et/ou en acidocétose. Aussi, les adultes n'ont souvent pas de quantité détectables d'anticorps au moment du diagnostic du diabète de type 1, étant donné que, dans la majorité des cas, la destruction des cellulesp se fait depuis plusieurs années et que le rythme de destruction est si lent que la production d'anticorps disparaît[16, 29]. De tous les gens ayant le diabète, 5à 10% ont le diabète de type 1. Il apparait normalement à l'enfance et à l'adolescence, mais il peut également survenir à n'importe quel âge et il est impossible à prévenir. L'insulinothérapie est le seul traitement pour ces gens, et elle est indispensable à leur survie[16, 18,29].
1.3.2 Cause idiopathique
Certaines formes de diabète de type 1 n'ont aucune étiologie. Certains patients ont une insulinopénie permanente et sont très susceptibles de développer de l'acidocétose, mais ils ne présentent aucune évidence de réaction auto-immune. Peu de gens se situe dans cette catégorie, mais la majoritéestd'origine africaine ou asiatique. Ces gens auront des épisodes d'acidocétose et vont présenter des déficiences très variables de la sécrétion d'insuline dans le temps. Le seul moyen de contrôler leurs glycémies est l'insulinothérapie.[16]
1.4 Le diabète de type 2
Les individus ayant le diabète de type 2 (ou « diabète non-insulinodépendant » ou « diabète adulte» sont considérés comme ayant une déficience relative de leur insuline[18]. L'étiologie spécifique de ce type de diabète n'est pas connue et il n'y a pas de destruction des cellules P par éaction auto -immune[16, 18]. Par contre, il est connu que le diabète de type 2 survient à cause d'une anomalie dans la sécrétion de l'insuline et dans son action[16,
18,29]. Les patients qui ont cette forme de diabète peuvent avoir des niveaux normaux ou augmentés d'insuline. En effet, l'hyperglycémie peut avoir comme conséquence une augmentation de la sécrétion d'insuline par les cellulesp du pancréas. Éventuellement, les cellules du corps humain deviendront résistantes à l'insuline, et une plus grande sécrétion de cette dernière sera nécessaire afin de maintenir des niveaux de glycémies dans les normales. Par contre, les cellules P ne peuvent soutenir un rythme élevé de sécrétion d'insuline très longtemps. Elles finiront par «s'essouffler» et la sécrétion d'insuline deviendra insuffisante pour compenser la résistance à l'insuline[16, 18,29]. La résistance à l'insuline peut être améliorée par l'activité physique, par une perte de poids et/ou par un traitement pharmacologique pour l'hyperglycémie[18].
De tous les gens ayant le diabète, 90 à 95% ont le diabète de type 2[16]. Le risque de développer ce type de diabète augmente avec l'âge, l'obésité et l'inactivité physique. Il est également plus fréquent chez les femmes qui ont souffert de diabète gestationnel et chez les individus souffrant d'hypertension artérielle ou de dyslipidémies[29]. Initialement, ces gens n'auront pas besoin d'insuline pour assurer leur survie. Par contre, à un stade plus avancé de la maladie, certaines personnes auront besoin d'insuline, car les cellules P ne pourront plus en sécréter suffisamment pour contrer la résistance à l'insuline[18]. Cette forme de diabète, pour plusieurs personnes, n'est pas diagnostiquée pendant plusieurs années, car l'hyperglycémie se développe graduellement et n'est pas assez sévère pour qu'elles ressentent les symptômes classiques du diabète[16]. Il n'en demeure pas moins que ces gens sont à risque de développer des complications macrovasculaires et microvasculaires dues au diabète[16].
Caractéristiques
Diabète de type 1 Diabète de type 2 « Diabète juvénile, diabète « Diabète adulte, diabète
insulino-dépendant » non insulino-dépendant »
% des diabétiques 5 à 10 % 90 à 95%
Age moyen à l'apparition Habituellement <30 ans
Habituellement > 40 ans, mais aussi tôt que 15 ans chez les adolescents obèses
Corps cétoniques Commun Rare
Poids corporel Non-obèse Obèse (>80% des cas)
Fonction pancréatique Habituellement aucune,
manque d'insuline
Présences de quantités faibles, normales ou élevées
d'insuline
Prévalence 0,5% 6 à 10%
Antécédents familiaux Peu courants Courants (60 à 90% des cas)
Traitements Insuline Alimentation Exercice Insulinosécréteurs Antihyperglycémiants Insuline
Symptômes Apparition subite Apparition plus insidieuse
Complications Fréquentes Fréquentes
11
Chapitre II : Le diabète et les maladies cardiovasculaires
2.1 Le diabète : facteur de risque de la maladie cardiovasculaire
Il est connu que le diabète de type 2 augmente le risque de développer une maladie coronarienne de deux à trois fois chez des sujets ayant cette maladie comparativement à des sujets non-diabétiques [30]. Le diabète est maintenant considéré comme étant un facteur de risque de la maladie cardiovasculaire [3], car des études ont démontré une forte relation entre le contrôle glycémique, mesuré à l'aide de l'HbAic, et les complications vasculaires
du diabète [31, 32]. Les problèmes cardiovasculaires sont la cause de 55% des décès chez les gens diabétiques, alors que les problèmes cérébrovasculaires en sont la cause dans 10% des cas [4]. Mais de quelle façon le diabète engendre-t-il des problèmes vasculaires?
2.2 L'athérosclérose
Le développement de l'athérosclérose est en lien direct avec les problèmes cardiovasculaires. Il faut tout d'abord définir l'athérosclérose et son évolution avant de bien comprendre les effets du diabète sur les différentes étapes du développement de l'athérosclérose. Il faut savoir que la plupart des patients diabétiques vont mourir d'une maladie cardiovasculaire, et que l'athérosclérose compte pour 75% de ces décès [33].
2.2.1 Définition de l'athérosclérose
L'athérosclérose est une maladie chronique et progressive de la paroi des vaisseaux sanguins [34]. Elle est également définie comme étant la perte d'élasticité des artères due à la sclérose provoquée par l'accumulation de lipides au niveau de l'une des trois tuniques constituant la paroi des artères, c'est-à-dire l'intima[18]. Par contre, notre compréhension de cette maladie a beaucoup évoluée dans les dernières décennies. On ne parle plus que de simples dépôts de cholestérol dans les artères, provoquant un rétrécissement progressif de ces dernières et, ultimement, un thrombus complet, mais bien d'un processus actif incluant des signaux moléculaires altérant les fonctions des cellules, incluant une dysfonction
endothelial et une réponse inflammatoire. Nous considérons toujours le développement de l'athérosclérose en phase chronologique. Le début de ce processus apparaît aussi tôt qu'à l'enfance, se développe avec l'âge et se termine avec le décès de l'individu[35, 36]. Le niveau auquel l'athérosclérose se développe dépend de la présence et de la sévérité de plusieurs facteurs de risques de la maladie cardiovasculaire, soit l'âge, le diabète, les dyslipidémies, l'hypertension artérielle et le tabagisme[36].Aussi, des niveaux élevés d'homocystéine et différentes infections peuvent influencer son développement[37]. La progression de l'athérosclérose implique plusieurs processus biologiques qui sont eux-mêmes inter-reliés : l'activation des plaquettes, l'activité thrombotique, le stress oxydatif, la prolifération et l'activation de cellules des muscles lisses, le métabolisme altéré du collagène, l'inflammation, la dysfonction endothéliale et les problèmes dans le métabolisme des lipides. L'athérosclérose se développe donc en étapes qui interagissent entre elles[36, 37].
2.2.2 Les étapes de l'athérosclérose
Diverses observations proposent que la lésion à l'endothélium de l'intima est la première étape de l'athérosclérose[38]. Plus récemment, les hypothèses mettent l'emphase également sur une dysfonction de l'endothélium[5, 18, 35,39]. Chacune des caractéristiques des lésions athérosclérotiques représente une étape différente d'un processus inflammatoire dans lesartères. Si ce processus est excessif, il peut en résulter une lésion avancée[37]. La dysfonction endothéliale mène à une réponse compensatoire venant altérer les propriétés homéostatiques de l'endothélium. Plus les lésions sont compliquées et plus l'endothélium sera perméable et adhérant aux leucocytes et aux plaquettes. Aussi, l'endothélium aura des propriétés pro-coagulantes et formera des molécules actives, telles que les cytokines et les facteurs de croissance[37]. Si la réponse inflammatoire qui résulte de tous ces processus n'est pas capable de neutraliser ces agents, elle continuera indéfiniment. En ce sens, l'inflammation chronique va venir stimuler la migration et la prolifération de cellules musculaires lisses vers la lésion et le lieu de l'inflammation pour former une lésion intermédiaire et la formation de tissus fibreux[40]. Si cette réponse continue avec la mêmeintensité, un phénomène appelé remodelage apparait : la paroi de l'artère devient plus épaisse, mais, pour compenser, l'artère se dilate et sa lumière reste du même diamètre[37].
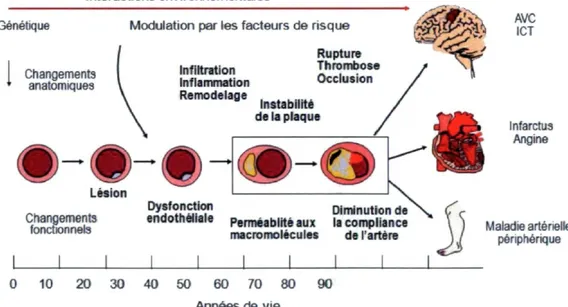
13 L'inflammation chronique vient également augmenter le nombre de macrophages et de lymphocytes au site de la lésion. Ces derniers vont se multiplier davantage lorsqu'ils entreront en contact avec la lésion. L'activation de ces cellules vient augmenter le relâchement d'enzymes hydrolytiques, de cytokines et de facteurs de croissance, ce qui accentue les dommages à l'artère[40]. Tous ces processus se répètent et augmente les dommages au site de la lésion et la restructuration de cette dernière. Au fil du temps, la lésion sera couverte par une couche de tissu fibreux, cachant des gouttelettes de lipides et des tissus nécrosés. La lésion, au départ inoffensive, sera désormais une lésion dite compliquée[37]. À ce niveau, l'artère ne peut plus se dilater suffisamment pour compenser la perte de sa lumière. La lésion va donc progressivement s'introduire dans la lumière de l'artère et venir perturber le débit sanguin, menant à diverses manifestations cliniques de l'athérosclérose : les maladies macrovasculaires[18]. Ces dernières seront décrites plus loin dans ce chapitre. Interactions environnementales Génétique Infarctus Angine Maladie artérielle périphérique 0 10 2 0 3 0 4 0 5 0 60 70 8 0 9 0 Années de vie
Figure 2 : Développement de la plaque athérosclérotique
Traduit et adapté du cours KIN-66948 - Sédentarité, activité physique et santé cardio vasculaire, 2010
2.3 La pathophysiologie du vaisseau diabétique
L'état métabolique anormal qui accompagne normalement le diabète cause plusieurs dysfonctions artérielles. Les anomalies incluent l'hyperglycémie chronique, les dyslipidémies et la résistance à l'insuline. Ces facteurs rendent les artères encore plus susceptibles au développement de l'athérosclérose. Le diabète vient altérer plusieurs fonctions de différentes cellules, dont celles de l'endothélium, des muscles lisses et des plaquettes, et vient également augmenter la coagulation sanguine, ce qui vient accélérer le processus de formation de la plaque athérosclérotique [5, 41].
2.3.1 La dysfonction endothéliale
Une couche simple de cellules endothéliales vient tapisser l'intérieur de chaque vaisseau sanguin, procurant une interface métaboliquement active entre le sang, les tissus, la coagulation et la thrombose[42]. L'endothélium synthétise plusieurs substances bioactives, incluant l'oxyde nitrique. Cette molécule est responsable de la vasodilatation et de la relaxation des vaisseaux sanguins[43]. Aussi, elle vient diminuer l'activation des plaquettes, limiter l'inflammation en diminuant l'adhésion des cytokines à l'endothélium et leur migration sur la paroi des vaisseaux sanguins, et réduire la prolifération de cellules musculaires lisses[43].
Le diabète vient diminuer la vasodilatation induite par l'oxyde nitrique avant même la formation de la plaque athéromateuse[44]. L'hyperglycémie chronique vient inhiber la production d'oxyde nitrique en bloquant une réaction importante à sa formation, c'est-à-dire en bloquant l'activation de la eNOS synthase[45]. Une autre anomalie commune dans le diabète de type 2, la résistance à l'insuline, vient également diminuer la vasodilatation induite par l'oxyde nitrique. Par ailleurs, le diabète vient augmenter la production d'agents vasoconstricteurs, dont l'endothéline-1, qui active le récepteur endothéline-A sur les cellules musculaires lisses, venant induire une vasoconstriction. De plus, l'endothéline-1 augmente la rétention de sel et d'eau, venant stimuler le système rénine-angiotensine, induisant une hypertrophie des cellules musculaires lisses[46].
Donc, le diabète vient accentuer le phénomène de dysfonction endothéliale dans le processus de développement de l'athérosclérose, en diminuant la capacité de vasodilatation
15 des vaisseaux sanguins, en augmentant la vasoconstriction de ces dernières, et en augmentant le nombre et la taille de cellules musculaires lisses qui formeront la plaque d'athérosclérose.
2.3.2 La dysfonction du muscle lisse vasculaire
Les artères qui sont atteintes par l'athérosclérose et par le diabète ont une fonction vasomotrice altérée. Spécifiquement, les patients diabétiques ont une capacité de vasodilatation de leurs vaisseaux sanguins par l'oxyde nitrique qui est diminuée, qui se reflète par une anomalie dans la fonction des cellules du muscle lisse vasculaire[44]. Malgré des évidences de l'augmentation de l'endothéline-1, de l'angiotensine-II, et d'une fonction anormale du système nerveux sympathique, le mécanisme de la dysfonction du muscle lisse vasculaire dans le diabète demeure inconnu. Par contre, il est connu que le diabète stimule l'activité athérogénique du muscle lisse vasculaire. L'hyperglycémie vient activer la protéine-kinase C et le facteur KappaP dans les cellules musculaires lisses des vaisseaux sanguins, ce qui contribue à l'augmentation de la production d'un anion très oxydant, l'O2", contribuant à créer un milieu oxydatif propice au développement de plaques
athérosclérotiques[47].
2.3.3 La dysfonction plaquettaire
Les plaquettes peuvent moduler la fonction vasculaire et participer significativement à la formation de thrombus. Des anomalies dans leurs fonctions peuvent exacerber la progression de l'athérosclérose et résulter en une rupture de la plaque athérosclérotique[48]. Des niveaux élevés de glucose sanguin chez les personnes diabétiques, vient activer la protéine-kinase C, diminuer la production d'oxyde nitrique et augmenter la production de O'", comme dans la dysfonction endothéliale et du muscle lisse vasculaire[49]. Aussi, en présence du diabète, les plaquettes viennent engendrer des problèmes dans l'homéostasie de la régulation du calcium. Des problèmes dans cette régulation contribuent au développement de l'athérosclérose, car le calcium présent dans les plaquettes vient réguler la structure même des plaquettes, la sécrétion et l'agrégation plaquettaire ainsi que la formation de la thromboxane[50].
2.3.4 Anomalies dans la coagulation
En plus de la dysfonction plaquettaire, le diabète vient augmenter la coagulation sanguine, résultant en un potentiel élevé d'occlusion par thrombus dans les artères. Les patients avec le diabète de type 2 ont une capacité de fibrinolyse diminuée, à cause des niveaux élevés de plasminogène dans les lésions athérosclérotique[51]. Le diabète vient également augmenter l'expression du facteur VII favorisant la coagulation, et diminuer les niveaux d'anticoagulants comme l'antithrombine III[52]. Donc, le diabète, en plus d'augmenter les niveaux de coagulation du sang, diminue la fibrinolyse, favorisant ainsi la formation et la présence de thrombusdans les artères.
2.4 Les maladies macrovasculaires
Les manifestations cliniques de l'athérosclérose peuvent se trouver dans trois lits vasculaires du corps humain : les artères coronaires (la maladie coronarienne), les membres inférieurs (la maladie artérielle périphérique) ainsi que dans les artères carotides et cérébrales (l'accident vasculaire cérébral)[5]. Le diabète vient augmenter l'incidence de chacune de ces maladies ainsi que leur développement.Les complications macrovasculaires du diabète de type 2 sont les causes les plus importantes de morbidité et de mortalité dans cette population [41].
2.4.1 La maladie coronarienne
La maladie coronarienne est définie comme étant une maladie touchant les artères coronaires du cœur. Les vaisseaux coronaires fournissent le muscle cardiaque en sang et en oxygène. L'athérosclérose au niveau des parois des artères coronaires entraîne un rétrécissement de la lumière des coronaires, diminuant le passage du sang. Par conséquent, l'approvisionnement du myocarde en oxygène et en nutriments devient insuffisant, ce qui est à l'origine de symptômes, tels que des douleurs rétrosternales et un sentiment d'oppression (angine de poitrine), pouvant mener àl'infarctus du myocarde[l 8].
Les problèmes coronariens sont les causes les plus importantes de morbidité sévère et de mortalité chez les patients diabétiques. Ces derniers ont de deux à quatre fois plus de risque
r
de développer une maladie coronarienne que les patients non-diabétiques[18]. Dans une étude de population[53], l'incidence sur sept ans d'un premier infarctus du myocarde ou de mortalité cardiovasculaire pour les patients diabétiques est de 20%, comparativement à seulement 3,5% pour les patients non-diabétiques. Aussi, une histoire d'infarctus du myocarde augmente la possibilité de subir un deuxième infarctus et le risque de mortalité cardiovasculaire dans ces deux mêmes groupes (45% pour les diabétiques vs 19% pour les non-diabétiques). Dans le registre OASIS[54], une étude sur l'angine instable, le diabète augmente le risque de mortalité de 57%. Donc, en fonction de la sévérité et de la présentation clinique, les patients ayant le diabète ont plus de risquede subir un événement coronarien. S'ils ont déjà eu cet événement, ils ont alors encore plus de risque de subir un deuxième événement et de mourir.
2.4.2 La maladie artérielle périphérique
La maladie artérielle périphérique est une condition qui survient lorsqu'il y a une diminution du débit sanguin artériel au niveau des membres, plus particulièrement dans les jambes, causé par un rétrécissement progressif du calibre des vaisseaux. Elle est l'une des principales causes de morbidité liée aux maladies cardiovasculaires. La maladie artérielle périphérique est causée par l'accumulation de plaque d'athérosclérose (cholestérol, calcium, tissus fibreux, etc.), surtoutau niveau des artères des membres inférieurs. Elle peut également affecter plusieurs artères, que ce soit unilatéral, bilatéral, proximal ou distal. L'apport en oxygène et en nutriments aux muscles est alors diminué (ischémie)[18].
Il y a une association entre la présence du diabète et l'augmentation de la prévalence de la maladie artérielle périphérique. En effet, cette dernière est de deux à quatre fois plus commune chez les diabétiques que chez les non-diabétiques[55]. Aussi, une augmentation de 1% de l'HbAicaugmente de 26% les risques de développer une maladie artérielle
périphérique chez les patients diabétiques[56]. Ces derniers développent également plus souvent les formes symptomatiques de la maladie artérielle périphérique, dont la claudication intermittente. La maladie présente beaucoup plus de complications chez les diabétiques. Ces patients ont cinq à dix fois plus d'amputations de membre que les non-diabétiques [56].
2.4.3 L'accident vasculaire cérébral
Selon l'Organisation Mondiale de la Santé, l'accident vasculaire cérébral (AVC) est le développement rapide de signes cliniques localisés ou globaux de dysfonction cérébrale avec des symptômes durant plus de 24 heurespouvant conduire à la mort, sans autre cause apparente qu'une origine vasculaire [57]. Les cellules nerveuses de la zoneatteinte sont endommagées et périssent. Les fonctions corporelles sont perturbées après une attaque cérébrale et la sévérité des séquelles dépendent de l'étendue et de la situation de la région touchée[18]. L'AVC est une conséquence[18]:
• d'une artère bouchée par un caillot (athérosclérose), bloquant ainsi la circulation sanguine, provoquant ce qu'on appelle un AVC ischémique ou infarctus cérébral (80 % des AVC);
• de la rupture de la paroi d'une artère, ce qui déclenche une hémorragie intracérébrale (15 % des AVC);
• d'une hémorragie méningée, le plus souvent causée par la rupture d'une malformation vasculaire congénitale (5 % des AVC).
Les patients diabétiques développent plus d'athérosclérose au niveau des carotides et des artères du cerveau que les patients non-diabétiques, ce qui fait en sorte que leur circulation sanguine dans les différentes parties du cerveau est perturbée[58]. La présence du diabète chez les patients ayant eu un AVC est trois fois plus grande que chez les patients non-diabétiques. Par ailleurs, le risque d'avoir un AVCest de 150% à 400% plus élevé chez les patients diabétiques comparativement aux individus non-diabétiques[59]. Par le fait même, le diabète augmente d'au moins trois fois le risque de développer de la démence suite à un AVC, double le risque d'un deuxième AVC et augmente la mortalité post-AVC[60, 61].
19
Chapitre III : La chirurgie cardiaque
La maladie coronarienne, comme vu dans le précédent chapitre, est le résultat d'un blocage progressif des artères coronaires par l'athérosclérose. Les problèmes coronariens symptomatiques (angine, infarctus) sont traités initialement par la médication (aspirine, nitrates et bêta-bloqueurs) et par la prévention secondaire (nutrition et activité physique). Les statines sont également des médicaments de choix pour contrôler les dyslipidémies et l'instabilité des plaques athérosclérotiques[6]. Par contre, certains patients devront subir une chirurgie, étant donné la sévérité de leur condition. En effet, les lésions athérosclérotiques venant obstruer à plus de 50% la lumière d'une artère seront considérées comme étant cliniquement significatives et seront une indication pour une possible intervention de revascularisation. Les objectifs de la revascularisation sont les suivants [18]:
• Augmenter le débit sanguin et l'apport en oxygène au myocarde;
• Diminuer ou éliminer les manifestations ou les conséquences potentielles d'ischémie, d'angine et d'arythmie;
• Diminuer la morbidité et la mortalité cardiovasculaire.
Donc, les objectifs clés de la revascularisation sont d'augmenter la survie du patient et/ou de diminuer ses symptômes [62].
3.1 Les chirurgies
Une des justifications de procéder à une chirurgie cardiaque est basée sur une évaluation des risques du patient de subir un événement cardiaque. Plusieurs études ont démontré que la chirurgie cardiaque est très efficace pour diminuer, voire faire disparaître les symptômes d'angine, pour retarder la survenue d'un infarctus du myocarde et, dans la majorité des cas, pour améliorer la survie des patients[6]. Plusieurs chirurgies et techniques de
revascularisation existent. Pour le bien de ce mémoire, nous nous pencherons sur une technique de revascularisation et sur deux types de chirurgie.
3.1.1 L'angioplastie
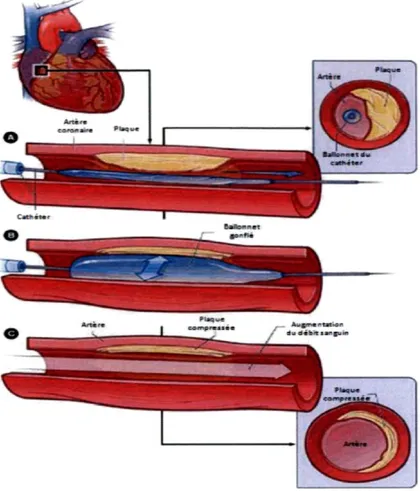
L'angioplastie est une intervention chirurgicale visant à désobstruer un vaisseau sanguin afin d'y rétablir le débit sanguin qui était altéré à cause de la présence d'une plaque d'athérosclérose[18]. Uncathéter est inséré dans l'artère radiale ou l'artère fémorale. À l'aide d'une technique d'imagerie appelée fluoroscopic, le cathéter est acheminé par les vaisseaux sanguins jusqu'à l'endroit de l'intervention, c'est-à-dire au lieu où l'artère coronaire ou une autre subdivision du cœur est obstrué. Une fois rendu à cet endroit, le ballonnet, qui se trouve à l'extrémité du cathéter, est gonflé, écrasant la plaque athérosclérotique sur la paroi de l'artère et permettant ainsi de rétablir le flot sanguin[34]. Par contre, le gonflement du ballonnet seul pour rétablir le flot sanguin comporte deux problèmes très importants : la fermeture abrupte du vaisseau sanguin et la resténose. Environ 2 à 10% des angioplasties par gonflement seul du ballonnet provoquent des dissections de l'intima, des thromboses et des spasmes du muscle lisse provoquant sa fermeture[63]. L'incidence des resténoses est de 40 à 50%, 6 à 9 mois suite à la procédure[64].
L'implantation de tuteurs (grillage que l'on colle à l'aide du ballonnet le long de la paroi de l'artère), en même temps que le gonflement du ballonnet, est la méthode de choix pour éviter ou réduire la survenue de ces problèmes[34]. L'implantation de ces tuteurs va permettre à l'artère de ne pas s'affaisser lorsque le ballonnet sera retiré. Aussi, ils permettront de diminuer le risque de resténose de 30%[65]. Par ailleurs, afin d'éviter le plus possible le risque de resténose, certains tuteurs sont « médicamentés » avec du sirolimus ou du paclitaxel [66]. Ce type de tuteurs relâchent localementde la médication inhibant la prolifération de muscle lisse[34]. Finalement, il a été démontré chez les patients diabétiques que l'angioplastie était moins efficace que chez les patients non-diabétiques, et que le diabète augmentait le risque de resténose et la progression de l'athérosclérose[34].
21
Figure 3: L'angioplastie
Traduit et adapté du site : http://fr.wikipedia.org/wiki/Angioplastie
S t é n o s e A n g l o p l a s t i e b a l l o n n e t A n g i o p l a s t i e t u t e u r T u t e u r
Figure 4 : L'angioplastie avec pose de tuteur
3.1.2 Le pontage coronarien
Si l'angioplastie ne fonctionne pas chez le patient, ou si l'on retrouve plus d'une occlusion ou si les occlusions sont dans des endroits difficiles d'accès pour le cathéter, il est possible d'envisager la chirurgie par pontage coronarien afin d'améliorer l'apport sanguin au myocarde. Elle permet alors de soulager les douleurs thoraciques du patient et d'améliorer son taux de survie[34].
Le pontage coronarien est une intervention à cœur ouvert et se déroule sous anesthésié générale. Habituellement, le cœur doit être arrêté pour réaliser les pontages. Il faut alors mettre en route une circulation artificielle qui alimente l'organisme pendant l'arrêt du cœur[6]. Les différentes étapes de la chirurgie cardiaque sont d'ailleurs décrites plus loin dans ce chapitre.
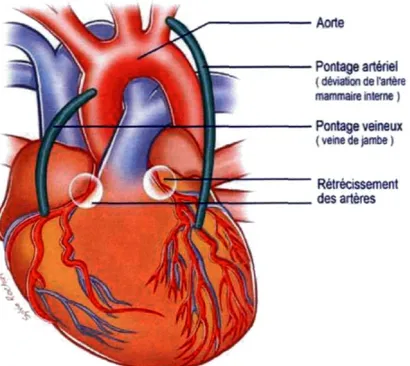
Le pontage coronarien consiste à venir greffer une veine (saphène), ou une artère (artère mammaire interne ou artère radiale) sur l'artère coronaire obstruée[18]. Les greffons (veine saphène et artère radiale) unissent en fait l'aorte et la partie du vaisseau coronaire situé en aval de l'obstruction afin de créer un « pont » permettant de revasculariser toutes les artères rétrécies et d'améliorer l'acheminement du sang riche en oxygène vers le cœur[67]. Dans ce cas-ci, l'artère radiale est utilisée comme un pontage veineux. En ce qui concerne le greffon de l'artère mammaire, ce dernier est suturé directement sur l'artère coronaire obstruée et son point d'origine est laissé en place[34]. Il faut noter que les veines et les artères utilisées lors du pontage coronarien ne sont pas essentielles à leur lieu d'origine [67].
La chirurgie par pontage coronarien dure en moyenne de trois à six heures. Les complications suite à une chirurgie par pontage coronarien se produisent plus souvent chez les patients âgés, les patients diabétiques et les patients obèses[18]. Les diabétiques ont une plus grande incidence de décès post-chirurgie (3,9% vs 1,6% pour des sujets non-diabétiques) ou d'AVC (2,9% vs 1,4%)[68]. Par ailleurs, il a été démontré que l'hyperglycémie lors d'une chirurgie par pontage coronarien était un facteur de risque indépendant pour la mortalité et la morbidité post-chirurgie chez des patients diabétiques
23
[69]. L'incidence d'une occlusion d'un greffon arrive plus souvent entre cinq et huit ans après la chirurgie dans les greffons veineux, alors que dans les greffons de l'artère mammaire interne, il semblerait qu'ils soient résistants à l'athérosclérose. Finalement, environ 50% des gens ayant subi une chirurgie de pontage coronarien seront toujours asymptomatiques dix ans après leur chirurgie [18].
Aorte Pontage artériel ( déviation de l'artère mammaire interne ) Pontage veineux ( veine de jambe ) Rétrécissement des artères
Figure 5 : Le pontage artériel (via l'artère mammaire) et le pontage veineux (via la veine saphène)
Tiré du site : http://dossier.coeur.free.fr/traitement.php
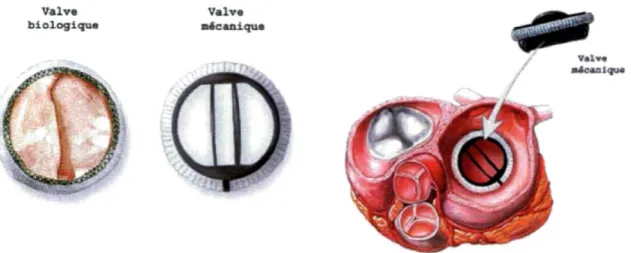
3.1.3 Les remplacements de valve
Une valvulopathie est un dysfonctionnement des valves cardiaques (par exemple : aortique, mi traie, tricuspide) qui vient perturber l'écoulement sanguin à l'intérieur du cœur, que ce soit entre les oreillettes et les ventricules, ou vers l'aorte. Les valves cardiaques ont pour objectif de faire circuler le sang dans une seule et unique direction à l'intérieur du cœur. Il existe deux types de dysfonctionnement d'une valve cardiaque[70]:
• Sténose : La valve ne peut pas s'ouvrir complètement, ce qui limite la quantité de sang pompée vers le reste du corps.
• Insuffisance : La valve ne se ferme pas complètement et le sang peut refluer au lieu de circuler dans une seule direction. Le reflux du sang réduit la capacité du cœur à pomper le sang vers le reste du corps.
Une valvulopathie peut être congénitale, acquise, ou la conséquence d'une infection. Pour la valvulopathie acquise, elle résulte le plus souvent de dépôts de minéraux sur la structure de la valve et les tissus avoisinants, empêchant alors son bon fonctionnement. Lorsque le niveau de sévérité de la sténose ou de l'insuffisance est trop important et engendre des symptômes, le remplacement de la valve malade est un traitement de choix. Le remplacement valvulaire est une opération chirurgicalequi a pour but de remplacer une valve cardiaque soit par une prothèse biologique (tissulaire d'origine animale) ou mécanique,soit par un homogreffe (valve humaine de cadavre) ou une autogreffe (seulement pour la valve aortique qui sera remplacée par la valve pulmonaire), qui fonctionnera exactement comme une valve cardiaque normale. Dans la majorité des chirurgies, il faudra remplacer la valve sous circulation extra-corporelle[70].
Chez certains patients, les valves mécaniques peuvent durer jusqu'à 25 ans.Toutefois, il arrive qu'il faille remplacer une valve si cette dernière est en fin de vie ou si une sténose ou une insuffisance de la valve réapparaît. Les gens ayant une valve mécanique devront prendre un anticoagulant à vie, afin d'éviter la formation de caillots et ainsi assurer le bon fonctionnement de la valve [71]. Par ailleurs, les valves tissulaires doivent généralement être remplacées au bout de 10 à 15 ans ou plus souvent chez les patients plus jeunes ou chez les enfants à cause de leur croissance[72].
25
Valve
biologique mécanique Valve
Figure 6 : Valve biologique et valve mécanique
Tiré du site : http://www.saintluc.be
3.2 Les étapes de la chirurgie cardiaque
Plusieurs étapes doivent être respectées afin d'assurer le bon déroulement de la chirurgie cardiaque ainsi que la sécurité du patient. Ces étapes ont toutes une importance capitale, car la moindre erreur peut avoir un impact important pour la survie du patient.
3.2.1 Arrivée et installation au bloc opératoire
Avant d'entrer au bloc opératoire, un agent anxiolytique (par exemple : Midazolam©,VersedO, etc.) est administré afin de réduire le stress et calmer le patient pour aider à l'induction de l'anesthésie [66]. Rendu au bloc opératoire, le patient est installé sur la table d'opération et une voie de perfusion intra-veineuseest installée dans le bras afin de permettre l'administration de liquide intra-veineux, d'agents anesthésiants et d'autres médications tels que les antibiotiques.Une canule sera installée dans l'artère radiale pour mesurer la pression artérielle afin de pouvoir la contrôler pendant toute la durée de l'intervention chirurgicale. Cette canule permettra également de prélever des échantillons sanguins pour des fins d'analyses en laboratoire [34].Des électrodes sont également installées afin de suivre le pouls du patient, ainsi qu'un appareil de saturométrie, afin de
surveiller le taux d'oxygène dans le sang, et un thermomètre, afin de suivre l'évolution de la température du patient et de la corriger au besoin.
3.2.2 Induction de l'anesthésie
Il est important pour les anesthésiologistes d'atteindre les objectifs de l'anesthésie afin d'assurer la sécurité du patient. Les objectifs d'une anesthésié générale sont l'analgésie, l'amnésie et l'inconscience [34]. L'anesthésie est induite par une combinaison de médications, incluant les agents d'induction (PropofolO, Étomidate©, Kétamine©,etc), les anxiolytiques (Versed©, Propofol©, etc.), les analgésiants (Fentanyl©, Sufentanyl©, etc.),les relaxants musculaires (Pancuronium©, Rocuronium©, etc.) et les anesthésiants en inhalation (Sevoflurane©, Desflurane©, Isoflurane©, etc.)[6]. L'administration de relaxants musculaires est effectuée afin de prévenir la rigidité des muscles de la poitrine associée à l'induction avec des doses élevées de narcotiques [6]. L'induction de l'anesthésie par voie intra veineuse produit une apnée assez rapidement, nécessitant une assistance ventilatoire immédiate par l'intermédiaire d'un masque [34].
3.2.3 Période pré-circulation extra-corporelle
Une fois le patient endormi, l'anesthésiologiste pourra l'incuber afin de permettre la ventilation. L'anesthésie sera maintenue par l'administration en continu ou en intermittence d'anesthésiants[6]. Une perfusion sera installée dans une veine centrale, plus souvent dans la veine jugulaire interne. Un cathéter de type« Swan-Ganz » sera également introduit par cette même voie, afin de mesurer les pressions pulmonaires ainsi que le débit cardiaque. Une sonde sera également introduite dans le conduit urinaire afin de recueillir les urines et d'en calculer la quantité. Après la mise en place de tout ce matériel, le patient sera badigeonné d'une solution antiseptique sur la presque totalité de son corps. Les champs opératoires seront installés, ainsi que les instruments nécessaires à la chirurgie. Le chirurgien pourra alors faire la sternotomie et commencer l'opération chirurgicale. Pendant ce temps, l'anesthésiologiste effectue une échocardiographie trans-œsophagienne afin de réévaluer la fonction cardiaque et la nature des lésions[34]. Il s'occupe également de l'hémodynamie, en étant prêt à administrer des médications vasodilatatrices (Nitroglycérine©, Nitroprusside©, etc.) ou vasopressives (Noradrenaline©, Phenylephrine©, Ephédrine©, etc.) afin de réguler la perfusion des organes vitaux[66].
27
Par contre, le chirurgien ne peut opérer le cœur facilement, dû aux battements cardiaques et aux mouvements respiratoires. Il faut donc ralentir la fréquence cardiaque ou arrêter le cœur. Cette situation est incompatible avec la vie, car les organes ne seront plus perfuses et oxygénés. La solution à ce problème se trouve en la circulation extra-corporelle.
3.2.4 Période de circulation extra-corporelle
La CEC permet de remplacer le cœur et les poumons durant la chirurgie cardiaque. L'appareil de circulation extra-corporelle s'occupe d'oxygéner le sang et de le faire circuler[6, 34]. Afin de pouvoir utiliser cette technique, l'anesthésiologiste doit administrer une dose d'héparine intra veineuse pendant la période de pré-circulation extra-corporelle afin de diminuer la coagulation sanguine et éviter la formation de caillots dans la tubulure de l'appareil, pouvant ainsi mener à des problèmes très graves pour le patient (thrombus, embolie, AVC, etc.). Le perfusionniste doit également, à plusieurs reprises durant la période de circulation extra-corporelle, mesurer l'efficacité de l'héparine à l'aide de l'ACT (activating clothing time). À ce moment, il jugera s'il doit donner ou non une dose supplémentaire d'héparine[6].
La circulation extra-corporelle permet donc des échanges gazeux adéquats, une perfusion normale des organes du corps humain, un contrôle adéquat de la température du corps et un recueil du sang du champ chirurgical avec retransfusion de ce sang de manière sécuritaire au patient. L'appareil de circulation extra-corporelle est de fabrication complexe et il en existe plusieurs marques sur le marché. La figure suivante nous donne une idée de l'appareillage nécessaire.[6]
Figure 7 : Les bases de la circulation extra-corporelle[6]
Le sang est amené par gravité par la ligne veineuse (A) dans un réservoir (B), est pompé par une pompe centrifuge (C) jusqu'à l'oxygénateur (D) et à la ligne artérielle (E) et est retourné dans la circulation par la ligne artérielle (F). Des lignes supplémentaires de succion (G) peuvent être utilisées pour la ventilation intracardiaque et pour enlever le sang du champ opératoire.
Finalement, afin d'arrêter le cœur pour permettre l'intervention chirurgicale, une technique appelée cardioplégie sera utilisée. La cardioplégie est réalisée en injectant directement dans les artères coronaires une solution riche en potassium. Cela va immédiatement provoquer l'arrêt du cœur, sans compromettre sa survie. Les poumons pourront également être arrêtés. Le chirurgien pourra alors effectuer l'intervention chirurgicale sans que le cœur ne contracte constamment et sans que les poumons ne fonctionnent. Des doses de cardioplégie devront être données quelques fois durant la chirurgie afin de maintenir l'arrêt du cœur.[34]
29 3.2.5 Période post-circulation extra-corporelle
Lorsque l'intervention chirurgicale est terminée, le cœur pourra de nouveau entrer en fonction et les poumons seront ventilés par un respirateur artificiel, ce qui permettra l'arrêt de la circulation extra-corporelle. Le cœur doit par contre repartir de par lui-même. S'il repart, mais que son rythme est anormal (par exemple, fibrillation ventriculaire), il devra être défibrillé. Le chirurgien installe également des drains thoraciques afin d'évacuer le sang, et des fils de stimulateur cardiaque afin de permettre au cœur de battre normalement en cas d'arythmies ou de ralentissement de la fréquence cardiaque. Le sternum sera ensuite refermé à l'aide de fils d'acier [6, 34, 66].
Pendant ce temps, l'anesthésiologiste s'occupe toujours de l'hémodynamie, mais effectue également une échocardiographie post-chirurgie afin d'évaluer l'effet des procédures chirurgicales effectuées. Il s'occupera également de surveiller la saturométrie, l'électrocardiogramme et la pression artérielle lors du transport du patient de la salle d'opération vers l'unité des soins intensifs, où il séjournera moins de 24 heures. Quelques heures après son arrivée à cette unité, le patient sera éveillé et extubé si aucune complication ne se présente.
30
Chapitre IV : Les déterminants de la perfusion cérébrale
: impact du diabète
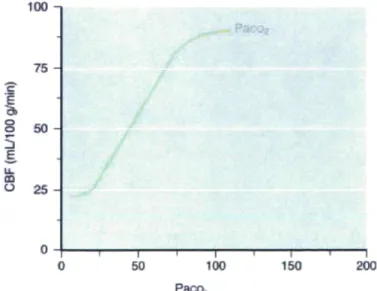
Le cerveau compte pour 2% de la masse totale du corps et reçoit de 15 à 20% du débit cardiaque, ce qui en fait l'un des organes le mieux perfusé. Il metabolise de 20 à 25% de l'oxygène du corps humain et consomme environ 400 calories par jour, en utilisant surtoutle glucose, seulement pour assurer son bon fonctionnement^]. Depuis quelques années, le lactate est également de plus en plus reconnu comme étant une source d'énergie pour le cerveau [74]. Environ 60% de la consommation énergétique du cerveau est utilisée pour assurer la fonction électrophysiologique, c'est-à-dire l'activité de dépolarisation et de repolarisation des cellules [75].Afin de subvenir aux besoins énergétiques et en oxygène du cerveau, le corps humain doit lui fournir un débit sanguin élevé et constant[73]. Par contre, étant donné l'espace restreint dans la boîte crânienne, le débit sanguin ne doit pas être excessif [75]. Plusieurs facteurs viendront moduler la perfusion et la régulation cérébrale. Il faut tout d'abord préciser que, dans plusieurs situations cliniques, les changements d'oxygénation cérébrale se font parallèlement aux changements du débit sanguin cérébral[76]. Si le débit sanguin cérébral diminue, l'oxygénation cérébrale sera également réduite, et vice-versa.Une augmentation ou une diminution de l'oxygénation cérébrale sont le reflet de perturbations du débit sanguin cérébral [76].
4.1 D é t e r m i n a n t s de la perfusion c é r é b r a l e 4.1.1 La pression artérielle
La pression dans les artères cérébrales est considérée comme étant le reflet de la pression de perfusion cérébrale (PPC) [77]. Le maintien du débit sanguin cérébral et de la PPC dépend de la pression intracrânienne (PIC), de la pression artérielle moyenne (PAM), de la pression hydrostatique (Phydro) et de la pression veineuse (PV) [73]. En ce qui a trait à la PV, elle se situe habituellement à quelques mmHg plus bas que la pression atmosphérique.
C'est pour cette raison que la PAM sera considérée, dans la plupart des situations, comme étant représentative de la PPC [77].
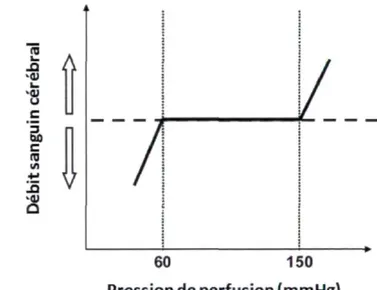
La PPC se situe normalement dans les alentours de 80 mmHg au repos. Par contre, si la pression artérielle diminue ou augmente, plusieurs mécanismes physiologiques entrent en jeu afin de maintenir un débit sanguin constant, dont l'autorégulation cérébrale [77, 78]. Entre autre, lorsque la pression artérielle augmente, il y aura une vasoconstriction des arterioles, donc une augmentation de la résistance vasculaire cérébrale pour contrôler le débit sanguin cérébral. Inversement, lorsque la pression artérielle diminue, il y aura une vasodilatation des arterioles, donc une diminution de la résistance vasculaire cérébrale pour contrôler le débit sanguin cérébral. Voici la formule qui représente l'interaction entre les différentes pressions afin de maintenir le débit sanguin cérébral :
PPC = PAM - (PIC + Phydro + PV)
4.1.2 La résistance vasculaire cérébrale
La résistance vasculaire cérébrale a une influence sur le débit sanguin cérébral. En effet, ce dernier sera influencé par des forces systémiques et des facteurs locaux d'impédance, peu importe la PPC. La résistance vasculaire cérébrale dépend elle-même de différents facteurs, comme la viscosité du sang et la nature des lits vasculaires intracrâniens [75].
• Viscosité du sang
■ Le taux d'hématocrite est le déterminant le plus important de la viscosité sanguine [79]. Chez des sujets sains, la variation du taux d'hématocrite dans les valeurs normales (entre 33% et 45%) résultent en des altérations modestes du débit sanguin cérébral. Par contre, si le taux d'hématocrite varie en dehors des valeurs normales, les changements du débit sanguin cérébral seront plus importants. Par exemple, lorsqu'une personne souffre d'anémie, sa résistance vasculaire cérébrale sera réduite et son débit sanguin cérébral sera plus élevé [75].
32
• Nature des lits vasculaires intracràniens
■ La nature des lits vasculaires intracràniens dépend elle-même de différents facteurs. Elle varie selon la vascularisation intracrânienne, c'est-à-dire selon le nombre, le diamètre et la longueur des vaisseaux sanguins, et par leurs connections. Elle dépend également de la pression intracrânienne et de l'activité vasomotrice [75]. Tous ces facteurs entrent en jeu pour réguler le débit sanguin cérébral.
4.1.3 Le débit cardiaque
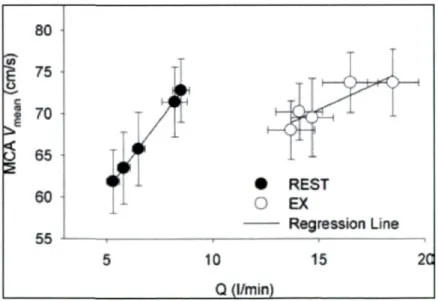
Le débit cardiaque est un facteur qui peut influencer directement le débit sanguin cérébral. Dans une étude effectuée chez des sujets humains, Ogoh et collaborateurs [80] ont trouvé une relation linéaire entre le débit cardiaque et le débit sanguin cérébral, mesuré à l'aide de la vitesse du débit sanguin dans l'artère cérébrale moyenne (MCAVmoy), que ce soit au
repos ou à l'exercice aérobie. Il faut également ajouter que cette relation linéaire est indépendante de l'autorégulation cérébrale et de la pression partielle en dioxyde de carbone (PaCO:). La figure suivante nous démontre d'ailleurs cette relation.
iA 80 75 70
5 65
60 55^pff
• REST O EX Regression Line 10 15 Q (l/min) 2CFigure 8 : Relation entre le débit cardiaque (Q) et le débit sanguin cérébral
(MCAVmean)
![Figure 7 : Les bases de la circulation extra-corporelle[6]](https://thumb-eu.123doks.com/thumbv2/123doknet/7595196.232622/42.918.167.789.93.617/figure-bases-circulation-extra-corporelle.webp)