© Dany Croteau, 2019
Succession saisonnière et écophysiologie des
diatomées arctiques: relation entre l’habitat, la niche
lumineuse et la stratégie photoadaptative
Mémoire
Dany Croteau
Maîtrise en biologie - avec mémoire
Maître ès sciences (M. Sc.)
Succession saisonnière et écophysiologie des
diatomées arctiques: relation entre l’habitat, la niche
lumineuse et la stratégie photoadaptative
Mémoire
Dany Croteau
Sous la direction de :
Johann Lavaud, directeur de recherche
Marcel Babin, codirecteur de recherche
ii
Résumé
L’environnement lumineux de l’Océan Arctique est unique en raison d’interactions complexes entre la lumière et le couvert de glace de mer enneigé, et les oscillations de photopériodes extrêmes. Le succès des organismes photosynthétiques arctiques suggère donc des mécanismes de régulation flexibles qui permettent la survie lors de longues périodes d’obscurités, la capture de photons dans la pénombre sous la glace et la photoprotection rapide lors d’éclairements excessifs soudains. Les diatomées sont les producteurs primaires arctiques principaux. Elles exploitent le continuum de niches lumineuses induit par la transformation saisonnière de leur habitat au cours d’une succession de formes de vie sympagiques (glace) et planctoniques (eau). Lorsque la photosynthèse sature, les diatomées dissipent l’énergie lumineuse excessive en chaleur via le quenching non-photochimique (NPQ), principalement contrôlé par l’action du cycle des pigments xanthophylles (XC). Généralement, chez les diatomées, l’opération de ces mécanismes de photoprotection est finement adaptée à leur niche lumineuse. Cependant, peu d’études se sont intéressées aux souches arctiques, malgré les profonds contrastes de niches lumineuses qu’elles surmontent (glace, sous la glace, eaux de fontes, eaux libres). Ce manque de données entrave nos capacités à anticiper l’impact de l’intensification de l’environnement lumineux de l’océan Arctique, causée par la réduction de la superficie et de l’épaisseur du couvert neige-glace, sur l’intégrité écosystémique. Nous avons étudié les réponses à la lumière de cinq espèces de diatomées arctiques représentatives des différentes phases et habitats de leur succession saisonnière. Les espèces sympagiques ont exprimé une stratégie photoadaptative survivaliste, caractérisée par une croissance saturée à faible éclairement et un fort NPQ longuement maintenu à l’obscurité. Les espèces planctoniques ont montré une plus grande flexibilité d’exploitation de la lumière et une importante photoprotection activée par des éclairements intense et l’obscurité prolongée. Ces stratégies photoadaptatives divergentes gouverneront probablement des réponses hétérogènes à l’intensification de l’environnement lumineux arctique.
iii
Abstract
Over their highly productive seasonal succession, Arctic diatoms occupy shifting habitats and contrasted light climates defined by snow/ice cover dynamics and extreme photoperiod variations. These unique light environment features suggest Arctic diatoms are well adapted to survive prolonged darkness periods, exploit minimal light in snow-covered sea-ice and overcome spontaneous excessive, and potentially harmful, light exposures. Diatoms mitigate photooxidative damages by dissipating oversaturating light energy as heat via the non-photochemical quenching (NPQ), mainly regulated by the xanthophyll cycle (XC). How heterogeneous light niches influence Arctic diatoms photoadaptative traits remains largely unknown and a crucial missing link to apprehend Arctic Ocean’s response to shrinking sea-ice and increasing illumination. To address this question, we selected five Arctic diatoms species harbouring diverse life traits and representative of distinct phases across the seasonal light niche continuum: from snow-covered dimly lit bottom sea-ice to summer stratified waters. To access how Arctic diatoms cope with a heterogeneous light environment, we studied their acclimation to two light intensities and subsequent darkness incubations, and parametrized NPQ-XC induction upon light shifts. Our results highlight the sea-ice cover as a strong selective force shaping Arctic diatoms photoadaptative strategies. Ice-related species exhibited a survivalist photoadaptive strategy with growth saturating at low irradiance and strong photoprotective capabilities sustained even in darkness. Open-water species photophysiology was more dynamic, expressing flexible light utilisation capacities and great photoprotection capacities triggered by high light and darkness. Ice-edge species showed strong adaptation to light fluctuations and dark physiology fine-tuned depending upon light history. We argue that diverging photoadaptative strategies foster Arctic diatom success in their respective seasonal niches and will likely drive uneven responses to a transforming Arctic Ocean.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Liste des tableaux ... v
Liste des figures ... vi
Liste des abréviations ... x
Remerciements ... xi
Avant-propos ... xii
Introduction ... 1
La transformation saisonnière de l’océan Arctique alimente une production primaire cyclique ... 1
Les diatomées : actrices écologiques essentielles bien adaptées à l’océan Arctique ... 5
Les diatomées arctiques s’acclimatent à leur environnement lumineux ... 8
Le NPQ et le cycle des xanthophylles des diatomées en réponse aux forts éclairements ... 8
Le NPQ et le XC des diatomées arctiques à l’obscurité ... 11
L’écophysiologie des diatomées est intrinsèquement liée à leur réponse à la lumière ... 12
Problématique ... 14
Objectifs et hypothèses ... 15
Chapitre I: Arctic diatom photoadaptative strategies: A seasonal story ... 16
Résumé ... 17
Abstract ... 18
Conclusion ... 41
Bibliographie ... 45
v
Liste des tableaux
Table 1: Arctic diatom species used in this study with their strain references and defining
life traits (Succession phases refer to Fig. 1). ………..….………...3
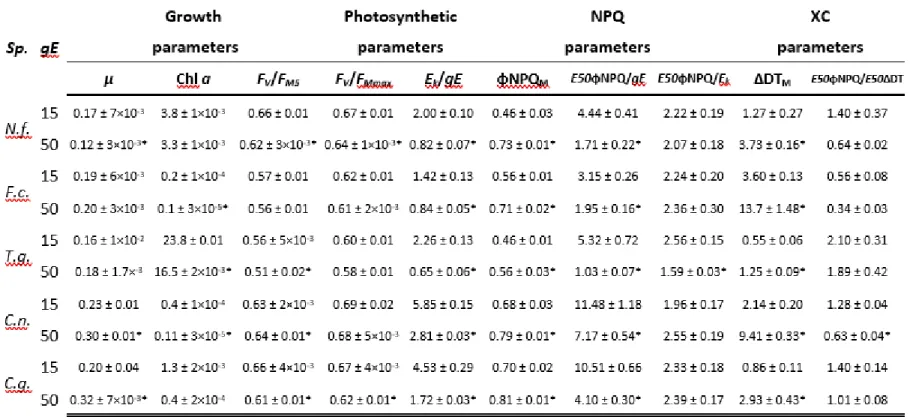
Table 2: Growth, photosynthetic, non-photochemical quenching (NPQ) and xanthophyll
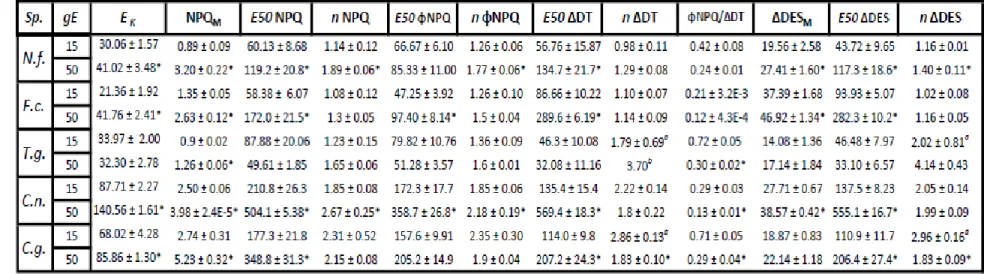
cycle (XC) parameters derived by fitting non-sequential light curves as described in (Serôdio & Lavaud, 2011) (all chlorophyll fluorescence parameters are described in Table S1). Asterisks indicate significant difference between acclimation in a same species (p <0.05, unpaired t-test). Additional physiological parameters can be found in Table S2 and inter-species statistic tests results in Table S3.………...26
Liste des tableaux en annexes
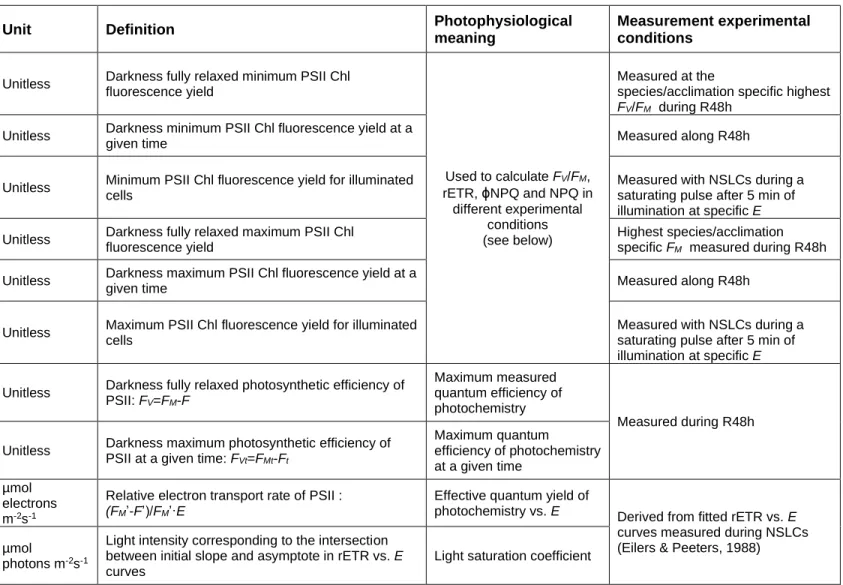
Table S1: Parameters investigated in this study, their units, definition, physiological
meanings and experimental conditions of measurement. ………..60
Table S2: Table S2: Light saturation coefficient (Ek), non-photochemical quenching (NPQ)
index and yield (ϕNPQ), newly diatoxanthin accumulation (ΔDT (mol 100 mol Chl a-1) and
de-epoxidation (ΔDES (%)) parameters derived by fitting non-sequential light curve as described in Serôdio & Lavaud, 2011 (all parameters are described in Table S1, DES fits are in Fig. S4). Asterisks indicate significant difference between gE in a same species (p <0.05, unpaired t-tests). Data are mean N=3, ± SE, except where otherwise stated. …...………..….63
Table S3: A) Results of a 2-way ANOVA analysis followed by Tuckey HSD test to compare
the effect of species (sp.), growth light (gE) and their interaction(sp.*gE) on different growth, photosynthetic, non-photochemical quenching (NPQ) and xanthophyll cycle (XC) parameters. Letters represent clusters of non-significantly different means for the corresponding parameter, A being the highest mean values and other letters following in alphabetic order B) Degrees of freedom (df), F-value and p-value of the 2-way ANOVA. ..64
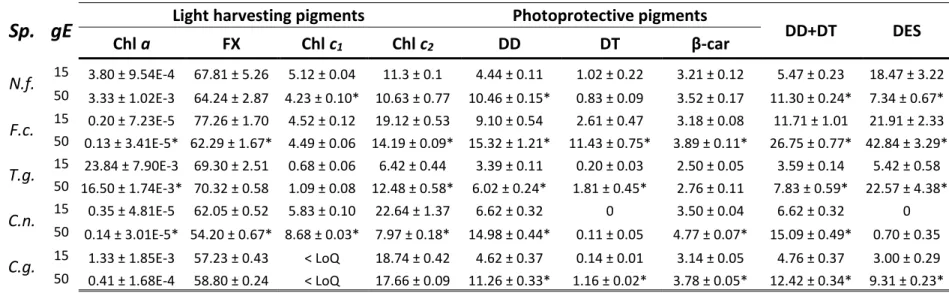
Table S4: Cellular chlorophyll (Chl) a concentration (pg cell-1), pigments relative content
(mol 100 mol Chl a-1) and de-epoxidation state (DES) (%) in all species/growth light (gE) after 5 min of darkness incubation. Asterisks indicate significant difference (p <0.05, unpaired t-test) between pigment contents under 15 and 50 µmol photons m-2 s-1 growth light
vi
Liste des figures
Figure 1: Schematic representation of the average Arctic diatom seasonal succession in
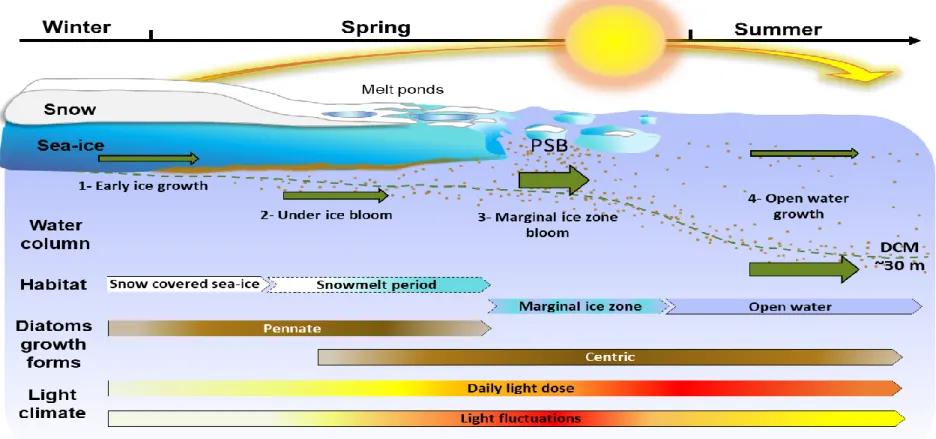
Baffin Bay (67.48 N; 63.79 W) through four contrasted phases along yearly light environment continuum. Daily light dose corresponds to atmospheric radiations measured above ocean level and is governed by photoperiod and solar angle-of-incidence. Light fluctuations frequency and amplitude increase with snowmelt and sea-ice cover heterogeneity (see Introduction). Diatom pennate growth form dominates sea-ice biomass and centric growth form dominates plankton. See (Oziel et al., 2019 and Randelhoff et al., 2019) for in depth description of the physicochemical parameters determining phytoplankton spring bloom (PSB) onset in Baffin Bay and Fig. S1 for in situ photosynthetic available radiation measurements at ice-water interface and in water column. Dashed green line represent the deep chlorophyll maximum (DCM). ………...2
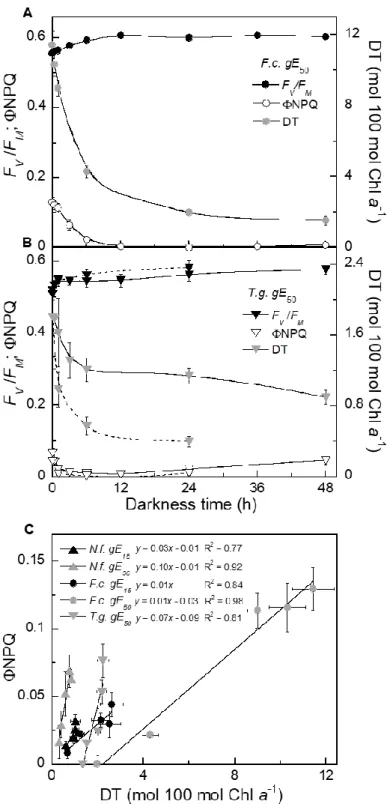
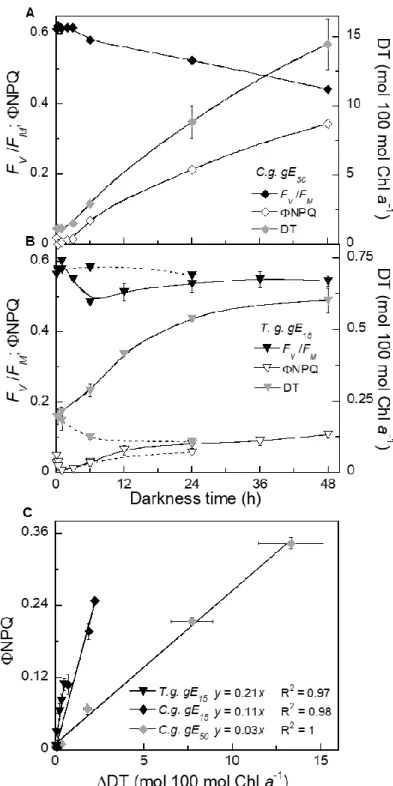
Figure 2: Sustained non-photochemical quenching (NPQS) relaxation in A) Fragilariopsis cylindrus (F.c.) and B) Thalassiosira gravida (T.g.) acclimated to 50 µmol m-2 s-1 growth light (gE); dashed lines represents values measured during parallel relaxation under 1 µmol photons m-2 s-1. C) Linear correlation between NPQ quantum yield (ΦNPQ) and diatoxanthin (DT) content in all species/gE for which NPQS was observed. Data are mean values N=3, ±
SE. See Fig. S3 for complete fluorescence and pigment kinetics in all species/gE.……...…..28
Figure 3 : Darkness non-photochemical yield (ΦNPQ) development and diatoxanthin
accumulation (ΔDT) in A) Chaetoceros gelidus (C.g.) and B) Thalassiosira gravida (T.g.) acclimated to 50 and 15 µmol m-2 s-1 growth light (gE) respectively; dashed line represents values measured during parallel relaxation under 1 µmol photons m-2 s-1. C) Linear correlation between ΦNPQ and ΔDT in all species/gE for which darkness ΔDT accumulation was observed. Data are mean values N=3, ± SE. See Fig. S3 for complete fluorescence and pigment kinetics in all species/gE ……….29
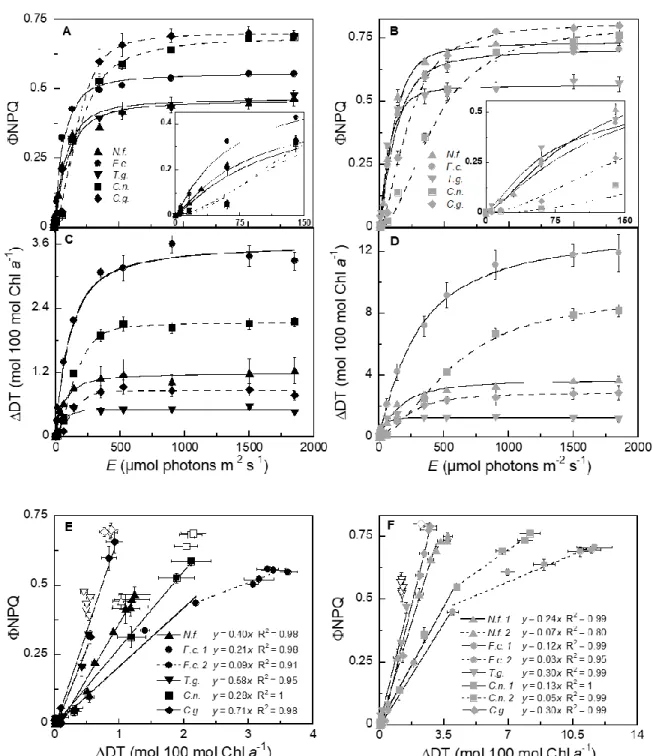
Figure 4: A-B) Non-photochemical quenching yield (ΦNPQ) and C-D) diatoxanthin
accumulation (ΔDT) induction measured during non-sequential light curves in all species acclimated to 15 (left panels) and 50 µmol m-2 s-1 (right panels) growth light (gE). Ice-related and open-water species are distinguished by continued and dashed lines respectively. E-F) Linear correlations between ΦNPQ and ΔDT. Dashed lines and open symbols represent departure from typical ΦNPQ/ΔDT linear relationship (see Discussion). Data are mean values N=3, ± SE. See Fig. S4 for de-epoxidation state accumulation and Fig. S5 for Stern-Volmer NPQ index values. ………...………31
vii
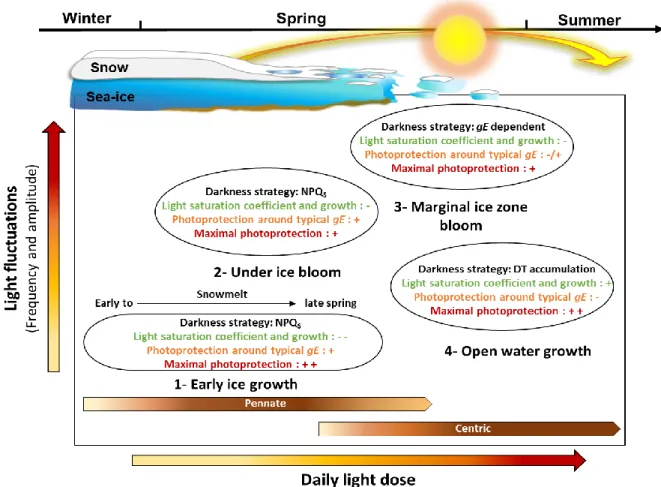
Figure 5: Cartesian coordinates of four light niches, parameterized by daily light dose and
light fluctuations, with the hypothetical photoadaptative strategy (darkness strategy, light harvesting efficiency (Ek) and growth (µ), photoprotection around typical growth light (gE)
(E50ΦNPQ, nΦNPQ, E50ΔDT, nΔDT, ΦNPQ/ΔDT) and maximal photoprotection (ΦNPQM,
ΔDTM)) of the diatom species dominating these niches. Transition between light niches
follows the Arctic Ocean seasonal habitat transformation and are described in Introduction and Fig. 1. Daily light dose and light fluctuations are also influenced by depth (see Discussion) in planktonic niches (3 and 4). Adapted from Dimier et al., 2009. NPQ(S),
(sustained) non-photochemical quenching; DT, diatoxanthin. All parameters value found in Table 2 and S2 and defined in Table S1……….……33
viii
Liste des figures en annexes
Figure S1: Time series of daily light doses Arctic diatoms are seasonally exposed to in Baffin
Bay. A) Daily light dose calculated from in situ photosynthetic available radiation (PAR) measured at ice-water interface during the 2015 and 2016 Green Edge ice-camp (Qikiqutarjuaq Island, 67.48 N; 63,79 W) campaigns as described in Oziel et al., 2019. Vertical dashed lines represent snowmelt initiation, melt pond initiation and sea-ice breakup. B) Daily light dose corresponding to PAR measured aboard the CCGS Amundsen at 3 and 30 m depths in the water column during the Green Edge campaign 2016 (Randelhoff et al., 2019). Horizontal dotted lines refer to the daily light doses corresponding to a 24 h illumination under the growth lights (gE) of 15 and 50 µmol photons m-2 s-1 used to grow diatom cultures in this study. Sea-ice break-up timing mismatch between graphs is due to longitude shifts between ice-camp and open-water sampling stations (see references for further details). .……….………67
Figure S2: 450 nm Normalised emission spectra of sunlight under Arctic Ocean sea-ice
(blue) and superficial water column layer (black), 24V white LED source (Super Bright LEDs, St-Louis, MO, USA ) used in this study (yellow), typical culture chamber light bulbs (grey) and absorption spectrum of Fragilariopsis cylindrus cells acclimated at 50 µmol photons m-2 s-1 (brown). All spectrums normalised at 450 nm. Field data measured at Green
Edge Project Ice Camp site (Qikiqutarjuaq Island, 67.48 N; 63.79 W) (see Oziel et al., 2019). Cultured cells measurement with dual beam spectrophotometer (Perkin Elmer, Lambda850, Woodbridge, Canada) equipped with an integrating sphere………...…………68
Figure S3: Complete relaxation kinetics during 48 h darkness incubations in all
species/acclimation studied. Left panels show mean (N=3 ± SE) of fluorometric parameters (described in Table S1); FV/FM (black markers), ΦNPQ (yellow), FM (blue), F (grey) (in
relative fluorescence unit (RFU)). Right panels show xanthophyll cycle related measurements; de-epoxidation state (DES) (brown), total xanthophyll pigments (XP) content (purple), diadinoxanthin (DD) content (green) and diatoxanthin (DT) content (red). Open symbols with discontinued trendline represents data acquired during additional experiments of 24 h relaxation under 1 µmol photons m-2 s-1. ………...……….69
Figure S4: Values of de-epoxidation state increase (ΔDES) as a function of light intensity
(E) exposure during non-sequential light curves in all species acclimated to a) 15 and b) 50 µmol photons m-2 s-1 growth light. Ice-related and open-water species are distinguished by continued and dashed lines respectively. Data are mean N=3, ± SE. ……….72
Figure S5: Stern-Volmer non-photochemical quenching (NPQ) index as a function of the 0
to 1 bounded NPQ yield (ΦNPQ) parameter. All values measured following 5 min of light exposures between 6 to 1850 µmol photons m-2 s-1 during non-sequential light curves in cells acclimated to 15 (black) and 50 (grey) µmol photons m-2 s-1. NPQ = FM/FM’-1 and ΦNPQ =
ix
Figure S6: β-carotene amount (µg/L) (diamonds) and relative content (mol 100 mol Chl a-1) (circles) variations during 48 h dark incubation in Chaetoceros gelidus acclimated to 15 (black) and 50 (grey markers) µmol photons m-2 s-1. The asterisk represents significant augmentation in β-carotene amount over 48 h (p = 0.03, paired t-test) which is undiscernible in relative content because Chl a amount also augments during darkness incubations. Data are mean N=3, ± SE.. ………74
x
Liste des abréviations
µ Taux de croissance
ΔpH Gradient de protons transthylacoïdal
ATP Adénosine triphosphate
Chl Chlorophylle
DD Diadinoxanthine
DDE Diadinoxanthine dé-époxydase
DEP Diatoxanthine époxydase
DES État de dé-époxydation/De-epoxidation state
DT Diatoxanthine
E Intensité lumineuse
E50 Intensité lumineuse de demi-saturation des paramètres photophysiologiques
Ek Éclairement de saturation des paramètres photosynthétiques
F’ Fluorescence minimale steady-sate de cellules acclimatées à la lumière
F0 Fluorescence minimale de cellules acclimatées à l’obscurité
FM Fluorescence maximale de cellules acclimatées à l’obscurité
FM’ Fluorescence maximale de cellules acclimatées à la lumière
FV Fluorescence variable (Fv = Fm – F0)
FV/FM Rendement quantique (quantum yield) maximal du PSII à l’obscurité
ɸPSII Rendement quantique (quantum yield) effectif du PSII
gE Éclairement de croissance/Growth light
LHC Complexe antennaire de collecte de la lumière/ Light harvesting complex MGDG Monogalactosyldiaglycérol
n Coefficient de Hill
NADPH Nicotinamide adénine dinucléotide phosphate
NPQ Quenching non-photochimique/ Non photochemical-quenching
NPQS NPQ soutenu/ NPQ sustained
ΦNPQ Quantum yield du quenching non-photochimique
NSLC Courbe de lumière non-séquentielle/ Non-sequential light curve PS I/II Photosystème I/II
qE Quenching énergie-dépendant
qI Quenching de photoinhibition
qZ Quenching lié à la zéaxanthine
RFU Unités de fluorescence relative/ Relative fluorescence units ROS Dérivés réactifs de l’oxygène/ Reactive oxygen species Rubisco Ribulose-1,5-biphosphate carboxylase/oxygénase XC Cycle des xanthophylles/ Xanthophyll cycle
xi
Remerciements
Tout d’abord, j’aimerais remercier mon directeur Johann Lavaud d’avoir toujours été disponible lors de ma maîtrise pour me conseiller, me transmettre ses connaissances et répondre à mes nombreuses questions. Mais surtout, merci de m’avoir fait confiance et laissé la liberté d’explorer et de suivre mes intuitions au fil de ma progression. Je veux également remercier Johann de m’avoir offert la chance de présenter des résultats dans plusieurs congrès et de m’aider à orienter la suite de mes études en recherche. Je voudrais également remercier mon codirecteur Marcel Babin et Doug Campbell, membre de mon comité d’encadrement, d’avoir enrichi mon parcours avec leur savoir et leurs commentaires constructifs.
Merci à Sébastien Guérin d’avoir partagé les hauts et les bas de la culture de microalgues avec moi et d’avoir aidé dans mes expériences. Mais surtout, merci de ta générosité, de ton temps et de ton savoir-faire technologique qui a permis d’améliorer et de faciliter la réalisation de mon projet de maîtrise. Merci à Flavienne Bruyant et Joannie Ferland pour leur encadrement en laboratoire, leurs explications du fonctionnement des nombreux appareils et protocoles, l’aide lors des expérimentations et leurs réponses aux questions le vendredi à 16h30.
Je voudrais également remercier le reste de l’équipe Takuvik qui m’a aidé au cours de ma maîtrise : merci à Marie-Hélène Forget, Julie Sansoulet et Debra Christiansen-Stowe pour le soutien administratif; merci à Emilie Doucet, Sarah-Michèle Cormier, Marine Béguin, Nicolas Schiffrine et Jade Larivière pour le soutien en laboratoire, merci à Véronique Richard et Mélanie Simard pour les extractions HPLC, merci à Philippe Massicote et Sébastien Guérin pour l’aide en statistiques et avec les scripts R; merci à Guislain Bécu pour l’aide avec les données de Green Edge.
Je souhaiterais finalement remercier les gens dans ma vie personnelle qui m’ont aidé à compléter ma maîtrise grâce à leur support moral. Je veux d’abord remercier ma meilleure amie et mon amoureuse, Nitaya. Merci d’avoir supporté ma mauvaise humeur lors de mes difficultés et mon horaire surchargé lors de mes réussites. Merci d’être ma plus grande motivation à ne pas procrastiner pour avoir plus de temps à passer avec toi. Merci à Francis, Nico, Vincent et Guillaume d’avoir partagé l’expérience amour-haine des études supérieures avec moi et de m’avoir écouté me plaindre plus souvent qu’à mon tour. Merci à mes amis, ma gang de bio et ma gang de fous, pour les rires et les bons moments qui ont rendu ces deux dernières années si mémorables. Merci à mes parents et mes sœurs, qui autant pour ma maîtrise que pour mes autres projets, n’ont pas besoin de comprendre exactement ce que je fais pour m’encourager et être fier de moi.
xii
Avant-propos
Le corps de ce mémoire est constitué d’un article scientifique intitulé « Arctic diatom photoadaptative strategies : A seasonal story » qui sera soumis à la revue « Limnology & Oceanography » le 8 octobre 2019. Je suis le premier auteur de ce manuscrit et Sébastien Guérin, Flavienne Bruyant, Joannie Ferland, Douglas Campbell, Marcel Babin et Johann Lavaud en sont les coauteurs.
Le projet a été initié et financé par Johann Lavaud et réalisé grâce aux équipements acquis via la chaire de recherche de Marcel Babin. Johann Lavaud, Marcel Babin et moi-même avons élaboré les plans expérimentaux. Sébastien Guérin a réalisé la conception des montages expérimentaux. Sébastien Guérin, Flavienne Bruyant et Joannie Ferland m’ont assisté lors de la culture des diatomées et de certaines expérimentations. Johann Lavaud et moi-même avons analysé les données brutes et écrit la première version de ce manuscrit qui a été amélioré par les commentaires constructifs de tous les coauteurs. Johann Lavaud, Marcel Babin et Douglas Campbell m’ont encadré et conseillé tout au long de ma maîtrise qui a mené à l’écriture de ce manuscrit.
1
Introduction
La transformation saisonnière de l’océan Arctique alimente une production primaire cyclique
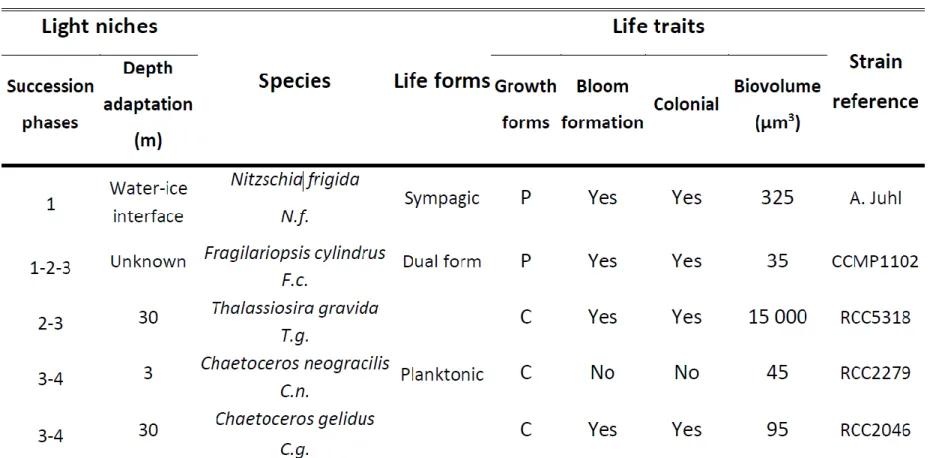
La vie sur Terre dépend principalement de l’utilisation de l’énergie solaire pour incorporer le carbone inorganique à des molécules organiques grâce à une suite de réactions photochimiques complexes réalisées par des organismes dits photosynthétiques. La disponibilité de la lumière est donc un paramètre charnière dans la structuration des écosystèmes puisqu’elle est intimement liée à la distribution spatiale, la productivité et la diversité des producteurs primaires à la base de la chaîne trophique. L’océan Arctique possède un environnement lumineux unique en raison 1) de variations lumineuses saisonnières extrêmes (jusqu’à six mois d’obscurité lors de la nuit polaire) (Kvernvik et al., 2018), et 2) des interactions dynamiques et imprévisibles entre la lumière et les couverts de neige et de glace de mer (Katlein et al., 2019) (Figure 1). Les microalgues diatomées sont les principaux producteurs primaires arctiques et exploitent une suite d’environnements lumineux contrastés au cours d’une succession saisonnière de multiples espèces qui inclut une grande diversité de traits de vie (caractéristiques distinctives des espèces qui affectent leur écologie sans être une adaptation à une pression sélective précise) (Table 1) (Poulin et
al., 2011; Blais et al., 2017). La succession saisonnière débute dans la glace de mer à
l’interface entre l’océan et l’atmosphère, un habitat unique où la vie microscopique foisonne dans des canaux de saumures (brine channels) formés par l’exclusion du sel de l’eau de mer durant la congélation. La productivité annuelle des microalgues sympagiques (vivant dans la glace) peut être d’une importance écologique cruciale saisonnièrement et régionalement, bien qu’annuellement, elle soit moindre que celle des microalgues planctoniques (vivant dans la colonne d’eau) (Leu et al., 2011).
Au cours de la transformation saisonnière de l’habitat arctique, quatre phases aux environnements lumineux contrastés, colonisés par des communautés microalgales différentes, peuvent être distinguées (Figure 1 et S1). (1) Au printemps, l’accentuation de l’angle d’incidence solaire accélère le transport de lumière à travers le manteau neigeux, ce qui induit la modification de ses propriétés optiques, particulièrement la diminution de son
2
Figure 1: Schematic representation of the average Arctic diatom seasonal succession in Baffin Bay (67.48 N; 63.79 W) through four contrasted phases along yearly light environment continuum. Daily light dose corresponds to atmospheric radiations measured above ocean level and is governed by photoperiod and solar angle-of-incidence. Light fluctuations frequency and amplitude increase with snowmelt and sea-ice cover heterogeneity (see Introduction). Diatom pennate growth form dominates sea-ice biomass and centric growth form dominates plankton. See (Oziel et al., 2019 and Randelhoff et al., 2019) for in depth description of the physicochemical parameters determining phytoplankton spring bloom (PSB) onset in Baffin Bay and Fig. S1 for
in situ photosynthetic available radiation measurements at ice-water interface and in water column. Dashed green line represents
3
Table 1: Arctic diatom species used in this study with their strain references and defining life traits (Succession phases refer to Fig. 1).
4
fort albédo, et promeut la transmission de lumière dans la couche superficielle de l’océan (Hancke et al., 2018). Les microalgues à la base de la glace de mer entament la photosynthèse à de très faibles éclairements qui augmentent progressivement en fonction de la fonte du couvert neigeux, jusqu’à atteindre des intensités sursaturantes dans les semaines qui précèdent la dislocation de la banquise (Galindo et al., 2017). Nitzschia frigida, l’espèce sentinelle de la glace arctique, représente fréquemment jusqu’à 50 % de la biomasse sympagique (Table 1) (Poulin et al., 2011). (2) L’amincissement du couvert neige-glace et l’émergence de structures moins opaques (mares de fonte, quilles, polynie, etc.) induisent l’augmentation hétérogène de la transmission de la lumière vers les eaux superficielles toujours couvertes de glaces où certaines espèces entrent alors en floraison (bloom) (Arrigo
et al., 2012; Assmy et al., 2017) (Figure 1). Fragilariopsis cylindrus colonise autant la glace
de mer que la colonne d’eau et est typiquement observée lors de cette phase de la succession (Table 1) (Poulin et al., 2011; Fragoso et al., 2017). (3) La productivité saisonnière de l’océan Arctique atteint son apogée dans la zone de glace marginale (Perrette et al., 2011) (~50% recouvert de glace (Randelhoff et al., 2019)) dans des eaux enrichies en nutriments par le brassage hivernal. Les espèces qui y entrent en floraison exploitent des fluctuations lumineuses d’amplitudes et de fréquences maximales, en raison des interactions erratiques entre la lumière et la banquise en fragmentation (Figure 1). Cet épisode de productivité maximale est relativement bref localement, mais alimenté par la croissance fulgurante d’espèces planctoniques telle que Thalassiosira gravida (Booth et al., 2002), il progresse le long du gradient latitudinal de fonte de la glace de mer. (4) Les eaux nouvellement libres sont plus calmes et les fluctuations lumineuses moins importantes et plus rares, bien que l’éclairement journalier continue de s’intensifier jusqu’au solstice d’été via la prolongation de la durée du jour (Wassmann, 2011) (Figure 1). Alors que la disponibilité des nutriments décroît rapidement et que le broutage par le zooplancton augmente (Palmer et al., 2014), les microalgues exploitent différentes profondeurs influençant leur niche lumineuse.
Chaetoceros neogracilis et Chaetoceros gelidus, dominent communément la colonne d’eau
en fin de succession en surface et au maximum de chlorophylle (Chl) profond (~30 m), respectivement, et illustrent bien la répartition hétérogène des diatomées dans un environnement lumineux tridimensionnel (Balzano et al., 2017) (Table 1).
5
Les changements climatiques en cours induisent une diminution de l’épaisseur et de la superficie de la glace de mer (Kinnard et al., 2011) et prolongent la saison d’eaux libres de glace (Overland & Wang, 2013), ce qui tend à exposer les microalgues arctiques à des éclairements saisonniers moyens de plus en plus élevés (Nicolaus et al., 2012). Le métaécosystème arctique est organisé autour des pulsations annuelles du couvert de glace de mer et est donc profondément affecté par ces bouleversements (Wassmann, 2011). Dans les dernières années, l’intensification de la disponibilité de la lumière a stimulé l’augmentation de la productivité primaire annuelle arctique (Arrigo & van Dijken, 2015), potentiellement grâce à des floraisons plus fréquentes sous le couvert de glace de mer amincit et aux propriétés optiques altérées (Assmy et al., 2017; Horvat et al., 2017). Cependant, pour les diatomées sympagiques adaptées aux éclairements très faibles, une luminosité accrue pourraient inhiber leur croissance (Leu et al., 2016) et elle réduit leur richesse en acides gras (Leu et al., 2010), une ressource inestimable pour le couplage trophique bentho-pélagique (Brown et al., 2016). Afin d’être en mesure d’appréhender l’ampleur écologique de ces changements, il est essentiel d’approfondir nos connaissances concernant la réponse à la lumière des diatomées arctiques, particulièrement comment elle est influencée par l’adaptation aux niches lumineuses contrastées qu’occupent les différentes espèces et leurs divers traits de vie.
Les diatomées : actrices écologiques essentielles bien adaptées à l’océan Arctique
Les diatomées représentent le groupe de microalgues eucaryotes le plus diversifié et le plus abondant en Arctique (Poulin et al., 2011). Elles sont issues de l’endosymbiose secondaire d’une algue rouge par un ancêtre hétérotrophe et l'acquisition de matériel génétique bactérien par voie de transferts horizontaux (Armbrust et al., 2004; Bowler et al., 2008). Ce parcours évolutif étonnant procure aux diatomées un agencement de caractéristiques physiologiques et métaboliques uniques par exemple: des chloroplastes entourés par quatre membranes lipidiques et intimement liés aux mitochondries (Flori et
al., 2017), un frustule silicieux qui enveloppe leur contenu cellulaire (Kooistra et al., 2007), et le cycle
complet de l’urée, absent chez les autres phototrophes, mais présent chez certains animaux (Allen et al., 2011). Deux formes de croissance principales se distinguent : les diatomées centriques (symétrie radiale), dominantes dans la colonne d’eau arctique, et les diatomées pennées (symétrie longitudinale), dominantes dans la glace de mer (Poulin et al., 2011).
6
Les diatomées polaires sont des organismes psychrophiles (adaptés au froid), c’est-à-dire que plusieurs traits qui favorisent leur survie et leur croissance dans les conditions extrêmes de leur environnement ont évoluées au cours de processus sélectifs et font partie intégrante de leur génome, on parle d’adaptation (Mock et al., 2017). Ces ajustements sont différents des mécanismes d’acclimatation qui s’actionnent en réponse aux changements des conditions de croissance sur des échelles de temps plus courtes (heures aux saisons) sans nécessiter de modifications du pool génique (voir ci-dessous pour l’acclimatation des diatomées à leur environnement lumineux (photoacclimation)) (Macintyre et al., 2002). Une adaptation clef des diatomées sympagiques est par exemple leur capacité à sécréter d’énormes quantités d’exopolysaccharides (Krembs et al., 2011; Aslam et al., 2018) qui rendent leur milieu de vie plus hospitalier et leur permettent de surmonter des températures sous le point de congélation, l’hyperoxie, des nutriments difficilement assimilables et de grandes fluctuations de salinité (Thomas & Dieckmann, 2002). En comparaison de leurs cousines tempérées, le taux de croissance (µ) et l’éclairement de saturation de la croissance des diatomées polaires sont nettement inférieurs (Lacour et
al., 2017). Une différence probablement attribuable aux températures froides qui ralentissent les taux
catalytiques enzymatiques (Feller & Gerday, 2003), partiellement compensée par une augmentation du pool de certaines enzymes, comme la Rubisco qui est essentielle à la fixation photosynthétique du carbone (Young et al., 2015; Gerecht et al., 2019). Les diatomées arctiques maintiennent également d’importantes concentrations d’acides gras polyinsaturés pour contrer la rigidification des membranes cellulaires par le froid (Teoh et al., 2013; Schaub et al., 2017). Par exemple, F. cylindrus répond à la diminution de l’éclairement de croissance par l’augmentation du ratio de glycolipides formant des monocouches (mono- sur digalactosyldiacylglycerol (MGDG :DGDG)) dans les membranes photosynthétiques (thylakoïdes), afin de maintenir la vélocité des flux d’électrons (Mock & Kroon, 2002). D’autres particularités distinctives des diatomées arctiques sont la synthèse de protéines antigels (Bayer-Giraldi et al., 2010), la survie durant de longues périodes d’obscurité (Peters & Thomas, 1996; Kennedy et al., 2019), la résistance aux chocs osmotiques (Krell et al., 2008) et aux stress oxydatifs (accentués en eaux froides par la plus grande solubilité du dioxygène et lors de la cristallisation de la glace de mer) (Hwang et al., 2008) typiques de leur habitat. Une caractéristique photophysiologique typique des diatomées est l’échange constant de molécules énergétiques (NADPH et ATP) entre les chloroplastes et les mitochondries couplés aux régulations métaboliques (Bailleul et al., 2015; Broddrick et al., 2019; Murik et al., 2019). En plus de cette particularité, certaines études récentes chez les diatomées polaires rapportent aussi un rôle
7
important de plusieurs voies alternatives de transport d’électrons, potentiellement en réponse à l’environnement extrême auquel elles font face. Ces flux d’électrons alternatifs permettraient 1) d’éviter les dommages photooxydatifs en équilibrant la pression d’excitation sur le photosystème (PS) II et la fixation de carbone ralentie par le froid (Alderkamp et al., 2012; Lacour et al., 2019a; Trimborn et al., 2019) et 2) de maintenir le métabolisme basal à faible température (Goldman et al., 2015; Kennedy et al., 2019).
Les diatomées arctiques doivent de surcroît faire face à des variations lumineuses soudaines (interactions lumière couvert neige/glace, brassage vertical) (Katlein et al., 2019) et de grandes amplitudes sur une échelle de temps saisonnière (fluctuations de l’épaisseur du couvert de neige, photopériode) (Kvernvik et al., 2018). L’adaptation à cet environnement lumineux particulier (photoadaptation) requière des capacités de protection face aux lumières excessives (photoprotection) efficaces et flexibles, et d’un autre côté, un potentiel de modulation de la capture et d’utilisation de l’énergie lumineuse (photoacclimatation) exceptionnels afin d’exploiter une étendue de lumières de croissance extrêmement ample (< 1 µmol photons m-2 s-1 sous le couvert de glace de mer enneigé et jusqu’à 1 500 µmol photons m-2 s-1 à la surface en eaux libres) (Oziel et al., 2019; Randelhoff et al., 2019).
Les traits photoadaptatifs qui permettent l’alternance rapide entre la maximisation de la récolte de lumière et la photoprotection, dans des conditions aussi hostiles, demeurent mal connus. À ce jour, ils n’ont été étudiés en laboratoire que chez un nombre limité d’espèces qui ne sont pas nécessairement bien représentatives de la suite de niches lumineuses contrastées occupées par les diatomées arctiques et de la diversité de leurs traits de vie (Table 1) (Kropuenske et al., 2010; Park et al., 2010; Petrou et al., 2011a; Beszteri et al., 2018; Lacour et al., 2018, 2019a; Kulk et al., 2019). En raison de ces lacunes dans les connaissances, il est actuellement impossible de supputer l’influence de ces différents éléments sur les réponses à la lumière des diatomées arctiques. En étudiant les paramètres de croissance, de capture de la lumière, de photoprotection et de réponse à l’obscurité d’espèces clefs, nous tenterons de déterminer si les niches lumineuses contrastées des diatomées arctiques se reflètent dans leurs stratégies de réponses à la lumière sur différentes échelles de temps (stratégie photoadaptative).
8
Les diatomées arctiques s’acclimatent à leur environnement lumineux
La grande plasticité phénotypique des diatomées (trait adaptatif qui réfère à l’amplitudes des capacités d’acclimatation à diverses conditions de croissance d’une espèce) (Armbrust et al., 2004; Bowler et al., 2008) (accentuée chez les espèces polaires (Mock et al., 2017)) leur permet d’exploiter un large éventail de conditions environnementales (Valenzuela et al., 2018) et de représenter un groupe photosynthétique majeur dans la majorité des écosystèmes aquatiques (Leblanc et al., 2012; Barnett et
al., 2015; Petrou et al., 2016). Les diatomées ajustent constamment leur photophysiologie pour optimiser
leur rendement photochimique et limiter les dommages photooxydatifs face aux changements lumineux de courtes (fonte du couvert neige-glace, brassage dans la colonne d’eau) (Goss & Lepetit, 2015; Lepetit
et al., 2017) et de longues durées (photopériode, saisons) (Kvernvik et al., 2018; Lowry et al., 2018). À
court terme, la photoacclimatation dépend de régulations métaboliques et transcriptionnelles. Une diminution du ratio de Chl a sur pigments photoprotecteurs et une augmentation de la Rubisco sont par exemple typiquement observées en acclimatation à forte lumière, et vice-versa à faible lumière (MacIntyre et al., 2002). L’état d’oxydoréduction du pool de plastoquinones, au cœur de la chaîne de transport d’électrons photosynthétiques, est un important nœud de contrôle de ces ajustements photophysiologiques qui modulent la capacité des cellules à déployer les mécanismes de photoprotection lorsqu’un stress lumineux survient (Lepetit et al., 2013). À long terme, des processus sélectifs façonnent l’évolution de stratégies photoadaptatives avantageuses aux différents groupes, espèces et écotypes photosynthétiques afin d’exploiter efficacement leur niche lumineuse respective (Lavaud et al., 2007; Dimier et al., 2009; Petrou et al., 2011a; Ocampo-Alvarez et al., 2013; Barnett et al., 2015; Shi et al., 2016) (voir ci-dessous).
Le NPQ et le cycle des xanthophylles des diatomées en réponse aux forts éclairements
Une molécule de Chl a excitée par la lumière retourne à son état fondamental par l’une des trois voies suivantes : 1) un électron est transmis à la chaîne photosynthétique de transport d’électrons engendrant la photochimie (quenching1 photochimique) 2) un photon est réémis
(fluorescence) ou 3) l’énergie est dissipée sous forme de chaleur par quenching non-photochimique
9
(non-photochemical quenching (NPQ)). Lorsque la photochimie est saturée (réduction du pool de plastoquinone), la pression d’excitation sur le PSII et la durée de demi-vie d’un singulet d’excitation de Chl a augmentent, ce qui favorise la probabilité qu’il passe en état de triplet surexcité. L’électron instable d’un triplet d’excitation de Chl a peut être arraché par le dioxygène, ce qui produit des dérivés réactifs de l’oxygène (reactive oxygen species (ROS)), responsables de dommages photooxydatifs qui peuvent causer la photoinhibition (Li et al., 2018). La photoprotection regroupe toutes les réponses physiologiques rapides ou même comportementales (espèces benthiques (Blommaert et al., 2017) ou sympagiques mobiles (Aumack et al., 2014)) qui permettent de limiter ou de réparer les photodommages. Chez les diatomées le NPQ, rapide et flexible, est le mécanisme le plus important (Goss & Lepetit, 2015). Lorsque l’extraction photolytique d’électrons excède la fixation de carbone, des ions H+ s’accumulent dans le lumen du thylakoïde ce qui accroît l’amplitude du gradient de protons transthylacoïdal (ΔpH). L’abaissement du pH dans le thylakoïde active l’enzyme diadinoxanthine (DD) dé-époxydase (DDE) (Olaizola et al., 1994). La DDE catalyse la conversion du pigment xanthophylle DD en diatoxanthine (DT), une réaction réversible par l’enzyme diatoxanthine époxydase (DEP) lors de la dissipation du ΔpH et en présence du cofacteur NADPH (Grouneva et al., 2009). Ces deux réactions forment ensemble le cycle des xanthophylles (XC) (Olaizola et al., 1994). L’action complémentaire du ΔpH, des molécules de DT et de protéines Lhcx déclenchent le découplage de certains complexes antennaires LHC (light harvesting complex) des PSII, ce qui favorise la dissipation d’énergie lumineuse sous forme de chaleur (Kuzminov & Gorbunov, 2016; Buck et al., 2019). Puisqu’elle est activée par le ΔpH, cette composante du NPQ est souvent désignée comme le qE (energy-dependant quenching). La famille de protéines antennaires Lhcx est essentielle pour l’induction et la modulation de la composante qE du NPQ (Bailleul et al., 2010a; Zhu & Green, 2010). Diverses isoformes de cette famille de protéines sont traduites en fonction des facteurs abiotiques de croissance (Taddei et al., 2016) et de la pression d’excitation sur le PSII (Lepetit et
al., 2017). Puisque la famille de protéines Lhcx est élargie chez la diatomée polaire modèle F. cylindrus (11 gènes vs. 4 ou 6 pour les espèces tempérées modèles) (Mock et al., 2017), il est
possible que les Lhcx jouent un rôle crucial permettant aux cellules de surmonter les larges gradients environnementaux caractérisant les habitats de hautes latitudes.
10
L’accumulation de DT en réponse aux fluctuations lumineuses est associée à une augmentation linéaire du NPQ, cependant la pente entre les deux variables varie selon les espèces et en fonction des conditions d’acclimatation à la lumière (‘histoire lumineuse’) (Dimier et al., 2009; Lavaud & Lepetit, 2013; Barnett et al., 2015). Une pente NPQ/DT plus abrupte est généralement considérée comme une adaptation à un milieu plus dynamique où les fluctuations lumineuses sont fréquentes et de grandes amplitudes (eaux côtières turbulentes vs. eaux océaniques calmes) (Lavaud et al., 2007). Ces disparités sont imputées aux multiples rôles photoprotecteurs de la DT et de sa répartition variables entre trois pools (Lepetit et al., 2010) : 1) un pool lié aux protéines LHC des complexes antennaires et impliqué dans
qE, 2) un pool dissous dans les glycolipides MGDG de la membrane thylacoïdale, et 3) un pool
associé aux protéines LHCr du PSI qui ne semble pas répondre aux variations lumineuses. La taille du pool solubilisé dans la matrice de MGDG augmente lorsque les cellules sont acclimatées à de plus forts éclairements (Schumann et al., 2007). Bien que cette DT ne participe pas à l’induction du qE-NPQ, elle protège des dommages photooxydatifs par la prise en charge des ROS (Lepetit et
al., 2010; Gallina et al., 2014). Chez les diatomées polaires, l’augmentation de la quantité de
MGDG (particulièrement à faible éclairement de croissance (Mock & Kroon, 2002)) pourrait permettre d’incorporer une plus grande quantité de DT à ce pool et fournir une protection additionnelle face aux stress oxydatifs importants lors de la cristallisation de la glace de mer (Mock
et al., 2002; McMinn et al., 2005). Une autre fonction alternative potentielle de la DT (ou de la
zéaxanthine (xanthophylle dé-époxydée homologue à la DT dans la lignée photosynthétique verte)) pourrait être celle d’une «mémoire moléculaire» qui module l’induction du NPQ lors de futurs stress lumineux (Galindo et al., 2017; Kress & Jahns, 2017). La fraction de DT incorporée à la matrice de MGDG pourrait aussi limiter les dommages photooxydatifs en modulant la rigidité des thylakoïdes en fonction des conditions lumineuses et/ou de la température (Bojko et al., 2019). Finalement, il est possible que la répartition de la DT entre les trois pools influence le NPQ soutenu (NPQS) à l’obscurité, typique des souches polaires (Lacour et al., 2018). Quel que soit le rôle de la
DT qui ne participe pas au qE-NPQ, plus son abondance relative est élevée, plus la pente NPQ/DT tend à diminuer (Lavaud et al., 2007). Lors de mon stage d’initiation à la recherche du baccalauréat en biologie 2017, nos expériences préliminaires sur F. cylindrus ont révélé un NPQ important qui sature à des éclairements modérés (< 300 µmol photons m-2 s-1) et avec une pente NPQ/DT 3 à 8
11
fois inférieure (selon la photoacclimatation) à la plus faible publiée dans la littérature auparavant (Barnett et al., 2015).
Le NPQ et le XC des diatomées arctiques à l’obscurité
La relaxation de la composante qE du NPQ est généralement complète après une vingtaine de minutes à l’obscurité chez les diatomées tempérées planctoniques (la relaxation est plus rapide lorsque les cellules sont exposées à une faible lumière (Grouneva et al., 2009)). Inversement, chez les diatomées polaires, un NPQ soutenu (NPQs) jusqu’à 24 h après le transfert à l’obscurité a été rapporté (Kropuenske
et al., 2010; Lacour et al., 2018; Kulk et al., 2019). Chez T. gravida, l’intensité de l’éclairement
d’acclimatation influence la quantité de DT accumulée et le temps nécessaire pour sa ré-époxydation à la noirceur (Lacour et al., 2018). L’époxydation de la DT par la DEP pourrait être inhibée à l’obscurité par l’épuisement du cofacteur NADPH via des ajustements métaboliques vers les mitochondries qui sont essentiels chez les diatomées (Bailleul et al., 2015). La DT responsable du NPQS demeurerait alors active
en qE et entraverait la reconnexion des LHC au PSII, en dépit de la remontée du pH à l’obscurité (Goss & Lepetit, 2015). Il est intéressant de constater que le NPQs est aussi observé chez les diatomées benthiques de vasières intertidales (Blommaert et al., 2017). Ce mécanisme pourrait donc être lié à l’évolution de ces espèces dans des environnements dynamiques où un substrat (glace de mer ou sédiments) peut obstruer la lumière durant de longues périodes (plusieurs heures à plusieurs mois), avant d’être déplacé (oscillations des marées, fonte de la neige-glace) plus ou moins progressivement. Alternativement, le NPQS pourrait être une réponse à un déséquilibre chronique entre les capacités de
collecte de la lumière et de la fixation du carbone (Adams et al., 2014). Le maintien du NPQS est souvent
observé chez les organismes pour lesquels des températures froides ralentissent la catalyse des enzymes du Cycle de Calvin ou quand des stress hydriques entravent l’extraction photolytique d’électrons (Verhoeven et al., 2018). Par exemple, certains conifères maintiennent de la zéaxanthine dans leurs complexes antennaires durant la période froide (Míguez et al., 2017) ou aride (Ishida et al., 2014) même à lumière suboptimale ou à l’obscurité. Pour les diatomées arctiques, les températures froides, qui ralentissent la catalyse de la Rubisco, et l’adaptation aux éclairements extrêmement faibles qui prévalent durant une longue partie de la saison de croissance pourraient être à l’origine de leur NPQS exacerbé. De
plus, certaines isoformes Lhcx pourraient être impliquées dans le NPQS des diatomées polaires.
12
corrélée à une relaxation plus lente du NPQ chez T. pseudonana (Zhu & Green, 2010). L’extension de la famille Lhcx chez F. cylindrus (Mock et al., 2017) renforce cette hypothèse.
Récemment, une autre stratégie d’acclimatation au noir surprenante a été révélée chez la diatomée arctique planctonique C. neogracilis (Lacour et al., 2019a). Un mois après une incubation à l’obscurité, le développement d’un fort NPQ accompagné d’une importante accumulation de DT a été mesuré. Cette réponse d’acclimatation à l’obscurité pourrait faciliter une reprise efficace de la photosynthèse après la nuit polaire en dissipant l’énergie lumineuse potentiellement dommageable durant la remise en marche de la machinerie de fixation du carbone (Lacour et al., 2019a). Du côté de F. cylindrus, une augmentation du potentiel d’induction du NPQ peut être observée un mois après l’incubation à l’obscurité (Kennedy et
al., 2019, Morin et al., 2019), sans qu’il n’y ait accumulation de DT. Les rôles complémentaires du XC
et du NPQ à l’obscurité chez les diatomées polaires demeurent un sujet méconnu. Son investigation sur une large sélection de diatomées arctiques pourrait révéler d’importantes divergences d’adaptation à des évènements d’obscurité fréquents causés par l’advection sous le couvert de glace de mer (Randelhoff et
al., 2018), les averses de neige (Galindo et al., 2017), le brassage vertical profond (Lowry et al., 2018) et
la nuit polaire (Kvernvik et al., 2018).
L’écophysiologie des diatomées est intrinsèquement liée à leur réponse à la lumière
L’environnement lumineux est un paramètre particulièrement important de la niche écologique des microalgues pour deux raisons principales : 1) il fluctue constamment et 2) la marge entre photoproduction nette et photoinhibition à laquelle les cellules sont confrontées est fine. Pour ces raisons, le rôle de la niche lumineuse dans le façonnement des stratégies photoadaptatives des différents groupes/espèces/écotypes de microalgues a largement été discuté (Dimier et al., 2009; Brunet & Lavaud, 2010; Petrou et al., 2011a). Par exemple, il a été observé que les espèces de diatomées dominantes en eaux calmes et exposées à moins de fluctuations lumineuses montrent une induction moins rapide et moins ample du XC, que celles retrouvées en eaux turbulentes (Lavaud et al., 2007; Dimier et al., 2009). L’adaptation de la photoprotection à l’environnement lumineux a également été décrite chez les plantes supérieures (Demmig-Adams et al., 2008), les macroalgues (Ocampo-Alvarez & García-Mendoza,
13
2013), les cyanobactéries (Six et al., 2007), et plusieurs autres groupes phytoplanctoniques (Dimier et al., 2009), ainsi que chez des écotypes d’une même espèce isolés à des latitudes ou à des profondeurs différentes (Bailey et al., 2005; Bailleul et al., 2010a; Lepetit et al., 2013; Ocampo-Alvarez & García-Mendoza, 2013). `
Les vasières intertidales sont des environnements lumineux dynamiques et stressants pour les diatomées microphythobenthiques qui y vivent et qui expriment une grande diversité écophysiologique intégrant 1) formes de vie : benthique et/ou planctonique, motile ou non-motile, et 2) habitats : sable fin ou vaseux. Il a été démontré que la niche lumineuse de ces espèces était plus influente sur leur stratégie de réponse à la lumière que leur proximité phylogénétique (Barnett et al., 2015). Un compromis évolutif entre l’amplitude du NPQ et la motilité (photoprotection comportementale liée au phototaxisme) est également connu chez certaines espèces benthiques (Blommaert et al., 2017) et pourrait exister similairement chez les diatomées sympagiques (Aumack et al., 2014), bien que les échelles de temps soient différentes (oscillations des marées vs. saisons). Chez trois diatomées et une haptophyte antarctiques, une photoprotection optimale en conditions de culture (éclairement, température et salinité) répliquant celles observées in situ lors de leur apparition dans la succession saisonnière a été observée (Kropuenske et al., 2010; Petrou et al., 2011a). Parmi les diatomées, F. cylindrus a exprimé le NPQ le plus élevé et la moins grande susceptibilité à la photoinhibition à toutes les acclimatations (Petrou et al., 2011a). Cette grande capacité d’acclimatation à des conditions environnementales variées a possiblement facilité sa distribution bipolaire et sa prolifération dans la glace de mer et la colonne d’eau. Finalement, les traits de vie peuvent aussi contraindre la photoadaptation. Il a notamment été démontré que des effets allométriques réduisent la concentration de Chl a intracellulaire optimale chez les espèces de plus grand biovolume afin de limiter l’auto-ombrage entre les pigments (Finkel & Irwin, 2000). Un autre effet du biovolume est l’augmentation de la susceptibilité aux photodomages des cellules en fonction de sa diminution (Key et al., 2010). Entre les formes de croissance pennées et centriques, des transporteurs thylakoïdaux différents pourraient être impliqués dans la relaxation du NPQ à l’obscurité et générer des cinétiques distinctes (Grouneva et al., 2011).
14
Problématique
Les traits photoadaptatifs des organismes photosynthétiques, parmi lesquels la stratégie de photoprotection (NPQ(S) et XC) est cruciale, sont fortement liés à leur niche lumineuse. D’un autre côté,
l’environnement lumineux de l’océan Arctique possède une dynamique particulière, où la métamorphose saisonnière de l’habitat contrôle la progression latitudinale des gradients environnementaux, notamment la disponibilité de la lumière. Les diatomées profitent de l’hétérogénéité de cet écosystème en exploitant les différentes niches lumineuses (milieu de vie et profondeur d’adaptation) (Table 1) grâce à une grande diversité de 1) formes de vie (sympagique et/ou planctonique), 2) formes de croissance (pennée ou centrique) et 3) biovolumes (35 à 15 000 µm3 dans cette étude) (Poulin et al., 2011). Les changements climatiques en cours induisent l’intensification de l’environnement lumineux dans lequel les diatomées arctiques évoluent, ce qui pourrait perturber leur dynamique saisonnière et leur productivité, particulièrement chez les espèces sympagiques adaptées à des éclairements extrêmement faibles (Leu et
al., 2016). Cependant, le peu d’études réalisées sur la photoprotection des diatomées polaires
(Kropuenske et al., 2010; Park et al., 2010; Petrou et al., 2011a; Beszteri et al., 2018; Lacour et al., 2018, 2019; Kulk et al., 2019), n’intègrent qu’une fraction de la diversité traits de vie et de niches lumineuses qui se succèdent lors des floraisons arctiques. Des propriétés photosynthétiques uniques (Lacour et al., 2017), l’extension de la famille de protéines Lhcx (Mock et al., 2017), un NPQ rapide (Petrou et al., 2011a), pouvant être maintenu (Lacour et al., 2018) ou induit à l’obscurité (Lacour et al., 2019a), ont été observés chez des espèces de diatomées polaires. Cependant peu d’efforts ont été fournis afin de raffiner
cette description de propriétés photophysiologiques étonnantes à l’échelle de la succession saisonnière des diatomées arctiques. Ainsi, il est actuellement impossible de supputer l’influence des contrastes de niches lumineuses par rapport aux divers traits de vie des diatomées arctiques sur leur stratégie photoadaptative. Ces lacunes dans les connaissances compliquent l’appréhension des
tendances futures de la productivité et de la dynamique des communautés microalgales de l’océan Arctique face aux changements climatiques. En analysant les principaux traits de réponse à la lumière
et à l’obscurité de plusieurs espèces de diatomées arctiques représentatives de cette diversité saisonnière, nous tenterons de répondre à ce besoin urgent.
15
Objectifs et hypothèses
Objectifs: Déterminer comment les principaux traits photoadaptatifs des diatomées arctiques sont
influencés par :
(1) L’environnement lumineux de la niche écologique (glace de mer vs. lisière du couvert
neige-glace vs. colonne d’eau, profondeur d’adaptation) où les différentes espèces ont été isolées; la niche écologique déterminant également la forme de vie (sympagique vs. planctonique ou les deux);
(2) Les traits de vies diversifiés des différentes espèces : formes de croissance (pennée vs.
centrique), biovolume, coloniale ou non, capacité d’entrer en floraison ou non, etc. (Table 1).
Hypothèse 1 : Les traits photoadaptatifs des espèces seront avantageux face aux particularités de
leur niche lumineuse et les différences seront plus marquées entre les espèces retrouvées aux extrêmes de la succession saisonnière (espèces exclusivement sympagiques qui prolifèrent au printemps vs. les espèces exclusivement planctoniques qui prolifèrent durant l’été). Entre ces deux situations, on s’attend à un gradient dans la réponse à la lumière illustré par des compromis entre certains traits photoadaptatifs chez les espèces qui se succédent lors de la transition entre ces deux habitats (Figure 1).
Hypothèse 2 : Les traits de vie pourraient influencer la stratégie photoadapatative des espèces et
causer des différences entre espèces de niches similaires, mais ils seront moins influents que l’adaptation à la niche lumineuse lorsqu’on considère l’ensemble des espèces.
16
Chapitre I: Arctic diatom photoadaptative strategies: A
seasonal story
17
Résumé
Au cours de leur succession saisonnière hautement productive, les diatomées arctiques exploitent une suite de climats lumineux contrastés définis par les interactions hétérogènes entre la lumière et le couvert de neige-glace dynamique et des fluctuations de photopériodes extrêmes. Une meilleure connaissance de l’influence de ces niches lumineuses diverses sur la stratégie photoadaptative des diatomées arctiques permettra d’anticiper l’impact écosystémique de l’intensification de l’environnement lumineux arctique via la réduction anthropique du couvert de glace de mer. Pour atteindre cet objectif, nous avons sélectionné cinq souches de diatomées arctiques représentatives des différentes niches lumineuses saisonnières. Nous les avons acclimatées à deux éclairements de croissance, puis étudié leur réponse à une période d’obscurité prolongée et paramétré l’induction de leurs mécanismes de photoprotection. Nous proposons que le couvert de neige-glace ait promu l’évolution de stratégies photoadaptatives divergentes qui gouverneront des réponses interspécifiques inégales des diatomées à un océan Arctique plus fortement éclairé.
18
Abstract
Over their seasonal species succession, Arctic diatoms occupy shifting habitats and contrasted light climates constrained by snow/ice cover dynamics and extreme photoperiod variations. How heterogeneous light niches influence Arctic diatoms photoadaptative traits remains largely unknown and a crucial missing link to understand Arctic Ocean responses to shrinking sea-ice and increasing light. To address this question, we selected five Arctic diatom species harbouring diverse life traits and representative of distinct phases across seasonal habitat transformation: from snow-covered dimly lit bottom ice to summer stratified waters. We studied their photoacclimation plasticity and subsequent responses to light shifts and dark incubations. Our results highlight the sea-ice cover as a strong selective factor shaping Arctic diatoms photoadaptative strategies. Ice-related species exhibited a survivalist photoadaptive strategy with growth saturating at low irradiance and strong photoprotective features sustained even in darkness. Open-water species photophysiology was more dynamic, expressing flexible light utilisation capacities and strong photoprotection capacities triggered by high light and darkness. Marginal ice zone species showed strong adaptation to light fluctuations and dark physiology fine-tuned depending upon light history. We argue that diverging photoadaptative strategies foster Arctic diatom success in their respective seasonal niches and will likely drive uneven responses to a transforming Arctic Ocean.
19
Introduction
Profound phenological change defines high latitude ecosystems. The Arctic Ocean (AO) is the epitome of Nature’s seasonal tug-of-war as winter darkness and snow-covered sea-ice gradually yield to summer with intensely illuminated open waters (Fig. 1). Despite drastic environmental cycles and freezing temperatures, life thrives in the AO, thanks in part to diatom microalgae, the main primary producers (Poulin et al., 2011). Diatom productivity climaxes at the marginal ice zone (MIZ) where the phytoplankton spring bloom occurs in waters partially covered by fragmenting sea-ice (Sakshaug, 2004). Because ongoing warming promotes thinner and shrunken sea-ice cover (Kinnard et al., 2011), more light is available which recently has been triggering earlier and more productive spring blooms (Arrigo & van Dijken, 2015; Horvat et al., 2017). Lipid-rich sympagic (sea-ice) diatoms are a central link in the bentho-pelagic food chain, and their pronounced shade adaptation may not be as well suited to a brighter future AO (Leu et al., 2010, 2016). Because the fate of the AO largely depends on sympagic and phytoplanktonic spring blooms responses to climate perturbations (Behrenfeld et al., 2017), massive efforts are being deployed to understand determinants of their blooming (Oziel et al., 2019; Randelhoff et al., 2019).
Over their seasonal succession, Arctic diatoms collectively exploit a strongly contrasted light environment continuum (Fig. 1 and S1). In Baffin Bay, the productive season begins early in spring within the bottom centimetres of the snow-covered sea-ice (Phase 1, Fig. 1), under weak irradiances (Selz et al., 2018). Pennate diatoms dominate sympagic biomass, as opposed to the centric growth forms dominating plankton, frequently with major contributions from Nitzschia
frigida (Poulin et al., 2011) (Table. 1). As snow melts (Phase 2), light transmission to the ocean
surface augments heterogeneously due to emerging icescape features (melt ponds, leads, etc.) (Assmy et al., 2017). Upon this exposure to increasing and fluctuating irradiances (Katlein et al., 2019), under-ice drifters, like the dual sympagic/planktonic Fragilariopsis cylindrus, start blooming (Arrigo et al., 2012; Fragoso et al., 2017). Most years, productivity culminates at the MIZ (Phase 3), where despite unsteady light interacting with drift ice, diatoms benefit from a surface layer enriched in nutrients and stratified by meltwater (Slagstad et al., 2015). This locally brief event progresses along latitude, driven by “bloom and bust” species like Thalassiosira
gravida (Booth et al., 2002). As photoperiod lengthens and the solar angle-of-incidence
20
(Wassmann, 2011). As surface nutrient availability subsequently declines and grazing pressure surges, diatoms exploit different depths and therefore light niches. For example, long enduring species like Chaetoceros neogracilis and Chaetoceros gelidus dominates the subsurface (~3 m) and deep (~30 m) chlorophyll (Chl) maxima, respectively (Balzano et al., 2017). Note that most species can be found relatively abundantly at several, but not all, successional phases (Table 1) (Booth et al., 2002; Luddington et al., 2016; Balzano et al., 2017).
To maintain productivity and growth, Arctic diatoms must constantly balance light energy harvesting and photochemically driven carbon fixation. When photochemical electron transport outstrips downstream assimilatory reactions, photodamage can ensue (Li et al., 2018). With sub-zero temperatures slowing down photosynthetic enzymes and repair processes (Ni et al., 2017), the margin between net photoproduction and photoinhibition shrinks (Verhoeven, 2014). The molecular toolkit evolved by photoautotrophs to optimise growth in a specific light niche (Fig. 1) represents their photoadaptative strategy. It embraces i) day to season scale photoacclimative processes operating over generational time scales, including large modulations of light harvesting pigments and Rubisco concentrations in polar diatoms (Young et al., 2015; Lacour et al., 2017; Gerecht et al., 2019), and ii) faster responding (seconds to hours) photoprotective mechanisms dissipating excessive light energy and mitigating photodamage; the multi-component non-photochemical quenching (NPQ) being diatom’s main short-term photoprotection mecanism (Goss & Lepetit, 2015). The photoadaptative strategy is a functional trait that can help elucidate species distribution in heterogeneous marine light environments (Dimier et al., 2009; Petrou et al., 2011a; Barnett et al., 2015; Shi et al., 2016; Lacour et al., 2019b) and support modelling of their seasonal succession (Polimene et al., 2014). Compared to their temperate counterparts, important discrepancies in polar diatom photoadaptative strategies are emerging (Petrou et al., 2016; Lacour
et al., 2017; Kennedy et al., 2019; Kulk et al., 2019). However, current data remain insufficient to
refine this resolution and link potential divergences between photoadapative strategies within Arctic diatoms species to their contrasting light niches and important ecodiversity.
In diatoms, the central NPQ component is qE (‘energy dependant’ quenching) whose dynamic regulation relies upon synergistic interactions between a transthylakoidal proton gradient (ΔpH), the enzymatic conversion of the xanthophyll pigment (XP) diadinoxanthin (DD) to diatoxanthin (DT) through the “xanthophyll cycle” (XC), and expression of specific Lhcx proteins
21
of the light-harvesting complex family (Buck et al., 2019). In diatoms, and other marine phototrophs, XC and NPQ amplitudes reflect both light niche adaptation (Lacour et al., 2019b) and light history acclimation, which modulates XP pool size (Park et al., 2010; Ocampo-Alvarez & García-Mendoza, 2013; Galindo et al., 2017) to ultimately govern coupling of photon absorption to carbon fixation (Álvarez et al., 2019). In addition to dynamic NPQ-qE, sustained NPQ (NPQS)
(henceforth meaning NPQ relaxation in darkness takes more than 1 h) is commonly reported both in polar diatoms cultures (Kropuenske et al., 2010; Lacour et al., 2018) and in sea-ice communities (Petrou et al., 2011b; Katayama et al., 2017). A parallel has been drawn with overwintering evergreens expressing long lasting quenching (qZ) (Verhoeven, 2014) and the combination of persistent light/cold stress faced by both groups. In F. cylindrus and T. gravida, NPQS may provide
extra photoprotection when low light-adapted cells are suddenly trapped beneath uncovered sea-ice and/or in stratified surface layer (Kropuenske et al., 2010). Potentially complementary to
NPQ-qE and NPQS-qZ, a non-photochemically driven DT accumulation and concomitant NPQ increase
during prolonged darkness has been reported in C. neogracilis (Lacour et al., 2019a). Its manifestation likely supports rapid photophysiological recovery upon light exposure following polar winter or transport to surface waters (Kvernvik et al., 2018).
These diverse mechanisms suggest Arctic diatom photoadaptative strategies have been shaped not only by a dynamic light climate and freezing temperatures, but also through recurrent darkness events, caused by advective transport underneath sea-ice (Randelhoff et al., 2018), punctuated snowfalls (Galindo et al., 2017), deep vertical mixing (Lowry et al., 2018) and extreme photoperiod (Kvernvik et al., 2018). However, the occurrence and inter-play among different NPQ types across Arctic diatoms and light niche occupancies remain to be investigated. In this study, we performed the first systematic assessment of complementary darkness and high light strategies over Arctic diatom seasonal ecodiversity. We propose a strong evolutionary driving role of the sea-ice cover, favouring a survivalist photoadaptative strategy as opposed to the dynamic competition-oriented strategy of open-water diatoms.