LES POLYPHÉNOLS DU THÉ VERT : DES MOLÉCULES À
DOUBLE ACTION CONTRE LA MALADIE PARODONTALE
Mémoire
Marie-Pierre Morin
Maîtrise en microbiologie
Maître ès sciences (M. Sc.)
Québec, Canada
© Marie-Pierre Morin, 2015
iii
RÉSUMÉ
Dans ce projet de recherche, les propriétés antibactériennes et le potentiel anti-destruction tissulaire des polyphénols du thé vert, plus particulièrement l’épigallocatéchine-gallate (EGCG), ont été évalués. Dans un premier temps, l’effet antibactérien d’un extrait de thé vert et de l’EGCG a été déterminé sur trois bactéries parodontopathogènes d’importance, soit Porphyromonas gingivalis, Aggregatibacter actinomycetemcomitans et Fusobacterium nucleatum. Les concentrations minimales inhibitrices se sont avérées être entre 1000 et 62,5 µg/ml. De plus, des effets synergiques et additifs des polyphénols du thé vert ont été observés lorsqu’utilisés en association avec le métronidazole ou la tétracycline, des antibiotiques couramment utilisés en thérapie parodontale. Dans un deuxième temps, un modèle de co-culture constitué de fibroblastes gingivaux intégrés dans un gel de collagène et recouvert de macrophages a été utilisé pour évaluer la capacité des polyphénols du thé vert à inhiber la sécrétion de métalloprotéinases matricielles (MMPs), notamment les MMP-3, MMP-8 et MMP-9. Il a été démontré que les polyphénols du thé vert atténuent la sécrétion des MMPs par le modèle de co-culture. En conclusion, les résultats de cette étude ont apporté des évidences supportant le potentiel des polyphénols du thé vert en vue d’une utilisation préventive et thérapeutique pour le contrôle des maladies parodontales.
v TABLE DES MATIÈRES
RÉSUMÉ ... III TABLE DES MATIÈRES ... V LISTE DES TABLEAUX ... VII LISTE DES FIGURES ... IX LISTE DES ABRÉVIATIONS ... XI REMERCIEMENTS ...XV
1. INTRODUCTION ... 1
1.1 Structure et histologie du parodonte ... 1
1.1.1 Gencive ... 2
1.1.1.1 Épithélium buccal ... 2
1.1.1.2 Épithélium sulculaire ... 4
1.1.1.3 Épithélium de jonction ... 4
1.1.1.4 Tissu conjonctif gingival ... 6
1.1.2 Ligament parodontal ... 7 1.1.3 Cément ... 7 1.1.4 Os alvéolaire ... 8 1.2 Écosystème buccal ... 8 1.3 Maladies parodontales ... 9 1.3.1 Généralités ... 9
1.3.1.1 Conséquences systémiques des maladies parodontales ... 11
1.3.2 Gingivite ... 13
1.3.3 Parodontite ... 14
1.3.3.1 Facteurs étiologiques bactériens ... 15
1.3.3.1.1 Porphyromonas gingivalis ... 18
1.3.3.1.2 Aggregatibacter actinomycetemcomitans ... 28
1.3.3.1.3 Fusobacterium nucleatum ... 31
1.3.3.2 Facteurs étiologiques immunitaires ... 32
1.3.3.2.1. Métalloprotéinases matricielles ... 35
1.3.4 Traitements des maladies parodontales ... 38
1.4 Polyphénols ... 40 1.4.1 Généralités ... 40 1.4.2 Classification ... 40 1.4.3 Thé ... 41 1.4.3.3 Thé vert ... 43 1.4.3.4 Composition ... 43
1.4.4 Effets bénéfiques du thé vert ... 44
1.4.4.1 Halitose buccale ... 45 1.4.4.2 Carie dentaire ... 48 1.4.4.3 Maladies parodontales ... 51 2. PROBLÉMATIQUE ... 55 2.1 Hypothèse de recherche ... 56 2.2 Objectifs spécifiques ... 56 3. MATÉRIELETMÉTHODES ... 57 3.1 Molécules à l’étude ... 57
3.3 Activité antibactérienne des composés ... 58
3.3.1 Détermination de la concentration minimale inhibitrice ... 58
3.3.2 Détermination de la concentration minimale bactéricide ... 60
3.4 Évaluation de l’effet synergique ... 60
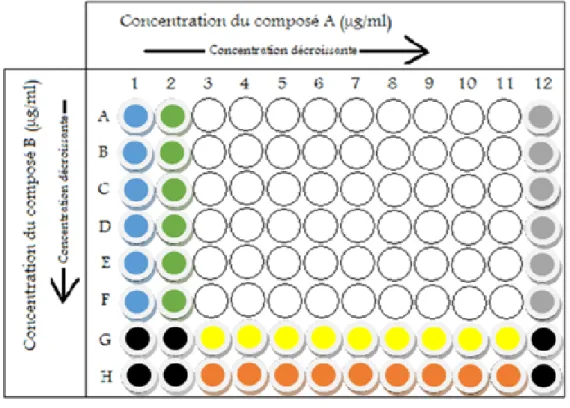
3.4.1 Préparation des microplaques ... 61
3.5 Culture cellulaire ... 63
3.6 Cytotoxicité des composés à l’étude sur les lignées cellulaires individuelles ... 64
3.7 Mise au point d’un modèle de co-culture macrophages/fibroblastes ... 65
3.8 Capacité des polyphénols d’intérêt à inhiber la sécrétion de métalloprotéinases matricielles (MMP-3, MMP-8 et MMP-9) par le modèle de co-culture ... 67
3.9 Analyses statistiques ... 69
4. RÉSULTATS ... 71
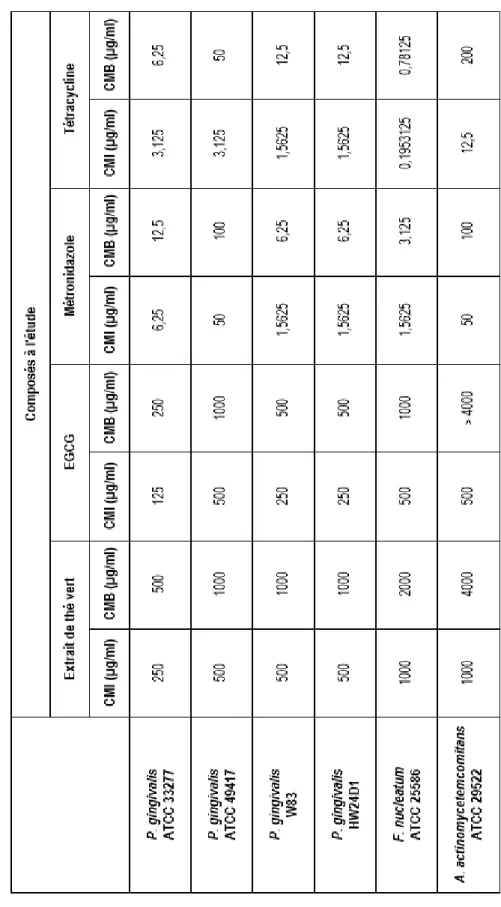
4.1 Activité antibactérienne des composés ... 71w2 4.1.1 Concentrations minimales inhibitrices et bactéricides ... 71
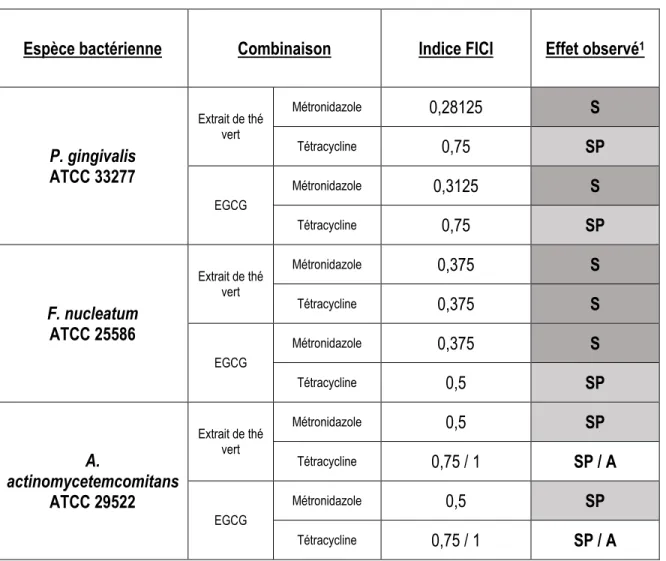
4.1.2 Détermination de l’effet synergique ... 74
4.2 Inhibition de la sécrétion de métalloprotéinases matricielles (MMP-3, MMP-8 et MMP-9) par le modèle de co-culture macrophages/fibroblastes ... 78
4.2.3 Réponse du modèle de co-culture macrophages/fibroblastes stimulé avec le LPS d’A. actinomycetemcomitans en condition faiblement (ratio 1 :10) et fortement inflammatoire (ratio 10:1) 78 4.2.4 Effet de l'extrait de thé vert et de l’EGCG sur la sécrétion basale des MMPs en conditions faiblement et fortement inflammatoires ... 83
4.2.5 Effet du thé vert et de l’EGCG sur la sécrétion des différentes MMPs en conditions faiblement et fortement inflammatoires à des fins préventives ... 88
4.2.6 Effet du thé vert et de l’EGCG sur la sécrétion des différentes MMPs en conditions faiblement et fortement inflammatoires à des fins thérapeutiques ... 93
5. DISCUSSION ... 99
5.1 Propriétés antibactériennes ... 100
5.1.1 Concentrations minimales inhibitrices et bactéricides ... 100
5.1.2 Détermination de l’effet synergique ... 103
5.2 Propriétés anti-destruction tissulaire ... 104
6. CONCLUSION ... 111
7. PERTINENCEDUPROJET ... 113
8. BIBLIOGRAPHIE ... 115
vii
LISTE DES TABLEAUX
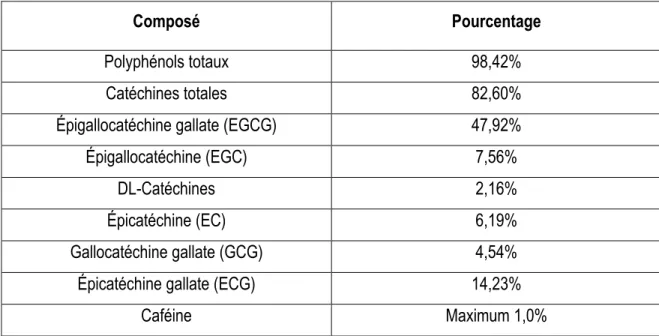
TABLEAU 1. Les différentes classes de composés phénoliques (Tableau adapté de [336]). ... 41 TABLEAU 2. Composition de l’extrait de thé vert GT#9 ... 57 TABLEAU 3. Combinaisons de molécules d’intérêt utilisées lors des essais d’effets synergiques ... 61 TABLEAU 4. Détermination des concentrations minimales inhibitrices et bactéricides des polyphénols du thé vert
vis-à-vis trois espèces bactériennes parodontopathogènes ... 73 TABLEAU 5. Détermination de l’effet synergique des polyphénols du thé vert en association avec le métronidazole
ou la tétracycline sur trois espèces bactériennes parodontopathogènes ... 76 TABLEAU 6. Détermination de l’effet synergique des polyphénols du thé vert en association avec le métronidazole
ou la tétracycline sur P. gingivalis ... 77 TABLEAU 7. Sécrétion des MMP-3, MMP-8 ET MMP-9 par le modèle de co-culture macrophages/fibroblastes à un
ix
LISTE DES FIGURES
FIGURE 1. Représentation schématique des tissus de soutien de la dent (Figure traduite et adaptée de Color Atlas of Histology, fifth edition, 2009 [6]). ... 1 FIGURE 2. Évaluation clinique d'un parodonte sain, affecté d'une gingivite ou d'une parodontite (Figure tirée de [55]) .... 11 FIGURE 3. Schéma représentant les interactions bactériennes des 6 complexes de colonisation (Figure tirée de [108]). 17 FIGURE 4. Schématisation du processus de fabrication du thé et composition en polyphénols des divers thés (FIGURE
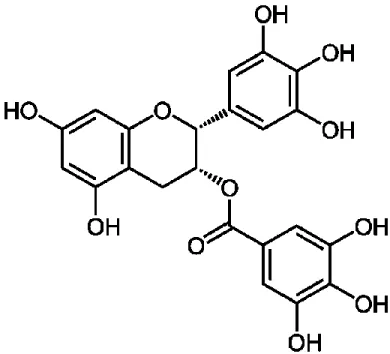
adaptée de [339]. ... 42 FIGURE 5. Structure moléculaire de l’épigallocatéchine-3-gallate. ... 44 FIGURE 6. Disposition des dilutions des composantes à l’étude et des contrôles dans la plaque 96 puits pour les essais
de synergie.. ... 62 FIGURE 7. Représentation schématique du modèle de co-culture macrophages/fibroblastes ... 67 FIGURE 8. Sécrétion de la MMP-3 par le modèle de co-culture stimulé avec le LPS d’A. actinomycetemcomitans en
condition faiblement inflammatoires (ratio 1 macrophage : 10 fibroblastes) ... 80 FIGURE 9. Sécrétion de la MMP-3 par le modèle de co-culture stimulé avec le LPS d’A. actinomycetemcomitans en
condition fortement inflammatoire (ratio 10 macrophages : 1 fibroblaste) ... 80 FIGURE 10. Sécrétion de la MMP-8 par le modèle de co-culture stimulé avec le LPS d’A. actinomycetemcomitans en
condition faiblement inflammatoire (ratio 1 macrophage : 10 fibroblastes) ... 81 FIGURE 11. Sécrétion de la MMP-8 par le modèle de co-culture stimulé avec le LPS d’A. actinomycetemcomitans en
condition fortement inflammatoire (ratio 10 macrophages : 1 fibroblaste) ... 81 FIGURE 12. Sécrétion de la MMP-9 par le modèle de co-culture stimulé avec le LPS d’A. actinomycetemcomitans en
condition faiblement inflammatoire (ratio 1 macrophage : 10 fibroblastes) ... 82 FIGURE 13. Sécrétion de la MMP-9 par le modèle de co-culture stimulé avec le LPS d’A. actinomycetemcomitans en
condition fortement inflammatoire (ratio 10 macrophages : 1 fibroblaste) ... 82 FIGURE 14. Effet du thé vert et de l’EGCG sur la sécrétion basale de MMP-3 en condition faiblement inflammatoire (ratio 1 macrophage : 10 fibroblastes) ... 85 FIGURE 15. Effet du thé vert et de l’EGCG sur la sécrétion basale de MMP-3 en condition faiblement inflammatoire (ratio 10 macrophages : 1 fibroblaste) ... 85 FIGURE 16. Effet du thé vert et de l’EGCG sur la sécrétion basale de MMP-8 en condition faiblement inflammatoire (ratio 1 macrophage : 10 fibroblastes) ... 86 FIGURE 17. Effet du thé vert et de l’EGCG sur la sécrétion basale de MMP-8 en condition fortement inflammatoire (ratio
10 macrophages : 1 fibroblaste) ... 86 FIGURE 18. Effet du thé vert et de l’EGCG sur la sécrétion basale de MMP-9 en condition faiblement inflammatoire (ratio 1 macrophage : 10 fibroblastes) ... 87 FIGURE 19. Effet du thé vert et de l’EGCG sur la sécrétion basale de MMP-9 en condition fortement inflammatoire (ratio
10 macrophages : 1 fibroblaste) ... 87 FIGURE 20. Effet du thé vert et de l’EGCG sur la sécrétion de MMP-3 en condition faiblement inflammatoire (ratio 1
macrophage : 10 fibroblastes) à des fins préventives ... 90 FIGURE 21. Effet du thé vert et de l’EGCG sur la sécrétion de MMP-3 en condition fortement inflammatoire (ratio 10
macrophages : 1 fibroblaste) à des fins préventives ... 90 FIGURE 22. Effet du thé vert et de l’EGCG sur la sécrétion de MMP-8 en condition faiblement inflammatoire (ratio 1
FIGURE 23. Effet du thé vert et de l’EGCG sur la sécrétion de MMP-8 en condition fortement inflammatoire (ratio 10 macrophages : 1 fibroblaste) à des fins préventives ... 91 FIGURE 24. Effet du thé vert et de l’EGCG sur la sécrétion de la MMP-9 en condition faiblement inflammatoire (ratio 1
macrophage : 10 fibroblastes) à des fins préventives ... 92 FIGURE 25. Effet du thé vert et de l’EGCG sur la sécrétion de la MMP-9 en condition fortement inflammatoire (ratio 10
macrophages : 1 fibroblaste) à des fins préventives ... 92 FIGURE 26. Effet du thé vert et de l’EGCG sur la sécrétion de MMP-3 en condition faiblement inflammatoire (ratio 1
macrophage : 10 fibroblastes) à des fins thérapeutiques ... 95 FIGURE 27. Effet du thé vert et de l’EGCG sur la sécrétion de MMP-3 en condition fortement inflammatoire (ratio 10
macrophages : 1 fibroblaste) à des fins thérapeutiques ... 95 FIGURE 28. Effet du thé vert et de l’EGCG sur la sécrétion de MMP-8 en condition faiblement inflammatoire (ratio 1
macrophage : 10 fibroblastes) à des fins thérapeutiques ... 96 FIGURE 29. Effet du thé vert et de l’EGCG sur la sécrétion de MMP-8 en condition fortement inflammatoire (ratio 10
macrophages : 1 fibroblaste) à des fins thérapeutiques ... 96 FIGURE 30. Effet du thé vert et de l’EGCG sur la sécrétion de la MMP-9 en condition faiblement inflammatoire (ratio 1
macrophage : 10 fibroblastes) à des fins thérapeutiques ... 97 FIGURE 31. Effet du thé vert et de l’EGCG sur la sécrétion de la MMP-9 en condition fortement inflammatoire (ratio 10
xi
LISTE DES ABRÉVIATIONS
spp. ATCC P. gingivalis P. intermedia F. nucleatum A. actinomycetemcomitans T. denticola T. forsythia S. mutans S. sobrinus S. moorei PMN LPS IL IL-1Ra TNF-α TGF-β EGF PDGF PGE2 MMP TIMPS RANK RANKL OPG NF-κB MAPK GT9 EGCG EC ECG EGC ELISA ̊C % h CO2 NaOH RPMI DMEM FBS PMA mM l, ml, µl g, mg, µg Espèce"American Type Culture Collection"
Porphyromonas gingivalis Prevotella intermedia Fusobacterium nucleatum Aggregatibacter actinomycetemcomitans Treponema denticola Tannerella forsythia Streptococcus mutans Streptococcus sobrinus Solobacterium moorei Polymorphonucléaire neutrophile Lipopolysaccharide Interleukine
Récepteur antagoniste de l'IL-1 "Tumor necrosis factor"-α "Transforming growth factor"-β "Epidermal growth factor" "Platelet-derived growth factor" Prostaglandine E2
Métalloprotéinases matricielles Inhibiteurs tissulaires de MMPs
"Receptor Activator of Nuclear Factor-κ B" Ligand de RANK
Ostéoprotégérine "Nuclear factor-kappa B"
"Mitogen-activated protein kinase" "Green tea" 9
Épigallocatéchine gallate Épicatéchine
Épicatéchine gallate Épigallocatéchine
"Enzyme-linked immunosorbent assay" Degré Celcius
Pourcentage Heure
Dioxyde de carbone Hydroxyde de sodium
"Roswell Park Memorial Institute medium" "Dulbecco's modified Eagle's medium" "Foetal bovine serum"
"Phorbol myristic acid" Millimolaire
Litres, Millilitre, Microlitre
xiii
« Que ton alimentation soit ton seul médicament »
Hippocrate (460 – 370 av. J.-C.)xv
REMERCIEMENTS
En préambule à ce mémoire, je souhaite adresser mes remerciements les plus sincères aux personnes qui m’ont apporté leur aide et qui ont contribué à l’élaboration de ce mémoire ainsi qu’à la réussite de ma maîtrise. Je témoigne ainsi toute ma reconnaissance aux personnes suivantes, pour l’expérience enrichissante et pleine d’intérêts qu’elles m’ont fait vivre durant ces dernières années au sein du Groupe de Recherche en Écologie Buccale (GREB).
On ne peut voir le potentiel et le travail d’une personne avant de lui offrir une première chance. C’est pour cette raison que je désire d’abord remercier Dr Daniel Grenier, de m’avoir accueillie au sein de son équipe de laboratoire, et d’avoir pu bénéficier de sa confiance et de son support constant. J’aimerais remercier les membres de mon comité d’encadrement, Dre Fatiha Chandad ainsi que Dre Juliana N. Santos. Leur disponibilité de même que leurs critiques constructives ont contribué grandement à la réalisation de ce projet.
Je tiens également à remercier tous mes collègues du GREB et plus spécifiquement l’équipe du Dr Daniel Grenier. Mes remerciements s’adressent à Jabrane Azelmat, Katy Vaillancourt et Geneviève LeBel, professionnels de recherche, Telma Bedran, Amel Ben Lagha ainsi que Bruno Haas (étudiants au doctorat), Jade Fournier Larente (étudiante à la maîtrise), pour leur appui, leur patience sans limites et la grande générosité dont ils ont fait preuve, et cela, malgré vos charges de travail respectives, tant professionnelles qu’académiques.
Merci à mes parents ainsi qu’à mes sœurs qui ont toujours été présents pour moi, qui m’ont soutenue et encouragée tout au long de mes études. Je tiens également à remercier mon copain pour sa compréhension, son écoute et ses encouragements. C’est entre autres grâce à eux que j’y suis arrivée! Enfin, je désire remercier mes amies pour leur présence. Leurs encouragements et leur appui tout au long de ma maîtrise m’ont permis de persévérer afin d’accomplir avec succès ce projet.
1
1. INTRODUCTION
1.1
Structure et histologie du parodonte
Par définition, le parodonte est un ensemble de tissus entourant la dent et participant au soutien de celle-ci [1]. Sa principale fonction est de maintenir les dents au sein de l’os alvéolaire tout en conservant l’intégrité de la surface muqueuse de la cavité buccale [2-4]. Le parodonte comporte plusieurs structures, dont la gencive, l’os alvéolaire, le cément ainsi que le ligament alvéolodentaire [5] (Figure 1).
Constituant une structure dynamique [2], le parodonte est formé tout au long de la vie par un arrangement vasculaire unique, un système lymphatique et réseau nerveux hautement spécialisé [2]. Ces quatre structures, devant agir en unité, ont chacune leur importance particulière et leur(s) rôle(s) spécifique(s) à jouer dans le maintien des organes dentaires au sein de la cavité buccale.
Figure 1. Représentation schématique des tissus de soutien de la dent (figure traduite et adaptée de Color Atlas of Histology, Fifth Edition, 2009 [6]).
2
Les connaissances actuelles sur l’histologie du parodonte permettent de mieux comprendre les différents types cellulaires retrouvés au sein des tissus parodontaux, les implications/interactions possibles entre ces derniers et ce qui se produit d’un point de vue cellulaire et moléculaire lors des différentes étapes entourant l’initiation et la progression des maladies parodontales.
1.1.1 Gencive
La gencive représente la portion épithéliale du parodonte. Cette dernière recouvre l’os alvéolaire, protège contre les agressions extérieures [7], et son apparence permet de déterminer l’état de santé du parodonte [2].
La gencive est divisée en trois composantes majeures. Dans un premier temps, la gencive marginale (libre) qui est fixée par simple adhérence à la dent sans y être attachée. La gencive libre forme un repli sur la surface de la dent, communément appelé le sillon gingival. La deuxième composante de la gencive, la gencive attachée, adhère fermement au cément de la dent et à l’os alvéolaire. Cette portion de la gencive est affectée lors d’une maladie parodontale et résultera en la formation d’une poche parodontale et d’une perte d’attache de la dent et la formation d’une poche parodontale. La dernière composante de la gencive est la muqueuse alvéolaire, caractérisée par une vascularisation plus visible.
La jonction dento-gingivale est une adaptation de la muqueuse buccale comprenant une composante épithéliale ainsi qu'une composante conjonctive. Le revêtement épithélial de la gencive est divisé en trois compartiments fonctionnels ; l’épithélium gingival, sulculaire et jonctionnel.
1.1.1.1 Épithélium buccal
L’épithélium buccal recouvre la gencive libre ainsi que la gencive attachée [2, 8, 9]. Il s’agit d’un épithélium pavimenteux stratifié kératinisé, composé de quatre couches cellulaires ; la couche basale
3 (stratum germinativum), la couche épineuse (stratum spinosum), la couche granuleuse (stratum granulosum), ainsi que la couche cornée (stratum corneum) et présentant des digitations épithéliales dans le chorion gingival [7].
La couche basale (stratum germinativum) représente la couche germinative, puisqu’elle est constituée de cellules germinales à grand potentiel prolifératif. Cette couche est formée par divers types cellulaires majoritairement cubiques dont les kératinocytes (90%), qui sont fixés entre eux ainsi qu’à la membrane basale sous-jacente au moyen des ‘gap’ jonctions et des hémidesmosomes [2]. Ces cellules issues de la couche basale vont migrer afin de traverser l’ensemble de l'épithélium buccal et, au bout de quelques jours, atteindre la couche cornée [10]. En plus des kératinocytes, la couche basale est caractérisée par la présence de mélanocytes (cellules pigmentaires) [11], ainsi que de cellules de Langerhans (macrophages, cellules immunitaires) qui joueront un rôle dans les mécanismes de défense de la muqueuse buccale [2, 4, 12, 13]. Les cellules de la couche basale servent à protéger l’intégrité de l’épithélium ainsi que des structures sous-jacentes et à produire de nouvelles cellules épithéliales. De plus, ces cellules synthétisent et sécrètent les macromolécules constituant la lame basale et permettant de séparer l’épithélium du tissu conjonctif, la lamina propria [14].
La strate épineuse (stratum spinosum), supra-adjacente à la couche basale, est composée de kératinocytes cuboïdes. Ces cellules auront tendance, au cours de leur migration vers les couches épithéliales apicales, soit la strate granuleuse (stratum granulosum) et la strate cornée (stratum corneum), à s’aplatir et à suivre un programme de différenciation en cellules mortes remplies de kératine et entourées d’une couche cornée de protéines et de lipides, constituant ainsi une des première ligne de défense qui est la barrière épithéliale. Les cellules mortes sont éliminées dans le sillon gingival par l’intermédiaire du fluide créviculaire [15].
En plus de former une barrière physique, les kératinocytes sécrètent des molécules impliquées dans l’adhésion cellules-cellules comme l’acide hyaluronique, de même que dans l’adhésion cellules-matrice comme les intégrines [16]. Ils sécrètent également des collagénases [17], des cytokines telles que le
4
«Tumor Necrosis Factor α» (TNF-α), l’interleukine-1 (IL-1α, IL-1ß), ainsi que des chimiokines dont l’interleukine-8 (IL-8). Les cellules de l’épithélium gingival buccal libèrent à un niveau basal des peptides antimicrobiens comme les ß-défensines (hBD) [18].
1.1.1.2 Épithélium sulculaire
L’épithélium sulculaire est une extension de l’épithélium buccal au sein du sillon gingival. Il s’agit d’un épithélium pavimenteux stratifié, qui, contrairement à l’épithélium buccal, est non kératinisé [2]. Puisqu’il est localisé dans le sillon gingival, ce dernier est constamment en contact avec le biofilm dentaire sous-gingival. Dans la littérature, il est soupçonné que l’absence de kératine pourrait expliquer la susceptibilité à l’infiltration bactérienne ainsi qu’à leurs produits potentiellement nocifs [19, 20].
1.1.1.3 Épithélium de jonction
L’épithélium de jonction, la troisième et dernière composante épithéliale du parodonte, est située à une interface d'importance stratégique entre le sillon gingival, colonisé par des bactéries, et les tissus conjonctifs parodontaux mous et minéralisés qui doivent être protégés de l’exposition aux bactéries ainsi qu’à leurs produits. Par conséquent, son adaptation, tant structurelle que fonctionnelle permet à l'épithélium de jonction de protéger contre la provocation microbiologique constante tout en fournissant le mécanisme d’attachement de l’épithélium à la dent [2].
Il s’agit d’une mince couche épithéliale située sous le fond du sillon gingival, contre la surface de la dent (émail), et qui s’étend jusqu’à la jonction amélo-cémentaire [21]. Fondamentalement, il s’agit d’un épithélium pavimenteux, pluristratifié (malpighien) et indifférencié qui constitue une entité histologique particulière, puisque ce dernier est caractérisé par un taux très élevé de renouvellement des cellules [2]. Il est plus large au niveau du fond du sulcus gingival, et se rétrécit jusqu'à une épaisseur de quelques cellules qui descend le long de l'apex de la dent.
5 La structure permettant l’attachement de l’épithélium à la dent se nomme l’attache épithéliale [22]. D’un point de vue fonctionnel, l’attache épithéliale permet aux cellules épithéliales spécialisées d’adhérer aux tissus dentaires calcifiés, protégeant par le fait même les structures sous-jacentes, de l'invasion par des substances étrangères. D’un point de vue anatomique, l’attache épithéliale consiste en une lame basale (interne, externe) et des hémidesmosomes, les deux produits par l’épithélium longitudinalement orienté qu’est l’épithélium de jonction [21]; il est en contact intime avec la surface extérieure de la dent, soit le cément ou l’émail. Tel un mécanisme dynamique, l'épithélium de jonction se renouvelle continuellement. De nouvelles cellules ayant l’apparence des cellules de la couche basale (aplaties et allongées ; orientation longitudinalement et parallèlement à la dent) sont produites à la base de ce dernier, et les cellules migrent (polarisation de la migration [23] jusqu’à sa surface, tout en maintenant la fixation biologique de la dent. Ce mécanisme complexe d’attachement consiste en une séquence d’événements qui se produit dès l’éruption de la dent à travers la muqueuse buccale [2].
À l’intérieur de l’épithélium jonctionnel sain, il est possible de noter la présence constante d’un infiltrat de cellules inflammatoires, telles que les monocytes, les macrophages ainsi que les polymorphonucléaires neutrophiles (PMNs). Ces cellules, occupant de 1 à 3% des espaces intercellulaires, répondent aux sollicitations continues auxquelles sont soumis les tissus parodontaux [2, 24, 25]. Les cellules de l’épithélium jonctionnel expriment à leur surface du N-acétyl-lactosamine, de l’EGF (Epidermal Growth Factor), du LAF-3 (Lymphocyte Activating Factor), de l’IL-8 (interleukine-8) et de l’ICAM-1 (Intercellular Adhesion Molecule-1) qui leur permet de communiquer avec les cellules immunitaires [24].
Dans les étapes entourant le déclenchement et la progression de la maladie parodontale, le sillon gingivo-dentaire se creuse à la suite à la désintégration des cellules superficielles de l’épithélium de jonction. L’environnement inflammatoire qui accompagne l’éruption avec la présence de nombreux PMNs au niveau de cet épithélium favorise la désintégration cellulaire [26].
6
1.1.1.4 Tissu conjonctif gingival
Le tissu conjonctif gingival, ou lamina propria, est le tissu prédominant de la gencive [2] et celui-ci assure, d’un point de vue fonctionnel, l’herméticité ainsi que la protection du parodonte profond [13]. La composante épithéliale de la gencive est séparée de la composante conjonctive par la lame basale, qui est composée de la lamina densa et de la lamina lucida, assurant la cohésion entre les différentes composantes de la gencive ainsi que les échanges gazeux et moléculaires entre celles-ci. Le tissu conjonctif gingival se compose, dans un état sain, d’approximativement 60 à 65% de collagène organisé en fibres, fibrilles, puis faisceaux de fibres (attache conjonctive ; insertion de fibres dans le cément) [7, 27, 28], de cellules (8%), représentées majoritairement par des fibroblastes (5%) ainsi que des cellules immunitaires (3%). Le volume restant, soit près de 35%, est occupé par le compartiment vasculaire ainsi que les éléments nerveux, incorporés dans une substance fondamentale [2, 27], composée principalement de diverses glycoprotéines et protéoglycanes [29, 30].
Les fibroblastes sont les principales cellules du tissu conjonctif, puisque ces dernières sont présentes dans des proportions pouvant aller jusqu’à 65% [27]. Les fibroblastes sont des acteurs importants dans la physiologie des tissus conjonctifs par des processus successifs de synthèse et de destruction [31-35] des fibres (collagène I, II, III, IV, réticuline, oxtalalnes, élastiques)[36] ainsi que de la matrice extracellulaire (glycoprotéines et glycosaminoglycanes ; milieu dans lequel se retrouvent les cellules et permettant le transport de l’eau, des électrolytes, des nutriments, des métabolites) [2, 37]. Par conséquent, le capital de tissu conjonctif demeure constant et suffisant pour remplir sa fonction [7]. Les fibroblastes gingivaux participent également à la réponse immunitaire inflammatoire en répondant à des stimuli provenant de molécules synthétisées et sécrétées par les cellules immunitaires de l’hôte ou provenant des bactéries parodontopathogènes présentes dans le biofilm sous-gingival [2].
Le tissu conjonctif contient également des leucocytes (neutrophiles, monocytes, macrophages, lymphocytes, mastocytes, plasmocytes) qui interagissent parfois avec les fibroblastes gingivaux [29, 38]. Les PMNs sont observés en plus grande proportion lorsque le tissu conjonctif est sain ou faiblement inflammé [26]. En plus de les retrouver dans le tissu conjonctif, ces derniers peuvent être présents dans l’épithélium de jonction, puis dans le sulcus gingival afin de répondre à la présence bactérienne de la plaque dentaire sous-gingivale ainsi qu’à leurs métabolites potentiellement nocifs.
7 Au sein du tissu conjonctif gingival, il est également possible de retrouver des populations de lymphocytes CD4+ et CD8+ [26].
1.1.2 Ligament parodontal
Le ligament parodontal, également appelé desmodonte, est un tissu conjonctif dense d’origine ectomésenchymateuse. Ce dernier, richement vascularisé et innervé [15, 21], est situé autour de la racine de la dent et s'étend de la partie interne de l’alvéole dentaire jusqu'au cément [7]. Les cellules ligamentaires les plus abondantes sont les fibroblastes (65%) qui sont responsables du métabolisme des composantes de la matrice extracellulaire, dont le collagène [39]. D’un point de vue fonctionnel, en plus de la synthèse du réseau de fibres de collagène dont il est constitué, le ligament parodontal ancre la dent au niveau de son alvéole [2] par l'intermédiaire des fibres de Sharpey et absorbe les forces de mastication ainsi que les forces occasionnées par d'autres mouvements buccaux.
1.1.3 Cément
Le cément est un tissu conjonctif minéralisé d’origine ectomésenchymateuse qui se caractérise par un dépôt continu au cours de la vie. Cette mince couche de tissu minéralisé (50 à 200 µm) entoure la racine en recouvrant la dentine radiculaire et permet l’ancrage des fibres du ligament parodontal à la racine de la dent [2, 7, 15, 24, 39]. En ce qui concerne sa composition, ce tissu possède des similitudes avec l'os alvéolaire, à l'exception que celui-ci n'est ni vascularisé, ni innervé [21]. Par conséquent, ce dernier est entièrement dépendant du desmodonte quant à l’apport de ses éléments nutritifs [7]. Le cément est formé d’une matrice organique qui se compose principalement de collagène (type I et type IIl), d'eau ainsi que de sels minéraux tels que des cristaux d'hydroxyapatite [40].
D'un point de vue histologique, le cément se divise en deux types distincts; un cément acellulaire et un cément cellulaire, caractérisés par la présence ou non de cémentocytes à l’intérieur de celui-ci ainsi que par l’origine des fibres de collagène (fibres de Sharpey) de la matrice (cémentoblastes ou fibroblastes) [15, 41, 42].
8
1.1.4 Os alvéolaire
L'os alvéolaire est la partie de l’os maxillaire et mandibulaire contenant les alvéoles dentaires [21]. Reconnu comme le principal élément de soutien du parodonte, ce dernier apporte rigidité à cette structure et assure la fixation des fibres parodontales [2]. Ce tissu conjonctif calcifié comprend une corticale externe, un os spongieux médian ainsi qu’une corticale externe (lame cribriforme) [2, 21]. Il possède également de nombreuses perforations à travers lesquelles il est possible de retrouver les vaisseaux sanguins ainsi que les fibres nerveuses [39]. Le tissu osseux possède la capacité de se remodeler grâce à l'action des ostéoblastes et des ostéoclastes. Ces derniers sont respectivement responsables de la formation et de la résorption du tissu osseux selon la demande fonctionnelle et métabolique [7, 39].
1.2
Écosystème buccal
L’environnement buccal, lieu d’échange direct entre l’organisme et son environnement [43], est un milieu complexe dans lequel cohabitent plus de 700 espèces de microorganismes [44, 45]. La microflore buccale résidente est amenée à varier en terme d’abondance et de composition en fonction des divers sites de l’individu, et selon divers facteurs tels que l’alimentation et le niveau d’hygiène buccale de celui-ci [46]. Malgré la présence de mycètes, de protozoaires, ainsi que de virus, les bactéries demeurent toutefois la classe de microorganismes prédominante à l’intérieur de la cavité buccale [47].
La salive, les dents (plaque dentaire supra-gingivale et sous-gingivale), la muqueuse buccale ainsi que la langue sont toutes des composantes de la cavité buccale où l’écosystème bactérien diffère, et donc, où différentes communautés microbiennes distinctes sont retrouvées. Celles-ci sont constituées de plusieurs genres bactériens comprenant à la fois des bactéries Gram positives et négatives et pouvant appartenir aux catégories de bactéries anaérobies, strictes ou facultatives, ainsi qu’aux bactéries aérobies. La salive renferme principalement des espèces appartenant aux genres Streptococcus, Veillonella et Actinomyces [48]. Sur la surface des dents, Streptococcus spp., Prevotella spp. et Actinomyces spp. sont principalement retrouvés [45]. Des bacilles Gram positifs de même que des bactéries du genre Veillonella font partie de la flore bactérienne au niveau de la langue [45], tandis que
9 les Streptococcus sont retrouvés au niveau des muqueuses buccales [49]. Quant au sillon gingival, une personne montrant une bonne santé buccodentaire voit ce sitecolonisé majoritairement par une faible charge bactérienne composée entre autres de bactéries Gram positives et anaérobies facultatives [50] appartenant en grande partie aux genres Streptococcus et Actinomyces (Streptococcus sanguis, Streptococcus mitis, Actinomyces naeslundii, Actinomyces viscosus) [21, 51]. Une modification de la flore microbienne en faveur des bactéries Gram négatives anaérobies strictes (voir section 1.3.3.1) dans le sillon gingival est fortement associée au développement des maladies parodontales et à la destruction éventuelle des tissus de support de la dent [50]. Ces bactéries colonisent le sillon gingival sous la forme de plaque dentaire, également appelée biofilm dentaire, qui peut être supra-gingivale ou sous-gingivale, cette dernière étant un facteur étiologique des maladies parodontales [21]. Cette structure est constituée essentiellement de bactéries qui adhèrent à la fois à la surface de la dent et entre elles [21, 52]. Son organisation rigoureuse, et hiérarchisée permet de créer un environnement stable dans lequel il est possible de retrouver des interactions bactériennes importantes d’un point de vue adhésif et nutritionnel [52].
1.3
Maladies parodontales
1.3.1 GénéralitésOutre la carie dentaire, les maladies des gencives, plus communément appelées maladies parodontales, constituent le principal problème buccodentaire chez la population adulte. Il est possible de distinguer deux grands types d’atteinte des tissus de soutien de la dent, soit la gingivite et la parodontite, celles-ci comportant de nombreux facteurs modifiants ou aggravants. Il est estimé à ce jour qu’environ 80 % de la population de l’Occident souffrira un jour de l’un ou l’autre de ce type d’affection [43].
Depuis plusieurs années maintenant, microbiologistes, immunologistes et dentistes travaillent de concert, avec des méthodes de plus en plus sophistiquées, sur l’étiologie des maladies parodontales. Récemment, de nouvelles connaissances et de nouveaux concepts en relation avec les pathologies du parodonte, ont permis d’améliorer le système de classification de celles-ci et ainsi de décrire la parodontite comme une pathologie inflammatoire d’origine infectieuse et multifactorielle [43].
10
Représentée par un équilibre fragile entre l’agression bactérienne et la réponse de l’hôte, la parodontite est influencée par divers facteurs innés environnementaux tels que l’âge, le sexe, l’hygiène buccale, les prédispositions génétiques et hormonales, la situation socio-économique, le stress, l’usage du tabac ainsi que diverses conditions systémiques telles que le diabète et le sida [53]. Pouvant mener à la perte éventuelle de la dent, il est primordial de comprendre l’étiologie des maladies parodontales.
L’état sain d’un individu se caractérise par une cohabitation harmonieuse des membres de la flore microbienne avec les cellules eucaryotes constituant les tissus parodontaux [50]. Cet état d’équilibre fragile entre l’agressivité bactérienne et la réponse de l’hôte est essentiel au maintien d’une bonne santé buccodentaire et celui-ci est régulé par trois facteurs, soit les conditions environnementales, les proportions de bactéries pathogènes/commensales ainsi que le système immunitaire de l’individu [54]. La microflore buccale étant constamment perturbée, dans la mesure où celle-ci ne regagne pas son état d’origine, elle traversera différents complexes de colonisation suivant une succession écologique ordonnée. En effet, des modifications quantitatives et qualitatives de cette flore en faveur des bactéries Gram négatives anaérobies strictes peuvent causer une rupture de l’équilibre et favorise l’apparition d’une réaction inflammatoire exagérée de l’hôte. Ce type de transition peut ainsi engendrer l’émergence de manifestations cliniques infectieuses et inflammatoires telles que les maladies parodontales [50]. Les étapes de progression qui caractérisent la maladie parodontale sont schématisées dans la figure 2 et seront décrites dans les sections qui suivent.
11 Figure 2. Évaluation clinique d'un parodonte sain, affecté d'une gingivite ou d'une parodontite (figure
tirée de [55])
1.3.1.1 Conséquences systémiques des maladies parodontales
Les maladies parodontales sont des maladies inflammatoires d’origine infectieuse qui affectent, à long terme, le système d’attache parodontal. Leurs signes et leurs symptômes rencontrent les signes classiques de l’inflammation, une perte d’attache, une destruction des tissus de soutien de la dent et, éventuellement, la perte de cette dernière. Bien que les maladies parodontales entraînent des conséquences au niveau local, il est maintenant connu que cette pathologie pourrait significativement augmenter le risque de certaines affections systémiques [56].
Au cours des dernières décennies, la relation entre la médecine dentaire et la médecine interne, en particulier en ce qui concerne le concept de la théorie de l’infection focale, a longtemps été un sujet de débats. Autrefois, la pathogénie des maladies focales a classiquement été attribuée à des pathologies de la pulpe dentaire ainsi qu’aux infections périapicales. Par contre, au cours des dernières années, leur rôle a été délaissé et confronté à l’intérêt croissant de la communauté scientifique quant aux associations possibles entre l’infection parodontale et les maladies systémiques. En effet, les agents
12
parodontopathogènes et leurs produits, ainsi que les médiateurs de l’inflammation engendrés par cette présence bactérienne au sein des tissus parodontaux, peuvent pénétrer dans le sang (épithélium compromis ou ulcéré à l’intérieur des poches parodontales), ce qui provoque des effets systémiques et/ou contribuant à différentes affections systémiques [57, 58].
Les infections focales d’origine buccodentaire peuvent être définies comme des infections survenant à distance, de façon généralisées ou localisées à divers appareils ou organes, et qui sont causées par des microorganismes, directement, ou leurs produits, indirectement, provenant de la cavité buccale [59]. Bien que ce concept demeure controversé, puisqu’il est difficile de prouver hors de tout doute l’origine buccale des microorganismes responsables d’infections extrabuccales, ce concept a été davantage pris en considération récemment par les communautés dentaires et médicales. Des études cliniques, de même que des expérimentations animales ont permis de suggérer trois principaux mécanismes physiopathologiques [60-62] :
1. Infection métastatique causée par la translocation de bactéries Gram négatives de la poche parodontale jusque dans la circulation sanguine (ex. : endocardites bactériennes) [54, 60, 63] : Les procédures dentaires, comprenant entre autres l’extraction des dents, les traitements endodontiques, la chirurgie parodontale ainsi que le surfaçage radiculaire, peuvent provoquer l’introduction de microorganismes buccaux dans le sang ou le système lymphatique [59, 64-67]. Plus important encore, la présence d’infections chroniques au sein de la cavité buccale, telle que la parodontite, est une condition importante qui favorise l’entrée des bactéries dans les tissus conjonctifs sous-muqueux et la circulation sanguine [68, 69]. La mastication, de même que les procédures d’hygiène buccale de routine peuvent également induire une bactériémie spontanée, plus particulièrement si les sujets présentent une mauvaise santé buccodentaire [68, 70]. Les bactériémies spontanées sont plus fréquentes et plus importantes sur une période cumulée que lors d’un acte isolé [59, 60, 71].
2. Lésion métastatique, telle que les lésions vasculaires, résultant de la circulation de toxines microbiennes ainsi que des médiateurs pro-inflammatoires [54] : Dans d’autres cas, les agents infectieux restent au site de la lésion initiale, mais les toxines bactériennes sont libérées et
13 peuvent atteindre un organe ou tissu quelconque via la circulation sanguine et provoquer des blessures métastatiques. Plus particulièrement, les endotoxines ou le lipopolysaccharide (LPS), libérés après la mort des bactéries Gram négatives [59], stimulent la production et la sécrétion de médiateurs de l’inflammation tels que l’IL-1, l’IL-6, l’IL-8, le facteur de nécrose tumorale (TNF), des lipides bioactifs (prostaglandines E2,thromboxane A2, facteur d’activation
plaquettaire), ainsi que des radicaux libres (oxygène actif, peroxyde d’hydrogène (H2O2),
monoxyde d’azote (NO)) [60]. Ces derniers jouent un rôle important dans le développement de certaines maladies focales.
3. Inflammation métastatique en raison de la réponse immunitaire face aux parodontopathogènes et leurs toxines [54, 72] : Des bactéries ou leurs antigènes solubles entrent dans la circulation sanguine et ces derniers réagissent avec les anticorps circulant pour former des complexes immuns [59, 60]. Ces complexes immuns peuvent être responsables d’un certain nombre de réactions inflammatoires aiguës ou chroniques dans les sites de dépôts [66]. Dans certains cas, certains anticorps contre des bactéries buccales peuvent également réagir avec les récepteurs tissulaires de l’hôte, résultant en de potentielles lésions immunitaires. Un tel phénomène de mimétisme microbien a été démontré pour la bactérie S.
mutans dans le tissu cardiaque humain [61, 73].
En se basant sur des études épidémiologiques, de nombreuses associations entre la parodontite chronique et les maladies cardiovasculaires [59, 74, 75], les maladies respiratoires [59, 76], le diabète [60], l’ostéoporose [54, 77], les enfants prématurés de faible poids à la naissance (hypotrophie) [54, 59, 60, 78, 79] et, plus récemment, le cancer du pancréas [54, 80], le syndrome métabolique [54, 81], l’insuffisance rénale chronique [54, 82], la polyarthrite rhumatoïde [54, 59, 83-85] ainsi que les maladies neurodégénératives telles que la maladie d’Alzheimer [54, 86] ont été proposés et recensés dans la littérature.
1.3.2 Gingivite
Parmi les deux principaux types de maladie parodontale, la gingivite est l’affection buccale la plus rencontrée au sein de la population, tous les âges confondus. Une étude épidémiologique réalisée aux
14
États-Unis dénombre que jusqu’à 85 % des enfants seraient atteints [87], et que 80 % à 90 % des adultes américains souffriraient de maladies parodontales, bien que seulement 5 % à 20 % soient atteints d’une forme sévère et généralisée de la maladie [88, 89]. La gingivite est définie comme une inflammation réversible, non spécifique et localisée, qui affecte la gencive libre [90]. C’est la forme la plus précoce et la moins sévère de la maladie parodontale qui n’entraîne aucune atteinte et destruction des tissus de support sous-jacents à la dent [55].
L’apparition de la gingivite est intimement liée à une hygiène buccale déficiente et à l’accumulation conséquente de différentes communautés bactériennes au niveau des sites sous-gingivaux [43, 91]. D’un point de vue clinique, la gingivite se manifeste par la présence d’un ou plusieurs des symptômes typiques de l’inflammation, soit la rougeur, un œdème ainsi que la présence occasionnelle de saignements gingivaux lors du brossage/sondage ou de façon spontanée [55]. Dans le but de prévenir l’apparition de maladies parodontales, plus précisément la gingivite, une bonne hygiène buccale et des visites régulières chez le dentiste sont nécessaires. Dans une optique thérapeutique, une élimination mécanique de la plaque sous-gingivale (détartrage) est réalisée par le dentiste. Bénigne dans sa forme simple, elle nécessite toutefois un suivi régulier. En effet, dans la mesure où aucun traitement n’est effectué ou que celui-ci n’est pas effectif, la gingivite peut dégénérer et conduire, par la colonisation des tissus plus profonds du parodonte, à la forme de maladie parodontale la plus sévère et agressive, la parodontite [54, 92].
1.3.3 Parodontite
Les parodontites sont des infections polymicrobiennes aux étiologies et pathogénies variées [93]. Aujourd’hui considérée comme une maladie inflammatoire progressive comportant plusieurs degrés de sévérité, elle est davantage retrouvée au sein de la population adulte et chez les personnes âgées [93].
Étiologiquement, les maladies parodontales, dont la parodontite, sont des infections polymicrobiennes causées par un groupe spécifique de bactéries opportunistes à Gram négatif [94], et significativement liées à la présence de plaque dentaire (biofilm) et de tartre. En conséquence à une mauvaise hygiène
15 buccale, le développement de ce type d’affection démontre un manque de maîtrise du facteur bactérien et résulte en une accumulation et une prolifération de communautés bactériennes regroupées sous la forme de complexes au niveau des sites sous-gingivaux. Les diverses formes de parodontites sont associées à une flore bactérienne différente et les sites d’un même sujet peuvent différer en terme de composition bactérienne [95-97]. Caractérisée par la formation de poches parodontales [98], la parodontite affecte, de façon irréversible, toutes les structures de soutien de la dent, soit le cément, le ligament parodontal et l’os alvéolaire [99]. La colonisation des tissus parodontaux par les bactéries parodontopathogènes entraîne plusieurs dommages tissulaires, de façon directe, en stimulant la réponse immuno-inflammatoire [21]. D’un point de vue clinique, les parodontites se manifestent par la présence de douleurs gingivales, de récession gingivale, d’altérations du système de mastication et la mobilité dentaire [43]. Cette condition pathologique progresse de façon épisodique et oscille entre des phases cycliques d’exacerbation, de rémission et de latence [100-102].
Il existe différents types de parodontite, tels que la parodontite chronique et la parodontite agressive. Les microorganismes qui sont associés à ces deux catégories peuvent différer. La résultante demeure toutefois la même, soit la présence d’inflammation gingivale, la formation de poches parodontales et la destruction des tissus contribuant au soutien de la dent [43, 92]. La parodontite chronique est la forme la plus commune et montre un taux de progression de lent à modéré. Elle affecte toutes les catégories d’âge, mais la prévalence et l’étendue des destructions parodontales augmentent en fonction du vieillissement et d’une hygiène buccale inadéquate [103-105]. Porphyromonas gingivalis est reconnu comme l’un des principaux agents étiologiques responsables de cette forme de parodontite [54, 94], et joue également un rôle dans les formes agressives généralisées [106]. La parodontite agressive, quant à elle, affecte une faible proportion de la population et montre une progression très rapide en ce qui a trait à la perte d’attache des tissus parodontaux et la résorption de l’os alvéolaire. Ce type d’atteinte possède une composante génétique, puisque le sujet atteint peut présenter une bonne santé générale [105]. Aggregatibacter actinomycetemcomitans est une bactérie pathogène fortement associée à certaines formes de parodontites agressives [98], localisées ou généralisées, réfractaires, et plus rarement à la parodontite chronique [106].
16
Bien que les bactéries puissent se retrouver à l’état planctonique à l’intérieur de la cavité buccale [43], la majorité d’entre elles s’organisent en un biofilm bactérien, plus connu dans le domaine clinique sous le nom de plaque dentaire [52]. Il s’agit de communautés bactériennes qui adhèrent à la fois entre elles ainsi qu’à la surface des dents pour former une organisation complexe et structurée [43].
Il est possible de distinguer deux types de plaque dentaire selon leur localisation, soit la plaque supra-gingivale et la plaque sous-supra-gingivale. La plaque supra-supra-gingivale se retrouve sur la surface de l’émail des dents et est baignée par la salive, constituant un environnement aérobie. Quant à la plaque sous-gingivale, elle se retrouve au niveau du sillon gingival et par conséquent, est entièrement submergée par le fluide créviculaire, qui crée un milieu anaérobie [107]. Continuité apicale de la plaque supra-gingivale, la plaque sous-gingivale est principalement à l’origine des maladies parodontales [21].
La pellicule exogène acquise, constituée de glycoprotéines salivaires qui se déposent peu après le brossage sur la surface des dents, représente la première phase de formation de la plaque supra-gingivale et permet alors l’adhésion de microorganismes [52]. La colonisation subséquente, se faisant de façon ordonnée et organisée, est répartie, comme le démontre la Figure 3, sous la forme de 6 complexes bactériens regroupant les colonisateurs primaires et secondaires.
17 Figure 3. Schéma représentant les interactions bactériennes des 6 complexes de colonisation (figure
tirée de [108]).
Les espèces pionnières, colonisatrices primaires, s’attachent de façon réversible à cette pellicule exogène à l’aide de leurs adhésines de surface. Cette catégorie comprend majoritairement des bactéries Gram positives telles que les espèces du genre Streptococcus et les Actinomyces (complexes jaune, vert, violet et bleu). Ces complexes favorisent le développement de conditions d’anaérobiose et par le fait même, la prolifération de colonisateurs secondaires, des bactéries Gram négatives anaérobies strictes incluant les espèces du genre Fusobacterium, Prevotella, Streptococcus, Peptostreptococcus, Eubacterium et Campylobacter [109]. Ces bactéries, appartenant au complexe orange, viennent soit remplacer ou joindre les espèces bactériennes déjà présentes au sein du biofilm et agissent à titre d’intermédiaires entre les colonisateurs primaires et les bactéries du complexe rouge, bactéries colonisatrices secondaires [110]. Les bactéries qui se développent au sein de la plaque sous-gingivale telles que P. gingivalis, T. denticola et T. forsythia sont les bactéries constituant le complexe rouge et qui sont le plus souvent associées au développement des maladies parodontales [108, 111]. Leur colonisation provoque l’approfondissement du sillon gingival pour former une poche parodontale,
18
à l’intérieur de laquelle se développe un écosystème bactérien difficile à éliminer [43]. Les colonisateurs secondaires synthétisent une matrice d’exopolysaccharides conférant au biofilm un environnement difficile d’accès aux cellules du système immunitaire ainsi qu’aux agents antimicrobiens. De plus, la virulence de cette structure stable est accentuée, puisque les structures antigéniques sont continuellement libérées dans le milieu et contribuent à la destruction des structures du parodonte [52, 112].
Les bactéries du complexe rouge possèdent plusieurs facteurs de virulence leur permettant à la fois une colonisation efficace des sites sous-gingivaux, d’échapper aux défenses de l’hôte afin de créer des dommages au niveau des tissus constituant le parodonte [113]. Les fimbriae, les adhésines de surfaces de même que certaines protéines de la membrane externe permettent l’adhésion des bactéries parodontopathogènes aux cellules de l’hôte [113]. La prolifération bactérienne et la colonisation efficace des sites de l’hôte sont assurées par des protéines de la membrane externe, des vésicules membranaires, le lipopolysaccharide (LPS) ainsi que des exopolysaccharides [113]. De plus, les bactéries pathogènes peuvent endommager les tissus de façon directe, en élaborant des enzymes protéolytiques qui causent la dégradation des protéines de l’hôte telles que la fibronectine et le collagène. De façon indirecte, la destruction des tissus du parodonte peut être la conséquence de l’activation des mécanismes inflammatoires et immunitaires de l’hôte par le LPS menant à la sécrétion de médiateurs inflammatoires tels que les cytokines et les métalloprotéinases matricielles (MMPs) [114].
1.3.3.1.1 Porphyromonas gingivalis
P. gingivalis est une espèce bactérienne dominante de la flore cultivable de la poche parodontale en phase active de destruction [7]. En effet, de nombreuses études ont démontré que ce membre du complexe rouge est une espèce d’importance, tant en prévalence qu’en nombre, dans la plupart des lésions des parodontites chez l’adulte, et plus spécifiquement la forme chronique, tandis que ce dernier ne se retrouve pas, ou en très faibles proportions chez un individu sain [115].
19 P. gingivalis est un coccobacille non-motile à Gram négatif, asaccharolytique et anaérobie strict, mesurant approximativement 1 µm de diamètre par 2 µm de long [7, 113]. Lorsque cultivée sur gélose sang enrichie d’hémine et de vitamine K, cette bactérie se caractérise par la formation de colonies à pigmentation noire. Cette particularité résulte de l’accumulation au niveau de la membrane bactérienne, d’un pigment identifié comme le fer (III) protoporphyrine IX sous la forme µ-oxo dimère [Fe(III)PPIX]2O dérivant de l’hémine (fer) contenue dans le milieu de culture [116-119].
Ce parodontopathogène est le microorganisme le plus intensément étudié d’un point de vue moléculaire et sa pathogénicité est attribuée à un ensemble de facteurs de virulence, dont la capsule, les fimbriae, les enzymes protéolytiques (cystéines protéinases; gingipaïnes), les hémagglutinines, le lipopolysaccharide (LPS) ainsi que les vésicules membranaires [7, 113, 116, 120-122]. Bien que la coopération bactérienne soit importante dans le déclenchement et la progression de la parodontite [123], les facteurs de virulence propres à P. gingivalis lui permettent de coloniser les sites sous-gingivaux, de contourner les mécanismes de défense immunitaire et d’engendrer la destruction tissulaire et osseuse caractéristique de la parodontite.
En plus d’être un contributeur prédominant dans le processus infectieux des maladies parodontales, P. gingivalis est également impliqué dans diverses conditions systémiques, notamment les maladies cardiaques (athérosclérose, ACV), le diabète, les pneumonies d’aspiration, les accouchements prématurés d’enfants de faible poids à la naissance ainsi que l’arthrite rhumatoïde [72, 76, 120, 124-133].
1.3.3.1.1.1 Facteurs de virulence de Porphyromonas gingivalis 1.3.3.1.1.1.1 Capsule
Lorsqu’un agent pathogène s’introduit dans l’organisme, le système immunitaire répond à cette nouvelle infection de deux manières; soit par la détection et la reconnaissance de cet organisme invasif, suivie de la destruction de celui-ci par une réponse immunitaire très complexe et élaborée.
20
La surface des microorganismes pathogènes constitue l’interface centrale entre l’hôte et la bactérie pathogène, et la reconnaissance de diverses composantes de surface (LPS, peptidoglycane, ADN bactérien [134]) par le système immunitaire est essentielle pour initier les processus d’élimination de cette dernière [135]. La stratégie la plus efficace employée par les bactéries parodontopathogènes afin d’éviter leur reconnaissance par les cellules de l’hôte [136], tout en exposant des molécules clés dans le processus d’invasion (adhésines, invasines) est d’empêcher la reconnaissance des motifs moléculaires associés aux pathogènes (PAMPs) se retrouvant à leur surface [135, 137, 138]. Pour ce faire, de nombreuses bactéries buccales Gram négatives telle que P. gingivalis possède une capsule de polysaccharides chargée négativement et hydrophile [139] recouvrant sa membrane externe, et dont la synthèse est modulée par divers facteurs environnementaux [140-142]. La capsule de ce microorganisme a été démontrée comme un important facteur dans l’établissement d’infections expérimentales, plus particulièrement dans un modèle murin [139, 142, 143]. Dans la littérature actuelle, six sérotypes capsulaires distincts (K1- K6) du point de vue de la composition de la capsule et de la virulence sont actuellement décrits [7, 139, 142, 144]. La capsule est considérée comme un facteur de virulence important puisque celle-ci permet à la bactérie de résister à l’action de diverses substances présentes dans la salive (lysozyme, ions métalliques toxiques) [145], tout en prévenant le dépôt des anticorps et des protéines du complément sur leur surface, leur permettant ainsi d’échapper à l’opsonisation et à la phagocytose qui en résulte (activation innée des défenses adaptatives) [135, 136, 142]. Réduisant la capacité des cellules effectrices de l’hôte à avoir accès aux bactéries invasives, les mécanismes de défenses contre ces bactéries encapsulées doivent être accrus.
1.3.3.1.1.1.2 Fimbriae
De nombreuses études épidémiologiques ont suggéré que P. gingivalis est un acteur important dans le déclenchement et la progression des maladies parodontales [108, 146, 147]. Bien que les mécanismes pathogéniques impliqués ne soient pas encore entièrement élucidés, l’adhésion bactérienne et la colonisation subséquente des tissus de l’hôte sont des étapes cruciales afin que la bactérie puisse exercer son pouvoir pathogène. Les fimbriae, des filaments longs et fins organisés de façon péritriche à la surface de la bactérie, ont été reconnus pour exercer ces fonctions [121, 148-150].
21 À ce jour, les fimbriae sont considérés comme des facteurs essentiels intervenant dans les interactions bactériennes avec les cellules de l’hôte et l’invasion des tissus.
Des examens ultrastructuraux des différentes souches de P. gingivalis ont montré que ces structures varient entre 0,3 à 3 µm de long et 5 nm de diamètre [121, 149-152]. Dans la littérature, il a été démontré que P. gingivalis exprime à sa surface deux types de fimbriae distincts; les fimbriae majeurs de type 1 (FimA; longs), ainsi que les fimbriae mineurs (Mfa; courts). Tous deux semblent impliqués dans le développement des maladies parodontales [147, 149, 153, 154]. Les fimbriae majeurs de type 1 (FimA) sont constitués d’une juxtaposition de sous-unités d’une protéine, la fimbrilline, cette dernière étant sous le contrôle du gène fimA [7, 149, 155], présent qu’en un seul exemplaire sur le chromosome de la bactérie [149, 156-158]. En se basant sur la variation de la séquence nucléotidique, le gène a été classé en six types (I, Ib, II, III, IV, V) [147, 149, 156, 159-162]. Il a été suggéré que les fimbriae majeurs, dus à leur longueur, sont les premières composantes bactériennes à interagir autant avec les autres espèces bactériennes que les cellules de l’hôte dans les sites sous-gingivaux [163]. Ces interactions de coagrégation/coadhésion sont possibles par l’intermédiaire de différents récepteurs présents sur la surface bactérienne, dont la glycéraldéhyde -3-phosphate déshydrogénase (GAPDH) chez certains streptocoques ainsi que la dentilisine de T. denticola [149, 155].
Les fimbriae mineurs sont des homopolymères provenant du gène mfa1 codant pour la sous-unité protéique Mfa [7, 149, 155]. Ce type de fimbriae permet également la coadhésion aux bactéries déjà présentes [149, 164-167].
Les fimbriae, en plus d’être responsables des propriétés adhésives de ce microorganisme et de médier l’adhérence de celui-ci à une grande variété de molécules et substrats au niveau de la cavité buccale [168], stimulent diverses cellules de l’hôte (cellules épithéliales, monocytes) via l’activation de la voie NF-κB (intermédiaire TLR-2, CD14) résultant en la sécrétion de diverses cytokines pro-inflammatoires (IL- 1β , IL-6 et TNF-α) [149].
22
1.3.3.1.1.1.3 Hémagglutinines
Les protéines membranaires, telles que les hémagglutinines, jouent un rôle crucial dans l’adhésion de P. gingivalis dans les sites sous-gingivaux [169-171]. Bien que cinq hémagglutinines différentes (HagA à HagE) soient exprimées à la surface cellulaire, ces dernières sont toutes impliquées dans la liaison de ce microorganisme aux récepteurs des cellules humaines, essentiellement des oligosaccharides [93, 121, 171].
De plus, P. gingivalis possède une activité hémolytique par l’intermédiaire des hémagglutinines. Ces protéines membranaires permettent de lier les érythrocytes puis de les lyser, libérant ainsi de l’hémoglobine, une source de fer essentielle à la croissance de ce microorganisme [121, 172-174].
1.3.3.1.1.1.4 Gingipaïnes
Certaines bactéries impliquées dans l’étiologie de la maladies parodontale possèdent un fort pouvoir protéolytique, qui, en plus de permettre la dégradation des protéines de l'hôte dans un contexte nutritionnel, interfère avec les mécanismes de défense mis en place par l'hôte lors de la réponse immunitaire [175], en plus de causer la destruction tissulaire et osseuse [116, 176]. Ces protéinases sont considérées comme un facteur de virulence important, puisqu'elles permettent la survie et la prolifération de la bactérie à l'intérieur de l'hôte, ce qui représente un aspect fondamental de la pathogénèse bactérienne [138].
P. gingivalis est une bactérie qui possède à sa surface et sécrète sous forme soluble une multitude de protéinases ayant différentes spécificités (cystéine endoprotéinase ; gingipaïnes, collagénases, dipeptidyl aminopeptidase IV), dont les gingipaïnes [175, 177, 178]. L'activité protéolytique de P. gingivalis la mieux caractérisée est reliée à trois cystéines protéinases possédant une activité amidolytique pour des acides aminés spécifiques, appelées gingipaïnes R (RgpA et RgpB ; cystéines protéinases spécifiques à l'arginine) et K (Kgp ; cystéine protéinase spécifique à la lysine), qui sont, selon plusieurs auteurs, fortement associées à la virulence de cette bactérie [116, 122, 177, 179, 180].
23 Les Arg-gingipaïnes A et B, de même que la Lys-gingipaïne clivent la région carboxy-terminale de leur résidu respectif, soit l’arginine ainsi que la lysine; cette activité catalytique étant liée à la présence d’un groupement thiol au site actif de l’enzyme [181].
Trois gènes codent pour les cystéines protéinases de P. gingivalis:
rgpA code pour la protéinase spécifique à Arg-X RgpA (95 kDa), qui possède un domaine catalytique ainsi qu'un domaine adhésine/hémagglutinine (hag sequence domain)(HA); rgpB code pour la protéinase spécifique à Arg-X RgpB (50 kDa) qui ne possède pas le domaine
adhésine/hémagglutinine à l'exception d'une petite extrémité C-terminale codant pour le domaine catalytique; et
kgp code pour la protéinase spécifique à Lys-X Kgp (≈ 110 kDa), qui possède un domaine catalytique ainsi qu'un domaine adhésine/hémagglutinine (hag sequence domain)(HA). Ainsi donc, RgpA ainsi que Kgp possèdent des domaines hémagglutinines qui contribuent à la colonisation de la cavité buccale par P. gingivalis [177, 182-186].
P. gingivalis est une bactérie asacharolytique qui nécessite de courts peptides ainsi que des acides aminés afin de subvenir à ses besoins énergétiques [121, 187]. Cette acquisition de nutriments est possible suivant la dégradation des protéines environnantes par les protéinases, plus spécifiquement les gingipaïnes. Ces dernières peuvent dégrader un certain nombre de substrats potentiellement importants au milieu du sillon gingival, incluant le collagène, la fibronectine, le fibrinogène et la laminine [121, 188].
Le fer est également un facteur de croissance indispensable à P. gingivalis, qui utilise l’hémine (fer protoporphyrine IX) afin de satisfaire ses besoins nutritionnels [121, 188-191]. Un certain nombre de composés contenant du fer ou des dérivés de l’hémine, tels que l’hémoglobine, la transferrine [192], l’haptoglobine, la myoglobine, l’hémopexine, la méthémoglobine, l’oxyhémoglobine, l’albumine, la lactoperoxydase, la catalase ainsi que le cytochrome c peuvent être dégradés par les protéases de P.
24
gingivalis à des fins nutritionnelles [121, 188-191]. De plus, grâce à l’hémolysine, ce parodontopathogène s’approprie du fer en libérant l’hémoglobine des érythrocytes [121, 193].
Bien que la fonction primaire des protéases sécrétées par les bactéries asaccharolytiques telle que P. gingivalis est de fournir de courts peptides pour subvenir à ses besoins énergétiques (croissance), les protéases sont également impliquées directement dans l’adhérence et la colonisation des tissus [121, 194]. En effet, la colonisation des sites sous-gingivaux par P. gingivalis est facilitée par sa capacité à adhérer à de nombreuses surfaces biotiques, dont les cellules épithéliales, la matrice extracellulaire, de même que les globules rouges et les autres bactéries. Bien que cette adhérence puisse être médiée par les fimbriae, les gingipaïnes de P. gingivalis peuvent également être impliquées, par des mécanismes directs ou indirects [195]. De plus, le fort potentiel protéolytique de P. gingivalis peut favoriser l’adhérence des parodontopathogènes aux tissus gingivaux. Ainsi, la dégradation de la fibronectine (matrice extracellulaire) permet la libération et l’exposition des cryptitopes à la surface des cellules eucaryotes, des sites d’adhésion masqués [196] permettant l’adhérence des bactéries [197-200].
Puisque la bactérie P. gingivalis est considérée comme un intrus pour le corps humain, cette dernière deviendra une cible naturelle pour le système immunitaire de l'hôte, qui tentera de l’éliminer en déployant divers mécanismes impliqués dans la réponse immunitaire innée, non-spécifique (complément, peptides antimicrobiens, neutrophiles et macrophages résidents), de même que dans la réponse immunitaire adaptative, plus spécifique (anticorps, macrophages activés, lymphocytes T) [116, 176]. Ces deux composantes de la réponse immunitaire sont en constante interaction et sont synchronisées par diverses cytokines [195]. Afin de survivre aux attaques du système immunitaire, P. gingivalis possède la capacité de manipuler ces deux branches de la réponse immunitaire, et il est soupçonné que les gingipaïnes constituent des acteurs clés dans ce processus.
L’invasion bactérienne induit, dans la cavité buccale, l’expression de peptides antimicrobiens cationiques tels que les β-défensines, la cathélicidine LL-37 ainsi que les α-défensines dérivées des
![Figure 1. Représentation schématique des tissus de soutien de la dent (figure traduite et adaptée de Color Atlas of Histology, Fifth Edition, 2009 [6])](https://thumb-eu.123doks.com/thumbv2/123doknet/6528394.175437/17.918.137.822.600.984/figure-représentation-schématique-soutien-traduite-adaptée-histology-edition.webp)
![Tableau 1. Les différentes classes de composés phénoliques (Tableau adapté de [336]).](https://thumb-eu.123doks.com/thumbv2/123doknet/6528394.175437/57.918.144.823.297.841/tableau-classes-composés-phénoliques-tableau-adapté.webp)
![Figure 4. Schématisation du processus de fabrication du thé et composition en polyphénols des divers thés (Figure adaptée de [339]](https://thumb-eu.123doks.com/thumbv2/123doknet/6528394.175437/58.918.125.749.576.928/figure-schématisation-processus-fabrication-composition-polyphénols-figure-adaptée.webp)