HAL Id: tel-02127266
https://tel.archives-ouvertes.fr/tel-02127266
Submitted on 13 May 2019HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Identification et caractérisation moléculaire de la
première étiologie génétique responsable de la maladie
de Whipple chez l’homme
Antoine Guerin
To cite this version:
Antoine Guerin. Identification et caractérisation moléculaire de la première étiologie génétique re-sponsable de la maladie de Whipple chez l’homme. Génétique. Université Sorbonne Paris Cité, 2017. Français. �NNT : 2017USPCB057�. �tel-02127266�
THÈSE DE DOCTORAT ÈS SCIENCES
UNIVERSITÉ PARIS DESCARTES – DIDEROT
École doctorale BIO – SPC
Spécialité: Immunologie
Présentée par Antoine GUÉRIN
Pou o te i le g ade de Do teu de l’U i e sit PARIS V – PARIS VII
Sujet de la thèse:
Laboratoire de Génétique Humaine des Maladies Infectieuses Unité INSERM U1163, Institut IMAGINE, Paris
Soutenue publiquement le 13 Novembre 2017
JURY
Dr. Agnès RÖTIG Président
Pr. Jacques FELLAY Rapporteur
Pr. Isabelle MEYTS Rapporteur
Pr. James DI SANTO Examinateur
Dr. Florence FENOLLAR Examinateur
Dr. Jacinta BUSTAMANTE Directeur de thèse
Pr. Jean-Laurent CASANOVA Directeur de laboratoire
IDENTIFICATION ET CARACTÉRISATION MOLÉCULAIRE DE LA PREMIÈRE ÉTIOLOGIE
How many roads must a man walk down, before you call him a man? …
How many years can some people exist, before they're allowed to be free?
-Bob Dylan, Blowin in the wind (1963)
Hu a ei gs are ulti ately othi g ut arriers-passageways- for genes. They ride us into the ground like racehorses from generation to generation. Genes don't think about what constitutes good or evil. They don't care whether we are happy or unhappy. We're just means to an end for them. The o ly thi g they thi k a out is what is ost effi ie t for the .
-Haruki Murakami, 1Q84 (2010) This issi g s ie e of heredity, this u worked i e of k owledge on the borderland of biology and anthropology, which for all practical purposes is as unworked now as it was in the days of Plato, is, in simple truth, ten times more important to humanity than all the chemistry and physics, all the technical and industrial science that ever has been or ever will be discovered.
Je oud ais e p e ie lieu e e ie Isa elle Me ts et Ja ues Fella pou ’a oi fait l’i e se ho eu d’a epte de ise o t a ail de th se. Je oud ais gale e t e e ie Ag s Rotïg, Flo e e Fe olla et Ja es Di Sa to pou ’a oi fait l’ho eu d’a epte de p e d e pa t à o ju de th se e ta t u’e a i ateu s.
Je voudrais ensuite adresser un incommensurable merci à Jean-Laurent Casanova pour ’a oi do les o e s de alise e t a ail e ’a ueilla t au sei de so la o atoi e durant mon master et ma thèse, ce qui mit bout à bout, représente quand même 5 longues années de dur labeu . Je lui se ais toujou s e o aissa t de ’a oi e a u da s e tou de « formule 1 », ’ ita t ai si de pe d e o te ps e faisa t « du karting dans le Limousin ». J’ai e effet, g â e à so e ige e, o e t app is du a t ette p iode, et ce, aussi bien en termes de rigueur scientifique que du développement de ma réflexion « step wise manner ».
Je souhaite e e ie i fi i e t Lau e t A el pou ’a oi si ie a ueilli da s le la o atoi e e faisa t p eu e d’u e patie e à toute p eu e, ui est sû e e t d’i flue e hel ti ue, fasse à l’ le t o li e ue j’ tais et ue je suis e tai e e t toujou s u peu. Si j’osais u e tapho e, je hoisi ais le o he i ua le fa e à la te p te.
Guillaume, ah ! Guillaume, comment te remercier ? Peut-être en utilisant le langage Vogt ui t’est p op e et ue t op peu de pe so es e o p e e t ou ’app ie t à sa juste aleu . Tu es u Milo Ma a a da s to ge e a tu ’as pe is d’op e le « déclic » essai e à l’ tudia t t op i atu e ue j’ tais, « déclic » ue tu tudies ai te a t d’u point de vue génétique. Tu as su à ta manière et peut-être inconsciemment trouver les mots pou o st ui e la ase solide ui sau a, j’e suis sû , soute i le este de a a i e.
Je remercie également Jacinta qui, ie ue ’a a t pas p u de ’a oi sous sa gou e e, ’a laiss la li e t de ’ pa oui pou e pe ett e de de e i le post-doc que je se ai de ai . J’ai app is eau oup de hoses es uel ues a es où elle ’a supe is , et je ne parle pas seuleme t de l’espag ol. E effet elle a su e o t e e t e aut es u’il fallait hoisi ses o ats et e pas o e e eu ui taie t pe dus d’a a e ais gale e t ue toute dis ussio tait supe flue si elle ’a ait pas u a gu e tai e s ie tifi ue ie organisé.
Un extraordinaire « Trugarez » à Manue, ma petite fée bretonne, pour le soutien sans ete ue u’elle ’a apporté durant toutes ces années. Les légendes arthuriennes étaient donc vraies, la science ayant depuis remplacé la magie. Elle a mis à profit son sens aigu du bénévolat pour aider une cause que certains considéraient comme perdue et qui était sans aucun doute humanitaire. Merci pour ces discussions, la correction de ce manuscrit, le réconfort, mais aussi pou ’a oi e is da s le d oit he i ua d je o e çais à ’ ga e .
Le simple fait de faire sourire le Dr. Puel le matin à toujours réussi à embellir ma journée. Le mot « pisseux » dans sa bouche sonnera à jamais pour moi comme un compliment. Je ne la remercierai jamais assez pour avoir su écouter sans limites, et ce, même quand elle
était surchargée de travail, toutes mes lamentations et doléances. Je garderais toujours au fo d de oi tous les p ieu e seig e e ts et e o a datio s u’elle ’a distill s avec beaucoup de bienveillance.
Mer i aussi à Vi ie pou toutes es dis ussio s s ie tifi ues ui ’o t eau oup p ofit et fait fl hi . Je le e e ie gale e t pou a oi fait se la t d’ t e ho u , ie ue ela l’a usait eau oup, à ha ue fois ue es fa ties d passaie t les li ites de la ie s a e. E pa la t de ela, je oud ais e e ie Ro ai pou a oi t , plus sou e t u’à so tou , la use de es fu iste ies ui, je l’assu e, taie t toujou s a i ales. Je le e e ie également pour ses conseils utiles et pour les conversations toujours attrayantes et son esprit de révolte.
Lazaro, comment aurais-je pu survivre sans toi ? Tous ces potins partagés, toutes ces conversations délicieusement médisantes ont apporté la légèreté indispensable au bon déroulement de mes journées et o t t salutai es pou o tat d’esp it. Me i à Ca oli e et M la ie pou leu aide da s les o e ts où j’ tais su e g pa la tâ he ui ’ tait incombée. Merci à Maya pour sa douce naïveté et pour son coté on ne peut plus maternel.
« Gracias » à Alejandro, Carmen et Cécilia, dits « the Spanish team » pour leurs leçons uotidie es d’espag ol. Me i à Ca e pou a oi po t so a elet leu au oi s u jou sur deux. « Aligatô gozaimasu » à Ku ihiko Sa pou ’a oi fait p ofite de sa ultu e Japonaise ue j’app ie tout particulièrement. Merci bien à Emilie, dit « Dabou » pour être u si o pu li et pou ’a oi sa s a t te du des pe hes. Un énorme merci à Valentine, pour avoir eu la bienveillance de corriger les fautes d’o thog aphe pou les isio s de e manuscrit. Ma grand- e p of de f a çais t’e se a, j’e suis sû , te elle e t reconnaissante. Merci à Joëlle pour avoir supporté mes blagues souvent déplacées avec son flegme caractéristique.
Je rends grâce à e si st ieu pe so age u’est Ale a d e. De pa la a i e o o e tio elle do t fo tio e so esp it, o esso t toujou s e i hi d’u e o e satio a e lui, e si pa fois o e s’e e d o pte ue uel ues jou s plus ta d. Me i pou tous ses o seils p odigu s au o e ts où j’e a ais le plus esoi .
Je e e ie Fa ie e pou ’a oi app is, e t e aut es, la vraie signification de l’apo al pse, do t je e peu ai te a t u’atte d e la e ue a e i patie e. Merci à Aurélie, Matthieu, Gaspard, Vimel, Shaïma et le groupe épidemio en général pour avoir su braver les codes e i pl e ta t les lig es ui o t o pl t es l’es uisse de e eau ta leau. Merci à Frédégonde pour ses coupes de cheveux toujours rafraichissantes symboles de la grande richesse guyanaise.
Merci à Cécile, Céline et Lahouri pour avoir soulagé ma phobie administrative
I would like to thank the New-York branch of the lab for all the challenging questions that help to improve my scientific knowledges. A special thanks goes to Janet for her
mentorship and her patience especially when I was hardly trying to gather my thoughts. A sweet thanks goes to Serkan, my little Turkish bear with a big melting heart.
Merci par avance Quentin pour toutes les séances de psychanalyse à venir qui feront le plus grand bien à mon potentiel syndrome frontal. Laura, premièrement merci de venir à a th se e a a t la dista e ie ue ie e t’ o ligeait. Deu i e e t, j’ai eau oup appris de la senior doctorante que tu étais lors de mon arrivée dans ce laboratoire et je te ga de ais toujou s da s o œu .
Du plus p ofo d de o œu je oulais i o de de e e ie e t o petit pa da. La patience et la pédagogie dont elle a fait preuve fasse à mon syndrome prononcé de « Peter Pan » sont non seulement incroya les ais ite t su tout d’ t e it oi su la . Grazie mille per la tua tenerezza illimitata eper il tuo sguardo sempre pieno di orgoglio per me. Non sarei diventato l'uomo che sono se tu non fossi la donna che sei.
Me i à l’i stitut I agi e pou ’a oi offe t e ad e u i ue de t a ail où la o e hu eu et l’e t aide g e t e aît e. U g a d e i à E ilie pou sa ie eilla e et so sourire toujours radieux.
Je voulais également remercier toute ma famille pour leur soutien. Ils me font en plus le plaisir de venir en masse à ma soutenance, en provenance de France et de Navarre, certain ayant même t a e s l’atla ti ue. J’ai d fi toutes les p di tio s e a i a t là où je suis maintenant pou leu p ou e u’ils a aie t aiso de oi e e moi. Je remercie tout pa ti uli e e t es pa e ts d’a oi e t e l leu s g es a e te d esse il a ai te a t plus de 30 ans, ayant ainsi créé un patrimoine génétique des plus intriguant. De plus, je suis rempli de fierté de pouvoir réunir en cette occasio , l’e se le des g atio s de o a e généalogique (26 à 80 ans, âge moyen approximatif 55 ans). Merci à Pao et Flo pour avoir apporté le côté chic et glamour à nos escapades ferretcapiennes et parisiennes. Merci aussi à Claire et Dridri (et la petite lucie) pour tous les merveilleux moments passés ensemble qui ont toujou s t d li ieu . Me i à Baptiste ui a su e ga de da s so œu alg la a fa tio de ou elles et de te ps li e pa tag . Me i à tous d’a oi suppo t les o s ue es ue peut avoir une thèse sur la vie personnelle.
Ap s a oi puis o es de supe latifs et de tapho es, je e dois d’a te là les e e ie e ts, si o ils de ie d aie t plus lo gs ue l’i t odu tio de a th se, e ui fe ait désordre. Je finirais donc en remerciant toutes les personnes qui auraient souhaité y figurer
Sommaire
Résumé ... 1
Liste des publications ... 2
Abréviations ... 3
Introduction ... 5
I. La maladie de Whipple: manifestations cliniques et données épidémiologiques ... 5
II. La maladie de Whipple: microbiologie et immunopathologie ... 8
III. Th o ie de la p dispositio g ti ue des aladies i fe tieuses hez l’ho e appli u e à la MW ……….14
Identification de la première étiologie génétique de la MW ... 16
I. Approche génétique par une étude génome entier appliquée à la cohorte ... 16
II. IRF4 et la famille des IRF ... 22
III. IRF da s l’i u it ... 24
1. Le ôle d’IRF da s les l pho tes T ... 24
2. Le ôle d’IRF da s les l pho tes B ... 28
3. Le rôle d’IRF da s les ellules loïdes ... 30
IV. Les IRF associés aux déficits immunitaires héréditaires ... 34
Caractérisation moléculaire et fonctionnelle de la mutation R98W en lien avec la MW ... 38
I. Pe te de fo tio de l’all le uta t R W ... 38
1. E te es de liaiso à l’ADN ... 38
2. E te es d’a ti ité transcriptionnelle ... 40
II. Étude de l’i pa t fo tio el des a ia ts IRF4 à l’ helle de la populatio ... 42
III. Conséquences transcriptomiques de la mutation R98W dans les cellules des patients ... 44
IV. Lo alisatio d’IRF e s st e de su e p essio et da s les ellules des patie ts ... 47
V. Études de la mutation dans les cellules myéloïdes ... 48
Conclusions et perspectives ... 50
1 Résumé
Résumé
La maladie de Whipple (MW) est une maladie infectieuse rare, sévère et chronique qui e tou he u’u e i o it d’i di idus i fe t s pa Tropheryma whipplei (T. whipplei). Le portage chronique et asymptomatique de T. whipplei est moins rare. La pathogénie de la MW reste largement inconnue. Par une approche génétique combinant une analyse de liaison du g o e e tie et le s ue çage de l’e se le des e o s, ous a o s test l’h poth se d’u e prédisposition génétique à la MW. Nous avons étudié une famille multiplexe comprenant quatre patients atteints de la MW ais ’a a t pas d’aut es pathologies asso i es et cinq porteurs asymptomatiques de T. whipplei, pour laquelle nous avons envisagé un modèle autosomique dominant (AD) avec une pénétrance incomplète liée à l’âge. Nous a o s o t que la mutation c.292 C>T (p.R98W) dans le gène IRF4 était le seul variant hétérozygote très rare et non-synonyme commun aux quatre patients. Chez la souris, le gène Irf4 est un facteur de transcription qui joue un rôle pléiotrope da s l’i u it . La caractérisation moléculaire de l’all le muté a montré un effet d l t e pa u a is e d’haplo-insuffisance pour la fonction de facteur de transcription de la protéine. Une augmentation de la localisation cytoplasmique de la protéine a également été observée. De plus, le défaut IRF4 étudié confère une réponse transcriptomique distincte dans les leucocytes stimulés par le BCG ou T. whipplei. En conclusion, nous avons identifié la première étiologie génétique associée à la MW. Le mode d’h dit est AD a e u e p t ance incomplète, le portage chronique précédant probablement la MW de plusieurs décennies chez les individus hétérozygotes infectés par T.
whipplei. Ces travaux permettront de mieux comprendre la pathogénie de la MW, de mieux
d fi i les a is es de l’i unité contre T. whipplei et de pouvoir offrir un diagnostic moléculaire et génétique adapté aux familles.
2 Liste des publications
Liste des publications
- A. Guérin, G. Kerner, N. Marr, J.G. Markle, F. Fenollar, N. Wong, S. Boughorbel, D.
Avery, C.S. Ma, S. Bougarn, M. Bouaziz, V. Beziat, E. Della Mina, L. Worley, T. Nguyen, E. Patin, C. Deswartes, R. Martinez-Barricarte, S. Boucherit, X. Ayral, S. Edouard, V. Rattina, B. Bigio, G. Vogt, F. Geissmann, L. Quintana-Murci, D. Chaussabel, S.G.Tanguy, D. Raoult, L. Abel, J. Bustamante, and J.L. Casanova. IRF4 haplo-i suffi ie u de lies a fa ilial fo of Whipple’s disease. Submitted.
- V. Béziat, J. Li, J.X. Lin, C.S. Ma, P. Li, A. Bousfiha, I. Pellier, S. Zoghi, S. Baris, S. Keles, N. Du, Y. Wang, Y. Zerbib, R. Lévy, T. Leclercq, F. About, A.I. Lim, G. Rao, K. Payne, S.J. Pelham, D.T. Avery, E.K. Deenick, J. Chou, R. Guery, A Belkadi, A. Guérin, M. Migaud, V. Rattina, F. Ailal, I. Benhsaien, M. Bouaziz, H. Tanwir, D. Chaussabel, N. Marr, J. El Benna, J. Bustamante, B. Boisson, I. Müller-Fleckenstein, B. Fleckenstein, M.O. Chandesris, M. Titeux, S. Fraitag, M.A. Alyanakian, M. Leruez-Ville, C. Picard, I. Meyts, J.P. Di Santo, A. Hovnanian, A. Somer, A. Ozen, N. Rezaei, T. Chatila, L. Abel, W.J. Leonard, S.G. Tangye, A. Puel and J.L. Casanova. Human ZNF341 governs STAT3 transcription and auto-induction for adaptive but not innate immunity. Submitted.
- F. Conti, S.O. Lugo Reyes, L. Blancas Galicia, H. He, G. Aksu, E. Borges de Oliveira Junior, C. Deswarte, M. Hubeau, N. Karaca, M. de Suremain, A. Guérin, L. Ait Baba, C. Prando, G.G. Guerrero, M. Emiroglu, FN. Öz, M.A. Yamazaki Nakashimada, E. Gonzalez Serrano, S. Espinosa, I. Barlan, N. Pérez, L. Regairaz, H.E. Guidos Morales, L. Bezrodnik, D. Di Giovanni, G. Dbaibo, F. Ailal, M. Galicchio, M. Oleastro, J. Chemli, S. Danielian, L. Perez, M.C. Ortega, S. Soto Lavin, J. Hertecant, O. Anal, N. Kechout, E. Al-Idrissi, G. ElGhazali, A. Bondarenko, L. Chernyshova, P. Ciznar, R.M. Herbigneaux, A. Diabate, S. Ndaga, B. Konte, A. Czarna, M. Migaud, S. Pedraza-Sánchez, M. Bano Zaidi, G. Vogt, S. Blanche, I. Benmustapha, D. Mansouri, L. Abel, S. Boisson-Dupuis, N. Mahlaoui, A.A. Bousfiha, C. Picard, R. Barbouche, S. Al-Muhsen, F.J. Espinosa-Rosales, N. Kütükçüler, A. Condino-Neto, J.L. Casanova, J. Bustamante. Mycobacterial disease in chronic granulomatous disease: A retrospective analysis of 71 cases. J Allergy Clin Immunol 2016 Jul; 138(1):241-248.e3. doi: 10.1016
3 Abréviations
Abréviations
1000G « 1000 Genomes Project » AD Autosomique dominant ADN Acide désoxyribonucléique AR Autosomique récessive ARNm Acide ribonucléique messager
AICE « AP-1–IRF composite elements »
AP-1 « Activator protein 1 »
BCG Bacille de Calmette et Guérin
CADD « Combined Annotation Dependent Depletion » cDC Cellules dendritiques conventionnelles
CLP « Common lymphoid progenitors » CMP « Common myeloid progenitors cells » CSR « Class switch recombination » DBD « DNA-binding domain » DC Cellules dendritiques EBV Vi us d’Epstei -Barr
EICE « Ets – IRF composite elements »
GC « Germinal center » GDI « Gene damage index »
GHMI Génétique Humaine des Maladies Infectieuses gnomAD « Genome Aggregation Database »
HEK « Human embryonic kidneys » HHV « Human herpesvirus »
HLA « Human leukocyte antigen » HSC « Hematopoeitic stem cells » HSV « Herpes simplex virus »
HSE Encéphalite herpétique, « Herpes simplex encephalitis » IAD « IRF-association domain »
4 Abréviations
IFN Interférons IL « Interleukine »
IRF « Interferon regulatory factor »
ISRE « Interferon stimulated response element »
LOD « Logarithm of odds » LPS Lipopolysaccharide
MDM Macrophages dérivés des monocytes MDSC « Myeloid-derived suppressor cells » MHC Co ple e ajeu d’histo o pati ilit Mo-DC DC dérivées de monocytes
MSC « Mutation Significance Cutoff »
MSMD Susceptibilité mendélienne aux infections mycobactériennes, « Mendelian
susceptibility to mycobacterial disease »
MW Maladie de Whipple
NHLBI-ESP « NHLBI GO Exome Sequencing Project » NI « Neutrality index »
NK Lymphocytes « Natural Killer »
PAMP « Pathogen-associated molecular patterns » PAS Acide périodique de Schiff
PBMC Cellules mononucléées du sang périphérique
PCR « Polymerase chain reaction »
pDC Cellules dendritiques plasmacytoïdes PID «Primary Immunodeficiency Diseases » SCID « Severe combined immunodeficiency » SNC Système nerveux central
T. whipplei Tropheryma whipplei
Th « T helper »
Treg Lymphocytes T régulateurs eTreg Treg effecteurs
5 Manifestations cliniques et données épidémiologiques de la MW
Introduction
I. La maladie de Whipple: manifestations cliniques et données épidémiologiques
La maladie de Whipple (MW) a été décrite pour la première fois en 1907 par le pathologiste George Hoyt Whipple (1), premier américain ayant reçu le prix Nobel de physiologie. Le cas décrit était un homme de 36 ans présentant une malabsorption associée à u e ad ite se t i ue et de l’a thralgie, la maladie étant alors qualifiée de « lypodystrophie intestinale » et fut longtemps considérée comme une maladie inflammatoire du s st e digestif. So o igi e i fe tieuse ’a t d ou e te u’e , a e l’ide tifi atio de Tropheryma whipplei (T. whipplei) (2). Plus de 2000 cas ont été rapportés dans la littérature à ce jour (3-6). Le patient typique est un homme (85 % des patients sont des hommes (7) , d’o igi e eu op e e, de 50-55 ans, présentant une perte de poids récente accompagnée de diarrhées, de malabsorption de nutriments, de douleurs abdominales et souff a t g ale e t d’a th algies a a t l’appa itio des s ptô es i testi au (3). Ces symptômes, caractéristiques de la forme classique de la MW, ont longtemps été considérés comme exclusifs dans la description de la maladie (3, 8). En réalité, la MW présente une symptomatologie bien plus variée et peu spécifique entraînant souvent des retards diag osti ues. E i o % des patie ts e p se te t pas d’attei te digesti e ais des atteintes cardiaques et neurologiques. Les endocardites à hémoculture négative, ainsi que les atteintes neurologiques isolées, validées par des réactions en chaîne par polymérase (PCR:
polymerase chain reaction) spécifique à T. whipplei, sont notamment de plus en plus
fréquemment décrites (3, 9-11). Des atteintes oculaires (12-14) ou pulmonaires (15-17) ont également été rapportées. Que ce soit dans sa forme classique ou non, la MW est une maladie infectieuse chronique marquée par des épisodes de rémissions et de rechutes. Ces rechutes
6 Manifestations cliniques et données épidémiologiques de la MW
sont estimées entre 2 et 33%, malgré une prise en charge thérapeutique spécifique (18, 19). Le traitement recommandé dans la littérature epose su la p es iptio d’a ti ioti ues pou u e du e i i ale d’u a (20-23); sans traitement adapté, la maladie évolue inévitablement vers le décès (19).
D’u poi t de ue pid iologi ue, la MW a u e incidence actuellement évaluée à 1 as pa illio d’ha ita ts dans les pays occidentaux mais sa prévalence reste incertaine, de part i) la difficulté du diagnostic et, ii) le fait que la majorité des études soit réalisée dans les pays occidentaux (24). U e tude e te o t e ue les as d’i fe tio du s st e e eu central (SNC) ne révèlent pas de biais du sexe-ratio contrairement à la forme classique de la maladie précédemment évoquée (25). Néanmoins, les souches retrouvées dans le liquide céphalo-rachidien des patients ayant une atteinte neurologique se retrouvent souvent au niveau du duodénum, sugg a t u se o d o t ôle i u itai e da s l’i fe tio du SNC, indépendant du genre du patient (26). Il est important de noter que le portage asymptomatique de T. whipplei dans la salive et les selles a été rapporté (3, 21, 27, 28). Il est actuellement estimé aux alentours de 4 % dans la population générale et de 1% chez les jeunes enfants en France. De manière intéressante, ce taux peut atteindre jus u’à 12 % chez les égoutiers et les sans-abris (3, 21, 29-31), et jus u’à % pou les p o hes de patie ts attei ts de la MW en France, sans que la maladie ne soit plus fréquemment observée dans les trois at go ies d’i di idus sus o es. De plus, les études menées dans des pays sub-sahariens et asiatiques, ont montré que le portage de T. whipplei dans les selles avait une prévalence de 12% et de 17% chez les adultes gabonais et sénégalais, respectivement, vivant dans un milieu u al, e tau s’élevant à 38% chez les enfants gabonais et jus u’à % hez les e fants sénégalais et laotiens (32-34). Ce portage ’ olue ue t s rarement en MW, mais est toutefois associé à des bactériémies et/ou des infections aiguës responsables de
7 Manifestations cliniques et données épidémiologiques de la MW
gastroentérites et/ou de fortes fièvres associées à de la toux, le plus souvent chez les enfants (32-34). T. whipplei est principalement retrouvée dans l’eau des gouts et da s d’aut es sou es d’eau o ta i e, e ui corrèle avec i) l’o se atio du tau le de po tage hez les égoutiers et les populations rurales et ii) le fait ue hez l’ho e, la a t ie soit d te t e principalement dans les selles et la salive. La transmission inter-humaine de la bactérie peut être de deux types, et e, e fo tio de la ualit de l’h gi e de ie. Ai si, la transmission serait principalement féco-orale pour les populations vivant ou travaillant dans des conditions pouvant être définies comme insalubres (égoutiers, sans-abris, milieu rural), alors que la transmission serait principalement oro-orale pour les populations ayant une meilleure hygiène de vie. Bien que la majorité des cas soit sporadique, cinq cas familiaux de MW ont été appo t s jus u’à p se t da s la litt atu e: hez u f e et u e sœu , hez u p e et sa fille ainsi que chez deux frères par trois fois (dont une des familles aurait eu un oncle et une grand-mère décédée de la MW) (7, 35-38). Enfin, quatre cas de MW dans un même village italien ont été rapportés (39). La fréquence des cas rapportés dans la littérature est tout à fait remarquable si nous considérons le fait que, dans les pays occidentaux, la maladie est très rare (incidence estimée à 10-6) bien que le portage asymptomatique soit autour de 3-5% dans la population générale.
8 Microbiologie et immunopathologie de la MW
II. La maladie de Whipple: microbiologie et immunopathologie
Bien u’ide tifiée e , l’isole e t et la ultu e de T. whipplei ’o t t possi les que dans les années 2000 (40). Cette étape a été déterminante pour caractériser le pathog e, d o t e l’asso iatio de T. whipplei à la MW, et améliorer son diagnostic (21,
41-58). Cette bactérie est intracellulaire, Gram positive et appartient à la famille des
actinomycètes (40). Son génome est petit (925 kb), et o pos d’u seul h o oso e circulaire. Plusieurs caractéristiques génomiques suggèrent ue l’ asio i u itaire et l’i te a tio a e l’hôte jouent un rôle important dans la réplication et la survie de T. whipplei (58). En effet, il lui manque plusieurs voies de signalisations biochimiques importantes, telles que celles de la ios th se d’a ides a i s ou de composants métaboliques essentiels, ce qui montre la dépendance de la bactérie vis-à-vis de son hôte (57). D’u poi t de ue structural, T. whipplei possède une paroi cellulaire composée de trois couches, incluant une couche interne, dense et constituée de polysaccharides, et deux autres couches plus fines de
Figure 1: T. whipplei au sein de la lamina propria.
SM: membrane de surface; W: paroi cellulaire incluant la couche interne (L1); L2 et L3, les couches de la membrane cytoplasmique. Les barres représentent 100 nm. Adapté de: M. T. Silva et al, J Gen Microbiol 1985.
9 Microbiologie et immunopathologie de la MW
la membrane cytoplasmique (Figure 1)(59). Il est intéressant de noter que la couche externe pourrait être générée à partir de la cellule hôte (59), ce qui pourrait expliquer certaines caractéristiques immunologiques, décrites dans le modèle de physiopathologie proposé (développé dans le paragraphe suivant), et infectieuses de la MW (60). Par exemple, les bactéries survivent et prolifèrent dans un e i o e e t a ide à l’i t ieu des phagosomes macrophagiques, ce qui leur permet ai si d’échapper aux traitements antibiotiques classiques (21, 49, 61). La culture de T. whipplei a pe is d’ide tifie plus de 50 souches (21, 50, 62-66), sa s u’au u e d’e t e elles e p se te u pou oi pathog e sup ieu , écartant l’h poth se de l’ e ge e d’u e sou he lo ale de T. whipplei comme responsable de la MW. De même, ces études ont également montré que certains patients étaient infectés par de multiples souches de T. whipplei simultanément, sans pour autant développer une symptomatologie plus sévère (26). Il ’ a do pas d’a gu e t d isif sugg a t u’u e variation génétique bactérienne spécifique est responsable de la MW, ce qui, à contrario, est e fa eu d’u fa teu li à l’hôte da s le d te i is e de ette aladie.
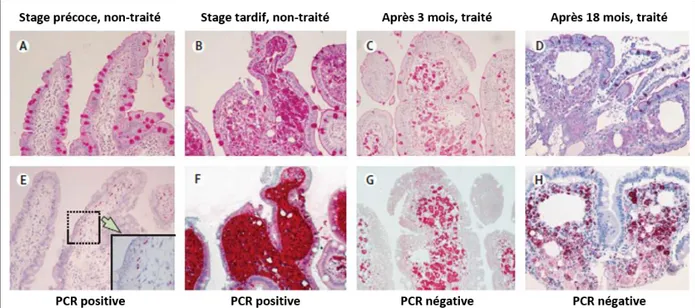
La p i ipale a a t isti ue histologi ue de la MW est l’i filt atio assi e des tissus par des macrophages infectés (Figure 2) (67). Dans la forme classique avec une localisation digesti e histologi ue, es a ophages i fe t s o stitue t jus u’à % des ellules de la muqueuse duodénale, entrainant u e di i utio d’a so ptio de ut i e ts g ale e t liée à une perte de poids (Figure 2, B, F) (67). L’i apa it des a ophages i fe t s à éliminer T. whipplei serait l’ l e t l de la ph siopathologie de la aladie (68). Après un traitement antibiotique efficace, les bactéries disparaissent, mais les macrophages persistent (Figure 2, C, D, G, H). Une étude a montré que T. whipplei se multipliait dans les macrophages dérivés des monocytes (MDM) et non dans les monocytes circulants, chez les sujets sains et atteints
10 Microbiologie et immunopathologie de la MW
(69). En effet, les bactéries se multiplient en plus grand nombre, in vitro, dans les MDM de patients atteints de la MW pa appo t à eu d’i di idus sai s mais les monocytes de patients so t apa les de o t ôle l’i fe tio (69). Des corrélations cellulaires entre la réplication de T. whipplei, l’interleukine-(IL)- et l’apoptose des MDM, ont été établies chez les patients (69, 70). En effet, il a été montré que les MDM et les monocytes incubés in vitro avec de l’IL-16 se montraient plus permissifs quant à la réplication de T. whipplei, notamment en inhibant la conversion des phagosomes en phagolysosomes (Figure 3) (69, 71). À l’i e se, des a ti o ps eut alisa t l’IL-16 inhibaient la croissance de la bactérie dans les macrophages (69), en restaurant la maturation des phagosomes (71). Un dysfonctionnement des macrophages
in vitro dans la maladie a été évoqué, impliquant une phagocytose et une dégradation
inefficace de T. whipplei, li es e l’o u e e à u d faut de p odu tio de l’IL-12 chez les
Figure 2: Diagnostic de la MW et conséquences du traitement.
(A-D a uage à l’a ide p iodi ue de Schiff (PAS). (E-H) Immunohistochimie (IHC) des sections des biopsies duodénales correspondantes. (A, E) PAS-négatif, mais IHC- et PCR-positives à un stage précoce de la MW sans symptômes intestinaux. (B, F) PAS-, IHC- et PCR-positives à un stage tardif de la MW avec symptômes intestinaux. (C, G) PCR-négative de la biopsie avec un faible PAS-positif mais IHC-positif des macrophages après 3 mois de traitement. (D, H) PCR-négative de la biopsie avec un faible PAS-positif mais IHC-positif des macrophages après 18 mois de traitement. Adapté de: T. Schneider et al, Lancet Infect Dis, 2008.
11 Microbiologie et immunopathologie de la MW
patients (21, 24). Cette di i utio de p odu tio d’IL-12 pourrait conduire à une diminution de p odu tio d’interféron (IFN)-γ pa les lymphocytes T/ natural killer (NK) et par o s ue t, à u d faut d’a ti atio des a ophages. De plus, un traitement par IFN-γ s’est l effi a e da s la p ise e ha ge d’u patie t a e u e MW sista te au a ti ioti ues (72). L’ensemble de ces données a conduit l’ uipe du P . Raoult à proposer un modèle de ph siopathologie de la MW. La p i ipale h poth se du a is e d’i fe tio de T. whipplei est u’ap s l’e t e de la a t ie da s l’o ga is e pa i gestio et so passage de la barrière intestinale, elle serait phagocytée par les macrophages résidents du tractus gastro-intestinal. Ces macrophages, e p oduisa t pas d’IL-12, vont être le point de départ de la créatio d’u environnement tolérogène. E effet, e a se e d’IL-12, la polarisation des lymphocytes T CD4+ naïfs va être en faveur des cellules CD4+ auxiliaires (T helper: Th)-2, qui ne p oduise t pas d’IFN-γ, o t ai e e t au Th . L’a se e de es toki es pro-inflammatoires va conduire à une différenciation et une polarisation inappropriées des monocytes,
Figure 3: T. whipplei au sein des phagosomes d’u MDM d sactiv pa l’IL-16.
Immunofluorescence indirecte et microscopie confocale. P62: marqueur spécifique des phagosomes. Adapté de: E. Ghigo et al, PLoS One, 2010.
12 Microbiologie et immunopathologie de la MW
nouvellement recrutés par effet chimiotactique su le lieu de l’i fe tion, en macrophages qui p oduise t de l’IL- et de l’IL-4. Ces macrophages infectés montrent une dégradation de T.
whipplei, u e p se tatio d’a tig es i effi a e et p oduise t également de l’IL-16. La
p se e d’IL- et d’IL- , o i e à l’a se e d’IFN-γ a i hi e la atu atio des ellules dendritiques (DC) et les rendre tolérogènes (insensibles à des antigènes spécifiques). Enfin, les cellules présentatrices d’a tig es p de e t it es, o t ig e da s les tissus périphériques et dans les ganglions lymphatiques où elles o t s’a u ule et e t e e
Figure 4: Macrophages positif au PAS au niveau de différents sites chez des patients.
(A) Colon. (B) Estomac. (C) Centres germinaux dans les ganglions lymphatiques. (D) Liquide cérébro-spinal. (E) Cerveau. (F) Peau. (G) Valve cardiaque. (H) Tissu adipeux de l’ pi a de et du o a de. (I) Membrane synoviale du genou. Adapté de: T. Schneider et al, Lancet Infect Dis, 2008.
13 Microbiologie et immunopathologie de la MW
apoptose, permettant ainsi la dissémination de la bactérie, créant ainsi des inflammations locales et des lésions focales (Figure 4).
En plus de ces données publiées hez l’ho e, u od le d’i fection de souris (CB-17/Icr-Prkdcscid/scid/Rj) présentant un SCID (severe combined immunodeficiency) a été étudié. Ces souris sont caractérisées par une absence des lymphocytes B et T et un défaut fonctionnel des cellules p se tat i es d’a tig es, ainsi que des cellules myéloïdes et NK. Ces souris déficientes montraient u ph ot pe o pa a le au sou is sau ages lo s de l’i fe tio pa T. whipplei (73), en termes de développement de granulome hépatique (macrophages et cellules épithéliales). Ce phénotype a également été observé pour des souris BALB/c infectées par le pathogène, ces souris étant caractérisées comme ayant une réponse immunitaire en faveur de la polarisation des Th2. De plus, les deux souris déficientes o t ôlaie t l’i fe tio sans morbidité, ni mortalité apparente. Cela écarte un rôle majeur des lymphocytes T dans le
o t ôle de l’i fe tio .
En parallèle, un effet délétère des IFN-/ du a t l’i fe tio à T. whipplei a été rapporté chez des souris déficientes pour les récepteurs des IFN de type I (74). Les macrophages de souris déficientes montraient une réduction de la réplication du pathogène, ai si u’u e diminution de l’apoptose. Les auteurs ont montré que ces conséquences étaient associées aux voies de signalisations des MAPK dépendantes de JNK mais également de Myd88/Trif via Irf3 (74). Pou l’i sta t, au u odèle in vivo (souris) ou in vitro (souris et ho e e s’est l suffisa e t o uste pou pe ett e la o p he sio de la physiopathologie de la MW. Cela est probablement dû au fait que le mécanisme de la maladie est subtil et à la difficulté de réaliser des études approfondies au niveau de cellules spécifiques hez l’ho e comme, par exemple, les macrophages résidents du tractus gastro-intestinale
14 Microbiologie et immunopathologie de la MW
pour la forme classique de la MW. Cependant, même si la physiopathologie n’est pas clairement définie, l’e se le des éléments épidémiologiques, notamment le fait i) que des familles multiplexes aient été rapportées et ii) que la majorité des individus peut être considérée comme résistante au développement de la MW, suggèrent que la composante g ti ue de l’hôte est p po d a te is-à- is de la po se à l’i fe tio pa T. whipplei. Il e iste do u fo t fais eau d’a gu e ts sugg a t ue la su e ue de la MW d pe d ait de fa teu s g ti ues de sus epti ilit de l’hôte.
III. Théo ie de la p dispositio g ti ue des aladies i fectieuses chez l’ho e
appliquée à la MW
Il est ai te a t ie ta li ue les fa teu s g ti ues de l’hôte joue t u ôle majeur dans la réponse aux agents infectieux pour expliquer la très grande variabilité observée entre des sujets exposés et infectés par un même agent infectieux (75). Cette théorie a t d o t e a e l’ide tifi atio de mutations responsables de PID (Primary
Immunodeficiency Diseases) dits classiques. Le tableau clinique des PID classiques se présente
sous forme de multiples infections, fréquemment causées par des microorganismes opportunistes, dans un contexte familial (76). Ils se caractérisent par une atteinte quantitative et/ou qualitative des cellules du système immunitaire, lymphocytes T et/ou B, ou cellules myéloïdes (par exemple, les déficits immunitaires combinés sévères ou la granulomatose septique chronique). Il existe cependant des groupes de patients qui, contrairement à ceux souffrant de PID classiques, présentent une sensibilité accrue particulière à un seul agent infectieux (76). Ainsi, notre laboratoire de « Génétique Humaine des Maladies Infectieuses » (GHMI), dirigé par le Dr Laurent Abel et le Pr Jean-Laurent Casanova, a largement contribué à l’ide tifi atio et la a a t isatio de es nouveaux PID (77, 78), telles que le syndrome de
15 Théorie de la prédispositio g ti ue des aladies i fe tieuses hez l’ho e appli u e à la MW
susceptibilité mendélienne aux infections mycobactériennes (MSMD) (79), la susceptibilité mendélienne aux infections à bactéries pyogènes (80, 81), la sus epti ilit à l’e phalite he p ti ue HSE hez l’e fa t (82), la candidose muco-cutanée chronique (83), la grippe sévère (84). Ces découvertes majeures ont pe is de fo ule l’h poth se ue la ajo it , voire la quasi-totalit , des a ifestatio s li i ues les plus s es d’i fe tio s pou aie t avoir une base génétique et relever de cette nouvelle classe de PID. La rareté de la MW et l’e iste e de fo es fa iliales taie t des a gu e ts e fa eu de l’h poth se d’u e prédisposition génétique à la MW, au moins pour certains patients. L’a se e de su e ue de la MW chez des patients présentant des PID classiques, les SCID par exemple, suggère que la réponse lymphocytaire (B/T/NK) ne joue pas un rôle de premier plan dans la MW (21). Par analogie avec le MSMD, il est aiso a le de suspe te u d faut da s l’i u it i e, ota e t a ophagi ue, u’elle soit lo ale i testi ale ou s st i ue (73). Cependant, il est i po ta t de e pas e lu e u pote tiel d faut de l’i u it adaptati e pou ant intervenir dans la susceptibilité à T. whipplei. En effet, une atténuation de la réponse des lymphocytes T/B/NK au cours du vieillissement pourrait expliquer le développement tardif de la MW chez les individus infectés. Nous avons donc e t ep is l’ tude de la MW par une approche génome entier, sans hypothèse à priori, afi d’ide tifie les fa teu s g ti ues.
16 Approche génétique par une étude génome entier appliquée à la cohorte
Identification de la première étiologie génétique de la MW
I. Approche génétique par une étude génome entier appliquée à la cohorte
La prédisposition génétique à un agent infectieux (bactérien, fongique, parasitaire ou viral) est un domaine de recherche en pleine explosion, ouvrant de nouvelles perspectives de d ou e tes aussi ie au i eau de la ph siopathologie des aladies i fe tieuses u’au niveau des aspects thérapeutiques et préventifs (77, 78, 85, 86). C’est do da s et environnement unique que je vais aborder la question de la prédisposition génétique à la MW. La première étape de cette approche est l’ ta lisse e t d’u e oho te, t s ie définie sur le plan clinique et microbiologique. A cette fin, le laboratoire GHMI a établi une collaboration avec le laboratoire du Pr Didier Raoult à Marseille, spécialiste de la MW et de T. whipplei.
Ce p ojet s’i s it da s le ad e d’u e e he he io édicale. Après obtention des accords éthiques, nous avons entrepris le recrutement de patients, avec recueil de données cliniques et biologiques. A ce jour, nous avons déjà recruté 51 patients atteints de MW issus de 43 familles indépendantes, tous d’o igine européenne, dont 31 hommes (60%) et 20 femmes (40%), le sexe-ratio étant inférieur au ratio décrit dans la littérature et évoqué précédemment. Parmi ces 51 patients, 39 d’e t e eu so t des as spo adi ues et 2 appartiennent à des familles multiplexes (cinq familles), comportant au moins deux individus souff a t d’u e MW. Deux de ces familles présentent des cas de MW sur plusieurs générations (père – fille et tante – nièce, mère – fils) et quatre de ces familles présentent des cas de MW dans la même génération (frère – sœu , ousi s, sœu s, f es , suggérant des modes de transmission dominant et récessif, respectivement. Tous ces patients ont présenté une MW sévère de forme classique (n=36) on non (atteintes neurologiques: n=9 ; cardiaques: n=3 ; oculaires: n=2 ; pulmonaires: n=1), ais au u e p se tait d’a t de ts cliniques,
17 Approche génétique par une étude génome entier appliquée à la cohorte
notamment aucune autre maladie infectieuse, ou ’a ait t diag osti u pou u d fi it immunitaire (héréditaire ou secondaire). Dans un premier temps, nous avons collecté des selles, de la salive et du liquide synovial da s le as d’u e a th ite pour chacun des patients. Pour les patients atteints de formes non classiques de la MW, des biopsies des organes infectés (valve cardiaque, poumons) ou un prélèvement du liquide céphalorachidien ont été réalisés. Ces échantillons ont été envoyés au la o atoi e du P . Raoult afi d’ ta li u diagnostic bactériologique définitif, basé sur la présence de T. whipplei, validé par PCR. Pour les patients atteints de la forme classique de la MW et e ut s a a t l’ ta lisse e t de la technique de détection du pathogène par PCR, le diagnostic définitif a été établi grâce à la détection de T. whipplei au i eau de iopsies de l’i testi g le olo e au PAS (acide périodique de Schiff). Dans un deuxième temps, nous avons recueilli des échantillons de sang des patients afin de o stitue u e olle tio iologi ue de plas a, d’ADN (acide désoxyribonucléique) génomique et de cellules mononucléées du sang périphérique (PBMC) par la technique de gradient de densité Ficoll. En considérant les données épidémiologiques de notre cohorte, ainsi que celles présentes dans la littérature, nous avons formulé l’h poth se ue la MW t oig e d’u e p dispositio g ti ue « mendélienne », au sens d’u e l sio o o-génique, c'est-à-dire la présence d’u a ia t a e dans le génome du patient, augmentant de façon significative le risque de développer une MW (avec un risque relatif au moins supérieur à 100) (78).
Le d te i is e g ti ue de la MW li à l’hôte est très peu documenté dans la littérature. Dans une étude incluant 90 patients (majoritairement d’o igi e allemande) et 152 contrôles sains (majoritairement d’o igi e italienne), les auteurs ont montré une association de la MW a e u pol o phis e p se t da s la gio p o ot i e de l’IL-16 (87), polymorphisme également associé à des maladies inflammatoires et auto-immunes (88-90).
18 Approche génétique par une étude génome entier appliquée à la cohorte
Cepe da t, l’ tude ’a pu ta li u e o latio e t e le g ot pe et le i eau d’IL-16 dans le sérum des patients testés. Quelques années auparavant, la même équipe avait montré une association de la MW avec les allèles HLA (human leukocyte antigen)-DRB1*13 et DQB1*06 (91), là encore sans montrer de corrélation avec une éventuelle conséquence in vitro ou in
vivo. Une possible association entre HLA-B27 et la MW a été décrite (92, 93), ce que des études
plus e tes ’o t pas o fi (94, 95). L’ensemble de ces résultats nous a conduit à aborder la question du déterminisme génétique de la MW par une stratégie génome entier, sans hypothèse à priori en utilisant le séquençage haut-débit. Ainsi, nous avons réalisé des analyses de s ue çage de l’e se le des e o s (WES) chez les 51 patients de la cohorte. 40 a al ses de a ia ilit du o e de opies d’u g e ont également été effectuées. La première hypothèse testée lors de ces analyses était l’homogénéité génétique au sein de la cohorte, et e, aussi ie au i eau d’u variant que d’u g e. Nous avons donc croisé les données de WES des patients afi d’ide tifie des variants présents dans un même gène chez au moins deux patients. N’a a t pas d’h poth se à priori sur le mode de transmission, nous avons pris en compte les variants hétérozygotes pour étudier la transmission autosomique dominante (AD) et homozygotes ou hétérozygotes composites pour la transmission autosomique récessive (AR). Le nombre de variants étant conséquent, nous nous sommes focalisés dans un premier temps sur ceux a a t u e fo te p o a ilit d’ t e d l t es in silico, à savoir les variants faux-sens/non-se s/site d’ pissage. Nous avons ensuite écarté les gènes dont la fonction semblait peu ou non pertinente dans le développement de la MW comme, par exemple les gènes appartenant à la famille des récepteurs olfactifs ou celle des mucines. De plus, les gènes présentant un taux élevé de variants dans la totalité des patients composants les différentes cohortes du laboratoire, mais également chez les contrôles sains ont également été exclus. Nous avons pour cela utilisé le score GDI (gene damage index),
19 Approche génétique par une étude génome entier appliquée à la cohorte
pe etta t d’ alue l’a u ulatio de variants délétères par gène dans la population générale (96). L’a al se de es sultats ’a pas o t d’e i hisse e t pa ti ulie à quelque niveau que ce soit (variant, gène), et ce, indépendamment de la fréquence allélique o sid e. Nous ’a o s do pu ide tifie de gènes mutés communs chez plus de deux patients sporadiques, ce qui suggérait u deg le d’h t og it g ti ue au sein de la cohorte. De plus, les analyses de variabilité du o e de opies d’u g e ’o t pas pe is d’ide tifie des délétions ou duplications au niveau génique ou chromosomiques chez les patients concernés (n=40). Il ’ a ait do pas d’a gu e t e fa eu d’u e d gulatio
ua titati e d’u ou de plusieu s gènes pouvant expliquer le développement de la MW.
Nous avons alors poursuivi l’ tude g ti ue en nous focalisant sur les cinq familles multiplexes présentes dans la cohorte et évoquées précédemment. Ces familles ’ ta t pas consanguines, nous avons ent ep is u e a al se e sui a t l’hypothèse que la ségrégation de la MW dans les familles présentant des cas sur plusieurs générations suivait un modèle AD avec un allèle délétère rare (avec une fréquence allélique inférieure à 0.01) et avec une pénétrance i o pl te li e à l’âge. Pour les familles présentant des cas dans une même g atio , l’h poth se test e tait u od le de t a s issio AR a e deu all les d l t es a es au sei d’u e g e. Nous nous sommes donc intéressés aux variants non-synonymes rares, hétérozygotes, codants et/ou prédits pou affe te l’ pissage, et communs aux membres affectés apparentés. Quatre familles comportaient deux individus souffrant d’u e MW et une famille comportait quatre individus ayant développé la maladie. Pour chacune des quatre premières familles, après avoir sélectionné les variants d’i t ts, nous avons obtenu un nombre important de gènes potentiellement candidats comportant des variations (n>100). Même en diminuant le filtre de fréquence allélique à 0.001, le nombre de gènes restant relativement conséquent (n>30). Au contraire, l’ tude de la cinquième famille
20 Approche génétique par une étude génome entier appliquée à la cohorte
multiplexe de notre cohorte ous a pe is d’o te i des sultats plus probants (Figure 5). D’o igi e f a çaise, cette famille comportait quatre individus atteints de la MW, sans avoir
Fig u re 5 : A rb re g én éa lo giq u e de la fa mi lle mult ip le xe étu d ié e. WT : al lèl e sauv ag e ; M : al lè le m u té e. Ch aq u e in d ivi du est r eprésent é p ar un s ym b o le di visé en deu x parti es : l a par ti e d u hau t i nd iq u e le stat u cl in iq u e d e l a M W (no ir: affect é, b lan c: sai n ), la p arti e du bas i n d iq u e la p ré sence d e T . whi p p lei id enti fié e p ar P CR o u par c o lo rati o n PA S (gr is: po si ti f, bl an c: né gati f, « ? »: no n t est é) . L e cas i n d ex e st in d iq u é p ar un e fl èche no ire
21 Approche génétique par une étude génome entier appliquée à la cohorte
d’aut es pathologies asso i es âge moyen: 77 ans), et cinq porteurs asymptomatiques de T.
whipplei (âge moyen: 55 ans). Nous avons réalisé une analyse combinant une analyse de
liaison du génome entier et le WES. Les résultats de l’a al se de liaiso o t is e ide e 12 régions chromosomiques ayant un LOD (logarithm of odds) score supérieure à 1,90, ce qui tait p o he de la aleu a i ale atte du. L’e se le de es gio s ou aie t , mégabases et comprenaient 26 g es oda ts. L’a al se des do es de WES a identifié 54 variants non-synonymes, codants, hétérozygotes et communs aux quatre patients de la famille. De plus, seul un de ces variants, localisé dans une région de liaison de 200 kilobases au niveau du chromosome 6, avait une fréquence allélique extrêmement rare. En effet, les études in-silico effectuées montraient que la mutation ’ tait retrouvée ni dans la base de do es d’ag gatio g o i ue Genome Aggregation Database: gnomAD) intégrant les bases de données publiques du projet 1000 génomes (1000 Genomes Project: 1000G) et du p ojet de s ue çage de l’e se le des e o s-NHLNI GO (NHLBI GO Exome Sequencing
Project: NHLBI-ESP , i da s ot e p op e ase de do es d’e o es (>4000). Cette mutation
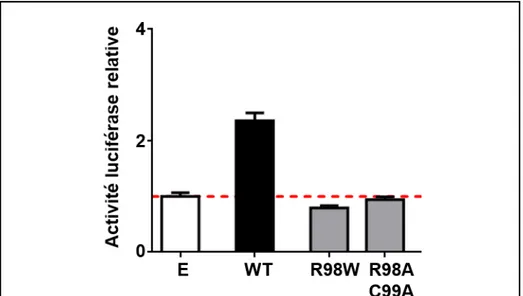
faux-sens (c.292C>T) dans le gène IRF4, résulte e u e pla e e t de l’a gi i e e positio 98 par un tryptophane (R98W). Nous avons confirmé la mutation par séquençage Sanger et montré que la ségrégation familiale suivait bien un modèle AD avec une pénétrance clinique incomplète, conformément à notre hypothèse de départ. De plus, IRF4 a un faible score GDI (2,85), ce qui suggère u’u e utatio da s e g e a de fo te p o a ilit d’ t e espo sa le de la maladie. Le score NI (neutrality index) d’IRF4 est de 0,15, e ui i di ue u’il a olu sous une sélection positive dans la population générale (97-99). IRF4 a également un paramètre de sélection purificatrice f de 0, , e ui sugg e u’il fait partie des 10% des gènes ayant la plus forte contrainte de sélection évolutive au sein du génome (100). Nous avons utilisé le score CADD (Combined Annotation Dependent Depletion), score qui permet de
22 Approche génétique par une étude génome entier appliquée à la cohorte
p di e u pote tiel i pa t d l t e d’u e mutation, combiné au score MSC (Mutation
Significance Cutoff), qui représente la plus basse valeur attendu du score CADD ayant une
relevance clinique/biologique pour un gène donné (101). La mutation R98W a un score CADD de 26,5 qui est significatif car il est bien au-dessus du s o e MSC d’IRF4 qui est de 11,1 (avec un intervalle de confiance de 95%). L’e se le de es a al ses in silico montre que la mutation identifiée dans IRF4, codant un facteur de transcription ayant un rôle clé dans l’i u it (102), a une probabilité très le e d’ t e la mutation causale. Enfin, dans la litt atu e, l’a ide a i R a t o t o e esse tiel pou la liaiso à l’ADN (103, 104) et donc pour la fonction protéique. Toutes ces données nous ont confortées dans le choix de cette mutation en tant que candidate potentiellement responsable du développement de la MW chez les quatre patients étudiés.
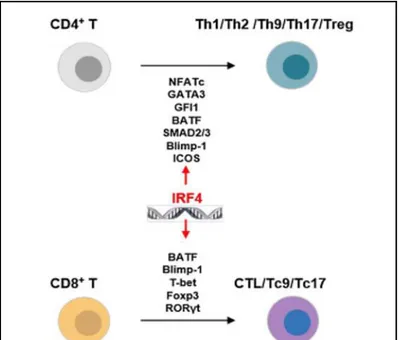
II. IRF4 et la famille des IRF
La famille des Interferons Regulatory Factor (IRF) est composée de 9 membres (IRF-1-9, Figure 6) chez les mammifères, qui ont en premier lieu été identifiés comme des régulateurs des IFN de type I i duit pa les i us, a a t d’ t e également asso i s, à l’e eptio d’IRF , à la régulation des IFN de types II et III. Les IRF jouent un rôle important dans la régulation des réponses immunitaires innée et adaptative, notamment en étant impliqués da s l’a ti atio et la différenciation de nombreuses populations de cellules immunitaires. Tous les IRF possèdent un do ai e de liaiso à l’ADN DNA binding domain: DBD d’e i o a ides aminés localisé en position N-terminale et hautement conservé, sugg a t u’ils agisse t comme des facteurs de transcriptions. À l’e eptio d’IRF , les IRF possèdent également un do ai e d’asso iatio IRF-association domain: IAD) leur permettant de former des homo- ou
23 IRF4 et la famille des IRF
hétéro-dimères a e d’aut es fa teu s de transcription (105). IRF4 est également composé d’u e s ue e de lo alisatio u l ai e ipa tite (106) et d’u do ai e d’auto-inhibition qui bloque la liaiso à l’ADN pa des i te a tio s h d opho es (104, 107). Contrairement aux aut es e es de ette fa ille, l’e p essio d’IRF est limitée aux cellules immunitaires et peut aussi ie a oi u ôle d’a ti atio que de répression de la transcription en fonction des partenaires avec lesquels il interagit. De plus, parmi les membres des IRF, seul IRF4 est induit par le lipopolysaccharide (LPS , l’IL-4 et CD40 et non par les IFN (108-110). Chez l’ho e et la souris, la protéine IRF4 a également été décrite comme interagissant avec BCL-6, NFAT et Foxp3 (111-114). IRF4 a initialement été décrit comme interagissant avec PU.1 (104, 115) avec
Figure 6: La famille des IRF.
DBD (bleu): do ai e de liaiso à l’AND; W: t ptopha e; e t : domaine de régulation; IAD1 (gris), IAD2 (jaune clair): domai e d’asso iatio au IRF; (jaune): domaine de répression; (orange): séquence de localisation nucléaire; P: site de phosphorylation. Adapté de: M. Lohoff et T. W. Mak, Nat. Rev. Immunol., 2005
24 IRF4 et la famille des IRF
le uel il se lie à l’ADN au i eau de s ue es sp ifi ues o es EICE (Ets – IRF composite
elements) principalement dans les lymphocytes B, les DC, et possiblement dans les
macrophages (116-118). Plus ta d, des tudes o t o t u’il i te agissait gale e t a e le complexe AP-1 (activator protein 1) se lia t à l’ADN au i eau de s ue es sp ifi ues nommées AICE (AP-1–IRF composite elements) principalement dans les lymphocytes T mais aussi dans les lymphocytes B et les DC (119-121). Il faut noter u’IRF peut également former des homodimères ui se lie t à l’ADN au i eau de séquences spécifiques nommées ISRE (interferon stimulated response element) mais avec beaucoup moi s d’affi it u’au i eau des autres séquences consensus précédemment citées (122). La plupart des études sur le rôle d’IRF da s l’i u it o t t réalisées su des od les u i s. Je ais ’atta he à les décrire dans les paragraphes suivants.
III. IRF4 da s l’i u it
1. Le ôle d’IRF4 da s les l phoc tes T
Les lymphocytes T peuvent être divisés en deux sous-populations majeures: les cellules CD4+ auxiliaires et les cellules CD8+ cytotoxiques. En réponses à divers stimuli (cytokines, antigènes), ces sous-populations se polarisent et acquièrent des rôles et des fonctions diff e tes da s l’i u it . Le ôle d’Irf4 dans le développement des cellules T CD4+est bien établi chez la souris. En effet, les souris déficientes pour Irf4 montrent une réponse lymphocytaire T affaiblie, en lien avec un défaut de différenciation/prolifération.
Pour commencer, le rôle d’Irf4 a été étudier dans le développement des lymphocytes Th1, cellules i duites pa l’Il- et p oduisa t de l’If -γ. Cependant, il reste encore relativement incertain à cause de plusieurs données contradictoires. En effet il a été rapporté
25 IRF da s l’i u it : lymphocytes T que les cellules T CD4+ Irf4 déficientes cultivées in vitro sous les conditions Th1, montraient soit une diminution (112, 123), soit une production normale (124) d’If -γ. De plus, dans un od le u i d’i fe tio pa Leishmania major, dans lequel la réponse Th1 favorise la gu iso et l’ li i atio du protozoaire intracellulaire alors que la réponse Th2 est espo sa le d’u e aladie h o i ue (125), les souris déficientes pour Irf4 échouent à o t ôle l’i fe tio . Cela e peut s’e pli ue seule e t pa le fait que ces souris ont une différenciation Th1 altérée a elles o t e t gale e t u d faut de d eloppe e t d’u phénotype Th2 (125). La susceptibilité à la maladie corrèle avec une augmentation très i po ta te de l’apoptose des l pho tes T CD + déficients pour Irf4, observation reflétée pa l’a se e p es ue totale de es ellules da s les ga glio s l phati ues des sou is déficientes étudiées (126). Actuelle e t, au u e tude o s ue te ’a t réalisée pour
o p e d e le ôle d’IRF da s le développement des cellules Th1 hez l’ho e.
Pou e ui est de l’ tude des cellules Th2, ui se te t de l’Il- et de l’Il-13 et qui interviennent dans la protection contre les pathogènes extracellulaires et la réponse allergique, il a été clairement établi chez la souris que leur différenciation et leur fonction dépendent d’Irf4 (124). En effet, la protéine Irf4 inhibe la production de cytokines par les ellules Th aï es alo s u’elle i duit la p odu tio de toki es pa les ellules Th oi es (127). G â e à la liaiso de e fa teu de t a s iptio au i eau du p o oteu de l’Il-4, en coopération avec Nfatc2, on observe une augmentation de la prolifération des cellules Th2 induite pa l’Il-4 ia la atio d’u e ou le de rétroaction positive (112). De plus, Irf4 régule gale e t l’e p essio de Gata3, fa teu gale e t i po ta t pou l’i du tio d’Il-4, ainsi que de Gfi1, facteur impliqué dans l’e pa sio des Th ia u a is e d pe de t de l’Il-2, ce qui suggère u’I f joue u rôle crucial pour la différenciation et la prolifération des cellules Th2 (107). Batf étant indispensable pour le développement des Th2 (128, 129) et la séquence
26 IRF da s l’i u it : lymphocytes T
AICE étant retrouvée dans ces cellules (121), il est très p o a le u’Irf4 régule aussi la
différenciation des Th2 en coopérant avec le complexe AP-1 (Batf-jun). Chez l’ho e, la prolifération des Th d pe da te de l’IL-4 est induite notamment pa l’a tio d’IRF e coopération avec NFATc1 (Nfatc2 chez la souris), ce qui suggère que les mécanismes rapportés chez la souris peuvent être extrapolés hez l’ho e (111).
De même que pour Il-4 dans les cellules Th2, la productio d’Il-9 par les cellules Th9 murines, i pli u es ota e t da s l’alle gie, est induite pa la liaiso d’Irf4 au niveau de son promoteur, et ce, ap s l’i du tio de l’e p essio d’I f pa le Tgf-β et l’Il-4 (130). La séquence AICE a été retrouvée au niveau du promoteur de l’Il-9 (121) et il a été montré que l’i du tio d’Il-9 dépendait de la coopération entre Batf et Irf4 (128). Pu.1 étant également important pour la différenciation des cellules Th9 (131), Irf4 pourrait aussi jouer un rôle dans cette différenciation en se liant avec Pu.1 à la séquence EICE. De plus, il a été montré que les souris déficientes pour smad2/3 sont résistantes à l’i fla atio e i hi a t la p odu tio d’Il-9 (132), ce mécanisme faisant intervenir la coopératio d’Irf4 avec Smad2/3. Chez l’ho e, seule l’i te a tio e t e BATF et IRF a t pou l’i sta t d o t e pour être importante pour la différenciation des cellules Th9 (128).
Quant aux cellules Th17, elles produisent de l’Il-17 et expriment Ror-γt g â e à l’a tio combinée de l’Il-6 et du Tgf-β. Ces cellules jouent un rôle dans la résistance aux maladies auto-immunes, o e les aladies i fla atoi es de l’i testi (133) et l’e phalo lite allergique expérimentale (134, 135) par exemple. Il a été montré qu’i f jouait u rôle dans l’i du tio de l’Il-6 et que la déficience en Irf4 était entrainait une absence de cellules Th17 (123, 136). De plus, l’i te a tio e t e Ap- et I f pe ett ait l’i du tio de plusieu s protéines importantes pour la différenciation des cellules Th17 telles que, Il-17, Il21, Il23r et
27 IRF da s l’i u it : lymphocytes T Rorc via la liaison de ce complexe à la séquence AICE au niveau de leurs promoteurs (119-121,
137). Enfin, la coopération entre Irf4 et Stat3 (138) est essai e à l’i du tio de Ror-γt (137),
ai si u’à sa fo tio pour la différenciation des cellules Th17, Irf4 ayant été décrit pour interagir avec ce dernier (139). Chez l’ho e, da s le as de maladies inflammatoires de l’i testin, le i eau d’e p essio d’IRF est aug e t du a t la phase a ti e d’i fla atio , e ui a t o l à u i eau le d’IL- et d’IL-17 e te es d’ARN (acide ribonucléique messager) (140).
Les l pho tes T gulateu s T eg so t i pli u s da s l’ho ostasie ellulai e et la suppression immunitaire. Les Tregs naïfs se différencient en Treg effecteurs (eTreg) et sont a a t is s pa l’e p essio d’Il-10, d’Icos et de Blimp-1. Ces cellules inhibent la fonction des DC ia l’a tio de l’Il-10, ainsi que celles des lymphocytes T ia l’a tio du Tgf-β. Ils sont induits pa l’Il-2 en combinaison avec le Tgf-β et Fo p . Da s e o te te, Irf ’est pas i pli u directement dans le développement des Treg mais joue un rôle dans la fonction des eTreg, notamment en gula t l’e p essio de Blimp-1, qui est u i du teu d’Il-10, se liant au promoteur de ce dernier en association avec Foxp3 (141). De plus, Irf4 en coopération avec stat3, est indispensable pour les fonctions suppressives des cellules Th2 et Th17 médiée par les eTreg (114, 142). Chez l’ho e, au u e tude o s ue te ’a a tuelle e t t alis e pou o p e d e le ôle d’IRF da s es ellules.
Bie ue la fo tio d’Irf4 ne soit pas clairement définie dans les lymphocytes T CD8+, de nombreux facteurs, tels que Batf, Blimp-1, T-bet et Ror-γt, essentiels pour la différenciation et la fonction des lymphocytes T CD8+, sont régulés par Irf4 (107, 143-148). Ainsi, Irf4 est un acteur clé dans la différenciation et la fonction de certaines sous-populations de lymphocytes
28 IRF da s l’i u it : lymphocytes T T, telles que les cellules Th2, Th9, Th17 et Tregs (Figure 7). Cependant, même s’il est tentant de faire des corrélations avec les résultats obtenus chez la souris, de nombreuses études doi e t e o e t e alis es pou o p e d e le ôle d’IRF dans le développement des sous-populations Th hez l’ho e.
2. Le rôle d’IRF4 da s les l phoc tes B
Les lymphocytes B, comme les lymphocytes T et NK, sont dérivés de cellules lymphoïdes progénitrices communes (common lymphoid progenitors: CLP) elles-mêmes dérivées des cellules souches hématopoïétiques (hematopoeitic stem cells: HSC). Pour arriver au stade de lymphocyte B mature, les CLP doivent passer par plusieurs stades de différenciation comprenant les stades des cellules lymphocytaires pré-pro B, pro-B, pré-B, puis immatures. Les lymphocytes B matures peuvent ensuite se différencier en cellules plasmacytoïdes, les deux types cellulaires ayant pour fonction notable de produire les anticorps, acteurs clés de la réponse immunitaire. Chacun de ces stades de différenciation est
Figure 7: Le ôle d’IRF4 da s les l phoc tes T.
29 IRF da s l’i u it : lymphocytes B très étroitement régulé par des facteurs de transcription spécifiques tels que Pu.1 et Ikaros pour le passage des HSC en CLP, par exemple. Les souris déficientes pour Irf4 montrent une absence de centres germinaux (germinal center: GC), sites de différenciation et de maturation des lymphocytes B au niveau des organes lymphoïdes secondaires (ganglions lymphatiques et rate). En conséquence, les souris montrent un défaut de différenciation/maturation des lymphocytes B entrainant une diminution de la réponse lymphocytaire B, une absence de cellules plasmacytoïdes dans la rate et la lamina prop ia, ai si u’u e di i utio de la commutation isotypique (class switch recombination: CSR).
Pour commencer, il a t o t u’Irf4, en coopération avec Irf , i duit l’e p essio d’Ika os et d’aiolos du a t les stages p o es de différenciation des cellules lymphocytaires pré-B (149). De plus, Irf4 est indispensable pour la modification des récepteurs dans le réarrangement des segments V-D-J des immunoglobulines, une étape primordiale pour la tol a e du soi pa les l pho tes B, e affe ta t le a a ge e t se o dai e des lo i et (150). De même, les lymphocytes B déficients pour Irf4 montrent un défaut dans la CSR en inhibant Aicda, u e e z e l de l’i du tio du CSR (151). Pa ailleu s, la liaiso d’Irf4 au promoteur de Bcl-6 est importante pour la formation des GC. Au demeurant, il a été montré que Bcl-6 empêche la différenciation des lymphocytes B en cellules plasmacytoïdes en i hi a t l’e p essio de Bli p-1 (152). Chez l’ho e, une étude a montré que l’a ti atio du récepteu CD i duisait l’aug e tatio de l’e p essio d’IRF di pa la oie NF- B da s u e lig e B i o talis e, et u’e se fi a t au p o oteu de BCL6, IRF4 diminuait l’e p essio de la p ot i e. Cela sugg e u’IRF joue aussi u rôle hez l’ho e dans la formation des GC (113). Collectivement, toutes ces données o t e t ue l’e p essio d’IRF , en tout cas chez la souris, est indispensable pour le développe e t et l’a ti it des
30 IRF da s l’i u it : lymphocytes B lymphocytes B (Figure 8), bien que des études plus approfondis soient nécessaire pour d te i e so ôle e a t hez l’ho e.
3. Le ôle d’IRF4 da s les cellules loïdes
Parmi les cellules myéloïdes murines, Irf4 est exprimé notamment dans les macrophages et les DC mais pas dans les monocytes circulants à l’ tat asal. Le développement des DC est dépendant de nombreux Irf, dont Irf4 et Irf8, en particulier. En effet, les souris déficientes pour Irf4 montrent une diminution du nombre de DC dans la rate. Les DC murines de la rate peuvent être divisées en 4 groupes, les cellules CD4+ (CD11b+), CD8+ (CD11b-), CD4- CD8- (CD11b+) et plasmacytoïdes (pDC). L’e p essio d’Irf4 dans tous ces groupes, à l’e eptio des DC CD8+, induit leur différenciation, ia l’a tio e a o t du Gm-csf (153), gula t ai si le i eau d’e p essio de p ot i es l s da s e p o essus CD , CD86 et Mmp12). De plus, les souris Irf4fl/fl CD11c-Cre montrent une diminution de la réponse à la p se tatio d’a tig es di e pa le o ple e ajeu d’histo o pati ilité (MHC) de classe II (154). Irf4 est indispensable à la migration (155) et à la survie des DC CD11b+ dans les
Figure 8: Le rôle d’IRF4 da s les l phoc tes B.
Igs: immunoglobulines; GCs: centres germinaux; CPL: cellules lymphoïdes progénitrices communes. Adapté de: S. Nam et J.S. Lim, Arch. Pharm. Res., 2016