Développement d’une signature moléculaire dans la
maladie osseuse de Paget
Thèse
Sabrina Guay-Bélanger
Doctorat en médecine moléculaire
Philosophiæ doctor (Ph.D.)
Québec, Canada
Résumé
La maladie osseuse de Paget (MOP) a changé de visage au cours des dernières années, augmentant le nombre d’individus atteints qui demeurent asymptomatiques. Étant donné le risque élevé de développer un ostéosarcome associé avec la MOP, cette maladie est une contre-indication à la prescription d’agents ostéoformateurs. Avec l’apparition prochaine de nouveaux agents ostéoformateurs pour le traitement de l’ostéoporose, il devient crucial de pouvoir dépister de façon fiable la présence de la MOP. Les objectifs de ce projet étaient (1) de mettre au point un test plus sensible permettant de détecter et d’évaluer la fréquence des mutations post-zygotiques SQSTM1/P392L chez les patients pagétiques, (2) de développer un test génétique de dépistage de la MOP incluant les mutations germinales et post-zygotiques dans SQSTM1, (3) et d’évaluer les performances diagnostiques de ce test intégré avec des marqueurs biochimiques dans une signature moléculaire spécifique à la maladie. Une technique de PCR sensible utilisant un acide nucléique bloqué (LNA) spécifique à la mutation SQSTM1/P392L a été développée, puis la présence de cette mutation a été recherchée dans les cohortes disponibles au laboratoire et dans différents tissus. Ensuite, le développement de la signature moléculaire a utilisé les données génotypiques et biochimiques disponibles dans les cohortes du laboratoire, puis des régressions logistiques ont été effectuées afin de déterminer la combinaison de marqueurs ayant la meilleure capacité à identifier correctement les patients avec la MOP. Des mutations post-zygotiques SQSTM1/P392L étaient présentes chez 4,8% des patients pagétiques, et 1,4% des individus sains dans les populations étudiées, cette mutation post-zygotique étant restreinte à la lignée monocytaire. Deux tests moléculaires sous forme d’algorithme en deux étapes ont ensuite été proposés. D’une part, un algorithme génétique pur pourrait être utilisé : des mutations germinales dans le gène SQSTM1 devraient d’abord être recherchées, et si elles sont absentes, le score génétique basé sur la combinaison de cinq marqueurs génétiques développée dans ce projet devrait être calculé. Cet algorithme génétique avait une sensibilité égale à 83,61% et une spécificité égale à 51,03% dans les cohortes étudiées. D’autre part, un algorithme génétique et biochimique pourrait être proposé: des mutations germinales dans le gène SQSTM1 devraient d’abord être recherchées, et si elles sont absentes, le score combiné basé sur la combinaison des marqueurs génétiques et biochimiques développée dans ce projet devrait être calculé. Dans les populations étudiées, cet algorithme avait une sensibilité égale à 93,88% et une spécificité égale à 54,00%. La découverte des mutations post-zygotiques confirme l’existence d’un spectre mutationnel de SQSTM1 dans la MOP et pourrait expliquer en partie son caractère focal. Ces résultats ont par la suite permis de développer deux tests moléculaires capables de dépister la MOP de façon plus fiable que les biomarqueurs actuellement disponibles en pratique clinique.
Abstract
Paget’s disease of bone (PDB) has changed in recent years, increasing the number of affected individuals who remain asymptomatic. Given the high risk of developing an osteosarcoma associated with PDB, this disease is a contraindication to the prescription of bone anabolic agents. With the incoming introduction of new bone anabolic agents indicated for osteoporosis treatment, it will be crucial to screen accurately for the presence of PDB. The objectives of this project were (1) to develop a more sensitive test to detect and assess the frequency of SQSTM1/P392L post-zygotic mutations in pagetic patients, (2) to develop a genetic test of PDB, including germinal and post-zygotic SQSTM1 mutations, (3) and to assess the diagnostic performance of this test integrated with bone biomarkers in a molecular signature of PDB. A sensitive PCR method using a locked nucleic acid (LNA) specific to the SQSTM1/P392L mutation was developed, and the presence of this mutation was investigated in the cohorts available in the laboratory, and in different tissues. Then, the development of the molecular signature used genotypic and biochemical data available in the laboratory, and logistic regressions were performed to determine the combination of markers with the best ability to correctly identify PDB patients. SQSTM1/P392L post-zygotic mutations were present in 4.8% of pagetic patients, and in 1.4% of healthy individuals in the population studied, this mutation being restricted to the monocytic lineage. Two molecular tests relying on a two steps algorithm were then developed. Firstly, a pure genetic algorithm could be proposed: a screen in the SQSTM1 gene should first be performed to search for disease-causing germinal mutations, and if negative, the genetic score based on a combination of the five SNPs developed in this study should be calculated. In the populations studied, this genetic algorithm had a sensitivity of 83.61% and a specificity of 51.03%. On the other hand, a genetic and biochemical algorithm could be used: a screen in the SQSTM1 gene should first be performed to search for disease-causing germinal mutations, and if negative, the combined score based on a combination integrating both genetic and biochemical markers developed in this study should be calculated. This genetic algorithm had a sensitivity of 83.61% and a specificity of 51.03% in the populations studied. The presence of post-zygotic mutations confirms the existence of a mutational spectrum of SQSTM1 in PDB, and may explain its focal character. These results conducted to the development of two molecular tests which predicted the PDB phenotype better than bone biomarkers already available in clinical practice.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations... xv
Remerciements ... xxi
Avant-propos ... xxiii
Introduction ... 1
1. Épidémiologie de la maladie osseuse de Paget ... 1
1.1 Incidence actuelle de la maladie osseuse de Paget ... 2
1.2 Prévalence actuelle de la maladie osseuse de Paget ... 2
1.3 Rôle des facteurs environnementaux dans la maladie osseuse de Paget ... 11
2. Aspects cliniques de la maladie osseuse de Paget ... 13
2.1 Physiopathologie de la maladie osseuse de Paget ... 13
2.1.1 Tissu osseux normal ... 13
2.1.2 Tissu osseux pagétique ... 16
2.2 Présentation clinique de la maladie osseuse de Paget ... 18
2.2.1 Symptômes ... 18
2.2.2 Diagnostic ... 19
2.2.3 Traitement et suivi ... 21
2.2.4 Complications ... 23
2.3 Désordres osseux apparentés à la maladie osseuse de Paget ... 28
2.3.1 Ostéolyse expansive familiale ... 28
2.3.2 Hyperphosphatasémie expansive du squelette ... 29
2.3.3 Maladie osseuse de Paget à début précoce ... 30
2.3.4 Maladie de Paget juvénile ... 31
2.3.5 Syndrome IBMPFD ... 32
2.3.6 Dysplasie fibreuse des os ... 33
3. Génétique de la maladie osseuse de Paget ... 34
3.2 Hétérogénéité génétique ... 36
3.3 Polymorphismes associés à la maladie osseuse de Paget ... 37
3.3.1 Variants communs ... 37
3.3.2 Variants rares ... 38
4. Importance du gène SQSTM1 et des particules virales dans la physiopathologie de la maladie osseuse de Paget ... 42
4.1 Mutations dans le gène Sequestosome 1 ... 42
4.2 Rôle de la protéine SQSTM1/p62 ... 49
4.3 Conséquences fonctionnelles des mutations dans SQSTM1 ... 52
4.4 Mutations dans le gène SQSTM1 associées à d’autres maladies ... 54
4.5 Rôle possible des particules virales ... 55
4.6 Corrélations phénotype-génotype ... 57
4.7 Interactions entre gènes et interactions gène-environnement ... 58
5. Médecine personnalisée dans les maladies osseuses ... 59
5.1 Biomarqueurs génétiques ... 61
5.1.1 Structure de l’ADN ... 61
5.1.2 Variations génétiques ... 62
5.1.3 Techniques de détection des polymorphismes et/ou des mutations ... 64
5.2 L’ARN comme biomarqueur... 70
5.3 Marqueurs protéiques ou biochimiques ... 71
5.3.1 Techniques de dosage des marqueurs biochimiques ... 75
5.4 Critères d’évaluation des biomarqueurs ... 77
5.4.1 Validité analytique ... 78
5.4.2 Validité clinique ... 78
5.4.3 Utilité clinique ... 82
5.4.4 Enjeux éthiques, légaux et sociaux ... 83
6. Problématique, hypothèses et objectifs... 84
Chapitre 1 ... 87
Detection of SQSTM1/P392L post-zygotic mutations in Paget’s disease of bone ... 87
Résumé ... 88
Abstract ... 89
Introduction ... 90
Materials and methods ... 91
Individuals ... 91
Optimization of the PCR‑clamping method for the SQSTM1/P392L mutation in PDB patients ... 93
Distribution of the SQSTM1/P392L post‑zygotic mutation in blood and saliva tissues of PDB patients .. 94
Distribution of the SQSTM1/P392L post‑zygotic mutation in bone tissue of a PDB patient... 94
Estimation of the copy number of the SQSTM1/P392L post‑zygotic mutation ... 94
Statistical analyses ... 95
Results ... 95
Development of the PCR‑clamping method for the GNAS/R201L mutation in FD patients ... 95
Optimization of the PCR‑clamping method for the SQSTM1/P392L mutation in PDB patients ... 98
Prevalence of the SQSTM1/P392L post‑zygotic mutation in PDB patients ... 101
Phenotype–genotype associations ... 104
Somatic mosaicism of the SQSTM1/P392L post‑zygotic mutation in PDB patients ... 106
Estimation of the copy number of the SQSTM1/P392L post‑zygotic mutation ... 109
Discussion ... 110
Acknowledgments ... 112
References ... 113
Chapitre 2 ... 117
Development of a Molecular Test of Paget’s Disease of Bone ... 117
Résumé ... 118
Abstract ... 119
Introduction ... 120
Material and methods ... 121
Individuals... 121
SNP selection and genotyping ... 122
Bone biomarkers ... 123
Statistical analyses ... 123
Results ... 125
Combination of genetic markers ... 126
Frequency of individuals with a genetic score ≥ 0.33 in an independent cohort ... 140
Genotype-phenotype associations ... 140
Combination of bone biomarkers ... 141
Combination of genetic and biochemical markers ... 145
Development of a molecular test, integrating SQSTM1 mutations screening followed by both genetic and bone biomarkers combinations ... 145
Acknowledgements ... 150 Disclosure ... 151 References ... 151 Discussion ... 155 Conclusion ... 163 Bibliographie... 165
Liste des tableaux
Tableau 1. Prévalence de la MOP dans les principaux pays du monde. ... 5 Tableau 2. Principaux facteurs environnementaux associés à la MOP lors d’études épidémiologiques. ... 12 Tableau 3. Principaux polymorphismes et variants génétiques rares associés à la MOP d’après les GWAS et
les études de gènes candidats. ... 39
Tableau 4. Haplotypes H1 et H2 identifiés dans la population canadienne-française chez les porteurs de la
mutation SQSTM1/P392L. ... 44
Tableau 5. Fréquence des haplotypes H1 et H2 dans diverses populations. ... 45 Tableau 6. Fréquence en pourcentage de patients atteints de la MOP porteurs de mutations dans le gène
SQSTM1 dans les principales cohortes caucasiennes publiées, dans les formes familiales (F) et chez les individus atteints non apparentés (NA). ... 46
Tableau 7. Principaux marqueurs biochimiques de la formation et de la résorption osseuse utilisés en
recherche et en pratique clinique. ... 75
Tableau 8. Tableau de contingence représentant un échantillon de N sujets classés en fonction de leur état de
santé et selon le résultat du test étudié. ... 82
Tableau 9. Description of the main clinical characteristics of patients (n=10) with fibrous dysplasia (FD). ... 98 Tableau 10. Description of the main clinical characteristics of pagetic patients (n=18) carriers of a
SQSTM1/P392L post-zygotic mutation. ... 102
Tableau 11. Comparisons of main clinical parameters between PDB patients with SQSTM1/P392L
post-zygotic mutations and patients with germinal mutations, or patients without any SQSTM1 mutation. ... 105
Tableau 12. Single nucleotide polymorphisms (SNPs) genotypes available for this study. ... 125 Tableau 13. Bivariate analyses of genetic markers in 243 patients with Paget’s disease of bone (PDB) and in
292 healthy controls, all non-carriers of any SQSTM1 gene mutation. ... 128
Tableau 14. Intrinsic and extrinsic characteristics for the main molecular tests developed in this study. ... 135 Tableau 15. Genotype combinations resulting in a genetic score ≥ 0.33 in men and women separately, all
non-carriers of any SQSTM1 gene mutation. ... 137
Tableau 16. Comparisons of main clinical characteristics between patients with Paget’s disease of bone (PDB)
with a genetic score ≥ 0.33 versus patients with PDB with a genetic score < 0.33; all were not carrier of any SQSTM1 gene mutation. ... 141
Tableau 17. Bivariate analyses of biochemical markers in 27 patients with Paget’s disease of bone (PDB) and
Liste des figures
Figure 1. Prévalence de la MOP dans le monde. ... 10
Figure 2. Résultats de la méta-analyse des changements séculaires de prévalence de la MOP. ... 10
Figure 3. Cellules osseuses en action lors du remodelage osseux. ... 15
Figure 4. Système RANK/RANKL/OPG dans l’ostéoclastogénèse. ... 15
Figure 5. Lésions ostéolytiques caractéristiques de la MOP. ... 17
Figure 6. Aspect histologique du tissu osseux pagétique. ... 17
Figure 7. Aspect histologique des ostéoclastes pagétiques. ... 18
Figure 8. Apparence radiographique d’un crâne atteint par la MOP. ... 21
Figure 9. Scintigraphie osseuse du corps entier chez un patient pagétique. ... 21
Figure 10. Déformations osseuses causées par la MOP. ... 27
Figure 11. Agents pharmacologiques disponibles ou en développement pour le traitement de l’ostéoporose. 28 Figure 12. Mode de transmission de la MOP. ... 35
Figure 13. Chromatogrammes de la découverte de la première mutation germinale associée avec la MOP. . 43
Figure 14. Conservation du résidu proline au cours de l’évolution. ... 43
Figure 15. Récapitulatif des mutations du gène SQSTM1 identifiées chez les individus avec la MOP. ... 48
Figure 16. Domaines d’interaction de la protéine SQSTM1. ... 50
Figure 17. Rôle de la protéine SQSTM1/p62 dans la voie de signalisation du RANK/NF- κB. ... 51
Figure 18. Processus de macroautophagie. ... 52
Figure 19. Schéma pathogénique de la MOP... 59
Figure 20. Structure de l’ADN. ... 62
Figure 21. Principales classes de variants génétiques chez l’humain. ... 64
Figure 22. Principe du séquençage par la méthode Sanger. ... 67
Figure 23. Principe de la méthode TaqMan. ... 68
Figure 24. Principe de la plateforme Sequenom MassARRAY iPLEX... 69
Figure 25. Structure du collagène de type 1. ... 75
Figure 26. Principe de la méthode ELISA. ... 77
Figure 27. Modèle de l’ACCE pour l’évaluation des tests biologiques... 78
Figure 28. Représentation graphique d’une courbe ROC. ... 82
Figure 29. LNA PCR-clamping method for the GNAS/R201L mutation in patients with fibrous dysplasia (FD). ... 96
Figure 30. Sequencing analysis with and without the use of the LNA PCR-clamping method in patients with fibrous dysplasia (FD). ... 97
Figure 31. Optimization of the LNA PCR-clamping method for the SQSTM1/P392L mutation in patients with
Paget's disease of bone (PDB)... 99
Figure 32. Sequencing analysis with and without the utilisation of the LNA PCR-clamping method in patients
with Paget’s disease of bone (PDB). ... 100
Figure 33. Sequencing analysis with and without the use of LNA PCR-clamping method in DNA from
monocytes, lymphocytes and saliva in patients with Paget’s disease of bone (PDB). ... 107
Figure 34. X-ray of the pelvis of a patient carrier of the SQSTM1/P392L post-zygotic mutation. ... 108 Figure 35. Histology of the transiliac bone biopsy of a patient carrier of the SQSTM1/P392L post-zygotic
mutation. ... 109
Figure 36. Area under the receiver operating characteristic (ROC) curve (AUC) calculations for the most
significant biomarker combinations developed in this study. ... 134
Figure 37. Molecular tests proposed for the detection of PDB developed in this study. ... 147 Figure 38. Présence d’un spectre mutationnel dans la MOP. ... 161
Liste des abréviations
ACCE: validité analytique, validité clinique, utilité clinique et enjeux éthiques, légaux et sociaux / analytic validity, clinical validity, clinical utility, ethical, legal and social implications
ALFY: autophagy-linked FYVE protein ALP: alkaline phosphatase
AMPc: adénosine monophosphate cyclique ADN: acide désoxyribonucléique
ARN: acide ribonucléique
ARNm: acide ribonucléique messager ATP: adénosine triphosphate
AUC: aire sous la courbe ROC / area under the ROC curve CASR: récepteur sensible au calcium / calcium sensing receptor CNV: variation du nombre de copies / copy number variation CSF1: colony-stimulating factor 1
CTHRC1: collagen triple helix repeat containing 1
CTX: télopeptide caboxy-terminal du collagène de type 1 / carboxy-terminal collagen crosslinks DC-STAMP: dendritic cell-specific transmembrane protein
ddNTP: didésoxyribonucléotide DFO: dysplasie fibreuse des os DKK1: dickkopf-1
dNTP: désoxynucléotide DPD: désoxypyridinoline
ELISA: enzyme-linked immunosorbent assay
EPS8L3 : epidermal growth factor receptor kinase substrate 8-like protein 3 ESR1: récepteur de l’estrogène 1 / estrogen receptor 1
FD: fibrous dysplasia FN: faux négatif FP: faux positif
GGT: gamma glutamyl-transférase
GNAS: guanine nucleotide-binding protein alpha-stimulating activity GSTM4: glutathione S-transferase mu 4
GWAS: étude pangénomique d’association / genome-wide association study HER2: human epidermal growth factor 2
HES: hyperphosphatasémie expansive du squelette
HRM: méthode de fusion à haute résolution / high resolution melt
hsCRP: protéine C-réactive à haute sensibilité / high-sensitivity C-reactive protein
IBMPFD: syndrome comportant une MOP à début précoce et/ou une démence fronto-temporale et/ou une myopathie à inclusions / inclusion body myopathy with early-onset Paget’s disease of bone and frontotemporal dementia
IκB: inhibiteur de κB
IκκB: inhibiteur de la kinase κB β IL-6: interleukine-6
KEAP1: kelch-like ECH-associated protein 1 LNA: acide nucléique bloqué / locked nucleic acid MOP: maladie osseuse de Paget
MVNP: protéine de la nucléocapside du virus de la rougeole / measles virus nucleocapsid protein NF-KB: nuclear factor-kappa B
NTX: télopeptide amino-terminal du collagène de type 1 / amino-terminal collagen crosslinks NUP205: nucléoporine 205
OEF: ostéolyse expansive familiale OPG: ostéoprotégérine
OPTN: optineurine
P1CP: propeptide carboxy-terminal du procollagène de type 1 / procollagen type 1 carboxy-terminal propeptide
P1NP: propeptide amino-terminal du procollagène de type 1 / procollagen type 1 amino-terminal propeptide PAL: phosphatase alcaline
PCR: réaction en chaîne par polymérase / polymerase chain reaction PDB: Paget’s disease of bone
PIGN: phosphatidylinositol glycan anchor biosynthesis class N PKC: protéine kinase C
PML: promyelocytic leukemia protein
PNA: acide nucléique peptidique / peptide nucleic acid PTH: parathormone
PYD: pyridinoline
RANK: receptor activator of nuclear factor kappa-B RANKL: receptor activator of nuclear factor kappa-B ligand
RFLP: polymorphisme de longueur des fragments de restriction / restriction fragment length polymorphism RIN3: ras and rab interactor 3
RPL17P14: ribosomal protein L17 pseudogene 14
RT-PCR: réaction en chaîne par polymérase à transcriptase inverse / reverse transcription polymerase chain reaction
SAP: shrimp alkaline phosphatase SLA: sclérose latérale amyotrophique
SNP: polymorphisme de nucléotide simple / single nucleotide polymorphism SQSTM1: sequestosome 1
TM7SF4: transmembrane 7 superfamily member 4
TNFα: facteur de nécrose tumorale alpha / tumor necrosis factor alpha TPA: tripropylamine
TRACP: phosphatase acide résistante au tartrate TRAF6: TNF receptor-associated factor 6 TRAP: tartrate-resistant acid phosphatase
UBA: domaine de liaison à l’ubiquitine / ubiquitin-associated domain
UCMA/GRP: upper zone of growth plate and cartilage matrix associated/Gla-rich protein VCP: valosin-containing protein
VN: vrai négatif VP: vrai positif
VPN: valeur prédictive négative VPP: valeur prédictive positive
À ma famille, pour votre soutien constant au
cours de toutes ces années
Remerciements
En premier lieu, j’aimerais remercier ma directrice de thèse, Dre Laëtitia Michou, pour m’avoir donné l’opportunité de faire un doctorat dans son laboratoire. Ces quatre années passées à travailler sous ta supervision m’ont grandement fait progresser, tant au niveau personnel que professionnel. Les mots me manquent pour décrire toute l’admiration que je te porte. Ta grande écoute, ta disponibilité et ta façon de prioriser à tout prix tes étudiants furent grandement appréciés, et font de toi une superviseure exceptionnelle. J’aimerais également te remercier pour toutes les opportunités que tu m’as offertes, que ce soit lors de la participation à des congrès internationaux ou pour la rédaction de manuscrits, qui ont grandement fait progresser mes connaissances. Je me considère très privilégiée d’avoir travaillé à tes côtés, et je n’aurais pas pu espérer meilleure formation pour faire mon entrée sur le marché du travail.
Je remercie Dr Brown et Dr Morissette, fondateurs du laboratoire, pour les précieux conseils qu’ils m’ont fourni tout au long de la réalisation de mon projet de doctorat. De plus, j’aimerais remercier tous les coauteurs des articles scientifiques auxquels j’ai contribué pendant mes études doctorales. Sans vous, la réalisation de ces travaux n’aurait pu être possible.
Également, je remercie les jurys qui ont accepté de lire cette thèse ainsi que pour leurs précieux commentaires. J’aimerais également remercier le Réseau en santé buccodentaire et osseuse pour le soutien financier au cours de mes études.
J’aimerais remercier Alexandra, Claudia, Davy, Edith, Iris, Julie, Mariejka et Nathalie, sans qui ces dernières années n’auraient sans doute pas été aussi agréables. Je m’estime des plus chanceuse de vous avoir côtoyées et d’avoir développé de si belles amitiés. Merci pour tous ces moments passés, pour ces discussions personnelles et parfois professionnelles! Votre présence va grandement me manquer. J’aimerais adresser un merci spécial à Edith et Julie. Edith, merci mille fois pour toute l’aide que tu m’as apportée au laboratoire, et pour tous les problèmes que tu as si bien su résoudre. Tu es sans doute l’élément clé du laboratoire, sur qui on peut toujours compter. Julie, merci pour toutes ces fois où tu m’as simplifié la vie avec des détails d’ordre administratif. Ta présence au sein de l’équipe est indispensable.
À ma famille et mes amis proches, j’aimerais vous remercier pour votre présence, et pour m’avoir aidée chacun à votre façon dans la réalisation de mes projets. Votre présence dans ma vie est d’une valeur inestimable.
Charles, merci pour ton amour, ta patience, ton support et tes encouragements pendant toutes ces années. Également, je te remercie pour ta grande compréhension, et pour toutes ces fois où tu as su me réconforter et m’apaiser dans les périodes de stress intense, comme toi seul sait si bien le faire.
Finalement, j’aimerais remercier mes parents. Papa, maman, merci pour votre soutien incomparable, et pour tous vos encouragements depuis ma plus tendre enfance. Je m’estime très chanceuse d’avoir d’aussi bons parents à mes côtés, sachant que je peux toujours compter sur votre présence pour m’éclairer et m’encourager à persévérer. Merci pour votre grande écoute, même si la plupart du temps mes études semblaient un peu abstraites à vos yeux. Cependant, sachez que vos efforts de compréhension envers ma passion pour la science ont grandement été appréciés. Je vous remercie également pour l’éducation et les belles valeurs que vous m’avez inculquées. Sans vous, je ne serais certainement pas rendue où je suis aujourd’hui. En fait, mes chers parents, j’aimerais vous dire merci pour tout, tout simplement.
Avant-propos
Au cours de mon doctorat, j’ai eu la chance de côtoyer des chercheurs et des étudiants hors pairs qui ont donné lieu à la publication de cinq articles scientifiques auxquels j’ai eu la chance de collaborer, et un qui a été récemment soumis dans la revue scientifique Bone. Ainsi, cette thèse est présentée avec insertions de deux articles pour lesquels je suis première auteure.
Le premier article, composant le Chapitre 1 de ma thèse et intitulé « Detection of SQSTM1/P392L post-zygotic mutation in Paget’s disease of bone », a été publié en janvier 2015 dans la revue scientifique Human Genetics. En tant que première auteure, j’ai planifié et réalisé toutes les étapes de ce projet, en plus d’assurer la rédaction du manuscrit. Sylvain Picard était chargé d’effectuer toutes les étapes expérimentales pour préparer la biopsie osseuse, ainsi que pour effectuer la microdissection au laser en vue d’extraire l’ADN des ostéoclastes. Edith Gagnon, en tant que principale assistante de recherche, a contribué à la planification expérimentale du projet. Jean Morissette, en tant que pionnier du laboratoire, a permis de mettre en place la banque d’ADN utilisée pour effectuer ce projet. Ethel S. Siris et Philippe Orcel sont des collaborateurs de longue date du laboratoire, qui nous ont fourni des échantillons d’ADN de patients atteints de MOP provenant de différentes populations (France et États-Unis, respectivement). Jacques P. Brown, en tant que chercheur rhumatologue, a contribué à la caractérisation clinique de chacun des patients inclus dans cette étude. Finalement, Laëtitia Michou, en tant que superviseure de la thèse, a contribué à la planification expérimentale et à la révision du manuscrit.
Le second article, composant le Chapitre 2 de ma thèse et intitulé « Development of a Molecular Test of Paget’s Disease of Bone », a récemment été soumis dans la revue scientifique Bone. En tant que première auteure, j’ai planifié et réalisé toutes les étapes de ce projet, en plus d’assurer la rédaction du manuscrit. David Simonyan et Alexandre Bureau, en tant que biostatisticiens, ont été d’une précieuse aide pour réaliser les analyses statistiques de ce projet. Edith Gagnon a contribué à la planification expérimentale du projet, ainsi qu’au génotypage des différents marqueurs génétiques. Caroline Albert, en tant que collaboratrice, a effectué les dosages sériques de la plupart des marqueurs biochimiques inclus dans l’étude. Jean Morissette, en tant que pionnier du laboratoire, a permis de mettre en place la banque d’ADN utilisée pour effectuer ce projet. Ethel S. Siris et Philippe Orcel sont des collaborateurs de longue date du laboratoire, qui nous ont fourni des échantillons d’ADN de patients atteints de MOP provenant de différentes populations (France et États-Unis, respectivement). Jacques P. Brown, en tant que chercheur rhumatologue, a contribué à la caractérisation clinique de chacun des patients inclus dans cette étude. Finalement, Laëtitia Michou, en tant que superviseure de la thèse, a contribué à la planification expérimentale et à la révision du manuscrit.
Lors de mon doctorat, j’ai contribué aux publications scientifiques suivantes :
Guay-Bélanger, S. et Michou, L. (2013) «Génétique et physiopathologie de la maladie de Paget.» Réalités en rhumatologie vol 53 Avril/Mai : 1-5.
Beauregard, M., Gagnon, E., Guay-Bélanger, S., Siris E. S., Morissette, J., Brown J. P., Michou, L. (2013) «Genetic association study of Dikkopf-1 and sclerostin genes with paget’s disease of bone.» Calcif Tissue Int
93(5): 405-12.
Beauregard, M., Gagnon, E., Guay-Bélanger, S., Morissette, J., Brown J. P., Michou, L. (2014) «Identification of rare genetic variants in novel loci associated with Paget’s disease of bone.» Hum Genet 133(6): 755-68.
Guay-Bélanger, S., Picard, S., Gagnon, E., Morissette, J., Siris E. S., Orcel, P., Brown J. P., Michou, L. (2015) «Detection of SQSTM1/P392L post-zygotic mutations in Paget’s disease of bone.» Hum Genet 134(1): 53-65.
Guay-Bélanger, S., Cormier, J. G., Michou L. (2015) «La maladie osseuse de Paget, une condition évanescente?» Revue du Rhumatisme 82(4) : 223-29.
Introduction
1.
Épidémiologie de la maladie osseuse de Paget
La maladie osseuse de Paget (MOP) est une affection à révélation tardive qui est rarement diagnostiquée avant la cinquantaine, et qui possède une légère prépondérance masculine. Elle est caractérisée par un remodelage osseux anormal d’un ou plusieurs os, dû à une augmentation de la résorption osseuse, suivie d’une formation osseuse excessive et désorganisée. Elle demeure actuellement la seconde maladie osseuse métabolique la plus fréquente après l’ostéoporose, affectant jusqu’à 3% de la population caucasienne après l’âge de 55 ans (Michou and Brown 2011). Cette prévalence augmente avec l’âge, pour atteindre jusqu’à 10% après 80 ans (Siris, Ottman et al. 1991). La MOP a été décrite pour la première fois par Sir James Paget en 1877, lorsqu’il détailla l’histoire médicale complète d’un patient qu’il suivit pendant plus de 20 ans, chez qui il observa une forme chronique d’inflammation, résultant en des déformations osseuses progressives (Paget 1877). À l’époque, il proposa le nom d’« osteitis deformans » pour ce phénotype, qui fut par la suite appelé Paget’s disease of Bone. Cependant, des analyses de squelettes excavés de sites archéologiques suggèrent que la MOP est apparue il y a environ 2 000 ans en Europe de l’Ouest, la majorité des cas ayant été découverts en Angleterre, et s’est répandue par la suite lors de la migration des européens vers d’autres pays (Mays 2010). Par ailleurs, l’Angleterre a connu par le passé une très forte prévalence de MOP. En effet, des études épidémiologiques effectuées à la fin des années 1970 dans 31 villes britanniques ont montré une prévalence de MOP globale ajustée pour l’âge et le sexe de 5% (Barker, Clough et al. 1977, Barker, Chamberlain et al. 1980). De plus, des prévalences au-delà de 6% ont été observées dans six villes anglaises situées dans la région du Lancashire (Barker, Chamberlain et al. 1980). L’Australie et la Nouvelle-Zélande, deux pays colonisés principalement par des britanniques, sont également connues pour avoir eu vers la fin des années 1970 des prévalences élevées de MOP. En effet, la prévalence ajustée pour l’âge et le sexe en Australie était égale à 3,2%, alors que celle en Nouvelle-Zélande était de 4,4% (Gardner, Guyer et al. 1978, Reasbeck, Goulding et al. 1983). À titre de comparaison, des études épidémiologiques effectuées dans différents pays de l’Europe de l’Ouest ont montré que la prévalence de la MOP variait à cette époque entre 0,4% et 2,7% (Detheridge, Guyer et al. 1982). Ainsi, la MOP a été par le passé une maladie très fréquente dans certaines régions du globe. Au cours des dernières décennies, plusieurs études ont rapporté une diminution de cette prévalence conduisant au portrait épidémiologique actuel de la MOP.
1.1 Incidence actuelle de la maladie osseuse de Paget
L’incidence actuelle de la MOP est difficile à évaluer de façon fiable puisque la majorité des patients sont asymptomatiques et que ce diagnostic est souvent une découverte fortuite. Néanmoins, certains pays ont évalué cette incidence, ce qui nous donne un aperçu du portrait épidémiologique de la MOP. En Angleterre, on note clairement une diminution de l’incidence de la MOP entre les années 1990 et 1997, celle-ci passant de 1 à 0,6 cas par 10 000 personnes-année (van Staa, Selby et al. 2002). En Espagne, une augmentation progressive de l’incidence de la MOP a été rapportée entre les années 1986 et 2003 dans la commune de Vitigudino, passant de 1,34 à 2,19 cas par 10 000 personnes-année. Cette augmentation a été suivie par une diminution majeure entre les années 2003 et 2009, l’incidence actuelle étant évaluée à 0,887 cas par 10 000 personnes-année. Cependant, on ne note aucun changement dans la ville de Salamanque, distante de seulement 70 km, l’incidence étant évaluée aux alentours de 0,3 cas par 10 000 personnes-année. Cette tendance particulière à la commune de Vitigudino, peuplée de moins de 3 000 habitants, pourrait être expliquée en partie par une augmentation de l’émigration des personnes de moins de 45 ans vers d’autres régions d’Espagne (Corral-Gudino, Garcia-Aparicio et al. 2013). Une augmentation significative de l’incidence de la MOP dans la ville brésilienne de Recife a été décrite entre les années 2006 et 2009, celle-ci étant maintenant évaluée à 50 cas par 10 000 personnes-année. Cette région du Brésil a connu par le passé une immigration massive d’européens, ce qui pourrait expliquer une incidence aussi élevée de la MOP dans un pays d’Amérique du Sud (Reis, Poncell et al. 2012). Malheureusement, l’incidence n’a jamais été étudiée au Canada, ni au Québec. Par ailleurs, il n’existe actuellement aucune donnée d’incidence de la MOP en Amérique du Nord.
1.2 Prévalence actuelle de la maladie osseuse de Paget
Plusieurs études de prévalence de la MOP ont été effectuées, démontrant des variations de prévalence considérables selon les régions géographiques (Tableau 1 et Figure 1). En effet, en plus de l’Angleterre, on retrouve une forte prévalence de la MOP en Australie, Nouvelle-Zélande, Amérique du Nord, Afrique du Sud et au Brésil, qui sont tous des endroits peuplés majoritairement par des européens (Bolland and Cundy 2013). De plus, on note des différences marquées de prévalence dans un même pays, avec au moins quatre foyers de haute prévalence décrits dans la littérature; le comté de Lancashire en Angleterre, les régions espagnoles Vitigudino et Cabrera, ainsi que la région de Campanie en Italie (Figure 1) (Barker, Chamberlain et al. 1980, Morales Piga, Lopez-Abente et al. 1990, Miron-Canelo, Del Pino-Montes et al. 1997, Rendina, Gennari et al. 2006). En revanche, la MOP est rare en Scandinavie, en Inde et en Asie du Sud-Est (Ralston 2008). Néanmoins, la publication récente de quelques séries de cas de MOP semble suggérer que ce diagnostic soit en émergence chez les asiatiques, possiblement en raison d'un meilleur accès aux procédures diagnostiques
ou d'une meilleure connaissance de cette maladie par les cliniciens (Lee, Han et al. 2004, H'Ng M and Ho 2005, Wang, Cheng et al. 2005, Hashimoto, Ohno et al. 2006, Maderazo and Li-Yu 2009, Wu, Tseng et al. 2009, Takigami, Ohara et al. 2010, Sankaran, Naot et al. 2012, Li, Long et al. 2013, Nagano, Yokouchi et al. 2013, Wat, Cheung et al. 2013). De même, on observe l’apparition de cas rapportés de MOP dans d’autres populations non caucasiennes, telles que les arabes et les latinos (Rojas-Villarraga, Patarroyo et al. 2006, Alshaikh, Almanea et al. 2011).
On rapporte dans la littérature une diminution de la prévalence de la MOP au cours des dernières décennies. En effet, un déclin de prévalence de la MOP d’environ 40% a été rapporté dans 10 villes d’Angleterre entre les années 1974 et 1994 (Cooper, Schafheutle et al. 1999). Les plus grandes différences ont été observées dans les villes de Lancaster, Preston et Wigan, toutes situées dans le comté de Lancashire, une région bien connue pour avoir eu une prévalence anormalement élevée de la MOP par le passé (Barker, Chamberlain et al. 1980). Ce déclin de prévalence pourrait entre autre être expliqué par l’afflux d’immigrants en provenance de régions ayant une faible prévalence de MOP, telle que l’Asie, ou par la diminution de l’exposition à certains facteurs environnementaux actuellement mal connus (Cooper, Schafheutle et al. 1999, Ralston 2008). Un déclin de prévalence a également été rapporté dans 8 villes d’Europe : Innsbruck, Malmö, Copenhague, Athènes, La Corogne, Valence, Székesfehérvár et Győr (Poor, Donath et al. 2006). Toutefois, ce déclin de prévalence n’a pas été observé dans les pays du sud de l’Europe, notamment l’Italie et l’Espagne, où celle-ci est demeurée stable (Gennari, Di Stefano et al. 2005, Guanabens, Garrido et al. 2008). La Nouvelle-Zélande, quant-à-elle, rapporte un déclin d’environ 50% sur une période de 20 ans (Cundy 2006). Exceptionnellement, la région de Recife au Brésil a connu une augmentation de la prévalence de la MOP dans les dernières années (Reis, Poncell et al. 2012). Au Canada, une seule étude de prévalence de la MOP a été effectuée, celle-ci étant estimée à 0,1% chez les hommes, et 0,2% chez les femmes (Hanley, Brown et al. 2003). Toutefois, il est important de mentionner que ces données ont été auto-rapportées par les participants, ce qui peut engendrer un biais de sous-estimation de la prévalence de la MOP en raison de la fréquence élevée des formes asymptomatiques de la maladie. En ce qui concerne le Québec, une région dans laquelle des formes familiales et des cas isolés de MOP ont été rapportés, il n’existe actuellement aucune donnée de prévalence.
Récemment, une méta-analyse des changements séculaires de prévalence de la MOP a démontré une diminution significative de cette prévalence dans la dernière décennie (0,64 [0,45; 0,91]) (Figure 2) (Corral-Gudino, Borao-Cengotita-Bengoa et al. 2013). Toutefois, il est important de noter que parmi les neuf régions géographiques étudiées dans cette méta-analyse, seules trois ont connu une diminution de prévalence significative, dont l’Angleterre et la Nouvelle-Zélande. Par ailleurs, près de la moitié des individus inclus dans l’étude étaient originaires de l’Angleterre, ce qui influence probablement de façon importante le résultat global de la méta-analyse. Néanmoins, cette étude reflète bien la tendance observée dans plusieurs pays, mais il
faut demeurer prudent quant à la généralisation de ces conclusions, puisque celles-ci ne s’appliquent qu’aux régions précédemment connues pour avoir une forte prévalence de MOP. Ainsi, il serait sans doute plus juste de parler d’harmonisation de la prévalence de la MOP, avec la disparition progressive des foyers de haute prévalence (Guay-Bélanger, Cormier et al. 2015).
Tableau 1. Prévalence de la MOP dans les principaux pays du monde.
Pays (Ville) Méthode de détection Nombre
d’individus Année Prévalence Référence
Afrique du Sud (Johannesburg) Radiographies abdominales* 1 355 (noirs)
1 003 (blancs) 1988 1,3% (noirs) 2,4% (blancs) (Guyer and Chamberlain 1988) Angleterre
(Bath, Cardiff, Carlisle, Lancaster, Preston, Southampton, Newcastle, Portsmouth
Warrington et Wigan)
Radiographies abdominales 9 828 1993-1995 2,0%
(Cooper, Schafheutle et al.
1999)
Australie Radiographies abdominales 1 203 1978 3,32% (Gardner, Guyer et
al. 1978)
Autriche (Innsbruck) Radiographies abdominales 950 2000-2001 0,2% (Poor, Donath et
al. 2006) Brésil (Recife) Radiographies abdominales, phosphatases alcalines et scintigraphie osseuse 7 752 2006-2009 6,8% (Reis, Poncell et al. 2012) Canada
(étude Camos) Questionnaire aux participants
2 884 (hommes) 6 539 (femmes) 1995-2003 0,1% (hommes) 0,2% (femmes) (Hanley, Brown et al. 2003)
Pays (Ville) Méthode de détection Nombre
d’individus Année Prévalence Référence
Danemark (Copenhague) Radiographies abdominales 950 2000-2001 0,3% (Poor, Donath et
al. 2006)
Espagne (Andalousie) Radiographies abdominales 714 2006-2007 0,14%
(Guanabens, Garrido et al.
2008)
Espagne (Iles Canaries) Radiographies abdominales 433 2006-2007 1,62%
(Guanabens, Garrido et al.
2008) Espagne
(Castille-La Manche/ Castille-Léon) Radiographies abdominales 422 2006-2007 2,37%
(Guanabens, Garrido et al.
2008)
Espagne (Catalogne) Radiographies abdominales 855 2006-2007 0,47%
(Guanabens, Garrido et al.
2008)
Espagne (Communauté valencienne) Radiographies abdominales 721 2006-2007 0,83%
(Guanabens, Garrido et al.
2008)
Espagne (Galice) Radiographies abdominales 700 2006-2007 1,0%
(Guanabens, Garrido et al.
Pays (Ville) Méthode de détection Nombre
d’individus Année Prévalence Référence
Espagne (Madrid) Radiographies abdominales 683 2006-2007 1,32%
(Guanabens, Garrido et al.
2008)
Espagne (La Corogne) Radiographies abdominales 715 2000-2001 0,4% (Poor, Donath et
al. 2006)
Espagne (Valence) Radiographies abdominales 872 2000-2001 0,5% (Poor, Donath et
al. 2006)
États-Unis (Atlanta) Radiographies abdominales 1 111 (noirs)
1 563 (blancs) 1980 1,2% (noirs) 0,9% (blancs) (Guyer and Chamberlain 1980)
États-Unis (New-York) Radiographies abdominales 950 (noirs)
1 082 (blancs) 1980 2,6% (noirs) 3,9% (blancs) (Guyer and Chamberlain 1980)
Grèce (Athènes) Radiographies abdominales 912 2000-2001 0,3% (Poor, Donath et
al. 2006)
Hongrie (Gyor) Radiographies abdominales 834 2000-2001 0,5% (Poor, Donath et
al. 2006)
Hongrie (Székesfehérvar) Radiographies abdominales 812 2000-2001 0,5% (Poor, Donath et
al. 2006)
Irlande (Dublin) Radiographies abdominales 938 1982 1,7% (Detheridge,
Pays (Ville) Méthode de détection Nombre
d’individus Année Prévalence Référence
Irlande (Galway) Radiographies abdominales 714 1982 0,7% (Detheridge,
Barker et al. 1983)
Italie (Sienne) Radiographies abdominales 1 778 1999-2000 0,98-1,48%
(Gennari, Di Stefano et al.
2005)
Italie (Sienne) Phosphatases alcalines 7 449 2000-2003 1,75%
(Gennari, Di Stefano et al.
2005)
Italie (Sienne) Scintigraphie osseuse 7 906 2000-2004 2,45%
(Gennari, Di Stefano et al.
2005)
Italie (Turin) Radiographies abdominales 6 609
1986-1987, 1992-1993 et 1999-2002 0,69-1,03% (Gennari, Di Stefano et al. 2005) Japon (global) Revue de littérature et questionnaires envoyés dans les
hôpitaux
126 008 000 2002-2003 2,8/1 000 000 (Hashimoto, Ohno et al. 2006)
Nouvelle-Zélande (Auckland) Radiographies abdominales 3 350 2005-2006 2,6% (Bastin, Bird et al.
2009) Pays-Bas (Rotterdam) Phosphatases alcalines et
confirmation radiographique 548 1990-1993 3,6%
(Eekhoff, van der Klift et al. 2004)
Pays (Ville) Méthode de détection Nombre
d’individus Année Prévalence Référence
Suède (Malmö) Radiographies abdominales 890 2000-2001 0,3% (Poor, Donath et
al. 2006) * Les radiographies abdominales incluent le bassin, le sacrum, les têtes fémorales et les vertèbres lombaires.
Figure 1. Prévalence de la MOP dans le monde.
Il existe des différences considérables dans la prévalence de la MOP entre les différents pays, et parfois au sein d'un même pays, avec l’identification de quatre foyers de haute prévalence de MOP matérialisés par une étoile sur la figure. Figure tirée de (Corral-Gudino, Borao-Cengotita-Bengoa et al. 2013).
Figure 2. Résultats de la méta-analyse des changements séculaires de prévalence de la MOP.
Cette méta-analyse inclut les données de prévalence de neuf régions géographiques, et démontre une diminution significative de la prévalence de la MOP au cours de la dernière décennie. Figure tirée de (Corral-Gudino, Borao-Cengotita-Bengoa et al. 2013).
1.3 Rôle des facteurs environnementaux dans la maladie osseuse de Paget
La diminution de l’incidence et de la prévalence de la MOP au cours des dernières décennies suggèrent que des facteurs non génétiques pourraient être impliqués dans la physiopathologie de la maladie. En effet, ces observations épidémiologiques pourraient être compatibles avec des changements dans notre mode de vie ou des modifications d’expositions environnementales. Les principaux facteurs environnementaux issus des études épidémiologiques qui ont été associés avec la MOP sont illustrés dans le Tableau 2. Le contact avec des animaux domestiques, tels que le chien et le bétail, est souvent mentionné dans la littérature, mais cela demeure un sujet controversé (Siris, Kelsey et al. 1990, Lopez-Abente, Morales-Piga et al. 1997). Cependant, il est intéressant de constater qu’aucune MOP n’a été diagnostiquée sur les squelettes datant de la période antérieure à la domestication du chien, connu pour avoir initialement transmis à l’homme certaines zoonoses (Roberts and Manchester 2005). De plus, les expositions à la fumée provenant de la cigarette ou de la combustion du bois de chauffage ont été associées avec la MOP (Michou, Collet et al. 2012, Audet, Beaudoin et al. 2013). L’exposition à certains facteurs environnementaux peut également expliquer en partie les différences épidémiologiques majeures observées entre les régions géographiques. Ainsi, la prévalence élevée observée dans la région du Lancashire pourrait être liée à la présence d’usines de traitement du coton qui utilisaient de l’arsenic, pour ensuite le rejeter dans l’eau des rivières approvisionnant les résidents de la région (Lever 2002). De plus, la prévalence élevée de MOP en Campanie a été associée avec un mode de vie rural, plus particulièrement avec la consommation de lait non pasteurisé et de viande n’ayant pas subi de contrôle sanitaire (Rendina, Gennari et al. 2006).
Tableau 2. Principaux facteurs environnementaux associés à la MOP lors d’études épidémiologiques.
Facteur environnemental Population Nombre
d’individus Année
Odds ratio
[IC 95%] Référence
Consommation de tabac Française 83 2011 3,37
[1,04-11,09]
(Michou, Collet et al. 2012)
Chauffage au bois pendant l’enfance Canadienne-française 361 2013 2,48
[1,37-4,49]
(Audet, Beaudoin et al. 2013)
Contact avec des animaux de la ferme Italienne 470 2005 2,22
[1,49-3,30]
(Merlotti, Gennari et al. 2005)
Contact avec des lapins Italienne 470 2005 1,78
[1,15-2,74]
(Merlotti, Gennari et al. 2005)
Contact avec des cochons Italienne 470 2005 2,44
[1,43-4,15]
(Merlotti, Gennari et al. 2005)
Contact avec le bétail Italienne 470 2005 1,68
[1,03-2,73]
(Merlotti, Gennari et al. 2005)
Contact avec des vaches Espagnole 299 1996 2,14
[1,16-2,94]
(Lopez-Abente, Morales-Piga et al. 1997)
Consommation de cervelle de bovin Espagnole 299 1996 1,77
[1,05-2,98]
(Lopez-Abente, Morales-Piga et al. 1997) Contact avec des chiens entre l’âge de 40 et 49 ans Américaine (USA) 866 1990 1,58
2. Aspects cliniques de la maladie osseuse de Paget
2.1 Physiopathologie de la maladie osseuse de Paget
2.1.1 Tissu osseux normal
Les os qui forment le squelette possèdent plusieurs fonctions vitales pour l’être humain; ils fournissent un soutien et un site d’attachement pour les muscles afin de permettre le mouvement du corps, protègent les organes vitaux, fournissent un environnement adéquat pour l’hématopoïèse, servent de réservoir pour divers facteurs de croissance et cytokines, en plus de participer au maintien de l’homéostasie minérale (Clarke 2008). Morphologiquement, il existe deux types d’os, qui diffèrent tant au niveau structurel que métabolique. L’os compact constitue environ 80% de la masse totale osseuse chez l’humain. Il compose la partie externe de l’os, possède un faible taux de remodelage osseux, et est très dense et compact, ce qui lui confère une très grande résistance aux flexions et torsions. Il assume notamment des fonctions de force mécanique et de protection (Hadjidakis and Androulakis 2006). Il est formé de plusieurs lamelles constituées de fibres de collagène parallèles qui sont arrangées de façon concentrique autour d’un canal vasculaire. Ces unités structurales sont nommées ostéons, ou système de Harvers, et permettent aux os d’être un excellent support mécanique (Shea and Miller 2005). L’os trabéculaire participe à la résistance mécanique, mais se charge surtout des fonctions métaboliques. Par ailleurs, il constitue le site majeur du remodelage osseux, et est le site d’initiation de la plupart des maladies osseuses métaboliques (Feng and McDonald 2011). Il est composé d’un réseau de travées osseuses interconnectées avec des espaces occupés par la moelle osseuse, et possède une structure dite lamellaire (Shea and Miller 2005).
Le tissu osseux est un organe dynamique qui est constamment en renouvellement. Le remodelage osseux, un processus par lequel les sites osseux les plus anciens sont résorbés et remplacés par de nouveaux, est d’une importance capitale puisqu’il permet aux os de conserver leur intégrité mécanique, de réparer les fractures et les micro-fractures, en plus de maintenir l’homéostasie minérale dans l’organisme (Compston 2001). Le remodelage osseux s’effectue à l’aide de cellules osseuses spécifiques; les ostéoclastes, les ostéoblastes et les ostéocytes (Figure 3). Les ostéoclastes sont des cellules multinucléées d’origine hématopoïétique, et proviennent donc de la même lignée cellulaire que les monocytes/macrophages. Leur formation résulte de la fusion cellulaire de plusieurs précurseurs mononucléés (Vaananen and Laitala-Leinonen 2008). La principale fonction des ostéoclastes est d’effectuer la résorption osseuse. En effet, ceux-ci adhèrent à la matrice osseuse et forment un compartiment étanche dans lequel plusieurs ions et enzymes sont sécrétés afin de dégrader la matrice osseuse sous-jacente (Henriksen, Bollerslev et al. 2011). La différenciation et l’activité des ostéoclastes sont principalement régulées par la voie de signalisation du Nucleor Factor kappa B (NF-κB). C’est la liaison entre le Receptor Activator of NF-κB Ligand (RANKL), sécrété par les ostéoblastes et les
ostéocytes, et son récepteur, le Receptor Activator of NF-κB (RANK), situé à la surface des précurseurs ostéoclastiques, qui permettra l’activation de cette voie de signalisation. L’ostéoprotégérine (OPG), un récepteur leurre sécrété par les ostéoblastes, est également d’une importance capitale. En effet, celle-ci inhibe l’interaction entre RANKL et RANK, régulant ainsi négativement l’ostéoclastogénèse (Figure 4) (Athanasou 2011). Les ostéoblastes proviennent des cellules souches mésenchymateuses qui ont également la capacité de se différencier en adipocytes, chondrocytes, myoblastes ou en fibroblastes (Neve, Corrado et al. 2011). De plus, la différenciation des ostéoblastes se fait principalement via la voie de signalisation Wnt (Eriksen 2010). La fonction principale de ces cellules est la formation osseuse, via la synthèse de protéines de la matrice osseuse incluant le collagène de type I, et est également responsable de la minéralisation de cette matrice (Katagiri and Takahashi 2002). Les ostéocytes sont des cellules dérivées des ostéoblastes qui sont trappées dans la matrice osseuse minéralisée. Ce sont les cellules osseuses les plus abondantes, représentant environ 90% des cellules osseuses totales (Bellido 2014). Elles ont une morphologie en forme d’étoile et possèdent des prolongements dendritiques qui forment une architecture cellulaire particulière, leur permettant ainsi de communiquer entre elles et avec les cellules localisées à la surface de l’os (Sapir-Koren and Livshits 2014). Les ostéocytes sont actuellement les cellules osseuses les moins bien caractérisées. Néanmoins, plusieurs fonctions leur sont attribuées, telles que la régulation du remodelage osseux et le maintien de l’homéostasie minérale, en plus d’être considérés comme des cellules mécano-sensorielles ayant l’habilité de détecter les contraintes mécaniques apposées sur l’os (Bonewald 2011).
Lors du remodelage osseux, les précurseurs ostéoclastiques sont recrutés à la surface osseuse, puis une fois activés, fusionnent pour former des ostéoclastes matures. Ces derniers effectuent ensuite la résorption de l’os sous-jacent. Puis, les précurseurs des ostéoblastes sont recrutés et activés afin de se différencier en ostéoblastes matures. Ces derniers enclenchent alors le processus de formation et synthétisent une nouvelle matrice osseuse dans les lacunes de résorption. Cette matrice d'os ostéoïde sera ensuite minéralisée (Datta, Ng et al. 2008). Le couplage entre les processus de résorption et de formation osseuse est finement régulé afin de conserver l’intégrité de la masse osseuse. Néanmoins, un découplage entre la résorption et la formation osseuse peut survenir, causant ainsi un remodelage osseux anormal et le développement possible d’une pathologie osseuse (Feng and McDonald 2011).
Figure 3. Cellules osseuses en action lors du remodelage osseux.
Le remodelage osseux requiert la présence des ostéoclastes, ostéoblastes et ostéocytes. Les ostéoclastes résorbent l’os, et font place aux ostéoblastes qui forment et minéralisent la nouvelle matrice osseuse. Figure tirée de (Kapinas and Delany 2011).
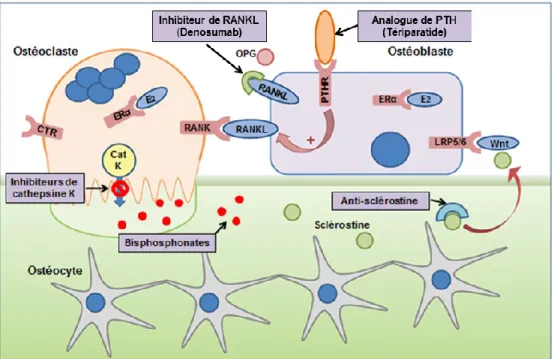
Figure 4. Système RANK/RANKL/OPG dans l’ostéoclastogénèse.
Le RANKL, sécrété par les ostéoblastes et les ostéocytes (non représentés ici), se lie à son récepteur RANK à la surface des précurseurs ostéoclastiques pour activer l’ostéoclastogénèse. L’OPG est un récepteur leurre du RANKL qui, en liant ce dernier, inhibe l’ostéoclastogénèse. Figure adaptée de (Ralston, Langston et al. 2008).
2.1.2 Tissu osseux pagétique
La MOP se caractérise par un excès de remodelage osseux affectant un ou plusieurs os. La phase initiale de la pathologie est caractérisée par une augmentation de la résorption osseuse, causée par des ostéoclastes plus nombreux et de plus grande taille, créant ainsi des lésions ostéolytiques. Par ailleurs, on peut facilement observer l’évolution de ces lésions sur les radiographies des os atteints (Figure 5) (Cundy and Bolland 2008). La seconde phase de la maladie est caractérisée par une augmentation subséquente de la formation osseuse causée par une activité compensatoire des ostéoblastes (en raison du couplage existant entre les ostéoclastes et les ostéoblastes), présents en grand nombre dans les lésions pagétiques. La matrice osseuse rapidement synthétisée est désorganisée et se présente sous la forme d’un os tissé qui est plus susceptible aux déformations et aux fractures qu’un os lamellaire. La moelle osseuse est par la suite infiltrée par des tissus fibreux et vasculaires, causant une hypertrophie de l’os atteint (Figure 6). Les lésions deviennent alors sclérotiques, sans apparence de remodelage osseux actif (Siris and Roodman 2013).
Histologiquement, les ostéoclastes sont les premières cellules affectées dans la MOP. Ceux-ci ont un phénotype cellulaire pagétique typique qui permet de les distinguer des ostéoclastes normaux. En effet, les ostéoclastes pagétiques sont plus nombreux, de grande taille, peuvent contenir jusqu’à 100 noyaux par cellule, et ont des inclusions nucléaires et cytoplasmiques provenant possiblement de virus de la famille des Paramyxovirus (Figure 7) (Roodman and Windle 2005). De plus, ils sécrètent des niveaux élevés d’interleukine-6 (IL-6), détectables dans la moelle osseuse et le sang périphérique des patients avec la MOP (Roodman, Kurihara et al. 1992). Ils sont également plus résistants à l’apoptose, ces derniers possédant une régulation à la baisse de certains gènes impliqués dans ce processus (Chamoux, Couture et al. 2009, Michou, Chamoux et al. 2010). De plus, leurs précurseurs sont hypersensibles à certains facteurs ostéoclastogéniques tels que le RANKL et la 1,25(OH)2 vitamine D3, formant des ostéoclastes à des concentrations beaucoup
moins élevées que celles normalement requises (Kukita, Chenu et al. 1990, Menaa, Reddy et al. 2000). L’hypersensibilité à la 1,25(OH)2 vitamine D3 est due à une augmentation de l’expression de TAFII-17,
maintenant nommé TAF12, une protéine liant les récepteurs de la vitamine D, dans les ostéoclastes pagétiques (Kurihara, Reddy et al. 2004). Les ostéoblastes pagétiques comportent également certaines anomalies. En effet, ceux-ci sur-expriment des gènes codant pour des cytokines ostéoclastogéniques, telles que l’IL-6, IL-1β, Dickkopf-1 (DKK1) et RANKL, ce qui pourrait contribuer au remodelage osseux excessif observé dans la MOP (Menaa, Reddy et al. 2000, Naot, Bava et al. 2007).
Figure 5. Lésions ostéolytiques caractéristiques de la MOP.
La progression des lésions ostéolytiques dans la MOP débutante est parfois observable sur des radiographies standards. On remarque en effet le « V de progression » caractéristique de la maladie. Figure adaptée de (Cundy and Bolland 2008).
Figure 6. Aspect histologique du tissu osseux pagétique.
Dans les lésions osseuses pagétiques, on note la présence d’ostéoclastes multinucléés et de plus grande taille qui résorbent la matrice osseuse, représentée ici en rose foncé. Les ostéoblastes sont également présents en grand nombre pour effectuer la formation osseuse, qui est désorganisée. La moelle osseuse est également infiltrée par du tissu fibreux, représenté ici par les filaments roses pâles. Figure tirée de (Bullough 2010).
Figure 7. Aspect histologique des ostéoclastes pagétiques.
Les ostéoclastes pagétiques sont de plus grande taille que les ostéoclastes normaux, et peuvent contenir jusqu’à 100 noyaux. De plus, des inclusions nucléaires et cytoplasmiques qui proviennent possiblement de virus de la famille des Paramyxovirus ont été observées dans ces cellules. Figure tirée de (Roodman and Windle 2005).
2.2 Présentation clinique de la maladie osseuse de Paget
2.2.1 Symptômes
Dans la majorité des cas, la MOP est asymptomatique. En effet, seuls 30 à 40% des patients sont symptomatiques au moment du diagnostic. Cependant, la proportion totale de formes symptomatiques est probablement plus faible étant donné que de nombreux cas de MOP ne seront jamais diagnostiqués (Ralston 2013). Par ailleurs, une étude anglaise récente suggère que seulement 16% des patients atteints de MOP consultent un professionnel de la santé (Tan and Ralston 2014). Le symptôme le plus fréquent est la présence de douleurs osseuses qui, selon une revue systématique, serait présente chez environ 50% des patients pagétiques (Tan and Ralston 2014). Ces douleurs osseuses sont généralement très localisées et permanentes, même quand le patient est au repos, et peuvent être exacerbées la nuit ou lors de l’apposition d’une charge sur l’os atteint. Des douleurs osseuses peuvent également être causées par des complications associées à la MOP, telles que les fractures ou l’arthrose secondaire à la présence d'une lésion pagétique à proximité d'une articulation (Griz, Fontan et al. 2014). De plus, cette maladie peut causer une augmentation de la chaleur cutanée à la surface des os atteints, due à une hypervascularisation des lésions pagétiques, ainsi que des hypertrophies, voire des déformations osseuses (Michou, Collet et al. 2006). Plusieurs autres symptômes sont souvent associés à la MOP, mais ceux-ci résultent davantage des complications qui y sont associées (voir section 2.2.4).
La MOP peut se présenter sous forme monostotique (un seul os atteint), ou polyostotique (plusieurs os atteints), et possède la plupart du temps une distribution asymétrique. De plus, une fois diagnostiquée, la maladie progresse dans les os initialement affectés, sans toutefois s’étendre à d’autres sites adjacents. Les os les plus fréquemment atteints sont le bassin, les fémurs, la colonne vertébrale, le crâne et les tibias. Les humérus, les clavicules, les côtes, les omoplates et les os faciaux sont moins souvent atteints, alors que les os des pieds et des mains sont plus rarement affectés (Siris and Roodman 2013). La maladie se présente sous la forme polyostotique dans environ 60 à 70% des cas (Haddaway, Davie et al. 2007, Wermers, Tiegs et al. 2008, Varenna, Zucchi et al. 2010). Cependant, on rapporte en Nouvelle-Zélande une augmentation de la proportion de patients avec une atteinte monostotique, qui est passée de 24% en 1985-1993 à 36% en 1994-2002, suggérant une évolution vers une forme moins extensive de la maladie (Cundy, Gamble et al. 2004).
2.2.2 Diagnostic
La plupart du temps, le diagnostic de MOP est posé suite à une découverte fortuite. Cela peut être dû à une augmentation des phosphatases alcalines (PAL) totales observées lors d’un bilan de laboratoire de routine, ou à l’observation de changements de la structure osseuse sur un examen d'imagerie médicale réalisé pour d’autres raisons médicales (Ralston, Langston et al. 2008). Lorsqu’une MOP est suspectée, l’évaluation diagnostique devrait inclure l’histoire médicale détaillée du patient, ainsi que son histoire familiale étant donné la forte composante génétique de la MOP. De plus, un examen physique approfondi doit être effectué afin de rechercher la présence possible de symptômes associés à la maladie, ainsi qu’à ses éventuelles complications (Siris and Roodman 2013).
Les tests de laboratoire incluent le dosage de la créatinine, du calcium, de l’albumine, de la 25-hydroxyvitamine D et des PAL totales. La fonction hépatique est également évaluée (gamma glutamyl- transpeptidase (GGT)) afin d’exclure la possibilité que les niveaux élevés de PAL totales soient dus à l’isoforme hépatique des PAL, puisque la mesure spécifique des PAL osseuses demeure difficile à obtenir dans le milieu clinique. En général, les patients pagétiques ont un bilan biochimique normal, à l’exception des PAL totales qui sont souvent élevées. Cependant, les niveaux de PAL peuvent être normaux, notamment chez les patients qui ont une atteinte monostotique ou une maladie métaboliquement peu active, et ne devraient donc pas exclure un diagnostic de MOP (Ralston 2013). Par ailleurs, les PAL totales ont une sensibilité variant entre 69% et 100%, et une spécificité de presque 100% pour le diagnostic de la MOP selon certaines études récentes (Griz, Fontan et al. 2014, Al Nofal, Altayar et al. 2015). Les examens d’imagerie sont les plus fiables pour confirmer le diagnostic de MOP. Le diagnostic positif de la MOP s’effectue sur les radiographies standards des os atteints. En effet, celles-ci démontrent une structure osseuse typique de la MOP, avec la présence de lésions ostéolytiques, sclérotiques, ou un mélange des deux (Lyles, Siris et al. 2001, Selby, Davie et al. 2002). De plus, lorsque le crâne est atteint, ces radiographies montrent parfois un aspect cotonneux
typique de la MOP, suggérant une atteinte mixte ostéolytique et sclérotique (Figure 8) (Ferraz-de-Souza and Correa 2013). Bien que les radiographies standards permettent de poser un diagnostic de MOP, elles sont peu utiles pour quantifier l’activité de la maladie puisque l’évolution des lésions pagétiques peut s’avérer très lente. De plus, la scintigraphie osseuse est particulièrement utile pour réaliser le bilan topographique initial de l’extension de la maladie. Il s’agit d’un examen d’imagerie très sensible qui permet de détecter l’augmentation du débit sanguin et de l’activité ostéoblastique caractéristiques de la MOP. En effet, suite à l’injection d’un agent radio-marqué, le plus souvent un bisphosphonate, les zones du squelette qui ont une activité métabolique anormale captent une quantité élevée de radionucléides, l'hyperfixation qui en résulte étant suggestive d'une atteinte pagétique (Figure 9) (Theodorou, Theodorou et al. 2011). Par ailleurs, la scintigraphie osseuse est l’outil de détection de la maladie le plus sensible, identifiant 97-98% des lésions pagétiques, alors que la sensibilité des radiographies se situe aux alentours de 85 à 91% (Laurin, Brown et al. 2001). Néanmoins, des radiographies des os hyperfixants à la scintigraphie osseuse devraient toujours être faites afin de confirmer la présence de lésions pagétiques et surtout de faire le diagnostic différentiel avec d’autres atteintes osseuses telles que des métastases osseuses (Josse, Hanley et al. 2007).
Outre la scintigraphie osseuse, il n’existe que très peu d’outils pour évaluer l’extension de la maladie, attestée par le nombre d’os atteints, chez les patients pagétiques. Cependant, un index anatomique permettant de calculer le pourcentage de tissu osseux atteints par la MOP chez un individu a été développé (Renier, Cronier et al. 1995), et est fréquemment utilisé dans les études de recherche clinique, notamment pour les associations phénotype-génotype. Afin de développer cet index, tous les os du squelette d’un homme de 30 ans en bonne santé ont d’abord été pesés individuellement. Ensuite, des pièces osseuses diverses provenant d’un laboratoire d’anatomie ont été pesées et finalement, une densitométrie minérale osseuse a été effectuée chez plusieurs hommes et femmes. À partir de toutes ces données, des rapports de poids entre les différentes pièces osseuses ont été effectués et le pourcentage de tissu osseux pour chaque os chez les hommes et les femmes a été estimé de façon successive. Par exemple, ces calculs ont permis d’estimer que le pourcentage du crâne chez l’homme est de 9%, alors qu’il est évalué à 11% chez la femme. Ainsi, en additionnant les pourcentages de chaque os atteint chez un individu pagétique, on obtient un score représentatif de l’étendue de la maladie chez cet individu, que l’on nomme Index de Rénier (Renier, Cronier et al. 1995).