© Angel Rene Alfonso Avila, 2019
Influence du profil minéral de la ration sur la production
de matière grasse du lait
Thèse
Angel Rene Alfonso Avila
Doctorat en sciences animales
Philosophiæ doctor (Ph. D.)
INFLUENCE DU PROFIL MINÉRAL DE LA
RATION SUR LA PRODUCTION DE
MATIÈRE GRASSE DU LAIT
Thèse
Angel René Alfonso Avila
Sous la direction de:
Rachel Gervais, directrice de recherche
Édith Charbonneau, codirectrice de recherche
iii
Résumé
Les quantités importantes d’aliments consommés et la proportion élevée de concentrés devant être incorporée aux rations pour soutenir les besoins des vaches hautes-productrices induisent bien souvent des perturbations de l’équilibre ruminal. Ces changements se répercutent sur la biohydrogénation ruminale des acides gras insaturés de la ration, qui entraînent à leur tour une inhibition de la synthèse des matières grasses par le tissu mammaire. Plusieurs stratégies nutritionnelles ont été mises de l’avant pour mieux tirer profit des rations riches en concentrés. Récemment, des études ont montré la capacité du carbonate de potassium (K2CO3) à prévenir la chute de matière grasse associée à des régimes à forte
teneur en concentrés. Toutefois, on comprend encore mal l’origine de ces effets. Les travaux de cette thèse visaient donc, dans un premier temps, à départager si les effets observés en ajoutant du K2CO3 aux rations des vaches laitières étaient dus à une augmentation de la
différence alimentaire cation anion (DACA), de la teneur en ions K+ ou encore du pouvoir tampon de la ration. Un autre objectif de cette thèse était de déterminer les effets d’un ajout de K2CO3 sur la synthèse de matières grasses du lait lorsque des sources d’acides gras
polyinsaturés (AGPI) sont introduites dans l’alimentation de la vache laitière. Enfin, les travaux cherchaient à déterminer l’effet d’un ajout de K2CO3 à la ration sur les populations
microbiennes du rumen, particulièrement celles reconnues pour être impliquées dans le métabolisme lipidique.
Pour répondre à ces questions, une première expérience a été mise en place, où 35 vaches Holstein en début de lactation ont été distribuées selon un plan en blocs complets aléatoires. La période expérimentale était de 28 jours et précédée d’une collecte de 5 jours (covariable). Les cinq rations expérimentales étaient constituées en vue de départager les effets du K2CO3 (témoin vs K2CO3), de la capacité tampon (K2CO3 vs KHCO3), de la DACA
(K2CO3 vs KCl) et du type de cations (K2CO3 vs Na2CO3). Dans cette expérience, et
contrairement aux études antérieures, l’ajout de K2CO3 aux rations riches en concentrés n’a
pas permis d’augmenter la production de lait ou la matière grasse des vaches en début de lactation. De plus, les résultats suggèrent qu’une augmentation du K alimentaire via l’ajout
iv
de K2CO3 pourrait induire un déséquilibre ionique cellulaire qui pourrait affecter le transport
des nutriments dans les cellules épithéliales mammaires et ainsi affecter la synthèse du lait.
Une seconde expérience a ensuite été menée, où 28 vaches Holstein en début de lactation ont été distribuées selon un plan en blocs complets aléatoires. La période expérimentale était également de 28 jours et précédée d’une collecte de 5 jours (covariable). Les quatre rations expérimentales étaient offertes selon un arrangement factoriel 2 × 2, soit 0 ou 1,5 % K2CO3 et 0 ou 2 % d’huile de soya, comme source d’acides gras polyinsaturés.
Les résultats ont montré que l’ajout de K2CO3 peut entraîner une augmentation de la sécrétion
des matières grasses laitières chez des animaux recevant de grandes quantités de concentrés. Cette augmentation dépend toutefois de la teneur en lipides de la ration. Cette étude a également permis de mettre en lumière une relation positive entre la production laitière et la teneur en chlore du lait.
Lors de cette seconde expérience, des échantillons de contenu ruminal ont également été prélevés chez 24 vaches (n = 6) afin d’étudier l’impact d’un supplément de K2CO3 sur
l’environnement et les populations microbiennes du rumen des vaches en début de lactation recevant des rations riches en concentrés avec ou sans huile de soya. Ces travaux ont permis de comprendre que le K2CO3 et l’huile de soya ont des effets distincts sur les populations
microbiennes. L’ajout de K2CO3 a stimulé la croissance de Butyrivibrio hungatei, bactérie
productrice de 18:1 trans-11. L’ajout d’huile de soya a, quant à elle, réduit la présence de
Butyrivibrio/Pseudobutyrivibrio, un groupe de bactéries productrices de 18:1 trans-11, de Fibrobacter succinogenes, une bactérie fibrolytique, de Butyrivibrio proteoclasticus, une
bactérie productrice de 18:0, et de Streptococcus bovis, une bactérie amylolytique.
Les travaux regroupés dans cette thèse apportent un éclairage nouveau sur le rôle de la supplémentation minérale sur les performances de production des vaches laitières.
v
Abstract
Negative energy balance typically appears in early-lactation dairy cows as a consequence of a reduction of dry matter intake, as well as of an increase in energy demand for milk production. To compensate this energy deficit, cows are fed with high-concentrate diets. However, highly fermentable carbohydrates introduced in diets can result in a decreased milk fat synthesis. Previous studies reported that addition of potassium carbonate (K2CO3) to high-concentrate diets helps to maintain milk fat, although the mechanism is yet
to be established. Consequently, the objective of the current thesis was, firstly, to investigate the effects of dietary cation-anion difference (DCAD), cation source, and buffering ability of the mineral supplement on rumen biohydrogenation of fatty acids (FA) and production performance of dairy cows fed a high-concentrate diet. Secondly, this thesis aimed at evaluating the effect of K2CO3 on production performance, biohydrogenation of fatty acids,
and mineral composition of milk in early-lactation dairy cows fed a high-concentrate diet with or without soybean oil (SBO), as a source of polyunsaturated fatty acid. A third objective of this thesis was to evaluate the effect of K2CO3 supplementation, in diets containing
soybean oil (SBO) on rumen microbial population associated with lipid metabolism.
Consequently, a first experiment was set up, where 35 early-lactation Holstein cows were used in a randomized complete block design with 33-d periods, including a 5-d pre-treatment collection period used as a covariate. Five different dietary pre-treatments were used to assess the effects of K2CO3 (control vs. K2CO3), buffering ability (K2CO3 vs. KHCO3),
DCAD (K2CO3 vs. KCl), and cation type (K2CO3 vs. Na2CO3). In this experiment, and as
opposed to previous studies, supplementing high-concentrate diets with K2CO3 did not
increase milk or milk fat yield in early-lactation cows. Also, results suggested that increasing dietary K through the addition of K2CO3 could lead to a disequilibrium in cellular ion
composition that can impair nutrient transport into and out of the mammary epithelial cells, and consequently affect milk synthesis.
A second experiment was conducted where 28 ruminally fistulated Holstein cows were used in a randomized complete block design. The experiment lasted 33 d, including a 5-d pre-treatment collection period used as a covariate. Experimental treatments were
vi
arranged as a 2 × 2 factorial with 0 or 1.5% K2CO3 and with 0 or 2% SBO. Results of this
experiment revealed that potential effect of K2CO3 on milk fat synthesis is dependent on the
levels of dietary polyunsaturated FA. Moreover, a positive relation was established between milk Cl concentration and milk yield, suggesting that the equilibrium of this ion is linked to the efficiency of lactogenesis.
Finally, rumen samples were collected from the rumen of 24 cows enrolled in the second experiment (n = 6) to assess treatment effects on rumen microbial population associated with lipid metabolism. Feeding K2CO3 and SBO had distinct effects on rumen
bacteria. Dietary K2CO3 stimulated the growth of Butyrivibrio hungatei, a bacterium
recognized to produce trans-11-18:1 during biohydrogenation. Conversely, feeding SBO reduced the growth of Butyrivibrio/Pseudobutyrivibrio bacterium group, known to produce
trans-11-18:1, of Fibrobacter succinogenes, a fibrolytic bacterium, of Butyrivibrio proteoclasticus, a bacterium involved in 18:0 production, and of Streptococcus bovis, an
amylolytic bacterium.
Overall, the experiments conducted and reported in this thesis provide new insights on the impact of mineral supplementation on milk performance in dairy cows.
vii
Table des matières
Résumé iii
Abstract v
Table des matières vii
Liste de tableaux xi
Liste des figures xiii
Liste d’équations xv
Liste des abréviations en français xvi
Liste des abréviations en anglais xviii
Abréviations utilisées pour désigner les acides gras xix
Remerciements xxii Avant-propos xxiii CHAPITRE I 1 1 Introduction 1 CHAPITRE II 4 2 Revue de littérature 4
2.1 Nutrition lipidique de la vache laitière 4
2.1.1 Métabolisme de lipides 5
2.1.1.1 Hydrolyse 6
2.1.1.2 Biohydrogénation 9
2.1.1.3 Modulateurs de l’environnement ruminal 14
2.1.2 Synthèse de la matière grasse laitière 16
2.1.2.1 Description de la matière grasse 16
2.1.2.2 Biosynthèse des acides gras 17
2.1.2.2.1 Absorption des lipides 18
2.1.2.2.2 Acides gras circulants dans le sang 19
2.1.3 Synthèse des acides gras dans la glande mammaire 29
2.1.4 Synthèse des triacylglycérols dans la glande mammaire 32
2.1.4.1 La sécrétion des globules de gras 33
viii
2.1.5.1 Fibres de la ration 34
2.1.5.2 Concentré 36
2.1.5.3 Supplémentation lipidique 39
2.1.6 Théorie de la chute de gras du lait 42
2.1.7 Influence des acides linoléiques conjugués dans la synthèse de la matière grasse
du lait 45
2.2 Minéraux dans l’alimentation chez la vache laitière et leurs effets sur la synthèse de
la matière grasse du lait 47
2.2.1 Différence alimentaire cations-anions 49
2.2.1.1 Effets de la différence alimentaire cations-anions (DACA) et des substances
tampon sur les paramètres digestifs et métaboliques 54
2.2.1.2 Effets de la différence alimentaire cations-anions sur les performances
laitières 57
2.2.1.2.1 Type de cations 64
2.2.1.2.2 Le rôle des ions dans la glande mammaire – Généralités 68
2.2.2 Tampons 72
2.2.3 Potassium 78
2.2.3.1 Effet du potassium sur le métabolisme ruminal des lipides – Approche in
vitro 85
2.2.3.2 Effets du potassium sur les performances laitières 88
2.3 Conclusion et objectifs 91
2.4 Bibliographie 92
CHAPITRE III 117
3 Potassium carbonate as a cation source for early-lactation dairy cows fed
high-concentrate diets 117
3.1 Résumé 118
3.2 Abstract 119
Key words: dietary cation-anion difference, potassium carbonate, milk fat synthesis,
chlorine 120
3.3 Introduction 121
3.4 Materials and methods 122
3.4.1 Cows, experimental design and treatments 122
ix
3.4.3 Statistical analysis 126
3.5 Results and discussion 127
3.5.1 Diets, DMI, and BW 127
3.5.2 Rumen fermentation attributes and minerals 129
3.5.3 Systemic acid-base status 130
3.5.4 Milk production and composition 131
3.5.5 Milk fatty acid composition 134
3.6 Conclusions 135
3.7 Acknowledgements 136
3.8 References 151
CHAPITRE IV 157
4 Interaction of potassium carbonate and soybean oil supplementation on performance of
early-lactation dairy cows fed a high-concentrate diet 157
4.1 Résumé 158
4.2 Abstract 159
4.3 Introduction 160
4.4 Materials and methods 160
4.4.1 Cows, Experimental Design, and Treatments 160
4.4.2 Experimental Measurements and Sampling 161
4.4.3 Statistical analysis 163
4.5 Results and discussion 165
4.5.1 Diets, DMI, and BW 165
4.5.2 Rumen pH, fermentation attributes, and minerals 165
4.5.3 Systemic acid-base status 167
4.5.4 Milk production and composition 167
4.6 Conclusions 171
4.7 Acknowledgments 172
4.8 References 184
CHAPITRE V 189
5 Effect of potassium carbonate and soybean oil supplementation on rumen microbial
population linked to lipid metabolism 189
x
5.2 Abstract 191
5.4. Introduction 193
5.5. Material and methods 194
5.2.1 Cows, Experimental Design, and Treatments 194
5.2.2 Rumen sampling 194
5.2.3 Microbial community analysis 195
5.6. Statistical analysis 196 5.7. Results 196 5.8. Discussion 197 5.9. Conclusions 200 5.10. Acknowledgments 200 5.11. References 201 CHAPITRE VI 209 6 Discussion et conclusions 209 6.1 Discussion générale 210 6.2 Conclusions 216 6.3 Bibliographie 217
xi
Liste de tableaux
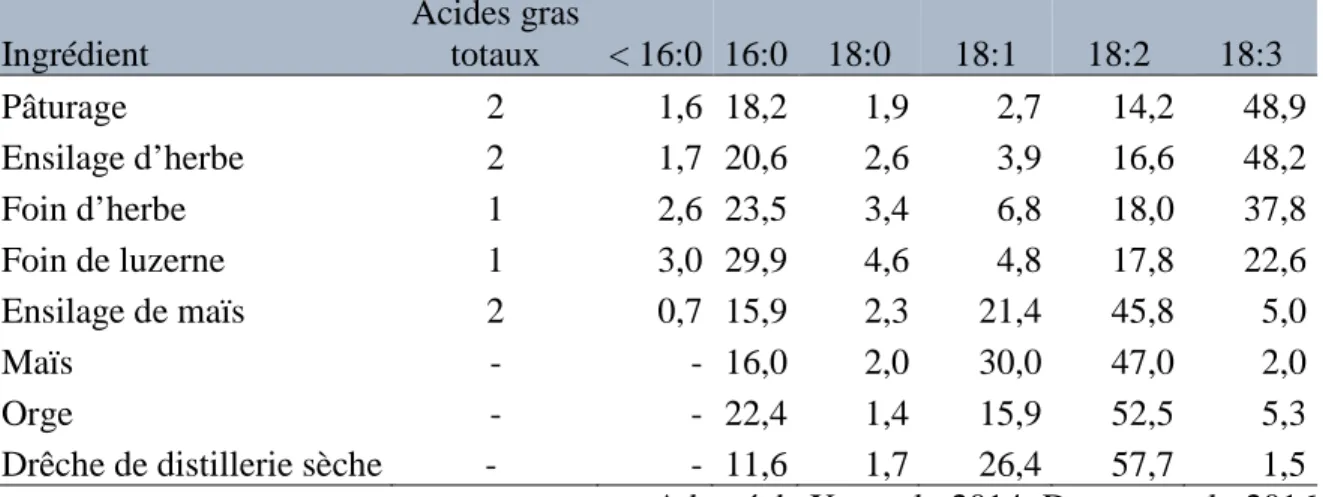
Tableau 2.1 Acides gras de fourrages multi-espèces selon la méthode de conservation. 11
Tableau 2.2 Principales classes de lipides du lait. 17
Tableau 2.3 Principaux acides gras du lait. 18
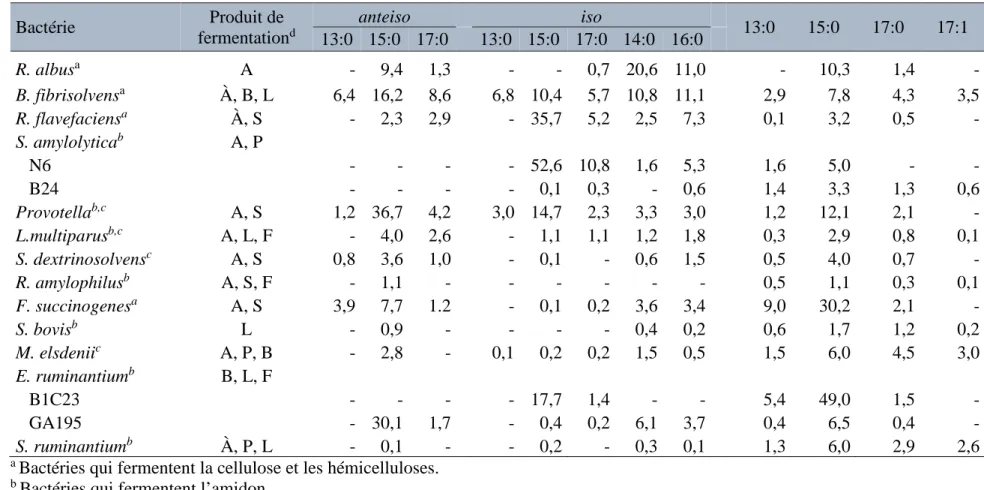
Tableau 2.4 Substrats prédominants, produits de fermentation, et acides gras à chaîne impaire et ramifiée (g/100 g d'acides gras) de certaines des principales bactéries impliquées
dans la fermentation des glucides. 25
Tableau 2.5 Teneur en acides gras (g/100 g de matière sèche) et composition (g/100 g d’acides gras totaux) des ingrédients utilisés dans les régimes des ruminants. 28 Tableau 2.6 Facteurs alimentaires pouvant modifier la concentration des acides linoléiques
conjugués du lait. 29
Tableau 2.7 Composition en acides gras (% des acides gras totaux) des principales sources
des lipides consommés par les ruminants. 39
Tableau 2.8 Gènes candidats affectés par la supplémentation en huile de poisson ou en acide
linoléique conjugué trans-10, cis-12. 41
Tableau 2.9 Concentration des cations et des anions dans les fluides physiologiques. 51 Tableau 2.10 Description des formules pour estimer la différence alimentaire cations anions. 55 Tableau 2.11 Différence alimentaire cation-anion suggérée pour maximiser les performances
de production de la vache laitière. 58
Tableau 2.12 Effets de la différence alimentaire cation-anion (DACA) de la ration de
lactation sur les performances laitières. 61
Tableau 2.13 Résumé des effets du ratio K:Na de la ration sur la consommation volontaire
de matière sèche (CVMS) et la performance laitière. 66
Tableau 2.14 Composition chimique des quelques ingrédients, milliéquivalents/kg de matière
sèche. 80
Tableau 2.15 Résumé des résultats des expériences in vitro en double flux continu lorsque le K2CO3 fut utilisé pour atteindre jusqu’à 3,3 % de K dans la ration, comparé au
NaOH et au KCl. 89
Table 3-1 Ingredients and chemical composition of the experimental total mixed rations 137
xii
Table 3-2 Dry matter intake, BW, and milk yield and composition of early-lactation cows receiving high-concentrate diets supplemented with different minerals ... 139 Table 3-3 Blood parameters of early-lactation cows receiving high-concentrate diets
supplemented with different minerals ... 142 Table 3-4 Rumen pH, volatile fatty acid (VFA), and mineral concentrations of rumen fluid from early-lactation cows receiving high-concentrate diets supplemented with different minerals ... 143 Table 3-5 Fatty acid composition of milk fat from early-lactation cows receiving
high-concentrate diets supplemented with different minerals ... 144 Table 4-1 Ingredients and chemical composition of the experimental diets ... 173 Table 4-2 Dry matter intake, BW, milk yield, and composition of early-lactation cows
receiving high-concentrate diets with or without K2CO3 and soybean oil (SBO) 175
Table 4-3 pH, ammonia N, volatile fatty acids, and minerals from rumen fluid of early-lactation cows receiving high-concentrate diets with or without K2CO3 and soybean
oil (SBO) ... 177 Table 4-4 Blood parameters of early-lactation cows receiving high-concentrate diets with or without K2CO3 and soybean oil (SBO) ... 178
Table 4-5 Composition of milk fat from early-lactation cows receiving high-concentrate diets supplemented with or without K2CO3 and soybean oil (SBO) ... 179
Table 5-1 List of primers used for quantitative real-time PCR detection of selected microbial species ... 206 Table 5-2 Relative abundance of DNA copies (counts in log10 per gram of rumen fluid) of
selected rumen microbiome of early-lactation cows receiving high-concentrate diets supplemented or not with K2CO3 and soybean oil (SBO)... 208
xiii
Liste des figures
Figure 2.1 Schéma de la lipolyse et de la biohydrogénation des lipides dans le rumen. ... 9 Figure 2.2 Sentiers de biohydrogénation ruminale simplifiés des acides oléique, linolénique,
et α-linolénique. ... 13 Figure 2.3 Principales voies possibles de biohydrogénation des acides linoléique et
linolénique. ... 14 Figure 2.4. Différents précurseurs de lipides qui contribuent à la synthèse des matières
grasses du lait dans la cellule épithéliale mammaire. ... 20 Figure 2.5 Voies métaboliques impliqués lors de la synthèse du gras du lait dans la glande
mammaire. L’inhibition des enzymes ATP-citrate lyase et NADP-malate déshydrogénase est indiqué par X. ... 30 Figure 2.6 Synthèses des triacylglycérols par la voie du glycerol-3-phosphaste ... 33 Figure 2.7 Relation entre la chute de la matière grasse du lait et un supplément ruminal
d’acide propionique ou postruminal de glucose. Chaque symbole représente une expérience. ... 38 Figure 2.8 Relation entre la teneur en matière grasse du lait et l’apport duodénal de lipides. ... 42 Figure 2.9 Modèle du transport de Cl- et de HCO3-à travers les compartiments prégastriques.
... 53 Figure 2.10 Ratio des ions du fluide intracellulaire de la glande mammaire et du lait de cobaye
(Cavia porcellus). ... 70 Figure 2.11 Réponse séquentielle à une charge d’ions H+, culminant dans la restauration de
l'équilibre acide-base par l'excrétion rénale de l'excès des ions H+. ... 73 Figure 2.12 Représentation schématique des composants et leurs relations dans le modèle du
bilan de potassium chez les vaches laitières. ... 83 Figure 2.13 Rétention apparente de K des vaches laitières selon le stade de lactation. ... 84 Figure 2.14. Teneur en acides gras (mg/incubation) des fourrages (A) et biohydrogénation
(%) des acides gras suite à l’incubation avec différentes concentrations de potassium supplémenté sous forme de KCl (B). Variables avec une lettre différente (e.g. a, b et c) indiquent des différences statistiquement significatives à P < 0,05. ... 86 Figure 3.1 Post-feeding temporal pattern of rumen pH (a), and NH3-N concentration (b) of
xiv
supplemented with different minerals ( , K2CO3; , KHCO3; , KCl; , Na2CO3).
... 148 Figure 3.2 Association between milk yield and milk concentration of (a) sodium, (b)
potassium, (c) chlorine, (d) calcium, and (e) sulfur, and between lactose yield and milk concentration of chlorine (f), in early-lactation cows fed high-concentrate diets unsupplemented ( , control) or supplemented with different minerals ( , K2CO3; ,
KHCO3; , KCl; , Na2CO3). ... 149
Figure 3.3 Association between milk fat concentration of trans-10, cis-12 18:2 and anteiso 15:0 in early-lactation cows fed a high-concentrate diet containing 1.8% of K2CO3
(DM basis). ... 150 Figure 4.1 Association between milk yield and milk concentration of (a) sodium, (b)
potassium, (c) chlorine, (d) calcium, and (e) sulfur, and between lactose yield and milk concentration of chlorine (f), in early-lactation cows fed high-concentrate diets with or without K2CO3 and soybean oil (SBO). , 0% K2CO3, 0% SBO; , 1.5%
xv
Liste d’équations
Équation 1. Équilibre chimique de l’acide carbonique (H2CO3) dans le sang accompli à
travers leur dissociation et / ou protonation. 74
Équation 2. Équilibre chimique du bicarbonate (HCO3-) dans le rumen. 75
xvi
Liste des abréviations en français
ACC Acétyl-CoA carboxylase
AGCIR Acides gras à chaîne impaire et ramifiée
AGNE Acides gras non estérifiés
AGPAT Acylglycérol acyltransférase
AGPI Acides gras polyinsaturés
AGV Acides gras volatils
ALC Acides linoléiques conjugués
ARNm Acide ribonucléique messager
CVMS Consommation volontaire de matière sèche
CO32- Carbonate
DACA Différence alimentaire cations-anions (Na + K – Cl – S)
DACA-S Différence alimentaire cations-anions (Na + K – Cl)
DGAT Diacylglycérol acyltransférase
DHA Acide docosahexaénoïque
ENL Énergie nette de lactation
EPA Acide eicosapentaénoïque
FASN Acide gras synthase
GPAT Glycérol-3-phosphate acyltransférase
HCO3- Bicarbonate
JEL Jours en lait
K2CO3 Carbonate de potassium
KHCO3 Bicarbonate de potassium
LPL Lipoprotéine lipase
MS Matière sèche
MNaP Mélange de NaHCO3 et pierre à chaux
NaHCO3 Bicarbonate de sodium
NDF Fibres insolubles au détergent neutre
NDFe Fibres insolubles au détergent neutre efficaces
NDFpe Fibres insolubles au détergent neutre physiquement efficaces
xvii
pKa Constante de dissociation
pCO2 Pression partielle en dioxyde de carbone
PTH Hormone parathyroïdienne
RCA restes calcifiées d’algues marines
REL réticulum endoplasmique lisse
SCD1 stearoyl-CoA désaturase (delta-9-desaturase)
SGLTs Na+/glucose cotransporteur ou symport
xviii
Liste des abréviations en anglais
ACACA Acetyl-CoA carboxylase alpha
ACSS1 Acyl-CoA synthetase short-chain family member 2
AGAPT6 1-Acylglycerol-3-phosphate O-acyltransferase 6
BcaT Branched-chain aminotransferase
BCKDH Branched-chain α-keto acid dehydrogenase
DMI Dry matter intake
FABP3 Fatty acid binding protein 3
FACL Fatty acyl-CoA ligase
HDL High Density Lipoprotein
LDL Low Density Lipoprotein
LPIN1 Lipin 1
NADPH Nicotinamide adenine dinucleotide phosphate
RCAD Rumen cation-anion difference
RUFAL Rumen unsaturated fatty acid load
SA Stearic acid-producing
VA1 Vaccenic acid-producing group 1
VA2 Vaccenic acid-producing group 2
xix
Abréviations utilisées pour désigner les acides gras
Abréviation utilisée Nomenclature officielle Désignation usuelle
4:0 butanoïque Butyrique 6:0 hexanoïque Caproïque 8:0 octanoïque Caprylique 10:0 décanoïque Caprique 11:0 undécanoïque Caproleique 12:0 dodécanoïque Laurique 13:0 tridécanoïque 14:0 tétradécanoïque Myristique
14:1 cis-9 tétradécénoïque cis-9 Myristoleïque
15:0 pentadécanoique -
16:0 hexadécanoïque Palmitique
16:1 cis-9 hexadécénoïque cis-9 Palimitoléique
17:0 heptadécanoique Margarique
18:0 octadécanoïque Stéarique
18:1 trans-9 octadécénoique trans-9 Élaïdique
18:1 trans-10 octadécénoïque trans-10
18:1 trans-11 octadécénoïque trans-11 trans-vaccénique
18:1 trans-12 octadécénoïque trans-12
18:1 trans-15 octadécénoïque trans-15
18:1 trans-16 octadécénoïque trans-16
18:1 cis-9 octadécénoïque cis-9 oléique
18:1 cis-11 octadécénoïque cis-11 cis-vaccénique
18:1 cis-12 octadécénoïque cis-12
18:1 cis-13 octadécénoïque cis-13
18:1 cis-14 octadécénoïque cis-14
18:1 cis-15 octadécénoïque cis-15
18:2 cis-9, trans-12 octadécénoïque cis-9, trans-15 18:2 trans-9, trans-12 octadécénoïque trans-9, trans-12 18:2 cis-9, trans-13 octadécénoïque cis-9, trans-13 18:2 trans-8, cis-13 octadécénoïque trans-8, cis-13 18:2 trans-9, cis-12 octadécénoïque trans-9, cis-12 18:2 trans-11, cis-15 octadécénoïque trans-11, cis-12
18:2 cis-9, cis-12 octadécadiénoïque cis-9, cis-12 linoléique
18:2 cis- 9, trans-11 octadécadiénoïque cis-9, trans-11 ruménique
18:2 trans-10, cis- 12 octadécadiénoïque trans-10, cis-12
18:3 cis- 6, -9, -12 octadécatriénoique cis-6, cis-9, cis-12 y-linolénique 18:3 cis-9, -12, -15 octadécatriénoique cis-9, cis-12, cis-15 linolénique 18:4 cis- 6, -9, -12, -15 octadécatetraénoique cis-6, cis-9, cis-12, cis-15
xx
20:0 eicosanoïque Arachidique
20:1 cis-9 eicosanoïque cis-9
20:1 cis-11 eicosanoïque cis-11 Gondoïque
20:2 cis-11, -14 eicosadiénoïque cis-11, cis-14 Homolinoléique
20:3 cis-8, -11, -14 eicosadiénoïque cis-8, cis-11, cis-14 Di-Homo-γ- linolénique 20:4 cis-8, -11, -14, -17
20:4 cis-5, -8, -11, -14 eicosatétraénoïque cis-5, cis-8, cis-11, cis-14 Arachidonique 20:5 cis-5, -8, -11, -14, -17 eicosapentaénoïque cis-5, cis-8, cis-11, cis-14, cis-17 Timnodonique
22:0 docosanoïque Béhénique
22:4 cis-7, -10, -13, -16 docosatétraénoïque cis-7, cis-10, cis-13, cis-16 Adrénique 22:5 cis-7, -10, -13, -16, -19 docosapentaénoïque cis-7, cis-10, cis-13, cis-16, cis-19 Clupanidonique 22:6 cis-4, -7, -10, -13, -16, -19 docosahexaénoïque cis-4, cis-7, cis-10, cis-13, cis-16, cis-19 Cervonique
xxi
« La fixité du milieu intérieur est la condition d'une vie libre et indépendante » Claude Bernard
xxii
Remerciements
J’aimerais tout d’abord remercier ma directrice Madame Rachel Gervais pour la patience et la confiance, même après le – 80 !!! Je garderai toujours en tête votre rigueur scientifique et votre bonne humeur, un mélange assez nécessaire de nos jours. Je ne trouverai jamais les mots pour exprimer ma gratitude. Je voudrais également remercier ma codirectrice Madame Édith Charbonneau, qui m’a offert en deux occasions l’opportunité de faire mes études doctorales, quelle aventure ! Merci aussi pour le temps que vous m’avez consacré lors de mon adaptation au Québec, ainsi que pour les conseils et votre approche pratique que vous m’avez transmise. Je remercie aussi Monsieur Yvan Chouinard pour son soutien; son regarde critique et pointu qui restera toujours présent dans ma mémoire. Merci à vous trois pour le temps que vous m’avez accordé au cours de mes études doctorales.
Je remercie aussi Johanne Chiquette et Gaëtan Tremblay pour m’avoir fait confiance et m’avoir accueilli chacun dans vos laboratoires !
Je voudrais également remercier mes amis de l’UL, Stéphanie, Véronique, Liliana, Anne So, Lucie, Éric, Max, Daniel, Michaël et toutes les personnes que j'ai eu l'occasion de rencontrer pendant mon doctorat ! Merci pour le temps !
Este logro es un reconocimiento a mi familia, su apoyo me ha sabido mantener a flote a pesar de la distancia. Gil y Julia, esto es un tributo a ustedes!! Hermanas Yessica, Yudy y Paola, simplemente gracias por todo, incluyendo mis sobrinos y sobrina. En fin, gracias por estar conmigo en este recorrido!
xxiii
Avant-propos
Cette thèse doctorale qui porte sur l’influence du profil minéral de la ration sur la synthèse de la matière grasse du lait inclut les résultats de deux essais expérimentaux. Ce travail comprend une introduction (Chapitre 1), une revue de travaux antérieurs (Chapitre 2), trois articles (Chapitres 3 à 5), ainsi qu’une discussion générale et les conclusions (Chapitre 6). Les chapitres 3, 4 et 5 ont été rédigés en anglais et sont présentés sous forme de manuscrits, dont les deux premiers sont déjà publiés dans une revue scientifique. Le 5e chapitre sera soumis sous peu pour publication. Pour ces trois publications, j’ai fait la collecte de données, les analyses de laboratoire et de données, ainsi que la rédaction. Également, j’ai participé activement à la conception et la mise en place du protocole du projet du chapitre 5. Enfin, ces travaux ont été faits sous la supervision de ma directrice, ma codirectrice et mes superviseurs.
Chapitre 3:
A. R. Alfonso-Avila,* É. Charbonneau,* P. Y. Chouinard,* G. F. Tremblay,† and R. Gervais*
*Département des sciences animales, Université Laval, Québec, QC, Canada G1V 0A6
†Québec Research and Development Centre, Agriculture and Agri-Food Canada, Québec, QC, Canada GIV 2J3
Potassium carbonate as a cation source for early-lactation dairy cows fed high-concentrate diets.
Journal of Dairy Science, March 2017, Volume 100, Issue 3, Pages 1751–1765;
xxiv Chapitre 4:
A. R. Alfonso-Avila,* É. Charbonneau,* P. Y. Chouinard,* G. F. Tremblay,† and R. Gervais*
*Département des sciences animales, Université Laval, Québec, QC, Canada G1V 0A6
†Québec Research and Development Centre, Agriculture and Agri-Food Canada, Québec, QC, Canada GIV 2J3
Interaction of potassium carbonate and soybean oil supplementation on performance of early-lactation dairy cows fed a high-concentrate diet.
Journal of Dairy Science, November 2017, Volume 100, Issue 11, Pages 9007–9019;
https://doi.org/10.3168/jds.2017-13077.
Chapitre 5:
A. R. Alfonso-Avila,* É. Charbonneau,* P. Y. Chouinard,* J. Chiquette,† and R. Gervais*
*Département des sciences animales, Université Laval, Québec, QC, Canada G1V 0A6
†Sherbrooke Research and Development Centre, Agriculture and Agri-Food Canada, Sherbrooke, QC, Canada J1M 0C8
Effect of potassium carbonate and soybean oil supplementation on rumen microbial population linked to lipid metabolism.
1
CHAPITRE I
1 Introduction
Au Canada, le revenu des fermes laitières est grandement influencé par le système de paiement du lait basé sur les composantes laitières. De ces composantes, la matière grasse laitière est celle qui est la plus malléable via l’alimentation, sa teneur pouvant varier jusqu’à 3 unités de pourcentage (Jenkins et McGuire, 2006). Ainsi, depuis plusieurs années, de nombreux travaux ont porté sur la recherche de stratégies nutritionnelles visant la modulation de la teneur et de la composition de la matière grasse laitière.
Le début de lactation est caractérisé par une diminution dans la consommation volontaire de matière sèche (CVMS), probablement due aux changements du statut endocrinien (Grummer et al., 1995), et conséquemment un plus faible apport en énergie. Ainsi, au cours de cette période, les animaux traversent un épisode de bilan énergétique négatif. Cette condition a été exacerbée dans les dernières décennies par une sélection génétique visant l’amélioration du potentiel de production de la vache laitière. Au Canada, entre 2005 et 2015, le cheptel laitier canadien a diminué de 11 % tandis que la production globale de lait a augmenté de 6 % (Commission canadienne du lait, 2016). Une réduction d’environ 30 % de la CVMS est observée durant la dernière semaine avant le vêlage (Grummer et al. 1995) et cette CVMS sous optimale se poursuit jusqu’à trois semaines après le vêlage (Grummer et al., 2004). En vue de réduire l’ampleur du bilan énergétique négatif, les rations fournies en début de lactation sont très riches en concentrés et faibles en fourrages.
L’équilibre ruminal est largement influencé par la proportion de fourrages ainsi que la disponibilité des gras polyinsaturés (AGPI) qui se trouvent dans la ration. En conséquence, ces facteurs ont la capacité d’altérer la population microbienne, déterminant notamment le type de fermentation et la disponibilité des précurseurs pour la synthèse du lait. En même temps, il est reconnu que les rations servies en début de lactation sont susceptibles d’entraîner des altérations au sentier de biohydrogénation des acides gras insaturés de la ration et ainsi promouvoir l’apparition d’intermédiaires reconnus pour avoir des effets antilipogéniques dans la glande mammaire. Le fait que l’acide linoléique conjugué (ALC) trans-10, cis-12 induise le syndrome de chute de gras du lait en réduisant la synthèse de novo des AG et des
2
AG préformés suggère une régulation cordonnée des enzymes impliqués dans la synthèse lipidique. Concrètement, l’abondance de l’ARNm pour l’AG synthase, l’acétyl-CoA carboxylase, la lipoprotéine lipase, la Δ9-désaturase, l’acyl gras-CoA estérase, la
glycérol-phosphate-acyltransférase et l'acyl-glycérol-glycérol-phosphate-acyltransférase diminuent pendant le syndrome de chute de gras du lait (Bauman et al., 2011)
Il y a quelques décennies, la supplémentation minérale a été proposée pour augmenter le pouvoir tampon afin de diminuer l’impact négatif des rations faibles en fibres et riches en concentrés permettant le maintien de l’équilibre ruminal (Emery et Brown, 1961; Nicholson et Cunningham, 1961;). Par ailleurs, des études récentes ont suggéré une implication des minéraux dans l’homéostasie acide-base au niveau systémique, qui se traduit par une augmentation du pH et des teneurs en bicarbonate (HCO3-) dans le sang chez les vaches
nourris avec de forte proportions de concentrés (Apper-Bossard et al., 2010). Également, la supplémentation minérale a des effets démontrés sur le métabolisme ruminal des lipides, notamment sur la diminution des teneurs en acides gras issues de sentiers alternatifs de biohydrogénation reconnus pour inhiber la lipogenèse mammaire (Jenkins et al., 2012; Harrison et al., 2012). Parmi ces études, certains auteurs suggèrent des effets positifs sur les vaches laitières lors d’un ajout de K2CO3, où on augmente simultanément la DACA, la
concentration des ions K, et la capacité tampon de la ration. Néanmoins, le mécanisme par lequel la supplémentation de K2CO3 pourrait diminuer l'impact des régimes alimentaires
riches en concentrés sur l’inhibition de la synthèse des matières grasses du lait est encore à établir. Ainsi, une meilleure connaissance des mécanismes d’action des suppléments minéraux sur l’ensemble du système digestif, sanguin, ou même mammaire, pourrait conduire au développement de stratégies nutritionnelles permettant de prévenir les effets indésirables associés aux rations riches en concentrés et/ou en AGPI notamment sur la synthèse de la matière grasse laitière.
Comme introduction à cette thèse, une revue de travaux antérieurs présentera l’état de connaissance concernant le métabolisme lipidique chez la vache laitière. Aussi, une mise à jour des effets de la supplémentation minérale sur les performances des vaches laitières sera proposée. Un des objectifs de cette thèse est de départager les effets de la DACA, de la teneur en ions K, et du pouvoir tampon de la ration sur la production et la composition du lait de
3
vaches en début de lactation. En second lieu, les travaux visent à étudier les effets d’un ajout de K2CO3 à la ration sur le processus de biohydrogénation ruminale et la synthèse des
matières grasses du lait chez les vaches laitières recevant une ration riche en concentrés et en AGPI. Enfin, la troisième expérience a pour but de déterminer l’effet du K2CO3 sur certaines
populations bactériennes du rumen impliquées dans le métabolisme lipidique de la vache laitière.
En somme, l’objectif de cette thèse est de mieux comprendre le rôle de la supplémentation minérale et notamment du potassium au sein des processus biologiques responsables de la production et de la composition de lait chez la vache en début de lactation.
Cette thèse conclura avec la présentation d’une discussion générale soulignant les possibles répercutions du stress ionique sur le bilan énergétique, et finalement sur l’importance de l’homéostasie cellulaire sur les performances laitières.
4
CHAPITRE II
2 Revue de littérature
Le premier lien entre la nutrition et les lipides fut mis en évidence grâce à la découverte des vitamines liposolubles, au cours des travaux faits par le Dr. Elmer Verner McCollum à l’Université du Wisconsin au début du 19ème siècle. Au fil des années, les recherches concernant les lipides chez les ruminants ont permis de mieux comprendre entre autres leurs fonctions biologiques. Aujourd’hui, on connaît mieux l’impact des acides gras sur l’expression de gènes impliqués dans la lipogenèse mammaire, et donc leur rôle dans l’apparition du syndrome de la chute du gras du lait. Afin de mieux comprendre les implications des lipides sur les performances des vaches laitières, la première partie de cette revue de travaux antérieurs traite du métabolisme lipidique de la vache laitière. Dans un second temps, les effets de la supplémentation minérale sur les performances laitières, la disponibilité des ions dans le liquide ruminal, le sang et le lait, ainsi que leur impact sur paramètres ruminaux et sanguins seront abordés. Une description du rôle des ions dans le transport des nutriments vers et hors des cellules épithéliales de la glande mammaire clôture cette partie.
2.1 Nutrition lipidique de la vache laitière
Les acides gras jouent plusieurs rôles biologiques d’importance majeure. En fait, les acides gras font partie des membranes cellulaires, interviennent également dans la signalisation cellulaire, et servent, entre autres, de couche externe de protection chez les animaux et les plantes. Les acides gras libres ne se rencontrent que rarement dans la nature, mais sont souvent estérifiés en phospholipides, glycérolipides ou squelette de stérols (Brown et al., 2009). Plus de 500 acides gras ont été trouvés dans les plantes et microorganismes, mais seulement quelques-uns sont quantitativement importants. Par ailleurs, on retrouve sept types d’acides gras majoritaires dans les plantes, comptant environ pour 95 % du total des acides gras des tissus foliaires, y compris les acides gras saturés comme l’acide laurique (12:0), myristique (14:0), palmitique (16:0), stéarique (18:0), et les acides gras insaturés
5
comme l’acide oléique (18:1 cis-9), linoléique (18:2 cis-9, cis-12), et α-linolénique (18:3 cis-9, cis-12, cis-15; Harwood, 2012).
La base de la ration des ruminants étant les fourrages, il est important de mentionné que les lipides représentent de 60 à 80 g par kg de matière sèche (MS) du tissu foliaire dans la plupart des ingrédients naturellement disponibles dans l’alimentation animale (Harfoot, 1978). En citant une série de travaux, Boufaïed et al. (2003) mentionnent que l’entreposage des lipides dans le tissu foliaire s’effectue dans les chloroplastes, sous forme de lipides polaires et leur concentration peut varier entre 22 et 25 % sur base sec. En outre, deux tiers de ces lipides sont estérifiés, dont 33 % sous forme de lipides simples (diglycérides, acides gras libres, cires), 50 % sous forme des galactolipides (mono- et digalactosyldiglycérides), et 17 % sous forme de phospholipides. Cependant, le profil des acides gras peut varier en fonction du stade de développement des plantes fourragères, des plans de fertilisation et de la méthode de conservation (Boufaïed et al., 2003).
La supplémentation de lipides dans la ration des ruminants afin d’augmenter la densité énergétique est aujourd’hui une pratique courante. Aussi, l’utilisation des lipides dans l’alimentation de la vache laitière peut être motivée par un désir de modifier la composition en acides gras du lait et ainsi changer la valeur nutritionnelle et sensorielle des produits laitiers pour mieux répondre aux demandes des consommateurs (Slot et al., 2009).
2.1.1 Métabolisme de lipides
La portion lipidique des rations pour ruminants contient typiquement une concentration élevée en AGPI, ceux-ci pouvant être nocifs pour certains micro-organismes du rumen. Ces lipides subissent toutefois une transformation intense dans le rumen via les processus d’hydrolyse et de biohydrogénation (Figure 2.1), aboutissant à un changement important dans la nature des acides gras qui seront absorbés et utilisés par les tissus (Bauman et al., 2003). De ce fait, la composition des aliments diffère drastiquement de celle des produits issus d’élevage des ruminants (Jenkins, 1993; Harfoot et Hazlewood, 1997).
6 2.1.1.1 Hydrolyse
Le rumen est considéré comme l’endroit principal où l’hydrolyse des lipides est accomplie. Processus qui se fait rapidement après l’ingestion des aliments. Indépendamment de la source de lipides dans la ration, l’hydrolyse est menée par des enzymes extracellulaires provenant des bactéries (Henderson et Hodgkiss, 1973). Ainsi, entre 85 et 95 % des lipides qui arrivent au rumen y sont hydrolysés (Bauchart, 1993). Cette hydrolyse entraîne la libération de glycérol et de galactose, qui sont par la suite convertis en acides gras volatils (AGV), principalement le propionate et le butyrate, en plus des acides gras saturés et insaturés (Jarvis et Moore, 2010). Il semblerait que l’hydrolyse soit réalisée par les bactéries afin de diminuer la toxicité des acides gras polyinsaturés (Maia et al., 2007).
En dehors du métabolisme lipidique, il semble que l’hydrolyse joue un rôle indirect et non négligeable sur les mécanismes de défense, l’abondance et la richesse du microbiome ruminal. Ainsi, l’hydrolyse permet de rendre disponibles les sources de carbones provenant des triacylglycérols, ce qui sert probablement à la synthèse d’antibiotiques chez les bactéries (Olukoshi et Packter, 1994). En outre, les bactéries communiquent entre elles à l’aide d’un signal chimique, ce qui est essentiel pour synchroniser les activités des niches bactériennes. La communication chimique qu’impliquent la production, la libération, la détection et la réponse à de petites molécules de type hormonal appelées autoréducteurs (e.g. acyle homoserine lactones, autoinducteur 2) est possible grâce à l’action enzymatique des estérases. Ce processus, appelé détection du quorum ou « quorum sensing » en anglais, permet aux bactéries de surveiller l'environnement à la recherche d'autres bactéries et de modifier le comportement à l'échelle de la population en réponse aux changements dans le nombre et/ou les espèces présentes dans une communauté (Waters et Bassler, 2005). Bien que ce mécanisme de communication bactérienne soit important, ce sujet a fait l’objet de très peu de recherches chez les vaches laitières (Erickson et al., 2002; Mitsumori et al., 2003).
Les bactéries produisent divers types d’enzymes lipolytiques. La carboxylesterase, par exemple, va hydrolyser de petits esters qui contiennent des molécules partiellement solubles dans l’eau. Les lipases véritables affichent, quant à elles, une activité maximale sur les triacylglycérols à longue chaîne insolubles dans l’eau. On trouve également divers types
7
de phospholipases (Arpigny et Jaeger, 1999). Chez les ruminants, les bactéries responsables de l’hydrolyse sont anaérobies strictes (Jenkins et al., 2008), ce qui a nécessité le développement de techniques anaérobiques, ainsi que de milieux de culture différentiels et sélectifs pour les caractériser (Stewart et al., 1997).
Hobson et Mann en 1961 ont démontré le rôle important d’Anaerovibio lipolytica 5ST, une bactérie isolée d’un rumen de brebis reconnu comme une des principales espèces impliquées dans l’hydrolyse de lipides alimentaires. Butyrivibrio fibrisolvens a par la suite été identifiée comme un des microorganismes responsables de la lipolyse de galactolipides et phospholipides (Hazlewood et Dawson 1975). La production d’estérase capable d’hydrolyser le p-nitrophenyl palmitate a été observée chez 74 bactéries, issues de 20 genres (Fay et al., 1990). Plus récemment, l’identification des bactéries lipolytiques du genre
Clostridium (LIT5, C. lundense ou R1T) et Propionibacteria (P. acnes, P. avium et LIT4) a été rapportée (Jarvis et al., 1998; Cirne et al., 2006, Edwards et al., 2013).
Les avancées rapides de la biologie moléculaire au cours des dernières années ont permis de caractériser l’environnement complexe du rumen (Huws et al., 2015). On estime aujourd’hui la variation génétique par des amplicons d’ADN ou d’ARN (produits naturellement ou artificiellement) dans des régions très spécifiques du génome (e.g. 16S pour les bactéries ou 18S pour les protozoaires). Ces nouveaux outils très puissants ont rapidement détrôné les méthodes classiques utilisées pour déterminer les bactéries impliquées dans le métabolisme lipidique du rumen.
L’exploration des gènes avec une activité lipolytique est possible aujourd’hui grâce à la construction de bibliothèques métagénomiques à partir du séquençage collectif de l’ADN de bactéries du rumen. Donc, une fois que les gènes sont identifiés, la transformation dans l’hôte Escherichia Coli est réalisée par mutagenèse (introduction volontaire de mutations) dirigée. Comme résultat, de nouvelles enzymes estérases (Est10, Est5S) des bactéries incultes ont été isolées chez les bovins (Keun et al., 2012; Rodriguez et al., 2015) et les ovins (EstGK1 et EstZ3; Bayer et al., 2010). Une autre enzyme, la lipase RlipE1, qui fait probablement partie d’une nouvelle sous famille, a été rapportée chez les vaches Holstein (Liu et al., 2009). Les mêmes auteurs ont identifié RlipE2, celle-ci partageant 90 % de similarité avec la carboxylestérase produite par Thermosinus carboxydivorans, bactérie qui n’avait jamais été
8
reliée à l’écosystème ruminal. Cependant, les chercheurs de l’Université d’Aberystwyth, dirigée par Huws et Newbold, ont mené un vaste travail de caractérisation des enzymes reliés à l’hydrolyse bactérienne dans le rumen des bovins (Privé et al., 2013; Privé et al., 2015). Au total, 17 estérases et lipases potentielles (lip 1 à lip 14, et alipA, alipB, et alipC), ainsi que 2 phospholipases (pl1 et pl2) ont été découvertes.
L’implication des protozoaires dans l’hydrolyse est moins remarquable que celle des bactéries. Il a été observé que l’Entodinium ecaudatum produisait du galactose à partir de galactolipides, suggérant ainsi une capacité à produire l’enzyme galactosidase, bien que l’activité enzymatique n’a pas été démontrée (Bailey et Howard, 1963). Un autre protozoaire, l’Entodinium caudatum, est reconnu pour sa production de phospholipases (Coleman et al., 1971). Néanmoins, il semble que la capacité de migration de protozoaires ciliés pour répondre aux gradients environnementaux des nutriments (chimiotaxie) a un impact important sur le métabolisme des lipides cellulaires des protozoaires per se, plutôt que pour la digestion de lipides alimentaires. Cela est dû à l’effet prédateur reconnu des protozoaires sur les bactéries. Il est estimé que le genre Entodinium spp. est responsable de 30 à 40 % de l’activité lipolytique (Wright, 1961).
Les facteurs affectant l’hydrolyse des lipides sont reliés à ceux qui, de façon directe (e.g. toxicité des lipides) ou indirecte (e.g. ratio fourrages:concentrés), influencent les bactéries. En essais in vitro, les rations avec une faible proportion de fourrages ont réduit d’au moins 48 % les bactéries lipolytiques, limitant ainsi l’hydrolyse de supplément de triglycéride à 5,8 % (trioléines). Contrairement à une ration riche en fourrage où l’hydrolyse atteint 87,6 % (Latham et al., 1972). De même, les enzymes et métabolites secondaires produits par les plantes ont un effet sur la lipolyse au moment de la conservation des fourrages ou pendant sa consommation. Par exemple, en stérilisant la luzerne avec des rayons γ, il a été possible de quantifier que les enzymes de la luzerne étaient responsables de 65 % de la lipolyse observée au cours de la fermentation en ensilage (Ding et al., 2013). La présence de polyphénols, comme les tannins dans certaines légumineuses, inhibe l’hydrolyse de lipides, et ce, jusqu’à 50 % avec le trèfle rouge sauvage (Lee et al., 2004); ce qui permet d’augmenter le transfert des AGPI de la ration au le lait et la viande. D’autres facteurs comme la faible
9
concentration en azote dans les rations, la taille des particules et l’ajout de substrats qui stimulent la diminution du pH ruminal inhibent le taux d’hydrolyse (Gerson et al., 1983).
En général, l’hydrolyse permet de maintenir un environnement propice dans lequel le métabolisme normal des bactéries entraîne l’étape suivante: la biohydrogénation des lipides.
2.1.1.2 Biohydrogénation
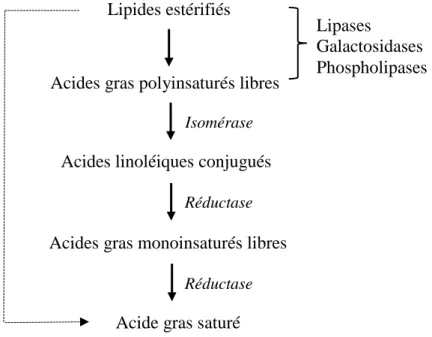
Suite à la lipolyse, le glycérol et le galactose produits sont fermentés, alors que la fraction insaturée des acides gras libres est partiellement ou totalement biohydrogénée par l’action d'enzymes microbiennes (Figure 2.1). Les isomérases transforment les liaisons éthyléniques qui se trouvent normalement dans la nature sous la configuration cis vers leur configuration trans, tandis que les réductases saturent ces liaisons (Sauvant et Bas, 2001).
Figure 2.1 Schéma de la lipolyse et de la biohydrogénation des lipides dans le rumen. Adapté de Buccioni et al., 2012
Il est évident que les lipides alimentaires qui arrivent au rumen vont déterminer le profil d’acides gras libres à biohydrogéner. Les acides gras contenus dans les glycolipides et
Lipides estérifiés
Acides gras polyinsaturés libres
Acides linoléiques conjugués
Acides gras monoinsaturés libres
Acide gras saturé
Lipases Galactosidases Phospholipases Réductase Isomérase Réductase
10
phospholipides des fourrages sont caractérisés par une proportion élevée d’AGPI, notamment le 18:3 cis-9, cis-12, cis-15 (Tableau 2.1). En général, lorsque les rations des vaches sont supplémentées avec de l’huile, exception faite de certaines huiles comme ceux de canola et de lin, une proportion élevée de 18:2 cis-9, cis-12 sous forme de triacylglycérols est apportée (Doreau et al., 2012).
Les bactéries impliquées dans les différentes étapes des voies de la biohydrogénation ont été caractérisées et classifiées en deux groupes, A et B, en fonction de leur affinité envers le substrat à hydrogéner (Kemp et Lander, 1983). Les bactéries du groupe A ont la capacité d’hydrogéner l’acide linoléique et l’acide linolénique (18:3 cis-9, cis-12, cis-15), et de produire aussi l’acide trans-vaccénique (18:1 trans-11) reconnu comme un intermédiaire de la biohydrogénation. En effet, plusieurs souches de Butyrivibrio fibrisolvens, des bactéries du genre Treponema, Micrococcus sp., Ruminococcus albus, Eubacterium, ainsi que certaines bactéries gram-négatives font partie de ce groupe. La biohydrogénation totale de 18:1 trans-11 (produit des bactéries du groupe A) vers l’acide 18:0 ne peut être réalisée que par les bactéries du groupe B. Selon Harfoot et Hazlewood (1997), ce groupe se limite à des bactéries du genre Fusocillus spp. et un bâtonnet gram-négatif nommé R8/5.
Wallace et al. (2007) ont suggéré, suite à l’analyse phylogénétique basée sur presque toute la longueur de la séquence du gène d’ARNr 16S (> 1300 pb), que la bactérie
Clostriduim proteoclasticum B316T partageait des similitudes morphologiques et
métaboliques avec Fusocillus spp., genre reconnu pour produire l’acide stéarique. Postérieurement, cette bactérie a été reclassée et renommée Butyrivibrio proteoclasticum (Moon et al., 2008). Par la suite, ce même groupe de recherche a évalué la position phylogénétique (nouveau système de classification des bactéries) à partir d’ARNr 16S des différentes espèces de bactéries en regardant leurs produits de fermentation, les mécanismes de production du butyrate, et le métabolisme de lipides (Paillard et al., 2007). Leurs travaux ont mené à l’identification de 3 sous-groupes. Les bactéries productrices d’acide vaccénique du groupe 1 (VA1, vaccenic acid-producing) regroupent les bactéries Butyrivibrio et
Pseudobutyrivibrio (40 souches), productrices d’acide trans-vaccénique ayant une activité
11
du groupe 2 (VA2, vaccenic acid-producing) sont représentées par les souches Butyrivibrio
hungatei (5 souches), elles aussi productrices d’acide trans-vaccénique.
Tableau 2.1 Acides gras de fourrages multi-espèces selon la méthode de conservation.
Frais Ensilage Foins
Foins de faible qualité Acide gras (g/100 g AG totaux)
12:0 0,63 0,24 0,79 0,62 14:0 1,00 0,87 1,04 1,55 16:0 16,90 18,70 21,90 29,80 16:1 1,00 0,83 1,69 1,80 18:0 2,14 2,12 2,39 4,27 18:1 3,84 3,40 4,18 7,23 18:2 15,80 16,60 17,50 16,10 18:3 52,60 49,80 47,10 23,60 20:0 0,89 0,73 - - 22:0 0,78 1,12 - -
Adapté de Glasser et al., 2013
Les bactéries productrices d’acide stéarique (SA, stearic acid-producing) sont les souches de
Butyrivibrio proteoclasticum (16 souches), bactéries qui ont la particularité de produire
l’acide stéarique à partir de l’acide linoléique. Les deux derniers groupes ont montré une activité enzymatique élevée du gène butyrate kinase, considérée comme un des mécanismes de production de butyrate grâce à l’action enzymatique.
Des travaux récents basés sur l’information génomique des bactéries inconnues appelée « matière noire des microorganismes ruminaux » ont permis d’identifier des bactéries du rumen qui ne sont pas encore cultivables et qui font partie des familles: Prevotella,
Lachnospiraceae incertae sedis, et non classées comme Bacteroidales, Clostridiales, et Ruminococcaceae; bactéries qui pourraient jouer un rôle important dans la biohydrogénation
des lipides dans le rumen (Huws et al., 2011). Par ailleurs, la caractérisation du lipidome (composition taxonomique des bactéries reliées au métabolisme des lipides) de bouvillons recevant une ration supplémentée d’huile de lin (riche en 18:3 cis-9, cis-12, cis-15) ou d’huile d’echium (riche en acide stéaridonique; 18:4 cis-6, cis-9, cis-12, cis-15) a été réalisée. La variabilité du profil en acides gras des suppléments lipidiques suggère que différentes
12
bactéries pourraient être impliquées. En effet, une abondance des genres Butyrivibrio,
Howardella, Oribacterium, Pseudobutyrivibrio et Roseburia a été observée lorsque les
animaux recevaient de l’huile de lin, tandis que les genres Roseburia et Succinovibrio étaient augmentés avec l’huile d’echium (Huws et al., 2015).
Il est estimé que les protozoaires peuvent contribuer jusqu’à 50 % de la biomasse microbienne du rumen (Newbold et al., 2015). Les premiers résultats des travaux réalisés afin de discerner l’implication des protozoaires dans la biohydrogénation n’ont pas été concluants dû à la contamination bactérienne (Wright, 1959; Abaza et al., 1975). L’utilisation plus récente de méthodes basées sur l’amplification en chaîne par polymérase (PCR) a permis de comprendre que le rôle des protozoaires est très limité en ce qui a trait à la biohydrogénation ruminale des acides gras (Devillard et al., 2006). Les concentrations élevées d’ALC cis-9, trans-11 et de 18:1 trans-11 qui se retrouvant dans les protozoaires seraient la conséquence d’une incorporation de ces acides gras par l’engloutissement des bactéries, des acides gras libres ou encore par l’ingestion de chloroplastes (Devillard et al., 2006; Huws et al., 2012).
Les champignons ont une fonction minimale dans le métabolisme des lipides du rumen, et ce, probablement parce qu’ils représentent une faible proportion (8 %) du microbiote. L’identification précise du rôle des champignons dans la biohydrogénation est compliquée par les difficultés associées à leur dénombrementet leur isolement étant donné les nombreux stades de leur cycle de développement. La seule étude démontrant un rôle des champignons dans la biohydrogénation a été réalisée par Nam et Garnsworthy (2007), qui ont démontré que le genre Orpinomyces a la capacité de biohydrogéner le 18:2 cis-9, cis-12, ayant comme produit final le 18:1 trans-11. Il semble toutefois que la dernière étape de ce processus de saturation du 18:1 trans-11 en 18:0 s’accomplisse plus lentement chez les champignons que chez les bactéries.
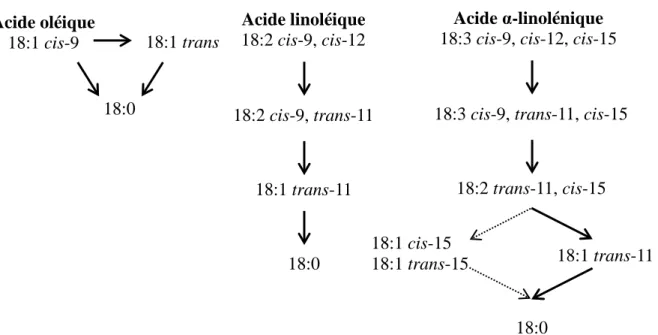
Le développement des technologies chromatographiques a permis l'étude des isomères formés pendant la biohydrogénation. Il existe différents sentiers de biohydrogénation ruminale des acides gras insaturés. À cet égard, Jenkins et al. (2008) ont fait une mise à jour de ces sentiers simplifiés (Figure 2.2), basée sur le travail préalable de Harfoot et Hazlewood (1997).
13
Figure 2.2 Sentiers de biohydrogénation ruminale simplifiés des acides oléique, linolénique, et α-linolénique.
Adapté de Jenkins et al., 2008 La biohydrogénation des AGPI entraîne aussi la formation de nombreux isomères ou intermédiaires de la biohydrogénation. Dans le cas de l’acide oléique, une biohydrogénation directe vers l’acide stéarique est reconnue (Figure 2.2), cependant il n’est pas établi si la multitude d’isomères 18:1 trans formés à partir de l’acide oléique sont intermédiaires ou encore sont les produits finaux de la biohydrogénation (Mosley et al., 2002). La biohydrogénation complète du 18:2 cis-9, cis-12 en 18:0 implique seulement deux intermédiaires; la première étape produit l’ALC cis-9, trans-11 (acide ruménique, isomère majoritaire des ALC), et est suivie de deux réactions de biohydrogénation qui donnent le 18:1
trans-11 et l’acide stéarique.
La biohydrogénation de l’acide linolénique débute par son isomérisation en 18:3 cis-9, 11, cis-15, suivie de sa biohydrogénation en 18:2 11, cis-15 et en 18:1 trans-11. Ce processus est résumé à la figure 2.2, où les sentiers de biohydrogénation simplifiés, qui sont habituellement rapportés, sont présentés.
Acide oléique 18:1 cis-9 18:1 trans 18:0 Acide linoléique 18:2 cis-9, cis-12 18:0 18:2 cis-9, trans-11 18:1 trans-11 Acide α-linolénique 18:3 cis-9, cis-12, cis-15
18:0
18:3 cis-9, trans-11, cis-15
18:2 trans-11, cis-15
18:1 cis-15
14
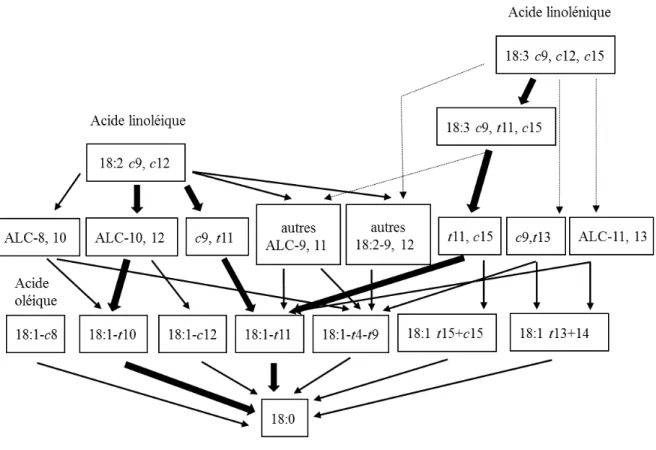
Figure 2.3 Principales voies possibles de biohydrogénation des acides linoléique et linolénique.
Adapté de Doreau et al., 2012
Le métabolisme ruminal des acides gras insaturés n’est cependant pas limité à ces quelques voies et sa complexité a été soulignée par Doreau et al., 2012. (Figure 2.3).
2.1.1.3 Modulateurs de l’environnement ruminal
De nombreux suppléments permettent une modification de l’environnement ruminal. Leurs mécanismes d’action impliquent de manière directe, ou non, des changements du microbiote. Des facteurs tels que le pH ruminal, la digestibilité des nutriments et leur vitesse de passage vont fortement affecter leur effet sur le métabolisme de lipides. Par exemple, l’ajout des ionophores à la ration sous forme de Monensin permet de sélectionner les bactéries du rumen qui produisent moins de H2 et d’acétate et qui produisent aussi plus de propionate et d’ATP (Ipharraguerre et Clark, 2003). Selon la méta-analyse de Duffield et al. (2008), la Monensin diminue l’ingestion de matière sèche de 0,3 kg/j tandis qu’elle augmente
15
la production de lait de 0,7 kg/j, c’est-à-dire qu’il y a un accroissement de 2,5 % de l’efficacité de la synthèse du lait. La teneur en matières grasses du lait est diminuée de 0,13 unité de %, sans présenter de répercussions sur la production des matières grasses du lait. Une brève description des composants de la ration des vaches laitières moins connus pour leurs effets sur le métabolisme du rumen sera présentée dans les prochains paragraphes.
Récemment, il a été montré que l’ajout d’acide butanoïque (2-hydroxy-4-méthylthio) diminue le risque de chute du gras du lait. Par exemple, les teneurs en isomères des sentiers alternatifs ont été réduites dans le lait de vaches hautes productrices recevant un supplément d’acide butanoïque (0,1 % MS). Ces animaux ont également maintenu une sécrétion de matières grasses dans leur lait supérieure à celle des vaches du groupe témoin. Toutefois, les mécanismes sous-jacents permettant d’expliquer ce phénomène n’ont pas encore été élucidés (Baldin et al., 2014; Baldin et al., 2015).
Le glycérol (glycérol 3-phosphate), sous-produit de la production de biodiesel, est considéré comme une source d’énergie apportant des squelettes de carbones pour la gluconéogenèse. Des études in vitro suggèrent qu’une supplémentation en glycérol (8 à 15 % de MS) diminuerait l’hydrolyse, condition préalable nécessaire à la biohydrogénation (Edwards et al., 2012). Les effets du glycérol sont liés à l’inhibition des bactéries impliquées dans le métabolisme des lipides et au passage favorisé des lipides totaux dans le rumen (Krueger et al., 2010). Il semblerait, dans ces conditions, que l’effet bactériostatique des AGPI sur les bactéries puisse également diminuer.
D’autre part, une méta-analyse, incluant 110 articles, suggère que l’addition des levures (e.g. Saccharomyces cerevisiae) tend à augmenter la concentration en matière grasse du lait (0,05 %) (Desnoyers et al., 2009). Bien que le mécanisme d’action ne soit pas connu, ce résultat est accompagné d’une augmentation significative du pH ruminal (0,03 unité), de la digestibilité de la matière organique (0,8 %), de la synthèse de lait (1,2 kg/j), et d’une baisse de l’acide lactique (- 0,9 mM) dans le rumen.
L’ail a démontré ses capacités à influencer la fermentation ruminale, en raison de ses effets antimicrobiens (Doreau et al., 2017). D’ailleurs, Ramos-Morales et al. (2013) ont mis en évidence, lors d’une étude in vitro, que l’huile d’ail, principalement composée de disulfure
16
de diallyle (80 µl/L) et de thiosulfinate de propylpropane (200 µl/L), affecte la biohydrogénation des acides gras. Les ALC trans-10, cis-12 et 18:1 trans-10 ont augmenté lors de supplémentation en huile d’ail, par rapport au témoin. Ces changements ont pu être constatés conjointement avec une augmentationde l’abondance de Butyrivibrio fibrisolvens avec l’ajout de thiosulfinate de propylpropane.
Bien qu’il ne s’agisse pas d’un facteur nutritionnel, l’inhibition immunogénique a été utilisée dans le but de créer des anticorps dirigés contre les bactéries productrices de lipases:
Anaerovibrio lipolytica, Butyrivibrio fibrisolvens, Propionibacterium avidum et Propionibacterium acnes (Edwards et al., 2017). Dans cette étude, un anticorps généré contre
une lipase purifiée de Pseudomonas a également été inclus pour déterminer si l'activité lipolytique extracellulaire pourrait être inhibée dans une plus grande mesure, en utilisant un anticorps ayant une plus forte spécificité pour la lipase elle-même, comparé à un anticorps ciblé contre des préparations de cellules entières. Tous les anticorps étaient efficaces pour réduire l’hydrolyse de 78 % en moyenne par l’utilisation de la lipase anti Pseudomonas. L'anticorps lipase anti Pseudomonas a provoqué le plus grand pourcentage d'inhibition de l'activité lipolytique, et une réduction de la lipolyse de 56 % (P. acnes) à 96 % (B. fibrisolvens H17C). De plus, l’anticorps de la bactérie Butyrivibrio fibrisolvens a manifesté une tendance à réduire les produits de la biohydrogénation de l’acide gras 18:3. Ainsi, ces résultats suggèrent que l’hydrolyse et la biohydrogénation peuvent être immunologiquement inhibées.
En raison du caractère exploratoire de la plupart des études citées dans cette section de la synthèse bibliographique, des précautions doivent être prises étant donné l’ignorance concernant les interactions entre les composants des rations et les substances modificatrices du rumen, ainsi que de leurs niveaux d’inclusion.
2.1.2 Synthèse de la matière grasse laitière
2.1.2.1 Description de la matière grasse
Chez les ruminants, les lipides du lait représentent entre 3 à 5 % du volume total et se trouvent sous forme de globules émulsifiés dans la phase aqueuse (87 %) du lait (Jensen,
17
2002). Les lipides du lait sont majoritairement composés de triacylglycérols, mais il y a également, en quantité moindre, des diacylglycérols, des monoacylglycérols, des acides gras libres, des phospholipides et des stérols (Tableau 2.2). Comme les triacylglycérols représentent 98 % des lipides totaux, ils affectent directement les propriétés technologiques des lipides du lait comme l’hydrophobicité, la densité et le point de fusion.
Tableau 2.2 Principales classes de lipides du lait.
Classe des lipides Quantité (% pondéral)
Triacylglycérols 98,3
Diacylglycérols 0,3
Monoacylglycérols 0,03
Acides gras libres 0,1
Phospholipides 0,8
Stérols 0,3
Caroténoïdes Trace
Vitamines liposolubles Trace
Composés aromatiques Trace
Jensen, 2002
Les phospholipides jouent un rôle important dans le lait grâce à leurs propriétés amphiphiles (MacGibbon et Taylor, 2006). Environ 65 % d’entre eux se trouvent dans la membrane de la gouttelette lipidique, alors que le restant est dans la phase diffusable du lait.
2.1.2.2 Biosynthèse des acides gras
Il a été établi que la matière grasse du lait contient environ 400 acides gras différents (Jensen, 2002), les principaux étant le 16:0 et le 18:1 (Tableau 2.3). Chez les ruminants, les acides gras proviennent de deux sources principales. Dans un premier temps, il y a ceux synthétisés dans la glande mammaire, un processus nommé « synthèse de novo », et dans lequel les acides gras produits contiennent de 4 à 16 atomes de carbone. La synthèse de novo des acides gras représente ainsi 45 % des acides gras totaux du lait (Bauman et al., 2011). Les autres acides gras sont prélevés de la circulation sanguine et comprennent des acides gras
18
de 16 atomes de carbone ou plus. Les acides gras provenant de l’alimentation, ceux issus de la population microbienne et enfin, ceux obtenus par la mobilisation des graisses corporelles, vont déterminer la concentration en acides gras du sang.
Tableau 2.3 Principaux acides gras du lait.
Acide gras Nom commun Intervalle moyen
(% pondéral) 4:0 Butyrique 2-5 6:0 Caproïque 1-5 8:0 Caprilyque 1-3 10:0 Caprique 2-4 12:0 Laurique 2-5 14:0 Myristique 8-14 15:0 Pentadécanoïque 1-2 16:0 Palmitique 22-35 16:1 Palmitoléique 1-3 17:0 Margarique 0,5-1,5 18:0 Stéarique 9-14 18:11 Oléique 20-30 18:2 Linoléique 1-3 18:3 Linolénique 0,5-2
1Contient approximativement 3 % d’isomères 18:1 trans.
Adapté de Jensen, 2002
2.1.2.2.1 Absorption des lipides
Les lipides qui quittent le rumen sont principalement des acides gras libres (85 à 90 %) fixés aux particules d'aliments et des phospholipides microbiens (10 à 15 %), ainsi que des petites quantités de triacylglycérols et de glycolipides provenant de matières premières résiduelles qui sont hydrolysées par les lipases intestinales et pancréatiques (Doreau et Ferlay, 1994). Comme il n'y a pas d'absorption ou de modifications significatives des acides gras à chaîne longue et moyenne dans l'omasum et l'abomasum, le matériel lipidique disponible pour l'absorption dans l'intestin grêle est similaire à celui qui quitte le rumen. Avant que l'absorption des acides gras puisse se produire, il est nécessaire que les acides gras adsorbés sur les particules d'aliments soient solubilisés dans le milieu aqueux. Il est considéré que la formation de micelles est la clé du processus de solubilisation et, par conséquent, la