Utilisation des antibiotiques et tests diagnostiques en
thérapie parodontale: une étude transversale sur les
pratiques courantes des parodontistes au Canada
Mémoire
Julie St-Onge
Maîtrise en sciences dentaires - parodontie - avec mémoire
Maître ès sciences (M. Sc.)
Utilisation des antibiotiques et tests diagnostiques en
thérapie parodontale : une étude transversale sur les
pratiques courantes des parodontistes au Canada
Mémoire
Julie St-Onge
Sous la direction de :
Dr Daniel Grenier, directeur de recherche
Résumé
En considérant la problématique grandissante des résistances bactériennes, cette étude avait pour but d’évaluer l’utilisation des antibiotiques et des tests diagnostiques microbiens en thérapie parodontale afin de vérifier si les pratiques cliniques actuelles des parodontistes canadiens concordent avec la littérature disponible. La collecte de données a été effectuée par l’entremise d'un questionnaire électronique acheminé par courriel et rempli de façon anonyme. Parmi les 322 parodontistes contactés, 64 ont participé à cette étude. Un taux de participation de 19,88 % a alors été atteint. Les résultats obtenus ont révélé que 59,38 % des parodontistes canadiens utilisent les antibiotiques locaux. Toutefois, les participants rapportent y avoir recours rarement et principalement pour la prise en charge de la parodontite réfractaire (39,47 %) et la parodontite chronique sévère localisée (21,05 %). D’ailleurs, la minocycline est l’antibiotique local le plus fréquemment utilisé. Pour ce qui est de l’antibiothérapie systémique, la majorité des parodontistes canadiens ont démontré des pratiques cliniques similaires pour les différentes conditions parodontales évaluées, et ce, autant pour les fréquences d’utilisation que les choix d’antibiotiques. La combinaison d’amoxicilline et de métronidazole est l’antibiothérapie systémique sélectionnée le plus fréquemment pour différentes conditions parodontales. Finalement, 82,81 % des participants n’utilisent jamais les tests diagnostiques microbiens dans leur pratique et cette non-utilisation a été justifiée par l’absence d’avantages associés à leur utilisation. En conclusion, une certaine similarité entre les habitudes de pratique a été dénotée pour l’antibiothérapie et les tests diagnostiques. Ainsi, en ce qui a trait à l’utilisation globale de l’antibiothérapie, les parodontistes canadiens respectent les évidences scientifiques actuelles. Pour ce qui est des tests diagnostiques, l’absence de littérature démontrant clairement les bénéfices cliniques d’avoir recours à ce type de test en thérapie parodontale a été reflétée par la faible utilisation de ceux-ci rapportée dans ce projet.
Abstract
Considering the emerging problem of bacterial resistance, this study was designed to evaluate the use of antibiotics and microbial diagnostic tests in periodontal therapy to determine whether the current clinical practices of Canadian periodontists are consistent with available literature. The data were collected through an electronic questionnaire sent by email and completed anonymously. There are 64 of the 322 periodontists contacted who participated in this study. A participation rate of 19.88 % was then obtained. The results show that 59.38 % of periodontists practicing in Canada use local antibiotics. However, participants mentioned using it rarely and mainly for the management of refractory periodontitis (39.47 %) and localized severe chronic periodontitis (21.05 %). Moreover, minocycline is the most frequently used local antibiotic. For systemic antibiotic therapy, the majority of Canadian periodontists demonstrated similar clinical practices. In fact, similarities were observed for frequency of use and antibiotic choice in various periodontal conditions evaluated. The combination of amoxicillin and metronidazole is the most frequently selected systemic antibiotic therapy for different periodontal conditions. Finally, 82.81 % of participants never use microbial diagnostic tests in their practice and this non-use was justified by the lack of benefits associated with these tests. In conclusion, a certain similarity between the practice habits was denoted for antibiotic therapy and diagnostic tests. Thus, the overall use of antibiotic therapy by Canadian periodontists respects current scientific evidence. The low use of diagnostic tests reported in this project reflects the lack of literature clearly supporting the clinical benefits of using these tests in periodontal therapy.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... viii
Liste des figures ... ix
Liste des abréviations, sigles et symboles ... xi
Remerciements ... xiii
Introduction ... 1
1. État des connaissances ... 3
1.1. Bactéries parodontopathogènes et biofilm ... 3
1.2. Maladies parodontales ... 5
1.2.1. Parodontite chronique ... 5
1.2.2. Parodontite agressive ... 6
1.2.3. Parodontite réfractaire ... 7
1.2.4. Maladies parodontales nécrosantes... 7
1.2.5. Abcès du parodonte ... 8
1.2.6. Parodontite associée à une lésion endodontique ... 10
1.3. Facteurs de risque ...11
1.3.1. Diabète ... 11
1.3.2. Tabagisme ... 12
1.4. Thérapie parodontale non chirurgicale... 12
1.5. Tests diagnostiques microbiens ... 13
1.5.1. Microscopie bactérienne ... 14
1.5.2. Culture bactérienne ... 14
1.5.3. Test immunologique ... 15
1.5.4. Sonde à ADN ... 15
1.5.5. Réaction de polymérisation en chaîne conventionnelle ou quantitative... 16
1.5.6. Test d'enzyme bactérienne ... 17
1.6. Antibiotiques ... 17 1.7. Antibiotiques locaux ... 18 1.7.1. Tétracycline (Actisite) ... 19 1.7.2. Doxycycline (Atridox) ... 19 1.7.3. Minocycline (Arestin)... 20 1.7.4. Métronidazole (Elyzol) ... 21 1.7.5. Chlorhexidine (PerioChip) ... 21 1.8. Antibiotiques systémiques... 21 1.8.1. Pénicilline ... 24 1.8.2. Tétracycline ... 25 1.8.3. Nitroimidazole ... 26 1.8.4. Fluoroquinolone ... 26 1.8.5. Macrolide ... 26
1.8.6. Clindamycine ... 27
1.9. Antibiothérapie combinée ... 27
1.10. Résistance antimicrobienne ... 28
1.11. Questionnaire de recherche ... 29
1.11.1. Questionnaire électronique ... 30
1.11.2. Élaboration d’un questionnaire électronique ... 31
1.11.3. Taux de participation ... 31 2. Problématique ... 33 2.1. Objectifs du projet ... 34 2.2. Hypothèses de recherche ... 34 2.3. Pertinence ... 35 3. Matériel et méthodes ... 36
3.1. Type d’étude et population étudiée ... 36
3.2. Questionnaire de recherche... 36
3.2.1. Questionnaire électronique ... 36
3.2.2. Développement du questionnaire... 37
3.2.3. Validation et test du questionnaire ... 38
3.3. Variables mesurées ... 38
3.4. Critères d’inclusion et d’exclusion... 39
3.5. Facteurs confusionnels ... 39
3.6. Recrutement des participants... 39
3.7. Traduction de la documentation ... 41
3.8. Taux de réponse ... 41
3.9. Incitatif à la participation ... 42
3.10. Tirage de l’incitatif ... 43
3.11. Démarche éthique ... 43
3.12. Analyse des résultats et analyse statistique ... 44
4. Résultats ... 46
4.1. Échantillonage ... 46
4.2. Profil des participants ... 47
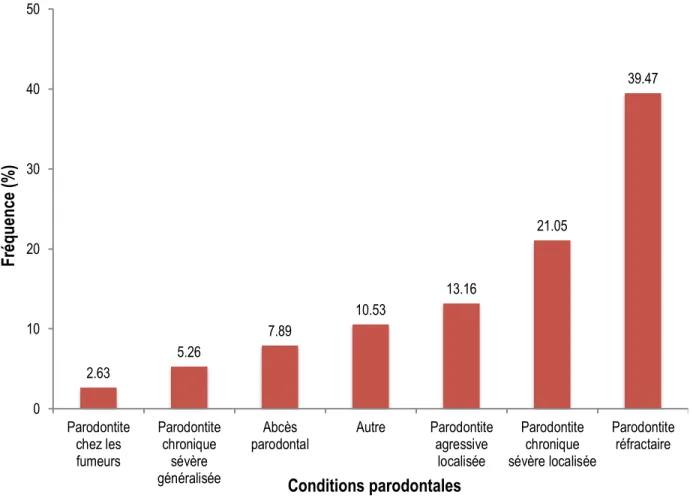
4.3. Antibiotiques locaux ... 52
4.3.1. Utilisation de l’antibiothérapie locale ... 53
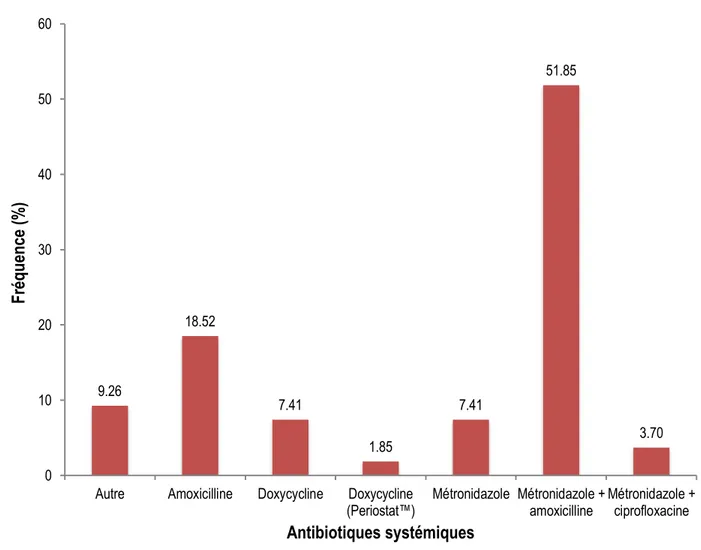
4.3.2. Sélection de l’agent thérapeutique ... 54
4.3.3. Type de procédures parodontales ... 54
4.3.4. Facteurs démographiques et utilisation des antibiotiques locaux ... 55
4.4. Antibiotiques systémiques... 56
4.4.1. Parodontite chronique sévère ... 57
4.4.2. Parodontite agressive ... 61
4.4.3. Parodontite chez un patient diabétique ... 65
4.4.4. Parodontite chez un patient fumeur ... 67
4.4.5. Maladies parodontales nécrosantes... 69
4.4.6. Abcès parodontal ... 73
4.4.7. Parodontite associée à une lésion endodontique ... 75
4.4.8. Parodontite réfractaire ... 77
4.4.9. Antibiothérapie et diverses thérapies parodontales ... 79
4.4.10. Facteurs démographiques et utilisation des antibiotiques systémiques ... 80
4.5. Tests diagnostiques microbiens ... 83
4.5.1. Utilisation des tests diagnostiques ... 83
5. Discussion ... 87
5.1. Interprétation des résultats ... 87
5.1.1. Antibiotiques locaux ... 87
5.1.1.1. Utilisation de l’antibiothérapie locale ... 87
5.1.1.2. Sélection de l’agent thérapeutique ... 88
5.1.1.3. Type de procédure parodontale ... 89
5.1.1.4. Facteurs démographiques et utilisation des antibiotiques locaux ... 90
5.1.2. Antibiotiques systémiques ... 90
5.1.2.1. Parodontite chronique sévère ... 91
5.1.2.2. Parodontite agressive... 92
5.1.2.3. Parodontite chez un patient diabétique ... 94
5.1.2.4. Parodontite chez un patient fumeur ... 95
5.1.2.5. Maladies parodontales nécrosantes ... 96
5.1.2.6. Abcès parodontal ... 97
5.1.2.7. Parodontite associée à une lésion endodontique ... 98
5.1.2.8. Parodontite réfractaire ... 99
5.1.2.9. Antibiothérapie et diverses thérapies parodontales ... 101
5.1.2.10. Facteurs démographiques et utilisation des antibiotiques systémiques... 102
5.1.3. Tests diagnostiques microbiens ... 104
5.1.3.1. Facteurs démographiques et utilisation des tests diagnostiques ... 106
5.2. Méthodologie de recherche ... 106
5.2.1. Critères d’inclusion et d’exclusion ... 106
5.2.2. Recrutement et taux de participation... 106
5.2.3. Questionnaire ... 107 5.3. Validité interne ... 108 5.4. Validité externe ... 109 5.5. Limitations de l’étude ... 109 Conclusion ... 111 Bibliographie / Médiagraphie ... 114
Annexe I - Questionnaire de recherche ... 127
Annexe II - Courriel de recrutement envoyé aux parodontistes pratiquant au Québec ... 165
Annexe III - Courriel de recrutement envoyé aux parodontistes pratiquant ailleurs qu’au Québec ... 168
Annexe IV - Courriel de rappel envoyé aux parodontistes pratiquant au Québec... 171
Annexe V - Courriel de rappel envoyé aux parodontistes pratiquant ailleurs qu’au Québec ... 174
Annexe VI - Questionnaire utilisé pour le tirage ... 177
Annexe VII - Consentement implicite et explicite ... 179
Annexe VIII - Courriel utilisé pour partager les résultats aux parodontistes pratiquant au Québec ... 184
Annexe IX - Courriel utilisé pour partager les résultats aux parodontistes pratiquant ailleurs qu’au Québec ... 187
Liste des tableaux
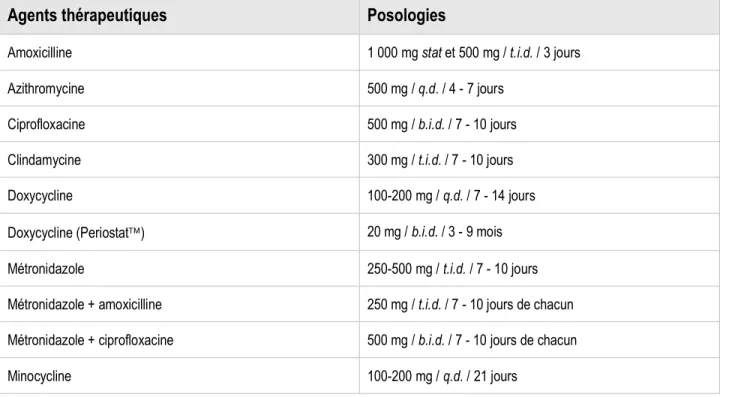
Tableau I : Différentes familles d’antibiotiques utilisés en parodontie et leurs modes d’action ... 23 Tableau II : Antibiothérapie systémique couramment utilisée en thérapie parodontale. ... 24 Tableau III : Résultats des analyses de régression logistique multivariées effectuées pour l’utilisation des antibiotiques locaux et les différentes données démographiques recueillies. ... 56 Tableau IV : Posologie des différents antibiotiques systémiques suggérés aux participants dans le
questionnaire ... 57 Tableau V : Résultats des analyses de régression logistique multivariées effectuées pour l’utilisation des antibiotiques systémiques selon diverses conditions parodontales et les différentes données
démographiques recueillies. ... 82 Tableau VI : Résultats des analyses de régression logistique multivariées effectuées pour l’utilisation des tests diagnostiques microbiens et les différentes données démographiques recueillies. ... 86
Liste des figures
Figure 1. Diagramme de flux des participants... 47
Figure 2. Distribution des participants selon chaque province canadienne. ... 48
Figure 3. Distribution du nombre d’années de pratique des participants. ... 49
Figure 4. Distribution des différents types de pratique des participants. ... 50
Figure 5. Distribution des participants selon le pays, dans lequel leur formation en parodontie a été complétée, c’est-à-dire le Canada ou les États-Unis. ... 51
Figure 6. Distribution des différentes universités canadiennes fréquentées par les participants ayant complété leur formation au Canada. ... 52
Figure 7. Fréquence d’utilisation des antibiotiques locaux selon diverses conditions parodontales. ... 53
Figure 8. Fréquence d’utilisation de différents agents thérapeutiques locaux. ... 54
Figure 9. Procédures parodontales pour lesquelles les antibiotiques locaux ont rapporté être utilisés ainsi que leur fréquence d’utilisation pour chacune de ces procédures. ... 55
Figure 10. Fréquence d’utilisation d’une antibiothérapie systémique pour le traitement de la parodontite chronique sévère localisée. ... 58
Figure 11. Fréquence d’utilisation d’une antibiothérapie systémique pour le traitement de la parodontite chronique sévère généralisée. ... 59
Figure 12. Fréquence d’utilisation des différents agents thérapeutiques lors du traitement de la parodontite chronique sévère localisée. ... 60
Figure 13. Fréquence d’utilisation des différents agents thérapeutiques lors du traitement de la parodontite chronique sévère généralisée. ... 61
Figure 14. Fréquence d’utilisation d’une antibiothérapie systémique pour le traitement de la parodontite agressive localisée. ... 62
Figure 15. Fréquence d’utilisation d’une antibiothérapie systémique pour le traitement de la parodontite agressive généralisée. ... 63
Figure 16. Fréquence d’utilisation des différents agents thérapeutiques lors du traitement de la parodontite agressive localisée. ... 64
Figure 17. Fréquence d’utilisation des différents agents thérapeutiques lors du traitement de la parodontite agressive généralisée. ... 65
Figure 18. Fréquence d’utilisation d’une antibiothérapie systémique pour le traitement de la parodontite chez un patient diabétique. ... 66
Figure 19. Fréquence d’utilisation des différents agents thérapeutiques lors du traitement de la parodontite chez un patient diabétique. ... 67
Figure 20. Fréquence d’utilisation d’une antibiothérapie systémique pour le traitement de la parodontite chez un patient fumeur... 68
Figure 21. Fréquence d’utilisation des différents agents thérapeutiques lors du traitement de la parodontite chez un patient fumeur... 69
Figure 22. Fréquence d’utilisation d’une antibiothérapie systémique pour le traitement de la gingivite ulcéro-nécrosante. ... 70
Figure 23. Fréquence d’utilisation des différents agents thérapeutiques lors du traitement de la gingivite ulcéro-nécrosante. ... 71
Figure 24. Fréquence d’utilisation d’une antibiothérapie systémique pour le traitement de la parodontite ulcéro-nécrosante. ... 72
Figure 25. Fréquence d’utilisation des différents agents thérapeutiques lors du traitement de la parodontite ulcéro-nécrosante. ... 73 Figure 26. Fréquence d’utilisation d’une antibiothérapie systémique pour le traitement d’un abcès
parodontal. ... 74 Figure 27. Fréquence d’utilisation des différents agents thérapeutiques lors du traitement d’un abcès parodontal. ... 75 Figure 28. Fréquence d’utilisation d’une antibiothérapie systémique pour le traitement de la parodontite associée à une lésion endodontique. ... 76 Figure 29. Fréquence d’utilisation des différents agents thérapeutiques lors du traitement de la parodontite associée à une lésion endodontique. ... 77 Figure 30. Fréquence d’utilisation d’une antibiothérapie systémique pour le traitement de la parodontite réfractaire. ... 78 Figure 31. Fréquence d’utilisation des différents agents thérapeutiques lors du traitement de la parodontite réfractaire. ... 79 Figure 32. Raisons expliquant la non-utilisation des tests diagnostiques en thérapie parodontale. ... 84 Figure 33. Diverses raisons expliquant l’utilisation des tests diagnostiques en thérapie parodontale. ... 85
Liste des abréviations, sigles et symboles
AAP American Association of Periodontology
ADN Acide désoxyribonucléique
ARN Acide ribonucléique
BANA Benzoyl-DL-arginine-naphthylamide
b.i.d. Bis in die (2 fois par jour)
CERUL Comité d’éthique de la recherche avec des êtres humains de l’Université Laval ELISA Enzyme linked immunosorbent assay
g Gramme Ig G Immunoglobuline G Ig M Immunoglobuline M mg Milligramme mL Millilitre mm Millimètre
PCR Polymerase chain reaction
VIH Virus de l’immunodéficience humaine
q.d. Quaque die (chaque jour)
stat Statum (immédiatement);
t.i.d. Ter in die (3 fois par jour).
% Pour cent
Remerciements
À tous les professeurs, les résidents, les membres du personnel de l’Université Laval et les amis qui ont contribué de près ou de loin à l’accomplissement de ce mémoire, je vous remercie grandement et je vous présente toute ma gratitude.
Je tiens particulièrement à exprimer ma reconnaissance envers mon directeur de mémoire Dr Daniel Grenier et mon codirecteur Dr Reginaldo Bruno Gonçalves. Je vous remercie de m’avoir guidé, aidé et conseillé tout au long de la réalisation de ce projet. Vous avez été d’une aide précieuse et vous avez grandement contribué au développement de mes connaissances. J’aimerais aussi remercier Dre Renée Gendron, membre de mon comité d’encadrement, pour sa générosité, sa disponibilité et ses nombreux conseils judicieux. Par la suite, je désire exprimer mes remerciements à Dr Luc Giasson, directeur du programme de maîtrise en sciences dentaires, de m’avoir permis d’acquérir une telle rigueur scientifique par l’entremise de toutes les notions enseignées et tous les conseils partagés. Je tiens aussi à souligner l’implication et l’excellent travail de Mme Hélène Crépeau, statisticienne au service de consultation statistique de l’Université Laval, dans la réalisation de ce projet.
Ensuite, j’aimerais exprimer mes plus sincères remerciements à toute ma famille. Tout au long de mon cheminement scolaire, vous m’avez épaulé et encouragé à réaliser mes rêves. Je désire remercier, plus particulièrement, mes très chers parents, Johanne et Alain, pour leur soutien éternel et leur grande écoute, mais également leurs nombreux conseils. Vous m’avez toujours poussé à aller de l’avant et m’accomplir davantage tant au plan personnel que professionnel. Je vous en suis extrêmement reconnaissante.
Finalement, j’aimerais témoigner toute ma reconnaissance envers Pier-Mathieu pour son soutien inconditionnel, son écoute attentionnée, ses encouragements et son dévouement extraordinaire au cours des dernières années. Sans ta présence à mes côtés, la réalisation de ce projet aurait été encore plus ardue. Tu m’as réellement donné la force de mener ce mémoire à terme. En fait, ces mots ne suffisent même pas pour t’exprimer toute ma reconnaissance. Merci infiniment, mon amour, de toujours me soutenir et m’épauler dans la réalisation de mes rêves.
Introduction
La parodontite est une maladie inflammatoire des tissus de support des dents. Celle-ci entraîne une destruction du ligament parodontal ainsi que du support osseux. Cette condition est occasionnée par divers microorganismes qui prennent une organisation particulière dans l’environnement buccal, mieux connue sous le nom de biofilm. Cette structure tridimensionnelle particulière des bactéries contribue grandement au développement d’une microflore parodontopathogène et justifie l’importance de la thérapie mécanique dans les traitements parodontaux afin de désorganiser cette structure. Le biofilm joue plusieurs rôles importants pour les bactéries, dont sa contribution au phénomène de résistance microbienne. En effet, certaines bactéries parodontopathogènes sont plus résistantes que d’autres aux traitements parodontaux. De ce fait, l’utilisation d’un antibiotique représente un adjuvant thérapeutique intéressant à la thérapie parodontale dans certaines conditions cliniques particulières. L’antibiothérapie utilisée en parodontie peut être sous forme locale ou systémique. Chacune des voies d’administration comporte ses avantages et ses désavantages. Divers agents thérapeutiques sont actuellement disponibles sur le marché. Il devient donc difficile pour le clinicien de déterminer ceux ayant réellement un effet cliniquement significatif. Afin de guider le clinicien dans son choix d’antibiothérapie, il peut s’avérer pertinent d’effectuer un test diagnostique microbien. Les différents types de tests varient en fonction du type de biomarqueurs qu’ils tentent de mettre en évidence. Ces tests peuvent également être utilisés afin de confirmer le diagnostic parodontal et ainsi, guider le clinicien dans son choix de thérapie parodontale et déterminer si une antibiothérapie serait favorable.
Afin de comprendre l’utilité des antibiotiques en parodontie, il est important de connaître la composition microbienne des diverses conditions parodontales. L’aspect microbiologique de la parodontie sera donc décrit dans la section suivante. Après l’acquisition de ces connaissances, il sera possible de discuter de diverses conditions parodontales fréquemment rencontrées et qui nécessitent parfois l’utilisation d’un adjuvant thérapeutique. De plus, certains facteurs de risque pour la maladie parodontale seront détaillés. Par la suite, les divers tests diagnostiques microbiens seront décrits afin d’illustrer les différentes techniques pouvant être utilisées par les parodontistes. Cette description permettra également de mettre en lumière les avantages et désavantages de chacun, ce qui pourrait justifier la popularité ou le manque de popularité de certains de ces tests. Le recours à ces tests peut être utile afin de déterminer la nécessité
d’une antibiothérapie, mais également le type d’antibiotique à privilégier. Les différentes antibiothérapies utilisées en thérapie parodontale seront alors présentées. Par la suite, la résistance microbienne aux agents thérapeutiques sera discutée. En effet, cette problématique grandissante justifie la prudence que les professionnels de la santé doivent avoir quant à la prescription d’antibiotiques afin d’éviter leur surutilisation. Finalement, les questionnaires de recherche seront discutés davatange afin de comprendre la pertinence de cet outil de collecte de données.
1. État des connaissances
1.1. Bactéries parodontopathogènes et biofilm
L’environnement buccal est un site propice pour la colonisation bactérienne. En effet, il s’agit d’une niche écologique comportant plus de 500 espèces microbiennes. [1] Étant donné la complexité de la microflore
microbienne sous-gingivale, Socransky et coll. [2] ont divisé les principaux pathogènes en 5 complexes
(rouge, orange, vert, jaune et mauve). Le complexe rouge comprend Porphyromonas gingivalis, Tannerella
forsythia et Treponema denticola. Le complexe orange comprend Fusobacterium nucleatum et ses
sous-espèces, Prevotella intermedia, Prevotella nigrescens et Peptostreptococcus micros. Il existe une très forte association entre la présence des espèces du complexe rouge et la présence d’une poche parodontale profonde. Ces espèces sont également associées à un saignement au sondage. D’ailleurs, il est intéressant de constater que P. gingivalis, T. forsythia et T. denticola sont fréquemment retrouvées au sein de la même poche parodontale. [2] Les espèces de ce groupe sont d’ailleurs reconnues pour s’échanger
des facteurs de croissance. [3] Les espèces du complexe orange sont également associées à
l’augmentation de la profondeur de poche, mais d’une façon moindre que celles du groupe rouge. [2]
Aggregatibacter actinomycetemcomitans sérotype b, n’appartenant à aucun complexe, est associé à la
parodontite agressive. [2,4,5] Il est intéressant de constater qu’il existe une interaction entre certains
complexes. Effectivement, le complexe rouge est fréquemment observé en présence du complexe orange. Donc, effectuer un traitement pour éliminer le complexe orange pourrait prévenir la recolonisation du complexe rouge. Toutefois, cette association n’est pas présente pour A. actinomycetemcomitans. Donc, un traitement visant à réduire les microorganismes du groupe rouge et orange peut être inefficace pour l’élimination d’A. actinomycetemcomitans. [2]
Une connaissance de la flore microbienne de la plaque sous-gingivale aide à établir un diagnostic parodontal, mais également à orienter le traitement adéquat. Les bactéries causant la maladie parodontale correspondent bien souvent à des bactéries endogènes, c'est-à-dire des composantes de la flore buccale normale. Il est donc permis de dire que la maladie parodontale correspond fréquemment à une infection opportuniste. [6] La majorité des bactéries parodontopathogènes retrouvées dans la plaque sous-gingivale
sont également retrouvées. Il s'agit principalement de spirochètes et bâtonnets à Gram négatif. [7] Les
bactéries parodontopathogènes les plus communes sont P. gingivalis, A. actinomycetemcomitans, T. forsythia, P. intermedia et T. denticola. [8] La microflore sous-gingivale varie quantitativement et
qualitativement selon la condition parodontale. Une proportion importante de bâtonnets motiles et de spirochètes est associée à une parodontite active alors qu'un site avec un nombre élevé de coques à Gram positif correspond à un site parodontal sain. [7]
Les bactéries parodontopathogènes participent de différentes façons aux infections parodontales, et ce, à l’aide de divers mécanismes pathogéniques. Par exemple, P. gingivalis produit plusieurs protéinases, dont certaines ont la capacité à dégrader les immunoglobulines de l’hôte dirigées contre des composantes de la surface cellulaire des microorganismes. [9] P. gingivalis possède aussi la capacité d’envahir et se répliquer à
l’intérieur des cellules de l’hôte. [10] De plus, ce microorganisme renferme des endotoxines dans sa
membrane cellulaire; il s’agit des lipopolysaccharides (LPS) qui jouent un rôle important dans la destruction parodontale. [11] La bactérie A. actinomycetemcomitans possède tout autant de mécanismes destructeurs.
En effet, elle adhère fermement aux tissus, produit plusieurs bactériocines et développe rapidement une résistance aux antibiotiques. A. actinomycetemcomitans sécrète également une leucotoxine qui détruit les neutrophiles et les macrophages de l’hôte. [12] Ces deux bactéries parodontopathogènes jouent un rôle
important dans le développement et la progression des maladies parodontales, cependant, elles ne constituent pas nécessairement les bactéries les plus virulentes de la flore sous-microbienne. [13]
Les bactéries retrouvées dans l’environnement buccal ont une organisation particulière. [14] En effet, les
différentes espèces se retrouvent dans un biofilm. Le biofilm est une structure complexe qui joue divers rôles. Il permet notamment l’apport adéquat des nutriments, l’élimination des produits métaboliques nocifs, la création d’un environnement physicochimique adéquat pour les microorganismes ainsi que la protection des agents pathogènes contre les mécanismes de défense de l’hôte et les antibiotiques. [15] Les bactéries
présentes au sein d’un biofilm sont plus résistantes aux antibiotiques que celles retrouvées sous forme planctonique. Cette résistance peut atteindre jusqu’à 1000 fois pour certaines espèces. [16] Les bactéries
parodontopathogènes P. gingivalis et A. actinomycetemcomitans démontrent une grande résistance aux antibiotiques lorsque présentes au sein d’un biofilm. [17–19]La structure du biofilm limite la pénétration des
agents antimicrobiens. De plus, la matrice du biofilm peut contenir des enzymes, tels des bêta-lactamases, à des concentrations pouvant inactiver un antibiotique de la classe bêta-lactame. Cependant, le rôle
protecteur du biofilm face aux antibiotiques dépend de plusieurs facteurs, c’est-à-dire la nature de l’agent, la capacité de l’agent à se lier au biofilm ainsi que la concentration atteinte par l’agent thérapeutique. [20] De
plus, la concentration bactérienne élevée au sein du biofilm facilite la communication entre les bactéries. Cette communication peut influencer la structure du biofilm ainsi que sa composition microbienne. De plus, cela favorise grandement l’échange de matériel génétique entre les bactéries. [15] En considérant tous les
rôles protecteurs du biofilm, il s’avère primordial de désorganiser cette structure avec une thérapie parodontale non chirurgicale avant de prescrire une antibiothérapie en parodontie afin de maximiser les résultats. [14]
1.2. Maladies parodontales
La présence de bactéries parodontopathogènes au niveau du sillon gingival est requise pour le développement et l'évolution de la maladie parodontale. [6] Toutefois, il est possible d’observer la présence
des bactéries parodontopathogènes pour une longue période chez un patient avec une condition parodontale saine, suggérant ainsi que ces microorganismes font partie de la flore microbienne normale. Les maladies parodontales se développent lorsqu’il y a un déséquilibre de l’homéostasie entre les défenses de l’hôte et ces microorganismes. [13] De plus, certains facteurs augmentent la susceptibilité de l’hôte à
développer une maladie parodontale. Parmi ces facteurs, mentionnons entre autre le stress, le tabagisme, la présence d’une hygiène inadéquate, une immunodéficience, une maladie génétique ou bien un trait génétique prédisposant à la maladie parodontale. La parodontite est donc une condition multifactorielle. [6]
Bien qu’une nouvelle classification des conditions et maladies parodontales a été publiée à l’été 2018 par Caton et coll. [21], seuls les diagnostics de la classification d’Armitage [22] seront présentés puisqu’il s’agissait
de ceux utilisés par les parodontistes lors de la collecte de données de ce projet.
1.2.1. Parodontite chronique
La parodontite chronique se définit comme étant une inflammation de la gencive qui se propage dans l’appareil de soutien de la dent. Cette inflammation mène à une destruction du ligament parodontal et du support osseux. Cette destruction se traduit par une perte d’attache clinique. Il s’agit de la maladie parodontale la plus fréquente chez l’adulte. Cependant, la parodontite chronique peut être observée à
n’importe quel âge, soit autant au niveau de la dentition primaire que permanente. La progression de la parodontite chronique est habituellement lente à modérée, mais il possible d’observer des périodes d’exacerbation de la maladie menant à une destruction rapide. [23] L’étendue et la sévérité de l’atteinte de la
condition sont grandement variables d’un individu à un autre.
En se basant sur le système de classification d’Armitage [22] établi en 1999, une parodontite est caractérisée
comme étant généralisée lorsque plus de 30 % des sites en bouche démontrent une perte d’attache clinique. Dans la situation inverse, soit une atteinte de 30 % et moins, il s’agit d’une parodontite localisée. La perte d’attache clinique est la valeur permettant de déterminer la sévérité de l’atteinte de la condition parodontale. En présence d’une perte d’attache clinique de 1 ou 2 mm, il s’agit d’une parodontite chronique légère. Si la perte d’attache clinique est de 3 ou 4 mm, le diagnostic d’une parodontite chronique modérée pourra être émis. Une perte d’attache de 5 mm et plus est considérée comme une atteinte sévère. [22]
1.2.2. Parodontite agressive
La parodontite agressive se distingue des autres types de parodontite par ses caractéristiques particulières. En fait, cette condition se caractérise par une progression rapide de la maladie et la quantité de dépôt microbien est, bien souvent, faible considérant la destruction parodontale présente. De plus, la tendance à observer une agrégation familiale a également été rapportée. [24]
La parodontite agressive peut être localisée ou généralisée. Une parodontite agressive localisée débute habituellement au moment de la puberté et se présente au niveau des premières molaires. La parodontite agressive généralisée est, pour sa part, couramment retrouvée chez les adultes de moins de 30 ans, quoiqu’il est possible de la diagnostiquer chez des personnes plus âgées. La perte d’attache se retrouve au niveau d’au moins 3 dents permanentes autres que les premières molaires et les incisives. La parodontite agressive, autant locale que généralisée, est fréquemment associée à la présence de la bactérie parodontopathogène A. actinomycetemcomitans (sérotype b) et à une dysfonction des neutrophiles. [24]
Toutefois, certains individus avec une parodontite agressive ne démontrent pas un résultat positif pour ce microorganisme. [13] Contrairement à la parodontite agressive généralisée, la parodontite localisée est,
parodontopathogènes. [24]
1.2.3. Parodontite réfractaire
Le terme parodontite réfractaire ne décrit pas une seule condition parodontale en tant que telle, mais se réfère plutôt aux conditions parodontales qui continuent de démontrer une perte d’attache à un ou plusieurs sites malgré une thérapie parodontale adéquate et une phase de maintien respectée. [25,26] Autant une
parodontite chronique qu’agressive peuvent être dites réfractaires. Ce diagnostic est établi après avoir complété une thérapie initiale adéquate. Il n’est pas possible de conclure qu’une parodontite est réfractaire si la thérapie initiale n’a pas été accomplie ou bien en présence d’une condition systémique justifiant la suspectibilité aux infections parodontales, tels le diabète ou la grossesse. [26]
Une parodontite réfractaire survient lorsque la thérapie mécanique n’a pas permis d’éliminer ou réduire suffisamment les bactéries parodontopathogènes ou suite à une réinfection par des pathogènes opportunistes. De plus, différents facteurs, bien souvent inconnus, peuvent également compromettre la réponse immunitaire de l’hôte suite à la thérapie initiale. [26]
1.2.4. Maladies parodontales nécrosantes
La gingivite ulcéro-nécrosante, la parodontite ulcéro-nécrosante et la stomatite nécrosante se regroupent sous le terme de maladies parodontales nécrosantes puisque ces conditions partagent plusieurs caractéristiques similaires, tels que l’étiologie, les signes cliniques et les traitements. Il s’agit de conditions inflammatoires sévères. De ce fait, il est important de les diagnostiquer et traiter rapidement puisque leur progression est rapide. [27] Seules la gingivite et la parodontite ulcéro-nécrosantes seront discutées dans la
section suivante.
La gingivite ulcéro-nécrosante n’affecte que les tissus gingivaux, principalement la gencive interdentaire et marginale, alors que la parodontite ulcéro-nécrosante entraîne une perte d’attache puisque le processus inflammatoire progresse au niveau du ligament parodontal et de l’os alvéolaire. [27,28] Le diagnostic de ces
maladies parodontales se base principalement sur la présentation clinique de la maladie. [27] Les
trois caractéristiques cliniques requises pour le diagnostic de la gingivite ulcéro-nécrosante sont la douleur, la nécrose des papilles interdentaires et le saignement spontané. En absence de l’un de ces signes cliniques, le diagnostic de gingivite ulcéro-nécrosante ne peut être posé. [28] En absence d’une maladie
systémique ou d’une immunodéficience, la parodontite ulcéro-nécrosante présente les mêmes caractéristiques cliniques que la gingivite ulcéro-nécrosante. Cependant, la parodontite est accompagnée d’une perte d’attache clinique et une perte osseuse. [29]
Une réponse immunitaire compromise est critique pour la pathogenèse des maladies parodontales nécrosantes. Ces conditions parodontales sont beaucoup plus fréquentes chez les patients atteints du virus de l’immunodéficience humaire (VIH). Le VIH est relié à une progression plus rapide et sévère des maladies parodontales nécrosantes. La réponse au traitement est également inférieure chez ces patients. [30] En absence du VIH, les facteurs les plus fréquemment associés à ce type de conditions sont
une hygiène buccale pauvre, un manque de sommeil, un stress important, une malnutrition, une maladie systémique, la consommation d’alcool et le tabagisme. [27–29] Bref, toutes les conditions pouvant altérer le
système de l’hôte peuvent contribuer au développement d’une maladie parodontale nécrosante. [27]
Étant donné la progression rapide et la destruction importante associées à ces conditions, il est important de procéder à une prise en charge adéquate et efficace des patients. Des résultats favorables peuvent être obtenus avec des mesures d’hygiène buccale efficaces, un traitement parodontal adéquat et un contrôle des facteurs de risque. D’ailleurs, en présence d’une réponse inadéquate au traitement de la phase aiguë ou bien en présence de signes systémiques, l’ajout d’une antibiothérapie peut être recommandé. [27] Dans
le cas d’une gingivite ulcéro-nécrosante, les signes et symptômes disparaissent en quelques jours. Toutefois, ces patients demeurent à risque de récidive et parfois, une gingivite ulcéro-nécrosante peut progresser en une parodontite ulcéro-nécrosante. [27,28]
1.2.5. Abcès du parodonte
Il existe différents types d’abcès au niveau du parodonte. Plus spécifiquement, il est possible d’avoir un abcès gingival, parodontal, péricoronaire et périapical. [27] Il est bien important de faire une distinction entre
les abcès d’origine dentaire et parodontale puisque la source de l’infection influencera le traitement. [31]
Seuls les abcès parodontaux seront détaillés dans la section qui suit.
Un abcès parodontal constitue une condition fréquente pouvant mener à une destruction rapide des tissus parodontaux. [31] Il s’agit plus précisément d’une infection purulente localisée au niveau des structures
parodontales telles que les poches parodontales, les furcations et les défauts osseux verticaux. [27,31] Un
abcès parodontal peut se produire au niveau de sites atteints d’une parodontite ou parodontalement sains. [27,31] Les abcès parodontaux en présence d’une parodontite peuvent se produire à différents
moments, soit lorsque la parodontite est non traitée, durant les traitements parodontaux, lors d’une parodontite réfractaire ou bien pendant la phase de maintien. Pour ce qui est des abcès parodontaux en absence d’une condition parodontale sous-jacente, il existe diverses étiologies telles que l’impaction d’un corps étranger, la perforation de la dent suite à un traitement de canal, l’infection d’un kyste latéral ou bien la présence de facteurs locaux affectant la morphologie radiculaire et prédisposant à développer des abcès. [31] De plus, un abcès parodontal peut être aigu ou chronique. Un abcès aigu sera symptomatique
alors qu’un abcès chronique sera, dans la plupart des cas, asymptomatique. Cependant, un abcès parodontal aigu peut devenir chronique si le drainage se fait par une fistule ou par le sulcus. Il en est de même pour un abcès chronique qui peut avoir une exacerbation aiguë. Le nombre d’abcès parodontaux en bouche peut guider le clinicien pour identifier la cause de cette condition. En effet, un abcès parodontal solitaire est bien souvent causé par un facteur local qui entraine la fermeture de la poche parodontale rendant ainsi, le drainage de l’abcès impossible. Toutefois, plusieurs abcès peuvent être présents chez des patients avec un diabète non contrôlé, médicalement compromis ou avec une parodontite non traitée ayant reçu un traitement d’antibiotique systémique pour une cause autre que dentaire. [27,31] La dernière situation
pourrait être expliquée par le fait que la prise d’antibiotique modifie la flore sous-gingivale conduisant à une surinfection. [31]
Puisque la présence d’un abcès peut diminuer le pronostic d’une dent et mener à son extraction, il est important d’intervenir rapidement afin de limiter la progression de la maladie. [27,31] Toutefois, il est d’autant
plus important d’effectuer les traitements requis dans un court délai afin de diminuer le risque de propagation de l’infection dans les sites extrabuccaux. [31] Le traitement d’un abcès parodontal aigu doit
débuter par la gestion de la phase aiguë afin de réduire les symptômes et limiter la destruction parodontale. Il est donc favorable de débuter par un drainage et un débridement de la région. Ensuite, il est important
d’évaluer la nécessité de prescrire des antibiotiques en fonction des signes locaux et systémiques. Pour les abcès chroniques, il est également possible d’envisager une approche chirurgicale. Ce traitement s’effectue principalement au niveau de défauts verticaux afin d’obtenir un meilleur accès. Cependant, si le pronostic de la dent atteinte est sans espoir, l’extraction doit être favorisée. Lorsque la phase aiguë est contrôlée, il sera alors possible de traiter la condition sous-jacente. Puisque la majorité des abcès parodontaux se présentent chez des patients atteints de parodontite non traitée, une prise en charge parodontale est souvent requise. [27]
1.2.6. Parodontite associée à une lésion endodontique
Le parodonte et le système endo-canalaire sont intimement reliés ce qui fait en sorte qu’une atteinte pulpaire peut avoir des répercussions au niveau du parodonte. [32] Les deux structures sont connectées
entre elles par le foramen apical, les canaux accessoires et les tubuli dentinaires. Cette communication peut également être établie suite à une perforation d’un traitement de canal ou une fracture verticale radiculaire. De plus, une lésion avec une atteinte parodontale et endodontique peut avoir une origine primaire endodontique, parodontale ou mixte. Une origine mixte signifie qu’il y a la présence d’une lésion parodontale et endodontique qui évoluent, de façon indépendante, au niveau de la même dent. La similarité au niveau de la flore microbienne rend possible ces infections croisées entre le parodonte et le système endo-canalaire. [33]
Une lésion avec une origine primaire endodontique correspond à une lésion périapicale chronique d’une dent nécrosée. Cette infection chronique peut se drainer dans le sulcus gingival et ainsi, ressembler cliniquement à un abcès parodontal. Toutefois, ce type de lésion se résorbe suite à un traitement de canal adéquat. Une lésion avec une origine primaire parodontale se produit principalement dans les cas de parodontite chronique. Contrairement à la lésion avec une origine primaire endodontique, la dent atteinte sera vitale et il y aura présence de plaque ou tartre. Ce type de lésion nécessite seulement une thérapie parodontale. Il existe 3 types de lésions combinées, soient une lésion endodontique avec une implication parodontale, une lésion parodontale avec une implication endodontique ou bien une vraie lésion combinée. [32] Dans le cas d’une lésion endodontique avec une implication parodontale, la lésion périapicale
parodonte varient en fonction de la charge microbienne dans le système endo-canalaire et la durée depuis laquelle les tissus périapicaux sont en contact avec les microorganismes. [33] Ce type de lésion peut
également se développer suite à une perforation lors d’un traitement de canal. Le traitement de ce type de lésion débute avec un traitement de canal. [32,33] Ensuite, il est recommandé d’attendre 2 à 3 mois avant de
réévaluer la condition parodontale et déterminer la thérapie parodontale requise. Dans le cas d’une lésion parodontale avec une implication endodontique, la pulpe devient nécrotique suite à la progression apicale de la condition parodontale qui produit alors la contamination des canaux latéraux ou du foramen apical. [32]
Cependant, l’effet de la parodontite sur la vitalité de la pulpe demeure controversé dans la littérature puisque certains rapportent que si le rapport sanguin à l’apex demeure intact, la pulpe pourrait survivre malgré l’invasion des canaux latéraux par certaines bactéries. [32,33] Finalement, une vraie lésion combinée
correspond à la progression apicale de la maladie parodontale en même temps que la progression coronaire d’une infection endodontique. Celle-ci est plutôt rare. [32] La prise en charge de ce type de lésion
peut être difficile, mais elle doit toujours débuter avec le traitement de canal. [33] Pour une vraie lésion
combinée ainsi qu’une lésion parodontale avec une implication endodontique, une thérapie endodontique et parodontale sont requises. Le pronostic des dents impliquées dans ce type de lésion varie principalement en fonction de l’atteinte parodontale. [32]
1.3. Facteurs de risque
Comme mentionné précédemment, certains facteurs génétiques et environnementaux mettent plus à risque une personne de développer une maladie parodontale. Parmi les facteurs de risque communs, il y a le tabagisme, le VIH, la nutrition, l’ostéoporose, le diabète, le stress et une réponse immunitaire altérée. [34]
Dans la section suivante, le lien entre la parodontite et le diabète ainsi que celui avec le tabagisme sera approfondi davantage.
1.3.1. Diabète
Dans la littérature, une association significative a bien été documentée entre le diabète et la parodontite. Bien que les évidences scientifiques discutent principalement des effets du diabète de type 2 sur le parodonte, le diabète de type 1 semble avoir des effets similaires sur les tissus parodontaux. [35] En fait, le
niveau de contrôle du diabète, plus précisément de la glycémie, influence l’atteinte et la sévérité de la parodontite. Cela dit, un patient diabétique avec une glycémie mal contrôlée est plus à risque de développer une parodontite qu’un patient non-diabétique. Cependant, un patient avec un diabète bien contrôlé n’est pas plus à risque de développer une maladie parodontale qu’un patient non-diabétique. [36]
Les études démontrent que l’hyperglycémie augmente la réponse inflammatoire dans les tissus parodontaux. Ceci induit alors plusieurs changements au niveau des leucocytes, des fibroblastes, des ostéoclastes et des cytokines pro-inflammatoires. Toutefois, l’effet du diabète sur la flore microbienne demeure encore controversé dans la littérature. [37] Pour ce qui est de la réponse aux traitements
parodontaux, les patients avec un diabète bien contrôlé obtiennent des résultats similaires aux patients non-diabétiques suite à une thérapie non chirurgicale. [38] Cependant, en ce qui concerne les patients avec
un mauvais contrôle glycémique, il est possible de s’attendre à ce que ces derniers démontrent des résultats moins stables à long terme. [39] Donc, tous ces éléments doivent être tenus en compte dans la
prise en charge d’un patient diabétique atteint d’une maladie parodontale.
1.3.2. Tabagisme
Selon une étude épidémiologique réalisée sur les données collectées entre 1988-1996 à l’aide du National
Health and Nutrition Examination Survey, environ 50 % des cas de parodontite aux États-Unis sont
directement attribuables aux fumeurs et ex-fumeurs. De plus, les fumeurs sont 4 fois plus à risque de développer une parodontite comparativement aux non-fumeurs. [40] La réponse immunitaire des patients
fumeurs est altérée et cela explique leur atteinte parodontale. Par exemple, il a été démontré que la consommation tabagique altère la fonction des neutrophiles. [41] De plus, le tabagisme diminue les résultats
obtenus après une thérapie parodontale non chirurgicale et chirurgicale. [42,43] Le tabagisme constitue donc
un facteur de risque important à prendre en considération dans la prise en charge des patients atteints de parodontite.
1.4. Thérapie parodontale non chirurgicale
La thérapie parodontale a pour but d’éliminer les bactéries parodontopathogènes, mais également de contrôler les facteurs de risque qui contribuent à la maladie parodontale. De plus, il ne faut pas négliger
l’importance du contrôle de la plaque dentaire et ainsi, effectuer une révision des instructions d’hygiène avec les patients avant de commencer la thérapie mécanique, c’est-à-dire l’instrumentation. Cela constitue des étapes importantes à la thérapie parodontale non chirurgicale. [23,44]
L’objectif principal de l'instrumentation, manuelle ou ultrasonique, est de réduire la quantité de plaque et tartre ainsi que de désorganiser le biofilm afin de permettre un équilibre entre la flore microbienne et la réponse immunitaire de l’hôte. Une thérapie parodontale est efficace lorsqu'elle permet de réduire ou éliminer suffisamment les bactéries parodontopathogènes. [45] Cependant, il s’avère quasiment impossible
d’éliminer complètement toutes les bactéries parodontopathogènes avec ce traitement. L'accessibilité peut limiter l'efficacité du surfaçage particulièrement au niveau des poches parodontales profondes et des furcations. [46] De plus, certaines bactéries parodontopathogènes sont plus résistantes à la thérapie
initiale. [6,47] En effet, P. gingivalis et A. actinomycetemcomitans sont difficiles à éliminer malgré un
surfaçage adéquat étant donné leur capacité à envahir les tissus parodontaux. [47] D’ailleurs, une relation
directe a été établie entre la présence de P. gingivalis et le nombre de poches parodontales résiduelles de plus de 4 mm suite à la thérapie mécanique. [48] Des conclusions similaires ont également été établies avec
la persistance d’A. actinomycetemcomitans et un gain d'attache clinique moindre suite aux surfaçages. [49]
1.5. Tests diagnostiques microbiens
L’utilisation de l’information microbiologique en thérapie parodontale s’avère utile pour déterminer le ou les agents causaux, établir le niveau d'activité de la maladie, évaluer le résultat du traitement et décider la fréquence des suivis parodontaux. [7] De plus, selon les espèces bactériennes présentes, il est possible de
déterminer si une antibiothérapie est requise. En effet, en présence d’A. actinomycetemcomitans, il peut être recommandé d’ajouter une antibiothérapie à la thérapie mécanique. [7,50] Un test microbien permet
également de vérifier l’efficacité de la thérapie parodontale initiale, c’est-à-dire la réduction ou l’élimination complète des bactéries parodontopathogènes. Le moment auquel les tests diagnostiques peuvent être utilisés varie en fonction de la condition parodontale. Chez les patients avec une parodontite agressive, il peut être pertinent de faire le test microbien avant d'initier les traitements parodontaux alors que pour les patients avec une parodontite réfractaire, l'échantillonnage peut être fait à la réévaluation. [6] Finalement, les
tests diagnostiques permettent de sélectionner l'antibiotique optimal selon la susceptibilité aux agents antimicrobiens des bactéries identifiées. [50]
Les tests diagnostiques peuvent donc représenter un outil intéressant à utiliser dans la pratique d’un parodontiste. Les tests varient en fonction du type de biomarqueurs qu’ils tentent de mettre en évidence. Il est possible d’utiliser les biomarqueurs microbiologiques, immunitaires et inflammatoires. Ces divers biomarqueurs peuvent être présents dans la plaque sous-gingivale, le liquide créviculaire et la salive. Quoique plusieurs tests soient actuellement disponibles sur le marché, les recherches continuent afin de développer des outils diagnostiques avec une plus grande sensibilité et spécificité afin de permettre au clinicien d’avoir une certaine prévisibilité dans ses traitements. [51]
1.5.1. Microscopie bactérienne
La microscopie à contraste de phase permet d’examiner directement les échantillons de plaque dentaire obtenus de la poche parodontale. Il s’agit donc d’une technique rapide et peu dispendieuse. [6] Elle permet
de visualiser la forme et la motilité des bactéries présentes dans la plaque sous-gingivale. Cependant, elle ne permet pas de spécifier le type exact de microorganismes retrouvés ni de connaître la susceptibilité aux antibiotiques. [8,52] Par contre, la microscopie à contraste de phase peut également être utilisée pour motiver
les patients à acquérir et maintenir de bonnes habitudes d’hygiène bucco-dentaire puisqu’elle permet de montrer à ces derniers ce qu’il est possible de retrouver dans leur bouche. [53]
1.5.2. Culture bactérienne
La culture bactérienne permet d'analyser des échantillons pour la présence d’une grande variété d'espèces microbiennes. [52] Il s'agit de la technique de base auxquels les nouvelles techniques sont comparées afin
d'évaluer leur sensibilité. [50] Pour effectuer une culture bactérienne, il est nécessaire d'obtenir un
échantillon de plaque sous-gingivale. Cette étape est habituellement réalisée avec une pointe de papier ou à l’aide d’une curette stérile. Cet échantillon est alors placé dans un milieu de transport adéquat et est acheminé dans un laboratoire de microbiologie, et ce, dans les plus brefs délais pour éviter la perte de viabilité des bactéries, qui sont pour la plupart des bactéries anaérobies strictes. La culture des bactéries s’effectue sur des milieux de croissance sélectifs et non sélectifs. Il est alors possible d'identifier les espèces bactériennes et tester leur sensibilité aux antibiotiques. La limitation principale de cette technique
est que toutes les bactéries viables de la plaque sous-gingivale ne sont pas facilement cultivables. Malgré le fait que les milieux de culture soient non sélectifs, il demeure que ces milieux possèdent des pressions sélectives et que cela ne permet pas la croissance de tous les microorganismes tels les spirochètes. [52]
Ainsi, le compte des bactéries cultivées peut différer des bactéries réellement retrouvées dans la poche parodontale. [8] De plus, il s’agit d’une technique onéreuse et longue. [50]
1.5.3. Test immunologique
Les tests immunologiques se basent sur le concept que les bactéries sont identifiées à l'aide d'anticorps hautement spécifiques qui vont se lier à des antigènes spécifiques à une espèce bactérienne particulière. [52] Ces tests utilisent les techniques d'immunofluorescence et « enzymed linked
immunosorbent assay » ( ELISA ) afin d'identifier et quantifier les espèces bactériennes présentes dans la
plaque sous-gingivale. [8] Il s'agit d'une technique rapide et peu coûteuse qui est efficace pour détecter
autant les bactéries viables que mortes. Il s'agit d'une technique simple pouvant être standardisée sous la forme de trousses qui peuvent être utilisées à la chaise. [50] Cependant, il s'agit d'une technique qui permet
d'identifier spécifiquement les microorganismes recherchés. [50,52] Des contrôles négatifs et positifs sont
nécessaires pour pouvoir interpréter les résultats du test. La détection des microorganismes non viables peut s’avérer un désavantage surtout lorsque le test immunologique est effectué après la thérapie parodontale initiale ou bien suite à une antibiothérapie. [50]
1.5.4. Sonde à ADN
Les sondes à ADN ont été développées pour identifier les séquences d'acides nucléiques spécifiques à une espèce bactérienne. Les sondes sont capables de détecter la présence d'aussi peu que 103 cellules et
procurer des informations quant à la présence d'espèces précises. [52] Il s’agit d’une technique avec une
sensibilité importante. [8] La vitalité des bactéries n’est pas requise pour permettre leur identification avec ce
type de test. Donc, les échantillons peuvent subir plusieurs traitements sans que cela affecte les résultats obtenus. [50] Toutefois, cette technique peut être sujette à des problèmes de spécificité et peut être limitée
par le nombre de sondes à ADN disponibles. Il est donc possible qu'une bactérie se retrouve en grande quantité dans un échantillon, mais qu'elle ne soit pas détectée étant donné qu'elle n'est pas spécifiquement
recherchée. [52] Le test d’identification microbienne Affirm DP (MicroProbe Co., Bothell, Washington,
États-Unis) est un appareil semi-automatique basé sur l’utilisation de sondes d’ADN. Il permet la détection de
P. gingivalis, A. actinomycetemcomitans, T. forsythia, P. intermedia et T. denticola dans les échantillons de
plaque prélevés avec une pointe de papier et ce, en moins de 40 minutes. [8] Les sondes à ADN
manufacturés par BTD (BioTechnica Diagnostics Inc., Cambridge, Massachussetts, États-Unis) peuvent également être utilisées directement sur des échantillons de plaque. Toutefois, l’analyse s’effectue dans un laboratoire spécialisé ce qui permet l'utilisation de diverses sondes et ainsi, permet l'identification d'un plus grand nombre d'espèces bactériennes. [8]
1.5.5. Réaction de polymérisation en chaîne conventionnelle ou
quantitative
La technique de la réaction de polymérisation en chaîne, mieux connue sous l’abréviation PCR, est basée sur l'identification d'une séquence d'ADN cible, soit l’ARN ribosomique 16S qui correspond à une composante de la sous-unité 30S du ribosome des bactéries. [54] Il n'y a aucun délai à respecter entre
l'échantillonnage et l'analyse puisque l'ADN peut être détecté chez une bactérie viable ou morte. Elle permet d'obtenir rapidement les résultats. [6] Ce test diagnostique peut être qualitatif, soit confirmer la
présence d’une bactérie, ou quantitatif, c’est-à-dire déterminer le nombre de bactéries présentes. [55] La
réaction de polymérisation en chaîne est un outil moléculaire très performant pour identifier une bactérie. Cette technique utilise l’amplification et la détection des produits d’ADN en utilisant une amorce spécifique ou aléatoire. La réaction de polymérisation en chaîne permet d’identifier adéquatement, P. gingivalis, T. forsythia, T. denticola, F. nucleatum et A. actinomycetemcomitans. [8,54,56] D’ailleurs, il a été rapporté que
l’utilisation de la réaction de polymérisation en chaîne est plus précise que la technique de culture bactérienne pour mettre en évidence ces pathogènes et permet l'identification de bactéries non cultivables tels les spirochètes. Il s'agit donc d'une technique avec une sensibilité très élevée. Toutefois, il faut être vigilant puisque les acides nucléiques des bactéries mortes peuvent être également détectés et ainsi, fausser les résultats obtenus. [8] Cependant, il est impossible de vérifier la susceptibilité des bactéries
identifiées aux antibiotiques. [6] Un nouvel axe de recherche sur la réaction de polymérisation en chaîne
consiste à détecter la présence de gènes de résistance aux antibiotiques et ainsi, prévoir l’effet de l’antibiothérapie lors des traitements parodontaux. [8]
1.5.6. Test d'enzyme bactérienne
Une autre technique pour mettre en évidence les bactéries parodontopathogènes consiste à détecter une enzyme spécifique à une ou plusieurs espèces bactériennes. La technique consiste à exposer un échantillon de plaque à un substrat colorimétrique qui est hydrolysé seulement par une enzyme spécifique. Par exemple, le benzoyl-DL-arginine-naphthylamide (BANA) est hydrolysé seulement par la trypsine qui est produite principalementpar T. denticola, T. forsysthia et P. gingivalis. [57] Dans une étude de Grisi et coll. [58],
une relation statistiquement significative a pu être mise en évidence entre l’augmentation de la profondeur de poche et un test BANA positif. Il s'agit donc d'une aide intéressante pour les cliniciens dans le diagnostic et la gestion de la maladie parodontale. [58] Le test d'enzyme bactérienne est une technique non
dispendieuse, rapide et fiable pour mettre en évidence T. denticola, T. forsysthia ou P. gingivalis. [52]
Toutefois, un test BANA positif ne permet pas de déterminer laquelle de ces 3 bactéries parodontopathogènes est présente et ni les proportions relatives de chacune. [59] De plus, cette technique
ne permet pas de tester la susceptibilité du pathogène identifié aux antibiotiques. [6]
1.6. Antibiotiques
Comme expliqué précédemment, la thérapie initiale est parfois insuffisante pour contrôler la maladie parodontale ou éliminer complètement les bactéries parodontopathogènes retrouvées au fond des poches profondes, des tubuli dentinaires ou ayant envahi les tissus parodontaux. [46] L’antibiothérapie en parodontie
est donc un adjuvant thérapeutique intéressant dans plusieurs situations cliniques. L’antibiothérapie pour le traitement de maladie parodontale peut être locale ou systémique. Chacun de ces modes d’administration comporte ses avantages et désavantages.
Toutefois, pour qu’un antibiotique soit considéré sécuritaire et permette l’élimination de microorganismes pathogènes, celui-ci doit respecter certains critères: [14]
1) Les microorganismes doivent être susceptibles à l’agent utilisé. 2) L’agent doit être capable de pénétrer dans le site infecté.
3) Des concentrations adéquates de l’antibiotique doivent être atteintes et maintenues au niveau du site infecté.
4) L’agent doit avoir une faible toxicité pour l’hôte tout en ayant une toxicité sélective pour les microorganismes.
5) L’agent ne doit pas engendrer une résistance microbienne ou bien créer un déséquilibre au niveau de la flore normale du patient.
1.7. Antibiotiques locaux
Il existe plusieurs avantages à utiliser localement une antibiothérapie. Tout d’abord, l’utilisation locale d’un agent thérapeutique permet d’atteindre des sites inatteignables avec la voie systémique et rend possible l’utilisation d’agents pouvant être toxiques lorsqu’ils sont administrés par la voie orale. De plus, la compliance du patient n’est plus problématique et les effets secondaires sont grandement réduits comparativement à l’antibiothérapie systémique. [60,61] L’utilisation locale d’un antibiotique permet d’obtenir
une concentration excédant bien souvent 1 mg / ml, ce qui est bactéricide pour la plupart des bactéries. [62]
Toutefois, le défi premier de l’antibiothérapie est de maintenir cette concentration élevée suffisamment longtemps. En effet, un agent mis au niveau d’une poche parodontale lors d’une irrigation sous-gingivale est rapidement éliminé par le fluide créviculaire. Donc, pour contrer l’élimination rapide de l’agent thérapeutique, les antibiotiques locaux utilisés doivent avoir une libération prolongée. Le véhicule de libération de l’agent antimicrobien doit être physiquement stable pour une période appropriée. [61]
L’antibiothérapie locale semble bénéfique chez les patients avec une parodontite chronique sévère au niveau des sites ne répondant pas adéquatement à la thérapie mécanique. En effet, Bonito et coll. [63] ont
effectué une revue systématique en 2005 sur l'utilisation des adjuvants locaux antimicrobiens. Ils ont comparé les résultats cliniques obtenus suite à un surfaçage seul à ceux obtenus avec l'ajout d'un adjuvant antimicrobien local chez les patients avec une parodontite chronique. L'ajout d'un antibiotique local permet d'obtenir des résultats statistiquement significatifs quant à la réduction de la profondeur de poche et le gain d'attache clinique. [63] Par la suite, dans une revue de la littérature effectuée par Rovai et coll. [64] en 2016, il
locale lors du surfaçage au niveau des poches parodontales avec une profondeur initiale de 5 mm et plus. Une réduction de la profondeur de poche et un gain d'attache clinique plus importants sont observés en présence d'une thérapie initiale combinée avec un adjuvant antimicrobien local comparativement à un surfaçage seul. Cependant, cela est applicable pour les patients avec un suivi parodontal adéquat. [64] De
plus, selon une revue de la littérature effectuée par Chambrone et coll. [65] en 2016, les patients fumeurs
bénéficient de l'ajout d'un antibiotique local lors de la thérapie parodontale initiale. En effet, au niveau des poches parodontales avec une profondeur initiale de 5 mm et plus, une réduction additionnelle de la profondeur de poche de 0,81 mm et un gain d'attache supplémentaire de 0,91 mm ont été observés avec l'ajout d'une antibiothérapie locale. [65] Bien qu’il soit clairement démontré dans la littérature que l'ajout d'un
antibiotique local permet de réduire davantage la profondeur de poche et d’augmenter le gain d'attache, plusieurs auteurs soulèvent le questionnement à savoir si ces résultats sont cliniquement significatifs. [63,66]
1.7.1. Tétracycline (Actisite)
La tétracycline en application locale fut le premier système d’antibiothérapie locale utilisée. Les fibres parodontales Actisite (ALZA, Palo Alto, Californie, États-Unis) correspondent à un monofilament de copolymère de plastique inerte et non résorbable contenant de la poudre de tétracycline 25 %. La fibre est insérée dans la poche parodontale et laissée en place pour 7 à 12 jours. La tétracycline est libérée de façon continue et permet donc de maintenir des concentrations élevées durant toute la période du traitement. [61] Dans la littérature, l’utilisation des fibres de tétracycline suite à la thérapie mécanique permet
de réduire la profondeur de poche, d’augmenter le gain d’attache clinique et de diminuer le saignement au sondage. [67,68] D’ailleurs, selon Michalowicz et coll. [68], le surfaçage et la mise en place de cet adjuvant
thérapeutique pour 10 jours permettent de maintenir les résultats obtenus pendant 1 an et de diminuer l’incidence des récidives en l’absence d’une phase de maintien. Ce produit n’est actuellement pas accepté par Santé Canada. [69]
1.7.2. Doxycycline (Atridox)
Un système de deux seringues automélangeantes est disponible pour le relâchement contrôlé de la doxycycline (Atridox; Block Drug, Jersey City, New Jersey, États-Unis). [61] Des concentrations variant de