Obtention de cellules souches humaines induites à la
pluripotence à partir de cellules d'urine et leur
différenciation neuronale
Mémoire
Priscilla Hoarau
Maîtrise en biologie cellulaire et moléculaire
Maître ès sciences (M. Sc.)
Québec, Canada
Obtention de cellules souches humaines induites à la
pluripotence à partir de cellules d'urine et leur
différenciation neuronale
Mémoire
Priscilla Hoarau
Sous la direction de :
Jack Puymirat, directeur de recherche
Mohamed Chahine, codirecteur de recherche
III
Résumé
Les cellules souches humaines induites à la pluripotence (hiPSCs) ont été conçues pour la première fois en 2007 par l’équipe du Docteur Yamanaka, au Japon.[1] Ce sont des cellules somatiques reprogrammées par un virus permettant, par exemple, la différenciation neuronale à des fins d'étude de maladies neuro-développementales telle que la Schizophrénie. Le prélèvement des cellules somatiques se fait aujourd'hui majoritairement par des méthodes assez invasives, notamment les biopsies de peau ou prélèvements sanguins. Ceci peut représenter un frein à leur utilisation notamment chez les enfants et surtout les enfants malades. La différenciation neuronale privilégiée est la voie dopaminergique (DA) car c'est ce type cellulaire qui est principalement atteint chez les schizophrènes. C'est pourquoi on priorise pour ce projet l'utilisation de cellules contenues dans l'urine, qui seront reprogrammées via un virus non-intégratif, le virus de Sendaï (SeV). La différenciation neuronale nous permettra d'obtenir des neurones DA fonctionnels, caractérisés par électrophysiologie. Les expériences ont montré une très grande efficacité de reprogrammation cellulaire au niveau des cellules d'urine, ainsi qu'un grand potentiel de différenciation neuronale, malgré quelques différences observées entre les lignées saines et schizophréniques. Grâce à ce projet, la réalisation d'un modèle cellulaire pour la Schizophrénie a pu être établie. Les différences notées entre les lignées pendant la différenciation ouvrent une nouvelle voie pour approfondir l'étude de la maladie au niveau cellulaire et moléculaire.
IV
Abstract
Human Induced Pluripotent Stem Cells (hiPSCs) were conceived for the first time in 2007 in Japan, by Doctor Yamanaka’s team.[1] These are somatic cells reprogrammed thanks to a retrovirus allowing, for example, neuronal differentiation for the purpose of neurodevelopmental disorders studies such as Schizophrenia. Today, the removal of somatic cells is mainly made by enough invasive methods, including skin and blood biopsies. This can represent a brake in their use predominantly children, mainly sick children. The preferred neuronal differentiation is the dopaminergic (DA) way because it's the mostly cell type affected in schizophrenics. That's why we prioritize the use of urine cells for this project, reprogrammed via a non integrative virus, the Sendai virus (SeV). The neuronal differentiation enables us to get functional DA neurons characterized by electrophysiology. Experimentations show a huge efficiency of urine cells reprogramming as well as a great potential of neuronal differentiation despite some distinctions between the two lines. Thanks to this project, the achievement of a cellular model for Schizophrenia could be established. The differences noticed between the two lines during the differentiation open up a new way to make cellular and molecular studies of this disease deeper.
V
Table des matières
Résumé ... III Abstract ... IV Table des matières ... V Liste des tableaux ... VIII Liste des figures ... IX Liste des abréviations ... X Remerciements ... XIV
1 Introduction ... 1
1.1 La Schizophrénie ... 1
1.1.1 La maladie ... 1
1.1.2 Les mécanismes cellulaires et moléculaires connus ... 2
1.1.3 Les traitements actuels ... 3
1.2 Les cellules souches ... 5
1.2.1 Les cellules souches ... 5
1.2.2 Les cellules souches humaines embryonnaires (hESCs) ... 5
1.2.3 Les cellules souches induites à la pluripotence (hiPSCs) ... 6
1.3 Les cellules somatiques ... 8
1.3.1 Les fibroblastes ... 8
1.3.2 Les cellules du sang ... 9
1.3.3 Les cellules d'urine ... 9
1.3.4 Les autres types cellulaires ... 10
1.4 Le virus de Sendaï ... 10
1.4.1 Sa nature et sa fonction ... 10
1.4.2 Les différentes techniques de reprogrammation employées ... 11
1.5 Les neurones dopaminergiques ... 12
1.5.1 Leur localisation ... 12
1.5.2 Leur fonction ... 13
1.6 Objectifs ... 16
1.6.1 La production de cellules souches induites à la pluripotence ... 16
1.6.2 La différenciation des hiPSCs en neurones dopaminergiques ... 16
2 Matériels et méthode ... 17
VI
2.1.1 Les lignées cellulaires ... 17
2.1.2 Le protocole expérimental... 17
2.2 La reprogrammation des cellules d’urine ... 20
2.2.1 Les lignées cellulaires ... 20
2.2.2 Le protocole expérimental... 20
2.3 La culture et caractérisation des hiPSCs ... 23
2.3.1 La culture des hiPSCs ... 23
2.3.2 La caractérisation des hiPSCs ... 25
2.4 La différenciation des hiPSCs en neurones DA ... 32
2.4.1 Les lignées cellulaires ... 32
2.4.2 Le protocole expérimental... 32
2.5 La caractérisation des neurones dopaminergiques ... 35
2.5.1 L'immunofluorescence ... 36
2.5.2 L’électrophysiologie ... 36
3 Résultats... 38
3.1 Culture des cellules d'urine ... 38
3.2 Reprogrammation des cellules d'urine ... 38
3.2.1 La transduction ... 38
3.2.2 La formation des clones ... 40
3.2.3 L'immunofluorescence sur cellules vivantes ... 41
3.2.4 La sélection des clones ... 41
3.2.5 Culture et amplification des hiPSCs ... 43
3.3 Caractérisation des hiPSCs ... 43
3.3.1 Les cellules hiPSCs ... 43
3.3.2 Les corps embryonnaires... 47
3.4 Différenciation et caractérisation des neurones DA ... 48
3.4.1 Les corps embryonnaires... 48
3.4.2 Les rosettes neuronales ... 49
3.4.3 Les cellules progénitrices neurales ... 51
3.4.4 Les neurones dopaminergiques ... 51
4 Discussion ... 55
5 Conclusion ... 59
VII
VIII
Liste des tableaux
Tableau 1 - Caractéristiques des antipsychotiques donnés aux patients schizophrènes .... 4
Tableau 2 - Principales caractéristiques des différentes méthodes de reprogrammation . 11 Tableau 3 - Caractéristiques des différentes lignées utilisées ... 17
Tableau 4 - Titre viral du lot #L2110082 des virus du kit de reprogrammation ... 20
Tableau 5 - Séquence des amorces pour la caractérisation de la pluripotence ... 28
Tableau 6 - Caractéristiques des anticorps utilisés pour cette immunofluorescence ... 30
Tableau 7 - Séquence des amorces utilisées pour la caractérisation des EB différenciés 32 Tableau 8 - Caractéristiques des anticorps utilisés pour cette immunofluorescence ... 36
IX
Liste des figures
Figure 1 - Représentation des différents facteurs de risque pour la Schizophrénie ... 2
Figure 2 - Schéma du devenir d'un blastocyste lors du développement de l'embryon ... 5
Figure 3 - Comparaison du cycle de vie du virus non-intégratif SeV et des autres virus ... 11
Figure 4 - Localisation des neurones DA dans les régions du cerveau humain ... 12
Figure 5 - Schéma des trois zones du FP où les neurones DA arrivent à maturité ... 13
Figure 7 - Représentation de la synthèse des cathécolamines ... 15
Figure 6 - Schéma de la localisation et fonctions des neurones DA dans le cerveau ... 15
Figure 8 - Exemple des cellules différenciées retrouvées dans les colonies d'hiPSCs ... 25
Figure 9 - Schéma des trois phases à l'étape de récupération de la phase aqueuse ... 26
Figure 10 - Principe d'une immunofluorescence simple indirecte ... 29
Figure 11 - Photo d'une partie des micro-puits d'une plaque AggreWell vide ... 33
Figure 12 - Morphologie des cellules d'urine avant la transduction pour la lignée #21 ... 38
Figure 13 - Morphologie des cellules d'urine à 7 jours post-transduction ... 40
Figure 14 - Morphologie d'un clone de la lignée #21 du jour 1 à 8 sur MEF ... 40
Figure 15 - Représentation de trois clones exprimant un des marqueurs de pluripotence 41 Figure 16 - Evolution de la morphologie des 3 clones obtenus de la lignée #21 ... 42
Figure 17 - Morphologie de trois exemples de mauvais clones piqués pour la lignée #21 43 Figure 18 - Morphologie des colonies d'hiPSCs des deux clones après 6 passages ... 43
Figure 19 - Résultats de la RT-PCR pour la vérification de la pluripotence des hiPSCs ... 44
Figure 20 - Résultats d'immunofluorescence sur la lignée hiPSCs saine #1 ... 45
Figure 21 - Résultats d'immunofluorescence pour la lignée hiPSCs schizophrénique #4 . 45 Figure 22 - Résultats d'immunofluorescence sur la lignée hiPSCs à risque #21 ... 46
Figure 23 - Morphologie des corps embryonnaires pour les trois lignées utilisées ... 47
Figure 24 - Morphologie de différents types cellulaires vus lors de la différenciation ... 47
Figure 25 - Résultats de la RT-PCR pour la caractérisation des EB ... 48
Figure 26 - Morphologie des EB obtenus dans la plaque AggreWell ... 49
Figure 27 - Résultats du test de Student pour la comparaison du diamètre des EB ... 50
Figure 28 - Morphologie des rosettes obtenues après la récolte des EB ... 50
Figure 29 - Morphologie des progéniteurs neuronaux en culture ... 51
Figure 30 - Morphologie des cellules neuronales en maturation ... 52
Figure 31 - Résultats de l'immunofluorescence sur les neurones de la lignée saine #1 ... 53
Figure 32 - Résultats de l'immunofluorescence sur les neurones de la lignée malade #4 53 Figure 33 - Résultats des courants sodiques obtenus pour la lignée saine #1 ... 54
X
Liste des abréviations
DA Dopaminergique
hiPSCs ou iPS Human Induced Pluripotent Stem Cells
OMS Organisation mondiale de la Santé
TH Tyrosine Hydroxylase
MAPs Protéines associées au microtubules
hESCs Human Embryonic Stem Cells
ICM Masse Cellulaire Interne
FIV Fécondation in vitro
SeV Virus de Sendaï
PBMC Cellules mononuclées du sang périphérique
SN Substantia Nigra
VTA Ventral Tegmental Areas
SHH Sonic HedgeHog
IsO Isthmic Organizer
FP Floor Plate
VZ Zone ventriculaire
IZ Zone Intermédiaire
MZ Zone marginale
NEAA Non Essential Amino Acid
SVF Serum de Veau Fœtal
RE/MC Renal Epithelial/Mesenchymal cells
RI Rock Inhibitor
MEF Fibroblastes de souris embryonnaires
MOI Multiplicité de l'infection
PE Phycoérythrine
Lam Laminine
PCR Réactions en chaîne par polymérase
RT Transcription Inverse
ADNc ADN complémentaire
dNTPs Désocyribonucléotides
S/AS Sens/Anti-Sens
TBE Tris-Borate-EDTA
PFA Paraformaldéhyde
BSA Albumine de Sérum Bovin
DAPI 4',6'-diamidino-2-phénylindole
aCGH Array-based Comparative Genomic Hybridization
STR Short Tandem Repeat
EB Corps embryonnaires
KSR KnockOut Replacement Serum
NIM Milieu d'induction neural
NNC Cellules non neurales
DNDM Milieu de différenciation de neurones dopaminergiques NPC Progéniteurs neuronaux ou cellules progénitrices neurales NRSR Agent de sélection des rosettes neurales
PLO Poly-L Ornithine
PN Précurseurs neuronaux
DNMM1 Milieu de maturation des neurones dopaminergiques 1 DNMM2 Milieu de maturation des neurones dopaminergiques 2
XI
XII
« The scariest moment is always just before you start »
XIII
XIV
Remerciements
J'ai énormément appris autant au niveau théorique qu'au niveau expérimental lors de mon passage dans le laboratoire du Dr Jack Puymirat au CMDGT/LOEX.
Je dois mes connaissances en biologie moléculaire à celui qui m'a guidée pendant mon projet, Dominic Jauvin, professionnel de recherche impliqué et déterminé. Je tiens donc à le remercier fièrement, ainsi qu'à Laurie Martineau, également professionnelle de recherche dans le laboratoire, qui m'a aidée et enseignée tout son précieux savoir en culture cellulaire.
Je veux remercier également les deux autres membres de notre équipe, Véronique Racine et Siham Ait-Benichou, pour tous les rires et petits moments partagés, ainsi que l'ensemble du LOEX pour toutes les réponses à mes questions.
Je remercie infiniment ma famille ainsi que mon conjoint d'avoir été les personnes les plus patientes au monde pour m'aider et me supporter durant ces deux ans de dur labeur.
Mais surtout, j'aimerai remercier au plus haut point mon directeur de recherche, le Dr Jack Puymirat, qui m'a permis de réaliser ce projet qui, en plus d'être innovant, est passionnant. Je remercie de la même manière, mon co-directeur de recherche, le Pr Mohamed Chahine qui m'a toujours rassurée et aidée à prendre confiance en moi tout au long du projet.
Pour finir, je remercie les financeurs de mon projet, qui sont aussi les collaborateurs de mon projet, le Pr Michel Maziade et le Pr Pierre Marquet, du centre de recherche CERVO de la ville de Québec.
Ce projet n'aurai pas pu aboutir sans l'aide de toutes ces personnes, alors infiniment, je vous remercie tous encore une fois.
1
1 Introduction
La Schizophrénie est considérée comme une maladie neurodéveloppementale affectant principalement les neurones dopaminergiques (DA) même si à ce jour tous les mécanismes cellulaires atteints par cette maladie ne sont pas totalement connus. Aucun modèle de souris reproduisant complètement les manifestations de cette maladie n’est disponible à ce jour. Afin de mieux comprendre les mécanismes responsables de cette maladie, nous avons créé un modèle cellulaire basé sur la culture de neurones dérivés de cellules souches humaines induites à la pluripotence (hiPSCs) de patients schizophrènes.
1.1 La Schizophrénie
1.1.1 La maladie
Selon l’Organisation Mondiale de la Santé (OMS), la Schizophrénie est une maladie touchant une vingtaine de millions de personnes dans le monde, représentant pratiquement 1% de la population mondiale. [3, 4] Elle survient plus généralement au début de l’âge adulte, entre 16 et 30 ans, et se distingue par des troubles psychotiques importants créant une incidence sur le contact avec la réalité. Les émotions, le ressenti, les pensées et le comportement de la personne se trouvent gravement affectés. Ces différents symptômes sont répartis dans trois classes qui sont les symptômes "positifs", les symptômes "négatifs" et les symptômes cognitifs. Ceux qui sont positifs touchent l'agitation du patient, ainsi que sa paranoïa et ses hallucinations alors que ceux qui sont négatifs et cognitifs sont moins tragiques mais sont malheureusement nocifs pour la personne. Parmi eux, on peut citer la perte d'intérêt pour les autres et la perte de l'affection, le retrait émotionnel et les défauts de syntaxe de leurs phrases. [3, 5] Ces symptômes de délire et d’absence retirent progressivement la personne schizophrène de la vie sociale. D'après la littérature, la Schizophrénie est causée par différents facteurs, notamment environnementaux, mais aussi par des défauts apparaissant lors du développement cérébral, c'est pourquoi la maladie est référée multifactorielle. [6] Les facteurs environnementaux sont multiples et peuvent être des complications obstétriques, des abus physiques ou psychologiques ou encore l'abus de drogue
2
tel que le cannabis. (Figure 1) [2, 7] Les scientifiques suggèrent que le mauvais développement du cerveau du fœtus au cours de la grossesse et de l’adolescence à la puberté, peut entraîner des modifications dans les réactions entre les neurotransmetteurs, causant ainsi des anomalies importantes. [2, 8, 9] Aujourd'hui on sait que la Schizophrénie est une maladie qui affecte le système dopaminergique central du cerveau. [10]
1.1.2 Les mécanismes cellulaires et moléculaires connus
La Schizophrénie est une maladie complexe affectant de nombreux mécanismes chez l'humain. Malheureusement, les atteintes sont tellement multiples qu'elles ne sont pas encore toutes étudiées ni découvertes. La dopamine et les neurones dopaminergiques sont les principales molécules et cellules atteintes connues de la maladie aujourd'hui (mécanismes détaillés dans la partie 1.5 Les neurones dopaminergiques). Ces manifestations semblent également être en lien avec des potentiels défauts mitochondriaux qui amèneraient à des dérèglements neuronaux. Ils pourraient en fait influencer le taux des différents neurotransmetteurs tels que la dopamine mais aussi le glutamate. [3, 11] La maladie entraîne un faible taux de Tyrosine Hydroxylase (TH) et de la dopamine ainsi que les transporteurs de la
Figure 1 - Représentation des différents facteurs de risque pour la Schizophrénie
Sur la figure, on peut voir que les facteurs influençant les risques d'avoir la Schizophrénie sont nombreux et peuvent toucher différentes catégories de personnes. On peut citer différents facteurs environnementaux tels que les complications obstétriques en premier lieu, la perte de parent en enfance ou encore l'abus de cannabis durant l'adolescence. Cette figure est tirée de l'article de Schmitt, de 2014. [2]
3
dopamine dans le cerveau des patients atteints comparé aux personnes saines. [5, 12] Ces variations sont dues en partie parce que les neurones dopaminergiques semblent avoir la capacité de changer de morphologie selon le type environnemental dans lequel ils se trouvent. [10]
La souris a été utilisée pour essayer de développer les symptômes de la maladie chez un modèle animal. Cependant, étant donné que la maladie est complexe et encore trop peu connue, il est difficile d'en créer un avec tous les symptômes. Le modèle le plus efficace actuellement, est la souris avec les protéines STOP déficientes. Ces protéines réguleraient les protéines associées aux microtubules (MAPs) qui elles mêmes, induisent la stabilité à froid des microtubules des neurones. [13] Leur rôle est donc très important dans la différenciation, la stabilité et la survie des neurones, c'est pourquoi on les rend déficientes chez ces souris. Ceci crée chez les souris un problème de maintenance et de développement du système nerveux, surtout au niveau des synapses. Pour les cultures de neurones in vitro, l'inhibition des protéines STOP affecte la différenciation neuronale. [14] Ces protéines pourraient donc jouer un rôle important dans la fonction synaptique des différents neurones, mais surtout dans les neurones dopaminergiques pour le cas de la Schizophrénie. De plus, chez l'humain, le gène STOP se situe dans la même région chromosomique que celle des désordres schizoïdes ce qui confirme la liaison de la protéine avec la maladie. [9, 15]
1.1.3 Les traitements actuels
Aucun moyen préventif n'est aujourd'hui disponible pour le traitement de la maladie de la Schizophrénie. Elle apparaît à des âges différents pour chacune des personnes et avec une intensité différente de chacun des symptômes. Chaque patient est par conséquent traité distinctement dans le but de lui obtenir le meilleur traitement qui soit. Les soins qui leur sont offerts allient autant la médication que l'aide psychologique et le support social.
Actuellement, les médicaments prescrits la plupart du temps aux patients sont des antipsychotiques typiques (anciens) ou atypiques (nouveaux) qu’on peut retrouver dans ce tableau. (Tableau 1) Ce sont des neuroleptiques permettant d'atténuer un
4
peu les plus gros symptômes, positifs le plus souvent, pour laisser une chance aux personnes de vivre une vie plus normale. [16]
Tableau 1 - Caractéristiques des antipsychotiques donnés aux patients schizophrènes
Avantages/Inconvénients Antipsychotiques typiques Antipsychotiques atypiques Coût - + Effets secondaires Risques spasmes musculaires entraînant la Dyskénie tardive
Prise de poids puis risques diabète et cholestérol
Exemples Chlorpromazine,
Haloperidol, ...
Olanzapine, Clozapine, Quetiapine, ...
Environ 20% des patients sous traitement d'antipsychotiques vont voir leur symptômes disparaître presque totalement. [3] Ceci est un petit pourcentage ce qui prouve que la maladie n'est pas totalement bien ciblée. La médication vise principalement les symptômes dits positifs des patients. Pour cela, le but des antipsychotiques est de bloquer le fonctionnement des récepteurs de la dopamine de type D2. (Types de récepteurs détaillés dans la partie 1.5 Les neurones dopaminergiques) Ceux-ci sont retrouvés à la surface des cellules neuronales et permettent le transfert du signal de la dopamine à l'intérieur de la cellule. Chaque patient se doit de prendre les neuroleptiques de façon régulière et répétée pour pouvoir discerner un minimum d'améliorations dans leurs comportements. [10] Le choix de la médication est un processus long car chaque patient réagit différemment aux médicaments disponibles. Celui qui est adapté à une personne X lui est prescrit à vie, ou jusqu'à ce qu'il ne lui suffise plus, autrement dit, qu'il soit moins efficace. Les patients dont les symptômes d'hallucination et de délire diminuent doivent tout de même continuer leur traitement sous réserve d'une rechute encore plus brutale. En plus de la médication, les patients doivent obtenir un soutien social et une aide psychologique non seulement de la part de leurs médecins, mais aussi de leurs proches. Ces aides leur permettent de se rapprocher, ou en vérité, de moins s'éloigner de la réalité. [8]
Ce tableau indique les différents neuroleptiques utilisés en tant que traitement de la Schizophrénie. Il présente également les risques liés à cette médication sur les patients traités.
5
Plus les patients sont diagnostiqués tôt dans le développement de la maladie, plus les traitements vont ralentir l'évolution de celle-ci.
1.2 Les cellules souches
1.2.1 Les cellules souches
Les cellules souches sont définies comme des cellules indifférenciées capables de proliférer de façon illimitée. Dans le corps humain, ces cellules procèdent au renouvellement normal des différents tissus qui le composent. Elles sont dites pluripotentes, ce qui signifie qu'elles peuvent se différencier dans tous les types cellulaires des trois feuillets embryonnaires (mésoderme, ectoderme et endoderme). Par contre, elles n'ont pas la capacité de se différencier en un organisme entier, c'est-à-dire qu'elles ne sont pas totipotentes. Les cellules souches embryonnaires proviennent de la cellule fécondée, appelée blastocyste, qui donnera ensuite l'embryon. (Figure 2)
1.2.2 Les cellules souches humaines embryonnaires (hESCs)
Les cellules souches embryonnaires ont été isolées chez les embryons humains pour la première fois en 1994. Ce sont les cellules du blastocyste, composé du futur placenta et du futur embryon, qu'on appelle la masse cellulaire interne (ICM). (Figure 2) Elle a été isolée et mise en culture par une équipe au Singapour. [17] Les blastocystes sont obtenus après une fécondation in vitro (FIV). Ce n’est seulement que 4 ans plus tard que les hESCs sont cultivées à partir de ces ICM.
Figure 2 - Schéma du devenir d'un blastocyste lors du développement de l'embryon
Le blastocyste après la fécondation, est supposé donner des cellules souches embryonnaires pluripotentes, qui vont se différencier dans les trois feuillets embryonnaires. Elles deviendront alors multi puis unipotentes. A ce stade, les cellules différenciées dans un feuillet ne sont plus capables de donner un type cellulaire d'un autre feuillet embryonnaire. Cette figure est tirée du site WEB de l'office fédéral de la santé publique suisse (https://www.bag.admin.ch/bag/fr/home.html)
6
[17, 18] Ces cellules avaient un grand potentiel quant à leur utilisation dans le monde de la recherche, au niveau des thérapies cellulaires et la médecine régénératrice notamment. Cependant, un problème subsistait au niveau de l'éthique. Auparavant, les méthodes d'obtention des hESCs étaient faites par FIV, par clonage reproductif ou encore issues des embryons congelés plus de 5 ans, avec l'accord de chacun des parents. Le statut moral de l'embryon était alors partagé : Fallait-il considérer l'embryon comme une personne à part entière ou comme une personne potentielle ? Ces cellules souches embryonnaires allaient à l'encontre de deux principes qui ne pouvaient être respectés simultanément : d'une part empêcher ou soulager la souffrance d'un individu atteint d'une maladie par thérapie cellulaire et d'autre part devoir respecter la vie de l'humain, qui est en fait le futur embryon "détruit" à des fins de cultures pour la recherche. [19] Également, selon plusieurs religions, les accords de prélèvement des embryons différaient. C'est pourquoi son utilisation a été restreinte aujourd'hui à l'emploi de seulement quelques lignées dont les lignées H1 ou H9 le plus souvent. [20, 21] C'est la découverte des cellules souches humaines induites à la pluripotence en 2007, autrement appelées hiPSCs, qui a permis d'y remédier et de continuer les recherches en thérapie cellulaire. [1, 22]
1.2.3 Les cellules souches induites à la pluripotence (hiPSCs)
Dr Shinya Yamanaka, détenteur du prix Nobel de la médecine en 2012 [23], a été le premier à produire des hiPSCs à partir de fibroblastes de souris, et l'année ensuite à partir de fibroblastes humain. [1, 24] Les hiPSCs sont induites grâce à quatre facteurs, qu'on appelle aujourd'hui les facteurs de Yamanaka : Sox2, Oct4, c-Myc et Klf4. Ces facteurs de pluripotence vont s'introduire dans le cytoplasme des cellules somatiques hôtes pour induire la dédifférenciation de celles-ci via le virus de Sendaï (SeV).
1.2.3.1 L'obtention des hiPSCs
Les premières cellules somatiques à avoir été reprogrammées sont les fibroblastes. Ce sont donc celles qui semblent être les plus utilisées, et les plus efficaces. Depuis, plusieurs autres types cellulaires ont été utilisés, tels que les cellules mononuclées du sang périphérique (PBMC), les cellules d'urine ou encore
7
les kératinocytes. [25, 26] Ces cellules sont prélevées par biopsies ou prélèvements sanguins, urinaires et capillaires. Comme ces méthodes sont communes et autorisées par l'éthique, il n'y a donc aucun obstacle pour leur utilisation dans la dédifférenciation, contrairement aux hESCs. La reprogrammation se fait par transduction et nécessite environ 1,5 mois de culture avant d'obtenir les colonies d'hiPSCs. La partie 1.4.2 Les différentes techniques de reprogrammation détaille les différentes façons d'y parvenir en gardant à l'esprit les avantages et inconvénients de chacune d'elles.
Les cellules somatiques transduites passent par trois étapes où elles évoluent aussi bien morphologiquement qu'au niveau de leurs expressions géniques. Premièrement, lorsque la cellule reçoit les facteurs de pluripotence, elle demeure dans un stade de régulation négative par rapport à sa spécification de départ. La provocation de la dédifférenciation entraîne des changements morphologiques induisant le rétrécissement des cellules dans leur taille. Les cellules sont ensuite dans un stade intermédiaire bancal impliquant des cellules indécises sur leur fonction. L'expression des gènes est instable à ce stage. C'est seulement au dernier stade où les cellules hiPSCs vont exprimer les marqueurs de pluripotence endogènes qu'elles sont jugées stables. [27]
1.2.3.2 L'utilisation des hiPSCs
Aujourd'hui les différents comités d'éthique ne nous permettent pas d'effectuer des travaux de recherche directement dans le cerveau, ou de faire un prélèvement de neurones humains pour l’étude des psychoses. La solution la plus plausible est de passer par la différenciation de cellules souches humaines de patients malades en neurones. Cette passerelle nous ouvre les portes sur l'étude des neurones dopaminergiques atteints de Schizophrénie sur du plus long terme.
Les applications possibles grâce à ces cellules sont multiples. Les chercheurs sont plus aptes à découvrir et développer de nouveaux médicaments pour les maladies ciblées. Ils peuvent être testés directement sur les hiPSCs provenant de différents patients malades et sains, et les comparaisons en ressortent plus évidentes. Cela permet aussi de savoir les effets secondaires à court terme sur ces cellules et
8
étudier la reproductibilité, car beaucoup plus de lignées sont disponibles. Les hiPSCs sont également utilisées pour les thérapies cellulaires amenant directement à des essais cliniques. Il y a quelques années, le premier essai clinique usant de la transplantation des hiPSCs chez les humains a commencé en 2013 chez des patients en dégénérescence maculaire. [28] La transplantation, réalisée un an plus tard, en 2014, n'est pas vraiment un succès puisque seulement 2 patients sur 6 prévus, ont pu être transplantés. En effet, le premier patient recouvre une vue améliorée d'après l'opération, mais le deuxième possédait des mutations dans le génome de ses hiPSCs induisant l’arrêt instantané de l’essai clinique. [29] Les essais cliniques aujourd'hui deviennent compliqués car trop coûteux et longs. C'est surtout au Japon, qu'ils semblent être le plus avancé dans ces projets en raison de leur centre de recherche. Celui-ci permet le stockage d'une grande banque de lignées d'hiPSCs et permet d'effectuer beaucoup de recherches sur la médecine régénérative et ainsi programmer plus d'essais cliniques. [30] Récemment, une nouvelle transplantation de cellules rétiniennes dérivées à partir d'hiPSCs a été faite chez un patient atteint de dégénerescence maculaire. Celle-ci semblerait bien se dérouler pour le moment et ne présenterait pas d'effets secondaires ou de mutations cachées. [31] Pour finir, de par sa prolifération illimitée soit sa quantité infinie de cellules disponible, les hiPSCs sont également un très bon moyen de cribler la toxicité lors de différents tests en recherche. Des biobanques de cellules souches sont aussi maintenant disponibles depuis l'arrivée des hiPSCs, ouverts à chaque personne désirant avoir ses cultures d'hiPSCs. [32]
1.3 Les cellules somatiques
Les cellules somatiques sont les cellules différenciées retrouvées partout dans le corps humain, utilisées ici à des fins de reprogrammation, pour obtenir des cellules souches. La méthode de prélèvement varie selon le type cellulaire désiré.
1.3.1 Les fibroblastes
Les fibroblastes sont des cellules formant les fibres du tissu conjonctif du corps humain et sont retrouvés dans de nombreux organes pleins, les voies génitales et urinaires mais surtout sous la peau. Pour les récolter, on peut réaliser une biopsie
9
de la peau en prélevant une "carotte" d’au moins 5 mm de diamètre. [33] Les biopsies sont des méthodes assez invasives, surtout chez les enfants et/ou patients malades. Le prélèvement peut parfois s'avérer compliqué et pénible, principalement lorsqu'il faut renouveler l'échantillon en cas de perte d'échantillons ou de non aboutissement du protocole.
1.3.2 Les cellules du sang
Les hiPSCs peuvent être produits à partir de sang également. On isole alors les PBMC du sang, par différentes centrifugations afin de séparer chacune des phases suivantes : plasma, PBMC, granulocytes et érythrocytes. Plusieurs protocoles sont disponibles pour l'isolement mais le protocole du site Miltenyi Biotec est une base qui revient très souvent comme procédé. [34] Une prise de sang peut être contraignante notamment pour les plus jeunes, et surtout ceux qui sont malades.
1.3.3 Les cellules d'urine
L'urine est un liquide naturel sécrété par l'humain chaque jour, peu importe l'âge, l'origine ethnique ou encore le sexe. Une personne adulte sans problème de reins, va produire naturellement environ 2 l d'urine par jour, ce qui permet d'avoir une grande accessibilité contrairement aux fibroblastes et aux PBMC. L'urine est un liquide plus ou moins jaune, considéré comme un déchet du corps et composé majoritairement d'eau et d'autres éléments autant organiques que non organiques. Sa composition varie d'une personne à une autre et d'une miction à l'autre selon la nourriture, boissons et/ou médicaments ingérés. [35] Lors de la miction de l'urine, des cellules se décrochent de l'urètre ou proviennent des reins, et ont un potentiel reprogrammable. [36, 37] Ce sont les cellules urothéliales qui vont nous permettre d'avoir des hiPSCs. Une série de lavages et de centrifugations est mise en place pour les isoler. [37] Elles sont un très bon moyen pour remédier aux méthodes plus complexes citées dans les chapitres ci-dessus. De plus, l'échantillonnage peut être répété facilement si besoin. C'est pourquoi, nous utilisons les cellules contenues dans l'urine pour ce projet.
10
1.3.4 Les autres types cellulaires
D'autres types cellulaires ont été testés par quelques équipes pour le moment, telles que les kératinocytes provenant des cheveux [38], ou encore en utilisant les lymphoblastes immortalisés. [39] Ces résultats, encore très récents, ne peuvent assurer l'efficacité et la reproductibilité des travaux mais restent des voies à élargir. Notre équipe essaye présentement de produire des hiPSCs à partir de la grande banque de lymphoblastes de notre laboratoire, via le virus de Sendaï.
1.4 Le virus de Sendaï
Le SeV est utilisé comme agent non infectieux pouvant transférer à des cellules somatiques des facteurs de pluripotence dans le but d'obtenir des hiPSCs.
1.4.1 Sa nature et sa fonction
Le SeV est un virus respiratoire provenant de la souris ou du rat, isolé dans le début des années 1950. [40] Le virus est sous une forme non-transmissible, soit non-infectieuse, et permet l'insertion des quatre facteurs de Yamanaka dans le cytoplasme des cellules somatiques. Ce virus est non-intégratif, c'est-à-dire que ses vecteurs vont directement dans le cytoplasme et y restent, sans jamais modifier directement le génome. C’est une capsule qui enveloppe un brin simple d'ARN, formant son génome, et comprenant plusieurs protéines virales. Ces dernières vont aider pour la fusion capsule-cellule, l’action de l'ARN polymérase et la structure de la capsule. Celle-ci se fixe à la cellule par le récepteur de l'acide sialique, donc réussit à se fixer à beaucoup de types cellulaires, dont les fibroblastes, les PBMC ou encore les cellules urothéliales. L'ARN va ensuite être lu par les ribosomes dans le cytoplasme et être traduit en protéines, contrairement aux autres vecteurs, qui eux apportent de l'ADN intégrant directement le génome de la cellule hôte. (Figure 3) [41]
Les craintes au niveau de la présence du virus qui reste dans les cellules après la transduction sont élevées. C'est pourquoi l'utilisation de ce SeV est une méthode innovante car il n'est normalement plus détecté dans les hiPSCs après les premiers passages. [42] Il joue son rôle en permettant l'insertion des quatre facteurs de Yamanaka dans les cellules, puis s'estompe au fur et à mesure des cycles cellulaires des cellules hiPSCs nouvellement produites.
11
1.4.2 Les différentes techniques de reprogrammation employées
Plusieurs techniques sont employées dans la recherche aujourd’hui, mais celle qui se distingue et se démarque, reste l'utilisation du SeV selon Schlaeger. [26] On note cependant une hausse de l'utilisation de l'ARN qui devient de plus en plus efficace et utilisée car elle ne nécessite aucun virus. Cette voie serait plus appropriée au niveau de l'éthique par rapport aux essais cliniques. [26] Certaines publications utilisent encore des lentivirus et des vecteurs épisomaux, qui impliquent une intégration dans le génome. Ces différentes méthodes ont plusieurs avantages et inconvénients jouant sur leur efficacité et leur rendement. (Tableau 2)
Tableau 2 - Principales caractéristiques des différentes méthodes de reprogrammation ARN Virus Sendaï Episomal Lentivirus
Efficacité ~1% ~0.1% ~0.01% ~0.5% Charge de travail + - - ++ Quantité de cellules requise ~50K ~500K ~500-800K ~100K Emergence des colonies ++ + + + Taux d'utilisation en recherche ~46% ~62% ~33% ~19%
- : Faible ; + : Modéré ; ++ : Fort
Tableau inspiré et modifié à partir de l'article de Schlaeger, de 2015. [26]
Figure 3 - Comparaison du cycle de vie du virus non-intégratif SeV et des autres virus
A gauche de la figure, on peut voir le mécanisme d'insertion du virus de Sendaï. En effet, il se lie à la membrane de la cellule via le récepteur de l'acide sialique, puis libère son contenu dans le cytoplasme de la cellule hôte. Ce contenu qui est l'ARN va être lu par les ribosomes et se traduire en protéines dans le cytoplasme même. Aucune intégration dans le génome n'est réalisée. C'est ensuite par RT-PCR et Immunofluorescence qu'on pourra voir l'expression des gènes de pluripotence endogènes. A droite de la figure est montré le mécanisme pour les différents autres vecteurs intégratifs utilisés pour la reprogrammation. Ces vecteurs vont se retrouver dans le noyau des cellules hôtes et intégrer le génome de façon à ce que les gènes de pluripotence deviennent endogènes. Cette modification du génome créée des mutations importantes, empêchant par exemple les essais cliniques. Cette figure est tirée du protocole du kit Cytotune de la compagnie Life Technologies, de 2013.
12
Dans ce projet, nous avons décidé de suivre un protocole avec le SeV, chez les cellules d'urine.
1.5 Les neurones dopaminergiques
Les neurones dopaminergiques sont un des types neuronaux retrouvés dans le cerveau humain.
1.5.1 Leur localisation
Le cerveau est composé de plusieurs parties comprenant différentes populations de neurones, entourés notamment de cellules gliales pour leur maintien. Il débute sa croissance par la formation d'un tube neural lors de la formation de l'embryon. [43] En effet, le stade appelé gastrulation après la fécondation amène à l'élaboration des trois feuillets embryonnaires, dont l'ectoderme. Ce feuillet est induit par des facteurs inhibiteurs (tel que DKK1, inhibiteur de la voie WNT) qui vont diriger le patron ectodermal neural formant le tube neural antérieur de l'embryon. C'est après cette étape que l'on retrouvera les neurones DA : dans la partie ventrale du cerveau qu'on nomme la Substantia Nigra (SN) ainsi que la zone tegmentale ventriculaire aussi connu sous le nom de Ventral Tegmental areas (VTA). [43] (Figure 4) Le tube neural ventral formé est induit lui grâce au facteur Sonic HedgeHog (SHH). Cette protéine fait partie des suppléments ajoutés dans nos milieux de culture lors de la différenciation neuronale. [43, 44]
Figure 4 - Localisation des neurones DA dans les régions du cerveau humain
Ce schéma montre une coupe sagittale du cerveau humain. Les parties en vert représentant les zones SN et VTA notamment, montrent les zones où sont localisés les neurones dopaminergiques. Cette figure est tirée de l'article de Blaess, de 2015. SN : Substantia Nigra ; VTA : Ventral Tegmental Areas
13
C'est dans le tube neural que sont formés les deux centres de signalisation qui vont orchestrer la croissance et la survie des neurones dopaminergiques. Ces centres ont une appellation plus commune qui se fait en anglais : The isthmic organizer (IsO) et The floor plate (FP). L'IsO est la partie définissant la frontière du cerveau moyen et du cerveau postérieur, et le FP encadre la partie ventrale. Ces zones régulent la spécification et la prolifération des neurones progéniteurs dopaminergiques et par la suite régulent également leur différenciation et assurent leur survie. Lorsque les progéniteurs neuronaux terminent leurs divisions, et se trouvent à un stade post-mitotique prêts à se différencier, ils se trouvent dans la zone ventriculaire (VZ) du FP. Ces cellules migrent ensuite dans la zone intermédiaire (IZ) où ils acquièrent l'expression de la tyrosine hydroxylase. Finalement les cellules neuronales différenciées et TH+ se retrouvent dans la zone marginale (MZ). (Figure 5) [45]
1.5.2 Leur fonction
Les neurones dopaminergiques chez l'humain sont essentiels pour la coordination, l'apprentissage, le raisonnement ou encore les émotions. On peut donc dire qu'ils sont indispensables à l'être humain. Ces neurones sécrètent un neurotransmetteur qui est la dopamine, impliquant un signal électrique et permettant toutes les fonctions citées ci-dessus. Si les neurotransmetteurs ou encore le signal se
Figure 5 - Schéma des trois zones du FP où les neurones DA arrivent à maturité
Ce schéma représente la zone du FP d'une souris E11.5. Dans la zone VZ représentée, on retrouve notamment les cellules neuronales post-mitotiques prêtes à migrer vers la zone jaune IZ, où elles deviendront matures et migreront vers la zone marginale (MZ) La flèche RM (Radial Migration) indique le sens de migration des progéniteurs neuronaux et la flèche TM (Tangential Migration) indique la migration des neurones DA matures sur la zone marginale. Cette figure est tirée de l'article de Arenas, de 2015.
14
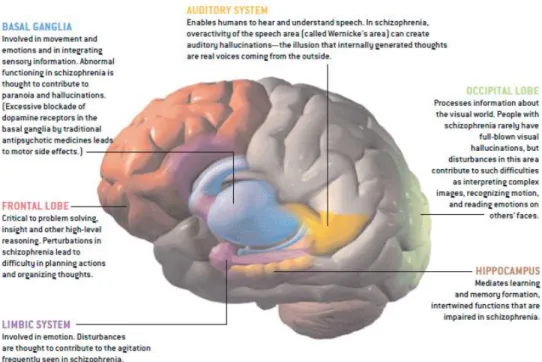
trouvent compromis, la personne aura des atteintes dans l'établissement de ces fonctions. C'est ce qu'il se produit chez les patients schizophrènes. [3, 46] Les neurones DA sont répartis dans les parties SN et VTA du cerveau humain, et leur projections sont plus diffuses dans le cerveau c'est donc pour cela que différentes fonctions sont atteintes. La partie Basal Ganglial par exemple va être engagée dans les mouvements de la personne, c’est pourquoi des maladies telles que le Parkinson existent, lorsque les neurones DA sont moindres. (Figure 6) [3]
Parmi les neurotransmetteurs qui sont touchés par la Schizophrénie, on retrouve la dopamine, découvert en 1952. [47] C'est une catécholamine (c'est à dire qu'elle contient un groupe catéchol) produite par un acide aminé qui est la tyrosine, qui est elle même obtenue grâce à la phénylalanine. La Tyrosine Hydroxylase hydroxyle la tyrosine afin d’obtenir la forme précoce de la dopamine, la L-dopa, et la dopamine décarboxylase va la transformer pour avoir la dopamine. (Figure 7) [46] Le facteur limitant de cette voie de signalisation est la tyrosine hydroxylase, qui est un des facteurs réduit chez les schizophrènes. La baisse de TH, va donc induire la baisse dopamine et donc de la transmission synaptique entre les neurones DA. [5] C'est la dopamine qui régule cette transmission à travers les cinq sous-types de récepteurs de la dopamine couplés à la protéine G. [48] Parmi ces sous-types se distinguent deux classes de récepteurs, le type D1 et le type D2. Il a été démontré chez la souris que perturber la voie de la signalisation du type D2 induisait chez elle une diminution de la réponse comportementale à un agoniste dopaminergique, qui est l'amphétamine ou l'apomorphine. [10] C'est pour cela que les antipsychotiques utilisés comme médication pour la Schizophrénie cible principalement ce récepteur de type D2.
15
Figure 7 - Schéma de la localisation et fonctions des neurones DA dans le cerveau
Les neurones dopaminergiques sont impliqués dans beaucoup de régions différentes du cerveau humain, entraînant par conséquent de nombreux dysfonctionnements chez la personne atteinte de maladie telle que la Schizophrénie ou encore le Parkinson. Chaque partie va jouer un rôle important : par exemple au niveau des émotions et des hallucinations (Basal Ganglia), au niveau de la compréhension d'un discours (Auditory System), ou encore dans la capacité de mémorisation et d'appréhension (Hippocampus). Cette figure est tirée de l'article de Javitt, de 2004.
Figure 6 - Représentation de la synthèse des cathécolamines
La dopamine, la norépinephrine et l'épinephrine sont des cathécolamines synthétisées à partir de la tyrosine. La plupart du temps, ces éléments jouent un rôle de neurotransmetteurs. Les personnes schizophrèniques ont un déficit au niveau du taux de la dopamine ce qui implique une baisse des cathécolamines suivantes. La quantité d'adrénaline (résultant de la dopamine) est donc diminuée, expliquant par exemple le manque de motivation chez les personnes schizophréniques. Cette figure est tirée de l'article de Daubner, de 2011.
16
1.6 Objectifs
L’objectif central de ce projet est de pouvoir produire un modèle cellulaire neuronal à partir de cellules souches humaines induites à la pluripotence pour l’étude de la Schizophrénie. L'hypothèse est que les cellules neuronales dopaminergiques dérivées des cellules hiPSCs (reprogrammées elles-mêmes à partir de cellules d'urine de patients schizophrènes), reproduisent le même phénotype cellulaire retrouvé chez les malades mais in vitro.
1.6.1 La production de cellules souches induites à la pluripotence
Afin d’obtenir notre modèle cellulaire, nous sommes partis d’une source de cellules facile à prélever et en grande quantité : les cellules urothéliales contenues dans l’urine. La reprogrammation de celles-ci en hiPSCs, se fait grâce à une transduction. On intègre quatre facteurs de pluripotence aux cellules via le virus de Sendaï, qui est non-intégratif.
Mon projet est une partie de ce que produit la plateforme iPSC du laboratoire du Dr Jack Puymirat. [49] La production en masse de cellules d’urine ainsi que la reprogrammation sont des étapes longues d’environ un mois chacune. Il faut par la suite compter environ deux mois pour que les hiPSCs soient amplifiées.
Une caractérisation complète de ces hiPSCs (RT-PCR, Immunofluorescence et différenciation dans les trois feuillets embryonnaires) est nécessaire, et nous offre la possibilité de passer au deuxième objectif, c’est-à-dire la différenciation neuronale.
1.6.2 La différenciation des hiPSCs en neurones dopaminergiques
Les neurones connus pour être atteints chez les patients schizophrènes sont les neurones dopaminergiques. C’est pourquoi nous avons été orientés vers cette différenciation. Les neurones matures sont obtenus et caractérisés au bout de 40 jours de culture (RT-PCR et Immunofluorescence).
Ce projet met en valeur la création d'un nouveau modèle cellulaire potentiel pour l'étude de la Schizophrénie, qui est une maladie encore très mal connue aujourd'hui.
17
2 Matériels et méthode
2.1 L'isolement et culture de cellules d'urine
2.1.1 Les lignées cellulaires
Ce projet a été approuvé par le Comité d’Éthique de Recherche de Robert Giffard à Québec. Les échantillons d’urine proviennent de patients sains et de patients schizophrènes de la région du Québec. (Tableau 3) Pour ce projet, les échantillons d'urine des patients #1 et #4 ont été utilisés pour la différenciation neuronale dans le but d’avoir un contrôle et un malade de même sexe, avec un âge similaire. Le patient #21 est le patient utilisé uniquement pour la reprogrammation dans le cadre de ce projet. Pour la suite, les lignées des patients 5439, 9322 et 4838 vont respectivement être appelées #1, #4 et #21.
Tableau 3 - Caractéristiques des différentes lignées utilisées
Lignée Sexe Année de naissance Etat de santé Numéro Patient
5439 Homme 13-07-1971 (46 ans) Sain #1
9322 Homme 14-07-1982 (35 ans) Schizophrène #4
4838 Femme 22-01-2004 (13 ans) Jeune à risque #21
2.1.2 Le protocole expérimental
Le protocole utilisé pour l’isolement et la culture de cellules contenues dans l’urine est tiré de l’article de Ting Zhou. [37] Afin d'augmenter le rendement cellulaire lors de l'isolement, le protocole a été un peu optimisé.
2.1.2.1 Le prélèvement urinaire
Les échantillons d’urine sont prélevés directement chez les patients désignés et sont ensuite transportés jusqu’à nos laboratoires. La première étape consiste à isoler les cellules urothéliales de l'échantillon. Il est recommandé aux patients de boire suffisamment d’eau au moins une demi-heure avant le prélèvement afin d'être sûr d'avoir un volume d'échantillon d'urine convenable au moment voulu. [37, 50] En effet, la première miction d’urine ne doit pas être prélevée car elle est plus chargée en divers sédiments et cellules non désirées. Ceux-ci représentent en fait tous les déchets rejetés normalement dans l’urine. [37, 51] Afin de diminuer les risques de contaminations bactériennes et fongiques dans les cultures, on ajoute des antibiotiques pour les premières étapes. L’échantillon d’urine doit être
18
gardé à 4°C pendant un temps maximum de 4 heures, pour éviter la mort des quelques cellules présentes. [50] Un échantillon d’urine peut contenir entre 0 à 15 cellules avec un potentiel reprogrammable selon nos expériences.
2.1.2.2 L’isolement des cellules d’urine
Le pot d’urine d’environ 70 ml, en moyenne, est réceptionné et gardé à 4°C jusqu’au début du traitement. L’urine est ensuite manipulée de façon stérile sous une hotte biologique, jusqu’à la fin du protocole. Après une bonne homogénéisation par pipetage, l’urine est répartie dans des tubes Falcon de 50 ml. L’homogénéisation permet de récupérer toutes les cellules qui ont eu le temps de sédimenter dans le fond du pot. Les tubes sont ensuite centrifugés pendant 10 minutes à une vitesse de 400 x g. On enlève le surnageant en laissant seulement environ 1ml d'urine en plus du culot obtenu. Chacun des culots est ensuite rincé avec un même volume de 10 à 20 ml de tampon de lavage (D-PBS supplémenté avec du Pénicilline/Streptomycine [100 µg/ml, Gibco] et de l'Amphotericine B [0,5 µg/ml, Wisent]). À cette étape, le ou les pots d’urine sont également rincés et rassemblés dans ce même tube final. Cela permet de récolter des cellules qui auraient pu rester accrochées aux parois du pot. Pour obtenir notre culot de cellules final, on réalise une dernière centrifugation de 10 minutes à une vitesse de 200 x g. La resuspension se fait dans 2 ml de milieu primaire (DMEM High Glucose [Hyclone] et Ham’s F12 [Gibco] [1:1] supplémenté avec du Sérum de Veau Fœtal (SVF) [10% v/v, Wisent], du Pénicilline/Streptomycine [100 µg/ml, Gibco], de l'Amphotericine B [2,5 µg/ml, Wisent] et tous les suppléments du kit REGM SingleQuot [Lonza]) qu'on ensemence directement dans un puits d'une plaque de 12 puits. Ce milieu va aider les cellules urothéliales à adhérer sur la matrice. Le reste de suspension cellulaire est ajusté à 2ml de milieu primaire et ensemencé dans un deuxième puits. La matrice utilisée pour la culture des cellules urothéliales est la gélatine ([0,1%, Sigma] diluée dans du D-PBS). Avant l'ensemencement, on incube au moins 30 minutes à 37°C pour que la matrice puisse polymériser. La plaque de cellules est incubée à 37°C, 5% CO2, pendant 24h. Aux jours un, deux et trois (c'est-à-dire respectivement 24h, 48h et 72h), il faut ajouter 1 ml de milieu primaire à chacun des puits sans jamais enlever de
19
milieu. Le quatrième jour, à 96h, il faut enlever environ 4 ml de chacun des puits et y ajouter 1 ml de milieu Renal Epithelial/Mesenchymal Cell (RE/MC). Celui-ci comprend en part égale du milieu RE (milieu RE Cell Basal [Lonza] avec tous les suppléments du kit REGM Single Quot, [Lonza]) et du milieu MC (DMEM High Glucose [Hyclone] supplémenté avec du SVF [10% v/v, Wisent], du GlutaMax [1% v/v, ThermoFisher], du Non Essential Amino Acid (NEAA) [1% v/v, Gibco], du Pénicilline/Streptomycine [100 µg/ml, Gibco], du bFGF [5 ng/ml, Feldan], du PDGF-AB [5 ng/ml, Peprotech] et de l'EGF [5 ng/ml, Peprotech], filtré à 0,22 µm). Il permettra aux cellules de mieux adhérer mais également de proliférer davantage. Un lavage avec le tampon peut être réalisé avant le changement de milieu lorsque l’échantillon d’urine est très chargé en sédiments et cellules épithéliales non désirées. Par la suite, la moitié du milieu RE/MC doit être remplacée quotidiennement. Après 9 à 12 jours de culture, on amplifie les colonies formées par les cellules adhérées avec un passage ordinaire. Pour cela, les cellules sont lavées avec du tampon de lavage et dissociées à 37°C avec du TrypLE Express ([1X, Gibco]) pendant environ 2 à 3 minutes. Les cellules centrifugées sont réensemencées dans plusieurs puits de gélatine avec du milieu RE/MC à une densité d'environ 100 000 cellules par boîte de Petri de 35 mm.
2.1.2.3 La culture quotidienne des cellules d’urine
À partir du premier passage, les changements de milieu complets se font tous les deux jours. Les cellules supportent généralement jusqu’à 5 passages avant de devenir sénescentes, et sont passées aux 7 jours environ. Si la transduction n'est pas réalisée à ce moment là, les cellules peuvent être congelées. La congélation se fait de façon standard avec un milieu de congélation commercial qui est le Cryostem ([Cedarlane]). Ainsi, les premières étapes du passage ordinaire sont effectuées puis la resuspension se fait dans le milieu de congélation (Cryostem [Cedarlane] supplémenté avec du Rock Inhibitor (RI) Y-27632 Dihydrochloride salt, [10 µM, LC Laboratories]) à une concentration d'au moins 500 000 cellules par ml. Le RI est un supplément ajouté lorsqu'on veut augmenter la survie des cellules lors de stress causé aux cellules.
20
2.2 La reprogrammation des cellules d’urine
La reprogrammation nécessite une période d'environ deux mois de culture sans compter l'amplification des colonies et leur caractérisation. Elle se compose de trois parties principales : la transduction, l’apparition des clones sur MEF (Fibroblastes embryonnaires de souris) et le piquage des clones.
2.2.1 Les lignées cellulaires
Afin de réaliser ce projet, trois lignées cellulaires ont été utilisées : #1 et #4 pour la différenciation neuronale (reprogrammées par ma collègue Laurie Martineau) et #21 pour la reprogrammation cellulaire que j'ai réalisée moi-même.
2.2.2 Le protocole expérimental
Dans le but de dédifférencier des cellules somatiques, la compagnie ThermoFisher Scientific a développé un kit (CytoTune®-iPS 2.0 Sendai Reprogramming Kit) permettant l’insertion des facteurs de Yamanaka dans celles-ci, via le virus de Sendai. Chacun des protocoles est adapté selon le type cellulaire choisi pour l’expérience. Dans ce projet, le protocole de reprogrammation des fibroblastes est un peu optimisé pour des fins d’utilisation sur les cellules d’urine.
2.2.2.1 L'ensemencement des cellules d'urine
Pour commencer, la décongélation des cellules d’urine doit se faire 2 jours avant la transduction, dans une plaque de 6 puits sur gélatine. L’ensemencement doit se faire de telle sorte que le jour de la transduction il y ait entre 50 à 80% de confluence pour un puits.
2.2.2.2 La transduction
Pour la transduction, il faut ajouter un puits supplémentaire par puits à transduire pour le compte cellulaire. Celui-ci va permettre d'estimer le volume de virus nécessaire pour un nombre de cellules donné, car on considère que les puits ont proliféré de façon similaire. Pour cela, on procède à un calcul en utilisant le MOI (Multiplicité de l'Infection) de chaque virus. (Tableau 4)
Tableau 4 - Titre viral du lot #L2110082 des virus du kit de reprogrammation
Virus Titre du virus (virus/µL) MOI
hKOS 1.3*105 5
hc-Myc 1.2*105 5
21
Le MOI est un facteur indiquant le nombre de particules virales qui sont ajoutées par cellule pour l'infection. (55) Celui qui est suggéré par le manufacturier du kit est à 5-5-3 pour hKOS, hc-Myc et hKLF4 respectivement, pour un minimum de 1,5 * 106 cellules. (42) Le calcul suivant permet de déterminer le volume de virus nécessaire pour le nombre de cellules comptées :
Le titre des virus change en fonction des lots pour les kits de reprogrammation. Chaque puits de transduction a son tube stérile de 1ml de milieu RE/MC, comprenant la quantité adéquate calculée de virus. Ces tubes de virus sont conservés à -80°C et doivent être décongelés immédiatement avant utilisation à 37°C pendant 5 à 10 secondes. Le reste de la décongélation se fait à la température de la pièce. Une fois que les tubes de virus sont totalement décongelés, il faut les centrifuger brièvement puis les mettre sur de la glace immédiatement. Le milieu de culture est donc remplacé par le milieu approprié avec les virus, et les cellules sont placées à 37ºC dans l'incubateur, 5% CO2, pendant 24h.
2.2.2.3 La culture quotidienne des cellules transduites
Le lendemain et à 48h, le milieu doit être remplacé par du milieu RE/MC frais sans virus. Pendant ces deux jours, beaucoup de cellules devraient mourir pour nous indiquer en réalité la forte insertion du virus dans les cellules hôtes. Ensuite, le milieu est changé seulement le quatrième et le sixième jour. Le passage des cellules sur MEF se fait après une semaine de culture, soit le septième jour. Les MEF sont décongelées la veille du passage, soit le jour 6, sur gélatine et dans du milieu pour fibroblastes (DMEM [90%, ThermoFisher] supplémenté avec du SVF [10%, Wisent]). Un tube de MEF de 0,5 millions de cellules ([MTI Global Stem]) gardé dans l'azote liquide est décongelé et divisé en trois dans des boîtes de Petri de 35 mm, pour une confluence d'environ 167 000 cellules par puits. Le lendemain, il faut s'assurer que les MEF ont bien adhéré et qu'ils soient bien répartis sur toute la surface des puits. Les cellules transduites sont donc
22
dissociées au TrypLE Express et ensemencées à des densités de 25 000 à 100 000 cellules par puits, toujours avec du milieu pour fibroblastes. Les boîtes de Petri sont toujours incubées à 37ºC, avec 5% CO2. Après 24h, le milieu des boîtes de Petri est remplacé par du milieu hESCs (DMEM/F12 [78ml, Hyclone] supplémenté avec du KnockOut Replacement Serum (KSR) [20ml, ThermoFisher], du NEAA [10 mM, Gibco], du β-2Mercaptoethanol [55 mM, Sigma] et du bFGF Human Recombinant Protein [10 µg/ml, ThermoFisher]) afin de maintenir le caractère pluripotent des cellules transduites. [52] Ensuite, le changement de milieu se fait quotidiennement. Généralement, après trois semaines de culture sur MEF, les clones devraient être très bien visibles et presque prêts à être piqués. Avant la sélection, on cible les clones exprimant un marqueur de pluripotence par immunofluorescence sur cellules vivantes.
2.2.2.4 L'immunofluorescence sur cellules vivantes
L'immunofluorescence sur cellules vivantes, communément appelée en anglais le Live Staining, est réalisée lorsque les cellules ciblées sont en encore en culture. Cette expérience est faite dans le but de repérer les clones exprimant au moins un des marqueurs de surface retrouvés chez les cellules pluripotentes. Pour cela, on a choisi des anticorps directement couplés à un fluorochrome phycoérythrine (PE) pour qu'une seule incubation soit nécessaire. Les trois anticorps utilisés sont les suivants : TRA-1-60 ([1/100, Monoclonal de souris IgM, StemCell]), TRA-1-81 ([1/100, Monoclonal de souris IgM, StemCell]) et SSEA4 ([1/100, Monoclonal de souris IgG3, StemCell]). La dilution est réalisée dans 1ml de milieu hESCs pour chacun d'eux et le milieu est ensuite ajouté aux trois boîtes de Petri de culture des clones. L'incubation se fait à 37°C, 5% CO2, pendant au moins une heure. Du nouveau milieu hESCs est replacé dans les boîtes de Petri avant d'être observées au microscope à fluorescence.
2.2.2.5 Le piquage des clones
La sélection des clones se fait en fonction de l'expression des différents marqueurs de surface. Le choix va se porter uniquement sur les plus beaux clones ayant une forme plutôt ronde et bien définie, et exprimant l'anticorps qui était ciblé. En général, on procède au piquage d'environ 15 clones pour une lignée, afin de se
23
garantir d'avoir au moins une lignée d'hiPSCs. Ceci sollicite l'aide d'une aiguille très fine ainsi que d'embouts de micropipette 1000 µl. L'aiguille va servir à délimiter la zone où se trouvent le clone potentiel et l'embout à le décoller une fois démarqué. Une fois en suspension dans le milieu, les clones sont aspirés un par un grâce à une micropipette et sont ensemencés dans des boîtes de Petri de 35 mm enduits de matrigel ([10 mg/ml, Corning] dilué dans du D-PBS), dans du milieu mTeSRTM1 (milieu basal mTeSRTM1 [400 ml, StemCell] avec son supplément de 100 ml de mTeSRTM1 [5X, StemCell], et du RI [10 µM, LC Laboratories]). Ce milieu est un milieu commercial offrant les conditions optimales de survie et de prolifération aux cellules souches pluripotentes. Ces manipulations sont toujours réalisées en conditions stériles sous une hotte biologique, grâce à une loupe Lynx de Vision Engineering. Les clones choisis vont ensuite être incubés à 37ºC, sous 5% CO2.
2.3 La culture et caractérisation des hiPSCs
Les hiPSCs sont des cellules proliférant sous forme de colonies. Afin qu'elles puissent maintenir leur état de pluripotence (grâce au bFGF présent dans le milieu) [52], le milieu doit être remplacé tous les jours. Malgré cet entretien, il arrive que des cellules se différencient quand même. Pour y remédier, il est important de les retirer afin de garder la culture d'hiPSCs la plus pure possible.
2.3.1 La culture des hiPSCs
2.3.1.1 La matrice utilisée
Le matrigel est une matrice extraite d'une tumeur de souris riche en protéines extracellulaires. [53] Il est composé majoritairement de protéines extracellulaires, comme la laminine (Lam), et également de facteurs de croissance, tels que l'EGF ou le FGF. Il est distribué dans les boîtes de Petri et gardé 1h à la température de la pièce pour la polymérisation, avant utilisation.
2.3.1.2 La culture cellulaire
Les changements de milieu doivent se faire chaque jour, et les passages idéalement tous les 4 à 7 jours selon la confluence des cultures et l'état des
24
colonies. Le passage doit être fait dans la mesure du possible lorsque les cellules sont encore dans leur état exponentiel de croissance.
2.3.1.3 Le passage enzymatique
Les colonies sont dissociées grâce à la Dispase ([1 mg/ml, Gibco] diluée dans du D-PBS) qui est un agent enzymatique. Le passage est réalisé dans le but de maintenir la culture et de l'amplifier au besoin. Par conséquent, il est essentiel d'avoir plusieurs morceaux de colonies pour procéder au développement des lignées d'hiPSCs. Pour faciliter cette étape, on découpe les colonies à l'aide d'une aiguille puis on les incube 2 à 3 minutes à 37°C dans de la Dispase jusqu'à ce que les morceaux de colonies se décollent légèrement sur les extrémités. La Dispase est aspirée et remplacée par du milieu de culture, et les morceaux de colonies sont mis en suspension à l'aide d'un grattoir dans ce milieu. Par la suite, les colonies sont récupérées et centrifugées à une vitesse de 170 x g et resuspendues très délicatement dans du milieu mTeSRTM-1 supplémenté avec du RI. On essaie de compter entre 20 et 30 morceaux par boîte de Petri pour éviter les tapis cellulaires. Les cellules sont toujours incubées à 37°C, avec 5% CO2. On peut aussi briser les colonies par pipetage pour le passage mais l'obtention de morceaux trop petits pourrait nuire à la culture. En effet, plus les morceaux sont petits plus ils sont propices à la formation de cellules différenciées.
2.3.1.4 Les hiPSCs différenciées
Les hiPSCs différenciées peuvent être sous la forme de masse cellulaire en 3D formée au centre des colonies denses (Figure 8A) ou encore de cellules isolées autour des colonies (Figure 8B). Ces différenciations doivent être enlevées via une aiguille ou encore un embout de micropipette de 1000 µl sous la hotte biologique, grâce à la loupe Lynx. Ces cellules sont très envahissantes, c'est pourquoi il est important de vérifier chaque jour l'état des boîtes de Petri. Parfois, il est préférable d'enlever une colonie trop touchée par ces cellules plutôt que d'essayer de la récupérer.
25
2.3.1.5 La congélation et la décongélation des hiPSCs
Pour la congélation des hiPSCs, les colonies entières sont passées à la Dispase, puis resuspendues dans du Cryostem supplémenté avec du RI. La congélation ne nécessite pas de découpe de colonies car lors de la décongélation, elles seront assez brisées pour être ensemencées. Les tubes de congélation sont placés au congélateur à -80ºC, puis transférés dans des contenants d'azote liquide pour le stockage. La décongélation des hiPSCs doit se faire le plus rapidement possible, en mettant le tube de congélation dans un bain-marie à 37°C, environ 1 à 2 minutes, jusqu'à ce qu'il ne reste plus qu'un petit glaçon de milieu cellulaire. Les cellules sont transférées dans 4 ml de milieu mTeSRTM-1, et centrifugées à une vitesse de 170 x g pendant 5 minutes. Le culot cellulaire est resuspendu très délicatement dans du milieu de culture supplémenté avec du RI, puis on réensemence dans des boîtes de Petri enduites de matrigel. En général, un tube de congélation comprenant environ 20 à 30 colonies est décongelé dans 2 ou 3 boîtes de Petri. Les cellules sont incubées à 37°C, sous 5% CO2.
2.3.2 La caractérisation des hiPSCs
On caractérise les colonies d'hiPSCs car on veut s'assurer qu'elles sont bien pluripotentes au niveau génique et protéique.
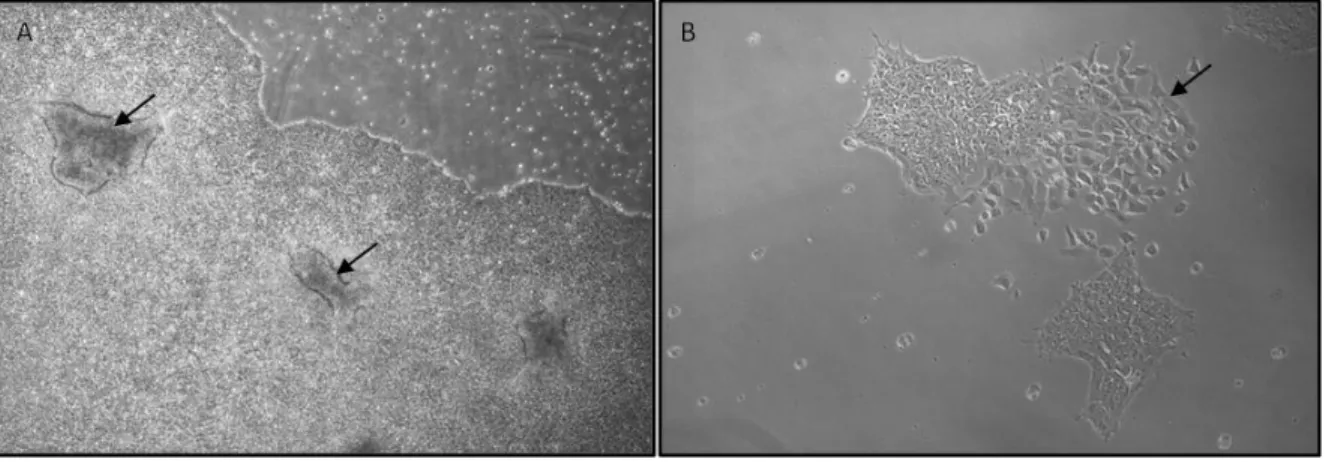
Figure 8 - Exemple des cellules différenciées retrouvées dans les colonies d'hiPSCs
A. Souvent lorsque trop de morceaux de colonies sont ensemencés dans une même boîte de Petri, les colonies se retrouvent
très denses et certaines cellules se différencient sous forme de masse cellulaire en 3D. B. Une population envahissante de cellules différenciées peut aussi apparaître sous forme de petites cellules isolées autour de belles colonies d'hiPSCs. Les flèches sur les deux photos indiquent la présence de ces cellules différenciées.



![Tableau inspiré et modifié à partir de l'article de Schlaeger, de 2015. [26]](https://thumb-eu.123doks.com/thumbv2/123doknet/5541476.132542/25.918.124.802.782.1044/tableau-inspiré-modifié-partir-article-schlaeger.webp)