HAL Id: dumas-01764122
https://dumas.ccsd.cnrs.fr/dumas-01764122
Submitted on 11 Apr 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Gestion Qualité des sous-traitants : approche par
analyse de risque
Célia Klotz
To cite this version:
Célia Klotz. Gestion Qualité des sous-traitants : approche par analyse de risque. Sciences pharma-ceutiques. 2018. �dumas-01764122�
1 Université de BORDEAUX
U.F.R DES SCIENCES PHARMACEUTIQUES
Année 2018
N°20
Thèse pour l’obtention du
DIPLOME d’ETAT de DOCTEUR EN PHARMACIE
Discipline : Assurance QualitéPrésentée et soutenue publiquement
Le 2 mars 2018 à Bordeaux
Par Célia KLOTZ
Née le 11 février 1992 à Lormont
Gestion Qualité des sous-traitants : approche par analyse
de risque
Directeur de thèse :
Mr Pierre TCHORELOFF
Jury
Président :
Mr Pierre TCHORELOFF, Professeur de Management de la Qualité, UFR
Bordeaux
Membres :
Mr Jean-François CAZAUBON, Responsable Assurance Qualité, SEPPIC
Mme Anne-Sophie KAUER, Docteur d’Etat en Pharmacie
2
Remerciements :
J’adresse mes remerciements à :
Monsieur TCHORELOFF pour m’avoir permis de me spécialiser dans un domaine qui me tient à cœur : l’Assurance Qualité au sein des industries de la santé. Merci d’avoir accepté de faire partie de mon jury et merci pour le savoir que vous m’avez transmis.
Monsieur Jean-François CAZAUBON pour m’avoir donné l’opportunité d’intégrer en qualité d’Alternante Coordinatrice Groupe l’entreprise SEPPIC, pour m’avoir formé et pour avoir été à mon écoute à chaque fois que j’en ai eu besoin.
Je souhaite également exprimer ma gratitude à :
L’ensemble du personnel du service Assurance Qualité de l’entreprise SEPPIC : Bérénice FOUCHE, Marine DAVID, Ruth LEFRANCOIS, Guilhem-Arnaud CATHALA, Pauline GARNIER, Aurélie SAMANIEGO, Maryse CARAUSSE et Philippe GOYAT pour leur aide et leur soutien lors de cette année. Ça a été un plaisir de travailler avec vous pendant un an, merci pour votre accueil, votre soutien et votre professionnalisme.
L’ensemble du personnel SEPPIC pour l’accueil réservé au sein des services de fabrication, conditionnement, contrôle qualité et maintenance sur le site de Castres et dans les différents bureaux sur le site de Paris.
L’ensemble des alternants pour mon intégration dans l’entreprise : Anja, Laura, Romain, Marianne, Thomas, Kevin, Fabien, Cindy, Thomas, Julie, Perrine, Livy, Benjamin, Morgane et Catherine. Cette dernière année n’aurait pas été la même sans vous.
Mes amies Laure Debarle, Alix Monnier, Charlotte Rivière et Gabrielle Tellier. La Dream Team merci d’avoir toujours été là et pour nos fabuleux voyages.
Geoffrey Garcia, Elodie Philips, David Perreira, Julien Giraud, Bénédicte Lott, Paul Gosson Varigault, Sylvain Tessier, Clément Rossignol, Marin Lahouati, Amélie Roussel-Dupré, Aurélie Labadie, Florian Deleau, Camille Paradis, Alix Pouget, Anthony Papeteau, Samy El Khadim, Anne Sophie Kauer pour ces six belles années d’examen, votre bonne humeur, nos fous rires, nos soirées arrosées… Mille mercis.
Manon et Sarah mes fidèles alliées.
Enfin je souhaite remercier ma famille. Je vous dédie cette thèse, merci maman, papa et Aurélie pour votre soutien inconditionnel durant mes années d’études dans les bons comme les mauvais moments. Vous êtes une source d’inspiration et de motivation pour toujours.
3
Table des matières
Glossaire... 5
Introduction : ... 7
Première partie : Définitions et notions ... 9
Chapitre 1 : Le système de gestion du risque : ... 9
Section 1 : Intégration de la gestion du risque dans le système de management ... 9
Section 2 : Les différentes étapes du processus de gestion de risque ... 10
Chapitre 2 : Méthodes d’évaluation du risque ... 11
Section 1 : La méthode AMDEC (analyse des modes de défaillances, de leurs effets et de leur criticité) ... 11
Section 2 : La méthode HAZOP (Hazard and Operability Study) : ... 11
Section 3 : Le HACCP (Hazard Analysis and Critical Control Points) ... 11
Chapitre 3 : Planification du Système de Management de la Qualité : ... 13
Section 1 : Organisme orienté client ... 13
Section 2 : Leadership ... 13
Section 3 : Implication du personnel ... 13
Section 4 : Approche processus ... 13
Section 5 : Management par approche système ... 13
Section 6 : Amélioration (continue) ... 16
Section 7 : Prise de décision fondée sur des preuves (Approche factuelle pour la prise de décision) ... 16
Section 8 : Management des relations avec les parties intéressées (Relation mutuellement bénéfique avec les fournisseurs) ... 16
Chapitre 4 : L’audit qualité externe ... 17
Section 1 : Définition ... 17
Section 2 : Planification des audits ... 18
Section 3 : Modalités de déclenchement – Organisation ... 18
Section 4 : Préparation de l’audit ... 19
Section 5 : Conduite de l’audit ... 19
A) Réunion d’ouverture : ... 19
B) Revues des documents et Collecte/vérification des données : ... 19
C) Etablissement de la liste des écarts : ... 19
D) Réunion de clôture : ... 20
E) Rapport d’audit : ... 20
F) Diffusion, clôture du rapport et archivage : ... 20
G) Clôture de l’audit et suivi du plan d’actions : ... 21
H) Habilitations des auditeurs : ... 21
Section 6 : Les risques potentiels ... 22
Deuxième partie : Cas pratique au niveau d’un fabricant de matières premières ... 23
Chapitre 1 : SEPPIC fabricant de matières premières ... 23
Section 1 : Matières premières ... 23
Section 2 : Présentation de SEPPIC ... 23
Section 3 : Politique d’entreprise et qualité ... 24
Section 4 : Les différentes activités externalisées ... 25
Chapitre 2 : Gestion des prestataires du besoin au maintien de l’agrément ... 27
Section 1 : Relation entre SEPPIC et ses prestataires ... 27
4
Section 3 : Définition du besoin : ... 31
Section 4 : Processus d’appel d’offre ... 31
Section 5 : Etablissement du CDC fonctionnel... 32
Section 6 : Lancement de l’appel d’offre ... 32
Section 7 : Processus de sélection ... 33
A) Phase de pré-sélection ... 33
B) Evaluation du prestataire ... 33
C) Analyse des résultats ... 34
Section 8 : CAPA : Actions Correctives et Préventives ... 35
A) L’enregistrement du problème qualité : ... 35
B) Evaluation préliminaire de la criticité : ... 35
Section 9 : Contrats ... 38
A) Supply Agreement ... 39
B) Quality Agreement ... 39
C) Cahier des charges ... 40
D) Cadre Général d’Exploitation ... 41
Section 10 : Décision Qualité et Agrément ... 41
Chapitre 3 : Traçabilité de la décision et suivi de l’agrément ... 42
Section 1 : Les différents prestataires SEPPIC ... 42
Section 2 : Les différents critères et les services responsables ... 42
Section 4 : Priorisation des actions en fonction de la note ... 50
Chapitre 4 : Application de la matrice ... 51
Section 1 : sous-traitant ... 51
A) Détermination de la criticité ... 51
B) Détermination de la note de performance et du niveau de risque ... 55
Section 2 : Commettant ... 57
A) Détermination de la criticité ... 57
B) Détermination de la note de performance et du niveau de risque ... 61
Conclusion ... 63
Bibliographie ... 65
Annexes ... 66
Annexe 1 : Fiche CAPA ... 67
5
Glossaire
AQ : Assurance Qualité
BPD : Bonnes Pratiques de Distribution BPF : Bonnes Pratiques de Fabrication BU : Business Unit (entité de l’entreprise) CAPA : Plan d’actions correctives et préventives CDC : Cahier Des Charges
CGE : Cadre Général d’Exploitation DO : Donneur d’Ordre
EFfCI : European Federation for Cosmetic Ingredients (Fédération Européenne pour les Ingrédients Cosmétiques)
EXCiPACT : International excipients certification (Certification Internationale des excipients)
ICH : International Council for Harmonisation of Technical Requirements
forPharmaceuticals for Human Use (Conseil international d'harmonisation des exigences
techniques pour l'enregistrement des médicaments à usage humain)
IPEC : International Pharmaceutical Excipients Council (Conseil International des Excipients Pharmaceutiques)
ISO : International Organization for Standardization (Organisation Internationale de normalisation)
NC : Non Conformité
PDCA : Plan Do Check Act (planifier- faire- vérifier-agir)
QAA : Quality Assurance Agreement (Contrat d’Assurance Qualité) QEQ : Questionnaire d’Evaluation Qualité
REACH : Registration, Evaluation and Autorisation of CHemicals (Enregistrement, Evaluation et Autorisation des Produits Chimiques)
SAg : Supply Agreement (contrat fournisseur)
SEPPIC : Société d’Exploitation de Produits Pour les Industries Chimiques SMQ : Système Management Qualité
6
Figures et Tableaux :
Figure 1 - le processus de gestion du risque ... 9
Figure 2 HACCP ... 12
Figure 3 – Produits vendus par SEPPIC et fabriqués (en totalité ou en partie) dans un atelier ou sur un site tiers ... 25
Figure 4 - schéma représentant les différents produits suivis par SEPPIC... 26
Figure 5 - Relation client/fournisseur ... 27
Figure 6 - Gestion d’une CAPA ... 35
Figure 7 - Evaluation de la criticité du problème qualité ... 36
Figure 8 - les différents contrats existants ... 38
Tableau 1 - Liste des écarts ... 19
Tableau 2 - Points d'encouragement ... 20
Tableau 3 - Evaluation des risques lors d’un Audit Qualité ... 22
Tableau 4 - La gestion des activités externalisées ... 29
Tableau 5 - Risques liés à la gestion Qualité des activités externalisées ... 30
Tableau 6 - Détermination du niveau de risque qualité pour l’agrément du prestataire ... 34
Tableau 7 - Les différentes Certifications existantes en fonction des différents produits ... 39
Tableau 8 - Evaluation du risque pour l’agrément du prestataire ... 41
Tableau 9 - Informations utilisées pour l’analyse de criticité des prestataires ... 43
Tableau 10 - Construction de la matrice, les différentes notations en fonction des différents critères ... 45
Tableau 11 - Certifications du prestataire en fonction du marché visé ... 48
Tableau 12 - Détermination du niveau de risque de notre prestataire ... 50
Tableau 13 - Exemple de cotation, information sur le sous-traitant ... 51
Tableau 14 - Exemple de cotation, information sur le sous-traitant et note marché ... 52
Tableau 15 - Exemple de cotation, information sur le sous-traitant et note opération ... 53
Tableau 16 - Exemple de cotation, information sur le sous-traitant, note libération et note de criticité ... 54
Tableau 17 - Exemple de cotation, information sur le sous-traitant, note SMQ ... 55
Tableau 18 - Exemple de cotation, information sur le sous-traitant, note performance et niveau de risque ... 56
Tableau 19 - Exemple de cotation, information sur le commettant ... 57
Tableau 20 - Exemple de cotation, information sur le commettant et note marché ... 58
Tableau 21 - Exemple de cotation, information sur le commettant et note opération ... 59
Tableau 22 - Exemple de cotation, information sur le commettant, note libération et note de criticité ... 60
Tableau 23 - Exemple de cotation, information sur le commettant, note SMQ ... 61
Tableau 24 - Exemple de cotation, information sur le commettant, note performance et niveau de risque ... 62
7
Introduction :
Le médicament :
« On entend par médicament toute substance ou composition présentée comme possédant des
propriétés curatives ou préventives à l’égard des maladies humaines ou animales, ainsi que toute substance ou composition pouvant être utilisée chez l’homme ou chez l’animal ou pouvant leur être administrée, en vue d’établir un diagnostic médical ou de restaurer, corriger ou modifier leurs fonctions physiologiques en exerçant une action pharmacologique, immunologique ou métabolique. »1
Excipient :
« Substance associée au principe actif d'un médicament et dont la fonction est de faciliter
l'administration, la conservation et le transport de ce principe actif jusqu'à son site d'absorption (par opposition à principe actif). »2
Un médicament est constitué de deux composants : des excipients et une ou plusieurs substances actives. L’activité de fabrication d’un médicament a toujours été une activité réglementée. Elle est régie par des normes, des référentiels, des standards auxquels les professionnels de la santé doivent se conformer. Face à l’augmentation des besoins d’excipients innovants et pour rester compétitifs, les industriels de la santé ont en profité pour externaliser leurs ressources d’approvisionnement.
Les autorités ont réagi en renforçant la réglementation afin de maîtriser au mieux les risques notamment Qualité (révision des Bonnes Pratiques de Fabrication, apparition de la Directive 2011/62 sur les médicaments falsifiés, apparition des Lignes directrices du 19 Mars 2015 sur les Bonnes Pratiques de Distribution des substances actives et sur l’évaluation des risques des excipients). La réglementation s’est aujourd’hui encore plus complexifiée. Pour maîtriser les risques Qualité dans l’externalisation des activités et répondre au exigences règlementaires et des clients, les industriels doivent donc auditer de façon régulière leurs sous-traitants. Cependant il est impossible d’auditer annuellement toutes les activités externalisées, on pourra alors mettre en place une analyse de risque pour prioriser nos actions et définir quelles solutions peuvent être mises en place.
La gestion du risque a pour but d’atteindre ou de dépasser les objectifs d’une organisation grâce à l’approche réfléchie des opportunités et des risques. Sont évalués les événements, les actions et les développements qui peuvent empêcher une entreprise d’atteindre ses objectifs et de mener à bien sa stratégie.
Les avantages de la gestion du risque sont :
- L’amélioration de la marge de manœuvre de l’entreprise
- L’identification et gestion des risques et des opportunités à l’échelle de toute l’entreprise - La détection précoce (système d’alarme précoce), minimisation et maîtrise des dangers
et des risques
1 article L.5111-1 code de la santé publique 2 Dictionnaire Larousse
8 - La prévention des impondérables en entreprise et minimisation des pertes
- D’assurer l’avenir à long terme - Le suivi de l’organisation
- D’optimiser la mise de capital et assurer la capacité de rendement à long terme - D’identifier et saisir les opportunités pour l’entreprise
- Le contrôle du risque pour mieux profiter des opportunités
9
Première partie : Définitions et notions
Chapitre 1 : Le système de gestion du risque :
Section 1 : Intégration de la gestion du risque dans le système de management
La politique de risque découle de la politique de l’organisation ; elle est planifiée, mise en œuvre, contrôlée et constamment améliorée par la direction générale. La gestion du risque relève de la direction. Les systèmes de management basés sur le modèle ISO 9000 s’y prêtent parfaitement. Il est important que la gestion du risque puisse être intégrée le plus facilement possible et donc à moindre coût dans le système de management.
Le modèle d’entreprise, qui se situe dans le champ de tension entre les besoins et la satisfaction de la clientèle d’une part et les exigences des parties intéressées, en est le point de départ. Le processus de management comprend également la gestion du risque.
10
Section 2 : Les différentes étapes du processus de gestion de risque
Le processus de gestion du risque comprend les étapes suivantes :
- La définition du système est une phase préparatoire à l’évaluation du risque. Des objectifs entrepreneuriaux clairs doivent être fixés par le management dans le cadre de l’organisation. L’évaluation du risque vise à détecter les risques et opportunités potentiels sur la voie des objectifs de l’entreprise. Les objectifs ne doivent pas uniquement être ancrés dans l’esprit des dirigeants, mais également fixés par écrit. - Dans l’identification du risque, tous les risques potentiels doivent être listés sous forme
de scénario. La check-list est appelé « liste des dangers ».
- L’analyse du risque comprend l’évaluation des scénarios selon leur probabilité et leur potentiel de dommages. Elle comprend également l’analyse des causes ou des dysfonctionnements. Les risques évalués sont transcrits dans la matrice. Sur ces bases, la direction décide quels risques sont tolérables et quels sont ceux qui doivent être traités en priorité.
- Concernant la maîtrise du risque, il s’agit d’introduire des mesures pour éviter ou réduire le risque grâce aux informations acquises.
- La mission de contrôle du risque consiste à appliquer correctement les mesures de maîtrise du risque. Le contrôle peut s’effectuer de deux manières en tant qu’activité continue ou par contrôles périodiques. Le contrôle continu se fait en temps réel et peut donc réagir plus rapidement à des conditions qui évoluent. Il est ainsi plus efficace qu’un contrôle périodique.
11
Chapitre 2 : Méthodes d’évaluation du risque
Il existe différentes méthodes ayant fait leurs preuves.
Section 1 : La méthode AMDEC (analyse des modes de défaillances, de leurs
effets et de leur criticité)
Cette méthode est essentiellement utilisée dans l’industrie automobile, pour les appareils médicaux ou autres systèmes techniques. L’AMDEC peut identifier les domaines où des mesures préventives supplémentaires peuvent être appropriées pour minimiser les risques. L’AMDEC permet une cotation de risque afin de pouvoir les classer du plus critique au moins critique pour pouvoir prioriser les actions correctives à mettre en place. Pour évaluer le risque nous pouvons déterminer :
- La sévérité du risque (entraîne-t-il une non-conformité ? Est-il détectable ou non ?) - L’occurrence du risque : ce risque est-il récurrent, fréquent, aléatoire ou non-rencontré ? - La probabilité de non détection du risque : moins le problème sera détectable plus la
note imputée sera élevée.
Pour obtenir la note finale il faudra multiplier les notes imputées aux trois facteurs et déterminer un seuil à partir duquel on définit le risque critique pour lequel on va mettre une action en place.
Section 2 : La méthode HAZOP (Hazard and Operability Study) :
Cette méthode permet d’identifier et d’évaluer des risques provoqués par la dérive d’un processus par rapport à son déroulement normal. C’est une technique de brainstorming : on identifie les risques par des mots-clés applicables aux paramètres du processus.
Section 3 : Le HACCP (Hazard Analysis and Critical Control Points)
Cette méthode est surtout utilisée dans l’industrie alimentaire. HACCP repose sur sept principes :
12
Figure 2 HACCP
L’évaluation des risques permet de déterminer à quel moment un risque est supportable et peut donc être accepté par le propriétaire du risque. A cet effet, un seuil de tolérance de risque est souvent indiqué dans le paysage des risques. On pourra dire que les risques qui sont situés au-delà de ce seuil ne doivent pas être tolérés ; par contre, ceux qui sont situés sous ce seuil sont acceptables.
13
Chapitre 3 : Planification du Système de Management de la Qualité :
Il faut se baser sur les huit principes du SMQ :
Section 1 : Organisme orienté client
Il faut satisfaire les exigences de nos clients pharmaceutiques, nutraceutiques, cosmétiques ou industriels pour une industrie fabriquant des matières premières comme SEPPIC et savoir dépasser leurs attentes en analysant les risques et opportunités susceptibles d’avoir une incidence sur la conformité de nos produits. D’autre part il faut aussi satisfaire les exigences légales et réglementaires applicables et s’assurer de leur compréhension.
Section 2 : Leadership
Les dirigeants doivent s’assurer que les responsabilités et autorités sont bien définies pour que le personnel puisse totalement s’impliquer dans son environnement de travail.
Section 3 : Implication du personnel
Tout le personnel doit être impliqué ; la qualité des services et des produits est l’affaire de tous. Les personnels sont au cœur de l’organisation, ils ont une place prépondérante aussi bien pour la mise en œuvre des processus que pour l’amélioration. Ils doivent être compétents, habilités et impliqués à tous les niveaux de l’organisme. Ils sont essentiels pour créer de la valeur.
Section 4 : Approche processus
Permet d’identifier des processus, de les manager et de voir leurs interactions pour obtenir des résultats conformes à la politique qualité et à l’orientation stratégique de l’organisme.
Section 5 : Management par approche système
Il faut identifier, comprendre et maîtriser un système de processus indépendant mais corrélé ce qui permet de vérifier l’efficience d’un organisme. On distingue différents processus :
- Processus de Management qui agissent sur le fonctionnement et la dynamique de l’amélioration de l’organisme
- Processus de réalisation (Conception, Production...) qui ont un impact direct sur la satisfaction du client.
- Processus support qui ne crée pas de valeur directement perceptible par le client externe mais qui sont nécessaires au fonctionnement de l’organisme.
L’adoption d’un système de management de la qualité relève d’une décision stratégique de l’organisme pour améliorer ses performances globales :
- Fournir des services conformes aux exigences du client et réglementaires - Amélioration de la satisfaction du client
- Prise en compte des risques et opportunités associés à la relation client/fournisseur - Aptitude à démontrer la conformité aux exigences spécifiées du système de management de la qualité
14
On peut utiliser une approche processus : qui intègre le cycle PDCA (Plan-Do-Check-Act) qui permet à un organisme de planifier ses processus et leurs interactions. Avec ce cycle PDCA on s’assure que le processus est doté de ressources adéquates et géré de manière appropriée et que les opportunités sont bien déterminées et mises en œuvre.
Indicateurs pour le suivi des activités externalisées : - Suivi des révisions de l’agrément des fournisseurs - Cahier des charges
- Suivi des QEQ - AUDIT
- Spécifications du produit - Analyses à réception
Chaque indicateur doit posséder des paramètres spécifiés et documentés. Les indicateurs sont nécessaires pour atteindre les objectifs, il faudra donc les établir, les mesurer et les surveiller. Ils permettent de vérifier que l’activité est réalisée conformément à ce qui a été déterminé lors de l’implémentation. Si des écarts apparaissent, ceux-ci doivent être alors gérés correctement. Exigences :
Réglementaires : BPF part II, EXCIPACTS, EFfCI Normatives : ISO 9001, ICHQ9 et ICHQ10
Ressources : humaines, informatiques, financières.
Le management par approche système débouche obligatoirement sur une amélioration continue de la performance globale de l’entreprise. Ainsi, la relation client-fournisseur et son évolution en est facilitée.
Ci-dessous nous pouvons voir un exemple de cartographie des processus pour la gestion des activités externalisées dans un laboratoire fabricant de matières premières tel que SEPPIC.
15 Objectif : SMQ du sous-traitant répondant aux exigences clients et règlementaires
- Obtenir une relation de partenariat avec nos sous-traitants
- Réunion mensuelle pour définir la stratégie d’évaluation des sous-traitants
Objectif : SMQ du sous-traitant répondant aux exigences clients et règlementaires
- Obtenir une relation de partenariat avec nos sous-traitants
- Réunion mensuelle pour définir la stratégie d’évaluation des sous-traitants
Identification et mise en œuvre de toute amélioration nécessaire
Changement de fournisseur
Avenant au contrat
CAPA
• Evaluation du fournisseur : indicateurs qualité (réclamation, NC, contrats en place, certifications du sous-traitant) • AUDIT • QEQ MANAGEMENT T IT SUPPORT OUTPUTS : - Conformité réglementaire - Relation SEPPIC/ sous-traitants bénéfique - Création de valeur ajoutée pour les deux parties : contrat en place CUSTOMERS : - Industrie Nutraceutique - Industrie Pharmaceutique - Industrie cosmétique - Industrie chimique - Autorités - SUPPLIER : - Sous-traitants - Commettants - Produits d’extension de Gamme - Les autorités INPUTS : - Besoin d’externaliser une activité - CDC - Exigences règlementaires : BPF (chap 7), BPD - Norme ISO 9001 - EFfCI, Excipact - Norme NFX REALISATION Contrôle Qualité Assurance Qualité Supply Chain Expression claire des besoins : AQ, utilisateurs, achats Appel d’offre : établissement du CDC fonctionnel SELECTION du sous-traitant Choix du
fournisseur soit par les achats soit par les BU APPROBATION par l’AQ : analyse de risque Agrément du fournisseur CERTIFICATION par l’AQ Contrat Commande/achat/ contrôle à réception Suivi du fournisseur : maintien de l’agrément AUDIT Indicateurs qualité CAPA Achats Business Units
16
Section 6 : Amélioration (continue)
Il faut déterminer les opportunités d’amélioration pour entreprendre des actions nécessaires pour satisfaire aux exigences du client et réglementaires.
Il faut identifier et maîtriser la non-conformité et les actions correctives qui en découlent, c’est-à-dire prendre en charge les conséquences du problème qui est survenu en analysant la non-conformité, en recherchant la cause de cette non-conformité et en évitant les non-conformités similaires. On devra donc mettre des actions en place, évaluer l’efficacité de ces actions, évaluer les risques et les opportunités (ex : SWOT), faire un feedback de la qualité du produit (ressource interne et externe) pour avoir une meilleure connaissance du processus ce qui pourra amener possiblement à une modification du SMQ.
Section 7 : Prise de décision fondée sur des preuves (Approche factuelle pour la
prise de décision)
C’est une approche qui permet de s’appuyer sur des données précises, sur une analyse logique des données et des informations pour prendre les bonnes décisions.
Les données peuvent être : des indicateurs, des tableaux de bord, le suivi de production, les non-conformités, etc.
Il faut prendre une décision en ayant toutes les informations nécessaires ; on parle ici de traçabilité des données.
Les outils pour la prise de décision : 5M (main d’œuvre, méthode, matière, milieu, moyen), méthode des 5 Pourquoi, le QQOQCCP (Qui, Quoi, Où, Quand, Comment, Combien, Pourquoi ?)
Section 8 : Management des relations avec les parties intéressées (Relation
mutuellement bénéfique avec les fournisseurs)
La détermination des risques et des opportunités permet leur analyse et conduit à planifier les actions appropriées en tenant compte des enjeux externes et internes et des besoins et attentes des parties intéressées pertinentes.
Exemple d’un risque : la disparition possible d’un fournisseur clé fait courir le risque de ne plus pouvoir livrer les produits promis à certains clients.
17
Chapitre 4 : L’audit qualité externe
Section 1 : Définition
C’est un élément indispensable qui intervient dans l’agrément et le suivi du fournisseur
« Audit / Inspection :
Définir la périodicité et le champ des audits, internes et externes, en prenant en compte des facteurs tels que :
- Les exigences réglementaires existantes ;
- Le statut de conformité globale et l’historique de l’entreprise ou du site ; - La robustesse de la gestion du risque qualité menée par l’entreprise ; - La complexité du site ;
- La complexité du procédé de fabrication ;
- La complexité du médicament et son importance thérapeutique ;
- Le nombre et l’importance des dommages (par exemple : rappel de lot) ; - Les résultats des audits/inspections précédents ;
- Les changements substantiels intervenus en matière de locaux, d’équipements,
de procédés de personnel clés ;
- L’expérience en matière de fabrication d’un médicament (par exemple :
fréquence, volume, nombre de lots)
- Les résultats des contrôles effectués par des laboratoires de contrôle officiels. »3
Dans la norme ISO 19001 : Guideline for Auditing Management Systems, on trouve trois chapitres qui expliquent les principes de l’audit, comment bien le manager, la réalisation d’audits de systèmes de management et cette norme donne des lignes directrices sur l’évaluation de la compétence des personnes impliquées dans le processus d’audit, y compris le ou la responsable du management du programme d’audit, les auditeurs et les équipes d’audit. :
- Partie 5 « Managing an audit programme » - Partie 6 « Performing an audit »
- Partie 7 « competence and evaluation of auditors »
18
Section 2 : Planification des audits
L’équipe chargée de la planification des audits, fournisseurs ou sous-traitants, est composée des différentes entités impliquées : Achats, Approvisionnements, Production et Qualité (Contrôle Qualité et Assurance Qualité). La coordination de la planification des audits est sous la responsabilité de la Direction Qualité Groupe.
La fréquence des audits externes varie entre les prestataires les plus critiques et les prestataires les mieux maîtrisés.
Le planning des audits se définit également en fonction des éléments factuels et historiques enregistrés, tels que : réalisation ou non du plan d’audits de l’année n-1, incidents/anomalies, nombre de litiges et/ou réclamations clients Qualité, résultat des audits précédents, conclusions du QeQ si existant.
Tous ces éléments permettent la priorisation des audits lors de l’établissement du plan. Le planning des audits est revu plusieurs fois par an, il est mis à jour en conséquence.
Tous les plans annuels d’audits sont examinés lors des revues annuelles de Direction en début d’année. Ces revues analysent la réalisation des audits planifiés de l’année n-1 et leurs grandes conclusions et valident les plans d’audit de l’année n.
Section 3 : Modalités de déclenchement – Organisation
Sur la base des plans annuels, le déclenchement des audits est initié par le Responsable de l’audit (auditeur). Ce déclenchement doit alors être annoncé et motivé. L’objectif et le champ de l’audit sont décrits et une date est proposée à ce moment là auprès de l’audité.
La réalisation de l’audit peut être motivée par différents évènements : - Audit prévu dans le programme annuel,
- Mises-en place et suivi d’actions dans le cadre d’amélioration continue, - Nouvelle réglementation
- Souhait d’auto-évaluation d’un service interne ou d’un processus, - Agrément d’un nouveau couple fournisseur/matière
- Suivi de l’activité d’un sous-traitant ou d’un commettant ou des dysfonctionnements rencontrés,
- Préparation d’un audit client,
- Audit pour cause (audit non prévu, motivé par une dérive Qualité sérieuse ou une question précise).
19
Section 4 : Préparation de l’audit
L’audit est conduit par un auditeur expérimenté et habilité. C’est le Responsable de l’Audit. Préalablement à l’audit, le Responsable d’Audit rédige et adresse directement à l’Audité une Notification d’audit avant l’audit précisant au minimum :
- L’objectif,
- Le référentiel utilisé,
- La date, le programme et les dispositions logistiques,
- La composition de l’équipe d’audit : Responsable d’audit, Co-auditeur, accompagnateurs si applicable.
Le Responsable de l’Audit doit également collecter et prendre connaissance des contrats en vigueur et des engagements réciproques avec son fournisseur.
Section 5 : Conduite de l’audit
A) Réunion d’ouverture :
Lors de la réunion d’ouverture, le plan d’audit est lu intégralement et reprécisé par l’auditeur. Il s’assure également de l’acceptation de celui-ci par l’audité et de la disponibilité des ressources. Un enregistrement des personnes présentes est également réalisé.
B) Revues des documents et Collecte/vérification des données :
L’audit est alors réalisé sur la base de documents référentiels écrits disponibles le cas échéant et/ou questionnaires de pré-audit. Les constats et preuves sont recueillis tout au long des entretiens avec les audités et visites sur sites. Ils doivent être le reflet concret des observations réalisées des activités et de l’examen des documents disponibles.
C) Etablissement de la liste des écarts :
Les écarts sont classés en :
Tableau 1 - Liste des écarts
Ecart Critique Non-conformité par rapport au référentiel applicable, présentant un risqué significatif, et inacceptable, nécessitant une action corrective urgente et programmée. Le risque est avéré, la conséquence a été observée.
Ecart majeur Non-conformité par rapport au référentiel applicable, pouvant entraîner un risque significatif et inacceptable, nécessitant une action corrective. Le risque est potentiel, la conséquence n’a pas été observée.
Ecart mineur Non-conformité, par rapport au référentiel applicable, n’entraînant pas de risque inacceptable et ne remettant pas en cause la fiabilité du système ; nécessitant une amélioration spécifique.
20 Les points d’encouragements sont classés en :
Tableau 2 - Points d'encouragement
Commentaire Piste de progrès pour améliorer la performance d’un élément sans toutefois dépasser les exigences du référentiel.
Bonne pratique
Elément sur lequel l’audité, doit dépasser les exigences du référentiel, soit se distinguer par une pratique, méthode ou technique performante.
Tout écart doit être factuel, être vérifiable et faire référence au chapitre du référentiel opposable dans le rapport d’audit.
D) Réunion de clôture :
A l’issue de l’audit, une réunion de clôture réunissant les principales personnes ayant participé à l’audit, l’auditeur fait ses remerciements, expose les points positifs, énumère et commente les écarts faits lors de l’audit ainsi que ses conclusions. Cette réunion est menée et clôturée par le Responsable d’audit.
E) Rapport d’audit :
Un rapport d’audit synthétique est ensuite rédigé par le Responsable de l’Audit. Ce rapport est formalisé sous une forme écrite, complète, précise, concise et claire.
La classification des écarts et les délais concernant le rapport d’audit sont rappelés dans le rapport.
F) Diffusion, clôture du rapport et archivage :
Le Responsable de l’audit diffuse le Rapport de l’audit. Selon la confidentialité du contenu du rapport, la diffusion peut aller au :
- Service Qualité du site concerné pour les Audits Qualité, - Directeur du site audité concerné
- Toute autre personne concernée par l’audit,
- Copie obligatoire au Service Achats pour les audits Fournisseurs/ sous-traitants. Dans le cas des audits Fournisseurs/ sous-traitants le rapport est diffusé uniquement à l’audité, dont la responsabilité est de communiquer et gérer l’information auprès des participants et personnes rencontrées lors de l’audit.
21
G) Clôture de l’audit et suivi du plan d’actions :
Le plan d’action est validé et signé par le Responsable de l’Audit. La validation du Plan d’Actions marque la Clôture de l’audit. Le Responsable de l’audit informe l’équipe auditée et les parties intéressées de la Clôture de l’audit.
Suivi du plan d’action :
Le responsable Qualité de l’entité auditée est responsable du suivi de la mise en œuvre des actions correctives sur le site audité.
Sauf cas considéré comme critique, Le suivi du Plan d’actions d’un fournisseur externe (vérification et relances des actions) est vérifié et assuré lors de l’audit suivant.
Pour les écarts critiques, l’action corrective doit être immédiate et le plan doit être clôturé sous 3 mois. Le plan d’action est clôturé une fois que toutes les actions sont terminées. Le plan d’action doit impérativement être clôturé lors de la réalisation de l’audit suivant.
H) Habilitations des auditeurs :
Les audits sont réalisés par des auditeurs internes ou externes.
Pour être habilité, tout auditeur externe : doit avoir une expertise ou une certification d’auditeur reconnue, accompagnées d’une expérience suffisante et récente des audits Qualité.
22
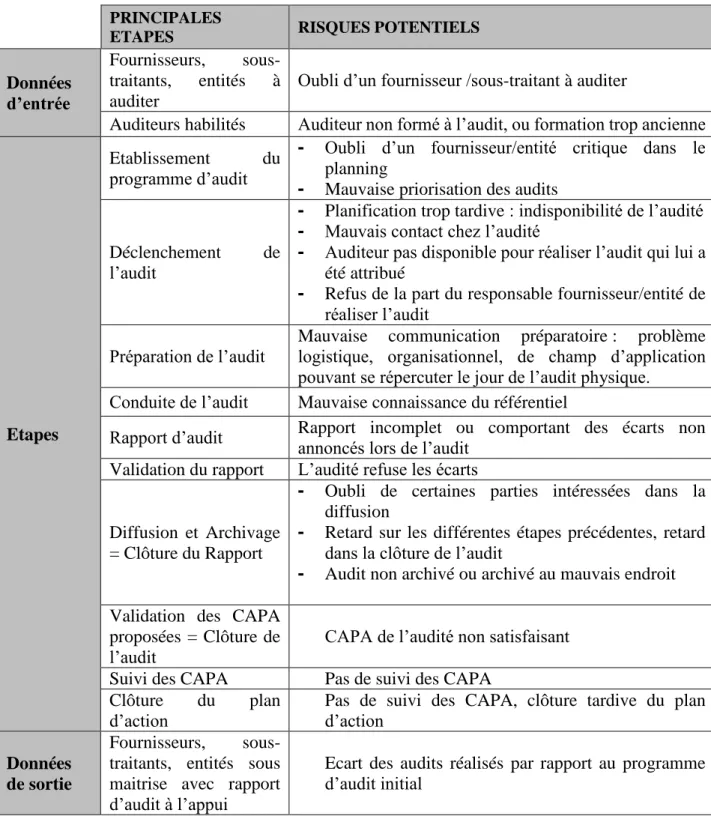
Section 6 : Les risques potentiels
Dans le tableau suivant, on peut voir les différentes étapes ainsi que les risques potentiels :
Tableau 3 - Evaluation des risques lors d’un Audit Qualité PRINCIPALES
ETAPES RISQUES POTENTIELS
Données d’entrée
Fournisseurs, sous-traitants, entités à auditer
Oubli d’un fournisseur /sous-traitant à auditer
Auditeurs habilités Auditeur non formé à l’audit, ou formation trop ancienne
Etapes
Etablissement du
programme d’audit
- Oubli d’un fournisseur/entité critique dans le planning
- Mauvaise priorisation des audits
Déclenchement de
l’audit
- Planification trop tardive : indisponibilité de l’audité - Mauvais contact chez l’audité
- Auditeur pas disponible pour réaliser l’audit qui lui a été attribué
- Refus de la part du responsable fournisseur/entité de réaliser l’audit
Préparation de l’audit
Mauvaise communication préparatoire : problème logistique, organisationnel, de champ d’application pouvant se répercuter le jour de l’audit physique.
Conduite de l’audit Mauvaise connaissance du référentiel
Rapport d’audit Rapport incomplet ou comportant des écarts non annoncés lors de l’audit
Validation du rapport L’audité refuse les écarts
Diffusion et Archivage = Clôture du Rapport
- Oubli de certaines parties intéressées dans la diffusion
- Retard sur les différentes étapes précédentes, retard dans la clôture de l’audit
- Audit non archivé ou archivé au mauvais endroit Validation des CAPA
proposées = Clôture de
l’audit CAPA de l’audité non satisfaisant
Suivi des CAPA Pas de suivi des CAPA
Clôture du plan
d’action
Pas de suivi des CAPA, clôture tardive du plan d’action
Données de sortie
Fournisseurs, sous-traitants, entités sous maitrise avec rapport d’audit à l’appui
Ecart des audits réalisés par rapport au programme d’audit initial
23
Deuxième partie : Cas pratique au niveau d’un fabricant de matières
premières
Chapitre 1 : SEPPIC fabricant de matières premières
Section 1 : Matières premières
Les excipients pharmaceutiques, nutraceutiques, cosmétiques peuvent remplir de multiples fonctions et ont un rôle-clé dans la formulation des produits finaux. Ils agissent sur la stabilité des substances actives, leur solubilisation et dissolution.
Pour les médicaments, ils servent de support à la substance active en facilitant sa mise en forme galénique et l’administration du médicament en fonction de la voie retenue. Ils facilitent le transport de la substance active et son ciblage ; ils assurent également de nombreuses autres fonctions. Associés aux substances actives, ils participent pleinement au mode d’action du médicament.
Pour les cosmétiques, ils sont l’ingrédient ou l’association d’ingrédients le plus important en quantité : ils peuvent représenter jusqu’à 90% des cosmétiques. L’excipient peut être neutre ou peut déjà constituer un actif à part entière.
Pour réussir un développement pharmaceutique, il est essentiel de connaître les caractéristiques des excipients, leurs paramètres critiques et leurs fonctionnalités afin de comprendre leur influence sur le procédé et la qualité du produit fini. Mais il faut également prendre en compte les aspects d’innocuité de ces composants lors du développement, notamment en termes de toxicité et de tolérance des excipients utilisés.
Section 2 : Présentation de SEPPIC
SEPPIC est une société fondée en 1943 qui regroupe aujourd’hui plus de 600 collaborateurs répartis dans le monde entier. Depuis plus de 70 ans, SEPPIC développe et commercialise des spécialités chimiques innovantes destinées aux marchés de la cosmétique, la pharmacie, la nutrition, les vaccins et les spécialités industrielles. SEPPIC bénéficie d’un leadership reconnu sur de nombreuses gammes de produits et réunit une combinaison unique d’expertises scientifiques dans le domaine de la chimie, de la formulation et de l’objectivation : polymères, tensioactifs et technologies d’émulsion, biologie, immunologie, transformation de produits naturels.
SEPPIC allie la réactivité et le dynamisme d’une entreprise de taille moyenne à la solidité d’un groupe industriel de dimension internationale : autant d’atouts qui lui permettent de s’imposer comme fournisseur de référence sur les marchés dynamiques de la santé et de la beauté.
24
Section 3 : Politique d’entreprise et qualité
Contexte Qualité :
La qualité est au service de la stratégie de l’entreprise SEPPIC, elle-même centrée sur la volonté première de satisfaire le client.
Les exigences Qualité de SEPPIC s’appuient sur plusieurs référentiels que, soit la réglementation, soit les exigences des clients imposent :
- ISO 9001 : 2008 (bientôt 2015) : Système de Management de la Qualité
- EXCiPACT : Bonnes Pratiques de Fabrication pour les excipients pharmaceutiques - EFfCI : Bonnes Pratiques de Fabrication pour les ingrédients cosmétiques
- BPF part I : Bonnes Pratiques de Fabrication des Médicaments à Usage Humain (pour l’activité pharmaceutique nouvelle)
- BPF part II (ICHQ7a) : Bonnes Pratiques de Fabrication pour les Substances Actives Pharmaceutiques
- BPD : Bonnes Pratiques de Distribution en Gros des Médicaments à Usage Humain (pour l’activité pharmaceutique nouvelle).
Ces différents référentiels sont aujourd’hui applicables aux produits et entités dont ils dépendent et font l’objet de Certifications officielles obtenues après audits physiques sur les différents sites. Ils visent à garantir la conformité des conditions de production ou de fonctionnement des pratiques de SEPPIC, ainsi que la Qualité des produits commercialisés, et ce dans le souci constant de satisfaire les clients sur tous les marchés adressés.
Aussi, dans la nécessité d’être conforme à terme à la norme ISO 9001 : 2015, l’approche « Analyse de Risques » est mise en pratique au sein du Groupe. Elle vise à identifier et mesurer les risques afin de mettre les moyens en œuvre pour les réduire d’une part, et les prévenir d’autre part. L’analyse de risque est un principe qui s’applique aux risques Qualité, et constitue une méthode pour les prioriser en fonction de leur probabilité d’occurrence, de leur fréquence d’apparition, et de leur gravité.
La reconnaissance de ces référentiels et de leur déploiement au sein des filiales et sites opérationnels SEPPIC sont suivis et coordonnés à l’échelle du Groupe.
25
Section 4 : Les différentes activités externalisées
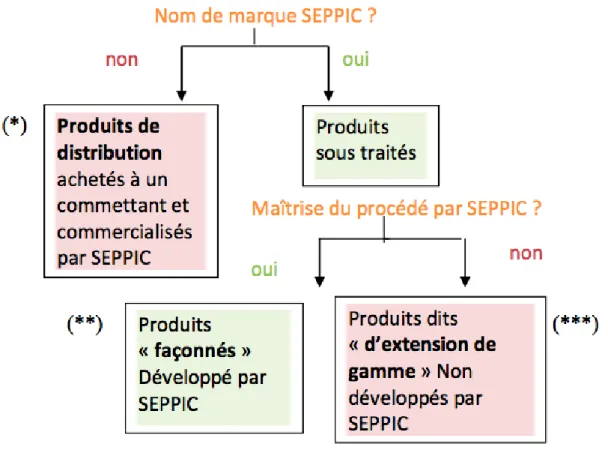
L’entreprise SEPPIC a effectué une analyse de risque concernant la gestion des activités externalisées en vue de la certification ISO 9001 : 2015. Ces activités concernent des produits vendus par SEPPIC et fabriqués (en totalité ou en partie) dans un atelier ou sur un site tiers.
Figure 3 – Produits vendus par SEPPIC et fabriqués (en totalité ou en partie) dans un atelier ou sur un site tiers
(*) Des produits de distribution sous nom commercial « NON SEPPIC » :
- Commercialisé par une entité du groupe SEPPIC sous son nom commercial d’origine. SEPPIC achète un produit à un commettant et le revend à son client.
Des produits sous-traités ou façonnés sous nom commercial SEPPIC :
- (**) Les produits « façonnés » sont développés par SEPPIC, fabriqués par une société tierce.
- (***) Les produits dits « d’extension de gamme » qui sont développés et fabriqués par une société tierce. SEPPIC a les droits de vente sous le nom de marque SEPPIC.
26
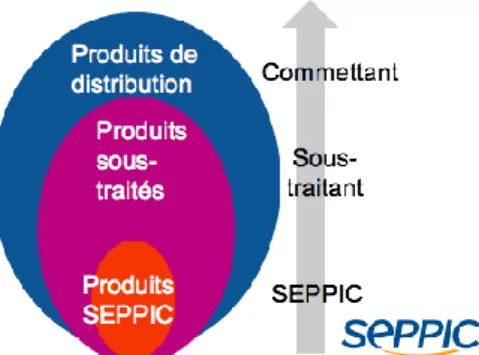
Figure 4 - schéma représentant les différents produits suivis par SEPPIC
La flèche grise représente le niveau de maîtrise à mettre en place pour les différents produits en fonction de leur criticité (moins critique : produits SEPPIC, au plus critique : produits de distribution). Moins le procédé du produit est connu plus il faudra mettre d’actions en place pour s’assurer de la qualité du produit final.
L’objectif prioritaire est de maîtriser les risques qualité liés aux activités externalisées.
Les activités externalisées peuvent aussi bien concerner la production, le prélèvement, le contrôle qualité, le stockage, la distribution de produits ou l’archivage (on exclut les aspects de communication, de stratégie ou de finance). Ces entités tierces constituent ce qu’on appelle les
Third Party Manufacturer (prestataire), c’est-à-dire l’ensemble des activités externalisées
27
Chapitre 2 : Gestion des prestataires du besoin au maintien de
l’agrément
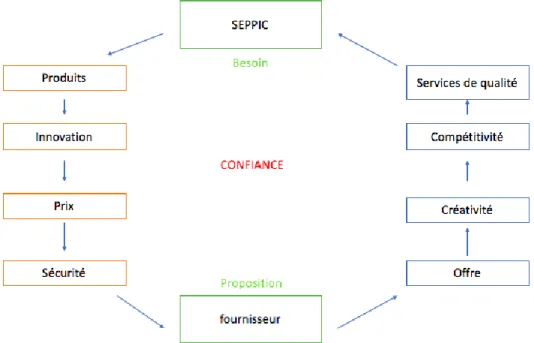
Section 1 : Relation entre SEPPIC et ses prestataires
Un prestataire est une personne physique ou morale qui satisfait les besoins d’une entreprise telle que SEPPIC en lui apportant un produit ou un service ou les deux. On parle donc de relation client (SEPPIC) fournisseur qui fait apparaître des obligations de la part de chacune des deux parties. SEPPIC a des attentes spécifiques définies dans le Cahier des Charges (acheter un produit de qualité, innovant, avec un prix attractif garantissant la sécurité de ses futurs clients). Le fournisseur doit proposer une offre correspondant à des besoins techniques spécifiques, en s’efforçant d’anticiper les attentes du client et de fournir un service de qualité. Une relation de confiance doit s’installer entre le client et le fournisseur.
Figure 5 - Relation client/fournisseur
Une des missions du service Assurance Qualité est de gérer les prestataires externes, il faut coopérer aux opérations de référencement des prestataires ou fournisseurs, notamment en évaluant leur niveau de qualité propre conformément aux référentiels en vigueur.
Suivre régulièrement le niveau réel de Qualité de ces prestataires et organiser des revues Qualité avec eux pour les sensibiliser aux attentes du marché.
Les produits qui sont fabriqués par les prestataires doivent avoir le même niveau qualité que les produits qui sont fabriqués par les sites de production SEPPIC.
La décision de sous-traitance est une activité qui doit correspondre à une démarche rigoureuse : Les raisons amenant à la sous-traitance d’un produit (fini ou intermédiaire) peuvent-être des :
- Raisons économiques (coût façonnage)
- Raisons matérielles (capacité SEPPIC insuffisante)
28 - Raisons réglementaires (limitation REACH)
- Raisons commerciales (compléter une gamme de produits) Organisation générale et responsabilités :
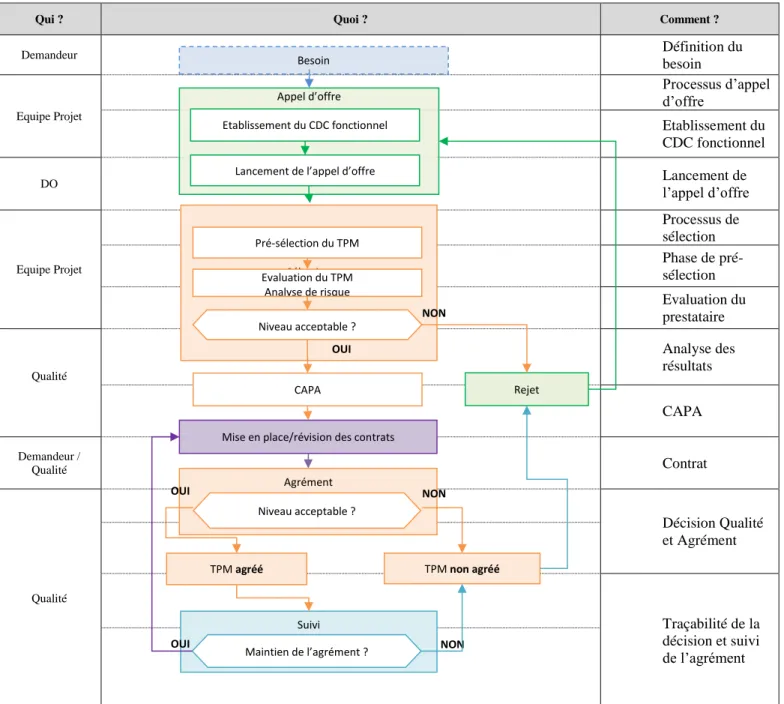
Dans le tableau suivant nous pouvons voir quel est le processus de réalisation qui est mis en place dans le laboratoire SEPPIC concernant la gestion des activités externalisées du besoin d’externaliser une activité au maintien de l’agrément du prestataire.
29
Tableau 4 - La gestion des activités externalisées
Qui ? Quoi ? Comment ?
Demandeur Définition du besoin Equipe Projet Processus d’appel d’offre Etablissement du CDC fonctionnel DO Lancement de l’appel d’offre Equipe Projet Processus de sélection Phase de pré-sélection Evaluation du prestataire Qualité Analyse des résultats CAPA Demandeur / Qualité Contrat Qualité Décision Qualité et Agrément Traçabilité de la décision et suivi de l’agrément Appel d’offre Sélection Besoin Etablissement du CDC fonctionnel
Lancement de l’appel d’offre
Niveau acceptable ? OUI NON Pré-sélection du TPM Evaluation du TPM Analyse de risque Rejet
Mise en place/révision des contrats
TPM non agréé CAPA
Suivi
Maintien de l’agrément ? NON OUI Agrément TPM agréé Niveau acceptable ? NON OUI
30
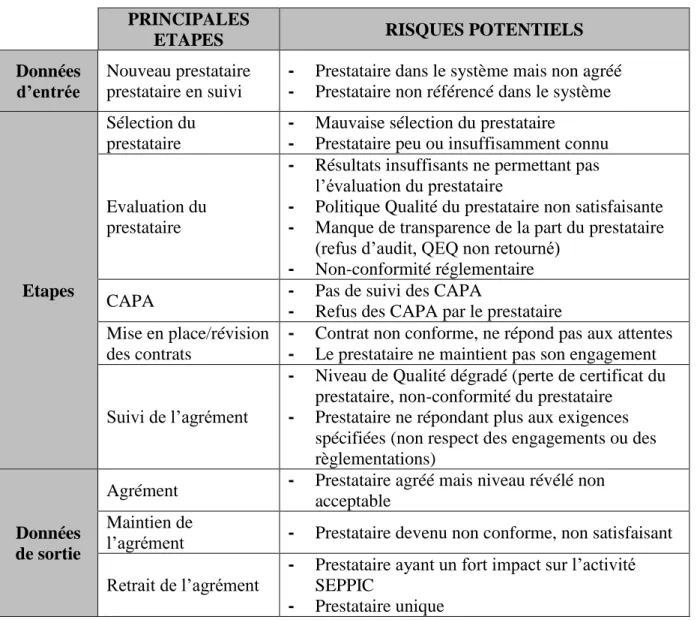
Section 2 : Risques principaux associés à la gestion des activités
externalisées
Ce tableau constitue une base d’exemples (non exhaustive) de risques répertoriés possibles :
Tableau 5 - Risques liés à la gestion Qualité des activités externalisées PRINCIPALES
ETAPES RISQUES POTENTIELS
Données d’entrée
Nouveau prestataire prestataire en suivi
- Prestataire dans le système mais non agréé - Prestataire non référencé dans le système
Etapes
Sélection du prestataire
- Mauvaise sélection du prestataire
- Prestataire peu ou insuffisamment connu
Evaluation du prestataire
- Résultats insuffisants ne permettant pas l’évaluation du prestataire
- Politique Qualité du prestataire non satisfaisante - Manque de transparence de la part du prestataire
(refus d’audit, QEQ non retourné) - Non-conformité réglementaire
CAPA - Pas de suivi des CAPA
- Refus des CAPA par le prestataire Mise en place/révision
des contrats
- Contrat non conforme, ne répond pas aux attentes - Le prestataire ne maintient pas son engagement
Suivi de l’agrément
- Niveau de Qualité dégradé (perte de certificat du prestataire, non-conformité du prestataire
- Prestataire ne répondant plus aux exigences spécifiées (non respect des engagements ou des règlementations)
Données de sortie
Agrément - Prestataire agréé mais niveau révélé non acceptable
Maintien de
l’agrément - Prestataire devenu non conforme, non satisfaisant Retrait de l’agrément
- Prestataire ayant un fort impact sur l’activité SEPPIC
31
Section 3 : Définition du besoin :
Données d’entrée
Le processus d’appel d’offre doit définir précisément les besoins et les objectifs du Demandeur au sein de SEPPIC.
Le Demandeur :
Le Demandeur est l’entité qui a intérêt à ce que le projet/produit/service se réalise. Ce demandeur peut faire partie du Marketing, de l’Innovation, des Achats…
Le Donneur d’Ordre : DO
Le DO est en relation directe avec l’activité externalisée. Il est en charge de : - Lancer le projet,
- Diriger le projet, - Gérer les contrats,
- Assurer le suivi du prestataire. L’Equipe Projet
Le DO doit s’entourer d’une équipe projet compétente de l’activité externalisée ciblée. Il doit analyser la faisabilité du projet et encadrer le bon déroulement de la phase projet.
Cette équipe projet peut se composer de : - DO,
- Experts techniques (afin de définir les aspects techniques/critères de choix), - Innovation, - Marketing - Achats - Qualité, - Réglementaire, - Business.
L’équipe projet peut faire appel aux fonctions supports nécessaires au projet (Propriété Intellectuelle, Juridique, etc.).
Section 4 : Processus d’appel d’offre
On peut contacter des fournisseurs qui sont déjà référencés dans la base de données SEPPIC (les achats vérifient la possibilité dans leur portefeuille des prestataires déjà référencés) ou faire appel à la concurrence afin de connaître leur solution et répondre à la demande interne. L’évaluation des fournisseurs est un examen systématique pour déterminer dans quelle mesure le fournisseur est capable de satisfaire aux exigences spécifiées de manière fiable et pérenne. Cette évaluation permettra d’estimer si les fournisseurs sont capables de satisfaire un certain nombre de besoins actuels et futurs.
32
Section 5 : Etablissement du CDC fonctionnel
Les aspects techniques des exigences de l’équipe projet et des équipes supports sont formalisés dans le cahier des charges (CDC) fonctionnel. Ce CDC rédigé par le DO, définit les grands objectifs du projet d’externalisation et représente la formalisation du besoin. Le CDC a pour but d’entretenir une relation de partenariat avec les fournisseurs pour passer d’un contrôle traditionnel à une relation de confiance fondée sur un contrat.
Le CDC fonctionnel contient :
− Les exigences produit (fabrication, conditionnement, étiquetage, etc.), − Les volumes d’achat prévisionnels,
− Les prix objectifs,
− Les exigences réglementaires, − Les exigences qualité,
− Les exigences géographiques de production.
Selon l’activité externalisée, peuvent être rajoutés à cette liste les points suivants : − Les spécificités du produit,
− Les spécifications analytiques et les méthodes de contrôle associées,
− Le procédé de fabrication et les étapes de validation : lots laboratoire, pilote, nombre de lots industriels, tests à effectuer toxicologique, stabilité, etc.) et données à recueillir, − Les prévisions de ventes de l’année…
Section 6 : Lancement de l’appel d’offre
Le support étant le CDC fonctionnel, l’appel d’offre est publié par le DO. L’appel d’offre est généralement lancé à au moins deux prestataires potentiels. Lors de l’analyse des offres, s’il y a des divergences avec le cahier des charges, le DO est sollicité pour éventuellement arbitrer les exigences.
On va rechercher un produit de sous-traitance en fonction de son intérêt : - technologique,
- marketing SEPPIC comme complément de gamme, - d’apport de chiffre d’affaire.
33
Section 7 : Processus de sélection
Le processus de sélection comprend : - Une phase de pré-sélection
- Une phase d’évaluation qui aboutit à la sélection du ou des prestataires adéquats.
Ce processus de sélection est mené à bien par l’équipe projet, la logistique et l’assurance qualité afin de valider la conformité au CDC fonctionnel.
A) Phase de pré-sélection
La phase de pré-sélection correspond au choix des prestataires ayant répondu à l’appel d’offre. Le choix se porte vers les prestataires se rapprochant le plus des besoins définis dans le CDC fonctionnel.
B) Evaluation du prestataire
Principe
Le DO et l’équipe projet évaluent la conformité, l’aptitude et les compétences du prestataire à mener à bien les activités proposées en externalisation.
Ils s’assurent également que le prestataire est pleinement responsable des contraintes liées aux activités requises (propriété intellectuelle, marché, clauses particulières…) et de la nécessité du respect de la réglementation en vigueur (ex : BPF, ISO 9001, EXCIPACT, EFfCI).
Audit initial
Le DO doit mettre en place une évaluation initiale du prestataire. Cette évaluation prend différentes formes selon la criticité de l’activité externalisée et du couple activité/prestataire.
Le DO doit demander au minimum un audit papier, qui se présente sous la forme de l’envoi du Questionnaire d’Evaluation Qualité (QEQ).
Le QEQ est à envoyer pour toute nouvelle activité qu’elle soit associée à un prestataire existant ou non. Il faut conserver l’envoi et la réception de ces QEQ dans un fichier ; la réponse est attendue dans les 30 jours ouvrés suivant son envoi.
- Dans le cas particulier de sous-traitance d’activités qui ne sont pas de la « production », la réponse au QEQ peut être partielle (exemple : pour les sous-traitants des laboratoires de contrôle)
- Dans certains cas, un document descriptif similaire du prestataire peut être accepté à la place du QEQ. Il doit être suffisamment complet.
Un audit qualité (sur site) peut aussi être effectué. Il reste le meilleur moyen d’évaluer les risques qualités liés à cette nouvelle activité. L’audit sur site permet de confirmer ou clarifier les points clés du questionnaire.
34
C) Analyse des résultats
Les résultats de l’évaluation sont analysés par l’Equipe Projet. La validation de ces éléments qualité est réalisée par l’Assurance Qualité qui décide si le niveau de Qualité du prestataire est acceptable ou non, avec les résultats de l’audit papier et/ou physique.
Tableau 6 - Détermination du niveau de risque qualité pour l’agrément du prestataire
Niveaux de risque Définition Statuts
Niveau de risque inacceptable
Le risque qualité encouru est trop important pour pouvoir autoriser
l’agrément du couple prestataire/produit
REJET
Niveau de risque acceptable
Le risque est faible voire quasiment inexistant et ne bloque pas l’agrément/l’homologation du couple prestataire/produit. Un suivi régulier est mis en place. Le risque qualité encouru est acceptable car il peut être maîtrisé
si des CAPA sont mises en place.
Validation qualité du système qualité
Le système qualité du fournisseur est réévalué de façon périodique selon les résultats obtenus lors de la précédente réévaluation.
Certains cas peuvent nécessiter des fréquences de réévaluation plus rapprochées ou plus espacées. Elles dépendent du statut du prestataire, de la criticité des activités et d’indicateurs qualité (réclamation, qualité de fourniture, résultats d’audits…) Elles doivent être justifiées.
35
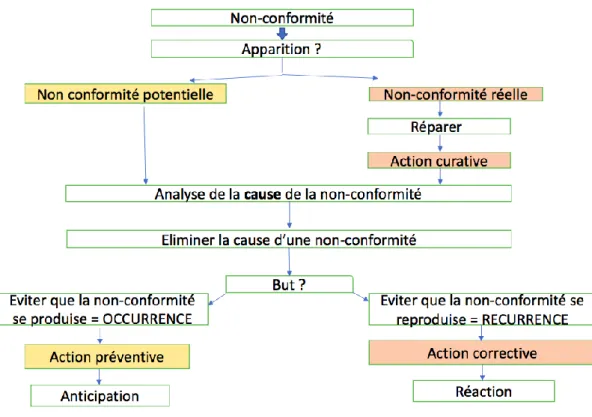
Section 8 : CAPA : Actions Correctives et Préventives
D’éventuelles CAPA peuvent être mises en place avant agrément.
Figure 6 - Gestion d’une CAPA
Le processus CAPA est un outil clef d’amélioration continue et de mesure d’efficacité du système Qualité, comme défini par l’ICH Q10. Suite à la détection de problèmes qualité ou d’évènements susceptibles d’impacter la qualité des produits, des actions curatives, correctives et préventives doivent être implémentées pour assurer la conformité des produits et processus aux exigences réglementaires.
A) L’enregistrement du problème qualité :
Le problème qualité est notifié par l’opérationnel (laboratoire de contrôle, opérationnel de production, qualité, etc) relevant la non-conformité et une fiche de notification anomalie, notification réclamation ou CAPA et créée puis signée par la personne réalisant la notification. Une copie est transmise au service Assurace Qualité en charge du problème.
B) Evaluation préliminaire de la criticité :
Une fois les informations remontées à la Qualité, celle-ci réalise une évaluation de la criticité du problème Qualité.
36 Criticité :
Mineur Majeur Critique
- Ecart par rapport à une procedure/instruction - Résultat hors tendance
- Ecart par rapport aux engagaments clients ou
référentiel - Résultat OOS (out of
specification) des MP - Résultats non conformes du produit fini pour un test du
bulletin d’analyse - Impact applicative
produit
- Impact sur la stabilité du produit
- Existe un risque de perte d’image pour la société - Existe un risque pour la
santé de l’utilisateur final
Problème non significatif Problème significatif
Figure 7 - Evaluation de la criticité du problème qualité
Conséquences :
En fonction de la criticité du problème Qualité, différentes actions peuvent être entreprises : Problèmes Qualité mineurs :
- Ne font pas obligatoirement l’objet d’une enquête ni d’une action corrective. - La mise en place d’une action curative est considérée comme suffisante.
Problèmes Qualité majeurs :
- Font l’objet d’une enquête afin de déterminer la cause racine et la mise en place d’actions correctives et/ou préventives.
Problèmes Qualité critiques :
- Sont traités en priorité. Les décisions doivent être prises au maximum 48h après la découverte du problème.
- Font l’objet d’une enquête afin de déterminer la cause racine et la mise en place d’actions correctives et préventives.
- Cette enquête inclus obligatoirement une analyse approfondie concernant le risque utilisateur et éventuellement la mise en place d’action curatives rapides si les CAPAs nécessitent un délai > 1 semaine.
Suite à cette étape l’Assurance Qualité imprime la fiche CAPA (Cf. Annexe 1 Fiche CAPA), la date et la signe pour traçabilité.
Définition de l’action ou plan d’action :
La gestion des actions curatives, correctives et préventives se trace à l’aide de la fiche CAPA. L’action se discute et se décide de manière collégiale entre le service Assurance Qualité et le responsable du service concerné.
37 Revue des CAPA :
Cette revue se fait annuellement au cours de la revue de direction, trimestriellement lors des Comités Qualité.
Pour être efficace, toutes les modifications faites doivent être communiquées à l’ensemble des personnes, départements, fournisseurs, sous-traitants, etc., qui sont ou seront concernés. Réalisation et évaluation de l’efficacité :
Le responsable de l’action doit s’assurer que cette dernière est mise en œuvre dans les délais impartis : toutes les tâches listées décrites dans le plan d’action sont initiées puis achevées et documentées.
Une fois l’action réalisée, l’AQ évalue alors l’efficacité de l’action. Une action efficace étant une action qui permet d’éviter l’apparition ou la réapparition du problème qualité, et plus spécifiquement de la ou des causes identifiées.
Clôture de la fiche CAPA :
Si le problème est résolu et s’il n’y a pas d’autres lacunes, la Qualité clôture la fiche CAPA. Suivi :
La qualité s’assure du suivi des actions à l’aide d’un tableau de suivi :
- L’avancement de chaque action à mettre en place, les actions doivent être réalisées dans le délai négocié.
- Date d’échéance : confirmée ou étendue : les actions en retard sont re-planifiées à une date renégociée sans introduire de risque qualité supplémentaire, si nécessaire des actions curatives sont mises en place pour maitriser le risque.
- Evaluation de l’efficacité de l’action exécutée : les actions jugées inefficaces font l’objet de nouvelles CAPAs.
L’archivage :
38
Section 9 : Contrats
LE CONTRAT :
7.14 Un contrat doit être établi entre le donneur d’ordre et le sous-traitant précisant leurs
responsabilités respectives et les processus de communication concernant les activités externalisées. Les aspects techniques du contrat doivent être établis par des personnes compétentes, possédant des connaissances appropriées en matière de sous-traitance d’activités et de bonnes pratiques de fabrication. Toutes les dispositions concernant les activités externalisées doivent être conformes aux réglementations en vigueur et à l’autorisation de mise sur le marché du produit concerné, et agréées par les deux parties.
7.15 Le contrat doit préciser clairement qui réalise chaque étape de l’activité externalisée,
gestion des connaissances, transfert de technologie, chaîne d’approvisionnement, sous-traitance, qualité et achat des composants, analyse et libération des composants, production et contrôle de la qualité (y compris les contrôles en cours de fabrication, l’échantillonnage et l’analyse).
7.16 Tous les enregistrements liés aux activités externalisées, par exemple ceux relatifs à la
fabrication, l’analyse et la distribution ainsi que les échantillons de référence doivent être conservés par le donneur d’ordre ou mis à la disposition de ce dernier. Tout enregistrement concernant l’évaluation de la qualité d’un produit, en cas de réclamation ou d’un défaut suspecté, ou dans l’investigation dans le cas d’une suspicion de produit falsifié, doit être accessible et décrit dans les procédures correspondantes du donneur d’ordre.
7.17 Le contrat doit permettre au donneur d’ordre d’auditer les activités externalisées
effectuées par le sous-traitant ou ses sous-traitants mutuellement agréés.4
Une relation contractuelle est établie entre SEPPIC et le prestataire. C’est la base d’une relation d’un échange de produits ou de services entre un client et un fournisseur. Cet échange doit satisfaire les deux parties. Les types de contrats possibles sont les suivants, dont le
SAg/CGA et le QAA sont obligatoires :
Figure 8 - les différents contrats existants
4Chapitre 7 de la partie 1 des BPF : ACTIVITES EXTERNALISEES, 2015 Niveau de détails
croissant