Université de Montréal
Utilisation de l’électrophysiologie dans l’étude du développement
des capacités d’intégration audiovisuelle
du nourrisson à l’âge adulte
par Emmanuelle Dionne-Dostie
Département de Psychologie Faculté des Arts et des Sciences
Thèse présentée à la Faculté des études supérieures en vue de l’obtention du grade de Philosophiæ Doctor (Ph.D.)
en Psychologie – Recherche et Intervention option Neuropsychologie clinique
Résumé
Une littérature abondante documente les bénéfices de l’intégration multisensorielle chez les adultes ainsi que les mécanismes cérébraux sous-jacents à ces habiletés. Toutefois, de nombreuses questions sur le développement de l’intégration multisensorielle chez l’enfant demeurent sans réponse et les travaux chez les animaux ainsi que les données comportementales, électrophysiologiques et en neuroimagerie chez l’homme ne forment pas de consensus quant à son caractère inné ou acquis.
Le premier objectif de la présente thèse vise donc à recenser les écrits de la littérature sur le développement des capacités d’intégration multisensorielle. Cette revue de la littérature, qui constituera l’article 1 de la thèse, présente les études comportementales et neuronales en faveur du caractère inné ou acquis des processus d’intégration multisensorielle. L’article 1 suggère que certaines habiletés de traitement multisensoriel sont présentes chez le nourrisson et le jeune enfant, mais que la capacité à intégrer les informations multisensorielles de façon optimale demeure un long processus qui se développe tardivement au cours de l’enfance et de l’adolescence. Cette revue nous a également permis de mieux cibler les lacunes de la littérature relatives au développement neuronal des capacités d’intégration, avec une attention particulière sur l’intégration d’informations audiovisuelles non linguistiques.
Ainsi, aucune étude en électrophysiologie ne s’est encore penchée sur la progression développementale des capacités d’intégration audiovisuelle chez les nourrissons et les enfants d’âge préscolaire. Ce constat a justifié la tenue de l’étude expérimentale présentée à l’article 2 dont l’objectif vise à caractériser la progression développementale neurotypique des mécanismes d’intégration d’informations audiovisuelles non linguistiques dès l’âge de 3 mois jusqu’à l’âge adulte. Cette recherche vise également à confirmer l'âge où les mécanismes
d’intégration audiovisuelle, d’une part, commencent à fonctionner de façon similaire aux adultes et, d’autre part, atteignent leur pleine maturité. Pour ce faire, nous avons mené une étude expérimentale transversale sur un vaste échantillon composé de 121 participants neurotypiques en utilisant l’électrophysiologie à haute densité, plus sécifiquement par le biais d’analyses temps-fréquence. Notre étude démontre la présence de précurseurs de l’intégration audiovisuelle dès l’âge de 2 ans. De plus, nous observons que les jeunes de 11-14 ans commencent à intégrer ces informations de façon similaire aux adultes, mais que les mécanismes d’intégration audiovisuelle atteignent leur pleine maturité tardivement au cours de l’adolescence soit entre les âges de 15 et 17 ans. Cette étude appuie la littérature quant à l’émergence progressive des capacités à intégrer les informations audiovisuelles, permet de documenter la progression développementale de ces capacités et répond à l’absence de littérature sur les processus neuronaux de l’intégration audiovisuelle chez le nourrisson et l’enfant d’âge préscolaire.
Dans l’ensemble, cette thèse offre une meilleure compréhension du développement neurotypique des mécanismes d’intégration audiovisuelle et fournit un point de comparaison pour étudier ces processus auprès d’enfants présentant des troubles neurodéveloppementaux souvent accompagnés de déficits sensoriels.
Mots clés : intégration multisensorielle, intégration audiovisuelle, audition, vision, électrophysiologie, ondelettes, développement neurotypique, troubles neurodéveloppementaux
Abstract
An abundant litterature documents the benefits associated to multisensory integration in adults as well as brain mechanisms underlying these skills. However, numerous questions regarding the development of multisensory integration during childhood remain unanswered and there is no consensus among animal data in addition to behavioral, electrophysiological and neuroimaging studies conducted in humans wether these skills are innate or acquired.
The first objective of this thesis is to review the literature on the development of multisensory integration capacities. This review, which will constitute the first article of this thesis, presents neuronal and behavioral studies in favour of the nature or nurture character of multisensory integration mechanisms. This review suggests that the capacity to detect and form multisensory associations begins very early in development, but that the ability to integrate multisensory information in an optimal manner is a progressive process that continues to develop over childhood and adolescence. This work has also allowed us to better target the gaps in the existing literature related to the neuronal development of integration capacities, with special emphasis on the integration of non linguistic audiovisual information.
Thus, to date no electrophysiological study has yet address the developmental progression of audiovisual integration capacities in infants and preschool children. This ascertainment has justified the conduct of the experimental study presented in the second article with the aim of characterizing the neurotypical developmental progression of non linguistic audiovisual information integration mecanisms as early as 3 months of age to adulthood. This research is also aimed at confirming the age when audiovisual integration mechanisms, on the one hand, begin to operate in a similar fashion than adults and, on the other hand, reach their full maturity. For these purposes, we have conducted an experimental
study. Here, we undertook a cross-sectional experimental investigation on a large cohort of 121 neurotypical individuals using high-density electrophysiology more specifically through time-frequency analysis. Our study revealed the presence of precursors of audiovisual integration in children as young as two years of age. Moreover, our results indicate that 11- to 14-year-old adolescents start to integrate this information in an adult-like manner, but that audiovisual integration mechanisms reach their full maturity late throughout adolescence between the age of 15 and 17 years. This study supports the literature regarding the progressive emergence of the capacities to integrate audiovisual information, documents the developmental progression of these capacities and answers the absence of literature on the neuronal processes of audiovisual integration in infants and preschool children.
Overall, this thesis provides a better understanding of the development of audiovisual integration mechanisms and provides a benchmark to investigate these processes in children with neurodevelopmental disorders often accompanied with sensory impairments.
Key words: multisensory integration, audiovisual integration, audition, vision, electrophysiology, wavelets, neurotypical development, neurodevelopmental disorders
Table des matières
Résumé ... i
Abstract ... iii
Table des matières ... v
Liste des tableaux ... viii
Liste des figures ... ix
Liste des sigles et des abréviations ... xii
Remerciements ... xv
1. INTRODUCTION ... 1
1.1 Introduction générale ... 2
1.2.1. Définition et opérationnalisation ... 5
1.3 Bases cérébrales de l’IMS ... 7
1.3.1 Colliculus supérieur : premier modèle d’étude ... 7
1.3.2 Aires associatives : modèle anatomique classique ... 8
1.3.2.1 Lobe temporal ... 9
1.3.2.2 Lobe pariétal postérieur ... 10
1.3.2.3 Lobe frontal ... 11
1.3.3 Aires sensorielles primaires : modèle anatomique moderne ... 11
1.4 Principes généraux de l’IMS ... 13
1.4.1 Règle spatiale ... 14
1.4.2 Règle temporelle ... 15
1.4.3 Préservation des champs récepteurs ... 16
1.4.4 Efficacité inverse ... 17
1.5 Intégration audiovisuelle ... 18
1.5.1 Développement des systèmes auditif et visuel ... 18
1.5.1.1 Système visuel ... 19
1.5.1.2 Système auditif ... 20
1.6 Intégration AV chez l’homme adulte ... 23
1.6.1 Gain comportemental ... 23
1.7 Inné ou acquis ? ... 26
1.7.1 Études animales ... 26
1.7.2 Sensibilité à la synchronie chez le nourrisson ... 27
1.7.3 Intégration AV chez l’enfant ... 29
1.8 Limites de la littérature dans l’étude des capacités de l’IMS chez l’enfant ... 31
1.9 Réponses électrophysiologiques ... 32
1.9.1 L’électrophysiologie de surface : principe général ... 32
1.9.2 Potentiels évoqués visuels et auditifs ... 33
1.9.3 Limites de l’utilisation des PÉs ... 36
1.9.4 Analyse spectrale ... 37 1.9.4.1 Analyse temps-fréquence ... 39 2. OBJECTIFS ET HYPOTHÈSES ... 41 2.1 Article 1 ... 42 2.2 Article 2 ... 42 3. MÉTHODOLOGIE ET RÉSULTAS ... 44 3.1 Article 1 ... 45 3.2 Article 2 ... 82 4. DISCUSSION GÉNÉRALE ... 129
4.1 Rappel des objectifs et résultats ... 130
4.1.1 Article 1 ... 130
4.1.2 Article 2 ... 133
4.2 Discussion et interprétation des résultats en lien avec la littérature ... 136
4.2.1 Existe-il vraiment un débat inné ou acquis ? ... 136
4.2.2 Progression développementale des habiletés de traitement AV ... 138
4.2.3 Rôle de l’attention dans l’IMS chez le nourrisson ... 140
4.2.4 Intégration AV tributaire du développement de l’audition et de la vision ... 142
4.2.5 Signature neuronale de l’intégration AV ... 144
4.3 Limites des études et avenues de recherches futures ... 148
4.3.4 Impacts cliniques de l’IMS dans les troubles neurodéveloppementaux ... 152 5. CONCLUSION GÉNÉRALE ... 155 6. BIBLIOGRAPHIE ... 158 ANNEXES ... xvi Annexe 1 ... xvii Annexe 2……….xl Annexe 3 ………xl
Liste des tableaux
Section méthodologie et résultats
Article 2
Table 1. Demographic data for each age group………..…117
Table 2. Linear regression equations between age and wavelet power in both conditions within all frequencies on frontocentral electrodes………...118
Liste des figures
Section introduction
Figure 1. Modèle anatomique moderne des régions corticales multisensorielles chez le primate. Les zones colorées représentent les régions dans lesquelles des évidences anatomiques et électrophysiologiques ont démontré de l’IMS ………....13
Figure 2. Superposition des cartes spatiales au niveau des colliculus supérieurs pour les modalités visuelle, auditive et somesthésique………...14
Figure 3. La figure suivante illustre l’IMS au sein d’un neurone multisensoriel du CS. Les champs récepteurs auditifs et visuels de ce neurone sont représentés par les cercles verts (visuel : vert foncé, auditif : vert pâle). Les stimuli auditifs (A) sont représentés par un cercle blanc entouré de traits et les stimuli visuels (V) par une barre blanche. De faibles stimuli A et V (représentés par les points noirs) sont intégrés afin de produire une augmentation de la réponse multisensorielle. L’augmentation de la combinaison des réponses excède la somme des réponses aux stimulations unisensorielles (voir histogramme) donnant lieu à une réponse sur-additive………....15
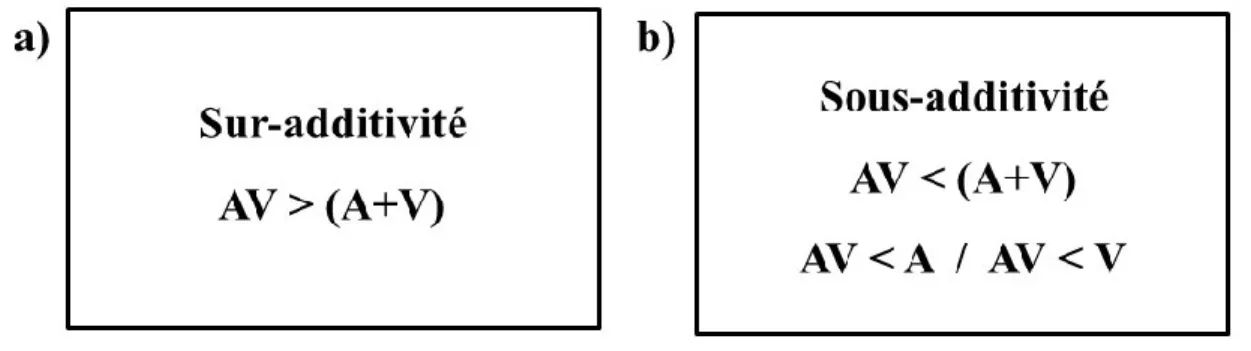
Figure 4. Résumé des deux principaux critères d’IMS (A : information auditive; V : information visuelle; AV : information audiovisuelle). a) Sur-additivité : l’effet de la combinaison du stimulus multisensoriel AV est plus grand que la somme des stimuli unisensoriels le composant. b) Sous-additivité : l’effet du stimulus AV est plus petit que la somme des stimuli unisensoriels ainsi que chaque stimulus unisensoriel seul………...17
Figure 5. Exemple d’enregistrement d’un PÉV chez nos participants adultes dans la région centrooccipitale (Oz) suite à la présentation d’un damier noir et blanc………....35
Figure 6. Enregistrement d’un PÉA chez nos participants adultes dans la région frontocentrale (Cz) suite à la présentation d’un ton pur de 1000 Hz………....…36
Figure 7. Décomposition du signal EEG dans les bandes de fréquences thêta, alpha, bêta et gamma………....…....38
Section méthodologie et résultats
Article 2
Figure 1. Grand-averaged AV ERPs on electrode FCz are depicted in panel (a) for groups 2-4, 5-7, 8-10, 11-14 and 15-17 years old and adults and (b) for groups 3-6 and 6-12 months old. Time is plotted on the x-axis and amplitude on the y-axis. A time window between 100 and 300ms was selected based on the development of AV N1 and P2 components as a function of
Figure 2. Topographic brain activities elicited when comparing both multisensory (AV) and sum (A+V) averaged wavelet responses for all age groups and electrode sites. Note that both conditions elicited significantly greater magnitude power of activation over the frontocentral region. Results from the topological scalp distribution t-test reveal that the frontocentral activation is stronger for the AV condition compared to (A+V), justifying the chosen electrodes of interest to study AV integration……….121
Figure 3. The linear regression illustrates the relationship between age and wavelet power in both conditions a) on electrode FCz (in blue: AV and in red: [A+V]). Topographic map representation of the slope regression between age and wavelet power for b) AV and c) (A+V) conditions on all electrodes. The scalp distribution is predominantly located over the frontocentral regions for the AV integration (b) and, at a lower intensity, for the (A+V) condition (c)……….122
Figure 4. Significant mean power differences between multisensory (AV: in white) and ([A+V]: in dark grey) responses are shown in theta, alpha, beta and gamma across age groups on electrode FCz. Light grey bars show no statistical differences between conditions (AV and [A+V])………..123
Liste des sigles et des abréviations
A Auditif
ADD/ADHD Attention deficit disorder with or without hyperactivity ADHD-C Attention deficit disorder combined type
ADHD-I Attention deficit disorder inattentive type ANOVA Analyse de variance / Analysis of variance ASTP Aire supérieure temporale polysensorielle
AV Audiovisuel / Audiovisual
A+V Somme des réponses unisensorielles auditives et visuelles / Sum of the unisensory auditory and visual responses
CN Caudate nucleus
CS Colliculus supérieur
CGL Corps genouillé latéral
DSM-V Diagnostic and Statistical Manual of Mental Disorders, 5th edition / Manuel diagnostique et statistique des troubles mentaux, 5e édition EEG Électrophysiologie / Electrophysiology
ERP Event-related potential
fMRI Functional Magnetic Resonance Imaging
IRMf Imagerie par résonance magnétique fonctionnelle IMS Intégration multisensorielle
IUGR Intrauterine growth retardation
MSI Multisensory integration
N Négativité
NIRS Spectroscopie proche infrarouge
PÉ Potentiel évoqué
PÉA Potentiel évoqué auditif PÉV Potentiel évoqué visuel
P Positivité
SIP Sillon intrapariétal
SC Superior colliculus
SMD Sensory Modulation Disorder
SN Substantia nigra
SPD Sensory Processing Disorder STS Sillon temporal supérieur
TDA/H Trouble déficitaire de l’attention avec ou sans hyperactivité TSA Trouble du spectre de l’autisme
µV Amplitude (microvolt)
µV2 Puissance (microvolt au carré)
Il n’est « rien dans notre intelligence qui ne soit passé par nos sens ».
Remerciements
Cette thèse de doctorat représente un travail de longue durée, et pour cette raison, constitue une tranche de vie qui m’a permis de faire des rencontres fortuites, de vivre des collaborations stimulantes, de susciter des réflexions personnelles et scientifiques et de créer de nouvelles amitiés. Derrière cette thèse se trouve la contribution de plusieurs personnes que je désire remercier car celles-ci retrouveront dans ce travail, l’aboutissement de leurs efforts pour lesquels j’exprime ma plus affectueuse gratitude.
Je tiens tout d’abord à remercier ma directrice, MARYSE LASSONDE, qui fut pour moi une directrice de thèse attentive et disponible malgré ses nombreuses occupations. Je la remercie pour sa présence, bien que nos discussions aient été davantage virtuelles, notre relation a évolué en un rapport autant amical que professionnel. Étant sa dernière étudiante à superviser, j’espère que le fruit de ce doctorat est à la hauteur de la confiance qu’elle a su m’accorder.
Je remercie chaleureusement ma co-directrice, ANNE GALLAGHER, qui est intervenue à mi-parcours de mon doctorat et m’a offert la possibilité de le compléter dans des conditions privilégiées. Je lui suis reconnaissante de m’avoir si spontanément intégrée à la vie du laboratoire LION où j’ai vécu son implantation et l’essor de celui-ci. Je la remercie également pour la sensibilité et la rétroaction qu’elle m’a prodiguées tant d’un point de vue scientifique que personnel.
J’offre aussi mes remerciements à mon co-directeur, OLIVIER COLLIGNON, qui m’a confié ce projet de thèse et s’est assuré d’une relecture rigoureuse accompagnée de suggestions avisées.
Mes pensées vont ensuite aux étudiants et aux futurs chercheurs des laboratoires LION et d’électrophysiologie et d’imagerie optique de l’Hôpital Sainte-Justine pour leur présence, leur bonne humeur et les nombreuses discussions plus enrichissantes les unes que les autres.
Je remercie vivement le personnel du laboratoire qui a fait de cette thèse une aventure des plus agréables et a largement facilité mon travail que ce soit par un support technique ou simplement par leur présence et leur amitié. Je remercie surtout l’ingénieure du laboratoire, JULIE TREMBLAY, pour sa contribution à la création du paradigme de recherche, à certaines analyses présentées dans cette thèse et pour la vulgarisation des jargons scientifiques rendant ainsi les concepts aussi simples que possibles, mais non plus simples. Je remercie PHETSAMONE VANNASING qui porte plusieurs chapeaux professionnels au laboratoire. Je retiens de notre intense collaboration des années de réunions périodiques toujours riches en discussions et en critiques stimulantes. Je la remercie de s’être acharnée sur mon cas tout au long de ce travail.
Au terme de cette aventure, je remercie enfin celles et ceux qui me sont chers et que j’ai quelque peu délaissés ces derniers mois pour achever cette thèse. À mes amis, ils se connaissent, pour leurs encouragements et, à certains doctorants d’avoir traversé à mes côtés les hauts et les bas de cette aventure doctorale. J’aimerais porter une attention toute particulière à SOLÈNE FOURDAIN, ma collègue de laboratoire, ma reviewer personnelle, mon amie. Elle m’a donné les moyens d’affronter les derniers milles de ce parcours doctoral en me permettant de voir plus clairement les différents concepts de cette thèse lors de nos discussions.
J’exprime ici toute ma gratitude et mon amour à ma famille, pour le simple, mais inestimable fait qu’elle soit là, près de moi, en toutes circonstances. Des remerciements plus particuliers s’adressent aux personnes qui suivent :
À ma mère, pour ton écoute et ton soutien dans mes périodes de doute et du magnifique modèle de labeur et de persévérance que tu as su m’inculquer.
À mon père, pour ta patience et tes relectures avisées me permettant d’affiner mes propos. À ma sœur, pour tout ce que nous partageons.
À mes beaux-parents, pour m’avoir accueillie comme votre propre fille.
1.1 Introduction générale
Les objets et les évènements perçus à travers nos différents organes sensoriels ne confèrent pas une impression d’un monde morcelé fait de sensations indépendantes, mais bien au contraire, procurent une perception unifiée et cohérente de l’environnement qui nous entoure. En effet, dans la vie quotidienne les décisions et les actions que nous croyons effectuées à partir d’informations provenant d’un seul sens, tel que la vision, sont fortement influencées par des renseignements provenant d’autres sens tels que l’audition ou le toucher et qui, malgré leur apparence superflue, sont informatifs. Par exemple, à la lecture de la présente thèse, vous interprétez des stimuli visuels (les mots que vous lisez), auditifs (les bruits de fond que vous essayez d’ignorer en lisant), tactiles (l’effleurement du papier entre vos doigts), olfactifs (l’odeur du dîner qui est en train de cuire), gustatifs (la gomme à la menthe que vous mâchez) et proprioceptifs (la sensation que vous donne le fait d’appuyer votre tête sur votre main). Puisque chaque sens obtient et transmet de façon indépendante un rapport unique de l’évènement, la synthèse des différents signaux sensoriels permet une évaluation plus juste et complète de la perception de l’évènement influençant ainsi notre perception du monde et la prise de décisions dans des situations les requérant (Ernst & Banks, 2002). Ce phénomène qu’est l’intégration multisensorielle (IMS) a une énorme valeur adaptative et joue indubitablement un rôle fondamental dans l’histoire évolutive des espèces vivantes. Les gains et bénéfices comportementaux découlant de la capacité sous-jacente du cerveau à intégrer différentes entrées sensorielles liées à un seul évènement ont été documentés et corroborés par une littérature scientifique abondante à ce sujet (Diederich & Colonius, 2004; Lovelace, Stein, & Wallace, 2003). Depuis les trois derniers siècles, les chercheurs tentent de nous éclairer sur
de neuroimagerie, les données chez l’animal et l’homme adulte ont apporté des concepts fondamentaux sur les bases cérébrales des processus d’IMS et ont corroboré leurs avantages comportementaux. De même, plusieurs études comportementales ont porté sur l'influence des processus d’IMS dans la perception des évènements chez le nourrisson et l’enfant. D’ailleurs, l’étude de ce phénomène a soulevé un débat sur la part respective de l’inné et de l’acquis dans le développement de l’IMS. Tandis que certains chercheurs stipulent que le système nerveux serait multisensoriel dès la naissance, d’autres font valoir le rôle significatif que joue l’expérience dans le développement de notre capacité à intégrer les diverses informations sensorielles. Cette question, débattue dans la communauté scientifique, sera d’ailleurs abordée dans la revue de la littérature qui constitue l’article 1 de la présente thèse. Celle-ci fait également état des connaissances actuelles sur les capacités et processus cérébraux sous-jacents au développement de l’IMS chez les nourrissons et les enfants neurotypiques. Bien que certains résultats comportementaux suggèrent la présence d’IMS dès les premières semaines de vie, aucune étude en électrophysiologie ou en neuroimagerie n’a encore examiné le développement de ces capacités avant l’âge de 7 ans. Ainsi, le deuxième article de la présente thèse vise à étudier la progression développementale des mécanismes d’intégration audiovisuelle (AV) et à exposer l’âge auquel ceux-ci atteignent leur maturité. Ces objectifs seront étudiés à l’aide d’une approche électrophysiologique et plus spécifiquement, par le biais d’analyses temps-fréquence. Une meilleure compréhension du développement des mécanismes d’IMS chez les individus neurotypiques fournit un point de comparaison pour étudier ces processus chez certaines populations cliniques à risque de présenter des problèmes sensoriels, notamment les individus présentant un trouble du spectre de l’autisme (TSA) (Bao, Doobay, Mottron, Collignon, & Bertone, 2017; Charbonneau et al., 2013; Collignon et al.,
2013; Stevenson et al., 2014), une dyslexie (Francisco, Jesse, Groen, & McQueen, 2017; Hahn, Foxe, & Molholm, 2014; Laarhoven, Keetels, Schakel, & Vroomen, 2016; Ye, Rüsseler, Gerth, & Münte, 2017), un trouble du langage oral (Kaganovich, Schumaker, Leonard, Gustafson, & Macias, 2014; Knowland, Evans, Snell, & Rosen, 2016; Meronen, Tiippana, Westerholm, & Ahonen, 2013), un trouble déficitaire de l’attention avec ou sans hyperactivité (TDA/H) (Benn, 2017; Cheung & Siu, 2009; Ghanizadeh, 2011). Des relations neurophysiologiques possibles entre les problèmes d’IMS et certains troubles neurodéveloppementaux sont d’ailleurs abordées dans l’article 1 de cette thèse.
Ainsi, l’introduction de cette thèse est divisée en plusieurs sections. La première vise à définir l’IMS et présenter les bases cérébrales sous-jacentes aux capacités d’intégration. Par la suite, un survol du développement respectif des systèmes sensoriels, auditif et visuel, sera effectué suivi par une présentation des gains comportementaux et des données neuronales sur l’intégration AV chez l’adulte. L’état actuel des études comportementales et électrophysiologiques sur le développement de l’intégration AV chez les nourrissons et les enfants sera exposé suivi d’une présentation des limites associées à ces études. Il est à noter que certains de ces sujets seront abordés relativement brièvement, puisqu’ils ont été par la suite largement détaillés dans l’article 1. La dernière partie de l’introduction présente l’électrophysiologie (EEG) cérébrale et les analyses associées ainsi que leur apport dans l’étude des mécanismes d’intégration AV.
À la suite de cette introduction, les objectifs principaux seront abordés suivi du corps de la thèse qui comporte deux articles. Le premier consiste en une revue de la littérature et le second présente une étude électrophysiologique. Les résultats issus de ce deuxième article
Cette discussion fera également l’objet des limites de notre recherche ainsi que des impacts cliniques et des perspectives d’études futures. Enfin, une conclusion générale sera présentée. Un manuscrit additionnel sur le développement de la perception de la voix et du langage chez le nouveau-né auquel j’ai activement participé (deuxième auteure) a récemment été accepté comme chapitre de livre et est également disponible en annexe.
1.2 Intégration multisensorielle
1.2.1. Définition et opérationnalisation
Les informations sensorielles peuvent être traitées de manière séparée : nous parlerons alors d’information unisensorielle par opposition à une information multisensorielle, contenant deux canaux sensoriels ou plus. Lorsque nous parlons d’information multisensorielle, nous décrivons un objet contenant au moins deux types d’informations sensorielles. Dès la naissance, nous interagissons avec le monde à travers nos sens, ce qui nous procure des informations complémentaires sur l’environnement. Pour percevoir et interagir dans un monde cohérent, notre cerveau doit fusionner le plus efficacement possible les informations des différents sens. L’IMS correspond au mécanisme perceptif consistant à associer les informations en provenance de différentes modalités sensorielles dans un percept unique multidimensionnel optimal (Stein, 2012). Les informations sensorielles issues d’un même objet ou évènement sont mieux et plus rapidement traitées que le même objet défini par l’information provenant d’une seule modalité sensorielle. Cette efficacité supérieure d’une présentation bisensorielle ou multisensorielle est reliée à la capacité du cerveau à intégrer les signaux redondants (Ernst & Bülthoff, 2004; Giard & Peronnet, 1999; Harrington & Peck,
1998; Miller, 1982; Molholm et al., 2002). Pour être intégrées, les estimations sensorielles doivent avoir la même unité, les mêmes coordonnées et doivent concerner les mêmes propriétés environnementales (Ernst & Bülthoff, 2004). Plus spécifiquement, la synchronie temporelle, la coïncidence spatiale ainsi que la détection des propriétés dites amodales (c.-à-d., propriétés d'un objet ou d’un évènement perçu qui ne sont pas liées à une modalité sensorielle particulière telles la taille, la forme, le rythme, le tempo, l’intensité) renforcent la probabilité que les deux informations recueillies proviennent d’un même objet et constituent donc un prérequis à leur intégration. Par exemple, la taille de l'objet que l'on touche et voit à la fois et la parole que l'on entend et lit sur les lèvres du locuteur fournissent des perceptions d'évènements uniques tirés d'informations redondantes véhiculées par deux modalités.
L’IMS peut s’opérationnaliser par une différence statistiquement significative entre la réponse évoquée par une stimulation multisensorielle et celle évoquée par sa composante unisensorielle. Cela s’applique aussi bien au niveau comportemental que neuronal (Ghazanfar, Maier, Hoffman, & Logothetis, 2005). Sur le plan comportemental, le gain associé à la combinaison des informations multisensorielles se traduit par une diminution des temps de réaction ainsi qu’une meilleure performance dans les tâches de précision et de détection d’une cible en comparaison à la présence d’informations provenant d’une seule modalité (Diederich & Colonius, 2004). Au niveau neuronal, l’IMS se manifeste par une augmentation de la fréquence de décharge des neurones multisensoriels. Ainsi, généralement, le taux d’influx nerveux des neurones multisensoriels évoqué par une stimulation bisensorielle est significativement plus élevé que la réponse neuronale générée lors de la stimulation unisensorielle la plus efficace (Binns & Salt, 1996; Stein & Meredith, 1993; Stein, Stanford,
1.3 Bases cérébrales de l’IMS
Avant de se pencher sur les données comportementales et électrophysiologiques de l’IMS, une synthèse des connaissances sur les structures et régions cérébrales impliquées dans cette capacité sera présentée.
1.3.1 Colliculus supérieur : premier modèle d’étude
La structure cérébrale la plus étudiée dans le domaine de l’IMS est sans aucun doute le colliculus supérieur (CS) qui joue un rôle important dans les comportements d'attention et d'orientation. L’existence des neurones multisensoriels fut mis en évidence pour la première fois au niveau de cette structure dans des travaux sur le mammifère (Stein & Meredith, 1993; Wallace & Stein, 1997). Le CS reçoit des afférences visuelles, auditives et somesthésiques provenant des voies sensorielles ascendantes ainsi que des projections descendantes du cortex qui convergent en différentes combinaisons sur les neurones multisensoriels (Champoux, Bacon, Lepore, & Guillemot, 2008; King, 2004; Stein, Stanford & Rowland, 2014; Wallace, Wilkinson, & Stein, 1996). Chaque neurone multisensoriel détient plusieurs champs récepteurs spécifiques aux diverses modalités sensorielles auxquelles il est sensible. L’organisation spatiale topographique du CS démontre que ce qui est important pour les neurones de cette structure est l’endroit où survient un évènement et non la modalité sensorielle de cet évènement. Le chevauchement des champs récepteurs unisensoriels dans le neurone multisensoriel conditionne la façon dont celui-ci répond aux stimuli issus de la même région de l’espace. Ainsi, les stimuli provenant de la même source spatiale activeront
différents champs récepteurs, quelle que soit leur modalité, des neurones logés dans la même région du CS (Stein et al., 2014). Des neurones multisensoriels et des réponses bisensorielles à des stimuli AV sont également présents au niveau du thalamus (Benedek, Perenyi, Kovacs, Fischer-Szatmari, & Katoh, 1997; Matsumoto, Minamimoto, Graybiel, & Kimura, 2001), de l’amygdale (Nishijo, Ono, & Nishino, 1988), du striatum (Chudler, Sugiyama, & Dong, 1995; Graziano & Gross, 1993; Nagy, Eördegh, Paróczy, Márkus, & Benedek, 2006; Nagy, Paróczy, Norita, & Benedek, 2005), de la substance noire (Nagy et al., 2005; 2006) et de l’insula (Bushara, Grafman, & Hallett, 2001). De plus, des connexions entre le CS et plusieurs structures sous-corticales et corticales sont également mises en évidence dans plusieurs études chez l’homme et l’animal (Harting, Huerta, Hashikawa, & van Lieshout, 1991; Huerta & Harting, 1984; Sommer & Wurtz, 2001).
1.3.2 Aires associatives : modèle anatomique classique
Le premier modèle ayant tenté d’expliquer l’IMS, le modèle hiérarchique classique, suggérait un traitement hiérarchique des informations sensorielles où les informations en provenance des différentes aires sensorielles primaires et secondaires seraient acheminées vers les aires associatives multisensorielles pour que l'intégration des différents stimuli se produise (Bushara et al., 2003; Calvert & Thesen, 2004). Par la suite, des connexions descendantes pourraient influencer l'activité des neurones retrouvés dans les cortex de niveaux hiérarchiques inférieurs. Le transfert d'information entre les niveaux serait assuré par des connexions cortico-corticales réciproques (Felleman & Van Essen, 1991; Rockland & Pandya, 1979). Malgré la grande variabilité des protocoles et des analyses proposés par les techniques de
nombre d’aires corticales impliquées de manière récurrente dans l’intégration des informations AV. Parmi ces aires, nous retrouvons les aires associatives qui peuvent recevoir des entrées en provenance de plusieurs modalités sensorielles ou des entrées convergentes provenant de plusieurs modalités.
1.3.2.1 Lobe temporal
Chez le primate, l’aire supérieure temporale polysensorielle (ASTP), localisée au niveau du sillon temporal supérieur (STS), est connue pour détenir des neurones multisensoriels (Barraclough, Xiao, Baker, Oram, & Perrett, 2005; Beauchamp, 2005; Schroeder & Foxe, 2002) et avoir des connexions bidirectionnelles avec les cortex unisensoriels auditif, visuel et somatosensoriel (Cusick, 1997; Padberg, Seltzer, & Cusick, 2003; Schmahmann & Pandya, 1991). Bien que le rôle de l’ASTP semble assez bien établi dans l'IMS du langage (Beauchamp, Lee, Argall, & Martin, 2004; Calvert, Campbell, & Brammer, 2000; Kang et al., 2006), des études en neuroimagerie chez l’homme ont également démontré l’existence d’intégration de stimuli AV non linguistiques. En effet, une plus grande activation fut démontrée dans les portions postérieures du STS en réponse à des stimuli AV non linguistiques, tels que des objets et des animaux, en comparaison à leur présentation unisensorielle auditive et visuelle respective (Beauchamp et al., 2004; Hein et al., 2007; Sestieri et al., 2006; Taylor, Moss, Stamatakis, & Tyler, 2006). Les connexions de l’ASTP comprennent des afférences visuelles provenant des aires visuelles postérieures pariétales (Cusick, Seltzer, Cola, & Griggs, 1995; Seltzer & Pandya, 1994), d’aires du lobe temporal (Boussaoud, Ungerleider, & Desimone, 1990; Kaas & Morel, 1993; Saleem, Suzuki, Tanaka, & Hashikawa, 2000) et du cortex visuel primaire (Falchier, Clavagnier, Barone, & Kennedy,
2002). Des afférences provenant de la partie visuelle du noyau pulvinar du thalamus peuvent aussi fournir une partie de l’activation visuelle (Bruce, Desimone, & Gross, 1986).
1.3.2.2 Lobe pariétal postérieur
Le cortex pariétal postérieur des primates contient des aires qui semblent encoder la localisation des objets (Colby & Goldberg, 1999). Bien que les afférences visuelles fournissent la principale source d’information sensorielle vers les aires du sillon intrapariétal (SIP) du cortex pariétal postérieur, des études anatomiques (Lewis & Van Essen, 2000a, 2000b) et physiologiques (Grunewald, Linden, & Andersen, 1999; Linden et al., 1999) chez le primate, ont révélé des évidences de convergence multisensorielle dans le SIP. En effet, des neurones multisensoriels répondant à des stimuli visuels, auditifs, somatosensoriels et vestibulaires (Avillac, Deneve, Olivier, Pouget, & Duhamel, 2005; Schlack, Sterbing-D'Angelo, Hartung, Hoffmann, & Bremmer, 2005) ont été mis en évidence dans les aires du SIP. Cette structure reçoit également des afférences visuelles, auditives et somesthésiques provenant de plusieurs aires corticales (Hackett, Stepniewska, & Kaas, 1998; Lewis & Van Essen, 2000a; Nakamura et al., 2001). Chez l’homme, le cortex pariétal postérieur a aussi été montré en neuroimagerie et en EEG comme jouant un rôle dans l’IMS (Blanke & Arzy, 2005; Kitada et al., 2006; Molholm et al., 2006; Sereno & Huang, 2006). Ensemble, les aires du SIP ne semblent pas impliquées directement dans l’intégration AV, mais jouent un rôle important dans les activités sensorimotrices, telles que les tâches de préhension, et ce, principalement à travers les modalités visuelles et somesthésiques (Cohen & Andersen, 2002).
1.3.2.3 Lobe frontal
Les études neuroanatomiques chez les primates ont démontré une convergence des afférences sensorielles de diverses modalités au niveau des neurones multisensoriels des cortex prémoteur, préfrontal et cingulaire antérieur (Chavis & Pandya, 1976; Fuster, Bodner, & Kroger, 2000; Graziano & Gandhi, 2000; Graziano, Reiss, & Gross, 1999; Jones & Powell, 1970). De plus, des connexions réciproques ont été rapportées récemment entre des cortex sensoriels primaires et certaines régions des cortex préfrontal et prémoteur (Barbas et al., 2005; Budinger, Laszcz, Lison, Scheich, & Ohl, 2008; Liu et al., 2013; Romanski, Bates, & Goldman‐Rakic, 1999; Sugihara, Diltz, Averbeck, & Romanski, 2006). Par ailleurs, de récentes études en neuroimagerie ont révélé la présence d’une intégration d’informations AV non linguistiques dans le cortex préfrontal (Bushara et al., 2001; Paraskevopoulos, Kuchenbuch, Herholz, & Pantev, 2012) et le cortex cingulaire antérieur (Benoit, Raij, Lin, Jääskeläinen, & Stufflebeam, 2010; Laurienti et al., 2003).
1.3.3 Aires sensorielles primaires : modèle anatomique moderne
Jusqu’à la fin des années 1990, il était admis que les cortex primaires ne pouvaient être sensibles à d’autres stimuli que ceux correspondant à la modalité à laquelle ils étaient dévolus. Le dogme selon lequel l’IMS n’était possible qu’à un plus haut niveau de traitement cognitif fut renversé par des études sur les animaux et les humains qui ont permis de découvrir la présence de convergence multisensorielle dans les aires cérébrales traditionnellement considérées unisensorielles (Kayser, Petkov, Augath, & Logothetis, 2007; Martuzzi et al., 2006; Romei, Murray, Merabet, & Thut, 2007; Wang, Celebrini, Trotter, & Barone, 2008;Watkins, Shams, Tanaka, Haynes, & Rees, 2006; Figure 1). Les travaux anatomiques chez les animaux (Clavagnier, Falchier, & Kennedy, 2004; Falchier et al., 2002; Rockland & Ojima, 2003) ont révélé l’existence de connexions directes entre les cortex primaires, visuel et auditif, durant le traitement de stimuli AV. Il a été démontré qu’une information provenant d’une modalité sensorielle peut moduler l’activité neuronale dans le cortex sensoriel d’une autre modalité. En effet, des études en IRMf ont démontré une activation du cortex auditif suite à des stimulations visuelles et une modification de l'activité du cortex visuel par des sons (Laurienti et al., 2002; Mishra, Martinez, Sejnowski, & Hillyard, 2007). De plus, la présence de connexions entre les aires sensorielles primaires favoriserait également des interactions multisensorielles rapides. En effet, des études en PÉs ont démontré la présence d’intégration AV précoce au niveau des cortex sensoriels spécifiques auditif et visuel (Giard & Peronnet, 1999; Molholm et al., 2002; Senkowski, Talsma, Grigutsch, Herrmann, & Woldorff, 2007). La précocité de ces interactions multisensorielles suggère que celles-ci ne dépendent pas uniquement de connexions en retour des aires associatives vers les aires unisensorielles et que les aires associatives ne constituent pas le dernier échelon du traitement sensoriel, mais fonctionnent plutôt en parallèle aux réseaux unisensoriels (Bushara et al., 2003; Calvert & Thesen, 2004).
Figure 1. Modèle anatomique moderne des régions corticales multisensorielles chez le primate. Les zones colorées représentent les régions dans lesquelles des évidences anatomiques et électrophysiologiques ont démontré de l’IMS (Inspiré de Ghazanfar & Schroeder, 2006).
1.4 Principes généraux de l’IMS
Les stimuli multisensoriels peuvent faciliter ou atténuer la réponse des neurones multisensoriels dans des conditions bien précises. Le caractère intégratif d’un neurone multisensoriel dépend de quatre principes distincts : les règles spatiale et temporelle, le principe de l’efficacité inverse ainsi que de la préservation des champs récepteurs (voir Stein & Meredith; 1993, pour une revue à ce propos; Stein et al., 2014).
1.4.1 Règle spatiale
La règle de coïncidence spatiale stipule que la réponse des neurones multisensoriels du CS est maximale lorsque les stimuli multisensoriels sont alignés spatialement (Meredith & Stein, 1986). Ceci serait la conséquence du chevauchement et de l’étendue suffisamment grande des champs récepteurs unisensoriels dans le neurone multisensoriel (Stein & Meredith, 1993; Wallace & Stein, 2007; Figure 2).
Figure 2. Superposition des cartes spatiales au niveau des colliculus supérieurs pour les modalités visuelle, auditive et somesthésique (Inspiré de Stein et Meredith, 1993).
Ainsi, l'information provenant de plusieurs modalités sensorielles d'une même zone spatiale suscite une réponse largement supérieure des neurones multisensoriels que la réponse unisensorielle la plus élevée, ou même que la somme arithmétique des réponses unisensorielles les plus importantes, phénomène de potentialisation connu sous le nom de sur-additivité (Wallace & Stein, 1997; Figure 3). En contrepartie, les stimuli de différentes modalités sensorielles ayant des origines spatiales discordantes peuvent réduire ou même
Stein, 1997), alors inférieure aux réponses unisensorielles, phénomène connu sous le nom de sous-additivité.
Figure 3. La figure suivante illustre l’IMS au sein d’un neurone multisensoriel du CS. Les champs récepteurs auditifs et visuels de ce neurone sont représentés par les cercles verts (visuel : vert foncé, auditif : vert pâle). Les stimuli auditifs (A) sont représentés par un cercle blanc entouré de traits et les stimuli visuels (V) par une barre blanche. De faibles stimuli A et V (représentés par les points noirs) sont intégrés afin de produire une augmentation de la réponse multisensorielle. L’augmentation de la combinaison des réponses excède la somme des réponses aux stimulations unisensorielles (voir histogramme) donnant lieu à une réponse sur-additive. Reproduit avec la permission de Macmillan Publishers Ltd: [Nature Reviews Neuroscience], Stein & Stanford, copyright (2008).
1.4.2 Règle temporelle
Selon Wallace et Stein (1997), les stimuli provenant de plusieurs modalités sensorielles doivent survenir au sein d'une même fenêtre temporelle afin d'être traités comme provenant d'un même évènement et ainsi susciter une réponse des neurones multisensoriels. En effet, il
semble que ce soit le recouvrement des patrons d’activité neuronale plutôt qu’une parfaite synchronie qui déterminera la réponse maximale (Meredith, Nemitz, & Stein, 1987; Wallace et al., 1996). Ceci étant dit, en raison des propriétés physiques des stimuli (les ondes lumineuses se propagent plus rapidement que les ondes sonores) et de la vitesse de conduction axonale selon les modalités (les informations auditives activent le CS plus rapidement que les informations visuelles), les informations sensorielles issues d’un même évènement activent les neurones multisensoriels à différentes latences. Pour pallier ce décalage, la présence d’une fenêtre temporelle suffisamment large permet le chevauchement des activités neuronales induites par les différents stimuli sensoriels et assure ainsi leur intégration (Meredith et al., 1987; Stein et al., 2014; Stein & Wallace, 1996). Bien qu’elle dépende des combinaisons sensorielles, la durée de cette fenêtre permettant une augmentation des réponses neuronales aux stimulations multisensorielles est généralement de 100 millisecondes (ms) et peut atteindre 1500 ms (Alais, Newell, & Mamassian, 2010). Ainsi, la règle de coïncidence temporelle indique que l’ampleur de la réponse multisensorielle est d’autant plus forte que les composantes unisensorielles sont temporellement proches (sur-additivité). En revanche, en cas de disparité temporelle importante, la réponse neuronale sera inchangée ou même diminuée (sous-additivité; Stein et al., 2014). Les règles de sur- et de sous-additivité sont représentées à la Figure 4.
1.4.3 Préservation des champs récepteurs
Selon Stein et ses collègues (1993, 2014) des neurones multisensoriels conservent les mêmes propriétés pour les entrées multisensorielles et unisensorielles afin d’assurer la
temporelle permettent de détecter et de localiser plus rapidement une cible présente dans un monde perceptif changeant.
Figure 4. Résumé des deux principaux critères d’IMS (A : information auditive; V : information visuelle; AV : information audiovisuelle). a) Sur-additivité : l’effet de la combinaison du stimulus multisensoriel AV est plus grand que la somme des stimuli unisensoriels le composant. b) Sous-additivité : l’effet du stimulus AV est plus petit que la somme des stimuli unisensoriels ainsi que chaque stimulus unisensoriel seul.
1.4.4 Efficacité inverse
Toujours dans le CS, différents types de neurones montrant une réponse multisensorielle différente ont été décrits en fonction de l’efficacité, donc de l’intensité des stimuli présentés (Perrault, Vaughan, Stein, & Wallace, 2005). La mesure de l’efficacité de la combinaison multisensorielle a été proposée comme étant le pourcentage de gain apporté par la combinaison de stimuli par rapport à la réponse maximale de chacun des stimuli unisensoriels à eux seuls (Stein & Meredith, 1993). Il a été observé que plus les stimuli unisensoriels sont de faible intensité, plus leur combinaison produira un gain important : c’est la règle d’efficacité inverse (Stein & Meredith, 1993; Stanford, Quessy, & Stein, 2005). Plus précisément, cette règle stipule que la présentation combinée de stimuli unisensoriels de faible intensité, produira une réponse neuronale multisensorielle d’autant plus augmentée. Ainsi, un
stimulus unisensoriel dont l’intensité est inférieure au seuil de détection peut être perçu par l’adjonction d’une autre composante sensorielle elle-même peu ou pas efficace (Meredith & Stein, 1986). Cette propriété est intéressante au niveau comportemental car elle permettrait d'augmenter la saillance (baisse du seuil de détection) de stimuli peu efficaces (Stein & Meredith, 1993; Stein & Stanford, 2008; Stein et al., 2014). À l’inverse, plus un stimulus unisensoriel est efficace par lui-même et moins il produira de réponse en combinaison avec un autre.
1.5 Intégration audiovisuelle
La vision et l'audition sont reconnues pour leur collaboration étroite dans la perception, comme en témoigne une littérature abondante. L’article 2 de la présente thèse s’intéresse spécifiquement au développement de l’intégration AV avec l’âge. Ainsi, les prochaines sections porteront sur ce type d’IMS.
1.5.1 Développement des systèmes auditif et visuel
Il est possible de supposer que l’expérience multisensorielle, sous l’effet de la maturation cérébrale, contribue à l’amélioration des capacités multisensorielles. Par ailleurs, cette amélioration peut également dépendre directement du développement de chacun des systèmes sensoriels et ainsi de leur capacité à mieux prélever et discriminer les informations sensorielles. Les études développementales portant sur les premiers mois de la vie démontrent
Ainsi, afin de mieux comprendre le développement des capacités d’intégration AV il importe de porter une attention particulière sur le développement respectif de chacun de ces sens.
1.5.1.1 Système visuel
L’organisation du système visuel se caractérise par deux voies distinctes permettant l’analyse de paramètres différents dans la perception visuelle et qui demeurent relativement séparées de la rétine au cortex (Daw & Daw, 2006). Le traitement initial de l’image prend place dans la rétine. L’information visuelle rejoint les axones des cellules ganglionnaires de la rétine, emprunte le nerf optique pour être ensuite relayée par le corps genouillé latéral (CGL) au niveau du thalamus avant de parvenir au cortex visuel primaire ou cortex strié (aire V1). L’impulsion électrique de V1 se propage ensuite vers les aires visuelles extra-striées (V2, V3, V4, V5/MT) où l’information visuelle sera traitée par deux voies distinctes impliquées dans des types de perception complémentaires. La voie magnocellulaire permet de déterminer la position spatiale d’un objet (voie dorsale, occipito-pariétale ou du « où ») et la voie parvocellulaire joue un rôle majeur dans la reconnaissance et l’identification visuelle (voie ventrale, occipito-temporale ou du « quoi ») (Snowden et al., 2012; Tovée, 1996).
Bien que le système visuel débute son développement anatomique au cours de la période gestationnelle, il demeure immature à la naissance tout en continuant de se spécialiser jusqu’à l’âge adulte (Brecelj, 2003). En effet, dès la 28ième semaine de gestation, le cortex visuel primaire connaît une expansion volumique fulgurante pour ensuite atteindre sa taille adulte vers l’âge de 4 mois suite à la naissance (Huttenlocher, 1990). Cette augmentation du volume paraît liée à l’augmentation de taille du corps du neurone et de la longueur des dendrites en lien avec une phase d’intense synaptogenèse. Il est estimé que seulement environ
10% du total du nombre de synapses qui existent dans le cortex visuel humain sont formés à la naissance. En effet, dans le cortex visuel primaire, la synaptogenèse est la plus rapide entre 2 et 4 mois, suivie d’une élimination progressive de 40% de la densité synaptique entre les âges de 8 mois et 11 ans (fonction visuelle mature) (Huttenlocher, de Courten, Garey, & Van der Loos, 1982). Quant à la myélinisation du système visuel, celle-ci débute entre le sixième et le huitème mois de vie fœtale, et se développe depuis le CGL vers le chiasma et le globe oculaire pour se poursuivre dans les nerfs optiques jusqu’à l’âge de 2 ans (Héran, Koskas, & Vignal, 2010; Magoon & Robb, 1981) et dans le cortex visuel primaire jusqu’à 5 ans (Huttenlocher & Dabholkar, 1997) pour ensuite se prolonger dans le cortex visuel extra-strié jusqu’à l’âge adulte (Paus et al., 2001). Sur le plan fonctionnel, plusieurs études animales ont démontré que le développement du traitement visuel s’effectue majoritairement après la naissance et dépend des stimulations visuelles environnementales (Crair, Gillespie, & Stryker, 1998; White & Fitzpatrick, 2007). D’ailleurs, la complexification et la spécialisation des réponses neuronales en réaction à des caractéristiques spécifiques d’un stimulus visuel s’accroîent avec l’âge. Au cours des premières années de vie, les PÉVs afffichent notamment des changements au niveau de la latence et de l’amplitude pour atteindre une morphologie adulte entre l’âge de 1 et 6 ans (Crognale, 2002; Kos-Pietro, Towle, Cakmur, & Spire, 1997; Madrid & Crognale, 2000).
1.5.1.2 Système auditif
Pour être analysée et décodée, l’onde sonore voyage à travers le système auditif qui est constitué de plusieurs relais fonctionnels accomplissant chacun une partie du traitement permettant de construire le percept auditif et, ultimement, de le lier avec nos connaissances et
par les cellules ciliées de la cochlée située dans l’oreille interne. Ensuite, ce signal progresse le long des noyaux du tronc cérébral, rejoint le cortex auditif primaire, responsable du décodage des composantes acoustiques élémentaires comme la fréquence et l’intensité (Bilecen, Seifritz, Scheffler, Henning, & Schulte, 2002; Formisano et al., 2003), pour ensuite atteindre les aires corticales auditives non primaires qui répondent aux composantes spectralement et temporellement complexes des sons (Hall et al., 2002; Hart, Palmer, & Hall, 2003).
Dès les toutes premières semaines de gestation, le processus de développement du système auditif se met en place et mènera à la formation des composantes de l’oreille ainsi que des voies auditives. D’un point de vue anatomique, les structures de l’oreille externe et moyenne s’édifient principalement durant le premier trimestre de la grossesse suivi par le développement de l’oreille interne qui prendrait fin dans le huitième mois de gestation (Lecanuet & Schaal, 1996). La majorité des études développementales suggèrent que l’audition fœtale débuterait et se développerait très progressivement entre la 20ième et la 28ième semaine de gestation (Aslin, Pisoni, & Jusczyk, 1983; Chelli & Chanoufi, 2008; Shahidullah & Hepper, 1993). Quant à lui, le développement anatomique des voies auditives centrales se fait parallèlement à celui du système périphérique. En effet, la maturation des différentes structures composant les premier (noyaux cochléaires), deuxième (complexe olivaire supérieur, thalamus), troisième (CS), et dernier relais (corps genouillé médian) des voies auditives primaires s’étend du quatrième au septième mois de gestation. La migration neuronale depuis les zones de prolifération périventriculaires débute vers la huitième semaine de vie au niveau du tronc cérébral, mais se prolonge après la naissance au niveau du cortex cérébral. De même, la myélinisation intervient après la croissance et la multiplication neuronale, et se développe progressivement de la périphérie vers le centre. Ainsi, les racines
du nerf auditif sont complétement myélinisées vers 24-26 semaines de gestation, mais la maturation et la myélinisation des projections thalamo-corticales au sein du cortex auditif atteignent un stade adulte vers l’âge de 5 ans. De même, les connexions atteignent leur pleine efficacité entre les âges de 11 et 12 ans (Moore & Linthicum, 2007). Ainsi, le système auditif serait opérationnel dès le début du troisième trimestre de la gestation et continuerait de s’affiner lors de l’enfance et même l’adolescence (Hnath-Chisolm, Laipply, & Boothroyd, 1998; Ruben, 1995). Sur le plan fonctionnel, une réactivité fœtale à des stimulations acoustiques (Grimwade, Walker, Bartlett, Gordon, & Wood, 1971) a été enregistrée dans plusieurs études (Lecanuet, Granier-Deferre, Cohen, Le Houezec, & Busnel, 1986; Ruben, 1995; Trudinger & Boylan, 1980). Au moment où la cochlée commence à répondre aux sons, des réponses évoquées peuvent être enregistrées jusqu’au niveau du cortex auditif primaire entre la 24ième et la 37ième semaines de grossesse (Draganova et al., 2005; Starr, Amlie, Martin, & Sanders, 1977; Weitzman & Graziani, 1968). La maturation des potentiels d’action s’accroît pendant la période fœtale et se poursuit pendant la période post-natale (Uziel, Marot, & Germain, 1980). En fonction de l’âge, la morphologie de la courbe électrophysiologique augmente progressivement en complexité, c’est-à-dire que la latence des composantes diminue et leur amplitude augmente (Cheour, Leppänen, & Kraus, 2000; Lippé, Martinez-Montes, Arcand, & Lassonde, 2009; Moore & Linthicum, 2007; Wunderlich, Cone-Wesson, & Shepherd, 2006).
1.6 Intégration AV chez l’homme adulte
1.6.1 Gain comportemental
Tel que mentionné précédemment, la capacité du cerveau à intégrer différentes informations sensorielles d’un même évènement confère des gains comportementaux notables qui seront abordés dans la revue de littérature (article 1). L’article 2 portant spécifiquement sur l’intégration AV non linguistique, les études exposant les avantages comportementaux associés à ce type d’IMS seront exposées dans la présente section.
Chez les adultes, des effets de facilitation comportementale tels qu’une diminution des temps de réaction ont été rapportés lorsque les informations auditives et visuelles sont présentées de façon simultanée ou dans un temps rapproché et partagent la même source spatiale (Colonius, Diederich, & Steenken, 2009; Fendrich & Corballis, 2001; Slutsky & Recanzone, 2001; Spence, Baddeley, Zampini, James, & Shore, 2003; Teder-Sälejärvi, Di Russo, McDonald, & Hillyard, 2005; Yang et al., 2013; Zampini, Shore, & Spence, 2003). De même, plusieurs études comportementales récentes ont révélé que les adultes intègrent les informations AV redondantes de façon optimale (Alais & Burr, 2004; Battaglia, Jacobs, & Aslin, 2003; Heron, Whitaker, & McGraw, 2004). Les gains comportementaux peuvent également se traduire par des effets de facilitation multisensorielle (c.-à-d., influence d'un stimulus accessoire sur le stimulus principal) où la présentation simultanée ou proche dans le temps d’un son, pertinent ou non pour la réalisation d’une tâche, induit notamment une diminution des temps de réaction à une cible visuelle et augmente l’intensité perçue du stimulus visuel (Fiebelkorn, Foxe, Butler, & Molholm, 2011; Lippert, Logothetis, & Kayser, 2007; McDonald, Teder-Salejarvi, & Hillyard, 2000; Noesselt et al., 2007; Stein & Wallace,
1996). Par exemple, un flash lumineux est identifié beaucoup plus rapidement quand il est précédé d’un son (McDonald et al., 2000) et l’émission d’un son peut améliorer la perception de l’intensité d’une lumière (Stein, London, Wilkinson, & Price, 1996).
1.6.2 Corrélats électrophysiologiques de l’intégration AV
Sur le plan neuronal, une méthode fréquemment employée pour mesurer l’IMS consiste à comparer la réponse évoquée par les stimuli audiovisuels (AV) à la somme des réponses émanant de chacune des modalités sensorielles auditive (A) et visuelle (V).
Intégration AV = réponses AV – [(réponses A) + (réponses V)]
D’ailleurs, plusieurs travaux en EEG et en magnétoencéphalographie (MEG) ont fait appel à ce modèle d’additivité pour étudier les processus d’intégration AV chez l’homme adulte par le biais de tâches passives ou requérant une réponse de la part du participant (Fort, Delpuech, Pernier, & Giard, 2002a, 2002b; Giard & Peronnet, 1999; Molholm, Ritter, Javitt, & Foxe, 2004; Molholm et al., 2002; Raij et al., 2010; Stekelenburg & Vroomen, 2007; Talsma & Woldorff, 2005; Teder-Sälejärvi, McDonald, Di Russo, & Hillyard, 2002; Vidal, Giard, Roux, Barthelemy, & Bruneau, 2008). Des effets de sur-additivité (Cappe, Thut, Romei, & Murray, 2010; Giard & Peronnet, 1999; Sakowitz, Quiroga, Schürmann, & Başar, 2005; Talsma, Doty, & Woldorff, 2006) et de sous-additivité (Molholm et al., 2002; Stekelenburg & Vroomen, 2007; Vroomen & Stekelenburg, 2010) ont été mesurés dans les études employant des PÉs. La mesure des PÉs repose sur l'enregistrement des modifications de
seront abordés en detail dans une section subséquente. Par exemple, certaines études ont démontré que l’information AV peut moduler l’amplitude des composantes EEG N1 et P2 auditives ainsi que la N1 visuelle (Besle, Bertrand, & Giard, 2009; Giard & Besle, 2010; Molholm et al., 2002; Stekelenburg & Vroomen, 2007, 2012). De même, une augmentation de l’amplitude des réponses oscillatoires AV évoquées a été trouvée dans les bandes de fréquences thêta, alpha, bêta et gamma (Sakowitz et al., 2001, 2005; Sakowitz, Schürmann, & Başar, 2000; Senkowski, Molholm, Gomez-Ramirez, & Foxe, 2005; Yan et al., 2016).
Les récentes études ont mis en évidence deux stades d’intégration distincts suite à la présentation de stimuli AV. En effet, des effets d’intégration précoce (autour de 50 ms) ont été démontrés dans plusieurs études en PÉs (Fort et al., 2002; Foxe & Schroeder, 2005; Giard & Peronnet, 1999; Molholm et al., 2004; Molholm et al., 2002; Talsma & Woldorff, 2005; Vidal et al., 2008) ainsi que dans certaines bandes de fréquences (Senkowski, Molholm, et al., 2005; Senkowski et al., 2007; Senkowski, Talsma, Herrmann, & Woldorff, 2005) au niveau pariéto-occipital. De même, de l’intégration AV a été observée entre 100 et 200 ms notamment dans les régions fronto-centrales (Molholm et al., 2002; Sakowitz et al., 2000; Senkowski, Molholm, et al., 2005; Teder-Sälejärvi et al., 2002; Tucker, 1993; Yan et al., 2016) et pariéto-temporales (Giard & Peronnet, 1999; Gondan & Röder, 2006; Teder-Sälejärvi et al., 2002).
Bien qu’il existe des divergences quant au type de composantes EEG observé, à la bande de fréquences ainsi qu’à la localisation cérébrale dans lesquelles la réponse neuronale se manifeste, l’ensemble de ces études démontre la présence de processus d’intégration AV chez l’adulte.
1.7 Inné ou acquis ?
Une question importante est de savoir si cette capacité à intégrer les informations multisensorielles de façon optimale est ancrée en nous dès la naissance ou si elle se développe au cours de l’enfance en fonction de l’expérience. La revue de la littérature incluse dans la présente thèse (article 1) s’attardera, en partie, sur le développement des capacités d’intégration dans plusieurs modalités sensorielles. Ainsi, nous n’aborderons que de façon sommaire la dichotomie inné-acquis de l’intégration AV.
1.7.1 Études animales
De récents travaux neurophysiologiques réalisés chez les animaux corroborent l’idée que le développement de la capacité du cerveau à intégrer les informations AV s’échelonne au cours d’une période postnatale prolongée (Wallace & Stein, 1997, 2001; Yu, Rowland, & Stein, 2010). Bien que les neurones multisensoriels corticaux et sous-corticaux soient fonctionnels dès la naissance, les travaux chez le chat ont démontré qu’ils ne répondent qu’à un seul type d’information sensorielle et que l’émergence des propriétés intégratives de ces neurones ne survient qu’après plusieurs mois de vie (Wallace, Carriere, Perrault, Vaughan, & Stein, 2006; Wallace & Stein, 1997). De plus, la maturation des réponses multisensorielles dépend fortement de l’expérience environnementale et des afférences des aires corticales (Wallace & Stein, 2001, 2007). Par exemple, suite à une privation visuelle les neurones multisensoriels émettent des réponses atypiques et échouent à intégrer les informations des différentes modalités (Wallace, Perrault, Hairston, & Stein, 2004). De même, chez des chats
neurones du CS développent une forme d’intégration où les stimuli spatialement disparates sont intégrés de la même façon que s’ils venaient d’un même endroit, suggérant que les principes gouvernant l’intégration des sens puissent être très plastiques et que ceux-ci s’établissent en fonction des propriétés de l’environnement (Wallace & Stein, 2007). De plus, la maturation des réponses multisensorielles dépend fortement des afférences des aires corticales. En effet, le retrait du sillon ectosylvien antérieur et du cortex latéral suprasylvien au cours des premiers stades développementaux chez le chat perturbe le développement des propriétés multisensorielles du CS (Jiang, Jiang, Rowland, & Stein, 2007; Wallace et al., 2006).
1.7.2 Sensibilité à la synchronie chez le nourrisson
Les résultats de plusieurs études comportementales contemporaines appuient deux conceptions sur le développement des habiletés multisensorielles. Le premier courant de pensée, celui de l’approche de différenciation développementale (Bower, 1974; Gibson 1969; Gibson 1966), suggère que le nouveau-né entre dans le monde avec des systèmes sensoriels fonctionnels et, conséquemment, est sensible aux propriétés amodales et peut percevoir des relations multisensorielles. D’une part, la capacité à lier les stimulations provenant de différents sens pourrait être antérieure à la naissance et remonter à la vie in-utéro. Différents travaux démontrent la présence d’une aptitude du fœtus à effectuer des mises en relation et des apprentissages multisensoriels (James, 2010). De plus, il a été démontré que les nouveau-nés détiennent des habiletés de perception multisensorielle de bas niveau et bénéficient des informations redondantes telles que la détection des relations de l’intensité et de la synchronie (Bahrick & Lickliter, 2000, 2004; Lewkowicz, 1996). Par exemple, des nouveau-nés peuvent