Myocyte Enhancer Factor 2 (MEF2) : un facteur impliqué
dans le maintien des fonctions stéroïdogéniques des
cellules de Leydig
Thèse
Mickaël Di-Luoffo
Doctorat en biologie cellulaire et moléculaire
Philosophiae doctor (Ph.D.)
Québec, Canada
III
RÉSUMÉ
Chez l’homme, les cellules de Leydig sont les principales productrices d’hormones stéroïdiennes dans le testicule. Ces hormones, dont font partie la testostérone, la dihydroprogestérone (DHP) et la dihydrotestostérone (DHT), sont indispensables à la spermatogenèse, au développement des caractéristiques sexuelles primaires et secondaires ainsi qu'au maintien de la fertilité masculine. Les niveaux d’hormones stéroïdiennes produits par ces cellules doivent être étroitement régulés au cours du développement. En outre, la stéroïdogenèse est source de formation d'espèces réactives de l'oxygène (ERO). La présence d'ERO en excès dans les cellules de Leydig, inhibe la stéroïdogenèse. Notre laboratoire a récemment identifié un nouveau facteur de transcription, myocyte enhancer factor 2 (MEF2), présent dans le testicule, tout au long de la vie. Ce facteur, premièrement identifié dans le cœur et le cerveau, est essentiel à l'organogenèse ainsi qu'à la différenciation cellulaire. Dans un premier temps, mon travail de doctorat met en évidence le rôle clé du facteur MEF2 dans la régulation de l’expression génique dans la lignée de cellules de Leydig MA-10. Dans un second temps, ce travail caractérise le rôle de MEF2 dans la régulation de l’expression des gènes impliqués dans les mécanismes de détoxification cellulaire, qui permettent l’élimination des ERO produites par la stéroïdogenèse. Le facteur MEF2 régule, seul ou en coopération avec la Ca2+
/calmoduline-dependent protein kinase I (CAMKI), l’expression du gène Gsta1 qui code pour une enzyme antioxydante, la glutathion-S transférase A1. De plus, MEF2 n’est pas le seul facteur de transcription présent dans les cellules de Leydig et la coopération entre différents facteurs de transcription permet la régulation de l’expression des gènes. Ainsi, dans un troisième temps, mon travail de doctorat met en évidence une nouvelle coopération entre les facteurs de transcription MEF2 et COUP-TFII dans les cellules de Leydig MA-10. MEF2 et COUP-TFII régulent l’expression du gène Akr1c14 codant pour une 3α-hydroxystéroïde déshydrogénase, permettant la régulation des niveaux de DHP et DHT qui sont des stéroïdes métaboliquement très actifs. En conclusion, mes travaux mettent en évidence le rôle du facteur MEF2 sur l’expression des gènes impliqués dans le maintien et la régulation des fonctions stéroïdogéniques des cellules de Leydig.
V
ABSTRACT
In male, the Leydig cells are the main producer of steroid hormones in the testis. These steroids, including testosterone, DHT and DHP, are essential for spermatogenesis, for the development of primary and secondary male sexual characteristics and for the maintenance of male fertility. The steroid levels produced by these cells must be tightly regulated throughout fetal and adult life. In addition to synthesizing steroids, steroidogenesis produces a significant amount of reactive oxygen species (ROS), which in turn disrupt steroid production. Our lab has recently identified the presence of a novel transcription factor, myocyte enhancer factor 2 (MEF2), in the mouse testis, throughout fetal and adult life. MEF2 factor is an important regulator of organogenesis and cell differentiation in various tissues and was first identified in the heart and the brain. Initially, my Ph.D. work highlights the key role of MEF2 factor in the regulation of gene expression in the MA-10 Leydig cell line. Secondly, my work characterized the role of MEF2 in the regulation of genes involved in cellular detoxification mechanisms, which seek the elimination of ROS produced by steroidogenesis. The transcription factor MEF2 regulates, alone or in cooperation with the Ca2+/calmodulin-dependent protein kinase I (CAMKI), the expression
of Gsta1 gene that encodes for an antioxidant enzyme, glutathione S-transferase A1. Furthermore, MEF2 is not the sole transcription factor present in Leydig cells and the cooperation between different transcription factors allows for proper regulation of steroidogenic gene expression. Thereby, the third part of my Ph.D. work highlighted a new cooperation between two transcription factors, MEF2 and COUP-TFII in MA-10 Leydig cells. In these cells, MEF2 and COUP-TFII cooperate to regulate Akr1c14 gene expression. This gene encode for a 3α-hydroxysteroid dehydrogenase that regulates the bioavailabilities of DHP and DHT, which are potent steroids. In conclusion, my work identifies novel important roles for MEF2 factor in the expression of genes involved in the maintenance and regulation of Leydig cell functions.
VII
TABLE DES MATIÈRES
RÉSUMÉ ... III ABSTRACT ... V TABLE DES MATIÈRES ... VII LISTE DES TABLEAUX ... XIII LISTE DES FIGURES ... XV LISTE DES ABRÉVIATIONS ... XVII REMERCIEMENTS ... XXIX AVANT-PROPOS ... XXXIII
1. Chapitre 1 : Introduction ... 1
1.1. Introduction générale ... 2
1.2. L’axe hypothalamo-hypophysaire gonadique ... 3
1.2.1. L’hypothalamus ... 3
1.2.2. L’hypophyse ... 5
1.2.2.1. Les cellules gonadotropes hypophysaires ... 7
1.2.2.2. Les gonadotropines hypophysaires ... 8
1.2.2.2.1. La FSH ... 8
1.2.2.2.2. La LH ... 9
1.3. L’appareil reproducteur masculin ... 11
1.3.1. Constitution ... 11
1.3.2. Le développement testiculaire ... 13
1.3.3. Composition du testicule ... 15
1.3.3.1. Les tubes séminifères ... 15
VIII
1.3.3.1.2. Les cellules de Sertoli ... 16
1.3.3.1.3. Les cellules germinales ... 18
1.3.3.2. L’espace interstitiel ... 20
1.3.3.2.1. Les vaisseaux sanguins ... 20
1.3.3.2.2. Les macrophages ... 21
1.3.3.2.3. Les cellules de Leydig ... 22
1.3.3.2.3.1. Les cellules de Leydig fœtales (FLC)... 24
1.3.3.2.3.2. Les cellules de Leydig adultes (ALC) ... 29
1.3.3.2.3.2.1. Des SLC aux PLC... 29
1.3.3.2.3.2.2. Des PLC aux ILC ... 31
1.3.3.2.3.2.3. Des ILC aux MLC ... 31
1.3.3.2.3.2.4. Les facteurs impliqués dans la différenciation des ALC . 34 1.3.3.2.3.3. Les modèles de cellules de Leydig utilisées ... 36
1.3.4. La stéroïdogenèse ... 38
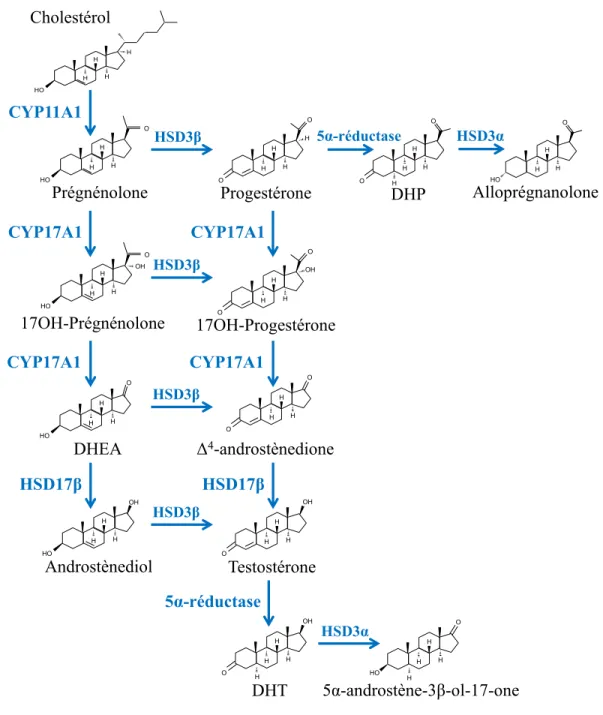
1.3.4.1. Le substrat de la stéroïdogenèse : le cholestérol ... 38
1.3.4.2. Le déroulement de la stéroïdogenèse ... 39
1.3.4.3. L’enzyme 3α-hydroxystéroïde déshydrogénase (HSD3α) ... 41
1.3.4.4. Les voies d’activation de la stéroïdogenèse ... 45
1.3.4.4.1. Le récepteur à la LH ... 45
1.3.4.4.2. La voie de l’AMPc et la protéine kinase A ... 46
1.3.4.4.3. La voie de la protéine kinase C ... 48
1.3.4.4.4. La voie des MAPK/ERK ... 49
1.3.4.4.5. La voie du Ca2+ et des CAMK ... 50
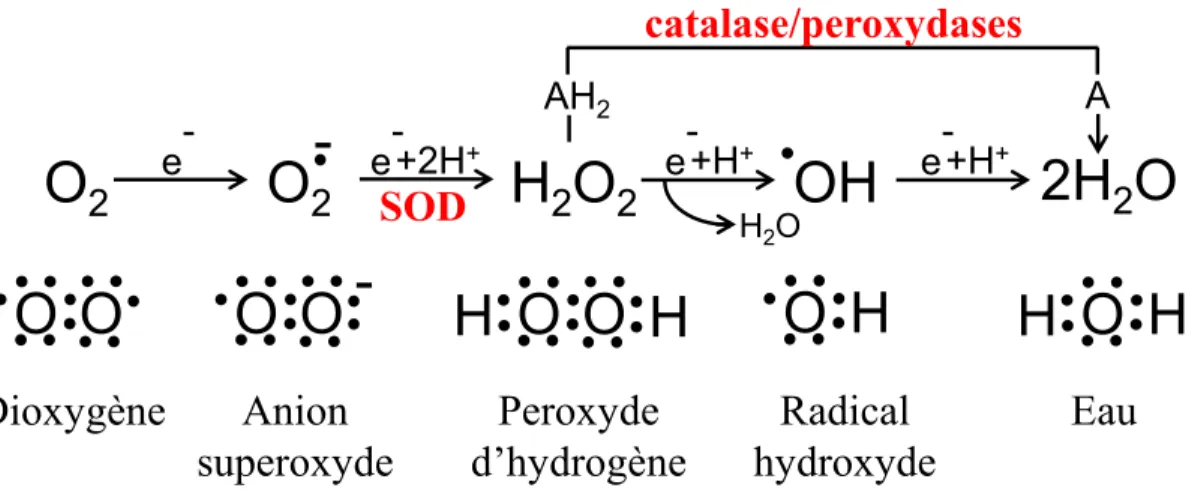
1.3.5. Les ERO (ou ROS) et les défenses antioxydantes ... 55
IX
1.3.5.2. Les défenses antioxydantes ... 58
1.3.5.2.1. Les molécules antioxydantes de petite taille ... 59
1.3.5.2.2. Les protéines transporteuses de fer et de cuivre ... 60
1.3.5.2.3. Les oligo-éléments ... 61
1.3.5.2.4. Les enzymes antioxydantes ... 61
1.3.5.2.4.1. La thiorédoxine réductase ... 61
1.3.5.2.4.2. L’hème oxygénase ... 61
1.3.5.2.4.3. Les protéines du choc thermique ... 62
1.3.5.2.4.4. Les Cu2+,Zn2+-SOD et Mn2+-SOD ... 62
1.3.5.2.4.5. La catalase ... 63
1.3.5.2.4.6. Les glutathion peroxydases ... 64
1.3.5.2.4.7. Les péroxyrédoxines ... 65
1.3.5.2.4.8. Les glutathion S-transférases ... 67
1.4. La régulation de l’expression des gènes ... 72
1.4.1. La chromatine ... 72
1.4.2. Les ARN polymérases ... 74
1.4.3. La séquence promotrice d’un gène ... 74
1.4.4. Les facteurs de transcription généraux ... 75
1.4.5. L’activation ou la répression des gènes ... 76
1.4.6. Les facteurs de transcription présents dans les cellules de Leydig ... 77
1.4.6.1. Le récepteur orphelin COUP-TFII ... 80
1.4.6.2. MEF2... 84
1.5. Hypothèse et objectifs ... 89
1.5.1. Hypothèse ... 89
X
1.5.3. Objectif II ... 90
1.5.4. Objectif III ... 91
2. Chapitre 2 : Nouveaux gènes cibles pour le facteur de transcription MEF2 dans les cellules de Leydig MA-10 ... 93
Introduction au chapitre 2 ... 94
RÉSUMÉ ... 96
ABSTRACT ... 97
INTRODUCTION ... 98
MATERIALS AND METHODS ... 100
RESULTS ... 104
DISCUSSION ... 108
ACKNOWLEDGEMENTS ... 113
REFERENCES ... 118
FIGURE LEGENDS ... 124
3. Chapitre 3 : Le facteur de transcription MEF2 : un nouveau régulateur de l’expression des gènes de la classe des Gsta dans la lignée de cellules de Leydig MA-10.... ... 131
Introduction au chapitre 3 ... 132
RÉSUMÉ ... 134
ABSTRACT ... 135
INTRODUCTION ... 136
MATERIALS AND METHODS ... 139
RESULTS ... 142
XI
ACKNOWLEDGEMENTS ... 150
REFERENCES ... 153
FIGURE LEGENDS ... 160
4. Chapitre 4 : MEF2 et NR2F2 (COUP-TFII) coopèrent pour réguler l’expression du gène Akr1c14 dans la lignée de cellules de Leydig MA-10 ... 170
Introduction au chapitre 4 ... 171
RÉSUMÉ ... 173
ABSTRACT ... 174
INTRODUCTION ... 175
MATERIALS AND METHODS ... 178
RESULTS ... 181
DISCUSSION ... 184
ACKNOWLEDGEMENTS ... 189
REFERENCES ... 190
FIGURE LEGENDS ... 198
5. Chapitre 5 : Discussion et conclusions ... 206
5.1. MEF2 : un régulateur de la stéroïdogenèse des cellules de Leydig ... 207
5.2. MEF2 : un facteur régulateur des défenses antioxydantes des cellules de Leydig. ... 210
5.3. MEF2 collabore avec d’autres facteurs de transcription ... 212
5.4. L’hypothèse d’une coopération MEF2/COUP-TFII dans les cellules de la prostate ... 214
XII
XIII
LISTE DES TABLEAUX Chapitre 1 Tableau 1.1 ... 71 Chapitre 2 Table 2.1 ... 114 Table 2.2 ... 115 Table 2.3 ... 116 Table 2.4 ... 116 Table 2.5 ... 117 Chapitre 3 Table 3.1 ... 151 Table 3.2 ... 152 Chapitre 4 Table 4.1 ... 196 Table 4.2 ... 197
XV
LISTE DES FIGURES Chapitre 1 Figure 1.1 ... 23 Figure 1.2 ... 33 Figure 1.3 ... 44 Figure 1.4 ... 54 Figure 1.5 ... 71 Figure 1.6.. ... 83 Figure 1.7. ... 88 Chapitre 2 Figure 2.1. ... 126 Figure 2.2. ... 127 Figure 2.3. ... 128 Figure 2.4. ... 129 Figure 2.5. ... 130 Chapitre 3 Figure 3.1 ... 163 Figure 3.2 ... 164 Figure 3.3 ... 165 Figure 3.4 ... 166 Figure 3.5 ... 167 Figure 3.6 ... 168 Figure 3.7 ... 169 Chapitre 4 Figure 4.1 ... 201 Figure 4.2 ... 202 Figure 4.3 ... 203 Figure 4.4 ... 204 Figure 4.5 ... 205
XVII
LISTE DES ABRÉVIATIONS
°C : degrés Celsius µm : micromètre ·OH : radical hydroxyle 3α-diol : 5α-androstène-3β-ol-17-one 3α-DIOL : 5α-androstane-3α-17β-diol 17-OH-PRE : 17-hydroxy-prégnénolone A A : adenine
ABP : androgen binding protein AC : adénylate cyclase
ACTH : adrenocorticotropic hormone ADH : antidiuretic hormone
ADN : acide désoxyribonucléique AF-1 : activation function 1 AF-2 : activation function 2 AFB1 : aflatoxine B1
AKR1C12 : aldo-céto réductase famille 1, membre C12 AKR1C13 : aldo-céto réductase famille 1, membre C13 AKR1C14 : aldo-céto réductase famille 1, membre C14 AKR1C18 : aldo-céto réductase famille 1, membre C18 AKR1C19 : aldo-céto réductase famille 1, membre C19 AKR1C2 : aldo-céto réductase famille 1, membre C2 AKR1C20 : aldo-céto réductase famille 1, membre C20 AKR1C21 : aldo-céto réductase famille 1, membre C21 AKR1C3 : aldo-céto réductase famille 1, membre C3 AKR1C6 : aldo-céto réductase famille 1, membre C6 ALC : cellules de Leydig adultes
AMH : hormone anti-müllerienne AMP : adénosine monophosphate
XVIII
AMPK : AMP-kinase
AR : récepteur aux androgènes
ARE/hARE : antioxidant response element/human antioxidant response element ARN : acide ribonucléique
ARNm : ARN messager ARNr : ARN ribosomiques ARNs : small/courts ARN ARNt : ARN de transfert
ARP1 : apolipoprotein regulating protein 1 ARX : aristaless-related homeobox
ATP : adénosine triphosphate
B
BMP : bone morphogenic protein BMP2 : bone morphogenetic protein 2 BMP4 : bone morphogenetic protein 4 Boite HMG : high mobility group box
bZIP : fermeture éclair à leucine (leucine zipper)
C
C : cytosine
Cas9 : CRISPR associated protein 9 C/EBP : CCAAT/enhancer binding protein C57BI/6J : C57 black 6
Ca2+ : ion calcium
CABIN1 : calcineurin-binding protein 1 CAM : calmoduline
CAMK : Ca2+/calmodulin-dependent protein kinase
CAMKK : Ca2+/calmoduline kinase kinase
CAT : catalase
CBP : CREB binding protein CD : cluster of differentiation
XIX C-KIT : mast/stem cell growth factor receptor
CN : calcineurine
CO : monoxyde de carbone
COUP-TFI : chicken ovalbumin upstream promoter-transcription factor I COUP-TFII : chicken ovalbumin upstream promoter-transcription factor II CREB : cAMPc-response element binding protein
CREM : cAMP-response element modulator
CRISPR : clustered regularly interspaced short palindromic repeats Cu : cuivre
CYP11A1 : cytochrome P450, family 11, subfamily A, polypeptide 1 CYP17A1 : cytochrome P450, family 17, subfamily A, polypeptide 1
D
DA : dopamine DAG : diacylglycérol DAG : diacylglycérol
DBD : DNA Binding Domains DCNB : 1,2-dichloro-4-nitrobenzene DHEA : déhydroépiandrostérone DHH : desert hedgehog
DHT : dihydrotestostérone
DNA precipitation : précipitation de l’ADN DR : direct repeat
E
e- : électron
EGF : epidermal growth factor EGR1 : early growth response 1
ELISA : enzyme-linked immunosorbent assay EPAC : exchange proteins acitvated by cAMP EREh : récepteur de l’estrogène
ERK : extra-cellular signal-regulated kinase ERO : espèces réactives de l’oxygène
XX
F
FGF : fibroblast growth factor FGF8 : fibroblast growth factor 8 FLC : cellules de Leydig fœtales FOG2 : friend of GATA
FSH : follicle stimulating hormone FSHR : FSH receptor
Fsk : forskolin
G
G : guanine
GATA2 : GATA binding protein 2 GC : germ cell, cellule germinale GDP : guanosine diphosphate
GHIH : growth hormone inhibiting hormone GHRH : growth hormone releasing hormone GMPc : guanosine monophosphate cyclique GnRH : gonadotropin releasing hormone GPX : glutathion peroxydase GSH : glutathion réduit GSSG : glutathion oxydé GST : glutahtione S-transferase GTP : guanosine triphosphate Gαs : Gα stimulating protein H H+ : ion hydrogène H2O2 : peroxyde d'hydrogène
HAT : histone acétyltransférase
hCG : hormone gonadotropine chorionique HDAC : histone déacétylase
HDL :high density lipoprotein
XXI HepG2 : cellules hépatiques humaines
HES1 : hairy and enhancer of split 1 Hh : hedgehog HMGR : HMG-CoA réductase HMT : histone méthyltransferase HSD17β : 17β-hydroxystéroïde déshydrogénase HSD3α : 3α-hydroxystéroïde déshydrogénase HSD3β : 3β-hydroxystéroïde deshydrogénase HSP : heat shock protein
HxKx : histone Hx, lysine x
I
IGF1 : insulin-like growth factor 1 IL : interleukine
ILC : cellule de Leydig immature
INSERM : institut national de la santé et de la recherche médicale INSL3 : insulin-like 3
IP3 : inositol triphosphate
IP3R : récepteurs à l’IP3 J
JAK/STAT : janus kinase/signal transducer and activator of transcription JDP2 : JUN dimerization protein 2
JNK : C-JUN- N-terminal kinase
K
K : lysine Kb : kilobases
Kd : constante de dissociation
kDa : kiloDalton
KIT : tyrosine-protein kinase KL : kit ligand
L
XXII
LH : luteinizing hormone
LHCGR : lutropin-choriogonadotropic hormone receptor LHR : récepteur à la LH
LHX : LIM/homeobox protein LHX3 : LIM/homeobox protein 3 LHX4 : LIM/homeobox protein 4 LHX9 : LIM/homeobox protein 9 LIF : leukemia inhibitory factor
LIFRα : leukemia inhibitory factor receptor α LPS : lipopolysaccharide
Lys : lysine
M
MA-10 : Mario Ascoli-10
MADS : (MCM1, agamous, deficiens, SRF) MAFK : Maf protein family K
MAPEG : membrane-associated proteins in eicosanoid and glutathione metabolism MAPK : mitogen-activated protein kinase
MAPKK/MEK : mitogen-activated protein kinase kinase MEF2 : myocyte enhancer factor 2
mg : milligramme
MITR : MEF2 interacting transcription repressor mL : millilitre
MLC : cellules de Leydig matures MLTC-1 : murine Leydig tumor cells-1 MSH : melanocyte stimulating hormone
N
NAD : nicotinamide adénine dinucléotide oxydé NADH : nicotinamide adénine dinucléotide réduit
NADP : nicotinamide adénine dinucléotide phosphate oxydé NADPH : nicotinamide adénine dinucléotide phosphate réduit NCAM : neural cell adhesion molecule
XXIII NFAT : nuclear factor of activated T-cells
NR2F1 : nuclear receptor subfamily 2, group F, member 1 NR2F2 : nuclear receptor subfamily 2, group F, member 2 NRF2/NFE2L2 : nuclear factor (erythroid-derived 2)-like 2 O
O2- : anion superoxide
O2 : dioxygène (ou oxygène)
O2·- : radical superoxyde
P
P45017A1 : 17α-hydroxylase
P450SCC : cholesterol side-chain cleavage enzyme PBX1 : pre-B-cell leukemia transcription factor 1 PCR : réaction de polymérisation en chaine
PC3 : lignée cellulaire cancéreuse prostatique humaine PDE : phosphodiestérases
PDGFα : alpha-type platelet-derived growth factor
PDGFRα : alpha-type platelet-derived growth factor receptor PGC : primordial germ cell, cellule germinale primordiale pH : potential hydrogène
PI3K : phosphoinositide 3-kinase PIC : complexe de pré-initiation
PIP2 : phosphatidylinositol-4,5-diphosphate
PIT1 : pituitary-specific positive transcription factor PIT1 : POU domain, class transcription factor 1 PKA : protéine kinase A
PKC : protéine kinase C
PLC : cellule de Leydig progénitrice PLC : phospholipase C
PMA : phorbol 12-myristate 13-acetate PModS : facteur testiculaire paracrine PN : post-natal
XXIV
Pomc : pro-opiomelanocortine PP : phosphatases
PPARα : peroxisome proliferator-activated receptor α PRDX : péroxyrédoxine
PRL : prolactine
PSA : prostate specific antigen PTCH1 : protein patched homolog 1 PTX1 : pituitary homeobox 1
PXR : pregnane X receptor
R
R : A ou G
RCPG : récepteur couplé à une protéine G RCPG : récepteurs couplés aux protéines G RLF : relaxin-like factor
ROS : reactive oxygen species
RXFP2 : relaxin family peptide receptor 2 RyR : récepteurs à la ryanodine
S
S : Sverdberg
SAPK : stress-activated protein kinase Se2- : selenide
Ser : sérine
SF1 : steroidogenic factor 1 SLC : cellule de Leydig souche SMAD : smad family member SNC : système nerveux central SOD : superoxyde dismutase
SOX9 : SRY-box-containing gene 9 SP1 : specificity protein 1
SRBI : scavenger receptors class B type I
XXV Sry : sex determining region Y
STAR : steroidogenic acute regulatory protein
STAT5 : signal transducer and activator of transcription 5 T
T : thymine
TBP : TATA binding protein TDF : testis-determining factor
TDY : testis determining gene on the Y TGFβ : transforming growth factor β Thr : thréonine
TRD : thiorédoxine réductase
TRH : thyreotropin releasing hormone TRX : thiorédoxine
TSPO : translocator protein
U
UVA : ultraviolet A
V
VEGF : vascular endothelial growth factor
W Wnt : winnt WNT5a : winnt 5a WT1 : wilms' tumor 1 Z Zn : zinc
XXVII A celui que j'ai quitté avant tout le monde A Franco Di Luoffo
XXIX
REMERCIEMENTS
Dans un premier temps, je voudrais remercier les membres du jury, Dr Cristian O’Flaherty, Dr Clémence Belleannée, Dr Pierre Leclerc, qui ont acceptés d’évaluer mon travail de doctorat.
Je voudrais également remercier mon superviseur le Dr Jacques J. Tremblay d’une part pour l’évaluation de mon travail de doctorat mais tout particulièrement pour son accueil dans le laboratoire et son soutien permanent dans l’élaboration de mon travail de recherche. Jacques, je voudrais grandement te remercier de m’avoir enseigné ta rigueur, ton dévouement et ta passion pour la recherche. Avec des moments plus ou moins difficiles, j’ai grandement apprécié ta manière d’enseigner ce que tu sais à tes étudiants. J’ai énormément appris de mon passage dans ton laboratoire et ceci me servira dans ma vie future. Tu as su m’éclairer et développer ma curiosité scientifique. Après trois ans et demi dans ton laboratoire, je suis devenu un « maniaque » du Power Point. Ceci est une bonne chose car comme tu le dis très bien : « ta présentation reflète ton précédent travail ». Je voudrais ensuite te dire : merci de m’avoir permis de participer à plusieurs congrès d’envergures régionales et internationales dans lesquels j’ai pris tout doucement ma petite place et m’y sentais à l’aise. Dans le domaine de la recherche, tu resteras un de mes modèles à suivre. Ce fut un plaisir de travailler avec toi… Je pense que tu rappelleras du mot : bolinette (def : un petit bol), le dictionnaire lui-même ne le connait pas.
Ensuite je voudrais remercier tous les membres de mon laboratoire en commençant par les professionnels de recherche. Merci à Catherine Brousseau et Nicholas Robert qui m’ont vraiment aidé pour l’aspect technique dans la réalisation de mon projet de recherche et avec qui j’ai passé des moments géniaux dans le laboratoire. Catherine : merci de m’avoir enseigné des techniques de biologie cellulaire et moléculaire ainsi que pour toutes les discussions, blagues et moments de fou rire. Je pense que McDonald’s nous remercie lui-même. Nicholas : merci pour ton aide dans la réalisation des manipulations scientifiques, de ta patience et de tes conseils éclairés. Je me rappellerai de ton affection pour la France et de ta reprise de répliques cultes comme : « la France », « Paris, Paris outragé ! Paris brisé ! Paris martyrisé ! Mais Paris libéré ! » Charles de Gaulle, ou ton magnifique accent italien quand tu dis : pepperoni, parmigiano ou pomodoro… Merci aux autres membres du
XXX
laboratoire comme Gabriel Garon alias Gabichou, Raifish E. Mendoza alias le petit vénézuélien, Céline Chesseron qui a supporté mes « weich grosse bien ou bien » ou Houssein Salem alias Housseinski qui termine n’importe quelle manipulation en disant : « ça va marcher ». Ces personnes sont devenues d’une part des personnes ressources importantes mais aussi des amis. Je remercie également les autres membres ou anciens membres du laboratoire : Annick Enangue, François Péloquin et Elise Paradis pour leur aide.
Une grand merci à tous les membres de l’équipe du Dr Robert Viger pour leur aide. Robert : merci pour tes remarques, conseils scientifiques, toujours très bons, durant les « lab meeting ». Francis Bergeron, merci de m’avoir appris certaines techniques de laboratoire et surtout à bien « seter le power supply ». Marie-France Bouchard, un grand merci pour ton aide précieuse en biologie moléculaire, tu as toujours été présente pour mes nombreuses questions. Je remercie également Sonia Morisset ainsi que toute l’équipe du Dr Robert Sullivan (Gille Frenette, Christine Légaré, Olivier D’Amour, Akintayo Ayoldele et Clémence Belleannée) pour leur aide.
Je remercie également le groupe du Centre de Recherche en Biologie de la Reproduction (CRBR) et le groupe du Réseau Québécois en Reproduction (RQR) qui m’ont permis de participer à des rencontres scientifiques, présenter mes travaux de recherche et ainsi améliorer ma démarche scientifique. Le sentiment de « famille » qui règne au sein de ces groupes est beau à voir.
Sans oublié un immense, énorme, gigantesque MERCI au Dr Caroline Daems, qui m’a accompagnée, aidée, soutenue, son appui est indescriptible tellement qu’il est grand. La protéine MEF2 est l’un des facteurs de notre rencontre : TATATATATA ma p’tite Caro. Cette expérience québécoise m’a permis de te rencontrer et ton entrée dans ma vie ne l’a rend que plus belle.
Je voudrais également remercier ma famille, particulièrement mes parents et grands-parents qui m’ont soutenu et aidé durant ce doctorat. Un grand merci à mes parents pour tous leurs appels depuis la France et leurs conseils précieux. Un grand merci à ma grand-mère et son
XXXI amie pour toutes leurs pensées pour moi. Merci aux personnes qui sont venues me voir pendant cette aventure : mes parents, mon cousin Damien et mon ami d’enfance Clément. Je dédie cette thèse à mon grand-père paternel : Franco Di Luoffo. Tu étais là à mon départ, j’espère qu’aujourd’hui tu es fier de moi et que le sourire qui te caractérisait, rayonne toujours.
Je remercie également les personnes que j’ai malencontreusement oubliées dans cette énumération.
XXXIII
AVANT-PROPOS
Au cours de mon doctorat, j’ai pu réaliser trois articles en tant que premier auteur. Le premier article est publié dans la revue Biology of Reproduction (BOR, 2015, Chapitre 2 de cette thèse). Le deuxième article est également publié dans la revue Endocrinology (Endocrinology, 2015, Chapitre 3 de cette thèse). Le troisième article a été soumis à la revue Andrology (Andrology, 2015 Chapitre 4 de cette thèse). J’ai aussi participé, comme co-auteur, à deux articles publiés dans les revues : Journal of Molecular Endocrinology (J Mol Endocrinol, 2014) et Endocrinology (Endocrinology, 2015).
Pour le premier article, je l’ai réalisé en co-premier auteur avec le Dr Caroline Daems. Nous avons participé à parts égales dans l’analyse des données de micropuces, la réalisation des expériences, l’analyse des résultats ainsi que la rédaction de l’article. Francis Bergeron a réalisé les expériences d’interférence à l’ARN, récolté les ARN qui ont été traités par la plateforme d’expression génique du Centre de recherche du CHU de Québec (CHUL). Il a aussi réalisé une première analyse des résultats de micropuces à l’aide du logiciel Partek. Le Dr Jacques J. Tremblay a supervisé, relu et corrigé (le fond, la forme et la langue) à tous les stades du cheminement vers la publication de cet article.
Pour le deuxième article, je l’ai réalisé en tant que premier auteur. J’ai accompli la majorité des expériences, l’interprétation des résultats ainsi que la rédaction de l’article. Catherine Brousseau a réalisé certaines confirmations des expériences de micropuces par PCR quantitative. Francis Bergeron a participé à l’analyse des résultats de micropuces dont découle l’idée de cet article. Il a apporté sa contribution scientifique à la réalisation de cet article. Le Dr Jacques J. Tremblay a supervisé, relu et corrigé (le fond, la forme et la langue) à tous les stades du cheminement vers la publication de cet article.
Pour le troisième article, je l’ai réalisé en tant que premier auteur. J’ai accompli la majorité des expériences, l’interprétation des résultats ainsi que la rédaction de l’article. Catherine Brousseau a réalisé la confirmation des expériences de micropuces par PCR quantitative. Le Dr Jacques J. Tremblay a supervisé, relu et corrigé (le fond, la forme et la langue) à tous les stades du cheminement vers la soumission de cet article.
1
1. Chapitre 1 : Introduction
2
1.1. Introduction générale
"La reproduction est le commencement de la mort" (James Joyce : écrivain irlandais du XXème siècle). Entre la reproduction et la mort, il y a la vie. Au cours de cette vie, certains humains cherchent à rendre celle d’autrui meilleure. La recherche scientifique sert à mettre en place des bases et ainsi essayer de comprendre le fonctionnement de la nature. La nature donne à l’organisme vivant un milieu propice pour se nourrir, procréer et donc pérenniser son espèce. Une fois dans un environnement propice, du premier organisme unicellulaire il y a 3,8 milliards d’années, aux plus évolués des organismes pluricellulaires, le but ultime est le même : se reproduire. Contrairement aux premières cyanobactéries « sans vouloir dévaluer leurs connaissances », l’Homme utilise son savoir scientifique et tente de déjouer les problèmes d’in/sous fertilité en gardant toujours en tête ce but ultime. Il reste encore des choses à trouver et donc à chercher afin de régler les problèmes d’infertilité humaine. D’un point de vue mondial, le taux de naissance n’a pas baissé et reste à 2,5 enfants par femme de 2005 à 2012 (http://donnees.banquemondiale.org). Par contre si on prend l’exemple de la France en 2012, environ 21% des couples ne parviennent pas à avoir un enfant après un an de tentatives sans contraception et plus de 10% n'y parviennent toujours pas deux ans après (Bulletin épidémiologique hebdomadaire de l’Institut national de la santé et de la recherche médicale INSERM, 21 février 2012). Au Canada, le taux d’infertilité des couples à presque doublé en 20 ans. Environ 8% des couples hétérosexuels échouaient leurs projets de famille après un an sans contraception en 1992, en 2012 ils sont 16%, révèle une étude de statistique Canada (1). Dans 33% des cas, la cause de l’infertilité du couple est masculine (http://canadiensensante.gc.ca). Dans ces 33%, 50% restent des causes d’in/sous fertilité idiopathiques. Il est donc important d’étudier la régulation des fonctions testiculaires masculines. Il reste encore un nombre important de choses à découvrir, pour essayer non pas de guérir complètement l’in/sous fertilité masculine mais de pouvoir réduire ces chiffres trop élevés.
Régulé en amont par le complexe hypothalamo-hypophysaire, l’appareil reproducteur masculin est composé des organes génitaux externes comme le pénis, le scrotum et les testicules et des organes génitaux internes comme les vésicules séminales, la prostate et l’épididyme. Les testicules sont les organes clés de la synthèse des spermatozoïdes et de la
3 production d’hormones stéroïdiennes. Stimulées par une gonadotropine hypophysaire les cellules de Leydig du testicule réalisent la stéroïdogenèse. Dans les cellules de Leydig, cette synthèse de stéroïdes est activée par diverses voies de signalisation dont celle du calcium et des Ca2+/calmodulin-dependent protein kinases (CAMK) (2). Il est connu d’une part que les facteurs de transcription myocyte enhancer factor 2 (MEF2) sont des effecteurs de la voie du calcium et des CAMK (revue dans 3) et que ces facteurs sont d’importants régulateurs de l’organogenèse et de la différenciation cellulaire dans le muscle et le cerveau (revue dans 4). Très peu de choses sont connues sur leurs rôles dans le testicule. Dans cette thèse, je propose de voir plus en détail les rôles ainsi que l’importance des facteurs MEF2 dans les cellules de Leydig du testicule.
1.2. L’axe hypothalamo-hypophysaire gonadique
Les fonctions reproductives sont sous contrôle du complexe hypothalamo-hypophysaire et des gonades qui elles-mêmes exercent un rétrocontrôle sur ce complexe. Chez l’homme, ce système régulateur ou homéostat de la fonction reproductive permet de moduler la concentration plasmatique de testostérone produite dans les testicules. Le complexe hypothalamo-hypophysaire fait partie du système nerveux central (SNC) et est situé au centre de l’encéphale. Il est constitué de l’hypothalamus et de l’hypophyse qui, en coopération, régulent l’activité des testicules en continue et ceci tout au long de la vie.
1.2.1. L’hypothalamus
La neurulation commence à trois semaines de gestation chez l’humain et est le premier évènement du développement du système nerveux central (5). De là commence le développement de l’hypothalamus à partir de la plaque neurale (5). Ce développement est sous l’influence de nombreuses voies de signalisation dont la voie winnt (Wnt) permettant la régionalisation de l’hypothalamus (6) ainsi que la voie hedgehog (Hh) qui permet la prolifération et la structuration des neurones progéniteurs de l’hypothalamus antérieur (7).
4
Une fois mis en place, il est situé dans la partie centrale du cerveau sous le thalamus, il forme les parois inféro-latérales et le plancher du troisième ventricule (8). L'hypothalamus se compose de trois régions adjacentes : une région périventriculaire, une région médiale et une région latérale (8). C’est une petite structure nerveuse constituée de plusieurs noyaux gris composés eux même de neurones. Les cellules composant l’hypothalamus sont des cellules neurosécrétoires. L’hypothalamus est relié à l’hypophyse par le système vasculaire porte hypothalamo-hypophysaire (9). Il régule, par l’intermédiaire de l’hypophyse, un nombre conséquent de fonctions physiologiques corporelles telles que le système nerveux autonome, la thermorégulation, la faim, le rythme circadien et les fonctions reproductives (7). De plus, il est le « centre intégrateur » de l’organisme. Il répond aux stimuli environnants en sécrétant de façon pulsatile certaines hormones (revues dans (10)).
Parmi ces hormones est retrouvée, la dopamine (DA) qui est le précurseur de l’adrénaline et de la noradrénaline. Un des rôles de cette hormone est d'inhiber la libération de prolactine par le lobe antérieur de l'hypophyse (11). Le phénomène de « frisson » que certaines personnes ont en écoutant « Thriller de Michael Jackson » est dû à une libération de dopamine (12). La somatolibérine ou encore growth hormone releasing hormone (GHRH) favorise quant à elle la libération de l’hormone de croissance ou encore Growth Hormone (GH). Il y a aussi la somatostatine ou encore growth hormone-inhibiting hormone (GHIH) qui elle, a un rôle inverse et inhibe la sécrétion de l’hormone de croissance (13). L’hormone thyréotrope hypothalamique ou encore thyrotropin releasing hormone (TRH) contrôle la sécrétion de la thyréostimuline ou encore thyroid-stimulating hormone (TSH) de l’hypophyse antérieure. La corticolibérine est un neurotransmetteur produit par l’hypothalamus, qui agit sur l’hypophyse et induire la libération de l’hormone corticotrope (ACTH).
Pour finir l’hypothalamus génère de façon pulsatile la gonadolibérine ou encore gonadotropin releasing hormone (GnRH) qui est responsable de la libération de deux hormones par l’antéhypophyse : l’hormone lutéinisante ou encore luteinizing hormone (LH) et l’hormone folliculo-stimulante ou encore follicle-stimulating hormone (FSH). Ces deux hormones agissent sur le testicule. La synthèse de GnRH est soumise à un
5 rétrocontrôle positif et négatif (en fonction du taux de testostérone plasmatique) qui régule les pics de GnRH envoyés par l’hypothalamus à l’hypophyse (revue dans 14).
1.2.2. L’hypophyse
L’hypophyse ou glande pituitaire est une glande endocrine qui se situe dans l’os sphénoïde à la base de la cavité crânienne. L’hypophyse se développe à la troisième semaine de gestation chez l’humain et au jour embryonnaire 8 (E8) chez les rongeurs. Le développement embryonnaire de la glande hypophysaire s'effectue sous l'induction et le contrôle de facteurs diffusibles comme bone morphogenetic protein 4 (BMP4), fibroblast growth factor 8 (FGF8), winnt 5a (WNT5a) et de facteurs de transcription hypophysaires (LIM/homeobox protein (LHX3), LIM/homeobox protein (LHX4), POU domain, class transcription factor 1 (PIT1), GATA binding protein 2 (GATA2) et steroidogenic factor 1 (SF1)) (15). Plus en détails, les molécules de signalisation BMP4, FGF8 et WNT5a, provenant du neuroépithelium dorsal, sont indispensables à l’initiation de la formation de la glande hypophysaire (16). En ce qui concerne les facteurs de transcription hypophysaires, LHX3 et LHX4, ce sont des facteurs redondants et indispensables au développement de la poche hypophysaire. En effet, le développement de l'hypophyse s'arrête au stade de la poche rudimentaire chez les souris portant la double invalidation génique : Lhx3-/- et Lhx4 -/-(17).
Une fois développée, l’hypophyse est divisée en trois parties bien différenciées :
- Une partie antérieure : l’antéhypophyse ou hypophyse glandulaire qui est formée de cellules endocrines dérivant de l'ectoderme de surface.
- Une partie intermédiaire : le lobe intermédiaire qui est présent chez de nombreuses espèces. Chez l’humain, il est présent au stade du développement embryonnaire et régresse à quinze ans pour laisser place à une zone intermédiaire (zone cystiforme). Cette zone contient de petits kystes revêtus de cellules épithéliales et quelques cellules glandulaires résiduelles.
6
- Une partie postérieure : la posthypophyse ou neurohypophyse recevant les terminaisons nerveuses neurosécrétrices des neurones hypothalamiques. Cette partie dérive du neuroectoderme et contient quelques cellules glandulaires. De plus, l’hypophyse est reliée à l’hypothalamus par ce que qui est appelé la tige hypophysaire ou tige pituitaire. L’hypothalamus est le « centre intégrateur » tandis que l’hypophyse est le « chef d’orchestre » de l’organisme. L’hypophyse répond donc aux stimuli de son homologue glandulaire « supérieur » en sécrétant différentes hormones. La région posthypophyse sert surtout à l’intégration des signaux hypothalamiques. Elle synthétise également la vasopressine ou encore antidiuretic hormone (ADH) qui agit sur le contrôle de la diurèse rénale (revue dans 18), l’ocytocine agissant chez la femme sur le contrôle de la contraction du muscle lisse utérin ainsi que la lactation (19). La zone intermédiaire libère l’hormone mélanotrope ou encore melanocyte stimulating hormone (MSH) qui est responsable de la synthèse de mélanine par les mélanocytes de la peau en réponse aux ultraviolets A (UVA) (20).
L’antéhypophyse, sous contrôle de l’hypothalamus, est indispensable au contrôle de nombreuses fonctions physiologiques. Cette région est composée de cinq variétés de cellules hormonogènes.
Les cellules corticotropes synthétisent un précurseur qui une fois clivé donnera l’hormone corticotrope. Cette ACTH se fixe aux récepteurs membranaires de la glande corticosurrénale et agit sur la synthèse des glucocorticoïdes et minéralocorticoïdes (revue dans 21). Les cellules thyrotropes sécrètent la thyréostimuline (TSH) qui agit sur la sécrétion d’hormones thyroïdiennes (22). Les cellules somatotropes sécrètent l’hormone de croissance (GH) qui a un rôle sur le rythme circadien en stimulant les phases de sommeil (revue dans 23) et sur le métabolisme (revue dans 24). Les cellules lactotropes sécrétent la prolactine ou encore prolactin (PRL) qui, chez la femelle, a des effets mammotrope, lactogénique et un impact sur le cycle menstruel (25). Chez le mâle, la prolactinémie a un impact direct sur la sécrétion de gonadotropines (LH et FSH) et aussi sur l’expression des récepteurs à la LH à la surface des cellules de Leydig du testicule (26). Pour finir, les cellules gonadotropes qui sécrètent la LH et la FSH. Les cellules gonadotropes
7 hypophysaires par l’intermédiaire des hormones qu’elles sécrètent sont indispensables au développement et au bon fonctionnement du système reproducteur.
1.2.2.1. Les cellules gonadotropes hypophysaires
Les cellules gonadotropes de l’hypophyse représentent 10 à 15% de la population de cellules hypophysaires. Durant le développement embryonnaire des mammifères, les cellules gonadotropes se développent et se différencient par l’expression de divers facteurs de transcription exprimés dans un compartiment cellulaire donné et à un temps donné (16). La différenciation des cellules gonadotropes est due à un gradient de bone morphogenetic protein 2 (BMP2). Chez la souris, ce gradient va permettre l’expression de facteurs importants comme GATA2 au jour embryonnaire 10,5 ou encore inhiber l’expression d’un facteur important à la différenciation des cellules anté-hypophysaires, PIT1 (27).
Le rôle majeur des cellules gonadotropes est de produire la LH et la FSH. Chez l’humain, l’origine de ces deux hormones a été controversée dans les années 70. En 1973, le monde scientifique était d’accord d’affirmer que : « toutes les cellules gonadotropes produisent la LH et la FSH » (28). La dualité de synthèse de ces hormones a été remise en cause trois ans plus tard. En 1976, il a été montré que 90% des cellules gonadotropes produisent les deux hormones mais 10% ne produisent que la FSH (29). Le résultat précédent de l’équipe du Dr Phifer (28) était dû à une mauvaise spécificité de l’anticorps utilisé. Chez la souris, l’expression du gène codant pour la sous-unité α, commune à la LH et la FSH, commence au jour embryonnaire 10,5. Le gène codant pour la sous-unité β de la LH commence au jour embryonnaire 16,5 tandis que la sous-unité β de la FSH est exprimée au jour embryonnaire 17,5 (revue dans 30). Cela traduit une expression différentielle dans le temps des deux gonadotropines, en vue du développement des organes reproducteurs.
De nombreux facteurs de transcription sont nécessaires à la synthèse des deux gonadotropines. Pour ne citer que certains, chez la souris, le facteur pituitary homeobox 1 (PTX1) est exprimé du jour embryonnaire 9,5 jusqu’à l’âge adulte et active un nombre conséquent de gènes impliqués dans le développement ces cellules anté-hypophysaires. Ce facteur active l’expression des gènes codant pour la sous unités α et des sous unités β de la
8
LH et de la FSH (31) (revue dans 30). Les facteurs pLIM et LHX3 sont aussi présents au jour embryonnaire 9,5 et activent la synthèse de la sous-unité α commune de la LH et de la FSH. Le facteur de transcription SF1 est aussi important pour la différenciation des cellules gonadotropes en activant en coopération avec PTX1, la transcription du gène codant pour la sous-unité β de la LH (31). Il est connu que ces facteurs sont sous contrôle de la sécrétion de la GnRH hypothalamique. La GnRH transite par la circulation porte hypothalamique et se fixe aux récepteurs (GnRHR) à la surface des cellules gonadotropes hypophysaires. La fixation de cette hormone induit la synthèse de LH et FSH (32).
1.2.2.2. Les gonadotropines hypophysaires
Ces deux hormones LH et FSH sont comme, cité précédemment, produites par les cellules gonadotropes de l’antéhypophyse et sous contrôle de la sécrétion pulsatile de GnRH par l’hypothalamus qui détermine le rapport de FSH/LH sécrétées. Ces deux hormones sont des hormones peptidiques (glycoprotéines) se composant de deux chaines α et β. Ces chaines sont très semblables entre LH, FSH, TSH et l’hormone human chorionic gonadotropin (hCG). La sous-unité α est commune pour ces quatre hormones. La sous-unité β donne, quant à elle, la spécificité de liaison de l’hormone à son récepteur (33). Chacune des sous-unités est porteuse d'une partie glucidique qui garantit leur stabilité dans le plasma et permet l’action hormonale. La variabilité importante de la partie glucidique, mais aussi du niveau de modifications post traductionnelles des gonadotropines, sont responsables de la grande hétérogénéité des formes circulantes. De plus, LH et FSH jouent des rôles différents sur l’appareil reproducteur et ces rôles varient en fonction du sexe.
1.2.2.2.1. La FSH
La FSH a été découverte en 1931 par trois scientifiques : Fevold, Hisaw et Leodard (34) (revue dans 35). Chez l’homme, la FSH agit principalement sur les cellules de Sertoli. Effectivement, avec la testostérone, la FSH stimule la spermatogenèse. Les cellules de Sertoli répondent à la stimulation par la FSH en synthétisant de l’androgen binding protein (ABP) et de l’inhibine β. L’ABP se fixe à la testostérone et à la dihydrotestostérone (DHT) et les rend moins lipophile pour qu’elles restent concentrées dans le fluide luminal des
9 tubes séminifères et donc favoriser la spermatogenèse (36). L’inhibine β permet la diminution de la synthèse de FSH (revue dans 37) ainsi que par l’intermédiaire de la production de LH, favoriser la production d’hormones stéroïdiennes par les cellules de Leydig du testicule (38). Une fois fixée à son récepteur spécifique, la FSH active des voies de signalisation intracellulaires. Le récepteur à la FSH est un récepteur membranaire appartenant à la grande famille des récepteurs couplés aux protéines G (RCPG) (39). Les récepteurs de la TSH et de la LH font aussi partie de la grande famille des RCPG (40). Les mécanismes d’action du récepteur à la LH seront vus en détails dans la partie 1.3.4.4.1. Le récepteur à la LH.
1.2.2.2.2. La LH
Tout comme la FSH, la LH a été découverte par le trio de chercheurs Fevold, Hisaw et Leodard (34) (revue dans 35). Cette hormone est une glycoprotéine comprenant une sous-unité α et une sous-sous-unité β. La sous-sous-unité α est commune à la LH, FSH, TSH et hCG. Une fois associée à la sous-unité α, la sous-unité β est responsable de la spécificité de l'activité de l'hormone (41). Le contrôle de la synthèse de la LH se fait principalement par la régulation de l’expression du gène qui code pour sa sous-unité β. Chez l’homme, la LH agit sur la sécrétion d’hormones stéroïdiennes par les cellules de Leydig. Ces hormones permettent le développement des caractéristiques sexuelles primaires et secondaires (revue dans 42). La testostérone circulante agit sur la sécrétion de GnRH par l’hypothalamus, afin de contrôler la sécrétion de LH (rétro-contrôle négatif) (43,44)
La synthèse de LH est sous le contrôle de la GnRH hypothalamique et la pulsatilité de la GnRH est un facteur important de la régulation de la sécrétion de LH. Une augmentation des pulsations de GnRH permet une augmentation de la transcription du gène Lhβ, codant pour la sous-unité β de la LH (45,46). De plus, l’absence de pulsatilité de GnRH mimée par l’administration d’un agoniste, diminue le niveau d’expression du gène Lhβ mais pas le niveau d’expression du gène codant pour la sous-unité α (47).
Il existe au moins trois facteurs de transcription qui sont connus pour réguler de manière importante l’expression du gène Lhβ : early growth response 1 (EGR1), SF1 et PTX1. Le
10
premier d’entre eux, le facteur EGR1 est également nommé NGFI-A, KROX-24, ou ZIF268. C’est une protéine en doigt de zinc qui fait partie de la famille des C2H2. EGR1 se lie à une séquence d’acide désoxyribonucléique (ADN) riche en guanine et cytosine (GC) : GCG(G/T)GGGCG (48,49). Chez la souris, la sécrétion de GnRH stimule la transcription du gène Egr1, ce qui permet, après sa traduction, la fixation de ce facteur sur le promoteur proximal du gène Lhβ (48,50,51). De plus, les souris mâles ou femelles Egr1-/- présentent d’une part, des problèmes de développement mais aussi des problèmes de stérilité dus à des dysfonctions de l’hypophyse ou des ovaires chez les femelles (49,52). Chez la souris, même si les autres facteurs gonadotropiques sont présents, l’invalidation du gène Egr1 diminue le niveau d’expression du gène Lhβ (49,52). Ces données montrent que le facteur de transcription EGR1 est impliqué dans le développement des cellules gonadotropes en plus d’être impliqué dans l’expression de la sous-unité β de la LH.
Le deuxième facteur SF1, seul ou en coopération avec EGR1, est connu pour être un régulateur clé de la transcription de la sous-unité β de la LH (49,51,53-55). Une fois lié à son site spécifique sur le promoteur proximal du gène Lhβ, le facteur ERG1 ne stimule pas l’activité promotrice de Lhβ (54). Par contre, la coopération de ERG1 et SF1 augmente de manière synergique l’activité promotrice du gène Lhβ (54).
L’autre facteur de transcription, connu pour agir avec ERG1 et SF1 et réguler la transcription de la sous-unité β de la LH, est PTX1 (31,55,56). Ce facteur de transcription à homéodomaine a été premièrement identifié dans les cellules corticotropes, comme régulateur de l’expression du gène Pomc codant pour la pro-opiomelanocortine qui est le précurseur de l’ACTH (57). La présence de PTX1 a été identifiée dans toutes les cellules de l’hypophyse et impliquée dans l’activation de nombreux gènes codants pour les différentes hormones hypophysaires dont le gène Lhβ (31). PTX1 est connu pour agir de manière synergique avec SF1 et PIT1 afin d’activer l’expression des gènes impliqués dans la différenciation des cellules gonadotropes (57,58). De plus, spécifiquement dans des cellules gonadotropes, la fixation de la GnRH induit la transcription de EGR1 qui interagit directement avec SF1 et PTX1 et à eux trois activent la transcription de la sous-unité β de la LH (51).
11 Il a aussi été montré que les facteurs CREB binding protein (CBP), GATA, et même d’autres facteurs de transcription induits par des pulsations de GnRH comme FOS ou C-JUN sont également fortement impliqués dans la régulation de la transcription du gène Lhβ par les cellules gonadotropes (59-61).
LH et FSH sont nécessaires au bon fonctionnement du système reproducteur. Elles nous font voyager, par l’intermédiaire de la circulation sanguine, du cerveau jusqu’en dessous de la ceinture.
Là où tout commence… 1.3. L’appareil reproducteur masculin
L’appareil (ou système) reproducteur (ou génital) est un système biologique constitué de l’ensemble des organes anatomiques dédiés à des fins de reproduction. Chez les organismes sexués, les organes génitaux permettent la réalisation des fonctions reproductives telles que l’insémination, la fécondation et chez les vertébrés supérieurs la gestation et la parturition. L’appareil génital, chez l’humain, est centré sur les gonades, qui produisent les gamètes (ou cellules sexuelles). Ce sont, respectivement, les ovaires chez la femme et les testicules chez l’homme qui permettent la production de ces gamètes.
Dans cette partie, je présenterai la constitution, les fonctions et la régulation de l’appareil reproducteur masculin.
1.3.1. Constitution
L’appareil reproducteur masculin est formé par :
- Le pénis (ou la verge) est un organe permettant, au mâle, de copuler (fonction reproductive) et permettant la miction (fonction urinaire). Il est constitué du prépuce, du gland et de corps caverneux qui se remplissent de sang.
- La prostate est une glande qui a pour rôle physiologique de produire 10% à 30% du liquide séminal. Ce liquide est riche en fructose et acide ascorbique
12
permettant de nourrir les spermatozoïdes. Il possède également un pH alcalin, créant un milieu favorable pour les spermatozoïdes dans l’environnement normalement acide. C'est à l'intérieur de la prostate que se fait la jonction entre l'urètre venant de la vessie et les canaux éjaculateurs. Elle sécrète également une glycoprotéine nommée prostate specific antigen (PSA) qui est dosée pour détecter un éventuel cas de cancer de la prostate.
- Les vésicules séminales sont des glandes reliées à la prostate. Elles produisent entre 70% et 90% du liquide séminal, qui est déversé dans les canaux déférents spermatiques.
- Les glandes de Cowper, nommées également les glandes para-urétrales ou les glandes bulbo-urétrales, jouent un rôle dans la défense immunitaire de l'appareil génito-urinaires, dans la fertilité (62). La cyprine qu’elles sécrètent permet de neutraliser l’acidité de l’urètre, rendant l’environnement favorable au passage du sperme (62).
- L’épididyme est un organe tubulaire accolé au testicule. Il recueille et emmagasine les spermatozoïdes venant des tubes séminifères des testicules. Il a un rôle de transport, de stockage et de maturation des spermatozoïdes. Il n’est pas un simple conduit mais assure des fonctions glandulaires complexes et est sous contrôle du système hormonal endocrinien (revue dans 63).
- Les testicules sont les gonades de l’appareil reproducteur mâle. Chez l’homme, ce sont des organes externes, pairs et symétriques situés dans le scrotum afin d’être à une température de 2°C inférieure à celle de l’organisme (64). Ceci permet un meilleur déroulement de la spermatogenèse (65). Ils sont formés de deux compartiments : les tubes séminifères et l’espace interstitiel. Leurs principaux rôles sont la stéroïdogenèse (production d’hormones stéroïdiennes) et la spermatogenèse.
Comme mon travail de doctorat porte sur la régulation des cellules de Leydig du testicule, je décrirai en détail cet organe dans les parties suivantes.
13 1.3.2. Le développement testiculaire
Chez les mammifères, le déterminisme sexuel est un processus qui demande l’intervention d’un réseau important de signaux cellulaires et hormonaux aboutissant au développement du phénotype mâle ou femelle. Au début du développement embryonnaire, les gonades mâles et femelles sont formées à partir de l’épithélium cœlomique. Au stade de la quatrième semaine de grossesse chez l’humain (jour embryonnaire 10,5 chez la souris), les gonades indifférenciées se forment. A ce stade, deux types de canaux sont présents chez l’embryon : les canaux de Wolff et les canaux Müller. Pour un individu de sexe génétique XX, les canaux de Wolff dégénèreront tandis que les canaux de Müller permettront le développement du système reproducteur féminin. En outre, il a été montré en 1991 par (66) que la seule présence du chromosome Y détermine le sexe du futur individu en initiant le développement du testicule au lieu du développement de l’ovaire. Il est connu depuis longtemps que le chromosome Y détermine le sexe masculin. Cependant, c’est dans les années 90 qu’a été découverte une région spécifique du chromosome Y qui initie le développement de l’appareil génital mâle (67). C’est le gène sex determining region Y gene (Sry) qui est responsable du développement mâle. Ce gène est présent sur le bras court du chromosome Y. Chez l’humain, c’est une région de 35 kilobases (kb) codant pour un facteur de transcription (sex-determining region Y protein, testis-determining factor (TDF) ou testis determining gene on the Y (TDY) chez la souris (66,67)). Les transcrits de ce gène sont présents chez la souris au jour embryonnaire 10,5, leur niveau d’expression est maximal au jour embryonnaire 11,5 et diminue progressivement pour ne plus être détectables 24 heures plus tard (68). Le gène Sry code pour un facteur de transcription contenant une high mobility group box (boite HMG) qui permet la liaison à une séquence d’ADN consensus AACAAT et induit un repliement de l’ADN à 90° (69,70). Chez le porc, il a été montré que le facteur de transcription GATA4, collaborant avec son partenaire friend of GATA (FOG2), se fixe directement au promoteur du gène Sry (71). Chez la souris, le facteur Wilms' tumor 1 (WT1) est connu pour être un important régulateur du gène Sry et du gène Amh (72). De plus chez cette espèce, la coopération de GATA4 et WT1 permet l’activation de la transcription du gène Sry. L’activation maximale du promoteur de Sry est dépendante des sites de fixation de WT1 (GCGTGGGAGT) et non pas des éléments GATA4 (73). Cependant, la configuration en doigts de zinc de GATA4 dans sa région
C-14
terminale est nécessaire à la fixation de WT1 sur ses sites spécifiques (72). L’action synergique de WT1 et GATA4 est aussi retrouvée pour l’activation du promoteur du gène codant pour l’AMH. L’isoforme WT1+KTS (Lys-Thr-Ser) permet la régulation transcriptionnelle et post-transcriptionnelle du gène Sry (74). Une fois transcrit/traduit le gène Sry, va donner les protéines TDF (humain) ou TDY (souris). Cette protéine agira sur la transcription d’autres gènes spécifiques au développement de l’appareil génital masculin. Dans la littérature, il est mentionné que TDF ou TDY ont très peu de gènes cibles connus mais leurs rôles seraient d’activer un ou des gène(s) cible(s) important(s) pour la formation du testicule et pour la différenciation masculine. Il a été identifié chez la souris, des sites de liaisons pour TDY dans plusieurs promoteurs dont le promoteur du gène sex determining region Y-box (Sox9) (75). Le facteur de transcription SOX9, est retrouvé chez la souris au jour embryonnaire 11,5 et permet la différenciation vers l’appareil reproducteur mâle (76). Les souris Sox9-/- ont un problème de développement dans l’expression des marqueurs des cellules de Sertoli et dans le développement du cordon testiculaire qui est le précurseur des filets nerveux et des vaisseaux sanguins alimentant le testicule, ainsi que le canal déférent qu’empruntent les spermatozoïdes en direction de la vésicule séminale (76) (revue dans 77).
L’expression de ces gènes mène, entre autres, à la différenciation des cellules de Sertoli qui se polarisent et s’agrègent autour des cellules germinales (apparues à E10,5) et permettre la réorganisation du testicule en deux parties : les tubes séminifères et l’espace interstitiel à E11,5 chez la souris. Au jour embryonnaire 12,5, les cellules de Leydig fœtales commencent à se différencier. Ceci sera vu plus en détail dans la partie 1.3.3.2.3 Les cellules de Leydig. Les cellules de Leydig et Sertoli communiquent. Pour se faire, les cellules de Sertoli synthétisent des molécules de signalisation telles que desert hedgehog (DHH) et platelet-derived growth factor (PDGFα) qui se fixent aux récepteurs transmembranaires protein patched homolog 1 (PTCH1) et platelet-derived growth factor receptor (PDGFRα) présents sur les cellules de Leydig (78-80) (revue dans 81). DHH sert aussi au développement du cordon testiculaire (82). En réponse aux cellules de Sertoli, les cellules de Leydig fœtales produisent l’activine A qui elle-même agit sur les cellules de Sertoli en activant leur prolifération (83). Ces cellules interagissent donc entre elles pour permettre une bonne formation et par la suite le bon fonctionnement du testicule. Vient
15 ensuite le tour, d’autres hormones importantes comme insulin-like 3 (INSL3) et par la suite la testostérone, qui permettent la descente testiculaire dans le scrotum. Le testicule est, une fois formé, constitué de différents compartiments.
1.3.3. Composition du testicule
Les testicules se situent dans le scrotum. Chaque testicule est directement entouré d’un tissus conjonctif solide et protecteur appelé l’albuginée. A l’intérieur de cette enveloppe, le testicule humain est formé de 200 à 300 lobules testiculaires contenant les tubes séminifères. Ces tubes séminifères sont entourés par l’espace interstitiel (Figure 1.1).
1.3.3.1. Les tubes séminifères
Chez l’homme, chaque lobule testiculaire comprend 1 à 4 tubes séminifères. Les tubes séminifères font de 150 à 300 µm de diamètre. Ils se rejoignent, deux par deux, dans un tube qui débouche dans le rete testis. Celui-ci se prolonge dans les canaux efférents et se jettent dans le canal épididymaire. Les tubes séminifères sont composés des cellules de Sertoli et des cellules germinales en cours de développement et entourés par les cellules péritubulaires.
1.3.3.1.1. Les cellules péritubulaires
Chez toutes les espèces, la morphologie des cellules péritubulaires est très semblable. Cette morphologie est intermédiaire entre celle d'un fibroblaste et celle d'une cellule myoïde. Chez les rongeurs, les cellules péritubulaires forment une couche continue de cellules allongées (84). Chez l’homme, il existe 2 à 5 couches de cellules myoïdes étoilées et extrêmement plates. Ces couches sont séparées par une matrice extracellulaire contenant du collagène, des fibres d'élastine et de microfibrilles (85). Les cellules péritubulaires sont d’origine mésenchymateuse. Très tôt dans le développement embryonnaire, les cellules mésenchymateuses progénitrices se transforment progressivement en cellules péritubulaires (86,87). Elles servent de cellules structurales du tube séminifère, permettent la contractilité
16
du tube (88) et permettent la différenciation ainsi que le maintien des fonctions des cellules de Sertoli avoisinantes (89).
1.3.3.1.2. Les cellules de Sertoli
Sous l’influence de TDF chez l’humain ou TDY chez la souris, les cellules pré-Sertoliennes sont les premières cellules du testicule à se différencier. Chez le fœtus, ces cellules se différencient avant même la formation des tubes séminifères (90). Elles ressemblent à des cellules épithéliales avec un noyau globulaire lisse et un cytosol clair et abondant. Les cellules de Sertoli sont des grandes cellules somatiques de soutien. Leur pôle basal est en contact direct avec les cellules péritubulaires. Leur pôle latéral est en contact avec le pôle latéral d’autres cellules de Sertoli. Elles sont reliées entre elles par des jonctions serrées. Le pôle apical est en contact avec les cellules germinales en cours de développement. Il a été montré que l’efficacité de la spermatogenèse chez l’adulte est en relation directe avec le nombre de cellules de Sertoli (91).
Ces cellules possèdent deux rôles majeurs essentiels au bon fonctionnement du testicule. Le premier rôle des cellules de Sertoli est la synthèse de nombreuses glycoprotéines dont la clusterine (92) et l’androgen binding protein (ABP) (93), l’activateur du plasminogène (94), la transferrine (95) et la céruloplasmine (96). Ces facteurs permettent la survie des cellules de Sertoli ainsi que la concentration de la testostérone à un endroit donné. Les cellules de Sertoli produisent aussi trois hormones qui jouent un rôle majeur sur le développement ou les fonctions testiculaires et ceci par leurs actions de type endocrine, autocrine ou paracrine. Ces trois hormones font partie de la famille du transforming growth factor β (TGFβ). La première hormone est l’AMH qui permet la régression des canaux de Müller, chez les individus XY. L'AMH est produite essentiellement par les cellules de Sertoli fœtales immatures (68). Les cellules de Sertoli adultes synthétisent, quant à elles, les deux autres hormones de la famille du TGFβ : les inhibines et les activines.
- Les inhibines sont formées de deux sous unités α et β. Trois gènes codent pour ces deux sous unités : inhα pour la sous-unité α et inhβA et βB pour la sous unité β. Dans le testicule de souris, les trois sous-unités sont principalement
17 exprimées par les cellules de Sertoli et de manière croissante de la puberté à l’âge adulte. Les niveaux d’expression de ces trois sous-unités sont faibles avant la puberté (97). La propriété essentielle de l'inhibine, celle qui lui a donné son nom, est sa capacité d'inhiber la synthèse de la FSH hypophysaire (98). L'existence d'un inhibiteur non stéroïdien de la sécrétion de FSH, provenant du testicule, avait été décrite par le Dr McCullagh en 1932 (revue dans 99), mais il fallut attendre 1982 pour localiser de façon indiscutable sa production par les cellules de Sertoli (100). L'action de l'inhibine sur la sécrétion de FSH hypophysaire exige au moins 24 heures, et passe en partie par la déstabilisation de son messager (101). Outre son effet endocrine, les inhibines potentialisent l'effet de la LH sur la production d'androgènes (102) et exercent d'autres effets paracrines sur les cellules de Leydig ou autocrines. La sécrétion des inhibines est principalement régulée par la FSH agissant par l’intermédiaire des récepteurs membranaires des cellules de Sertoli.
- Les activines sont formées par des dimères de sous-unités β des inhibines. Il existe trois formes d’activines : deux formes homodimériques A (βA, βA), B (βB, βB) et une forme hétérodimérique AB (βA, βB) (revue dans 103). Les activines sont synthétisées par les cellules de Sertoli (104) mais aussi par les cellules de Leydig (105). De plus, leurs récepteurs sont retrouvés sur les cellules germinales, à des stades spécifiques de leur maturation, sur les cellules de l’espace interstitiel (macrophages, vaisseaux sanguins et les cellules de Leydig) ainsi que dans l’hypophyse (106). Les activines possèdent une activité biologique opposée à celle des inhibines ; elles stimulent, en particulier, la sécrétion de GnRH par l’hypothalamus qui elle-même stimule la production de LH et FSH par l'hypophyse. A contrario, les activines inhibent la sécrétion basale d'hormone de croissance et d'ACTH (revue dans 107). Elles ont aussi des effets paracrines au niveau du testicule car la sécrétion d’activines par les cellules de Leydig fœtales permet la prolifération des cellules de Sertoli (83). Le facteur central de la régulation par les membres de la famille du TGFβ est le gène smad family member 4 (Smad4). Des souris mâles ayant subi une invalidation conditionnelle de Smad4-/- ou activin βA-/-, ont des problèmes