Synthèse et caractérisation des matériaux
nano-structurés et leur mise en œuvre comme
photo-catalyseurs pour la dégradation du glyphosate en
milieu aqueux
Mémoire
Mabrouk Feriani
Maîtrise en sols et environnement
Maître ès sciences (M. Sc.)Québec, Canada
Synthèse et caractérisation des matériaux
nano-structurés et leur mise en œuvre comme
photo-catalyseurs pour la dégradation du glyphosate en
milieu aqueux
Mémoire
Mabrouk Feriani
Sous la direction de :
Safia Hamoudi, directrice de recherche
Khaled Belkacemi, codirecteur de recherche
Résumé
L’utilisation des pesticides n’a cessé d’augmenter en particulier le glyphosate, herbicide utilisé principalement dans l’agriculture. Ses effets ont été démontrés néfastes sur l’environnement et sur la santé humaine. Bien que la plupart du glyphosate résiduel soit adsorbé par les constituants du sol, une partie peut être désorbée ou atteindre les eaux de surface par érosion. Le renforcement des normes de qualité de l'eau en milieu agricole et urbain entraîne le développement de nouveaux procédés. Les photocatalyseurs à base de TiO2 peuvent procurer une solution attrayante pour l’élimination de cet herbicide. Actif
uniquement dans le domaine de l’UV qui représente 4% du rayonnement solaire, étendre cette réactivité photocatalytique dans le domaine du visible est un enjeu majeur. Le dopage du TiO2 à l’azote et au graphène a permis une élimination totale du glyphosate au bout de
30 minutes. Après sa synthèse, le photocatalyseur GR-N/TiO2 a été caractérisé par
différentes techniques à savoir la diffraction des rayons X (DRX), l’infrarouge à transformée de Fourier (FTIR), la spectroscopie de photoélectrons X (XPS) et la microscopie électronique par transmission (TEM). L'activité photocatalytique est testée sur la dégradation du glyphosate sous irradiation de la lumière visible. Les résultats montrent que le composite GR-N/TiO2 peut effectivement photodégrader le glyphosate grâce à une
amélioration impressionnante de l’activité photocatalytique due à une grande adsorption du glyphosate sur le nanomatériau synthétisé et à l’extension de l'absorption au domaine du visible.
Abstract
Pesticide use has been increasing especially for glyphosate an herbicide used mainly in agriculture. Its effects have been proven harmful to the environment and human health. Although most of the residual glyphosate can be adsorbed by the soil constituents, a part may be desorbed or reach surface waters by erosion. Strengthening the quality standards of water in agricultural and urban areas leads to the development of new processes. TiO2
-based photocatalysts can provide an attractive solution for the elimination of this herbicide. Active under UV light which represents only 4% of solar radiation, extending this photocatalytic activity to the visible range is a major issue. Doping TiO2 with nitrogen and
graphene shows a total elimination of glyphosate within 30 minutes of reaction. The photocatalyst GR-N/TiO2 was characterized by various techniques namely X-ray
diffraction (XRD), infrared Fourier transform (FTIR), X-ray photoelectron spectroscopy (XPS) and transmission electron microscopy (TEM). The photocatalytic activity was tested under visible light irradiation to glyphosate degradation. Results showed that the GR-N/TiO2 composite can effectively photodegrade glyphosate with an impressive
improvement of the photocatalytic activity due to a large adsorption of glyphosate on the synthesized nanomaterial and the extension of the absorption to the visible light region conferred to photocatalyst.
Table des matières
Résumé ... iii
Abstract... iv
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations ... ix
Remerciements ... x
Introduction ... 1
Chapitre 1 : Synthèse bibliographique ... 4
I. Les pesticides ... 4
I.1. Le glyphosate ...5
I.2. Impact du glyphosate ...5
I.2.1. Impact sur la santé humaine ... 6
I.2.2. Impact sur l’environnement ... 6
I.3. Transfert du glyphosate : du sol à l’eau ...7
I.3.1. L’adsorption ... 8
I.3.2. La désorption ... 10
I.3.3. La dégradation ... 11
I.3.4. La dissipation ... 12
II. La dégradation du glyphosate dans les eaux de surface ... 14
II.1. La dégradation biologique ... 14
II.2. La dégradation chimique ... 14
II.3. La photodégradation ... 15
III. Les méthodes d’élimination du glyphosate dans les eaux de surface ... 16
III.1. Hydrolyse chimique ... 16
III.2. Coagulation- floculation-filtration ... 16
III.3. Chloration ... 17
III.4. Procédés d’oxydation avancés (AOPs) ... 17
Ozonation couplée ... 17
IV. Les photocatalyseurs appliqués à la dégradation des polluants organiques ... 20
IV.1. Les photocatalyseurs à base de TiO2 ... 20
Chapitre 2 : Hypothèse et objectifs ... 26
Chapitre 3 : Matériels et méthodes ... 27
I. Méthodologie... 27
II. Synthèse des matériaux ... 27
II.1. Le graphène ... 27
II.2. Synthèse du nanomatériau à base de TiO2 dopé à l’urée (N/TiO2) ... 28
II.3. Synthèse des matériaux à base de TiO2 dopé avec l’urée sur support de graphène (GR-N/TiO2) 29 III. Caractérisation des matériaux synthétisés ... 30
III.1. Diffraction des rayons X ... 30
III.2. Caractérisation par spectroscopie UV-visible ... 30
III.3. Détermination de la surface spécifique (méthode BET) ... 31
III.4. Analyse structurale - spectroscopie de vibration IR (FTIR) ... 31
III.5. Caractérisation par spectrométrie de photoélectrons induits par rayons X (XPS) ... 32
III.6. Caractérisation par microscopie électronique à transmission (MET) ... 33
IV. Évaluation de la réactivité du photocatalyseur GR-N/TiO2 ... 33
Chapitre 4 : Résultats et discussions ... 36
I. Caractérisation des nanomatériaux synthétisés ... 36
I.1. Caractérisation par DRX ... 36
I.2. Caractérisation par UV-visible ... 37
I.3. Caractérisation par BET ... 38
I.4. Caractérisation par infrarouge à transformée de Fourier (FTIR) ... 41
I.5. Caractérisation par XPS ... 42
I.6. Caractérisation par MET ... 48
II. Évaluation des différents nanomatériaux synthétisés ... 48
II.1. Mise en œuvre des différents nanomatériaux pour la dégradation du glyphosate ... 48
II.2. Évaluation de l’activité photocatalytique du GR-N/TiO2 ... 50
II.3. Étude de la stabilité de l’activité photocatalytique du GR-N/TiO2... 53
Conclusion générale ... 55
Références bibliographiques ... 57
Liste des tableaux
Tableau 1 : Les propriétés physico-chimiques du glyphosate ... 8 Tableau 2 : Propriétés texturales des nanomatériaux synthétisés ... 38 Tableau 3 : Les nanomatériaux mis en jeu pour la dégradation du glyphosate et les méthodes de
synthèse correspondantes ... 49
Liste des figures
Figure 1 : Modes de transfert du glyphosate du sol à l'eau ... 7
Figure 2 : Schéma du processus de photocatalyse sur une particule de TiO2 ... 21
Figure 3 : Méthodologie de travail ... 27
Figure 4 : Caractérisation par DRX de l’oxyde de grphène ... 36
Figure 5 : Caractérisation par DRX du N/TiO2 et le GR-N/TiO2 ... 37
Figure 6 : Caractérisation par UV-Visible du N/TiO2 et le GR-N/TiO2 ... 38
Figure 7 : Isothermes d’adsorption des nanomatériaux synthétisés ... 39
Figure 8 : Distribution des tailles des pores des nanomatériaux synthétisés ... 40
Figure 9 : Spectre FTIR du N/TiO2 et du GR-N/TiO2 ... 41
Figure 10 : Spectre XPS de N/TiO2 ... 42
Figure 11 : Spectre Ti 2p du N/TiO2 ... 43
Figure 12 : Spectre O 1s de N/TiO2 ... 43
Figure 13 : Spectre C 1s de N/TiO2 ... 44
Figure 14 : Spectre N 1s du N/TiO2 ... 44
Figure 15 : Spectre XPS du GR-N/TiO2 ... 45
Figure 16 : Spectre Ti2p du GR-N/TiO2 ... 45
Figure 17 : Spectre O 1s du GR-N/TiO2 ... 46
Figure 18 : Spectre C 1s du GR-N/TiO2 ... 47
Figure 19 : Caractérisation par XPS du GR-N/TiO2 ... 47
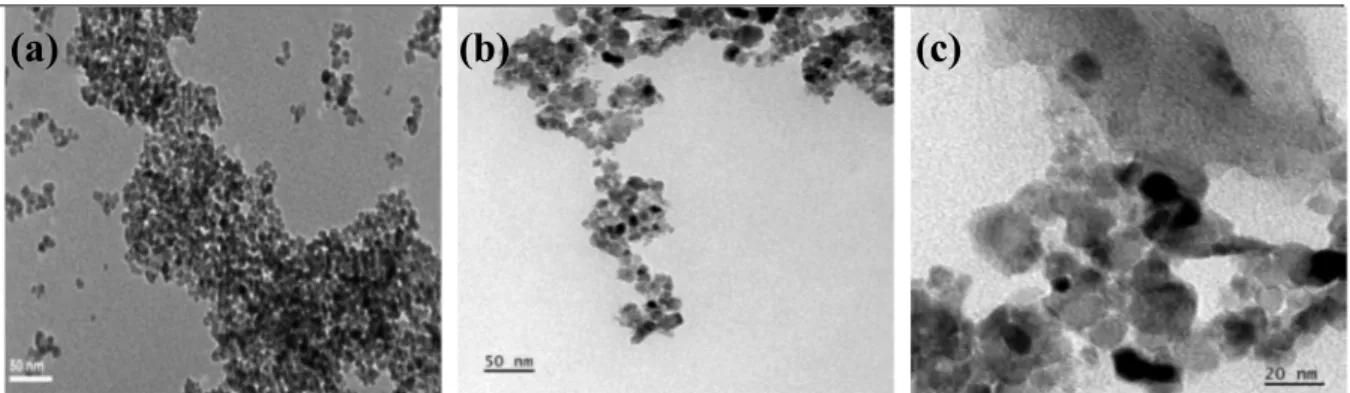
Figure 20 : Caractérisation par MET : (a) TiO2 pur 50 nm, (b) GR-N/TiO2 50 nm, (c) GR-N/TiO2 20 nm ... 48
Figure 21: Les taux d’élimination du glyphosate relatifs aux différents nanomatériaux ... 49
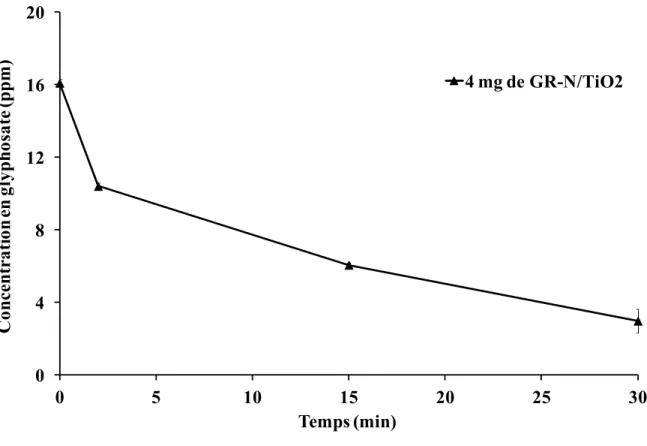
Figure 22 : Suivi de la dégradation du glyphosate mis en action avec 4 mg de GR-N/TiO2 ... 50
Figure 23 : Suivi de la dégradation du glyphosate mis en action avec 8 mg de GR-N/TiO2 ... 51
Figure 24 : Suivi de l’élimination du glyphosate pour deux quantités différentes de GR-N/TiO2 ... 52
Figure 25 : Taux d’élimination du glyphosate avec réutilisation du même photocatalyseur pendant 30 minutes après rinçage et séchage ... 53
Liste des abréviations
Ads : Adsorbé
BET : Méthode de Brunauer, Emmett et Teller BC : Bande de conduction
BV : Bande de valence
CVD : Dépôt en phase vapeur par procédé chimique DRX : Diffraction des rayons X
EDI : Eau déionisée E : Énergie
El : Énergie de liaison Eg : Énergie de gap
FTIR : Spectroscopie de vibration infrarouge à transformée de Fourier GO : Oxyde de graphène
GR : Graphène
GR-N/TiO2 : Oxyde de titane dopé à l’urée sur support de graphène HPLC : Chromatographie liquide à haute performance
MET : Microscopie électronique à transmission N/TiO2 : Oxyde de titane dopé à l’urée
pH : Potentiel hydrogène TiO2 : Oxyde de titane UV : Ultraviolet
UV-Vis : Spectroscopie UV-visible
Remerciements
Ce travail a été effectué au sein du département sols et environnement. Je tiens tout d’abord à remercier Monsieur Antoine Karam, Directeur du programme Sols et Environnement, pour m'avoir accueilli au sein de son département. Je tiens à le remercier vivement pour son importante aide et sa gentillesse.
Ensuite, ma reconnaissance va tout naturellement à Monsieur, Khaled Belkacemi, Professeur à l’Université Laval, pour son encadrement, sa contribution à la réalisation de ce travail et pour ses précieux conseils qu’il a bien voulu me prodiguer.
Cette maitrise a été effectuée sous la direction de Madame Safia Hamoudi, Professeure à l’Université Laval. Je la remercie vivement d’avoir accepté de suivre de près mon travail, de m’avoir fait confiance et pour toutes les connaissances qu’elle a bien voulu me transmettre, tant sur les plans techniques et scientifiques qu’humains.
Mes remerciements s’adressent également aux membres du jury pour l’intérêt qu’ils ont porté à ce travail en acceptant d’en être les rapporteurs.
En témoignage de la franche collaboration dont j’ai bénéficié tout au long de ma maitrise, je remercie bien vivement toute l’équipe du département sols et environnement.
Je me permets aussi de remercier toutes les personnes qui par leurs actes, leurs conseils, leurs avis, leurs critiques et leurs jugements de quelque nature que ce soit puisqu’elles ont contribué à forger ma personnalité et m’ont permis d’être ce que je suis.
Et pour finir, je tiens à remercier mes parents qui m’ont toujours soutenu, qui n’ont épargné aucun effort pour me venir en aide et pour leurs encouragements à aller toujours de l’avant dans le domaine du savoir et de la recherche.
Introduction
L’utilisation des pesticides n’a cessé d’augmenter et en particulier dans le domaine de l’agriculture. Les herbicides représentent la catégorie la plus utilisée et la plus vendue au Québec, vente évaluée à 62.8% par rapport à la consommation totale en pesticides et ce d’après le dernier bilan des ventes de pesticides (Gorse et Balg, 2014). Un grand nombre de pesticides a été détecté dans les eaux des rivières décelant le plus souvent des herbicides. Une analyse statistique montre une tendance à la baisse des concentrations médianes d’atrazine, de S-métolachlore et de dicamba, mais une tendance à la hausse des concentrations de glyphosate a été observée. La présence et la concentration de glyphosate continuent donc d’augmenter dans les cours d’eau et dans les eaux souterraines.
Ce phénomène peut être lié à l’expansion des cultures génétiquement modifiées tolérantes au glyphosate (Giroux et Pelletier, 2012). Chargées en glyphosate, ces eaux de surface et souterraines constituent la majeure partie des eaux brutes destinées aux stations de traitement des eaux afin de les rendre potables. Ne pouvant pas être traitées efficacement par ces dernières, les eaux à la sortie de ces stations présentent par conséquent une teneur élevée en glyphosate (Hedegaard et Albrechtsen, 2014; Malaguerra et al., 2013).
La concentration est à ce jour en dessous de la concentration limite réglementée dans l’eau potable, mais la tendance croissante de sa teneur nous impose de réagir et assurer une solution afin de réduire les teneurs en glyphosate dans les eaux de surfaces surtout que cet herbicide est toxique et présente des risques pour l’environnement et la santé humaine (Samuel et al., 2012).
La popularité grandissante de l’utilisation de glyphosate est due à sa rapidité d’infiltration et de déplacement à l’intérieur de la plante et aussi à sa grande solubilité dans l’eau. Le glyphosate est très peu volatil dans l'air grâce à sa faible tension de vapeur qui le rend très peu soluble dans l’air. Son impact sur la pollution atmosphérique est négligeable (Doliner, 1991). Sa dégradation biologique est rapide dans le sol à cause du grand nombre de microorganismes présents. Cependant, le glyphosate peut se retrouver facilement après un épisode pluvieux dans les eaux de surface où le nombre de microorganismes est restreint. Il est donc primordial de trouver des solutions efficaces pour sa dégradation.
De nos jours, les photocatalyseurs ont attiré l’attention pour la conversion de l’énergie des photons en énergie chimique. Un grand intérêt a été donné à l’utilisation de ces photocatalyseurs utilisant l’énergie solaire pour le traitement des eaux contenant des polluants organiques à l’instar du glyphosate. Parmi les matériaux les plus reconnus par des activités catalytiques on trouve l’oxyde de titane TiO2. La structure cristalline anatase du
TiO2 offre des applications étendues dans la dégradation de ces polluants.
L’utilisation technologique des photocatalyseurs à base de TiO2 présente une piste
prometteuse pour la dégradation des polluants organiques, le glyphosate en particulier. La large bande interdite de TiO2 nécessite l'irradiation avec la lumière ultraviolette (UV) pour
obtenir une activité photocatalytique. Cependant, la lumière UV ne représente qu’une petite fraction de l’énergie du soleil (4%) comparée à celle de la lumière visible (40%) d’où l’intérêt d’étendre la gamme d’absorption de TiO2. Néanmoins, le taux de recombinaison
rapide des paires électron-trou abaisse aussi grandement le rendement quantique de TiO2 et
limite son application dans la région de la lumière visible. Doper le TiO2 par des ions non
métalliques constitue une approche permettant d’atteindre la lumière visible tout en préservant la stabilité thermique de la structure anatase de TiO2. En même temps, il est
important d’empêcher la recombinaison des paires électrons-trous afin d’augmenter son activité photocatalytique. Développer un photocatalyseur réunissant toutes ces propriétés et permettant une dégradation efficace du glyphosate consiste l’enjeu majeur de ce travail. Ce travail de recherche consiste à apporter une solution à la pollution des eaux naturelles causée par le glyphosate et c’est à travers un nanomatériau capable, par photocatalyse, d’adsorber et dégrader ce polluant. Le but est donc de synthétiser un photocatalyseur, le caractériser et le mettre en œuvre pour la dégradation du glyphosate présent dans les eaux naturelles.
Dans le contexte d’une teneur croissante du glyphosate dans l’eau et afin de trouver une solution aux attentes environnementales, l’approfondissement des recherches sur les photocatalyseurs constitue une excellente approche surtout qu’il s’agit de matériaux régénérables qui peuvent être utilisables plusieurs fois sans perdre leurs activités catalytiques.
Ce projet vise l’obtention de nouveaux photocatalyseurs permettant la dégradation du glyphosate. Du point de vue économique et environnemental, ce projet propose une solution innovante pour dégrader le glyphosate dont la teneur croissante constitue un problème majeur pour les fournisseurs des pesticides. La continuité des ventes de ces produits à usage agricole peut ainsi être conservée étant donné que notre but est de proposer des solutions judicieuses contre la contamination de l’eau par le glyphosate.
Le mémoire est organisé en trois parties où sont abordés :
‐
Une synthèse bibliographique dans laquelle je mets en avant la consommation grandissante du glyphosate, ses effets sur l’environnement et sur la santé humaine ainsi que son mode de transfert vers les eaux naturelles. Ensuite, je décris les voies de dégradation de cet herbicide en attribuant un intérêt particulier à la voie de dégradation par les photocatalyseurs à base de TiO2.‐
La présentation du matériel, les techniques d’analyse et les méthodes utilisées dans ce travail pour la synthèse, la caractérisation et l’évaluation du photocatalyseur réalisé.‐
Les résultats constatés et les discussions correspondantes concernant les différentes étapes de réalisation du photocatalyseur à travers les synthèses des nanomatériaux utilisés, leurs caractérisations et leurs évaluations.Chapitre 1 : Synthèse bibliographique
I. Les pesticides
La lutte contre les organismes nuisibles aux cultures a été depuis toujours la préoccupation première de l’agriculteur. Les premiers moyens étaient de nature physique tels que le ramassage des larves et des insectes adultes, la destruction des plantes malades par le feu et le désherbage manuel. Ces actions sont devenues mécaniques suite au développement technologique au fil du temps. L’utilisation de produits chimiques est assez ancienne et a toujours accompagné ces actions à travers l’emploi du soufre et de l’arsenic (Calvet, 2005). Mais c’était surtout au cours des XIXème et XXème siècles que les propriétés biocides de
nombreux produits chimiques avaient été mises en évidence et ont donné lieu à de considérables développements des techniques de protection des plantes. Les pesticides ont donc fait leur apparition et ont pris une grande ampleur en raison des graves maladies ayant touché les productions agricoles vitales comme la pomme de terre, la vigne et les céréales. Les pesticides ont été utilisés à des fins de contrôle et d’élimination des organismes nuisibles à savoir, les herbicides pour les mauvaises herbes, les insecticides pour les insectes, les fongicides pour les champignons et les bactéricides pour les bactéries.
Dans le monde et en particulier au Québec, l’utilisation des pesticides n’a cessé d’augmenter au courant des trente dernières années. En effet, les ventes totales au Québec ont grimpé de 2665 tonnes en 1985 pour atteindre 9337 tonnes selon le dernier bilan de 2014 dont 3854 tonnes de matières actives (les composants auxquels les effets recherchés sont attribués). Le milieu agricole totalise à lui seul 84% des ventes, suivi par le milieu urbain avec 11% correspondant à l’usage domestique et l’entretien des espaces verts (Gorse et Balg, 2014). Selon ce même bilan, les herbicides constituent 62,8 % des ventes totales de pesticides. Les insecticides occupent le deuxième rang avec 15,0 %, viennent ensuite les fongicides avec 14,4 %.
I.1. Le glyphosate
Le glyphosate, le N-phosphono-methyl-glycine est l’herbicide organophosphoré le plus utilisé dans le monde (Giesy et al., 2000). La formule moléculaire est C3H8NO5P. Sa
première commercialisation par Monsanto sous le nom de Roundup date de 1974.
Les herbicides et en particulier le glyphosate représentent la catégorie la plus utilisée au Québec. L’utilisation massive et répétée du glyphosate peut engendrer des conséquences néfastes affectant les différents compartiments environnementaux. En effet, seulement 1% de la matière active dispersée sur la parcelle traitée atteint la cible. La quantité restante s’en va dans l’environnement et plus précisément dans les eaux et le sol (Al-Rajab et Hakami, 2014; Giesy et al., 2000).
Le glyphosate a été détecté dans des échantillons d'eau souterraine canadienne recueillis en 2009 à des concentrations maximales de 0,042 µg/L (Van Stempvoort et al., 2014). En outre, la détection de glyphosate a été rapportée dans environ 20 cours d’eau dans les états du Midwest américains à des concentrations supérieures à 0,1 µg/L mais ne dépassant pas la limite réglementaire américaine qui est de 700 µg/L (Battaglin et al., 2005).
Au cours de ces dernières années, la consommation du glyphosate a connu une augmentation fulgurante suite à l’expiration du brevet protégeant la formulation du Roundup (Battaglin et al., 2014) ; mais aussi suite à la mise sur le marché de plantes,
Roundup ready, modifiées génétiquement pour résister à des doses de glyphosate
suffisantes afin d’éliminer la totalité des mauvaises herbes. En effet, une fois pulvérisé sur le feuillage, il se déplace rapidement dans les tissus de la plante jusqu’aux racines. Le glyphosate inhibe alors l’enzyme 3-phosphate 5-enolpyruvylshikimate synthétase (EPSPS) impliquée dans la synthèse des acides aminés aromatiques essentiels aux plantes provoquant un dérèglement du métabolisme puis la mort.
I.2. Impact du glyphosate
Au cours des dernières années, un certain nombre d’études scientifiques ont exprimé des craintes quant à l’innocuité du glyphosate. Leurs inquiétudes portent sur ses effets sur la santé et plus précisément sur la santé humaine et ses impacts sur l’environnement.
I.2.1. Impact sur la santé humaine
Les risques de bioaccumulation du glyphosate dans les aliments est minime du fait qu’il est peu soluble dans les graisses. De plus, son mode d’action est propre aux plantes et sa toxicité pour les animaux et les humains reste relativement faible (Pelfrène, 2003). Cependant, des études récentes ont montré que le glyphosate est à l’origine d’une certaine atteinte à la santé humaine qui se manifeste par des irritations de la peau, des yeux et des voies respiratoires (Williams et al., 2000).
Des effets toxicologiques sévères dus au glyphosate ont été révélés dans la littérature. Il peut être mutagène et génotoxique (Kongsong et al., 2014). Il est associé au myélome multiple (Sorahan, 2012) ou au lymphome non-hodgkinien (Mink et al., 2012).
Le glyphosate peut aussi avoir une action sur la synthèse des hormones sexuelles ainsi que des effets délétères sur les cellules placentaires chez l’humain (Cassault-Meyer et al., 2014; Gasnier et al., 2009). L’agence de protection de l’environnement aux Etats Unis (U.S. EPA) a établi un niveau maximal de contamination de l’eau potable par le glyphosate égal à 700 µg/L (Jönsson et al., 2013), ce niveau est inférieur au Canada et est égal à 280 µg/L (Giroux, 2002) alors qu’en Europe la norme est de 0.1 µg/L selon la directive européenne n° 98/83/EC (Küsters et Gerhartz, 2010). Une consommation à long terme d’eau potable présentant des concentrations dépassant cette limite peut endommager les reins et empêcher la reproduction (Kongsong et al., 2014).
I.2.2. Impact sur l’environnement
L’utilisation du glyphosate a pour effet de dégrader la biodiversité des sols agricoles et dénaturaliser les écosystèmes concernés.
Des études en laboratoire ont montré que le glyphosate a un impact sur les micro-organismes du sol. L’exposition à cette substance réduit le rythme de leur croissance ce qui affecte leur rôle (Busse et al., 2001). En effet, compromettre la santé du sol et sa chimie a pour conséquence d’accroître les phytopathologies, de réduire le taux de fixation de l’azote et les rendements agricoles par la suite. Parmi les maladies dont le glyphosate est incriminé, on cite la pourriture des racines, le syndrome de la mort subite chez le soya et le piétin échaudage (Johal et Huber, 2009).
I.3. Transfert du glyphosate : du sol à l’eau
Dès son application, le comportement du glyphosate implique des phénomènes de ruissellement et d’infiltration mettant en jeu des processus complexes tels que la rétention englobant l’adsorption et la désorption, la dégradation et la dissipation (Figure 1). Ceux-ci contrôlent le transport du glyphosate du sol aux différents compartiments environnementaux et leur devenir à long terme.
Le glyphosate peut parvenir aux eaux souterraines par infiltration au travers des sols et aux eaux superficielles et ce par ruissellement.
Figure 1 : Modes de transfert du glyphosate du sol à l'eau
(Stéphanie et Emmanuel, 2010)
Le glyphosate, dérivé de la glycine est très polaire, très soluble dans l’eau et insoluble dans la plupart des solvants organiques. Son adsorption dans les sols est très rapide (Ibáñez et al., 2005).
C’est une molécule qui contient trois groupements ; deux groupements acides, l’un carboxylique et l’autre phosphonique et un groupement amine. Ceci lui attribue cinq états
Adsorption Désorption Volatilisation Photodégradation Dégradation Adsorption Désorption Traitement Transport Pluie Dépôt sec Érosion/Transport Ruissellement Infiltration Ecoulement de subsurface et drainage Eau superficielle Zone non saturée SOL Sédiments
d’ionisation différents selon le pH dont les pKa à 20°C sont respectivement 0.8, 2.6, 5.6 et 10.6 (Sprankle et al., 1975).
Cette particularité permet d’envisager une adsorption par des liaisons H et/ou de coordination de fortes énergies mais très dépendantes du pH du sol et de la présence des cations échangeables divalents et trivalents (Miles et Moye, 1988). Le caractère ionisable de cette molécule peut modifier fortement la rétention du glyphosate dans les sols selon le pH et les valeurs de pKa.
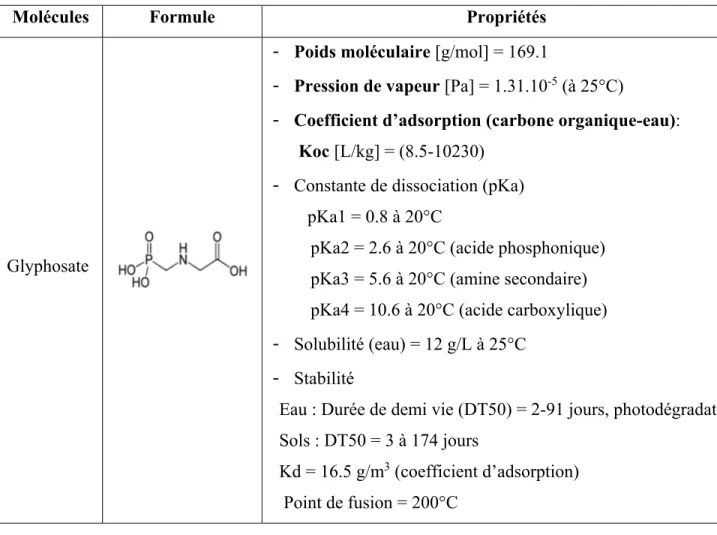
Tableau 1 : Les propriétés physico-chimiques du glyphosate (Couture et al., 1995; Dousset et al., 2004; Sprankle et al., 1975)
Molécules Formule Propriétés
Glyphosate
‐
Poids moléculaire [g/mol] = 169.1‐
Pression de vapeur [Pa] = 1.31.10-5 (à 25°C)‐
Coefficient d’adsorption (carbone organique-eau):Koc [L/kg] = (8.5-10230)
‐
Constante de dissociation (pKa) pKa1 = 0.8 à 20°CpKa2 = 2.6 à 20°C (acide phosphonique) pKa3 = 5.6 à 20°C (amine secondaire) pKa4 = 10.6 à 20°C (acide carboxylique)
‐
Solubilité (eau) = 12 g/L à 25°C‐
StabilitéEau : Durée de demi vie (DT50) = 2-91 jours, photodégradation Sols : DT50 = 3 à 174 jours
Kd = 16.5 g/m3 (coefficient d’adsorption)
Point de fusion = 200°C
I.3.1. L’adsorption
L’adsorption joue un rôle important dans le devenir du glyphosate. En effet, elle conditionne l’équilibre entre les quantités présentes dans la solution du sol et celles retenues par les constituants organo-minéraux du sol. L’adsorption est ainsi liée à la
disponibilité du glyphosate pour une éventuelle dégradation et/ou transfert. Le glyphosate a la particularité d’être fortement adsorbé par les sols, mais l’ampleur de sa rétention reste variable et dépend de plusieurs paramètres à savoir le pH, la teneur des sols en matières organiques et la teneur en argiles et oxydes métalliques.
Effet du pH
Nombreuses sont les études qui ont mentionné une diminution de l’adsorption du glyphosate avec une augmentation du pH des sols (Morillo et al., 2000; Zhou et al., 2004). En effet, la diminution du pH fait apparaître des molécules moins chargées négativement facilitant ainsi l’adsorption (Nicholls et Evans, 1991). Cependant, en étudiant deux différents sols, Cheah et al. (1997) n’ont pas trouvé une interdépendance entre le pH et l’adsorption du glyphosate.
Effet de la teneur en matières organiques
La teneur en matières organiques joue un rôle important dans l’adsorption du glyphosate (Hance, 1976; Morillo et al., 2000; Paul et al., 1975). Dans une étude sur un sol d’une forêt canadienne, Feng et al. (1990) ont observé 90% de rétention de glyphosate dans les 15 premiers centimètres de la couche supérieure du sol où la concentration en matières organiques est très élevée.
Pour étudier l’effet de la teneur en matières organiques sur l’adsorption du glyphosate, Albers et al. (2009) ont étudié six sols. La première étape a concerné l’étude de ces échantillons de sols en conservant leur intégrité (sols entiers). La deuxième étape a consisté à éliminer la matière organique présente dans ces mêmes échantillons. Le résultat de cette étude montre que l’adsorption du glyphosate sur les sols riches en matières organiques est nettement supérieure. Cependant, ces mêmes auteurs mentionnent que le glyphosate adsorbé sur les substances humiques dans les sols naturels semblait être plus facilement désorbé que le glyphosate adsorbé sur des sols amorphes Fe / Al-oxydes.
Effet de la teneur des sols en argile et en oxyde métallique
Les premières études ont attribué l’adsorption du glyphosate au caractère argileux des sols se distinguant par une surface réactionnelle importante due à leurs structures en feuillets mais aussi à leurs propriétés d’échange ionique (Paul et al., 1975). En étudiant l’adsorption de cet herbicide sur un sol argilo-limoneux et un autre sableux, ces auteurs ont confirmé que la teneur en argile est responsable de l’adsorption. Ce même constat a été remarqué plus tard dans d’autres travaux (Glass, 1987; Hill, 2001).
L’adsorption du glyphosate au sol s’effectue en formant un complexe dont l’intensité de cette adsorption va dépendre de la nature minéralogique des sols mais aussi du pH et du cation compensateur (Glass, 1987). Ainsi, la montmorillonite adsorbe plus que l’illite ou la kaolinite et cette adsorption devient plus importante avec l’addition de cations comme le Cu2+, Mn2+, Zn2+, Fe3+ et Al3+. L’effet le plus marqué a été constaté en présence des ions
trivalents Fe et Al, respectivement.
Cependant, le rôle prédominant des argiles sur l’adsorption du glyphosate a été remis en cause plus tard en attribuant un rôle majeur au pH ou à une association de ce dernier avec la teneur en cuivre, le fer amorphe et le phosphore (Mamy et al., 2005). D’un autre côté, l’adsorption a été fortement liée à la teneur du sol en oxyde de fer ou d’aluminium et à la présence de certains autres cations soulignant le rôle important des cations sur l’adsorption du glyphosate en formant des ponts cationiques (Ren et al., 2014; Zhou et al., 2004). Néanmoins, cette rapide adsorption liée à ces oxydes devient très facilement inversée par la suite (Ololade et al., 2014; Ren et al., 2014).
I.3.2. La désorption
Les études concernant la désorption du glyphosate, voire son extraction par une solution aqueuse, se font rares. Pour les faibles concentrations en glyphosate, la désorption est très minime mais plus importante dans les sols sablo-limoneux que dans les sols argileux (Cheah et al., 1997). Elle est accentuée par la présence d’acides humiques et elle est liée essentiellement à la concentration initiale en glyphosate (Arroyave et al., 2016).
I.3.3. La dégradation
En plus d’être adsorbé et/ou désorbé, le glyphosate peut se dégrader suite à sa dissipation par la transformation de sa molécule mère. Après son application sur les plantes, une partie du glyphosate va se trouver dans les constituants du sol tandis qu’une autre partie va se trouver dans la solution aqueuse. Diverses réactions chimiques, biologiques et biochimiques vont par la suite avoir lieu conduisant à sa transformation voire à sa minéralisation et ce en fonction de plusieurs facteurs comme l’activité biologique, les propriétés physico-chimiques et la nature des surfaces mises en jeu.
La dégradation biologique
La dégradation biologique fait appel principalement à des processus impliquant les microorganismes. Après une phase de latence, période d’adaptation des microorganismes au nouveau substrat ou la multiplication de populations capables de dégrader le glyphosate, les microorganismes peuvent mobiliser un ensemble d’enzymes utilisant exclusivement le glyphosate comme substrat pour leur croissance et leur maintien (métabolisme) le transformant ainsi jusqu’à sa minéralisation (Araújo et al., 2003; Banks et al., 2014). Les composants organiques du sol peuvent constituer en plus du glyphosate, sa matière active en particulier, un substrat secondaire ou un co-substrat. Dans ce cas, les microorganismes ne contribuent que partiellement à la dégradation du glyphosate. Le processus de la biodégradation peut être accentué plus dans un sol riche en argile que dans un sol léger dans lequel l’activité microbienne est faible et due à un pH acide. La dégradation est davantage accentuée suite à une bonne accessibilité du glyphosate aux microorganismes. Cette accessibilité dépend essentiellement de la porosité du sol, de l’aération et de la rétention d’eau (Yaduraju, 1994). Cependant, d’autres études évoquent un effet inverse attribué à la teneur en argile et aux microorganismes qui favorisent l’adsorption et par conséquent le ralentissement de la biodégradation qui est fortement impactée par le pH mais le phénomène reste davantage complexe par le changement des conditions environnementales (Nomura et Hilton, 1977) et en particulier la température (Laitinen et al., 2006).
La dégradation chimique
La dégradation chimique est basée essentiellement sur une hydrolyse acide ou basique dans la solution du sol conduisant à des produits intermédiaires polaires plus hydrosolubles que le composé parent. Les processus réactionnels sont catalysés au niveau de la surface des constituants du sol : argile, matières organiques et oxydes métalliques. D’autres réactions peuvent aussi intervenir comme les réactions d’oxydation par l’intermédiaire de radicaux libres des constituants du sol.
Le pH, l’humidité et la température sont des paramètres pouvant fortement impacter la dégradation chimique du glyphosate (Barrett et McBride, 2005). Cependant, à travers la littérature, on ne peut pas attribuer une règle générale à cette voie de dégradation. En effet, une très faible dégradation a été mise en évidence dans les travaux de Paul et al. (1975). Torstensson et Aamisepp (1977) ont également observé une diminution de la toxicité du glyphosate avec le temps dans des sols stériles attribuée à la dégradation chimique. Contrairement à Rueppel et al. (1977) qui n’ont observé aucune dégradation du glyphosate sur des sols stériles et qui ont conclu que la dégradation chimique ne peut pas être la voie principale pour la dégradation du glyphosate.
La photodégradation mettant en œuvre les radiations solaires peut être aussi responsable de la dégradation photolytique et thermique du glyphosate. Elle peut être extrêmement significative à la surface des plantes, dans les débris végétaux, dans l’atmosphère, dans l’eau ou même à la surface du sol (Somasundaram et al., 1990).
I.3.4. La dissipation
Les deux processus fondamentaux conduisant à la dissipation du glyphosate sont la dégradation et la dispersion. La dégradation va assurer la transformation de la molécule initiale alors que la dispersion va entraîner le glyphosate hors de son point d’application. Ces deux processus vont contribuer à sa disparition mais aussi à définir sa persistance au point d’application. La dissipation est donc appréciée par la mesure de la persistance ou de la demi-vie de dissipation. Mais sa valeur est approximative et dépend de la méthodologie analytique mise en œuvre et des conditions du milieu.
Après traitement, le glyphosate peut migrer dans la solution du sol par diffusion ou bien il peut passer dans la phase gazeuse du sol ou dans l’air sous forme d’aérosol comme il peut être aussi entrainé verticalement et/ou latéralement sous l’action des excédents d’eau. La diffusion est limitée à des zones proches du point d’application du glyphosate alors que la volatilisation et surtout le transfert par l’eau peut avoir des effets néfastes se traduisant par la perte du produit hors de l’espace traité qui finit généralement dans la profondeur du sol et dans les eaux de surface. En effet le glyphosate n’est pas susceptible de se volatiliser, cela est dû à sa faible tension de vapeur. Cependant, une partie du glyphosate appliqué dans les cultures peut être transférée dans l’atmosphère lors des traitements par vaporisation des gouttelettes entre la rampe d’application et le sol (Zablotowicz et al., 2009).
L’eau reste le principal vecteur de transport du glyphosate. Les processus régissant ce phénomène de transport sont l’entraînement du glyphosate par l’eau et sa solubilisation dans l’eau de pluie ou d’irrigation. Le transport du glyphosate se produit lorsque la quantité d’eau tombée est supérieure à la capacité d’infiltration du sol ou à partir du moment où le sol a atteint son état de saturation (Rasmussen et al., 2015).
Les concentrations en glyphosate dans les eaux de ruissellement dépendent essentiellement des doses appliquées et de la date à laquelle apparaît le ruissellement après traitement. Le transport est fortement accentué par les précipitations (Rasmussen et al., 2015).
Conclusion
Une fois appliqué, le glyphosate est fortement adsorbé par les constituants des sols. Il est par ailleurs susceptible de subir une dégradation, principalement attribuée aux micro-organismes présents dans les sols. La biodégradation met en jeu des mécanismes complexes qui dépendent des conditions physicochimiques telles que le pH, l’oxygène et la température. Le glyphosate peut en outre être dégradé par voie chimique ; cette voie de dégradation reste cependant faible.
Il est à noter qu’à travers la littérature, on assiste à de très fortes variations entre sols tant au niveau de l’adsorption, la désorption, la dégradation et la mobilité sans que les paramètres à l’origine de ces comportements particuliers soient identifiés. Enfin, on se trouve face à une réalité attestant la présence du glyphosate dans les ressources en eau dont l’effet toxique est
avéré sur l’environnement et la santé humaine. Il est donc primordial de trouver des solutions efficaces pour sa dégradation dans les eaux de surface.
II. La dégradation du glyphosate dans les eaux de surface
Le glyphosate figure parmi les pesticides les plus détectés dans les eaux de surface. Sa concentration devient très élevée par temps de pluie (Botta et al., 2009). Une conséquence directe de cette pollution réside en la contamination des eaux potables dont les eaux de surface représentent la part la plus importante des ressources en eau destinée à la consommation. Des concentrations élevées en glyphosate ont été détectées aussi dans les eaux usées suite au rinçage des conteneurs à herbicides. Des valeurs limites peuvent atteindre jusqu’à 450 µmol/L (Manassero et al., 2010). Naturellement, ces eaux usées, chargées en glyphosate, vont se retrouver à leur tour dans les rivières. La dégradation du glyphosate dans les eaux peut être biologique ou chimique.
II.1. La dégradation biologique
La dégradation biologique est réalisée essentiellement par des processus impliquant des microorganismes présents dans les sols, l’eau et les boues activées. Suite à cette dégradation, le glyphosate peut être minéralisé et donner suite à des composés inorganiques tels le CO2 et le H2O comme il peut être partiellement dégradé en molécules organiques
(Malik et al., 1989; Sviridov et al., 2015). Cependant, les microorganismes sont moins abondants dans les eaux naturelles que dans les sols et par conséquent le rendement de dégradation biologique est faible. Une filtration sur sable ou sur charbon actif peut favoriser une accumulation de microorganismes favorisant la biodégradation du glyphosate. Cependant, le court temps de séjour demeure un handicap pour une biodégradation efficace (Jönsson et al., 2013). Par conséquent, la voie de dégradation chimique peut être favorisée.
II.2. La dégradation chimique
La dégradation abiotique est la deuxième voie de dégradation des pesticides. Elle est due à des réactions chimiques telles que les réactions d’oxydations, de réduction, d’hydrolyse, de conjugaison et de photoréactions. L’efficacité de ce mode de dégradation reste controversée. En effet, Arias-Estévez et al. (2008) ont affirmé que la dégradation abiotique
contribue uniquement à l’atténuation du pouvoir biocide spécifique à la matière active et à l’introduction de nouvelles molécules chimiques dans le milieu. Cependant, nombreux sont les travaux soulignant l’importance de cette voie de dégradation à savoir, la dégradation chimique et la photodégradation.
II.3. La photodégradation
La photodégradation est assurée par les radiations solaires sous l’action de la lumière et de la chaleur. La dégradation peut être liée à une absorption directe de la lumière par la matière active ou bien par l’intermédiaire de substances agissant comme des photo-sensibilisateurs (Cui et al., 2002).
Selon Rueppel et al. (1977), le glyphosate n’est pas sensible à la photodégradation. Les essais ont consisté à irradier le glyphosate sous UV pendant 48 heures équivalentes à 16 jours d’exposition à la lumière ordinaire à raison de 8 heures par jour. Aucune dégradation n’a été observée. Ce constat a été confirmé dans les travaux de Doliner (1991).
Le résultat inverse a été remarqué par Lund-Hoie et Friestad (1986) qui mentionnent un effet significatif de la photodégradation du glyphosate dans les eaux naturelles. En effet, l’irradiation sous UV d’une solution contenant 1 mg/L de glyphosate a conduit à une dégradation de 18.4% le 1er jour et de 86.7% le 14ème jour. Selon les mêmes auteurs, en
faisant varier la concentration en glyphosate de 1 à 2000 mg/L, les demi-vies respectives étaient de 4 et de 28 jours.
Le pH et la nature de l’eau jouent un rôle important dans la photodégradation de glyphosate (Mallat et Barceló, 1998). Deux types d’eaux exposés à la lumière ont été testés à pH 3. La demi-vie du glyphosate était de 230 jours dans l’eau de source et de 345 jours dans l’eau de rivière. A pH 7, la demi-vie baisse considérablement et passe respectivement à 60 et 100 jours dans chaque eau. A l’abri de la lumière, la demi-vie du glyphosate dans l’eau de source est de 730 jours à pH 3 et de 770 jours à pH 7. N’absorbant pas la lumière, la photodégradation du glyphosate serait induite par la présence de composés photosensibles dans le milieu aqueux.
Cependant, Trotter et al. (1990) estiment que ces résultats ne sont pas concluants et que la photolyse joue un rôle mineur dans la dégradation du glyphosate.
III. Les méthodes d’élimination du glyphosate dans les eaux de surface
III.1. Hydrolyse chimique
L’hydrolyse chimique acide ou basique constitue le mode de dégradation du glyphosate le plus fréquent mais son efficacité est à prouver. Des essais en laboratoire menés par Doliner (1991) ont montré que le glyphosate reste stable pendant 32 jours dans des solutions stériles maintenues dans l’obscurité et tamponnées à pH 3, 6 ou 9 et à des températures de 5 et 35°C. Le pH, l’humidité et la température jouent un rôle important sur la dégradation chimique du glyphosate.
III.2. Coagulation- floculation-filtration
D’autres méthodes chimiques peuvent aussi intervenir pour l’élimination du glyphosate. Speth (1993) a étudié l’élimination du glyphosate dans l’eau suite à une coagulation chimique suivie par une filtration. Les résultats ont montré une faible élimination du glyphosate en utilisant le sulfate d’aluminium comme coagulant. Toutefois, il convient de noter que la turbidité de l'eau filtrée est relativement élevée (2 NTU), suggérant des conditions non optimales qui pourraient bien avoir biaisé les résultats. Dans le même contexte, Kempeneers (2000) a étudié l’élimination du glyphosate provenant d’une eau de rivière selon deux méthodes. La première a consisté en une coagulation avec le sulfate d’aluminium suivie d’une floculation qui a engendré un pourcentage d’élimination de 16 %. Cependant, la deuxième méthode a consisté en une coagulation suivie d’une filtration a montré un meilleur rendement d’élimination du glyphosate atteignant 40%. La concentration initiale en glyphosate était de 1 µg/L. Ainsi, d’après ces études, l’élimination du glyphosate dans l’eau est plus efficace dans le cas où la coagulation est suivie directement par une filtration et non une floculation même si ce rendement d’élimination n’excède pas les 50%. En effet, le glyphosate va s’adsorber sur les particules présentes dans l’eau et leur élimination est plus efficace avec une filtration que par une floculation. Cependant, dans les stations de traitement d’eau potable, la floculation précédée par la coagulation est une étape importante dans le prétraitement de l’eau ayant lieu toujours avant la filtration. La coagulation suivie d’une filtration devient techniquement impossible
d’autant plus que les consommations en réactifs (coagulant et surtout acide) font de ce procédé un procédé non économiquement viable.
III.3. Chloration
La chloration offre des rendements élevés de dégradation du glyphosate dans l’eau. Cependant, une diminution de la température a un effet négatif sur le rendement d’élimination du glyphosate (Jönsson et al., 2013). Les produits de dégradation du glyphosate par chloration ne sont pas stables dans les conditions de traitement des eaux potables. En effet, des produits intermédiaires ont été identifiés suite à la chloration, comme le N-chloroaminomethanol qui engendre un sous produit cancérigène le chlorure de cyanogène dans les conditions de traitement des eaux potables (Mehrsheikh et al., 2006; Pedersen et al., 1999).
III.4. Procédés d’oxydation avancés (AOPs)
Depuis une vingtaine d’années, de nouvelles combinaisons de techniques physico-chimiques ont vu le jour dans le but de réduire et dégrader les composés organiques et inorganiques très complexes. Parmi ces techniques, on trouve les procédés d’oxydation avancés chimiques et photochimiques dont l’ozonation, l’ozonation couplée O3/H2O2 -
O3/H2O2/UV, le système Fenton H2O2/Fe2+, le système photo-Fenton H2O2/Fe2+/hυ et
l’oxydation photocatalytique.
Ces procédés mettent en œuvre la combinaison de deux ou trois réactifs oxydants afin de produire des radicaux hydroxyles OH•. Ces espèces sont hautement actives capables de réagir rapidement sur la plupart des polluants organiques difficilement oxydables par voie biologique ou par les traitements chimiques conventionnels.
Ozonation couplée
L’ozonation couplée au peroxyde d’hydrogène (O3/H2O2), à l’UV (O3/UV) et à la
combinaison des deux (O3/H2O2/UV), constituent une alternative pour la dégradation du
glyphosate dans l’eau. En effet, le peroxyde d’hydrogène H2O2 réagit très rapidement sous
radicaux initient par la suite d’autres mécanismes radicalaires de décomposition du peroxyde d’hydrogène participant à l’oxydation du glyphosate. Cependant, le rendement d’élimination du glyphosate selon cette méthode est optimal à des pH supérieur à 8 ce qui ne correspond pas aux conditions de traitement des eaux potables (Assalin et al., 2009; Ikehata et El-Din, 2005). De plus, ce procédé est affecté par la faible solubilité de l’ozone. Le couplage de l’ozone à l’UV permet lui aussi de produire des radicaux libres permettant une oxydation très réactive et efficace pour l’élimination des polluants organiques. En effet, l’ozone en solution aqueuse absorbe la lumière UV avec une adsorption maximale à 253.7 nm (Hart et al., 1983) conduisant à la libération de ces radicaux libres. Ainsi, le couplage de l’ozone au peroxyde d’hydrogène et/ou la lumière UV permet une élimination du glyphosate aqueux néanmoins ces procédés sont affectés par la faible solubilité de l’ozone, la forte consommation énergétique et la sensibilité au pH ainsi que les réactions parasites consommant le OH•(Zaviska et al., 2009). Toutes ces techniques nécessitent une demande énergétique élevée affectant le coût global du traitement de l’eau.
Systèmes Fenton et photo-Fenton
Le système Fenton est le système d’oxydation radicalaire le plus connu. Cette technique de traitement consiste à initier des réactions de décomposition du peroxyde d’hydrogène par des sels métalliques afin de produire des espèces radicalaires très réactives. Pour l’élimination des polluants organiques comme le glyphosate présent dans l’eau, le sel métallique utilisé dans la réaction Fenton est le Fe2+. La décomposition du H
2O2 par les
ions ferreux est de type radicalaire (Haber et Weiss, 1934).
Fe2+ + H2O2 Fe3+ + OH- + OH• H2O2 + OH • H2O + HO2 • Fe2+ + OH• Fe3+ + OH Fe2+ + HO2• Fe3+ + HO2- Fe3+ + HO 2 • + H2O Fe2+ + O2 + H3O+
Ce procédé Fenton présente un défaut majeur affectant son application pour le traitement des eaux. En effet, son efficacité est conditionnée par une zone de pH allant de 2 à 4
(Zaviska et al., 2009). Au-delà de cette plage de pH, on assiste à une précipitation du fer (Fe2+ et Fe3+) pour former des hydroxydes de fer provoquant la diminution de l’activité
catalytique. L’élimination de ces résidus de fer par des ligants organiques nécessite par conséquent un cout supplémentaire.
Ce procédé peut être accentué en utilisant une source d’irradiation UV. Cette action permet une augmentation de taux des radicaux libres en décomposant par photolyse le peroxyde d’hydrogène pour former deux radicaux hydroxyles selon la réaction d’initiation (Jarpa et al., 2016) :
H2O2 + hν 2 OH•
Mais aussi en stimulant la réduction de Fe3+ en Fe2+ selon la réaction :
Fe3+ + H2O + hν Fe2+ + OH• + H+
Ainsi, le couplage du système Fenton à une source d’irradiation UV est censé permettre l’augmentation des radicaux libres et par conséquent le taux de dégradation des polluants organiques. Cependant, Huston et Pignatello (1999) ont montré que le procédé photo-Fenton (H2O2/Fe2+/hν) appliqué pour l’élimination du glyphosate dans l’eau à un pH
optimal égal à 2.8 et 2 heures d’irradiation n’a montré aucune efficacité. De plus la faible plage de pH demeure l’inconvénient majeur à l’application de ce procédé pour l’élimination du glyphosate présent dans l’eau.
La photocatalyse
Il en ressort, à travers la littérature, que la photocatalyse est un moyen potentiel pour l’élimination des micropolluants présents dans l’eau (Chergui–Bouafia et Alloune, 2007). Cette technique vient compenser les inconvénients liés aux procédés biologiques, physico-chimiques (Hassan et al., 2016) et certains procédés d’oxydation avancée déjà cités précédemment à savoir le coût excessif ou l’impossibilité technique de la mise en œuvre de ces procédés appliqués au traitement du glyphosate aqueux.
La photocatalyse est l’une des plus simples méthodes AOPs capable de produire des intermédiaires radicalaire en particulier le OH• hautement réactif conduisant à la minéralisation des composés organiques y compris le glyphosate (Chen et Liu, 2007). Dans
les réactions de photocatalyse, les semiconducteurs jouent le rôle de catalyseurs. Ils ne sont pas consommés dans la réaction globale et sont appelés photocatalyseurs. Ces derniers possèdent une bande de valence saturée d’électrons et une bande de conduction totalement vide. Suite à une irradiation lumineuse de niveau énergétique au moins égal à la largeur de la bande interdite (hν ≥ Eg), les électrons de la bande de valence passent sur la bande de conduction générant ainsi une paire électron/lacune électronique ou plus simplement ē /h+. La réaction globale de formation des paires électron/trou est la suivante :
Photocatalyseur + hν ē + h+ (E ≥ Eg)
Cependant, une partie des paires électron/trou sont réellement utilisées dans la génération de radicaux. En effet, ces espèces peuvent se recombiner en libérant de la chaleur ou réagir séparément avec d’autres molécules présentes dans le milieu. En présence d’eau, les trous peuvent réagir avec des donneurs d’électrons (H2O, OH-) pour produire des espèces
oxydantes comme les radicaux hydroxyles OH• (Ollis et al., 1991). En présence d’un
polluant en solution aqueuse, ce dernier peut céder un électron à un trou h+ et s’oxyder sous
la forme primaire d’un radical cation. L’oxydation de cette dernière espèce se poursuivra jusqu’à sa minéralisation complète grâce notamment aux espèces actives de l’oxygène (OH•, HO
2•, H2O2).
IV. Les photocatalyseurs appliqués à la dégradation des polluants organiques
Les oxydes métalliques (TiO2, ZnO, ZrO2, SnO2) ainsi que les sulfures métalliques (CdS,
ZnS) sont des exemples classiques de photocatalyseurs appliqués à la dégradation de polluant organiques (Fan et al., 2016; Reddy et al., 2015; Wu et al., 2016; Yasin et al., 2015). Les plus répandus restent toutefois le TiO2 et le ZnO étant donné leur coût réduit et
leur stabilité (Hassan et al., 2016).
IV.1. Les photocatalyseurs à base de TiO2
L’oxyde de titane TiO2 est le semiconducteur le plus étudié dans les applications en
photocatalyse grâce à sa stabilité chimique élevée, sa non toxicité et son faible coût (Fujishima et al., 2008; Jönsson et al., 2013; Kazuhito et al., 2005; Kongsong et al., 2014).
Il permet d’atteindre des rendements élevés dans les réactions de dégradation photocatalytique des composés organiques (Low et Boonamnuayvitaya, 2013). Cependant, l’efficacité de la dégradation photocatalytique dépend fortement des conditions opératoires telles que la nature du photocatalyseur, sa concentration en suspension dans l’eau, l’intensité lumineuse, la concentration en oxygène dissous, la température, le pH et la
concentration en polluants (Alkaim et al., 2013; Tan et al., 2011).
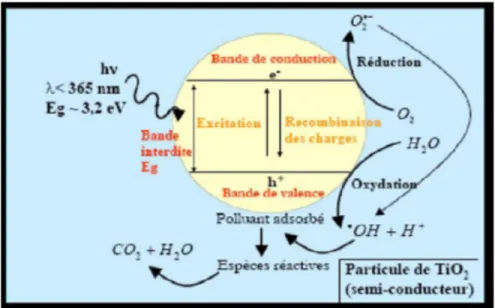
Le processus photocatalytique repose sur l’excitation de TiO2 par un rayonnement
lumineux de longueur d’onde inférieure à 385 nm correspondant à une énergie supérieure ou égale à la largeur de la bande interdite de 3,2 eV.
Sous cette excitation lumineuse, les électrons (ē) de la bande de valence (BV) du TiO2
passent vers la bande de conduction (BC) laissant une charge positive ou trou (h+) dans la
BV (figure 2).
Figure 2 : Schéma du processus de photocatalyse sur une particule de TiO2 (Chergui– Bouafia et Alloune, 2007)
Ces paires électron/trou créées vont réagir à la surface du TiO2 en adsorbant les électrons
de l’oxygène O2 et former le radical superoxyde O∙, d’une part, mais aussi en adsorbant
les donneurs d’électrons provenant de H2O ou OH- pour générer des espèces radicalaires
proximité du photocatalyseur (Chen et Liu, 2007). Le schéma réactionnel peut être décrit par :
, → ∙, ∙, → ∙
→ ∙
Mais ces pairs électrons/trous peuvent se recombiner en libérant de la chaleur ou réagir séparément avec d’autres molécules présentes dans le milieu.
L’activité catalytique de TiO2 est limitée donc par la rapide recombinaison des paires
électron/trou (Tan et al., 2013). De plus, sa large bande interdite de 3,2 eV limite son application à l’UV mais aussi à cause du faible taux d’adsorption de TiO2. Cependant,
l'augmentation de la surface spécifique et la réduction de la taille des particules de TiO2
permet d'accroître le taux d’adsorption. En effet, les polluants organiques adsorbés sont en outre dégradés à la surface du catalyseur. Par conséquent, une augmentation de la capacité d'adsorption doit améliorer l'activité photocatalytique (Bhatkhande et al., 2002).
IV.2. Synthèse et caractérisation des photocatalyseurs à base de TiO2
Plusieurs matériaux ont été utilisés pour synthétiser les co-adsorbants pour TiO2 tels que les
argiles, les zéolites et les matériaux adsorbants à base de carbone, afin d'améliorer l'activité photocatalytique de TiO2 (Leary et Westwood, 2011). Le charbon actif, les nanotubes de
carbone et le graphène (Wang et al., 2012) ont été largement utilisés comme matériaux co-adsorbants en raison de leurs grandes surfaces spécifiques. Le graphène (GR) possède des propriétés thermiques, optiques et électroniques exceptionnelles et peut être synthétisé en utilisant le graphite naturel, peu coûteux, selon la méthode hydrothermale (Cheng et al., 2012; Khalid et al., 2012). La faible activité catalytique de TiO2 résultant de la
recombinaison des charges peut être réduite en utilisant le graphène possédant une grande surface spécifique de 2600 m2/g (Zhang et al., 2010b).
L’amélioration de l’activité photocatalytique du GR-TiO2, due à l’empêchement des
charges à se recombiner, a été observée clairement à travers la densité photoélectrique. En effet sous une excitation de lumière visible ou UV, le GR-TiO2 présente une densité de
à la structure π-π des atomes de carbone. De plus, la bande interdite du composite GR-TiO2
est estimée à environ 2,66-3,18 eV à différents pourcentages en poids de graphène variant de 0,25 à 10% (Cheng et al., 2012). La réduction de l’énergie de la bande réduite est due à l’extension de la limite d’absorption de la lumière du photocatalyseur GR-TiO2 à des
longueurs d’ondes plus grandes grâce à la formation des liaisons Ti-O-C (Zhang et al., 2010a).
Le composite GR-semiconducteur est considéré comme un photo-sensibilisateur mais une charge excessive en graphène peut conduire à une diminution de l’activité photocatalytique en raison de la réduction des sites actifs à la surface de TiO2 empêchant la lumière d’y
accéder (Wang et Zhang, 2011). Ainsi, afin de parvenir à la plus grande activité photocatalytique, la teneur en graphène optimale dans le composite GR-TiO2 doit être
étudiée.
Une autre façon d'améliorer l'activité photocatalytique de TiO2 est d'étendre la limite
d'absorption du TiO2 à une longueur d'onde plus longue par le dopage avec des ions
métalliques de transition tels que Fe3+, Mn2+, Ni2+ et Zn2+ (Wang et al., 2009). Le Fe3+ est
considéré comme un excellent métal de transition permettant d’améliorer l’activité photocatalytique car son rayon atomique est proche du Ti4+ et peut être donc intégré dans la
structure cristalline du TiO2 (Lu et al., 2011). La stabilité de Fe3+ est une autre propriété
exceptionnelle résultant de sa configuration électronique de 3d5 (Devi et al., 2010). Le
photocatalyseur TiO2 dopé par le Fe3+ peut prévenir la recombinaison électron/trou et par
conséquent l’amélioration de l’activité photocatalytique (Elghniji et al., 2012). Elle est également renforcée par la réaction d’oxydo-réduction des ions Fe3+ qui produit plus de
radicaux hydroxyles OH• et d’ions superoxydes O2-.
Il est vrai que le dopage de TiO2 par des ions métalliques a permis d’améliorer l’activité
photocatalytique mais il a été observé que ces ions peuvent affecter la stabilité thermique de la structure anatase de TiO2. Récemment, un co-dopage par des ions métalliques et non
métalliques a été étudié pour pallier le problème de l’instabilité thermique mais aussi pour améliorer davantage l’activité photocatalytique (Cong et al., 2011; Songkhum et Tantirungrotechai, 2013). Yang et al. (2013) ont procédé à un co-dopage par le Mo et C, une augmentation de l’activité photocatalytique a été observée dans la plage de la lumière
visible. Dans une autre étude récente, un co-dopage de TiO2 avec les ions Mn et N pour la
dégradation de la rhodamine B a été réalisé dans une étude récente (Quan et al., 2014). Les résultats ont montré que les tailles de particules cristallines sont restées stables et que l’augmentation de la concentration de dopage n’a que peu d’effet sur la structure. L’alliance des ions Mn et N peut ainsi empêcher la transformation de la structure TiO2 de la phase
anatase à rutile à des températures de calcination élevées.
Avec ce co-dopage, l'effet synergique des ions Mn et N a permis de réduire l'écart de la bande de TiO2 et d’inhiber la recombinaison des paires électrons-trous photogénérées,
conduisant à une grande amélioration dans l'activité photocatalytique dans la région de la lumière visible. Le catalyseur a présenté une forte absorption se situant entre 400-650 nm (Quan et al., 2014).
Pour la dégradation du colorant méthylorange, Khalid et al. (2012) ont synthétisé selon la méthode hydrothermale à basse température un photocatalyseur à base de TiO2 dopé avec
différentes concentrations en azote sur un support de graphène. Ce nanomatériau composite a été caractérisé par différentes méthodes afin de s’assurer de la bonne réalisation à savoir la diffraction des rayons X (DRX), la spectroscopie infrarouge à transformée de Fourier (FTIR), la spectrométrie de photoélectrons induits par rayons X (XPS), la microscopie électronique à transmission (MET). Les résultats ont montré que les réponses spectrales du photocatalyseur composite sont prolongées dans la région de lumière visible et montrent une réduction significative de l’énergie de la bande interdite de 3,18 à 2,64 eV. L’activité photocatalytique a été testée à travers la dégradation du colorant méthylorange. Les résultats ont montré une impressionnante amélioration de la photodégradation par rapport à celle utilisant le TiO2 pur.
La dégradation photocatalytique du glyphosate dans l’eau a été rarement étudiée (Chen et Liu, 2007). Cependant plusieurs travaux mentionnent le potentiel de cette voie de dégradation (Hassan et al., 2016; Li et al., 2016). Chen et Liu (2007) ont étudié la dégradation du glyphosate sous une source de lumière UV dans l’eau en appliquant le TiO2
dopé comme photocatalyseur. Le dopage a été effectué avec des ions métalliques comme le fer et le cuivre. Les résultats montrent que l’activité photocatalytique peut être doublée pour des concentrations optimales en Fe3+ et Cu2+ pour un meilleur rendement d’élimination du
glyphosate pouvant atteindre 68.9% et 88.5% avec les ions de fer et de cuivre respectivement. Dans la même étude, les auteurs mentionnent qu’à des concentrations optimales en K2S2O8, KBrO3 et H2O2 l’activité photocatalytique peut être améliorée mais
aucun effet n’a été remarqué pour des faibles concentrations en Na+, K+, Mg2+, Ca2+, Zn2+,
Chapitre 2 : Hypothèse et objectifs
Dans le but d’éliminer le glyphosate présent dans un milieu aqueux par voie de dégradation photocatalytique, l’hypothèse suivante est émise :
Le dopage du TiO2 par des éléments non métalliques, en particulier l’azote, et sa combinaison avec le graphène peuvent constituer une approche permettant d’étendre son domaine d’absorption à la lumière visible tout en préservant la stabilité thermique de la structure anatase de TiO2. Ce dopage permettra aussi d’empêcher la recombinaison des paires électrons-trous afin d’augmenter l’activité photocatalytique pour une dégradation efficace du glyphosate.
Les objectifs principaux de ce travail vont consister donc à :
‐
Synthétiser un support de dispersion du glyphosate à base de graphène présentant une surface spécifique élevée.‐
Synthétiser et caractériser un photocatalyseur à base de TiO2 dopé avec de l’uréecontenant une teneur élevée en azote N. Ce photocatalyseur doit présenter une activité catalytique élevée dans le domaine du visible afin d’utiliser efficacement l’énergie solaire.
‐
Une fois synthétisé et caractérisé, le photocatalyseur composé du graphène de l’azote et de TiO2 va être mis en contact avec le glyphosate en vue d’une évaluation de sonactivité photocatalytique sous radiation solaire.
Chapitre 3 : Matériels et méthodes
I. Méthodologie
Plusieurs étapes de synthèse, de caractérisation et d’évaluation vont être nécessaires pour la réalisation du photocatalyseur qui sera composé de graphène, TiO2 et de l’azote (Figure 3).
Une technique appropriée va être utilisée pour la synthèse des différents matériaux, simple ou composite. Une ou plusieurs techniques de caractérisation vont être appliquées afin de s’assurer de la bonne réalisation des nanomatériaux et des résultats attendus. Ensuite, on procèdera à l’évaluation du pouvoir photocatalytique du nanomatériau final en le mettant à l’épreuve en présence d’une solution aqueuse contenant le glyphosate.
II. Synthèse des matériaux
II.1. Le graphène
Les matériaux à base de graphène peuvent être utilisés dans diverses applications telles que la photovoltaique, les nanocomposites et les supports de catalyse. Le graphène va être utilisé dans notre travail comme support de dispersion des catalyseurs.
Figure 3 : Méthodologie de travail
GR-N/TiO2
Traitement thermal
Synthèse
Chimique à base de graphite Sol-gel
N/TiO2
Graphène
Evaluation de la réaction photocatalytique
HPLC ionique
Caractérisation
UV-Vis
Différentes méthodes de synthèse du graphène existent déjà : CVD, épitaxie, méthode chimique. C’est cette dernière qui est appliquée car elle est la plus simple, efficace et ne nécessite pas beaucoup d’équipements. La production du graphène est associée à l’oxydation de graphite pour former l’oxyde de graphite selon la méthode de Hummers et Offeman (1958), puis l’exfolier pour avoir l’oxyde de graphène (GO) avec les ultrasons. L’oxyde de graphène obtenu est stocké sous forme de poudre.
La méthode hydrothermale, consistant à placer le GO dans un autoclave à téflon, permet de le réduire et avoir finalement le graphène. Notre choix a été porté sur l’utilisation de la méthode hydrothermale. Afin de s’assurer de la bonne réalisation du graphène, une caractérisation par la diffraction des rayons X est nécessaire.
La synthèse du graphène est réalisée par voie chimique selon la méthode de Tan et al. (2013).
Mode opératoire
12 ml de H2SO4, 2.5g de P2O5 et 2.5g de K2S2O8 ont été ajoutés à 3g de carbone graphite.
Ce mélange a subi une agitation pendant 4h30 en maintenant une température à 80°C. Par la suite, 500 mL d’EDI ont été rajoutés et centrifugés jusqu’à un pH neutre. Le graphite préoxydé est ainsi obtenu. Ce dernier est dispersé dans 120 mL de H2SO4 à 0° C. 15 g de
KMnO4 ont été sensiblement rajoutés afin de garder une température en dessous de 20°C.
Une coloration verte est aperçue. Une agitation à température ambiante est maintenue pendant 2 heures. Après, 250 mL d’EDI ont été rajoutés délicatement sans dépasser 50°C. Une agitation pendant 2 heures est de nouveau effectuée. Une coloration marron est observée. Ensuite 700 mL d’EDI et 20 mL de H2O2 (30%) ont été rajoutés suivis d’un
rinçage en utilisant 1 L de HCl (10%) et 1L d’EDI. Puis, suite à une centrifugation, l’oxyde de graphite a été obtenu. Pour avoir l’oxyde de graphène il suffit juste de faire une sonification.
II.2. Synthèse du nanomatériau à base de TiO2 dopé à l’urée (N/TiO2)
L’oxyde de titane TiO2 présente une énergie de GAP élevée de 3,2 eV ne permettant pas un
mouvement facile des électrons de la bande de conduction vers la bande de valence et vice versa. On aura besoin donc d’une source lumineuse UV qui permet de faciliter le