HAL Id: dumas-01815842
https://dumas.ccsd.cnrs.fr/dumas-01815842
Submitted on 14 Jun 2018
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Connaître les mécanismes de l’éclaircissement dentaire
externe pour comprendre et traiter les cas difficiles
Astrid Gabet
To cite this version:
Astrid Gabet. Connaître les mécanismes de l’éclaircissement dentaire externe pour comprendre et traiter les cas difficiles. Sciences du Vivant [q-bio]. 2017. �dumas-01815842�
AVERTISSEMENT
Cette thèse d’exercice est le fruit d’un travail approuvé par le jury de soutenance
et réalisé dans le but d’obtenir le diplôme d’État de docteur en chirurgie
dentaire. Ce document est mis à disposition de l’ensemble de la communauté
universitaire élargie.
Il est soumis à la propriété intellectuelle de l’auteur. Ceci implique une obligation
de citation et de référencement lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite encourt toute
poursuite pénale.
Code de la Propriété Intellectuelle. Articles L 122.4
UNIVERSITÉ PARIS DESCARTES
FACULTÉ DE CHIRURGIE DENTAIREAnnée 2017 N° 041
THÈSE
POUR LE DIPLÔME D’ÉTAT DE DOCTEUR EN CHIRURGIE DENTAIRE Présentée et soutenue publiquement le : 13 juin 2017
Par Astrid GABET
Connaître les mécanismes de l’éclaircissement dentaire externe pour
comprendre et traiter les cas difficiles
Dirigée par M. le Docteur Jean-Pierre Attal
JURY
Mme le Professeur Tiphaine Davit-Béal Président
M. le Docteur Jean-Pierre Attal Assesseur
Mme le Docteur Élisabeth Dursun Assesseur
Remerciements
À Madame le Professeur Tiphaine Davit-Béal
Docteur en Chirurgie dentaire
Spécialiste qualifiée en Médecine bucco-dentaire Ancien Interne des hôpitaux
Docteur de l’Université Pierre et Marie Curie Habilitée à Diriger des Recherches
Professeur des universités, Faculté de Chirurgie dentaire Paris Descartes Praticien Hospitalier, Assistance Publique-Hôpitaux de Paris
Pour m’avoir fait l’honneur et le plaisir de présider mon jury de thèse. Pour toutes ces années à Ivry durant lesquelles, envers et contre tout, vous nous avez transmis votre expérience, emprunte de l’enthousiasme et l’optimisme avec lesquels vous exercez votre métier. Pour l’importance que vous accordez à rapidement connaître vos étudiants, et l’attention que nous en ressentons. Pour tout cela et vos encouragements incessants, souvenez-vous, je vous prie, de ma gratitude et de mes remerciements.
À Monsieur le Docteur Jean-Pierre Attal
Docteur en Chirurgie dentaire
Docteur de l‘Université Paris Descartes Habilité à Diriger des Recherches
Maître de Conférences des Universités, Faculté de Chirurgie dentaire Paris Descartes Praticien Hospitalier, Assistance Publique-Hôpitaux de Paris
Pour m’avoir fait l’honneur et le plaisir de diriger ma thèse d’exercice. Votre vision, passionnée, scientifique, et affranchie, de la dentisterie moderne ; dont la transmission est facilitée par vos talents pédagogiques; m’a rendue accessible des horizons professionnels jusqu’alors inatteignables. Pour cela, et avec le profond respect que je vous décerne, je tiens à vous adresser un très large et sincère merci. Pour votre patient et enthousiaste soutien, votre confiance, votre inépuisable création, votre générosité et votre grande disponibilité, à nouveau, je vous exprime toute ma gratitude et ma reconnaissance. Merci.
À Madame le Docteur Élisabeth Dursun
Docteur en Chirurgie dentaire Ancien Interne des Hôpitaux Docteur de l'Université Paris Nord
Maître de Conférences des Universités, Faculté de Chirurgie dentaire Paris Descartes Praticien Hospitalier, Assistance Publique-Hôpitaux de Paris
Pour m’avoir fait l’honneur et le plaisir de prendre part à mon jury de thèse. Pour votre ferme, discrète et douce présence. Pour la constance de votre gentillesse, de votre attention, de votre humilité, et de votre enseignement, pour la confiance, la spontanéité et la simplicité avec lesquelles vous m’avez associée à vos travaux, acceptez de recevoir mes nombreux remerciements. Pour l’exemple que vous êtes, merci.
À Monsieur le Docteur Gil Tirlet
Docteur en Chirurgie dentaire
Docteur de l'Université Paris Descartes
Maître de Conférences des Universités, Faculté de Chirurgie dentaire Paris Descartes Praticien Hospitalier, Assistance Publique-Hôpitaux de Paris
Pour m’avoir fait l’honneur et le plaisir de constituer mon jury de thèse. Pour nous transmettre la beauté de notre métier, avec enthousiasme, dynamisme et persévérance. Pour la bienveillante et patiente paternité avec laquelle vous soutenez la jeunesse de notre profession, pour votre confiance, je vous adresse mes sincères et respectueux remerciements.
À mes ainés,
Madame le Docteur Catherine Lesteven, Monsieur le Docteur Christian Moussally,
Mesdames les Docteur Sarah Amr et Aude-Sophie Zlowodski, Messieurs les Docteurs Luc Chikhani, Claude Elbaz, et Thierry Morel, Madame le Docteur Aurore Guigon,
Madame le Docteur Linda Greenwall,
Pour les guides que vous avez été durant mes études.
Pour m’avoir fait découvrir notre métier et sa richesse, pour la passion que vous lui portez, pour le partage de votre expérience.
Pour m’avoir chaperonnée, prise sous votre aile et fait confiance depuis mes balbutiements dans le milieu.
Pour votre accueil chaleureux, pour votre soutien, exigeant et bienveillant, pour votre attention.
À tous les enseignants, praticiens ou professionnels, qui ont croisé ma route et qui, de près ou de loin, m’ont enrichie, aidée et soutenue.
À Madame le Professeur Florence Chemla, chef de service d’Ivry,
Pour le soutien que vous décernez à la création de cette nouvelle consultation Dyschromies à laquelle j’ai la chance de participer.
À mes amis et ainés, Delphine de Nagourski Thomazi, et à Jean Marion, À mes chères amies, Anna, Clotilde, Dikris, Florine,
À tous mes amis ivryiens, et à Rémy, mon binôme de partout,
Aux internes ivryiens, en particulier à Alexandra, Jessica, Mounia, Brice, Pierre-Marie, Aux 5 roses et leurs gardes du corps, Anna, Dikris, Léa, Lucile, Sybille, Clément et Olivier, À Anaïs Bletry et Stéphane Le Goff,
À tous ceux qui auront égayé et enrichis mes années d’étude à Ivry et Montrouge. Pour votre accueil, nos échanges, votre aide et votre présence, si précieuses. Pour votre amitié. Pour le réconfort, le soutien, la joie, que vous représentez. Pour votre confiance.
Pour les oasis que vous étiez au sein du service d’Ivry et à Montrouge et que vous continuez d’être ! Pour tous les moments partagés et à venir.
À mes chères amies, Anne, Astrid et Julie,
Pour votre constante et discrète présence, pour notre complicité et le bonheur que vous êtes. Parce que la vie serait moins belle, moins folle et moins large sans vous.
À mon amie Laure,
Notamment parce que c’est grâce à toi, ton amitié, ta folie et ta joie de vivre, que j’ai vécu une belle P1, que j’ai réussi et que je suis dentiste aujourd’hui.
À vous tous mes si chers amis, d’ici et là,
Pour les milles saveurs que vous apportez à la vie. Pour les joies et les peines partagées.
À mes parents,
Pour tout ce que je ne saurai vous dire mais qui m’habite. Pour tout ce que vous m’avez donné et transmis.
Pour le soutien inébranlable, rassurant, respectueux, aimant et doux, que vous êtes. Pour vos témoignages.
À mes frères, Victor et Louis,
À ma sœur, mon beau-frère et ma nièce, Charlotte, Jean-Marie et Domitille, Pour la chance de vous avoir.
Pour la beauté que vous apportez à la vie. Pour les bouées d’amarrage que vous êtes. Pour me supporter ou me sup-porter de près.
À mes grands-parents,
Pour notre complicité, et votre soutien. Pour le partage de l’amour du travail.
Pour la vie parisienne à vos côtés, que vous rendez plus douce, plus légère, et plus rassurante. Pour votre témoignage.
À ma bonne-maman,
Pour ton soutien, tes pensées, ta tendresse, ton humilité, tes rires, et tous ces moments partagés. Pour m’avoir transmis le goût de l’ouverture à tout ce qui est différent.
Pour ton témoignage.
À mes oncles et tantes,
À mes grand-tantes et mon grand-oncle, À mes cousins,
À ma marraine, À mes filleuls.
Table des matières
INTRODUCTION ... 5
1: LA COULEUR DE LA DENT NATURELLE ET LA COULEUR DE LA DENT ÉCLAIRCIE... 7
1 .1LA COULEUR DE LA DENT NATURELLE ... 7
1.1.1. La couleur de la dent ... 11
1.1.2. Les modifications de la couleur de la dent ... 12
1.2LE MÉCANISME DE L’ÉCLAIRCISSEMENT EXTERNE AMBULATOIRE ... 14
1.2.1. Diffusion de H2O2 dans l’émail et la dentine, et paramètres d’influence ... 14
1.2.2. Interaction de H2O2 avec les chromophores et oxydation ... 17
1.2.3. Opacification de l’émail ... 18
1.3LA COULEUR DE LA DENT ÉCLAIRCIE ET L’OPACIFICATION DE L’ÉMAIL ... 18
1.3.1. Description de l’étude de Ma et al. ... 18
1.3.2. Discussion ... 22
1.3.3. Conclusion ... 24
2: CONSÉQUENCES ET APPLICATIONS CLINIQUES... 26
2.1MODALITÉS COURANTES DE L’ÉCLAIRCISSEMENT ... 26
2.2CAS PARTICULIER DE L’ÉCLAIRCISSEMENT CHEZ L’ENFANT... 27
2.2.1. Pourquoi éclaircir les dents des enfants ?... 27
2.2.2. Quels autres intérêts de l’éclaircissement chez l’enfant ? ... 27
2.2.3. Quels risques et quels effets secondaires de l’éclaircissement chez l’enfant ? ... 28
2.2.4. Quel produit pour l’éclaircissement chez l’enfant ? ... 28
2.2.5. Quel protocole, quelles précautions pour l’éclaircissement chez l’enfant ? ... 28
2.2.6. Quelle réglementation pour l’éclaircissement chez l’enfant ? ... 29
2.3DENTS AVEC ÉMAIL ÉPAIS ... 29
2.3.1. Description ... 29
2.3.2. Mécanisme de l’éclaircissement ... 30
2.3.3. Durée de traitement ... 30
2.3.4. Pronostic du traitement ... 31
2.4DENT AVEC ÉMAIL FIN OU ABSENT ... 31
2.4.1. Description ... 31
2.4.2. Mécanisme de l’éclaircissement ... 32
2.4.3. Durée du traitement ... 32
2.5DENTS ÂGÉES ... 33
2.5.1. Description ... 33
2.5.2. Mécanisme de l’éclaircissement ... 34
2.5.3. Durée de traitement ... 34
2.5.4. Pronostic du traitement ... 35
2.6ZONES DE LA DENT AVEC PEU D’ÉMAIL : LES COLLETS ... 35
2.6.1. Description ... 35
2.6.2. Mécanisme de l’éclaircissement ... 36
2.6.3. Spécificités et durée du traitement ... 37
2.6.4. Pronostic du traitement ... 37
2.7ZONES DE LA DENT AVEC PEU D’ÉMAIL : LES RACINES ... 37
2.7.1. Sur le plan optique ... 37
2.7.2. Mécanisme de l’éclaircissement ... 38
2.7.3. Spécificités et durée du traitement ... 40
2.7.4. Pronostic du traitement ... 41
2.8DENT CALCIFIÉE (« SINGLE DARK TOOTH ») ... 41
2.8.1. Description ... 41
2.8.2. Mécanisme d’éclaircissement ... 42
2.8.3. Spécificités et durée du traitement ... 42
2.8.4. Pronostic du traitement ... 43
2.9TÉTRACYCLINES ... 44
2.9.1. Rappel sur les cyclines ... 44
2.9.2. Description ... 45
2.9.3. Mécanisme de l’éclaircissement ... 45
2.9.4. Durée du traitement ... 47
2.9.5. Pronostic du traitement ... 48
2.10HYPOMINÉRALISATION TRAUMATIQUE ET LÉSION CARIEUSE DÉBUTANTE ... 49
2.11FLUOROSE ... 50
2.11.1. Définition ... 50
2.11.2. Sur le plan optique ... 51
2.11.3. Mécanismes de l’éclaircissement ... 52
2.11.4. Le problème des taches blanches ... 53
2.11.5. Durée du traitement ... 53
2.11.6. Pronostic du traitement ... 53
2.11.7. Intérêt de la microabrasion contrôlée ... 54
2.11.8. Cas particulier des enfants ... 54
2.11.9. Synthèse ... 55
2.12.1. Définition ... 56
2.12.2. Sur le plan optique ... 56
2.12.3. Mécanisme de l’éclaircissement ... 58
2.12.4. Spécificités et durée du traitement ... 59
2.12.5. Pronostic du traitement ... 60
2.12.6. Cas particulier des enfants ... 60
2.13AMÉLOGÉNÈSE ET DENTINOGÉNÈSE IMPARFAITES ... 61
2.14EN CAS D’ÉCLAIRCISSEMENT INTERNE ASSOCIÉ ... 61
3: EXPERIMENTATIONS ... 63 3.1INTRODUCTION ... 63 3.2MATÉRIEL ET MÉTHODES ... 63 3.2.1. Matériel ... 63 3.2.2. Méthode ... 64 3.3RÉSULTATS ... 66
3.3.1. 1ère expérimentation - Influence de la déprotéinisation et de la déminéralisation engendrées par le PC sur la morphologie des dents éclaircies par le PC, en surface et en subsurface ... 66
3.3.2. 2ème expérimentation - Étude par pesée de la déshydratation lors d’un éclaircissement externe par du peroxyde de carbamide à 10% : ... 68
3.4DISCUSSION ... 70
3.4.1. L’éclaircissement externe au peroxyde de carbamide à 10% à pH neutre, engendre une légère déminéralisation et une déprotéinisation visible en subsurface ... 71
3.4.2. L’éclaircissement externe au peroxyde de carbamide à 10% à pH neutre, n’engendre pas de déshydratation significative durable. ... 73
3.5CONCLUSION ... 74
4: CRÉATION D’UNE CONSULTATION DYSCHROMIES CHEZ L’ENFANT, L’ADOLESCENT ET L’ADULTE. ... 75
4.1PRÉSENTATION DE L’ÉQUIPE ... 75 4.2PROBLÉMATIQUE ... 75 4.3OBJECTIFS ... 77 4.4DÉROULEMENT DE LA CONSULTATION ... 77 4.5SYNTHÈSE ... 78 CONCLUSION ... 79 BIBLIOGRAPHIE ... 81
TABLE DES FIGURES ... 87
TABLE DES TABLEAUX ... 89
Introduction
Ces dernières années la dentisterie a évolué vers des traitements de plus en plus conservateurs, voire ultraconservateurs. Ces traitements ont été classés au sein d’un gradient thérapeutique1, en fonction de leur niveau de préservation tissulaire. Parmi les traitements les moins invasifs figure l’éclaircissement dentaire. Décrit par Haywood et Heymann en 1989 2, l’éclaircissement dentaire externe ambulatoire, est aujourd’hui reconnu comme étant une méthode sûre, efficiente, et en phase avec la demande de la population 345. Toutes les études épidémiologiques évaluent à environ 30 à 60% le pourcentage de la population souhaitant avoir les dents plus lumineuses ou « plus blanches »6.
L’augmentation de la luminosité résulte de la diffusion d’agents blanchissants au sein de l’émail et de la dentine, de leur intéraction avec ces derniers et de la modification des propriétés optiques de la dent 78 9. Toutefois, le mécanisme approfondi est encore mal connu. Et bien que de nombreuses colorations dentaires physiologiques aient été traitées avec succès, via ce procédé, il demeure actuellement des situations cliniques délicates, pour lesquelles les résultats sont moins probants : les colorations des racines, les colorations cervicales, les colorations liées à la tétracycline, les colorations liées aux grands syndromes (fluorose sévère, amélogénèse imparfaite, MIH) …etc. Pour aider le praticien à gérer ces situations cliniques délicates et lui proposer des protocoles adaptés, il nous a semblé nécessaire d’étudier, auparavant, de manière approfondie, les propriétés optiques de la dent, ainsi que les mécanismes de l’éclaircissement.
Dans un premier temps, nous nous intéresserons à la couleur de la dent naturelle, nous exposerons le mécanisme habituellement décrit de l’éclaircissement dentaire externe et nous développerons un effet méconnu de cet éclaircissement, à savoir l’opacification amélaire10. Dans une deuxième partie, nous détaillerons les conséquences et applications cliniques, permises par la compréhension de ce mécanisme. Une troisième partie sera destinée à la description d’une expérimentation que nous avons réalisée au laboratoire de biomatériaux de notre faculté, et qui a eu pour but de mieux
1 Tirlet et Attal, « Le gradient thérapeutique : un concept médical pour les traitements esthétiques. » 2 Haywood et Heymann, « Nightguard vital bleaching. »
3 Haywood, « Current status of nightguard vital bleaching ».
4 Sulieman, « An overview of bleaching techniques : I. History, chemistry, safety and legal aspects ». 5 Minoux et Serfaty, « Vital tooth bleaching : biologic adverse effects : a review. »
6 Simon, Tirlet, et Attal, « Evaluation de la demande esthétique ».
7 Kwon et Wertz, « Review of the mechanism of tooth whitening : the mechanism of tooth whitening ». 8 Kwon, « A dynamic process : elucidating the mechanism of tooth whitening ».
9 Ma et al., « Separate contribution of enamel and dentine to overall tooth colour change in tooth bleaching ». 10 Ibid.
comprendre les mécanismes - décrit au début de ce mémoire - en testant deux hypothèses précises. Enfin, la quatrième et dernière partie, nous donnera l’occasion de présenter la création d’une nouvelle consultation « Dyschromies » que nous ouvrons dès cette année à l’hôpital Charles Foix d’Ivry sur Seine.
1: La couleur de la dent naturelle et la couleur de la dent
éclaircie
1 .1 La couleur de la dent naturelle
La dent est un ensemble de tissus (émail et dentine principalement) de composition et structure différentes, et possédant donc des propriétés optiques différentes. Pour cette raison, la lumière n’interagit pas de la même façon avec chaque tissu.
L’émail est un tissu très minéralisé. De structure prismatique, ce tissu est composé, en volume, de 84% de cristaux d’hydroxyapatites, de 12% d’eau et de 4% de matière organique11. C’est donc un tissu relativement homogène sur le plan structural et chimique. La diffusion lumineuse au sein de l’émail est permise par les cristaux d’hydroxyapatites qui lui confèrent sa translucidité12 13. Cette translucidité de l’émail implique qu’une partie des photons lumineux atteigne la dentine et cela explique déjà (voir plus loin) pourquoi la couleur de la dent est très influencée par la couleur de la dentine.
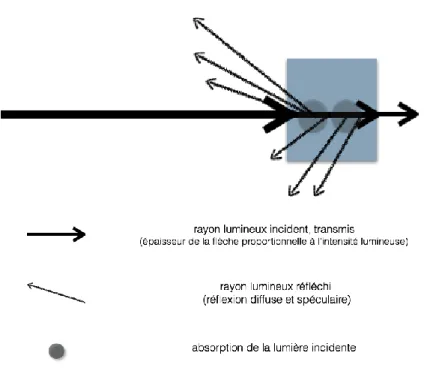
Rappel: Un corps est translucide lorsqu’il réfléchit, absorbe, et transmet la lumière incidente (figure 1.1).
11 Piette et Goldberg, La dent normale et pathologique.
12 Magne, « Bioemulation biomimetically emulating nature utilizing a histoanatomic approach visual synthesis ». 13 Joiner, « Tooth colour : a review of the literature ».
Figure 1.1 : Propriétés optiques d’un corps translucide. Source : Auteur
La dentine est un tissu moins minéralisé que l’émail et beaucoup plus hétérogène. Parcourue, de la jonction émail-dentine à la cavité pulpaire, de tubules délimitant une dentine inter et péritubulaire, elle est composée, en volume, de 50% de matière minérale, de 30% de matière organique et de 20% d’eau14.
Cette hétérogénéité structurale et chimique paramètre la diffusion lumineuse au sein de la dentine, et notamment son opacité. Sur le plan structural, ce sont l’orientation, la densité, le nombre et le diamètre de ces tubuli qui jouent un rôle sur la propagation de la lumière15 16 17. Sur le plan chimique ce sont les composants minéraux organiques et aqueux qui jouent ce rôle.
Rappel: Un corps est opaque lorsqu’il absorbe et réfléchit la lumière incidente (figure 1.2).
14 Piette et Goldberg, La dent normale et pathologique. 15 Fondriest, « Optical characteristics of natural teeth ». 16 Zijp, « Optical properties of dental hard tissues ».
Figure 1.2 : Propriétés optiques d’un corps opaque. Source : Auteur
Au contact de la dent, la lumière rencontre donc différents tissus (figure 1.3) : au niveau du bord libre : l’émail – translucide - uniquement (zone 1), dans le corps de la dent le plus coronaire (zone 2): l’émail – translucide- , la jonction amélo-dentinaire (JAD) et la dentine – opaque -, dans la partie médiane (zone 3) : l’émail – translucide - , la JAD, la dentine - opaque - et la pulpe, et sur les racines découvertes (zone 4) : la dentine – opaque - uniquement (avec ou sans le cément).
Notons que juste sous l’émail, au niveau du manteau dentinaire, on observe une sous-couche dentinaire, assez translucide, qui permet à la lumière de pénétrer plus loin dans la dentine opaque, donnant ainsi de la profondeur à la dent. Pour des raisons de simplification, nous n’avons pas reproduit cette couche.
Lorsque la lumière atteint la dent, elle est essentiellement (figure 1.3) : - transmise au niveau des zones translucides,
- réfléchie au niveau des zones opaques, - absorbée (dans chacune des zones colorées),
- réfractée. En effet, les composants des tissus n’ayant pas tous le même indice de réfraction, le trajet lumineux au sein de la dent est dévié : il s’agit de la réfraction. Plus un faisceau lumineux est réfracté, et moins il est disponible pour être transmis. Ainsi la réfraction conditionne la translucidité (ou l’opacité) de la dent.
Figure 1.3 : Les différents tissus que traverse la lumière et ses différentes interactions avec la dent. La lumière arrive sur l’émail, translucide, qui en transmet la majorité au corps sous jacent (JAD et dentine), en absorbe une faible partie, puis la réfléchit. La dentine, opaque, absorbe, puis réfléchit la lumière qu’elle a reçue. La réflexion lumineuse provient donc essentiellement du corps opaque, qui est la dentine.
1.1.1. La couleur de la dent
Ten Bosch et al. 18 ont montré que la couleur de 28 dents - dont l’émail avait été éliminé – correspondait presque strictement à la couleur de la dent « complète ». Cela prouve donc que la couleur de la dent naturelle est majoritairement déterminée par celle de la dentine.
En effet, lorsque la lumière rencontre l’émail translucide, une faible partie est absorbée et réfléchie, et l’autre partie est transmise à la dentine (Cf. figure 1.3). La dentine, à son tour, absorbe et réfléchit la lumière qui est ensuite renvoyée à l’œil de l’observateur à travers l’émail. L’émail est donc un filtre qui module, d’une part la lumière qui arrive sur la dentine, et d’autre part celle renvoyée par la dentine192021. La dentine étant le corps opaque de la dent22, c’est elle qui règle la couleur de la dent naturelle et donc la teinte, la saturation, et la luminosité de la dent naturelle.
La dent possède également deux autres propriétés optiques : la fluorescence et l’opalescence2324. La fluorescence se définit comme l’absorption de lumière d’une certaine longueur d’onde suivie par sa réémission à une longueur d’onde supérieure. La dentine, qui possède cette caractéristique, présente la capacité, lorsqu’elle est soumise à un rayonnement UV non visible, de réémettre dans le spectre visible bleu. Ainsi, plus un tissu est fluorescent et plus il apparait désaturé. Une voie de recherche pour améliorer les résultats des éclaircissements externes dans les cas complexes, serait de mimer le procédé utilisé par les céramistes qui incorporent des poudres fluorescentes2526 à leurs couronnes pour augmenter leur luminosité, et donc masquer les dyschromies sous-jacentes et diminuer la saturation.
Un objet qui apparait d’une certaine couleur lorsqu’il réfléchit la lumière et d’une autre couleur lorsqu’il la transmet, est opalescent. Les longueurs d’onde courtes sont réfléchies et les structures apparaissent bleutées (opalescence bleutée) ; les longueurs d’onde longues sont transmises et les structures paraissent orangées ou ambrées (opalescence ambrée). Elle est très fréquente au niveau du bord libre des dents jeunes.
18 ten Bosch et Coops, « Tooth color and reflectance as related to light scattering and enamel hardness ». 19 Ibid.
20 Fondriest, « Shade matching in restorative dentistry : the science and strategies ».
21 Eimar, « Tooth enamel ultrastructure : correlation between composition and physical properties ». 22 Fondriest, « Optical characteristics of natural teeth ».
23 Sikri, « Color : implications in dentistry ».
24 Fondriest, « Optical characteristics of natural teeth ». 25 Sikri, « Color : implications in dentistry ».
Ces interactions lumière/dent sont modulées par les épaisseurs et constitutions des deux composants traversés, émail et dentine. Par exemple, si l’émail est très fin, il devient encore plus translucide (cas des érosions où la visibilité de la dentine est forte), et si la dentine est très fine elle devient moins opaque (cas de la dentine radiculaire qui laisse voir un tenon radiculaire).
Ainsi, la dent, de part son hétérogénéité constitutionnelle, possède des propriétés optiques variées et variantes, qui modifient donc son rendu visuel. Par exemple, d’une zone géographique à l’autre, la dent peut être plus translucide ou plus opaque (figure 1.4).
Figure 1.4 : Illustration des propriétés optiques des tissus dentaires sur deux incisives centrales. On note bien sur ces incisives centrales des zones très opaques blanches (zones hypominéralisées, qui présentent une hétérogénéité chimique et structurale entraînant des interfaces réfractives), opaques jaune-orangées au niveau du collet, translucides à la jonction du bord libre et de la face proximale (surtout en mésial),
et même un peu d’opalescence ambrée ou bleutée. Source : Dr. Jean-Pierre Attal
1.1.2. Les modifications de la couleur de la dent
La couleur de la dent peut être altérée par les phénomènes suivants :
1.1.2.1. Le vieillissement
- L’émail devient plus minéralisé et s’affine (par usure mécanique) : il est encore plus translucide (figure 1.5).
- Des dentines secondaire et tertiaire sont formées aux dépens de la lumière des tubuli dentinaires et du volume de la chambre pulpaire. Ces processus physiologiques aboutissent à l’augmentation du volume de la dentine et de sa saturation, et donc de la dent.
L’émail augmente donc en translucidité en diminuant son volume, alors que la dentine augmente en saturation en augmentant son volume. Ainsi la participation de la dentine à la couleur de la dent augmente avec le temps (figure 1.5).
Figure 1.5 : Sourire d’une patiente de 75 ans.
On note l’importante translucidité de l’émail, notamment au niveau des bords libres, en raison de l’usure mécanique notable. La dentine est quant à elle très saturée et opaque.
Source : Auteur
1.1.2.2. Les colorants
Les colorants peuvent être extrinsèques ou intrinsèques.
1.1.2.2.1. Les colorants extrinsèques
Toute la vie, la dent est exposée au milieu buccal, source de composants colorés et colorants. Ces colorations extrinsèques n’intéressent que la surface amélaire (éventuellement sa profondeur dans les zones hypominéralisées, et/ou poreuses, ou en présence de fissures), et n’altèrent pas la composition chimique de la dent. Elles ont tendance à se former dans les zones peu accessibles au brossage et ont diverses origines :
- le biofilm, - le tabac,
- l’ingestion d’agents cationiques (ex : chlorhexidine) ou de sels métalliques (étain, métal, etc.).
1.1.2.2.2. Les colorants intrinsèques
L’émail, mais aussi la dentine, peuvent être le siège profond d’incorporations chromogéniques lors de l’odontogenèse, ou lors de situations cliniques particulières, en créant des dyschromies, alors appelées intrinsèques. Ces dernières ont plusieurs étiologies :
- iatrogéniques médicamenteuses, par exemple le fluor et les tétracyclines,
- pathologiques, notamment liées à des atteintes pulpaires (ex : hémorragie pulpaire ou calcification),
- anomalies héréditaires et génétiques, comme le sont par exemple les amélogénèse et dentinogénèse imparfaites.
Maintenant que nous avons une bonne connaissance de la couleur de la dent naturelle, attachons nous à comprendre les modifications de cette couleur induites par l’éclaircissement dentaire externe.
1.2 Le mécanisme de l’éclaircissement externe ambulatoire
Même si le mécanisme de l’éclaircissement est aujourd’hui encore mal élucidé, la littérature s’accorde à expliquer le changement de perception de la couleur de la dent par trois grands phénomènes 272829 : 1) la diffusion de peroxyde d’hydrogène (H2O2) à travers les tissus dentaires, 2) une interaction chimique entre le peroxyde d’hydrogène et les chromophores et 3) une opacification de l’émail. Si les deux premiers phénomènes sont très souvent décrits dans la littérature, le troisième, qui nous semble essentiel ne l’est, lui, presque jamais.
1.2.1. Diffusion de H2O2 dans l’émail et la dentine, et paramètres d’influence
L’émail et la dentine sont des tissus hautement perméables pour les fluides. En effet H2O2, diffuse facilement et rapidement dans les tissus dentaires, jusqu’à arriver dans la cavité pulpaire. Les voies
27 Joshi, « An overview of vital teeth bleaching ».
28 Kwon, « A dynamic process : elucidating the mechanism of tooth whitening ».
d’accèsles plus importantes sont les espaces interprismatiques amélaires et les tubuli dentinaires30 31. C’est ainsi qu’en 15 minutes le peroxyde atteint la pulpe32.
La diffusion d’H2O2 au sein de la dent est influencée par une série de paramètres33, parmi ceux-ci citons:
1.2.1.1. Le temps de contact
C’est le paramètre d’influence le plus important. La diffusion du produit éclaircissant est nettement améliorée par la prolongation du temps de contact 34 35 36 37.
1.2.1.2. La composition et la structure des substrats rencontrés
Les dents jeunes (cristaux d’hydroxyapatite de l’émail plus petits et tubuli dentinaires larges) permettent une bonne diffusion d’H2O2.
Les dents âgées (cristaux d’hydroxyapatite de l’émail plus importants et tubuli moins larges) freinent la diffusion 3839.
Les dents hypominéralisées (MIH par exemple) permettent une meilleure diffusion notamment au niveau des zones hypominéralisées4041.
La présence de restaurations empêche bien entendu la diffusion d’H2O2 à leur niveau.
30 Kwon et al., « Penetration pattern of rhodamine dyes into enamel and dentin: confocal laser microscopy observation ». 31 Ubaldini et al., « Hydrogen peroxide diffusion dynamics in dental tissues ».
32 Greenwall, « Tooth whitening : the last 25 years ». 33 Haywood, « Frequently asked questions about bleaching ».
34 Kwon, « A dynamic process : elucidating the mechanism of tooth whitening ». 35 Joshi, « An overview of vital teeth bleaching ».
36 Elfallah et Swain, « A review of the effect of vital teeth bleaching on the mechanical properties of tooth enamel. » 37 Haywood, « Frequently asked questions about bleaching ».
38 Greenwall, « Tooth whitening : the last 25 years ».
39 Kelleher et al., « Bleaching and bonding for the older patient ».
40 Elhennawy et Schwendicke, « Managing molar-incisor hypomineralization : a systematic review ».
41 Lygidakis et al., « Best clinical practice guidance for clinicians dealing with children presenting with molar-incisor-hypomineralisation (MIH) ».
1.2.1.3. La composition et la concentration des produits 42
Nous décrivons ici la molécule de base et l’additif principal:
Molécule de base : un consensus se dessine sur l’utilisation du peroxyde de carbamide à 10% qui se dissocie en 3,6% d’H2O2, qui est le principe actif, et 6,4% d’urée. L’urée est un déprotéinisant. Il facilite donc la diffusion du peroxyde d’hydrogène43. Même si la diffusion augmente avec la concentration de produit éclaircissant, on se limitera aux plus faibles concentrations, qui sont les plus documentées et les plus sécurisantes.
Additif : les carbopols sont des agents épaississants qui permettent l’augmentation de la viscosité des gels blanchissants et retardent la dégradation du peroxyde de carbamide. Le relargage de H2O2 au sein de l’émail et de la dentine est ainsi plus graduel. La durée d’action du produit, dont la diffusion et la rétention sont optimisées, est alors allongée, et les résultats améliorés444546.
1.2.1.4. La pression des fluides pulpaires
La pression des fluides pulpaires s’exerce de telle façon qu’elle a tendance à repousser les flux entrant47 48. On peut penser que l’histoire de la dent, conditionnant l’état pulpaire, et donc impactant la pression intrapulpaire, influence alors la diffusion du peroxyde d’hydrogène. Sur dent dépulpée, cette pression des fluides pulpaires est nulle, ce qui optimise donc la diffusion au sein des tubuli dentinaires.
Au total, étant donné le grand nombre de facteurs d’influence, la diffusion du principe actif H2O2 est très variable non seulement d’un individu à l’autre, d’une dent à l’autre, mais aussi au sein même d’une dent. Cela explique aisément certains résultats non reproductibles et fluctuants, comme nous le verrons au chapitre 2.
42 Hanks et al., « Cytotoxicity and dentin permeability of carbamide peroxide and hydrogen peroxide vital bleaching materials, in vitro ».
43 Goldberg, Arends, et Jongebloed, « Action of urea solutions on human enamel surfaces. »
44 Caneppele, Borges, et Torres, « Effects of dental bleaching on the color, translucency and fluorescence properties of enamel and dentin ».
45 Haywood, « Frequently asked questions about bleaching ». 46 Greenwall, « Therapeutic aesthetics ».
47 Soares et al., « Transenamel and transdentinal cytotoxicity of carbamide peroxide bleaching gels on odontoblast-like MDPC-23 cells ».
1.2.2. Interaction de H2O2 avec les chromophores et oxydation
Les chromophores sont des molécules organiques colorées possédant de longues chaines conjuguées (composées alternativement de simples et doubles liaisons) au sein desquelles sont souvent inclus des hétéroatomes ou des noyaux phényles ou carbonyles (figure 1.6).
Figure 1.6 : La molécule de tétracycline.
De couleur jaune, elle présente de nombreux noyaux phényles ou carbonyles.
Source : Sánchez, Rogers, et Sheridan, « Tetracycline and other tetracycline-derivative staining of the teeth and oral cavity ». 49
Leur décoloration est permise par leur oxydation par H2O2, qui entraîne une dégradation d’une ou plusieurs doubles liaisons de la chaine carbonée. Leurs propriétés d’absorption de la lumière sont ainsi modifiées (changement du spectre d’absorption pour des longueurs d’onde plus courtes : les composés deviennent moins colorés voire non colorés) en faveur d’une diminution de la teinte. Il en résulte une augmentation de la luminosité.
Suite à ce processus oxydatif, à l’origine de l’éclaircissement dentaire, la double liaison stable du chromophore est transformée en simple liaison avec un électron non apparié. L'électron non apparié entraîne une grande instabilité de la molécule, il faut donc lui laisser le temps de se lier à une autre molécule, ou bien d’être digéré, afin de stabiliser la molécule. Le retour à une situation plus stable (via la reformation d’une double liaison), apparaît être une hypothèse expliquant une part des récidives post-éclaircissement50. D'où, encore une fois, l'intérêt d’effectuer sur une longue période les éclaircissements.
Enfin, nous verrons (chapitre 2) que pour que ce phénomène ait lieu il faut que H2O2 rencontre les chromophores, alors que ces derniers sont généralement agglutinés les uns aux autres. Il faudra
49 Sánchez, Rogers, et Sheridan, « Tetracycline and other tetracycline-derivative staining of the teeth and oral cavity ». 50 Joiner, « Review of the effects of peroxide on enamel and dentine properties ».
donc dégrader - par oxydation - les chromophores se trouvant en périphérie de l’agrégat, puis de proche en proche continuer dans sa profondeur.
1.2.3. Opacification de l’émail
Ce phénomène est rarement décrit dans les articles et pourtant il nous paraît essentiel. Nous le développerons dans une partie spécifique (chapitre 1.3).
Au total, la combinaison de ces trois phénomènes permet ce que nous appelons l’éclaircissement de la dent. Par l’action sur les chromophores, nous aboutissons à une désaturation colorimétrique des tissus dentaires au sein desquels H2O2 aura diffusé. Par l’opacification de l’émail51 52, nous aboutissons à un gain de luminosité important.
1.3 La couleur de la dent éclaircie et l’opacification de l’émail
Une étude récente de Ma et al. 53 nous semble essentielle pour bien comprendre les modifications optiques de la dent éclaircie et notamment cette opacification de l’émail. C’est pourquoi nous avons décidé de la décrire.
1.3.1. Description de l’étude de Ma et al.
1.3.1.1. Objectif
L’objectif de cette étude est de déterminer la contribution de la dentine et de l’émail à l’éclaircissement. L’effet de l’éclaircissement est-il lié au changement de couleur de la dentine ou à celui de l’émail ? L’hypothèse que Ma et al. cherchent à vérifier, est que l’émail contribuerait plus largement que la dentine au changement de couleur permis par l’éclaircissement, notamment grâce au masquage de la dentine sous-jacente.
51 Ma et al., « Separate contribution of enamel and dentine to overall tooth colour change in tooth bleaching ». 52 Kwon et Wertz, « Review of the mechanism of tooth whitening : the mechanism of tooth whitening ». 53 Ma et al., « Separate contribution of enamel and dentine to overall tooth colour change in tooth bleaching ».
1.3.1.2. Matériel et méthode
Pour ce faire, ils sélectionnent des prémolaires orthodontiques, dont le différentiel maximal de teinte correspond à celui présent entre deux dents controlatérales. Elles sont stockées dans de la salive artificielle à 37°C. Ils mettent en place un traitement par un gel de peroxyde de carbamide à 10% ayant un pH de 6,8, et ce, 8 heures par jour, pendant 7, 14 ou 28 jours (groupe dents éclaircies). Entre chaque exposition au gel, les dents sont rincées avec de l’eau distillée. Les auteurs mesurent les coordonnées Cie L*a*b* (Système de référence colorimétrique de la Commission Internationale de l’Éclairage, L* est la grandeur qui caractérise la luminosité, a* le niveau de rouge et b* le niveau de jaune) de chaque échantillon, puis les découpent afin d’obtenir différents groupes d’échantillons : émail éclairci (BE), dentine éclaircie (BD), contrôle émail (CE), contrôle dentine (CD). Puis à partir de ces coupes, des modèles recombinés émail-dentine (ED) sont formés : BE/BD, CE/BD, BE/CD, CE/CD. L’union des échantillons se fait sous forte pression, et à leur interface est placé un gel de glycérine, dont l’indice de réfraction (1,5) est proche de celui de l’émail (1,65).
Cela permet d’obtenir différentes mesures : - Les coordonnées Cie L*a*b*.
- La contribution émail/dentine dans le changement de couleur de la dent : CTCC. - Le paramètre de translucidité de l’émail : TP.
1.3.1.3. Résultats
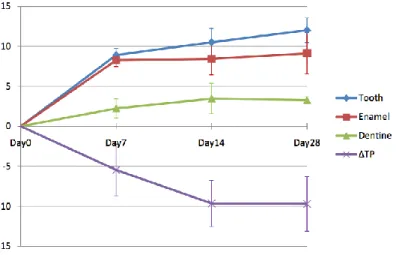
1.3.1.3.1. Luminosité et paramètre b
Après éclaircissement, les résultats donnent une nette augmentation de L (luminosité) (figure 1.7) et une nette diminution de b (jaune) pour les groupes BE/BD (dent complètement éclaircie, en bleu sur la figure) et BE (émail éclairci, en rouge sur la figure). Cela est significatif d’un éclaircissement, au cours duquel la luminosité augmente et la saturation en jaune diminue.
Pour le groupe BD (dentine éclaircie, en vert sur la figure) le paramètre L augmente très peu la première semaine et le paramètre b diminue lors de la deuxième semaine de traitement.
Figure 1.7 : Évolution de la luminosité (L) de la dent, de l’émail, et de la dentine.
La dentine gagne très peu en luminosité : 1 seule unité en 7 jours puis se stabilise quasiment. L’émail lui est éclairci de 5 unités en 1 semaine, puis son gain de luminosité se stabilise également. Finalement, la dent se trouve plus lumineuse, majoritairement grâce à la composante émail. De plus on peut noter que l’effet du traitement global en terme de luminosité est obtenu pour un peu plus que la moitié (3,5 unités /6) à l’issue de
la 1ère semaine.
Source : Ma et al. 54
Figure 1.8: Évolution de b de la dent, de l’émail et de la dentine.
Ce paramètre représente la variation de la teinte du bleu (-300) au jaune (+300). Après 28 jours de traitement, la dentine reste assez jaune, alors que la quantité de jaune dans l’émail diminue nettement. A l’échelle de la dent, une nette diminution du paramètre b est mise en évidence. Notons que cette désaturation amélaire en
jaune est assez rapide (1 semaine), comme précédemment pour l’augmentation de la luminosité. La désaturation dentinaire (alors que la dentine est plus jaune initialement) est beaucoup plus lente. C’est pour
cela que l’éclaircissement des dents calcifiées est indiqué sur une période prolongée.C’est aussi pour cette même raison que les dents âgées répondent moins bien ou moins vite que les dents jeunes (pour lesquelles il
n’y a pas eu d’apposition de dentinaire secondaire et/ou tertiaire). Source : Ma et al. 55
54 Ibid.
1.3.1.3.2. CTCC
Il s’agit de contribution émail/dentine dans le changement de couleur de la dent (figure 1.9).
Figure 1.9 : Évolution de la contribution émail/dentine dans le changement de couleur.
A n’importe quel stade du traitement, la contribution de l’émail dans le changement colorimétrique de la dent est plus importante que celle de la dentine. C’est pour cette raison que l’obtention du changement optique provoqué par l’éclaircissement peut être imputé à l’émail, majoritairement. Les dents présentant un volume dentinaire plus important que celui d’émail, sont donc plus difficilement éclaircies. Notons qu’après 1 mois de
traitement, la composante d’éclaircissement liée à la dentine augmente. Source : Ma et al. 56
Enfin, la mesure CTCC permet d’affirmer que la contribution de l’émail est plus importante que celle de la dentine, dans l’obtention du changement optique provoquée par l’éclaircissement.
1.3.1.3.3. TP
Il s’agit du paramètre de translucidité de l’émail (figure 1.10) ou transmittance.
Figure 1.10 : E : changement de couleur de l’émail, de la dentine et de la dent.
Le changement de couleur de l’émail est plus important que ce lui de la dentine. On peut donc penser que le changement de couleur de la dent éclaircie est majoritairement lié à ce lui de l’émail. TP : capacité de transmission de l’échantillon d’émail éclairci : par ailleurs, on note une franche diminution de la transmission lumineuse à travers l’émail. Ce graphique explicite donc l’opacification de l’échantillon éclairci. Le changement
global de la couleur de la dent est symétrique à l’augmentation d’opacification amélaire. Ainsi, ce graphique permet d’affirmer que la couleur de la dent éclaircie est liée à celle de l’émail.
Source : Ma et al. 57
1.3.2. Discussion
L’émail semble donc contribuer largement à l’éclaircissement des dents. Une combinaison d’éléments peut expliquer ce résultat :
- Notons tout d’abord que les produits éclaircissants sont déposés au contact direct de l’émail, il y a donc sûrement une concentration moindre de principe actif disponible pour la dentine, lorsqu’il a traversé l’épaisseur de l’émail.
- D’autre part, la mesure du paramètre de translucidité (figure 1.10), nous indique que l’émail perd en translucidité, lorsqu’il est soumis à du peroxyde de carbamide, le rendant ainsi plus opaque. Ainsi, moins de lumière est transmise - par le filtre amélaire - à la dentine, donc il en
57 Ibid.
résulte que la majeur part de la lumière réfléchie à l’œil provient de l’émail, et non de la dentine.
Il est difficile d’expliquer cette diminution de la translucidité amélaire. Selon Ma et al, il y aurait une élimination partielle des tissus minéraux et organiques de la dent par l’action oxydante des produits de blanchiment. Pour Eimar58 en revanche, le peroxyde de carbamide n’induit ni déminéralisation ni élimination de substance organique, mais provoque seulement une oxydation de la matière organique. Enfin, selon Goldberg 59 60, l’urée (issue de la dégradation du peroxyde d’hydrogène), dégrade la matrice organique de l’émail en clivant les liaisons hydrogène des protéines. Cette action de l’urée, engendrerait également une perte des cristaux d’hydroxyapatite intimement liés à cette matière organique (cette dernière représentant 4% du volume de l’émail). A partir de ces éléments, nous pouvons développer une théorie réfractive pour expliquer cette opacité de l’émail liée au traitement.
Une théorie réfractive
En effet, la modification au sein de la matière organique (que ce soit en faveur d’une simple oxydation ou carrément de sa dégradation), suffirait à ce que la distance entre les cristaux d’hydroxyapatite augmente, modifiant la structure cristalline de l’émail. Cette hétérogénéité amélaire induite par H2O2 et par l’urée engendre un milieu hétérogène en indice de réfraction61. La lumière incidente est réfractée au sein de l’émail et a donc du mal à être transmise. Le même type raisonnement pourrait être tenu s’il y avait une élimination partielle des tissus minéraux de la dent (hypothèse de Ma et al.), avec une augmentation de l’hétérogénéité du tissu et donc une augmentation du nombre des interfaces réfractives.
De plus, cette opacité serait accentuée, selon notamment Fondriest et al. 62 , par la déshydratation créée par l’éclaircissement. L’eau facilite la diffusion de la lumière au sein d’un milieu. Ainsi, la déshydratation amélaire réduit la possibilité de transmission lumineuse d’un cristal à l’autre. La dent apparaît donc moins translucide, réfléchit plus de lumière, et est donc plus lumineuse.
58 Eimar et al., « Hydrogen peroxide whitens teeth by oxidizing the organic structure ». 59 Goldberg, Arends, et Jongebloed, « Action of urea solutions on human enamel surfaces. »
60 Elfallah et Swain, « A review of the effect of vital teeth bleaching on the mechanical properties of tooth enamel. » 61 Denis et al., « White defects on enamel : diagnosis and anatomopathology : two essential factors for proper treatment (part 1) ».
L’instabilité colorimétrique des dents éclaircies, dans les semaines suivant le traitement, serait liée à leur réhydratation. Nous testerons cette hypothèse au chapitre 3 de cette thèse.
Enfin, l’éclaircissement entraîne aussi des modifications de l’état de surface de l’émail, qui font varier les trajectoires de la lumière et induisent plus ou moins de réflexion : une dent présentant des irrégularités de surface ne permettra pas à la lumière d'être transmise facilement, ce qui contribue à une opacité supplémentaire. Ainsi, la reminéralisation des surfaces dentaires suite à un traitement d’éclaircissement, via l’utilisation du Tooth Mouss (GC), bien qu’elle optimise l’état de surface des dents (indispensable pour limiter l’adhésion du biofilm), pourrait avoir tendance à limiter très légèrement sa luminosité, en augmentant la transmission de la lumière, au moins en surface.
1.3.3. Conclusion
Les modifications optiques de la dent éclaircie sont donc le résultat de plusieurs phénomènes : - un changement de teinte et de saturation, lié au changement de spectre de réflexion et
d’absorption de la lumière de la dent, suite à l’oxydation et/ou la dégradation des chromophores,
- un changement de translucidité de l’émail (opacification), lié au changement dans la manière dont la lumière interagit avec l’émail et la dentine, suite à la déshydratation et à la désorganisation structurelle de l’émail.
La lumière provenant d’une dent éclaircie et réfléchie à l’œil, est donc majoritairement issue de l’émail, devenu moins translucide et dont les chromophores ont été facilement dégradés. Cet émail éclairci est finalement moins saturé et plus lumineux.
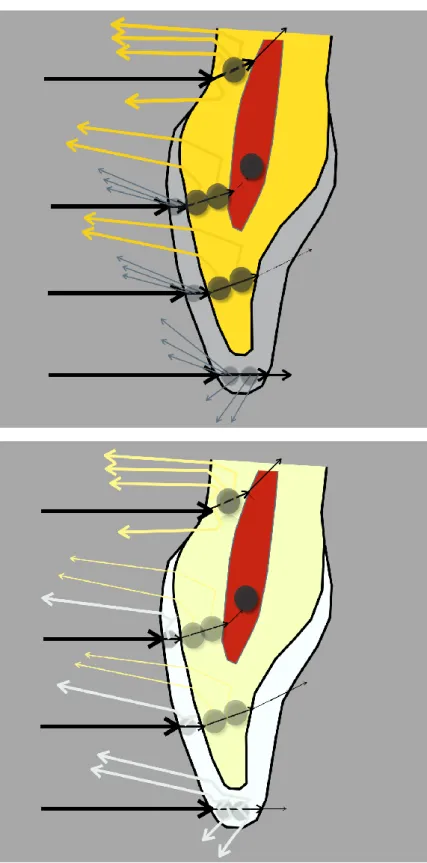
Au total, nous pouvons dire que la couleur d’une dent « éclaircie » est essentiellement influencée par l’émail, alors que celle de la dent « naturelle » provient en majorité de la dentine (figure 1.11).
Figure 1.11 : Propriétés optiques de la dent naturelle (en haut) et éclaircie (en bas).
La lumière réfléchie par une dent éclaircie, provient majoritairement de l’émail, devenu désaturé et surtout opacifié. Ainsi, moins de lumière est disponible pour la dentine, désaturée, elle aussi, par l’éclaircissement.
2:
Conséquences et applications cliniques
A travers le chapitre précédent, nous avons donc montré que le gain de luminosité obtenu lors d’un éclaircissement externe était principalement dû à la désaturation et à l’opacification de l’émail. Dans le chapitre qui suit, nous avons sélectionné différentes situations pour lesquelles ces nouvelles connaissances nous permettent de proposer des modifications du protocole du traitement d’éclaircissement. Ces modifications, adaptées à chaque situation, permettent d’en optimiser les résultats. Auparavant, nous rappellerons les modalités courantes de l’éclaircissement externe ambulatoire, seule technique utilisée ici, et nous parlerons du cas particulier de l’éclaircissement chez les mineurs.
2.1 Modalités courantes de l’éclaircissement
Tout au long de ce travail, notre thérapeutique de référence, sera l’éclaircissement externe ambulatoire tel qu’il a été décrit par Haywood et Heymann en 198963. Il s’agit, pour le patient, d’un port quotidien de gouttières thermoformables, maxillaire et mandibulaire, issues des moulages de ses arcades, permettant l’application d’un gel de peroxyde de carbamide à 10%, dont le pH avoisine la neutralité. Ces gouttières sont semi-rigides, et sans réservoir. Le design gingival n’importe que peu, en revanche, l’attention sera portée sur l’adaptation gouttière-dent qui nécessite d’être très précise pour une rétention maximale du produit.
La durée quotidienne de traitement est ajustée par le patient, afin de gérer au mieux ses sensibilités et d’être compatible avec son mode de vie, tout ceci permettant d’obtenir une bonne compliance, indispensable à ces protocoles de moyen terme. Le traitement commence par une heure de port quotidien, puis, jour après jour, le patient peut augmenter cette durée, si aucune sensibilité n’apparaît. Ainsi il peut s’étendre d’une heure à toute une nuit. Évidemment, plus la durée quotidienne de traitement est importante, plus le gain de luminosité est rapide. Toutefois, il est nécessaire pour la pérennité des résultats, de respecter un temps total de traitement de 3 à 4 semaines minimum. Le patient est régulièrement reçu (environ tous les 15 jours) pour évaluer le bon
déroulement du traitement et la nécessité de le poursuivre ou non. Lorsqu’une harmonie colorimétrique est obtenue à l’échelle du visage (par exemple en respectant le critère d’harmonie entre la sclérotique de l’œil et les dents), et/ou lorsque le patient est satisfait et les objectifs de traitement atteints, l’éclaircissement s’achève. Cependant, le traitement n’est pas terminé. En effet, s’en suivent une à deux semaines durant lesquelles a lieu un apport de phosphate de calcium amorphe (Tooth Mousse –GC) via le port des gouttières une heure par jour. Le patient entre ensuite en maintenance. Des séquences d’éclaircissement de 4 à 5 jours, tous les 4-5 ans permettent une stabilité à long terme des résultats.
2.2 Cas particulier de l’éclaircissement chez l’enfant
2.2.1. Pourquoi éclaircir les dents des enfants ?
Comme il a été dit plus haut, les dyschromies dentaires peuvent représenter un vrai handicap entraînant des difficultés personnelles et/ou sociales. Cela est vrai chez l’adulte, mais aussi chez l’enfant64 65 . C’est pour cela, que l’éclaircissement doit être aujourd’hui considéré comme une solution thérapeutique répondant à un besoin médical. Tout particulièrement chez les enfants, l’éclaircissement ne doit pas être effectué à la demande des parents qui souhaitent des dents plus blanches pour leur enfant. Ce dernier doit être demandeur. Il faut garder, surtout pour les enfants, un objectif médical au traitement d’éclaircissement.
2.2.2. Quels autres intérêts de l’éclaircissement chez l’enfant ?
Par ailleurs, les nombreuses propriétés suivantes du PC, rendent son utilisation très intéressante chez les jeunes, et notamment chez ceux, nombreux, en cours de traitement orthodontique :
- Action éclaircissante,
- Élévation du pH buccal permettant la réduction du risque carieux,
- Utilisation des gouttières d’éclaircissement pour l’administration de produit reminéralisant et/ou désensibilisant.
En effet, une combinaison de ces trois actions chez des enfants en cours de traitement orthodontique permet en outre une gestion des leucomes précarieux. Notons que des publications
64 Haywood, « The “bottom line” on bleaching 2008 ».
ont prouvé que le port d’une gouttière d’éclaircissement pendant l’établissement de la dentition adulte ne gênait en rien l’éruption dentaire66.
2.2.3. Quels risques et quels effets secondaires de l’éclaircissement chez l’enfant ?
Les jeunes dents présentent des pulpes élargies et donc une importante vascularisation. De ce fait, aucun dommage pulpaire, consécutif à un éclaircissement par PC à 10%, n’a été rapporté dans la littérature67. Nous rappelons aussi le consensus de littérature vis à vis de l’innocuité du peroxyde de carbamide à 10% à un pH avoisinant la neutralité68.
2.2.4. Quel produit pour l’éclaircissement chez l’enfant ?
Il semble logique d’utiliser chez l’enfant, à efficacité équivalente, la concentration de PC la plus faible possible, à savoir 10%. Récemment, l’arsenal pharmaceutique s’est agrandi avec la commercialisation de PC très faiblement concentré (5%) (une seule formule commerciale NOVON White Dental Beauty - Optident), particulièrement adaptée à ce genre de situations.
2.2.5. Quel protocole, quelles précautions pour l’éclaircissement chez l’enfant ?
Tout d’abord, notons qu’il n’y a quasiment pas de demande avant 10 ans. Le pic de demande se situe autour de l’âge de 15 ans (communication personnelle Linda Greenwall – Londres).
Nous modifierons légèrement le protocole chez les enfants en prenant les précautions suivantes : - Nous sélectionnerons les indications avec discernement en évaluant, comme pour toute thérapeutique médicale, le ratio bénéfice/risque/sécurité,
- Nous ferons la démonstration réglementaire au cabinet, et nous demanderons aux parents de contrôler la procédure,
- Nous contre-indiquerons le port nocturne et nous le restreindrons à 1 heure par jour,
- Nous limiterons l’éclaircissement aux dents antérieures visibles (6 à 10 dents antérieures maxillaires et mandibulaires),
- Nous insisterons sur le caractère obligatoire du rendez vous de contrôle à 15 jours.
66 Ibid.
67 Elhennawy et Schwendicke, « Managing molar-incisor hypomineralization : a systematic review ». 68 Haywood et al., « Effectiveness, side effects and long-term status of nightguard vital bleaching ».
2.2.6. Quelle réglementation pour l’éclaircissement chez l’enfant ?
Notons cependant que pour délivrer ces traitements à cette jeune population, il faudra attendre la modification de la directive européenne interdisant les éclaircissements chez les moins de 18 ans (directive du Conseil 2011/84/UE du 20 septembre 2011). Pour le moment nous savons que le CED (Council of European Dentist) a proposé à la commission de voter, au cours des mois de mai ou juin 2017, dix exceptions à cette loi :
- Dyschromie sur dents non vivantes, - Taches blanches sur dents antérieures,
- Taches jaunes ou marron sur dents antérieures, - MIH,
- Fluorose,
- Dyschromies liées aux antibiotiques,
- Dyschromies liées à des pathologies rénales ou du foie, - Amélogénèse imparfaite,
- Taches blanches post-orthodontiques,
- Toute opacité ou dyschromie qui affecte la qualité de vie de l’enfant.
Rappelons que la déclaration des droits de l’homme et du citoyen - qui sont donc aussi ceux des enfants - stipule que la santé orale est un droit de l’homme. C'est cet argument qui a convaincu le CED de l'urgence de modifier la réglementation européenne.
Au total, si la situation le justifie, non seulement l’éclaircissement peut être indiqué (avec discernement) chez l’enfant, mais il apparaît souvent comme la solution thérapeutique de choix.
2.3 Dents avec émail épais
2.3.1. Description
2.3.2. Mécanisme de l’éclaircissement
- Après éclaircissement, comme décrit plus haut, l’émail étant épais, l’opacification amélaire obtenue est importante. Il existe donc un masquage de la dentine saturée sous jacente.
- Par ailleurs, la désaturation se fait facilement car les chromophores ne sont pas encore agglutinés, comme ils le sont chez le sujet âgé69 (Figure 2.1)
Figure 2.1 : Organisation des chromophores chez un jeune.
Les chromophores ne sont pas encore agglutinés (à gauche), et ainsi leur oxydation par le produit d’éclaircissement se fait facilement (à droite).
Source : inspiré par Dr. Rod Khurty 70
2.3.3. Durée de traitement
Letemps de traitement est court, de 2 à 4-6 semaines (Figure 2.2).
69 Kurthy, « Why we see problems with teeth whitening : the science of whitening part 1 ». 70 Ibid.
Figure 2.2 : Exemple d’un traitement d’un mois chez un patient de 18 ans.
A gauche, photo avant ; à droite, photo après. L’augmentation de la luminosité, liée à l’opacification de l’émail épais et à la désaturation, est remarquable. L’équilibre regard/sourire est agréable. Notons l’harmonie
« blanc » de la sclérotique, « blanc » des dents. Source : Dr. Jean-Pierre Attal
2.3.4. Pronostic du traitement
Le pronostic du traitement est bon.2.4 Dent avec émail fin ou absent
2.4.1. Description
Nous prendrons comme exemple de description la dent érodée (figure 2.3)
Ce n’est pas une contre-indication de l’éclaircissement externe ambulatoire : en effet, un traitement au peroxyde de carbamide à 10%, contenu dans un produit ayant un pH proche de 7, n’a pas d’influence sur la déminéralisation engendrée par l’érosion71.
Il est cependant nécessaire de diagnostiquer d’éventuelles sensibilités préopératoires et de mettre en place un traitement curatif fonction de leur intensité, et ce avant le début de l’éclaircissement, afin de prévenir une possible aggravation lors de ce dernier. S’il n’existe aucune sensibilité préexistante, un traitement préventif (brossage avec un dentifrice contenant du nitrate de potassium, et/ou application directe dans la gouttière pendant 10 à 30 min quotidiennement)727374
71 Demarco et al., « Erosion and abrasion on dental structures undergoing at-home bleaching ». 72 Joshi, « An overview of vital teeth bleaching ».
73 Haywood, « Current status of nightguard vital bleaching ». 74 Greenwall, « Therapeutic aesthetics ».
sera également mis en place 15 jours avant l’éclaircissement et poursuivi pendant et après (comme lors de tout traitement d’éclaircissement, d’ailleurs). De plus, nous insisterons pour que le patient (présentant ou non des sensibilités pré-éclaircissement) commence son traitement par des temps d’application courts (1 heure), qu’il sera possible d’augmenter si les sensibilités ne se manifestent pas. Une surveillance particulière est à adopter.
Figure 2.3: Erosion vestibulaire marquée sur 21.
La persistance des contours amélaires est caractéristique de cette usure chimique. Elle laisse percevoir la dentine sous-jacente. L’émail érodé, aminci, quasiment pelliculaire au niveau du bord libre, augmente en
translucidité. On observe également des lésions abrasives cervicales, surtout dans le secteur 2. Source : Dr. Jean-Pierre Attal
2.4.2. Mécanisme de l’éclaircissement
L’érosion amélaire engendrant un amincissement de ce dernier, l’effet d’opacification est ici moindre. La qualité de l’éclaircissement est liée dans ce cas à la désaturation de l’émail, puis à celle de la dentine qui prendra le relais. Il faut donc une augmentation du temps de contact H2O2/dentine pour que la diffusion du peroxyde de carbamide puisse se faire en profondeur et qu’ainsi la dégradation des chromophores soit complète.
2.4.3. Durée du traitement
Le temps de traitement est long, de 6 à 8 semaines.
Le pronostic du traitement est bon. En effet, le peroxyde de carbamide est presque au contact direct de la dentine saturée car l’érosion aura créé une voie de diffusion. Toutefois, notons que si l’érosion est inactive, ou ancienne, on se retrouve alors avec une couche superficielle hyperminéralisée et dans cette situation l’éclaircissement est plus difficilement obtenu (cette situation est détaillée dans le chapitre 2.7 qui traite de l’éclaircissement des racines).
2.5 Dents âgées
Il n’est pas l’objet de cette thèse de discuter du bien fondé de l’éclaircissement chez les personnes âgées mais notons toutefois que, même chez les seniors, l’éclaircissement doit être considéré comme un traitement médical, comme c’est également le cas chez les enfants et les adultes. C’est une thérapeutique qui participe à l’amélioration de l’estime de soi et donc de la santé de l’individu, selon la définition qu’en fait l’OMS. D’ailleurs, la littérature rapporte que l’éclaircissement « rajeunit » le visage du patient de 10 ans en moyenne75. Que peut on donc faire de mieux que de permettre à un patient âgé, et peut être par ailleurs polypathologique, de retrouver, dans ces conditions, un sourire plus lumineux ?
2.5.1. Description
Avec l’âge, les dents deviennent moins lumineuses. Elles prennent une couleur jaune et parfois même un peu rouge/orangée voire marron.
En effet, le vieillissement des tissus dentaires, s’accompagne d’une réduction des composants organiques (majoritairement eau, protéines, et collagène) en faveur d’une hyperminéralisation de l’émail et de la dentine (notamment par l’apposition continue de dentine secondaire). La dent âgée devient alors un milieu optiquement relativement homogène : ainsi la diffusion en son sein diminue et elle apparaît plus translucide. De plus, il existe également très souvent une usure mécanique et/ou chimique des tissus dentaires, entrainant un amincissement de l’émail. Enfin, les colorants extrinsèques finissent par pénétrer dans l’épaisseur de la dent, contribuant à la saturation de dent. De ce fait, l’émail âgé, affiné et plus translucide, permet qu’une plus grande part (en comparaison avec une dent jeune) du rayon lumineux incident soit transmise à la dentine, devenue plus saturée
par les phénomènes décrits plus haut76. Au total, la dent âgée, par l’augmentation de la saturation et de la visibilité de la dentine, manque nettement de luminosité.
2.5.2. Mécanisme de l’éclaircissement
Dans cette situation, l’enjeu de l’éclaircissement est d’une part de réduire la portion de lumière disponible pour l’absorption dentinaire en augmentant l’opacité de l’émail (permise par une diminution de son homogénéité structurale), et d’autre part de désaturer la dentine en dégradant ces volumineux agglomérats de chromophores constitués tout au long de la vie.
La digestion des conglomérats chromophoriques nécessite l’allongement du temps de contact H2O2/dent, comme l’illustre la figure 2.4.
Figure 2.4 : Organisation des chromophores chez un adulte.
Agglomérats de chromophores chez le sujet âgé (à gauche) entrainant une diffusion difficile du peroxyde d’hydrogène en leur sein (à droite). Pour atteindre tous les chromophores « emprisonnés » dans les agrégats, le temps de contact nécessaire avec l’agent éclaircissant est forcément plus long (que lorsque ces agrégats ne
sont pas formés)
Source : inspiré par Dr. Rod Khurty 77
2.5.3. Durée de traitement
C’est pour cela qu’un éclaircissement chez une personne âgée présentant une réduction amélaire et une saturation importante, est long et peut s’étendre jusqu’à 8 à 10 semaines (versus en moyenne 2-4 semaines pour dents jeunes)78 (figure 2.5).
76 Zijp, « Optical properties of dental hard tissues ».
77 Kurthy, « Why we see problems with teeth whitening : the science of whitening part 1 ». 78 Haywood, « Nightguard vital bleaching : current concepts and research ».