Une exposition prénatale paternelle au mélange d’organochlorés
de l’Arctique altère la fertilité et la santé des fils dans un modèle
de rat
Thèse
Clotilde Maurice
Doctorat en sciences animales
Philosophiae doctor (Ph.D.)
Québec, Canada
© Clotilde Maurice, 2014
Résumé
Des niveaux d’élevés d’organochlorés (OC), incluant des pesticides et des produits industriels connus pour être des perturbateurs endocriniens, ont été détectés dans les populations humaines et animales en Arctique. Nous avons émis l’hypothèse qu’une exposition durant la vie précoce aux doses environnementales d’organochlorés qui contaminent l’Arctique, affecte la fonction et le développement reproducteur sur plusieurs générations avec une transmission paternelle dans un modèle de rat. Des femelles Sprague-Dawley (F0) ont été gavées avec le mélange d’organochlorés de l’Arctique (500 µg PCB/kg de masse corporelle/ 3X semaine) ou de l’huile de maïs (témoins) avant l’accouplement avec un mâle non traité et jusqu’à la mise bas de la portée F1. Après le sevrage, les mâles F1 ont été nourris avec de la nourriture commerciale et n’ont jamais été exposés directement aux organochlorés. À 90 jours après la naissance, les mâles de chaque génération ont été accouplés avec 2 femelles non traitées chacune pour engendrer des fœtus (19,5 jours de gestation) et des ratons de la génération suivante. Les mâles F1 exposés aux organochlorés et leur fils F2 ont eu un développement et des organes reproducteurs anormaux. Les F1 et F2 OC étaient sous-fertiles. Tous les F3 et F4 n’ont montré aucune différence avec les témoins. Les descendants F2, F3 et F4 de la lignée organochlorés ont été plus atteints par le situs inversus thoracalis que les générations témoins. De leur naissance jusqu’à l’âge adulte, les F2 OC ont montré un retard de croissance en comparaison aux témoins, en raison de leurs petits placentas. L’exposition prénatale au mélange d’organochlorés altère la méthylation de l’ADN spermatique des F1 et pourrait expliquer le phénotype anormal des fils F2 issus des pères F1 exposés aux organochlorés. Nos résultats suggèrent qu’une exposition prénatale au mélange d’organochlorés de l’Arctique sur un ancêtre mâle d’une famille provoque une dysfonction reproductive, mais aussi des pathologies du développement qui sont transmises par le père de façon transgénérationnelle. Ces observations représentent un des premiers modèles des effets écotoxicologiques sur la santé des descendants transmis par le père.
Abstract
Elevated levels of organochlorine, including pesticides and industrial compounds, some of which are known endocrine disruptors, have been reported in human and wildlife populations in Arctic. We hypothesized that early life exposure to Arctic organochlorine mixture, which contaminates Inuits, affects the reproductive development and function of subsequent generations in a paternally mediated manner on a rat model. Sprague-Dawley females (F0) were gavaged with Arctic concentrations of an organochlorine mixture (500 µg PCB/kg body weight/ 3X weekly) or corn oil (control) before mating with untreated males and until parturition of the F1 litters. After weaning, all F1 male pups were fed commercial chow and never directly exposed to organochlorine. At 90 days of age, F1 males (n = 15) were mated to 2 untreated females each to generate F2 fetuses (at 19.5 days of gestation) and pups. Males were similarly mated to produce the F3 and F2 generation. Prenatally-exposed F1 males and their sons F2 had abnormal reproductive organs, residual nipples, alteration of puberty onset, lower spermatid production per testis and less sperm in epididymis and were sub-fertile in compare with control males. All F3 and F4 males were identical to control males from the same generation. Despite this abnormality was not present in F1 generation, F2, F3 and F4 in organochlorine lineage were significantly more reached by situs inversus thoracalis than all control generations. From birth until adulthood, F2 from prenatally exposed F1 fathers have shown a growth delay compared to F2 control due to their smaller placenta. Prenatal organochlorine exposure alters F1 sperm DNA methylation and would involved in embryo development and might partly explain the developmental phenotype of F2 sons sired by prenatally-treated F1 organochlorine. Our results suggest that a prenatal exposure to Arctic concentrations of organochlorine of male ancestor resulted in a reproductive dysfunction but also developmental pathologies, which are transgenerational paternally mediated. These observations represent one of the first models of paternally mediated ecotoxicological effects on offspring health.
Tables des matières
Résumé ... III Abstract ... V Table des matières ... VII Liste des figures ... XI Liste des tableaux ... XIII Liste des abréviations ... XV Épigraphe ... XVII Remerciements ... XIX Avant-propos ... XXI
Chapitre 1 : Introduction
1. Les étapes sensibles du développement masculin, pouvant influencer la fertilité chez
les mammifères : deux espèces, l’Homme et le rat. ... 1
1.1. Développement et mise en place du tractus mâle chez le fœtus 1 1.1.1. Mise en place du testicule ... 1
1.1.2. Masculinisation du système reproducteur durant le développement ... 7
1.2. La puberté 10 1.3. La mise en place de la barrière hématotesticulaire 15 1.4. La spermatogenèse 16 1.4.1. Les cellules de Sertoli ... 16
1.4.2. La testostérone ... 17
1.4.3. Les oestrogènes ... 17
1.4.4. L’acide rétinoïque ... 18
1.4.5. Les divisions cellulaires ... 19
1.4.6. La spermiogénèse, étape finale de la spermatogenèse... 22
1.4.7. Les anomalies de la spermatogenèse ... 25
1.5. Acquisition du pouvoir fécondant des spermatozoïdes 25 1.5.1. La structure de l’épididyme ... 25
1.5.2. Les fonctions de l’épididyme ... 26
1.5.3. Les hormones qui contrôlent les fonctions épididymaires ... 27
1.5.4 Le plasma séminal ... 28
1.6. La fécondation 30 1.6.1. La capacitation... 30
2. Modifications des patrons épigénétiques : des étapes clés pour la fertilité et la santé
des mâles ... 36
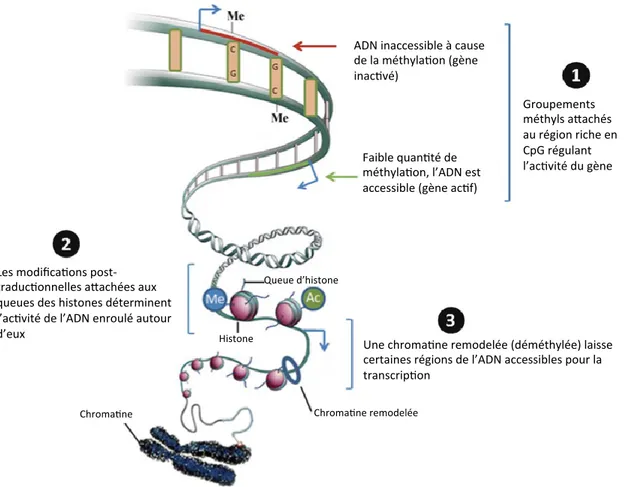
2.1. Sommaire des mécanismes de régulation en épigénétique 36 2.1.1. La méthylation et la déméthylation de l’ADN ... 36
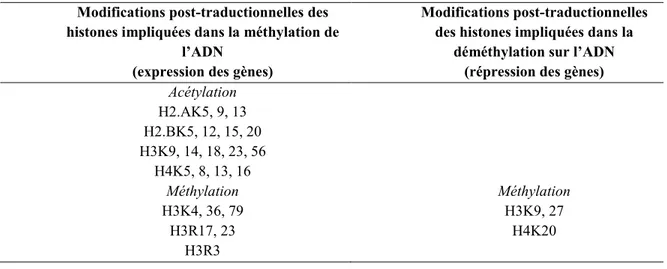
2.1.2. Les histones ... 38
2.1.3. Les ARN non codants ... 41
2.2. La programmation épigénétique des gamètes 42 2.2.1. Durant le développement dans les cellules germinales primaires ... 43
2.2.2. La régulation épigénétique dans la spermatogénèse ... 49
2.2.3. Un organe clé du développement : le placenta ... 51
2.3. Les anomalies des patrons épigénétiques du spermatozoïde et leurs conséquences sur la fertilité 54 2.4. Les effets multigénérationnels et transgénérationnels de la lignée paternelle 56 3. Les organochlorés, polluants organiques persistants dans l’environnement et perturbateurs endocriniens : impact sur la santé des mâles ... 59
3.1. Définition d’un organochloré 59 3.2. Les effets des organochlorés sur la santé des mammifères 61 3.2.1. La contamination de l’Arctique canadien et la santé de la faune ... 61
3.2.2. Les effets de la consommation des animaux exposés aux OC sur la santé animale ... 64
3.2.3. Contamination par les organochlorés : la santé des populations humaines ... 65
3.3. Les mélanges environnementaux 70 3.4. Un cas particulier : l’exposition chronique aux OC des Inuits du Nord du Québec, Nunavik et dans le Territoire du Nunavut. 75 4. Hypothèses et objectifs du projet de recherche ... 85
Chapitre 2 : Paternal exposure to Arctic contaminants alters the sperm
epigenome and induces negative pregnancy outcomes over multiple
generations
1. Résumé ... 902. Abstract ... 91
3. Introduction ... 92
4. Materials and methods... 94
Organochlorine mixture and animals ... 94
Early life exposure of F1 males ... 94
Analysis of the early life-exposed F1 pups and their F2, F3 and F4 offspring ... 95
F1, F2, and F3 male fertility and progeny outcomes ... 95
Post-mating reproductive assessment of F1, F2 and F3 adult males ... 96
Sperm quality assays ... 96
Sperm motion parameters ... 97
Capacitation assay ... 97
Sperm DNA protein composition ... 98
Sperm chromatin staibility assay ... 98
Testosterone assay ... 99
Reduced representation bisulfite sequencing (RRBS) on F1 sperm ... 99
Confirmation of RRBS by DNA pyrosequencing from F1, F2, F3 and F4 sperm ... 100
Histological evaluation of follicle numbers ... 100
Statistical analyses ... 101
5. Results ... 102
Female phenotype ... 102
Fathers expsoed to Arctic organochlorines early in life produce a lineage with developmental abnormalities in futur generations ... 102
Growth and congenital abnormalities ... 102
Male reproductive development ... 103
Sperm quality ... 103
The sons of fathers exposed to Arctic organochlorines are subfertile ... 104
Early life exposure to Arctic organochlorines alters the sperm epigenome ... 104
6. Discussion ... 106
7. Figures and Tables ... 111
8. Bibliography ... 135
Chapitre 3 : Prenatal exposure to an environmentally-relevant mixture
of Arctic contaminants decreases male reproductive function and
health in an aging rat model
1. Résumé ... 1442. Abstract ... 145
3. Introduction ... 146
4. Materials and methods ... 147
Prenatal treatment ... 147
Prenatal exposure of F1 males ... 147
Male fertility analysis ... 147
Lung histology ... 147
Reproductive assessment of young and old F1 males ... 148
Serum testosterone measurements ... 149
Statistical analyses ... 149
5. Results ... 150
Health of OC rats ... 150
6. Discussion ... 152
Prenatal exposure alters the health of aged males ... 152
Fertility decline due to prenatal exposure ... 153
Acknowledgements ... 154
7. Bibliography ... 155
8. Table and Figure ... 158
Chapitre 4 : Discussion
1. Résultats sur la fertilité et l’appareil reproducteur masculin : critiques des techniques utilisées. ... 169Les analyses de l'appareil reproducteur mâle ... 169
Les analyses de la qualité spermatique ... 171
Conclusions sur les techniques d'analyse du tractus masculin et de la qualité spermatique ... 177
L'analyse de la fertilité chez les rats ... 178
2. Critique du modèle rat et avantages à utiliser un modèle de grand mammifère ... 180
3. Les similarités et les différences de résultats sur la fertilité masculine et anomalies du développent reproducteur entre notre modèle et les populations humaines ... 181
Chez les populations Inuites ... 181
Chez les populations humaines du reste du monde exposé par les OC ... 184
4. Critiques des résultats sur l’épigénome spermatique des individus exposés ainsi que l’implication de ces résultats dans les populations Inuits ... 185
Les modifications de l'épigénome spermatique des mâles F1 exposés dans notre modèle . 185 Une transmission possible par la mère F0 exposée aux OC ... 188
L'application possible de nos résultqts dans les popiulations Inuites ... 188
5. Les perspectives du modèle ... 189
Listes des figures
Chapitre 1 : Introduction
Figure 1.1. Schématisation de la différenciation et de la migration des cellules durant les étapes de la mise en place du testicule fœtal. ... 6 Figure 1.2. Résumé des actions des hormones produites par les cellules de Sertoli et de Leydig dans le
testicule fœtal. ... 8 Figure 1.3. Schéma de l'axe gonado-hypothalo-hypophysaire et ses actions dans la spermatogenèse. ... 13 Figure 1.4. L’illustration résumée de la spermatogenèse. ... 21 Figure 1.5. Compaction de l'ADN spermatique durant la spermiogénèse. ... 25 Figure 1.6. A) Schéma d'un ovocyte et ces cellules environnantes. B) Schématisation des étapes
physiologiques de la capacitation jusqu’à la réaction acrosomale. ... 32 Figure 1.7. La représentation de l’ancien dogme et du nouveau de la fécondation chez les mammifères.
... 35 Figure 1.8. Mécanismes de méthylation et de déméthylation de l’ADN. ... 37 Figure 1.9. Les changements de niveaux de méthylation dans les cellules germinales parentales puis
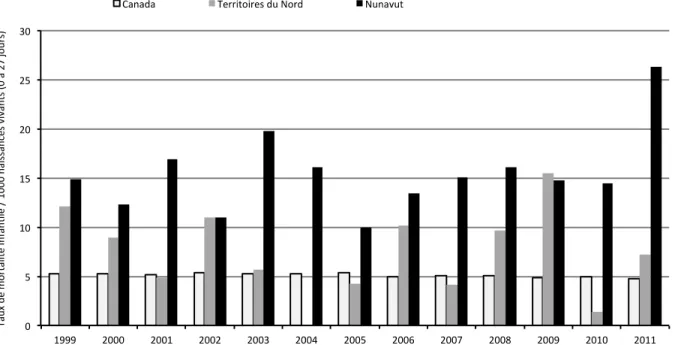
après fécondation dans le nouvel embryon chez les mammifères. ... 46 Figure 1.10. Famille moderne Inuite mangeant la nourriture traditionnelle ... 76 Figure 1.11. Mortalité infantile dans le Canada et les certains territoires sur 1000 naissances vivantes
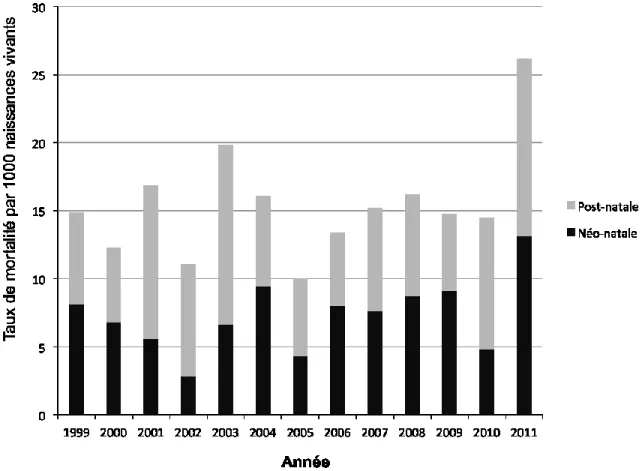
(entre 0 et 27 jours) entre 1999 et 2011. ... 80 Figure 1.12. Mortalité infantile séparée en mortalité néo-natale et post-natale dans le Nunavut entre
1999 et 2011. ... 82
Chapitre 2 : Paternal exposure to Arctic contaminants alters the sperm epigenome and induces negative pregnancy outcomes over multiple generations
Figure 2.1. Schematic diagram of the experimental.design. ... 140 Figure 2.2. Reproductive development for each paternal lineage generation (Control and OC). ... 143 Figure 2.3. Effects on early life exposure to the Arctic organochlorine mixture on the body weights of male pups in each generation of the paternal lineages. ... 144 Figure 2.4. Photographic examples of reproductive and developmental abnormalities in pups of the paternally-exposed male lineages compared to Controls. ... 146 Figure 2.5. Effects of early life exposure to the organochlorine mixture on sperm production and reproductive organ weights. ... 148 Figure 2.6. Numbers of differentially A) hypermethylated and hypomethylated genes and B) the distribution in intergenic, exon and intron of hyper- and hypomethylated genes modified more than once in sperm from early life exposed F1 fathers. ... 154 Figure 2.7. Numbers of differentially expressed genes sperm from early life exposed F1 fathers. ... 155 Figure 2.8. Pyrosequencing analysis after bisulfite conversion was carried out on sperm from the OC and Control paternal lineages (n = 6) to assess methylation levels of six CpG regions located in Tbx2 gene, which was hypermethylated in sperm from F1 rats that were prenatally exposed to OC, according to the RRBS analysis. ... 160 Figure 2.9. Pyrosequencing analysis after bisulfite conversion was carried out on sperm from the OC and Control paternal lineages (n = 6) to assess methylation levels of five CpG regions located in Twf2 gene, which was hypermethylated in sperm from F1 rats that were prenatally exposed to OC, according to the RRBS analysis. ... 161
Figure 2.10. Pyrosequencing analysis after bisulfite conversion was carried out on sperm from the OC and Control paternal lineages (n = 6) to assess methylation levels of four CpG regions located in Rapsn gene, which was hypomethylated in sperm from F1 rats that were prenatally exposed to OC, according to the RRBS analysis. ... 162
Chapitre 3: Prenatal exposure to an environmentally-relevant mixture of Arctic contaminants decreases male reproductive function and health in an aging rat model.
Figure 3.1. Impact of early life exposure to an environmentally-relevant concentration of the Arctic OC mixture on the body weights and lung histology of rats at different ages. ... 186
Listes des tableaux
Chapitre 1 : Introduction
Tableau 1.1 Chronologie de la différenciation de la gonade primitive en testicule fœtal ... 3 Tableau 1.2. Résumé des modifications d'histones qui activent ou désactivent la transcription de l’ADN. ... 40 Tableau 1.3. Travaux sur les mélanges de perturbateurs endocriniens classés par ordre croissant selon
la pertinence à une exposition environnementale ... 72 Tableau 1.4. Familles des polluants contaminant la nourriture traditionnelle des Inuits de l’Arctique . 78 Tableau 1.5. Liens entre une exposition prénatale à certains OC et une présence importante de
maladies chez les enfants du Nunavut et du Nunavik, Canada. ... 84
Chapitre 2 : Paternal exposure to Arctic contaminants alters the sperm epigenome and induces negative pregnancy outcomes over multiple generations
Table 2.1. Composition of the organochlorine mixture used in this study. ... 139 Table 2.2. Growth and fertility parameters of the F0 founder females that were gavaged with corn oil (Controls) or the Arctic organochlorine mixture (OC) and their F1 litters. ... 141 Table 2.3. Number of follicles in F0 founder females that were gavaged with corn oil (Control) or the Arctic organochlorine mixture (OC) and their F1 daughters. ... 142 Table 2.4. Neonatal and postnatal pup mortality according to paternal lineage (Control vs. OC) in each generation. ... 145 Table 2.5. Congenital defects according to paternal lineage (Control vs. OC) in each generation. ... 147
Table 2.6. Sperm quality parameters after 15 and 120 min at 37°C in 5% CO2 for each generation of
the paternal lineages at PND 90 (Control versus OC). ... 149 Table 2.7. Sperm chromatin fragmentation according to the Sperm Chromatin Structure Assay
(SCSA®) and quantity of sperm DNA protamine according to the Chomomycin A3 assay (CMA3) in each generation in of the OC or Control paternal lineage (n = 4). No differences are apparent between the paternal lineages. ... 151 Table 2.8. Fertility parameters according to paternal lineage (Control vs. OC) in each generation. ... 152 Table 2.9. Differentially-expressed genes in sperm from early F1 fathers that were prenatally-exposed to the organochlorine mixture. ... 153 Table 2.10. Hypermethylated genes implicated in biological process identified by Gene Ontology (GO) were differentially methylated in the sperm of F1 fathers that were prenatally-exposed to Arctic organochlorines compared to F1 Controls. ... 156 Table 2.11. Hypomethylated genes implicated in biological process identified by Gene Ontology (GO) were differentially methylated in the sperm of F1 fathers that were prenatally-exposed to Arctic organochlorines compared to F1 Controls. ... 157 Table 2.12. Differentially methylated genes in sperm of F1 fathers that were prenatally-exposed to Arctic organochlorines have been associated with cancers and human diseases. ... 159
Chapitre 3 : Prenatal exposure to an environmentally-relevant mixture of Arctic contaminants decreases male reproductive function and health in an aging rat model.
Table 3.1. Ratio of reproductive organ weight on body weight and fertility, sperm quantity and quality parameters of prenatally-exposed and Control males at PND 90 and PND 365. ... 187
Tableau 4.1. Les taux de mortalité infantile et d’anomalies du développement conduisant à la mort du nourrisson dans les populations Inuits, Premières Nations et non aborigènes du Canada. ... 191 Tableau 4.2. Les différences remarquables entre l’étude de Anway et ses coll., 2005 et notre étude. .. 193 Tableau 4.3. Les concentrations d’OC présentent dans le sang des mères Inuites et dans le sang des F0 gavées avec le mélange de 500 µg / kg de masse corporelle d’OC. ... 194 Tableau 4.4. Données préliminaires sur les protéines sous exprimées dans les membranes des
Liste des abréviations
ADN acide désoxyribonucléique AhR récepteur à l’hydrocarbon d’aryl
AMH hormone anti-Müllerienne (Anti-Müllerian hormone)
AR récepteurs aux androgènes
ARN acide ribonucléique
BER le système de réparation par excision de base BSP Binder of sperm homolog proteins
CASA Computer assisted sperm analysis CGP cellules germinales primitives
CpG zone de l’ADN avec Cytosine-phosphate-Guanine CTC chlortétracycline DDE dichlorodiphenyldichloroéthylène DDT dichlorodiphenyldichloroéthane DHEA déhydroépiandrostérone DHT dihydrotestostérone DNMT ADN (cytosine-5)-methytransferase
EFSA autorité européenne de sécurité des aliments
FSH hormone folliculo-stimulante (Follicle Stimulating Hormone) HBCD hexabromocyclododecane (organite de polybromodiphényléther) IGF1 Insulin-like growth facteur 1
Igf2 Insulin-like growth facteur 2 Insl3 l’insulin like hormone 3
LH hormone lutéinisante (Luteinizing Hormone)
GABA acide -aminobutyrique
GnRH gonadolibérine (Gonadotropin-Releasing Hormone) GPx glutathion peroxydase
hCG hormone gonadotropine chorionique (Chorionic Gonadotropin) NER le système de réparation par excision de nucléotide
NOAEL niveau avec aucun effet observé (No Observed Adverse Effect Level) NWT Northwest Territories Service
OC organochlorines
PBDE les polybromodiphényléthers PCBs les polychlorobiphényles PCR polycomb repressive complex
ROS dérivé réactif de l’oxygène (reactive oxygen species) RRBS Reduced representation bisulfite sequencing
SAM S-adenosylmethionine
SCSA sperm chromatine structure assay
Sod superoxyde dismutase
TGF – β facteurs de croissance de transformation bêta ZP3 protéine 3 de la zone pellucide
Il y a plus de courage que de talent dans la plupart des réussites. Félix Leclerc
Remerciements
Je remercie tout d’abord ma directrice, le Dre Janice Bailey d’avoir guidé, aidé et dirigé ma formation. Merci aussi pour sa grande patience avec moi. Merci à ma codirectrice, le Dre Sarah Kimmins pour tous ses excellents conseils et sa rigueur qui m’ont été très utiles pour progresser. Ce fut un grand honneur pour moi d’être parmi leurs étudiants. Je remercie aussi le Dr Jacques J Tremblay pour ses conseils et son enthousiasme sur mes résultats et pour m’avoir souvent adoptée dans son équipe pendant les congrès, ce fut vraiment agréable.
Je souhaite aussi remercier les organismes subventionnaires : le Fond Québécois de Recherche sur la Nature et les Technologies (FQRNT), le Réseau Québécois en Reproduction (RQR) ainsi que les Instituts de recherche en santé du Canada (IRSC).
Je tiens à souligner l’importance des personnes citées dans ce paragraphe dans la réussite de mes expériences durant cette thèse. Merci à toute l’équipe du Dre Sarah Kimmins et spécialement à Romain Lambrot pour son aide technique, ses excellents conseils pratiques et sa bonne humeur. Un grand merci à Marie-Ève Tremblay et mes merveilleuses étudiantes d’été Cyndi Ladouceur, Marine Petronio et Amélie Tremblay pour leurs aides durant les protocoles animaliers et les analyses spermatiques. Votre énergie, votre bonne humeur et votre motivation m’ont beaucoup aidée. Merci à Anthony Guernec pour tous ses précieux conseils, nos nombreuses sorties musicales toujours accompagnées d’une bonne bière.
Je voulais aussi remercier mes amies québécoises et étudiantes exceptionnelles du département, Geneviève Maher, Andréanne Martin, Julie Bernier, Nadia Bergeron et Marie-Pierre Fortier ainsi que la plus grande équipe de hockey de Québec depuis les Nordiques, les Domino’s, avec un spécial pour Jack, Martin-Serge, Simon et Mic « Dundee » pour leurs accueils chaleureux. Je ne serais jamais restée dans un pays aussi froid sans eux. Parce que derrière tous grands hommes il y a des femmes, merci à Julie et Dominique qui ont été si souvent d’un grand soutien. Un grand merci à mes parents qui ont financé la plus grande partie de mes études. Je remercie aussi mon amoureux, Benoît, pour être arrivé dans ma vie au bon moment et pour m’avoir soutenue jusqu’à la fin.
Avant-Propos
Cette thèse est présentée avec insertion d’articles et comporte quatre chapitres. Dans le premier, les connaissances sur la physiologie reproductrice mâle et en épigénétique nécessaires à la compréhension de l’impact de l’environnement sur la fertilité mâle et les modifications des profils épigénétiques transmis aux enfants par le père qui pourraient influencer l’évolution de maladies, sont abordées. Les données connues sur les effets des polluants organochlorés sur la santé des populations animales, mais aussi humaines de l’Arctique sont énoncées. L’objectif de cette introduction est d’établir des liens entre les connaissances que nous possédons sur ces trois domaines.
Le second chapitre est en préparation pour soumission dans le journal Proceedings of the National Academy of Sciences. Cette étude trace les phénotypes reproducteurs et développementaux de 4 générations de mâles issus d’un père d’une première génération exposé de façon prénatale au mélange d’organochlorés contaminant l’Arctique. J’ai effectué toutes les manipulations et analyses ainsi que toutes les mises au point et les élaborations de protocoles aider par plusieurs stagiaires d’été : Amélie Tremblay, Marine Petronio, Cyndi Ladouceur et Léah Domingue. Les analyses du niveau de méthylation au sein des spermatozoïdes des mâles F1 ont été faites par le Dr Serge McGraw et le Dr Donovan Chan dans le laboratoire de Jacquetta Trasler à l’Université McGill. Les données du pyrosençage ont été faites par Romain Lambrot, dans le laboratoire de Sarah Kimmins à l’Université McGill.
Le troisième chapitre a été soumis dans Journal of Developmental Origins of Health and Disease. Cette étude décrit les effets négatifs d’une exposition prénatale au mélange d’organochlorés contaminant l’Arctique sur la fertilité et la santé des mâles F1 âgés d’un an. J’ai effectué la plupart des expériences et Magaly Kaczmarczyk, étudiante au doctorat dans le laboratoire d’Yves Tremblay au centre de recherche du CHUL de Québec a effectué l’analyse des poumons.
Le dernier chapitre discute les résultats obtenus et énonce plusieurs perspectives intéressantes pour le modèle. Le Dre Janice Bailey a relu et corrigé tout le manuscrit.
Chapitre 1: Introduction
Ce chapitre d’introduction traite en premier lieu de l’appareil reproducteur mâle chez les mammifères, des étapes de la phase fœtale (la différenciation sexuelle) à celles de la puberté (début de la vie reproductive) qui influencent la fertilité durant la vie adulte, en décrivant surtout les aspects physiologiques et endocrinologiques. En second lieu, les mécanismes épigénétiques impliqués dans la transmission paternelle d’informations dans le développement et la santé de la descendance seront traités. En troisième lieu, la littérature sur des contaminants environnementaux comme les organochlorés sera analysée en raison des liens existants à la santé des individus des populations hautement exposées. L’introduction se termine par l’énoncé des hypothèses et objectifs du projet de recherche visant à établir l’impact d’une exposition prénatale au mélange environnemental d’organochlorés qui affectent les populations de l’Arctique sur la capacité des pères à avoir une descendance saine et sur une possible transmission transgénérationnelle des anomalies à travers la lignée paternelle.
1. Les étapes sensibles du développement masculin, pouvant influencer la
fertilité chez les mammifères : deux espèces, l’Homme et le rat.
1.1. Développement et mise en place du tractus mâle chez le fœtus
1.1.1. Mise en place du testicule
Le testicule occupe deux grandes fonctions : la gamétogenèse et la stéroïdogenèse. La gamétogenèse, c’est l’étape de mise en place et de développement des cellules germinales pendant la vie fœtale, mais comprend aussi la spermatogenèse, instaurée à la puberté, responsable de la production de spermatozoïdes. Quant à la stéroïdogenèse, elle correspond à la synthèse et la sécrétion des androgènes, principalement la testostérone et de la 17beta-estradiol par les cellules de Leydig présentes dans le testicule (fœtal et adulte).
À partir du cholestérol sanguin délivré à la membrane interne des mitochondries de la cellule de Leydig, l’enzyme CYP11A1 (cytochrome P450, famille 11, sous famille A, polypeptide 1; appelé aussi P450scc pour P450 side chain cleavage) fabrique de la prégnénolone (Rosol et al., 2013). Le phénomène de transport du cholestérol dans la mitochondrie implique des interactions entre la protéine StAR (Steroidogenic Acute Regulatory protein) et le récepteur périphérique à la benzodiazépine TSPO (translocator protein 18kDa ou Peripheral-type benzodiazepine receptor) (Papadopoulos, 2004). Chez le rat, la prégnénolone quitte la mitochondrie et rejoint le réticulum endoplasmique lisse, où elle est convertie en progestérone par la 3β-hydroxystéroïde déshydrogénase (Rosol et al., 2013). La progestérone est transformée en androstènedione par la CYP17A1 (cytochrome P450, famille 17, sous famille A, polypeptide 1), puis convertie en testostérone par la 17β-hydroxystéroïde déshydrogénase (Payne et Hales, 2004). Chez l’homme, la prégnénolone est convertie en 17OHprégnénolone par la Cytp450-c17 puis transformée en déhydroépiandrostérone (DHEA) par la même enzyme (Rosol et al., 2013). La DHEA est ensuite transformée en androstènedione par 3β-hydroxystéroïde déshydrogénase puis en testostérone par la 17β-hydroxystéroïde déshydrogénase (Rosol et al., 2013).
Différenciation de la gonade primaire en testicule fœtal
Le tableau 1.1 résume chronologiquement les étapes cruciales du développement du testicule fœtal. La figure 1.1 schématise les différenciations et migrations des différents types cellulaires durant le développement testiculaire fœtal.
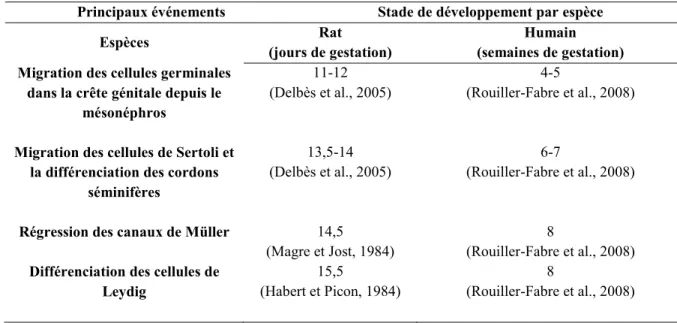
Tableau 1.1. Chronologie de la différenciation de la gonade primitive en testicule fœtal
Principaux événements Stade de développement par espèce
Espèces Rat
(jours de gestation)
Humain
(semaines de gestation) Migration des cellules germinales
dans la crête génitale depuis le mésonéphros
11-12 (Delbès et al., 2005)
4-5
(Rouiller-Fabre et al., 2008)
Migration des cellules de Sertoli et la différenciation des cordons
séminifères
13,5-14 (Delbès et al., 2005)
6-7
(Rouiller-Fabre et al., 2008)
Régression des canaux de Müller 14,5
(Magre et Jost, 1984)
8
(Rouiller-Fabre et al., 2008)
Différenciation des cellules de Leydig
15,5
(Habert et Picon, 1984)
8
D’après les parties de la figure 1 :
La différenciation sexuelle des gonades primitives en testicule est régulée par l’expression de nombreux gènes dont Sry (Koopman, et al., 1991), Sox-9 (Vidal et al., 2001), Sf1 (De Santa Barbara et al., 1998) et Wt1 (Hammes et al., 2001). Sry initie la cascade de gènes régulant la différenciation de la gonade primaire en testicule. Sox-9 et Sf1 s’expriment dans les futures cellules de Sertoli qui produiront l’hormone anti-Müllérienne (AMH) qui bloque l’évolution de l’appareil reproducteur femelle (Koopman, 1999). L’AMH est présente chez tous les mammifères placentaires (Josso et di Clemente, 1999). C’est une protéine hormonale membre de la famille des facteurs de croissance de transformation bêta (TGF- β) (Josso et di Clemente, 1999). Les protéines WT1 et SF1 sont impliquées dans la régulation de l’expression de Sry (Koopman, 1999). Une fois, la différenciation sexuelle mâle déclenchée, le testicule se forme par étape :
1) La gonade primitive (gonade bipotentielle), appelée aussi crête génitale, à pour origine le mésonéphros. C’est à partir du 11e jour de gestation chez le rat et à partir de la 4e semaine de grossesse chez l’homme que les crêtes génitales se forment et que les cellules germinales primitives (CGPs) les colonisent (George et Wilson, 1994). Les CGP, une fois dans la gonade, prolifèrent activement.
2) et 3) Les cellules de Sertoli migrent à partir du mésonéphros dans le testicule pour englober les CPGs pour former les cordons séminifères puis se différentient dans le testicule fœtal (Karl et Capel, 1998; Skinner et al., 1985) dès 13,5 jours de gestation chez le rat et entre 42 et 45 jours de grossesse chez l’homme (Tilmann et Capel, 1999). À ce moment-là, les CGPs sont appelées gonocytes (Delbès et al., 2005). L’AMH est produite par les cellules de Sertoli avant la formation des cordons. Durant le développement prénatal, une hausse de production de l’AMH suivit par la production de testostérone aide la gonade primaire à se différencier en testicule (Sharpe, 2006). La population des cellules de Sertoli adultes prolifère pendant la gestation puis le taux de division diminue. Finalement la prolifération s’arrête après la naissance car le nombre de cellules de Sertoli est limité dans le testicule (Rasoulpour et al., 2010). La testostérone participe à la régulation du nombre de cellules de Sertoli durant la gestation mais aussi durant la vie adulte. Une souris transgénique mâle dont les récepteurs aux androgènes (AR) ont été coupés, montre 30 à 50 % de cellules de Sertoli en moins que les sauvages à la naissance et
60 à 75 % en moins chez les transgéniques (Tan et al., 2005). Les récepteurs aux androgènes font partie de la sous famille 3 des récepteurs nucléaires, groupe C et membre 4 (Sharpe, 2006).
4) Chez les humains et les rongeurs, les cellules de Leydig fœtales produisent deux hormones nécessaires à la masculinisation du fœtus : la testostérone et l’insulin like hormone 3 (Insl3) qui induit la descente testiculaire intra-abdominale (Sharpe, 2006). Chez l’humain, il semble que l’acide rétinoïque soit un régulateur de la stéroïdogenèse de la cellule de Leydig fœtale (Lambrot et al., 2006). Chez les humains, la LH stimule la production de testostérone à partir de 7 semaines de gestations (Lambrot et al., 2006). En même temps, les précurseurs des cellules de Leydig adultes venant du mésonéphros, migrent dans le testicule et se multiplient. Leur nombre est déterminé durant la vie fœtale. Leur différenciation viendra juste avant la puberté (Sharpe, 2006).
Figure 1.1. Schématisation de la différenciation et de la migration des cellules durant les étapes de la mise en place du testicule fœtal, adapté de Sharpe 2006 (droits obtenus). La différenciation du testicule de
la crête génitale commence par 1) la migration des cellules germinales dans la gonade primitive, suivie par 2) la différenciation et la migration des cellules de Sertoli qui entourent les cellules germinales puis 3) la différenciation et la migration des cellules péritubulaires du mésonéphros pour entourer les cellules de Sertoli et les cellules germinales (formation des cordes séminifères) et pour finir 4) la différenciation et la migration des cellules de Leydig dans les régions inter-cordales (interstitielles). Ces étapes se chevauchent durant le développement.
L’acide rétinoïque facteur de développement du testicule
L’acide rétinoïque est un métabolite de la vitamine A (rétinol), produit par le foie et les intestins. Les récepteurs à l’acide rétinoïque sont nucléaires et présents sur la cellule de Sertoli (RAR-β et γ; RXRγ), la cellule de Leydig (RAR-α, β et γ; RXRα, β et γ ) et les cellules germinales fœtales (RAR-α, β et γ; RXRα et γ ) chez le rat et l’homme (Boulogne et al., 1999; Cupp et al., 1999). Après la naissance, tous les différents récepteurs sont présents sur les cellules du testicule jusqu’à la vie adulte (Boulogne et al., 1999; Dufour et Kim,1999). L’acide rétinoïque diminue la prolifération des gonocytes fœtales et néonatals en régulant l’apoptose et la mitose par activation du récepteur RAR-α (Boulogne et al., 1999; Livera et al., 2000 et 2001). Chez les fœtus de rats, l’acide rétinoïque réduit la sécrétion de testostérone en agissant sur les cellules de Leydig fœtales (Livera et al., 2000). Cependant en présence de fortes doses de LH dans des cellules de rats fœtales in vitro, l’acide rétinoïque stimule la production de testostérone chez les cellules de Leydig (Lambrot et al., 2006).
1.1.2. Masculinisation du système reproducteur durant le développement
La masculinisation du tractus continue grâce à la différenciation de la gonade primaire en testicule qui commence à produire la testostérone, la DHT, l’AMH et Insl3 pour la mise en place du tractus masculin (Sharpe, 2006). L’AMH est libéré dans le sang par les cellules de Sertoli et l’Insl3 par les cellules de Leydig (Sharpe, 2006). La dihydrotestostérone (DHT) est produite à partir de la conversion de la testostérone par l’enzyme 5-réductase produite par la prostate et par la peau de la région génitale chez le fœtus (Sharpe, 2006). La production et les effets des différentes hormones sont schématisés à la figure 1.2. La testostérone permet la régulation de la croissance et la maturation des gonocytes majoritairement (car les gonocytes ont des récepteurs à la testostérone) par la cellule de Sertoli avec qu’ils partagent des jonctions adhérentes (van Dissel-Emiliani et al., 1993).
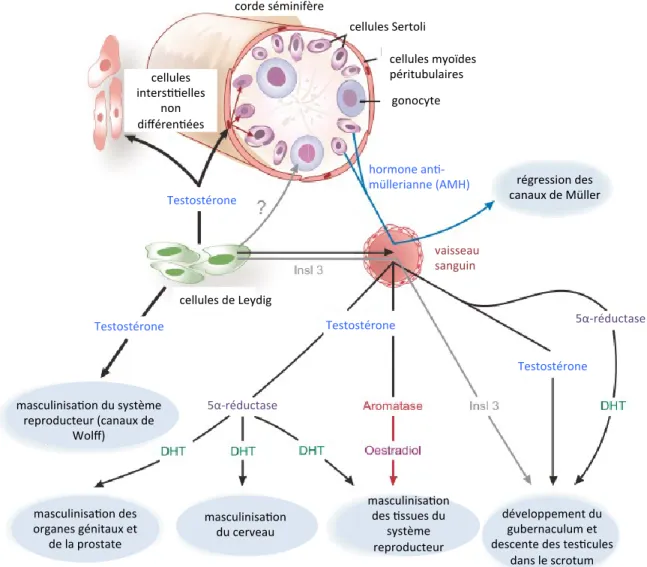
Figure 1.2. Résumé des actions des hormones produites par les cellules de Sertoli et de Leydig dans le testicule fœtal adapté de Sharpe 2006 (droits obtenus). Le schéma illustre les sites de production et les
voies pour atteindre les tissus cibles de la testostérone, de l’Insl3 et de l’AMH, responsables du processus de masculinisation du fœtus mâle. La majorité des effets hormonaux sont obtenus après le passage de l’hormone dans le système sanguin qui alimente tous les tissus cibles. L’exception est la testostérone qui agit sur le canal de Wolff par un mécanisme de transport local. Les tissus périphériques sont touchés par la DHT et l’œstradiol après la conversion de la testostérone.
Différenciation du canal de Wolff
Deux types de canaux sont présents chez l’embryon lors du stade indifférencié du développement de l’appareil génital des mammifères et proviennent du canal rénal du mésonéphros (Sajjad, 2010). Le canal de Müller est le futur tractus femelle (Goldman et Cooper, 2010) alors que le canal de Wolff forme en partie l’urètre (le reste vient du canal de Müller), les vésicules séminales, les épididymes et le canal déférent, future voie génitale mâle (Rasoulpour et al., 2010; Sajjad, 2010). L’AMH produite par les cellules de Sertoli, engendre une résorption des canaux de Müller alors que le canal de Wolff sera stabilisé par la testostérone produite par les cellules de Leydig (Sajjad, 2010; Sharpe, 2006).
La descente testiculaire
Les testicules embryonnaires se trouvent en dessous du mésonéphros et sont maintenus dans l’abdomen par deux ligaments : le ligament suspenseur qui se trouve au pôle apical et le gubernaculum testis au pôle caudal du testicule. Dû en majeure partie à l’action de Insl3 et par la testostérone produite par les cellules de Leydig (Figure 2), le ligament suspenseur disparait tandis que le gubernaculum testis se contracte et se rétrécit ce qui tire le testicule vers le bassin. C’est la descente intra-abdominale du testicule (Bay et al., 2011; Rasoulpour et al., 2010; Sharpe, 2006). Par action de la testostérone seule, le testicule se loge au fond d’une hernie de la paroi abdominale (processus vaginalis), à l’intérieur de bourrelets génitaux qui se transforment en scrotum (Bay et al., 2011). Les testicules descendent à l’intérieur du scrotum grâce à la contraction du gubernaculum dans le scrotum à 16 jours après la naissance chez le rat (Tyl, 2002), et à 35 semaines de grossesse chez l’homme (Bay et al., 2011). Chez le rat comme chez l’homme, l’oestradiol provenant de la mère et de la conversion de la testostérone par l’aromatase dans la cellule de Leydig, aide au bon développement de la prostate et du pénis (Rasoulpour et al., 2010; Sharpe, 2006). Cependant la DHT a un effet plus fort sur la masculinisation du tractus et du cerveau des mâles (Sharpe, 2006).
La mise en place du tractus masculin (exemple : descente testiculaire, masculinisation des voies génitales, organes reproducteurs) est dépendante des androgènes et des œstrogènes
(Creasy et Chapin, 2013). Des anomalies dans la synthèse ou l’action des androgènes provoquent des anomalies du développement du tractus mâle comme la cryptorchidie (la non-descente testiculaire dans le scrotum), qui résulte d’un manque d’effet de Insl3 ou de la testostérone, et l’hypospadias (ouverture de l’urètre sur la face inférieure du pénis au lieu de l’extrémité) qui résulte d’un faible niveau de testostérone (MacLaughlin et Donahoe, 2004; Sharpe, 2006). Ces anomalies du système reproducteur mâle trouvent leurs origines durant cette phase sensible de développement qu’est la différenciation sexuelle du tractus mâle et peuvent être à l’origine de problème de fertilité adulte (Sharpe, 2001).
1.2. La puberté
Le début de la puberté se fait 30 jours après la naissance chez le rat mâle (Rasoulpour et al., 2010) et entre 11 et 12 ans chez les garçons (Tinggaard et al., 2012). Chez le rat, le seul moyen physique d’observer la mise en place de la puberté est la séparation du prépuce sur le pénis (Boekelheide et Chapin, 2005; Creasy et Chapin, 2013; Rasoulpour et al., 2010). Chez l’homme, la séparation du prépuce s’effectue durant la grossesse et n’a aucun lien avec la puberté (Rasoulpour et al., 2010). Ce sont des traits physiques de l’homme comme la mue de la voix, le développement de la pilosité, la croissance et l’augmentation du volume testiculaire dû à l’activité spermatique des tubes séminifères, qui marquent la puberté (Tinggaard et al., 2012).
L’axe gonado-hypothalamo-hypophysaire
L’axe gonado-hypothalamo-hypophysaire est impliqué dans le déclenchement de la puberté. Une augmentation de la pulsatilité de la gonadotropin-releasing hormone (GnRH) secrétée par l’hypothalamus, stimule les productions de gonadotropines, qui sont les hormones produites par l’adénohypophyse (lobe antérieur de l’hypophyse) : la folliculostimuline (FSH) et l’hormone lutéinisante (LH) (Lewis et Lee, 2009; Tinggaard et al., 2012). Les kisspeptines, une famille de neuropeptidiques, produits par l’hypothalamus influencent le déclenchement de la puberté en régulant la pulsativité de la sécrétion de la GnRH (Buck Louis et al., 2008; Tinggaard et al., 2012).
Après injection de kisspeptines in vivo et ex vivo à des rats mâles non pubères (5, 15 et 25 jours après la naissance), les niveaux de productions de GnRH de l’hypothalamus et de LH sanguin ont augmenté ayant pour conséquence l’avancement de la puberté chez ces individus (Castellano et al., 2006). D’autres études ont montré la présence du récepteur à la leptine (LepR) sur les neurones à kisspeptines des rongeurs et des moutons (Backholer et al., 2010; Smith et al., 2006). Des souris déficientes en leptine (ob/ob) produisent moins d’ARN messagers de Kiss1 dû à un plus faible nombre de neurones à kisspeptines dans ces animaux contrairement aux souris sauvages (Quennell et al., 2011). Les animaux déficients en leptine ne montrent pas de puberté sauf après une injection de leptine à l’âge de la puberté (Quennell et al., 2011). La leptine et les kisspeptines sont essentiels pour le déclenchement de la puberté chez les rongeurs, mais aussi chez l’homme. Chez l’homme, une lignée de cellules neuronales exprimant Kiss1 a augmenté sa production d’ARN messagers suite à une stimulation à la leptine (Morelli et al., 2008).
La FSH agit sur les cellules de Sertoli. Si les cellules de Sertoli sont saturées par la FSH, celles-ci produisent l’inhibine B, pour rétro-inhibiher l’hypothalamus qui change la pulsativité de la GnRH et ainsi diminue la production de FSH (Tinggaard et al., 2012). La LH induit l’augmentation de la production de testostérone par les cellules de Leydig (Tinggaard et al., 2012). La testostérone, en grande quantité, rétro-inhibe la production de LH via une modification de la pulsativité de la GnRH. Les mécanismes qui régissent l’activation de l’axe gonado-hypothalamo-hypophysaire sont encore mal connus chez les rongeurs, les primates non humains et les humains (Buck Louis et al., 2008; Tinggaard et al., 2012).
La LH stimule les cellules de Leydig qui sécrètent la testostérone, essentielle à l’activité de support des cellules de Sertoli. La testostérone créée aussi une rétro-inhibition sur l’hypothalamus pour modifier la pulsativité de la GnRH qui arrête la production de LH (Figure 1.3) (Rasoulpour et al., 2010; Sharma et Agarwal, 2011). La testostérone a un rôle de maintien des caractères sexuels primaires (maintien des activités des organes reproducteurs : érection, spermatogenèse, prostate, vésicule séminale) et secondaire (ex. : développement musculaire, pilosité) (Rasoulpour et al., 2010; Tinggaard et al., 2012).
La FSH agit directement sur la cellule de Sertoli qui sécrète l’activine, hormone qui maintient la spermatogenèse (Figure 1.3) (Rasoulpour et al., 2010; Sharma et Agarwal, 2011). La cellule de Sertoli est stimulée par la FSH dont elle régule la production par un effet de rétro-inhibition sur l’adénohypophyse en sécrétant l’inhibine (Figure 1.3) (Rasoulpour et al., 2010; Sharma et Agarwal, 2011).
Figure 1.3. Schéma de l'axe gonado-hypothalo-hypophysaire et ses actions dans la spermatogenèse. La
production de spermatozoïdes est sous le double contrôle des cellules de Sertoli (cellules nourricières et activatrices de la spermatogénèse) et de la testostérone, hormone produite par les cellules de Leydig (les cellules interstitielles situées entre les tubes séminifères). Le complexe hypothalamo-hypophysaire contrôle l'activité des testicules par le biais de la FSH et de la LH. La testostérone, outre son rôle dans l'activation de la spermatogénèse et dans le développement des caractères sexuels secondaires, exerce un rétrocontrôle négatif sur l'hypophyse et l'hypothalamus.
Les facteurs métaboliques et nutritionnels
Le déclenchement de la puberté est influencé par des facteurs métaboliques et nutritionnels comme le rapport poids-taille. Le poids est lié avec la leptine qui stimule les kisspeptines et la pulsativité de la GnRH (Elias, 2012). La croissance dépend en partie de l’hormone de croissance ou somatotrophine secrétée par l’adénohypophyse qui stimule la production d’insulin-like growth factor 1 (Igf1) par le foie. Ce facteur de croissance agit sur la croissance cellulaire de l’individu spécialement des muscles, des os, du cartilage, du foie, des reins et de la peau due à la présence de récepteur Igf1 dans ces cellules (DiVall et al, 2010). Les neurones à GnRH de l’hypothalamus contiennent des récepteurs Igf1 qui stimulent la production de GnRH (DiVall et al, 2010). Il est nécessaire pour l’individu d’atteindre un ratio masse corporelle sur la taille qui permet une production suffisante de leptine et d’Igf1 (ex : puberté précoce chez les enfants obèses due à une augmentation de leptine) (Ahmed et al., 2009; Marcovecchio et Chiarelli, 2013).
L’épigénétique
Il y a plusieurs gènes qui contrôlent la production de GnRH comme KiSS1, GNRHR, GPR54 et TAC3 qui agissent en réseaux (Ojeda et al., 2010). Dans un modèle de rat femelle, Lomniczi et coll., en 2013 ont montré que l’expression du gène KiSS1 dans les neurones KNDy (neurones à kisspeptines), activateurs des neurones à GnRH pour la mise en route de la puberté, dépendait des modifications post-traductionnelles de l’histone H3 (H3k914ac, H3k9me3 et H3K27me3). La mise en place de ce code d’histone permet l’augmentation de la méthylation des promoteurs des gènes (Cbx7, Eed et Yyl) de la famille des PcG (Polycomb-group proteins) ce qui diminue leurs expressions juste avant la puberté (Lomniczi et al., 2013). Les protéines (CBX7, EED et YYL) se retirent du promoteur de KiSS1 et l’ARN polymérase 2 se met en place pour commencer la transcription, ainsi l’expression de KiSS1 augmente rapidement suivit de la GnRH (Lomniczi et al., 2013). Ce système a été développé chez les femelles mais on peut imaginer un système identique chez le mâle (Lomniczi et al., 2013).
La puberté permet la mise en place de la fonction reproductrice mâle en déclenchant la spermatogenèse, la maturation du spermatozoïde dans l’épididyme, la production de plasma séminal, les fonctions érectiles et l’éjaculation (Rasoulpour et al., 2010).
La puberté étant régulée principalement par des hormones, les perturbations de celles-ci peuvent augmenter ou baisser l’âge du début de la puberté. Des changements dans l’âge de la puberté peuvent déclencher des problèmes sur le système reproducteur mâle comme un hypogonadisme hypogonadotrope (insuffisance de fonctionnement des gonades par manque de stimulation en provenance de l’axe hypothalamo-hypophysaire) ce qui provoque une baisse de la testostérone circulante et altère la régulation de la spermatogenèse (Mantovani, 2011). Ces anomalies peuvent diminuer la qualité spermatique et la fertilité de l’individu adulte (Euling et al., 2008).
1.3. La mise en place de la barrière hématotesticulaire
La barrière hématotesticulaire protège les spermatocytes jusqu’aux spermatozoïdes du système immunitaire (Creasy et Chapin, 2013). Toutes les cellules après la méiose I, portent un matériel génétique et des antigènes différents des cellules somatiques de l’individu (Creasy et Chapin, 2013). S’il n’y avait pas la barrière testiculaire, le système immunitaire considèrerait les spermatozoïdes comme des cellules étrangères et les détruirait (Creasy et Chapin, 2013).
La barrière hématotesticulaire est composée de jonctions serrées qui rejoignent les cellules de Sertoli (Creasy et Chapin, 2013). Elle est mise en place vers 14 jours après la naissance chez le rat (Creasy et Chapin, 2013; Rasoulpour et al., 2010). Chez l’homme, la barrière se construit par apparition de plaques de jonctions communicantes entre les cellules de Sertoli à partir de 5 ans jusqu’à la puberté où elle finira de se former (Rasoulpour et al., 2010).
1.4. La spermatogenèse
Avant la puberté, le niveau d’œstrogène produit par les cellules de Leydig, diminue la production de testostérone par rétro-inhibition puis quand la puberté commence, le niveau d’œstrogène chute pour permettre une production de testostérone intensive via la forte stimulation des cellules de Leydig par la LH qui amorce la spermatogenèse (Sharma et Agarwal, 2011).
1.4.1. Les cellules de Sertoli
La mise en place et le bon fonctionnement de la spermatogenèse dans les testicules sont importants dans la vie reproductive, car la spermatogenèse permet la production des spermatozoïdes, gamète reproducteur mâle, chez l’homme comme chez le rat. La production journalière de spermatozoïdes par gramme de testicule est d’environ 5 millions pour un homme et de 20 millions pour un rat (Hess et de Franca, 2009). D’après Hess et de Franca, 2009, une forte efficacité de la spermatogenèse (haute production spermatique) est le résultat de la combinaison entre un support important des cellules de Sertoli pour les cellules germinales et un grand nombre de cellules de Sertoli par gramme de testicule. La cellule de Sertoli occupe donc des fonctions importantes (Sharma et Agarwal, 2011) : 1. Le maintien de l’intégrité des épithéliums des tubes de séminifères
2. La compartimentalisation des épithéliums des tubes séminifères
3. La sécrétion de fluide dans la lumière du tube séminifère pour le transport des spermatozoïdes
4. La participation à la spermiation en phagocytant le cytoplasme de la spermatide allongée qui se détache de l’épithélium du tube séminifère.
5. La nutrition les cellules germinales 6. La sécrétion d’hormones
7. La régulation du cycle de spermatogenèse
Même si la cellule de Sertoli est nécessaire au support métabolique des cellules germinales, les hormones provenant de l’axe gonado-hypothalamo-hypophysaire sont aussi importantes pour l’activité et le maintien de la spermatogenèse (Sharma et Agarwal, 2011).
1.4.2. La testostérone
La testostérone est nécessaire pour le maintien de la spermatogénèse et pour inhiber le processus d’apoptose des cellules germinales (Singh et al., 1995). Les tubes séminifères des testicules sont exposés à une concentration de testostérone 25 à 100 fois plus grande que dans le système sanguin, c’est une régulation paracrine (Sun et al., 1989). La testostérone n’agit pas directement sur les cellules germinales, mais à travers les cellules de Sertoli qui possèdent des récepteurs aux androgènes (AR). Ces récepteurs sont nucléaires, permettent la transcription de l’ADN (Mooradian et al., 1987). Sous l’influence de la testostérone, la cellule de Sertoli produit de l’inhibine, de l’activine (voir 1.2. La puberté), mais aussi de la transferrine (bêta globuline synthétisée aussi par le foie) qui transporte les molécules de fer à travers les jonctions serrées jusqu’aux différentes cellules germinales (Kierszenbaum, 1994; Skinner et Griswold, 1982). La suppression de la testostérone diminue d’au moins 50% le nombre de cellules germinales à chaque stade de différenciation sauf pour les spermatogonies (McLachlan et al., 1994). Les cellules de Sertoli produisent des androgen binding protein (ABP) qui sont des protéines de transport des androgènes, mais cette production est régulée par la FSH (Hagenäs et al., 1975).
1.4.3. Les oestrogènes
Les souris mâles mutantes pour les gènes des récepteurs aux estrogènes ont été infertiles mais ont montré un développement reproducteur normal (Lubahn et al., 1993). En mettant au point une souris knockout pour les récepteurs aux estrogènes Erα, Hess et ses coll. en 1997 ont montré que les souris mâles étaient infertiles en raison d’une atrophie des testicules après la puberté. L’œstradiol est actif dans le bon fonctionnement de la spermatogenèse (Hess et al., 1997). Les œstrogènes comprennent l’œstradiol et l’estrone. L’œstradiol est produit à partir de la testostérone par l’aromatase et l’estrone à partir de l’androstenedione par l’aromatase aussi. L’aromatase est une enzyme de la superfamille du cytochrome P450 se trouvant dans le réticulum endoplasmique des cellules de Leydig (Carreau et Hess, 2010).Chez un rat mâle adulte, les cellules de Leydig produisent la majeure partie des œstrogènes (Papadopoulos et al., 1986).
Les récepteurs nucléaires aux œstrogènes ER sont exprimés spécifiquement par les cellules de Leydig et les canaux efférents (Carreau et Hess, 2010). Les récepteurs nucléaires ER sont présentes sur les testicules, les épididymes, la prostate et les vésicules séminales du rat (Carreau et Hess, 2010). L’œstradiol permet la fonction de réabsorption du fluide luminal dans les canaux efférents et dans l’épididyme, et ainsi l’augmentation de la concentration du sperme avant d’entrer dans l’épididyme (Hess, 2003). Chez l’homme, les récepteurs ER n’ont pas été détectés dans des immunobuvardages effectuées avec des extractions de testicules contrairement à ER dont la forte expression a été détectée dans les cellules de Sertoli par une technique d’immunofluorescence sur des coupes testiculaires (Fietz et al., 2014). Chez l’homme, l’œstradiol semble influencer aussi les épididymes puisque la présence d’aromatase a été détecté par une technique d’immunohistochimie dans les cellules épithéliales et aussi dans la gouttelette lipidique des spermatozoïdes se trouvant dans la lumière de l’épididyme (Carreau et al., 2008). Il y a des récepteurs ER et ER sur la membrane nucléaire (Luconi et al., 2004) et dans les mitochondries du spermatozoïde humain qui semblent être impliquées dans la motilité dans le tractus femelle (Solakidi, 2005; Carreau et al., 2007b).
1.4.4. L’acide rétinoïque
Chez des rats nourris avec un régime alimentaire déficient en vitamine A, la spermatogénèse a été arrêtée au stage de la spermatogonie A (Morales et Griswold, 1987). L’acide rétinoïque est essentiel au bon fonctionnement de la spermatogénèse. Dans un autre modèle de rat ayant un régime alimentaire déficient en vitamine A, des injections contenant de fortes doses d’acide rétinoïque ont stimulé la prolifération des spermatogonies A, leurs différenciations en spermatogonies B et ensuite celles en spermatocytes, mais pas en spermatides (Van Pelt et de Rooij, 1991). Des injections répétées d’acide rétinoïque ont été nécessaires pour atteindre le stade de spermatides suggérant que la défiance en vitamine A peut retarder la spermiation (Van Pelt et de Rooij, 1991). La souris mutante pour le récepteur RAR-α montre les mêmes problèmes dans la spermatogénèse que la souris ayant un régime alimentaire déficient en vitamine A (Lufkin et al., 1993). Le récepteur RAR-α étant exprimé par les spermatogonies chez l’adulte, l’acide rétinoïque exerce ses effets par
ces récepteurs (Dufour et Kim, 1999). La souris mâle mutante pour RXR-β est stérile en raison d’une dégénération des cellules de Sertoli (Dufour et Kim, 1999). RXR-β permet de maintenir l’activité de la cellule de Sertoli chez le rat adulte (Dufour et Kim, 1999).
Dans une culture de cellules testiculaire de rat adulte, l’acide rétinoïque augmente la sécrétion de testostérone, mais la diminue quand les cellules de Leydig sont stimulées aussi par la LH (Chaudhary et al., 1989). Dans des études in vitro sur des cellules de Leydig, il a été montré que l’acide rétinoïque réduit l’expression des récepteurs à la LH et augmente l’expression de protéines régulant la stéroïdogenèse et la ligase P450 C17α-hydroxylase-C17-20 (enzyme du réticulum endoplasmique pour la synthèse des stéroïdes) (Lefèvre et al., 1994; Lee et al., 1999).
1.4.5. Les divisions cellulaires
À la figure 1.4.A, on voit que les cellules de Sertoli se trouvent à côté des spermatogonies B. À la figure 1.4.B, les spermatogonies B sont des cellules germinales issues de divisions des spermatogonies A à noyau clair (Ap = A pale), elles-mêmes issues de mitoses des spermatogonies A à noyau sombre (Ad = A dark) (Hess et de Franca, 2009; Sharma et Agarwal, 2011). Les gonocytes prolifèrent 3 à 4 jours après la naissance puis ils migrent du centre des cordes séminifères aux périphéries pour se transformer spermatogonies Ad (McGuinness et Orth, 1992a et b; Orth et Boehm, 1990). Ces changements sont contrôlés par les cellules de Sertoli (Orth et Boehm, 1990). Les spermatogonies Ad deviennent des cellules souches, car elles s’auto-renouvèlent (Hermo et Robaire, 2010; Hess et de Franca, 2009; Rasoulpour et al., 2010a; Sharma et Agarwal, 2011). Les spermatogonies de type B se divisent par mitose pour produire les spermatocytes I (primaires) qui ont un noyau à 4 N (les chromosomes sont par pair) et vont ensuite subir une division par méiose pour devenir les spermatocytes II (secondaires) qui ont un noyau à 2 N (un chromosome par pair est présent dans un noyau) (Figure 4.B) (Dym et Clermont, 1970; Hermo et Robaire, 2010; Sharma et Agarwal, 2011). Les jonctions serrées créées par les cellules de Sertoli forment la barrière hématotesticulaire décrite au paragraphe 1.3, qui sépare les spermatogonies des autres cellules germinales mâles. Le compartiment basal, de la figure 1.4.A, situé entre la membrane basale du tube séminifère et les jonctions complexes des cellules de Sertoli
renferme les spermatogonies Ad, Ap et B mais aussi les spermatocytes I qui ont accès aux nutriments et hormones grâce au sang (Dym et Clermont, 1970; Sharma et Agarwal, 2011). Le compartiment adluminal est séparé de la partie basale par la barrière hématotesticulaire et renferme les spermatocytes II, les spermatides rondes et allongées (Sharma and Agarwal, 2011). Les spermatocytes II, issus de la première division de méiose (division réductionnelle) des spermatocytes I, subissent la deuxième division de méiose (division équationnelle, qui donnent les spermatides, cellules ayant 1N chromosome (Figure 1.4.B) (Dym et Clermont, 1970; Hermo et Robaire, 2010; Hess et de Franca, 2009; Sharma et Agarwal, 2011). Les spermatides rondes issues de la dernière division de méiose se transforment en spermatozoïde par un processus de différenciation qui compacte fortement la chromatine de son noyau, c’est la spermiogenèse (Dym et Clermont, 1970; Sharma et Agarwal, 2011). Durant cette étape, les spermatides rondes s’allongent en éliminant le cytoplasme cellulaire, les mitochondries et l’appareil de Golgi se développent pour former le flagelle du spermatozoïde, l’acrosome est mis en place et les protamines accompagnées de ponts disulfures remplacent les histones de la chromatine pour la compacter. À la fin de la spermiogenèse, les cellules sont appelées des spermatides allongées (Sharma et Agarwal, 2011). La dernière étape est la spermiation. Elle consiste à séparer les spermatides allongées des jonctions de type desmosome qui les relient aux cellules de Sertoli et à perdre leurs cytoplasmes pour devenir des spermatozoïdes qui sont libérés dans la lumière du tube séminifère (Hess et de Franca, 2009; Sharma et Agarwal, 2011). Si on compare le rendement de la spermatogenèse chez le rat et l’homme, le premier produit plus de 20 millions de spermatozoïdes par jour et par testicule alors que le deuxième n’est qu’à environ 5 millions (Hess et de Franca, 2009). L’homme semble avoir une des spermatogenèses les moins productives des mammifères (Robaire et al., 2006).
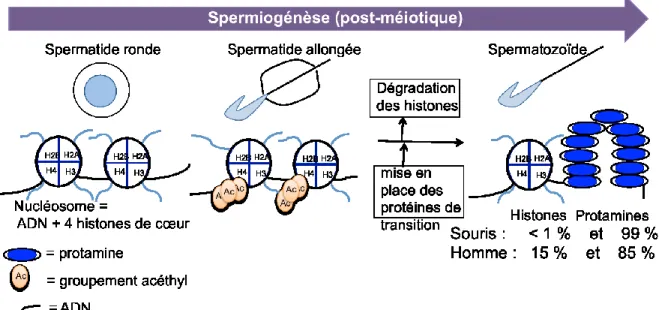
Figure 1.4. L’illustration résumée de la spermatogenèse (par Nicole Vacheret :
http://fr.wikipedia.org/wiki/Spermatogen%C3%A8se; droits obtenus). En A) schéma d’une coupe d’un
tube séminifère avec M B= membrane basale, Sp B = spermatogonie B, SPI = spermatocyte I, SPII = spermatocyte II. En B) les différentes divisions cellulaires pour chaque cellule de la spermatogenèse jusqu’au spermatozoïde ainsi que le nombre de cellules obtenues à chaque division.
1.4.6. La spermiogenèse, étape finale de la spermatogenèse
La spermiogenèse est un processus spécifique de la spermatogenèse où les spermatides effectuent leur transformation finale pour devenir un spermatozoïde. Cette étape consiste en partie à compacter l’ADN du noyau progressivement suivi par l’inactivation du génome (Sharma et Agarwal, 2011).
À la figure 1.5, l’histone H4 est hyperacétylée dans les spermatides allongées puis toutes les histones sont remplacées par des protéines de transition et finalement remplacées par les protamines (Rajender et al., 2011; Sharma et Agarwal, 2011). L’hyperacétylation des histones provoque une forte déméthylation de l’ADN et une forte transcription produisant des ARNnc qui sont entreposés dans le noyau du spermatozoïde (Dadoune et al., 2011). Durant la spermiogenèse de la souris, du rat et de l’homme, des ruptures de brins d’ADN sont générées par les topoisomérase II lors du remodelage de l’ADN pour permettre aux histones d’être retirées et aux protéines de transitions de prendre leurs places (Chen et Longo, 1996; Cho et al., 2001; Roca et Mezquita, 1989). Les présences de topoisomérase II et des ruptures de l’ADN correspondent à l’hyperacéthylation de l’histone H4 de l’ADN des spermatides (Marcon et Boissonneault, 2004). La possibilité que les histones soient dégradées par des protéases avant ou durant la mise en place des protéines de transitions expliquerait la disparition des histones dans les spermatides (Faulkner et al, 1987). Cependant, ces travaux ont été effectués dans des morceaux de tubes séminifères contenant des spermatides ayant un acrosome en formation. L’acrosome contient de nombreuses protéases (Marushige et Marushige, 1983). Il est donc nécessaire de pousser les recherches pour identifier des protéases non acrosomiques qui pourraient être responsables de la dégradation des histones (Marushige et Marushige, 1983).
Dans les spermatides en élongation, une ubiquitination des histones H2A et H3 a été montrée (Baarends et al., 1999). Dans les cellules somatiques, l’ubiquitination des histones est associée avec la déstabilisation des nucléosomes pour permettre la transcription des gènes (Li et al., 1993). La protéase E3hsitone capable d’ubiquitiniser toutes les histones a
montré une forme spécifique dans le testicule, c’est UBC4-testis (Liu et al., 2005). Cette protéase a été identifiée par une technique de spectrophotométrie de masse dans les spermatides en élongation précoce de souris où les histones commencent à être
ubiquitinisées et remplacées après (Liu et al., 2005). UBC4-testis n’a pas pu être détectée par immunocytochimie dans les différentes spermatides des coupes testiculaires de souris (Liu et al., 2007). Il est possible que la technique d’immunocytochimie ne soit pas assez sensible pour détecter la faible concentration de UBC4-testis dans les spermatides (Liu et al., 2007). UBC4-testis pourrait participer à désintégration des histones, mais ce n’est probablement pas la seule protéase (Liu et al., 2007).
La déacétylation et la méthylation des histones donnent ensuite l’ordre via le complexe de DNMT3s de mettre des groupements méthyles sur l’ADN pour arrêter toute transcription (Li, 2002; Dadoune et al., 2011). Les protamines permettent de compacter fortement l’ADN et de neutraliser sa charge négative (Rajender et al., 2011; Sharma et Agarwal, 2011). Des histones sont non remplacées par des protamines (histones résiduelles) dans les spermatozoïdes humains (entre 5-15 % d’histones retenues (Gatewood et al., 1990; Jenkins et Carrell, 2012) et de souris (environ 1 % d’histones retenues (Balhorn et al., 1977). Il n’y a aucune étude sur la quantité d’histones résiduelles dans les spermatozoïdes de rat dans la littérature.
Figure 1.5. Compaction de l'ADN spermatique durant la spermiogenèse. Les queues des histones formant
les nucléosomes dans les spermatides rondes sont acétylées puis il y a une dégradation des histones et ils sont remplacés par des protéines de transition. Les protéines de transition sont remplacées par les protamines qui permettent un enroulement plus compact de l’ADN.