HAL Id: dumas-01783545
https://dumas.ccsd.cnrs.fr/dumas-01783545
Submitted on 2 May 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Suivi de la variation de la composition corporelle par
impédancemétrie des enfants en cancérologie : étude
prospective observationnelle
Marie Lafenêtre
To cite this version:
Marie Lafenêtre. Suivi de la variation de la composition corporelle par impédancemétrie des enfants en cancérologie : étude prospective observationnelle. Médecine humaine et pathologie. 2018. �dumas-01783545�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
UNIVERSITÉ GRENOBLE ALPES UFR DE MÉDECINE DE GRENOBLE Année : 2018 Suivi de la variation de la composition corporelle par impédancemétrie des enfants en cancérologie : étude prospective observationnelle. THÈSE PRÉSENTÉE POUR L’OBTENTION DU TITRE DE DOCTEUR EN MÉDECINE DIPLÔME D’ÉTAT Marie LAFENETRE THÈSE SOUTENUE PUBLIQUEMENT À LA FACULTÉ DE MÉDECINE DE GRENOBLE Le : 26/04/2018 DEVANT LE JURY COMPOSÉ DE Président du jury : Monsieur le Professeur Dominique PLANTAZ Membres : Monsieur le Professeur Noel PERETTI Madame le Docteur Cécile PERRET Directrice de Thèse : Madame le Docteur Amandine RUBIO
L’UFR de Médecine de Grenoble n’entend donner aucune approbation ni improbation aux opinions émises dans les thèses ; ces opinions sont considérées comme propres à leurs auteurs.
Remerciements :
A Monsieur le Professeur PLANTAZ. Merci de nous faire l’honneur de présider ce jury de thèse et merci pour votre encadrement dans votre service.
A Monsieur le Professeur PERETTI. Merci d’avoir accepté de faire parti de ce jury et de l’intérêt que vous portez à ce travail. Merci pour votre enseignement pendant ces 6 mois à Lyon.
A Madame le docteur PERRET. Merci d’avoir accepté de faire partie de ce jury. Merci pour ton dynamisme et ton apprentissage durant le stage.
A ma directrice de thèse, le docteur Amandine RUBIO. Merci de m’avoir accompagné durant ces longs mois de travail. Merci pour ta patience, ton soutien et tes nombreuses critiques constructives au sujet de ce travail. J’espère que tu seras félicitée pour tout l’encadrement que tu donnes aux étudiants.
A tous les enfants et leurs parents qui ont accepté de participer à ce travail de thèse. Sans vous, ce travail n’aurait pas pu voir le jour. Même dans les moments les plus difficiles, vous avez toujours accepté de mettre ce travail en avant et je vous en suis très reconnaissante. A tous les médecins des différents services de pédiatrie de l’Hôpital Couple Enfant, les puéricultrices et les auxiliaires puéricultrices qui ont joué le jeu pour ce travail, merci.
A tous les médecins, les équipes paramédicales des services adultes, ainsi que les médecins généralistes en ambulatoire, dans lesquels mon internat a débuté. Je vous remercie pour la transmission de votre savoir médical, votre gentillesse et votre bienveillance.
A tous les médecins et les équipes paramédicales des services de pédiatrie où mon internat s’est rallongé. Merci de m’avoir donné le gout de la pédiatrie : service de pédiatrie au CH de Chambéry, service des urgences pédiatrique, service de néonatalogie, service de l’ IHO, service de pédiatrie polyvalente, service de réanimation pédiatrique au CHU de Grenoble, service d’hépato-gastro-entérologie de l’ HFME.
A mes parents, merci pour votre présence, votre soutien sans faille et surtout votre patience éternelle durant ces longues années. Merci pour votre aide pour tous les embuches petites ou grandes de la vie quotidienne. Sans vous, jamais je n’aurai pu arriver jusque là. Vous avez aussi fait 12 ans d’études avec moi. Il est temps de vous reposer.
A Emilie, merci pour ton soutien depuis 31 ans (malgré mon caractère bien trempé) et encore plus durant ces six derniers mois. A Christophe, merci pour ton aide également et tes bons
petits plats. A mon neveu adoré, Pierre-Louis, qui me dévalise en chocolat, mais que j’aime tant.
A mes Grands-Parents. Merci pour votre soutien durant ces années. Certains ne sont pas ou plus là physiquement, mais nous savons que le cœur y est.
A Jean-Pierre (dit tonton JP) et Pierrette. Merci d’avoir traversé la France pour ce moment. A Mylène et Jean-Michel, Maxime et Sunny. Merci d’être là aujourd’hui.
A tous les amis de la famille : Patricia, Philippe, Mireille, Michel, Fabienne, Jean Marc. Merci pour votre gentillesse, votre bienveillance. Merci tout particulièrement à mes filleules, Lucie et Noëlie, pour ce que vous êtes et votre joie de vivre.
A la famille Benhamou-Froissard et leurs chipies. Je sais que vous auriez aimé être là.
A ma « belle-famille ». Merci de m’avoir aussi bien accueillie. Merci de m’avoir fait partagé une de vos passions : les Etrusques et les Syriaques.
A mes amies de la fac de Bordeaux : Alexia, Alizée, Elsa, Virginie. Merci pour toutes ces années passées en votre compagnie. Merci pour tous ces fous rires, ces bons moments. Merci pour votre soutien malgré les km qui nous séparent. Sans vous, ces années n’auraient pas été les mêmes et je n’en serai pas là aujourd’hui.
Et merci pour ces pièces rapportées: Hugo, Gaby, Elrick, Myriam, Agathe, Gaspard, Juliette, Apolline et la petite dernière Margaux.
A Delphine. Merci pour cette amitié depuis des années malgré les DOM-TOM qui nous séparent.
A Barbara. Merci pour notre amitié depuis tant d’années malgré l’éloignement.
A Amandine. Merci pour ton soutien, ton écoute, tes petits plats, ton aide et ton amitié durant ces années. Merci pour les dernières corrections de dernière minute. Merci à Pierrick pour ses bons conseils lecture.
A Christine. Merci pour ton amitié, ta tarte à l’oignon et ta conduite à la nîmoise. A Karen. Merci pour ton aide, ton soutien, ta gentillesse et surtout ton accent (ui).
A Cyril et Carole. Merci pour cette colocation durant 6 mois ainsi que votre soutien à Lyon. A Cécile et Benjamin. Merci d’être là aujourd’hui.
A la famille Thonon et ses apparentés : à Blandine pour sa folle attitude, à Jenny pour sa bonne humeur, à Line pour sa force tranquille, à Mélodie pour son look perceuse/jupe, à Amélie pour son rire, à Adrien pour son brillant parcours, à Damien pour ces jeux de lumières, à Nico pour sa mémoire sans faille, à Laurens pour son relooking qui perdure, à Claire et Mylène pour leur joie de vivre.
A Héloïse pour son écoute, ses encouragements, ses chocolats.
A la Pédiatrie Poîlade : Amélie, Clarisse, Hélène, Myriam et Laure. Merci pour ces 6 mois de stage et bien plus encore avec tous ces fous rires, ces bons moments, ces déguisements, ces vidéos. Merci aux médecins d’avoir subis ou encouragés nos bêtises : Julie, Eglantine, Cécile, Nadège, Maélys, Guylène.
A mes co-internes de la réanimation pédiatrique : les Maries, Philippe, Sophie, Claire. Merci Claire pour ton aide pour ma thèse malgré ton travail dans le service.
Merci Sophie pour ta bienveillance et tes conseils.
A mes co-internes de Lyon : Emma, Mélodie, Nathalie, Solène, Victor. Merci d’avoir pris soins de moi comme vous l’avez fait et d’avoir été si compréhensifs.
A Josiane et Antoine de la bibliothèque de Grenoble. Merci pour tous ces articles demandés 24H sur 24 tout au long de cet internat.
A Samuel. Une seule phrase dans cette thèse ne pourrait pas résumer tout ce que je te dois et tout ce que tu m’apportes depuis 5 ans. Merci d’avoir été là, d’être là et de m’accompagner ici et là-bas.
Abréviations : ... 11 Résumé: ... 12 I/ Introduction : ... 15 2/ Matériel et Méthodes : ... 19 2.1/ Patients : ... 20 2.2/ Procédure : ... 20 2.3/ Mesures : ... 20 2.3.1/ Statut nutritionnel : ... 20
2.3.2/ Caractéristiques des patients : ... 21
2.3.3/ Caractéristiques des traitements : ... 21
2.4/ Analyses statistiques : ... 22
3/ Résultats : ... 22
3.1/ Caractéristiques de la cohorte : ... 22
3.2/ Etat nutritionnel au diagnostic : ... 24
3.3/ Evolution de l’état nutritionnel de 0 à 12 mois : ... 25
3.4/ Evolution de l’état nutritionnel en fonction de la pathologie : ... 25
3.5/ Evolution de l’état nutritionnel en présence ou non d’une corticothérapie et d’une radiothérapie : ... 27
3.6/ Apport du suivi de la composition corporelle par rapport au suivi du poids, de l’IMC et de l’ IW : ... 28
4/ Discussion: ... 28
4.1/ Evolution de la composition corporelle: ... 29
4.2/ Les limites de l’étude: ... 31
5/ Conclusion: ... 32
Bibliographie : ... 34
Annexes : ... 36
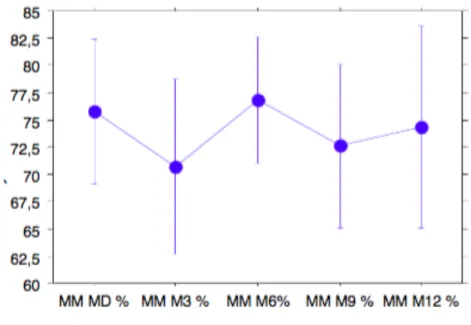
Figure 1 : Variation de la MM et de la MG au cours du suivi : ... 36
Abréviations :
CC : Composition Corporelle MG : Masse Grasse
MM : Masse Maigre DS : Déviation Standard
IMC : Indice de Masse Corporelle INCa : Institut National du Cancer
LAL : Leucémie Aigue Lymphoblastique IW : Indice de Waterloo
Résumé :
Introduction : Dénutrition et surnutrition sont des problèmes nutritionnels majeurs pendant et après le traitement du cancer. Leur prise en charge implique un suivi précis de la composition corporelle (CC). Ce suivi nutritionnel permet de repérer les variations du poids, de la masse grasse (MG) et maigre (MM) afin d’adapter une prise en charge nutritionnelle personnalisée. Cependant l’évolution de la CC au cours du traitement du cancer chez l’enfant a très peu été rapportée dans la littérature. L’objectif de cette étude était donc d’étudier l’évolution de la CC des enfants atteints de pathologies cancéreuses pendant leur traitement. L’incidence du type de tumeur et du traitement sur la CC a également été analysée, ainsi que la recherche de corrélations statistiques entre les différents composant de la CC et les marqueurs traditionnels de l’état nutritionnel.
Méthodes : Il s’agissait d’une étude prospective observationnelle de 15 patients nouvellement diagnostiqués d’une pathologie maligne : pathologies hématologiques malignes, tumeurs solides, tumeurs cérébrales. Des mesures anthropométriques (poids, taille) et de CC par impédancemétrie bioélectrique ont été réalisées au diagnostic, puis à 1, 3, 6, 9 et 12 mois de suivi.
Résultats : Une baisse de MM et une augmentation importante de MG ont été constatées au cours des trois premiers mois de traitement, associées à un gain de poids. Le suivi de la CC a permis de repérer un nombre plus important d’enfants surnutris (MG>+2 déviations standards (DS)) que le seul suivi du poids et de l’ IMC (Indice de Masse Corporelle). Aucune corrélation n’a été retrouvée entre les valeurs de poids, d’IMC et de MG pendant l’évolution du traitement. Aucune relation n’était retrouvée entre l’évolution de la MG et l’utilisation de corticothérapie.
Conclusion : Une augmentation du taux de MG pendant la période intensive de traitement a été concomitante à la fonte de la MM. L’amélioration des prises en charges nutritionnelles
ont leur intérêt dès les premières phases du traitement afin d’en améliorer la tolérance, d’en diminuer les complications immédiates et à distance.
Abstrat :
Introduction: Under-nutrition and over-nutrition are major nutritional problems during and after oncological treatment. Body composition in an essential tool in nutrional status follow-upIt indeed allows for the detection of fat mass (FM) ans fat free mass (FFM) changes and is essential to adapt the nutrional support. However, there is only one sudy in the medical literature describing the follow up of body composition during the childhood cancer treatmenhis. The aim is this is to analyse the changes in body composition during the cancer treatment in children. The effect of the types of tumor and of treatment have been analysed. Statistical correlation between the evolution of body composition, weight and body mass index (BMI) were studied.
Methods: A prospective cohort study of 15 newly diagnosed cancer patients with maligancies: hematological, solid tumor and brain malignacies was performed. Anthropometric data (weight, height) and body composition was assessed at diagnosis and 1, 3, 6, 9 and 12 months after diagnosis.
Results: A decrease of FFM and an increase of FM and a weight gain were found in patient with hematological malignancies during the first three months. A greater number of patients were diagnosed with overnutrition (FM>+2 standart deviations) with analysis of body composition as compared to BMI. Not correlation was found between weight, BMI et the FM. Not significant correlation was found between the FM evolution and the corticosteroid therapy.
Conclusion: The fat mass increased after the most intensive period of treatment with a decreased of the fat free mass. The nutritional care is important at the begining of the childhood cancer treatment for improve the side effects during the treatment and remote.
I/ Introduction :
En France, le cancer de l’enfant et de l’adolescent, touche chaque année en moyenne 2200 nouvelles personnes (1 750 chez les moins de 15 ans et 450 chez les adolescents de 15 à 19 ans) d’après les données de l’Institut National du Cancer (INCa). Les cancers les plus fréquents sont les leucémies (29 % des cas), les tumeurs du système nerveux central (23 %) et les lymphomes (12 %). La moitié d’entre eux survient avant l’âge de 5 ans. Le sex-ratio est de 1,2 garçon pour 1 fille. Le taux de survie est en augmentation progressive, atteignant 81% à 5 ans en France métropolitaine sur la période 2000 à 2007 (1). Ceci est expliqué, entre autres, par un diagnostic plus précoce et des traitements (chimiothérapie, radiothérapie et chirurgie) plus intensifs (2).
La malnutrition, définie comme un processus pathologique chronique affectant la composition corporelle (CC), est une complication fréquente des cancers de l’enfant. Elle peut être présente dès le diagnostic ou apparaître durant le traitement. Sa prévalence au moment du diagnostic varie de 5 % chez les enfants atteints de leucémies à 50% dans les neuroblastomes, voire plus dans les cancers métastatiques ou autres tumeurs solides (2).
La malnutrition est la conséquence d’un déséquilibre entre la consommation et l’utilisation d’énergie correspondant soit à une « surnutrition » (over-nutrition en anglais) ou à une dénutrition (under-nutrition) pouvant exister de façon concomitante chez un individu.
La dénutrition peut se définir comme une baisse de la masse maigre (MM) < -2 déviations standards (DS) ou un Indice de Masse Corporelle (IMC) < -2 DS (3). Sa prévalence au diagnostic varie de 0 à 5% dans les pathologies hématologiques malignes à 30% dans les tumeurs solides (4). Elle est causée par un apport protéino-énergétique insuffisant (pertes
excessives, consommation augmentée, utilisation inappropriée des substrats) par rapport aux besoins nécessaires à un métabolisme adapté à l’âge (5). Certains types de pathologies malignes (tumeurs solides, cérébrales, métastatiques ou non) et le type de protocole thérapeutique utilisé peuvent constituer des facteurs favorisants de dénutrition. L’hyper-catabolisme dans le cancer est lié à l’inflammation chronique tumorale avec relargage de cytokines pro-inflammatoires type IL-1, IL-6, TNF-alpha et IFN-gamma (2,6) entraînant une protéolyse (avec fonte de la MM) et une lipolyse, le tout dans un contexte d’augmentation de la dépense énergétique de base (2,7). Il s’y associe éventuellement une baisse des ingesta (plurifactorielle : du fait d’une anorexie, de nausées, de vomissements, de mucite avec modification gustative), un syndrome de malabsorption (effets gastro-intestinaux de la chimiothérapie et/ou de la radiothérapie), et/ou une susceptibilité accrue aux infections. Cet état conduit à une moins bonne tolérance de la chimiothérapie, une majoration des complications thérapeutiques et des risques infectieux, une baisse de la densité minérale osseuse et des troubles de la croissance (8), une réduction de la qualité de vie, ainsi qu’une augmentation des taux de récidive avec un taux de survie plus faible (2–4). A distance, la dénutrition a comme conséquences un risque accru de troubles du comportement chez l’adolescent, de difficultés attentionnelles avec un impact scolaire puis professionnel (9,10).
La surnutrition ou over-nutrition est par définition une augmentation de la masse grasse (MG) ou de l’IMC au-delà de +2 DS (3,11). Son incidence en cours de traitement varie de 25 à 40%. De façon générale, une augmentation significative de la MG a souvent été mise en évidence chez des enfants du cancer par rapport à des groupes contrôles sains (12).
Les étiologies de l’obésité et/ou du surpoids incluent la prise de glucocorticoïdes, source d’augmentation de l’apport énergétique avec une accumulation de MG, et l’asthénie conduisant à une sédentarité. Cette tendance peut être potentialisée par l’attitude parentale
prônant le repos et autorisant plus de liberté vis-à-vis de la composition des ingesta. Les tumeurs cérébrales, en particulier dans le cadre de radiothérapie avec irradiation trans-crânienne (à l’origine de déficit en GH, dommages de l’axe hypothalamo-hypophysaire, dérégulation de la sécrétion de leptine, résistance à l’insuline) entraineraient également une prévalence augmentée de l’obésité durant le traitement (13) et persistante à long terme (jusqu’à 15 ans post traitement) (14). Enfin, il a été montré qu’être en surpoids ou obèse lors du diagnostic ou le devenir pendant le traitement d’une Leucémie Aigue Lymphoblastique (LAL) était fortement associé au fait d’être toujours en surpoids ou obèse en fin de traitement (15,16), entraînant des complications à long terme de type cardio-vasculaires, endocriniennes, métaboliques. De plus, l’obésité au moment du diagnostic est associée à une diminution du taux de survie à 5 ans (17).
Les index classiques de mesure (poids, taille, IMC, indice de waterloo (IW) ou rapport poids/poids attendu pour la taille) permettent d’avoir une impression générale de la croissance et de l’état nutritionnel de l’enfant. Ces index peuvent cependant être pris en défaut dans certaines pathologies, avec notamment une surestimation du poids du fait de la taille de la tumeur, de l’apparition d’un troisième secteur par hypo-albuminémie, du remplacement de la MM par la MG. Dans l’étude de Murphy et al, seulement 5% des enfants traités pour une pathologie maligne étaient identifiés comme dénutris avec le score d’IMC contre 48% avec une mesure de la composition corporelle (CC) par mesure du potassium intra-cellulaire (18). De même, le travail de Blijdorp et al chez des patients survivants (14) a montré que l’IMC sous-estimait le taux d’obésité par rapport à la mesure de CC par absorptiométrie biphotonique. Il existe en effet différents phénotypes de CC à IMC normaux traduisant un défaut des index classiques de mesure : LA-HM (Low-Adiposity-High Mass), HA-HM (High Adiposity-High Mass)-, LA-LM (Low Adiposity-Low Muscle Mass)-HA-LM (High
Adiposity-Low Mass) (19).
La CC (% de MG et % de MM subdivisée en masse musculaire et masse hydrique) est un meilleur indicateur de l’état nutritionnel global de chaque individu que les mesures anthropométriques. Les différents indicateurs de CC comprennent la mesure des plis cutanés, la circonférence musculaire brachiale, l’absorptiométrie biphotonique, la mesure du potassium intracellulaire, et l’impédancemétrie bioélectrique.
Les mesures anthropométriques (mesures des plis cutanés par un adipomètre, mesures des circonférences brachiales) permettent d’approcher de manière simple la CC et d’en suivre l’évolution. Elles sont pourtant peu utilisées en routine et non recommandées par les référentiels car les résultats sont très opérateur-dépendant (20).
L’absorptiométrie biphotonique consiste en une irradiation corporelle totale par un faisceau de photons. Utilisée pour évaluer la densité osseuse, elle permet de distinguer la MM, le MG et la masse minérale et est considérée par certains comme le gold standard de la mesure de CC (21). Il s’agit cependant d’un examen légèrement irradiant, lourd, peu accessible et coûteux qui ne peut être répété pour le suivi individuel.
La mesure du potassium (mesure d’un isotope du potassium, le K40, présent de façon naturelle dans le corps) permet d’avoir une estimation de la MM et est indépendante des changements du compartiment extracellulaire ; elle est ainsi parfois considérée comme une méthode de référence (18). Il s’agit d’une technique non invasive mais l’utilisation en pratique médicale est rarement possible.
L’impédancemétrie bioélectrique est une mesure de la résistance au passage du courant électrique. Elle mesure avec une bonne sensibilité et spécificité l’eau totale et extracellulaire, et permet d’en déduire la MM et la MG. C’est le seul examen de CC qui soit reproductible, facile d’accès, peu onéreux, sans danger, rapide et réalisable au lit du
malade. Cette technique a été validée dans le suivi longitudinal de la CC d’enfants et de patients d’oncologie adultes (21). A ce jour, une seule étude a analysé l’évolution de la CC au cours de la prise en charge nutritionnelle chez l’enfant atteint d’un cancer (3). Il semblerait que la MG tende à augmenter au cours du traitement, de façon proportionnelle aux apports énergétiques, tandis que la MM diminuerait (5) de façon plus ou moins marquée selon le type de pathologie tumorale. L’évolution de la MM ne serait pas corrélée avec les apports énergétiques ou protéiques (5).
L’objectif principal de ce travail était d’étudier l’évolution de la CC de chaque patient depuis le diagnostic jusqu’aux 12 mois de leur prise en charge. Les objectifs secondaires étaient de comparer l’évolution de la CC en fonction des différents types de diagnostics (tumeurs hématologiques, solides et cérébrales) et des thérapeutiques (corticothérapie et radiothérapie). Enfin, l’intérêt d’ajouter la mesure de la CC dans le suivi nutritionnel de ces patients était de rechercher l’existence de corrélations entre évolution des MM et MG, du poids et de l’IMC de chaque patient. A terme, cela permettrait de motiver l’intégration de la mesure de la CC à chaque consultation de suivi, en vue d’adapter au mieux la prise en charge nutritionnelle de chaque patient, dès le diagnostic posé.
2/ Matériel et Méthodes : 2.1/ Patients :
Tous les enfants nouvellement diagnostiqués d’une pathologie maligne et admis dans les services d’Immuno-Onco-Hématologie Pédiatrique, Soins Continus et Réanimation Pédiatriques du Centre Hospitalier Universitaire Grenoble Alpes (CHUGA) pour un nouveau diagnostic de pathologie maligne entre août 2016 et août 2017 ont été inclus. La période de
suivi était de 12 mois. Les patients éligibles étaient âgés de 4 à 18 ans, et ne devaient jamais avoir été pris en charge pour une pathologie maligne antérieurement. L’accord du comité d’éthique local a été obtenu. Un accord oral de participation à l’étude a été donné par les parents ainsi que les enfants en âge de le donner.
2.2/ Procédure :
Le statut nutritionnel a été mesuré au moment du diagnostic (MD) puis à 1 (M1), 3 (M3), 6 (M6), 9 (M9) et 12 mois (M12) du diagnostic. Les mesures de poids, taille, tour de hanche, tour de taille de la CC par impédancemétrie bioélectrique ont été prises lors des venues de chaque enfant prévues dans son protocole de soins.
2.3/ Mesures :
2.3.1/ Statut nutritionnel :
Le poids a été mesuré à chaque visite avec une balance digitale portable présente dans chaque service, et exprimé en kg. La taille a été mesurée à chaque visite à l’aide d’une toise graduée, en position debout et prise en cm. L’IMC a été calculé selon la formule poids/taille2 puis exprimé en DS grâce au logiciel expert e-PINUT (URL : http://78.234.239.140/fmi/iwp/res/iwp_auth.html;jsessionid=01FEC867B6D0996D11DD94E B.wpc1). Les mesures de tour de taille et tour de hanche ont été effectuées à l’aide d’un mètre ruban gradué en cm. Concernant le tour de taille, le repère a été pris au niveau du nombril. Pour le tour de hanche, le diamètre le plus large a été retenu.
La mesure d’impédancemétrie a été réalisée à chaque visite à l’aide du bioimpedancemètre Bodystat® QuadScan 4000 multifréquences, en respectant les conditions de mesure
préconisées par le laboratoire. L’enfant était allongé depuis au moins 5 minutes dans le calme sur son lit, sans que des parties de son corps ne touchent les parties métalliques du lit. Deux électrodes étaient posées sur la main droite (une en regard des premières phalanges sur le dos de la main et l’autre entre les deux os de l’avant-bras au niveau du poignet) ainsi que deux électrodes au niveau du pied droit (une électrode en regard des premières phalanges et une au niveau du coup de pied). Si ce placement n’était pas possible, les électrodes étaient placées sur l’hémicorps gauche. Les calculs ont été effectués via l’impédancemètre. Les valeurs de MG et de MM ont été exprimées en kg, en % du poids corporel total puis en DS par rapport aux normes de la population française, publiées par Braillon et Peretti en 2011 (22). Une dénutrition était définie par un taux de MM < -2 DS ou un IMC < -2 DS et une surnutrition par un taux de MG > 2DS ou un IMC >2 DS.
2.3.2/ Caractéristiques des patients :
L’âge, le sexe, le diagnostic, les mesures anthropométriques et de CC au diagnostic ont été recueillis pour chaque patient inclus.
2.3.3/ Caractéristiques des traitements :
L’existence d’une prise en charge nutritionnelle (expertise d’un(e) diététicien(ne)), d’une prescription de compléments nutritionnels oraux, d’une nutrition entérale et/ou parentérale a été relevée dans les dossiers.
Les patients recevant des corticoïdes dans leur protocole de soins respectifs à chaque pathologie ou dans la cadre d’une hypertension intracrânienne ont été recensés. De même, le
recours à une radiothérapie (irradiation trans-crânienne ou irradiation locale) ou à une opération chirurgicale (autre qu’une biopsie diagnostique) a été notée.
2.4/ Analyses statistiques :
Les données quantitatives ont été exprimées en termes de médiane et de valeurs extrêmes, les données qualitatives en termes d’effectif et de pourcentage. Les analyses statistiques ont été réalisées avec le logiciel Statview 5.0 pour Windows (Cary, NC, Etats Unis). Les valeurs nominales ont été comparées avec un test exact de Fisher. La recherche de corrélations entre variables quantitatives a été menée avec des régressions logistiques univariées. En cas de p<0,10, des analyses multivariées ont été réalisées. Pour étudier la variation de CC entre le diagnostic, M3, M6, M9 et M12 chez les mêmes sujets, des tests de Wilcoxon pour groupes appariés ont été effectués. Pour comparer les données quantitatives entre les 2 groupes, des tests de Mann-Whitney pour groupes non appariés ont été effectués. Un p<0,05 a été retenu comme significatif.
3/ Résultats :
3.1/ Caractéristiques de la cohorte :
Dix-neuf patients ont été éligibles. Quatre patients ont refusé de participer. Au total, 15 enfants ont été inclus. Neuf patients soit 60% présentaient une pathologie hématologique maligne (6 LAL, 3 lymphomes (anaplasiques à grandes cellules ou lymphome de Hodgkin), 3 (20%) des tumeurs solides (1 sarcome Ewing, 1 ostéosarcome, 1 néphroblastome) et 3 (20%) des tumeurs cérébrales (2 médulloblastomes, 1 glioblastome). L’âge médian était de 8,5 ans
(extrêmes 4-16 ans), 10 étaient de sexe féminin. Pendant la période de l’étude, 2 patients sont sortis de l’étude (décès à 6 mois et 9 mois de la prise en charge).
Cinq patients ont reçu de la radiothérapie : 3 une irradiation cérébrale et 2 une irradiation locale.
Douze patients soit 80% ont reçu une corticothérapie (hydrocortisone et/ou prednisolone et/ou dexaméthasone) : 9 une corticothérapie protocolaire dans le cadre de tumeur hématologique ; 3 à visée anti-oedémateuse chez ceux atteints de tumeur cérébrale. La corticothérapie totale protocolaire varie de 1800 mg/m2 à 5260 mg/m2 en équivalent prednisolone pour ces enfants selon le protocole utilisé pour chaque pathologie hématologique. Les doses totales de corticoïdes à visée anti-oedémateuse n’ont pas pu être recueillis précisément mais étaient au maximum de 1900 mg/m2 d’équivalent prednisolone. Cinq ont bénéficié d’une résection tumorale. Tous les patients ont eu une évaluation par une diététicienne. Sept patients ont reçu des compléments nutritionnels oraux; une patiente a bénéficié d’une nutrition entérale au long cours sur gastrostomie; sept une nutrition parentérale de courte durée (inférieure à 7 jours).
3.2/ Etat nutritionnel au diagnostic :
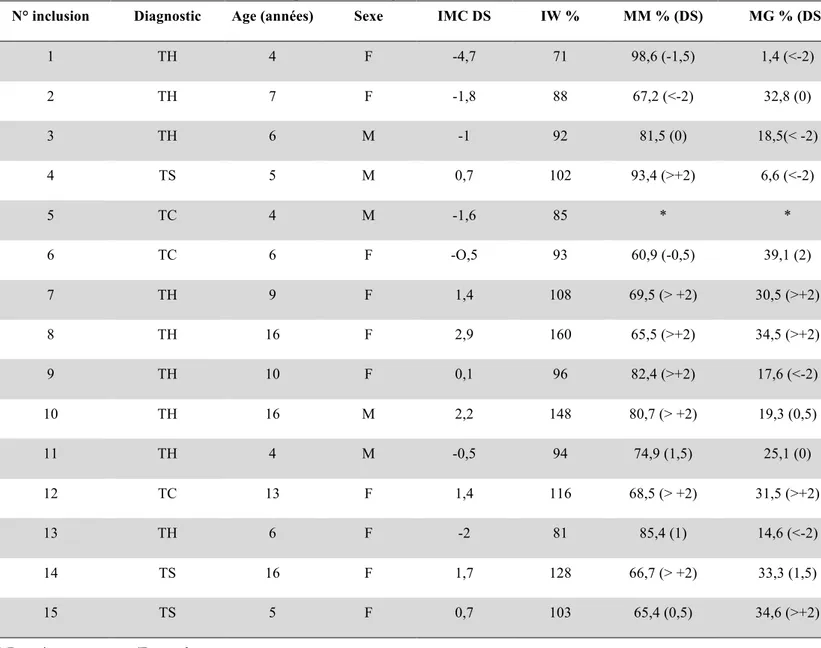
Les caractéristiques de l’état nutritionnel des patients ont été résumées dans le tableau 1.
Tableau 1 : Etat nutritionnel des patients au diagnostic
N° inclusion Diagnostic Age (années) Sexe IMC DS IW % MM % (DS) MG % (DS)
1 TH 4 F -4,7 71 98,6 (-1,5) 1,4 (<-2) 2 TH 7 F -1,8 88 67,2 (<-2) 32,8 (0) 3 TH 6 M -1 92 81,5 (0) 18,5(< -2) 4 TS 5 M 0,7 102 93,4 (>+2) 6,6 (<-2) 5 TC 4 M -1,6 85 * * 6 TC 6 F -O,5 93 60,9 (-0,5) 39,1 (2) 7 TH 9 F 1,4 108 69,5 (> +2) 30,5 (>+2) 8 TH 16 F 2,9 160 65,5 (>+2) 34,5 (>+2) 9 TH 10 F 0,1 96 82,4 (>+2) 17,6 (<-2) 10 TH 16 M 2,2 148 80,7 (> +2) 19,3 (0,5) 11 TH 4 M -0,5 94 74,9 (1,5) 25,1 (0) 12 TC 13 F 1,4 116 68,5 (> +2) 31,5 (>+2) 13 TH 6 F -2 81 85,4 (1) 14,6 (<-2) 14 TS 16 F 1,7 128 66,7 (> +2) 33,3 (1,5) 15 TS 5 F 0,7 103 65,4 (0,5) 34,6 (>+2)
* Données manquantes/Erreur de mesure TH: Tumeur hématologique
TS: Tumeur solide TC: Tumeur cérébrale
La médiane du poids au diagnostic était de 21 kg (extrêmes 10,8 kg à 88 kg). La médiane de l’IMC au diagnostic était de 0,1 DS (extrêmes -4,7 à + 2,9DS). La médiane de la MM était de 72,2% (extrêmes 60,9 à 98,6%). La médiane de la MG au diagnostic était de 27,8% (extrêmes 1,4-39,1%).
Un enfant était dénutri au diagnostic (MM < -2 DS) et 4 étaient surnutris (MG > + 2 DS). Il n’existait pas de différence significative d’état nutritionnel au diagnostic pour les trois groupes de pathologies malignes, que ce soit en termes de taux de MM, MG ou en termes d’IMC.
3.3/ Evolution de l’état nutritionnel de 0 à 12 mois :
En moyenne, le poids était stable entre MD et M3, chutait à M6 avec une ré-ascension à M9. Sur le plan individuel, 80% ont présenté une perte de poids significative (<5%) au cours du suivi. La perte de poids significative était plus importante durant la période de M3 à M6. L’IW (%) et l’ IMC (DS) étaient globalement stables sur l’ensemble du suivi.
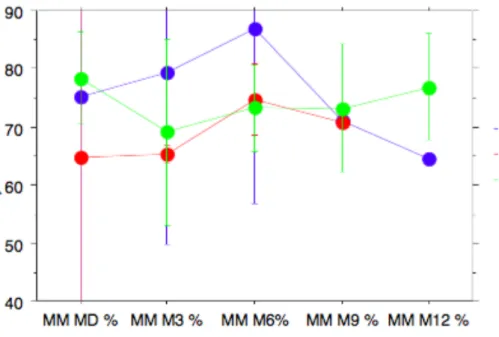
La variation moyenne de MM et MG au cours du suivi est présentée dans la figure 1.
La variation négative de la MM était la plus importante de MD à M3 (delta de -5%) pour ré-augmenter à 6 mois d’évolution (delta de + 6%) et diminuer de nouveau à M9 (delta de -4%). Six des patients (sur 12 mesures réalisées) avaient une baisse de la MM en %. Aucun des enfants ne présentait à M3 une MM < - 2 DS, deux à M6, un à M9. La MG augmentait de MD à M3 puis chutait à M6 (delta de – 6%) et pour ré-augmenter à M9. Quatre enfants avaient une MG > + 2 DS à M3 et à M9.
Ces évolutions présentaient une grande variabilité inter-patient et n’étaient donc pas statistiquement significatives.
3.4/ Evolution de l’état nutritionnel en fonction de la pathologie :
Sept des 9 patients atteints de pathologie hématologique (soit 77%) avaient un gain de poids de 0 à 3 mois (moyenne de 1,1 kg, dont deux de façon significative), avec une prise de MG non significative entre MD et M6 (+5%, p=0,1) alors que dans le même temps, ils présentaient une tendance à la baisse de la MM significative (-5%, p=0,045). Deux de ces enfants étaient dénutris à M6, puis un à M9 et deux à M12. Deux étaient surnutris à M3, un à M6, trois à M12.
Tous les enfants atteints de tumeur cérébrale avaient un gain de poids durant les trois premiers mois (dont 2/3 >5%). Chez ces derniers, les valeurs moyennes de % de MG étaient plus élevées durant les 9 premiers mois comparées aux autres pathologies que ce soit à MD (35,3%), M3 (34,7%) ou M6 (25,3%), M9 (29,3%). Aucun de ces enfants n’était dénutris durant l’évolution. Un gardait un état de surnutrition tout au long du traitement.
Tous les enfants atteints de tumeur solide perdaient du poids à 3 mois d’évolution. Ces derniers, avaient cependant une MM haute durant l’évolution à M3 (79,3%) et à M6 (87%) et à M9 et perdaient plus en MG que en MM. Aucun de ces enfants n’évoluait vers un état de dénutrition; seulement un avait une surnutrition initiale persistante à 6 mois d’évolution et un autre présentait une MG > + 2 DS à 6 et 9 mois du début du traitement.
Les variations moyennes de MM et MG au cours du suivi pour les différentes pathologies sont présentées dans la figure 2.
3.5/ Evolution de l’état nutritionnel en présence ou non d’une corticothérapie et d’une radiothérapie :
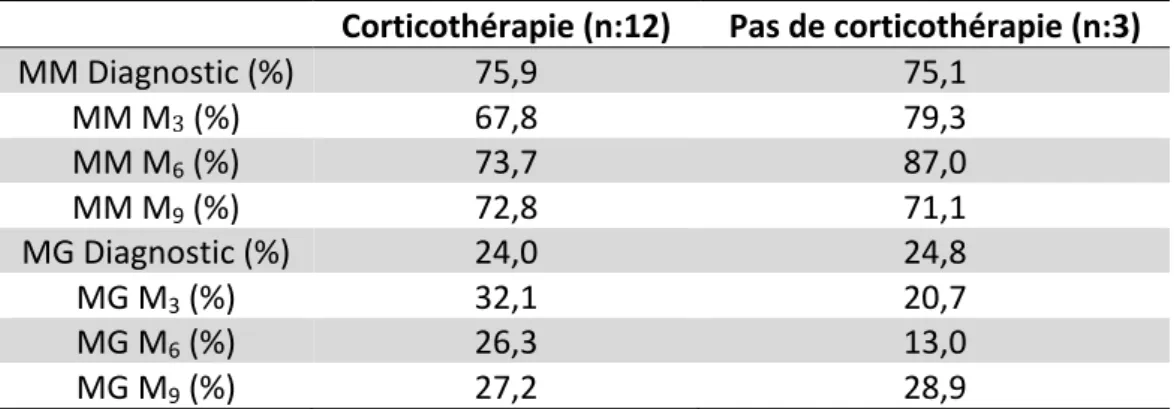
Il existait une nette tendance à la réduction de MM et à l’augmentation de la MG chez les enfants recevant une corticothérapie ; cette tendance était la plus prononcée à M3 et à M6 (écart de médiane à + 15% lors de l’utilisation de corticothérapie) sans atteindre le seuil de significativité statistique (tableau 2). Ceux ayant reçu une corticothérapie protocolaire (tumeurs hématologiques) avaient une MG plus élevée au cours du suivi avec une variation plus faible que ceux ayant reçu une corticothérapie anti-oedèmateuse (tumeurs cérébrales).
Corticothérapie (n:12) Pas de corticothérapie (n:3) MM Diagnostic (%) 75,9 75,1 MM M3 (%) 67,8 79,3 MM M6 (%) 73,7 87,0 MM M9 (%) 72,8 71,1 MG Diagnostic (%) 24,0 24,8 MG M3 (%) 32,1 20,7 MG M6 (%) 26,3 13,0 MG M9 (%) 27,2 28,9
Tableau 2 : Moyenne des MM et MG en fonction d’un traitement par corticothérapie ou non
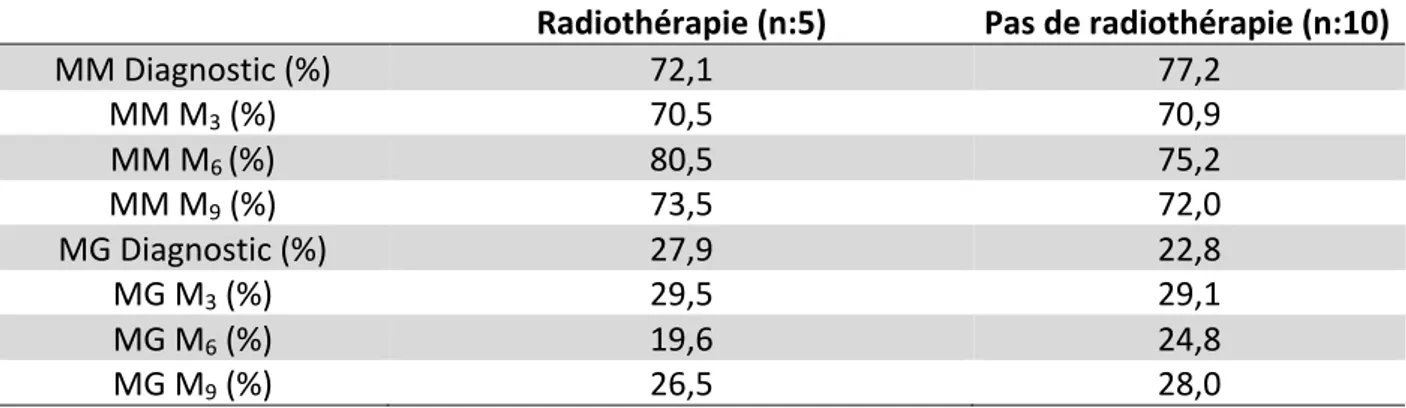
La CC des enfants relevant d’un traitement par radiothérapie n’était pas significativement différente au cours de l’évolution, des enfants n’ayant pas d’indication de radiothérapie. Les enfants ayant eu des séances de radiothérapie présentaient tous, à un moment du suivi, une MG > + 2 DS (tableau 3).
Radiothérapie (n:5) Pas de radiothérapie (n:10) MM Diagnostic (%) 72,1 77,2 MM M3 (%) 70,5 70,9 MM M6 (%) 80,5 75,2 MM M9 (%) 73,5 72,0 MG Diagnostic (%) 27,9 22,8 MG M3 (%) 29,5 29,1 MG M6 (%) 19,6 24,8 MG M9 (%) 26,5 28,0
Tableau 3 : Moyenne des MM et MG en fonction d’un traitement par radiothérapie ou non
3.6/ Apport du suivi de la composition corporelle par rapport au suivi du poids, de l’IMC et de l’ IW :
Le seul résultat à la limite de la significativité retrouvé était une corrélation entre la variation de la MM et la variation du poids (p=0,05 ; r=0,56) à M6.
Aucune corrélation n’a été retrouvée entre les variations de MM/MG, les variations du poids aux autres temps, l’IMC et l’ IW.
4/ Discussion:
L’objectif de cette étude était de décrire l’évolution de la CC au cours du traitement chez des enfants atteints de pathologies malignes afin, à terme, d’améliorer la prise en charge nutritionnelle en ciblant davantage la perte de MM et la prise de MG. Il s’agissait à notre connaissance de la 1ère étude dans la littérature française, et seulement la 2ème toutes langues confondues (3), décrivant les modifications de la CC dans le temps lors du traitement d’un cancer chez l’enfant mesurées par bio-impédancemétrie.
4.1/ Evolution de la composition corporelle:
Cette étude a montré que l’évolution de la CC était la plus importante entre le diagnostic et 6 mois, avec une perte de MM et une augmentation de MG à M3. De plus, nous avons vu qu’il pouvait exister une évolution inverse entre MM et poids, ce qui illustre l’importance du suivi de la MM, dont la valeur pronostique est la plus importante. La MM tendait ensuite à ré-augmenter à M6 puis re-diminuait à M9. Cette évolution avait également été mise en évidence, par Brinksma et al. (3) mais qui observait dans son étude, 17% d’enfants dénutris contre 0% dans notre étude à M3. Les 3 premiers mois correspondant en effet à la période de traitement la plus intensive (phase d’induction) pour la plupart des enfants: traitement par prednisone, déxaméthasone, séances de radiothérapie, chimiothérapie avec effets secondaires indésirables (mucite, asthénie, anorexie).
Dans cette étude, toutes les pathologies tumorales étaient à risque d’augmentation de la MG, en particulier les 3 premiers mois, sans aucune significativité retrouvée concernant l’influence de la corticothérapie et la radiothérapie.
Quatre-vingt pourcent des patients étudiés ont reçu une corticothérapie (protocolaire et dans le cadre de l’HTIC). Nous avons montré, comme d’autres (3,4,6,16) avant nous, qu’il s’agissait d’un facteur de risque de perte de MM et d’augmentation de la MG : en effet, les glucocorticoïdes augmenteraient la consommation d’énergie des patients et auraient un rôle, autre que l’augmentation des ingesta, sur la béta-oxydation des acides gras et la dépense énergétique de repos (12) mais sans atteindre la significativité comme dans d’autres études. La variation plus faible et la chute de MG moins importante tout au long du traitement pour les enfants atteints de tumeurs hématologiques étaient expliquées par l’utilisation de corticoïdes tout au long du traitement contrairement aux enfants atteints de tumeurs cérébrales recevant une corticothérapie seulement durant les premiers jours suivant le diagnostic. Le calcul exact des doses de corticothérapie utilisée dans les tableaux d’HTIC n’a pas pu être
calculé (données informatiques manquantes). Un % de MG plus élevé au diagnostic et une surnutrition étaient observés dans le groupe radiothérapie pouvant être expliqués par un déficit en hormone de croissance, un trouble des hormones thyroïdiennes très souvent présents au diagnostic de ces pathologies liés à la tumeur elle même (3,15).
Ceux qui bénéficiaient d’une radiothérapie initiale (et donc d’une corticothérapie anti-HTIC), correspondaient aux 3 patients atteints de tumeur cérébrale, avaient également une augmentation de leur MG du diagnostic à M3 accompagnée d’un état de surnutrition. Cette évolution de CC anormale chez ces patients peut être attribuée à l’altération de la sensibilité de la leptine au niveau hypothalamique (23,24) induite par la radiothérapie ainsi qu’à l’existence d’un polymorphisme de cette dernière altérant sa fonction et donc la régulation du poids. Cependant, certaines études récentes ne mettent pas en évidence d’association entre radiothérapie et évolution positive de la MG (16).
L’augmentation importante secondaire de M6 à M9 (+7%) de la MG dans le groupe radiothérapie correspondait aux deux enfants ayant reçu de la radiothérapie pendant ces périodes dans le cadre d’une tumeur solide (sarcome d’Ewing) et d’un lymphome de Hodgkin.
L’évolution (de la MG) sensiblement superposable dans ces deux groupes peut être expliquée par la plus grande proportion d’enfants ne recevant pas d’irradiation mais une corticothérapie (inclusion d’un plus grand nombre d’enfants atteints de pathologies hématologiques).
Une MM haute au diagnostic (2 patients avec MM > +2 DS) jusqu’à 9 mois de traitement était observée chez les enfants atteints de tumeurs solides contrairement à certaines études (3) sans modification majeure de leur CC après la chirurgie d’exérèse tumorale. Un enfant évoluait vers une surnutrition de 9 à 12 mois d’évolution pouvant être expliqué par une irradiation focale et pulmonaire protocolaire.
Enfin, ce travail confirme le fait que le poids et l’IMC ne sont pas des reflets fidèles de l’évolution de la CC. A 3 mois en particulier, l’IMC, qui était stable par rapport au diagnostic, ne permettait pas d’apercevoir le changement majeur de CC que subissaient les patients ; il en est de même pour l’ IW. Ceci confirme le fait que la mesure de la CC doit faire partie intégrante de l’évolution nutritionnelle, en particulier chez ces patients au métabolisme très perturbé.
4.2/ Les limites de l’étude:
Cette étude présente plusieurs limites. Tout d’abord, le nombre de patients inclus était faible. En effet, le service d’Immuno-Hémato-Oncologie Pédiatrique du CHU de Grenoble Alpes est un petit centre de recrutement avec une faible proportion de tumeurs solides et cérébrales, et la durée d’inclusion pour ce travail a été limitée dans le temps. De même, le nombre de mesures par patient a diminué au fil du temps car tous les patients n’ont pas encore terminé l’étude. Ce travail présente en effet des résultats préliminaires ; les inclusions et le suivi de la CC se poursuivent.
Les limites de cette étude incluent également de possibles biais de mesure d’impédancemétrie. En effet, la réalisation dans des conditions strictement identiques était difficilement réalisable (mouvements de l’enfant, prises opérateur-dépendant des mesures de tours de taille et de hanche). D’autres facteurs confondants potentiels sont la présence d’hyperhydratation lors des chimiothérapies, la réplétion vésicale, l’heure du dernier repas. L’intérêt de réaliser ces mesures à la fin de chaque phase du traitement protocolaire (fin d’induction, pré/post-chirurgical) doit se discuter pour certaines pathologies malignes. Enfin, par manque de moyens, nous n’avons pas pu étudier deux facteurs majeurs influençant la CC : l’activité physique de l’enfant, et la quantification des ingesta. Il est donc prévu de poursuivre cette étude en y incluant des évaluations de l’activité physique par actimétrie et
questionnaires d’activité, ainsi que des relevés alimentaires à chaque temps. Ceci permettra de mieux comprendre l’évolution de la CC chez ces patients, et à terme d’essayer de l’influencer de façon positive.
5/ Conclusion:
Cette étude a confirmé la nécessité d’étudier l’évolution de la CC pour suivre l’état nutritionnel des enfants et non l’utilisation seule des données anthropométriques simples. Il n’existe pas de relation entre l’évolution du poids et de la CC hormis une corrélation à la limite de la significativité entre la variation du poids et celle de la MM à M6. La période la plus à risque se situe entre le diagnostic et les trois premiers mois avec une perte de MM et une prise de MG.
Une prise en charge nutritionnelle préventive et précoce est donc nécessaire afin de limiter les conséquences de la malnutrition, facteur péjoratif important d’après les études. Un projet de mesure de l’activité physique et de relevé des ingesta parallèlement au suivi de la CC est en cours pour une meilleure compréhension de cette dernière.
Bibliographie : 1. Sommelet D, Clavel J, Lacour B. Epidémiologie des cancers de l’enfant. 2. Gaynor EPT, Sullivan PB. Nutritional status and nutritional management in children with cancer. Arch Dis Child.2015;100:1169‑72. 3. Brinksma A, Roodbol PF, Sulkers E, Kamps WA, de Bont ESJM, Boot AM, et al. Changes in nutritional status in childhood cancer patients: a prospective cohort study. Clin Nutr Edinb Scotl.2015;34:66‑73. 4. Murphy AJ, White M, Elliott SA, Lockwood L, Hallahan A, Davies PS. Body composition of children with cancer during treatment and in survivorship. Am J Clin Nutr.2015;102:891‑6. 5. Brinksma A, Roodbol PF, Sulkers E, de Bont ESJM, Burgerhof JGM, Tamminga RYJ, et al. Finding the right balance: An evaluation of the adequacy of energy and protein intake in childhood cancer patients. Clin Nutr Edinb Scotl.2015;34:284‑90. 6. Butturini AM, Dorey FJ, Lange BJ, Henry DW, Gaynon PS, Fu C, et al. Obesity and outcome in pediatric acute lymphoblastic leukemia. J Clin Oncol Off J Am Soc Clin Oncol.2007;25:2063‑9. 7. Brinksma A, Huizinga G, Sulkers E, Kamps W, Roodbol P, Tissing W. Malnutrition in childhood cancer patients: a review on its prevalence and possible causes. Crit Rev Oncol Hematol.2012;83:249‑75. 8. Sommelet D, Clavel J, Lacour B. Épidémiologie des cancers de l’enfant. Paris; Berlin; Heidelberg [u.a.: Springer; 2009. 9. Benton D. The influence of dietary status on the cognitive performance of children. Mol Nutr Food Res.2010;54:457‑70. 10. Galler JR, Bryce CP, Waber DP, Hock RS, Harrison R, Eaglesfield GD, et al. Infant malnutrition predicts conduct problems in adolescents. Nutr Neurosci.2012;15:186‑92. 11. Co-Reyes E, Li R, Huh W, Chandra J. Malnutrition and obesity in pediatric oncology patients: causes, consequences, and interventions. Pediatr Blood Cancer. 2012;59:1160‑7. 12. Reilly JJ, Brougham M, Montgomery C, Richardson F, Kelly A, Gibson BE. Effect of glucocorticoid therapy on energy intake in children treated for acute lymphoblastic leukemia. J Clin Endocrinol Metab. 2001;86.3742‑5. 13. Ventham JC, Reilly JJ. Childhood leukaemia: a model of pre-obesity. Proc Nutr Soc.1999;58:277‑81. 14. Blijdorp K, van den Heuvel-Eibrink MM, Pieters R, Boot AM, Delhanty PJD, van der
Lely A-J, et al. Obesity is underestimated using body mass index and waist-hip ratio in long-term adult survivors of childhood cancer. PloS One. 2012;7:e43269. 15. Sklar CA, Mertens AC, Walter A, Mitchell D, Nesbit ME, O’Leary M, et al. Changes in body mass index and prevalence of overweight in survivors of childhood acute lymphoblastic leukemia: role of cranial irradiation. Med Pediatr Oncol.2000;35:91‑5. 16. Zhang FF, Rodday AM, Kelly MJ, Must A, MacPherson C, Roberts SB, et al. Predictors of being overweight or obese in survivors of pediatric acute lymphoblastic leukemia (ALL). Pediatr Blood Cancer.2014;61:1263‑9. 17. Lange BJ, Gerbing RB, Feusner J, Skolnik J, Sacks N, Smith FO, et al. Mortality in overweight and underweight children with acute myeloid leukemia. JAMA. 2005;293:203‑11. 18. Murphy AJ, White M, Davies PSW. The validity of simple methods to detect poor nutritional status in paediatric oncology patients. Br J Nutr.2009;101:1388‑92. 19. Prado CMM, Siervo M, Mire E, Heymsfield SB, Stephan BCM, Broyles S, et al. A population-based approach to define body-composition phenotypes. Am J Clin Nutr.2014;99:1369‑77. 20. Warner JT. Body composition, exercise and energy expenditure in survivors of acute lymphoblastic leukaemia. Pediatr Blood Cancer.2008;50:456‑461; discussion 468. 21. Wan CS, Ward LC, Halim J, Gow ML, Ho M, Briody JN, et al. Bioelectrical impedance analysis to estimate body composition, and change in adiposity, in overweight and obese adolescents: comparison with dual-energy x-ray absorptiometry. BMC Pediatr. 2014;14:249. 22. Braillon P, Peretti N. Dual-energy X-ray absorptiometry.2011;25:91‑5. 23. Garmey EG, Liu Q, Sklar CA, Meacham LR, Mertens AC, Stovall MA, et al. Longitudinal changes in obesity and body mass index among adult survivors of childhood acute lymphoblastic leukemia: a report from the Childhood Cancer Survivor Study. J Clin Oncol Off J Am Soc Clin Oncol.2008;26:4639‑45. 24. Nolan VG, Krull KR, Gurney JG, Leisenring W, Robison LL, Ness KK. Predictors of future health-related quality of life in survivors of adolescent cancer. Pediatr Blood Cancer.2014;61:1891‑4.
Annexes :
Figure 2 : Variation de la MM et de la MG en fonction des pathologies:
Tumeurs solides
---Tumeurs hématologiques
---Tumeurs cérébrales ---