HAL Id: dumas-01758193
https://dumas.ccsd.cnrs.fr/dumas-01758193
Submitted on 19 Oct 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
dans la prise en charge du cytomegalovirus : faut-il
réévaluer la zone thérapeutique ? Résultats d’une étude
préliminaire menée au CHU de Rennes
Claire Arnoult
To cite this version:
Claire Arnoult. Suivi thérapeutique pharmacologique du ganciclovir dans la prise en charge du cy-tomegalovirus : faut-il réévaluer la zone thérapeutique ? Résultats d’une étude préliminaire menée au CHU de Rennes. Sciences du Vivant [q-bio]. 2016. �dumas-01758193�
THÈSE D'EXERCICE / UNIVERSITÉ DE RENNES 1
FACULTÉ DE PHARMACIE
sous le sceau de l’Université Européenne de Bretagne
THÈSE EN VUE DU
DIPLÔME D'ÉTAT DE DOCTEUR EN PHARMACIE
présentée par
Claire
Arnoult
né(e) le 13 novembre 1991 à Saint-Malo
________
Intitulé de la thèse :
Suivi thérapeutique pharmacologique
du ganciclovir dans la prise en charge
du cytomegalovirus : faut-il réévaluer
la zone thérapeutique ?
Résultats d'une étude préliminaire
menée au CHU de Rennes.
Thèse soutenue à Rennes le 27 janvier 2016
devant le jury composé de :
Anne GOUGEON
Professeur des Universités à l'UFR de pharmacie Rennes 1 et Praticien Hospitalier au CHU de Rennes / Président
Charlotte PRONIER
Docteur en pharmacie, assistante Hospitalo-universitaire au CHU de Rennes et à l'Université de Rennes 1/ Juge
Pierre FILLATRE
Docteur en médecine, chef de clinique et assistant des hôpitaux au CHU de Rennes / Juge
Florian LEMAITRE
Docteur en pharmacie, assistant Hospitalo-universitaire au CHU de Rennes et à l'Université de Rennes 1 / Directeur de thèse
UNIVERSITE DE RENNES 1
FACULTE DES SCIENCES PHARMACEUTIQUES ET BIOLOGIQUES
LISTES DES ENSEIGNANTS-CHERCHEURS ANNEE 2015-2016
PROFESSEURS
1 BOUSTIE Joël
2 BURGOT Gwenola
3 DONNIO Pierre Yves
4 FAILI Ahmad 5 FARDEL Olivier 6 FELDEN Brice 7 GAMBAROTA Giulio 8 GOUGEON Anne 9 LAGENTE Vincent 10 LE CORRE Pascal
11 LORANT (BOICHOT) Elisabeth
12 MOREL Isabelle
13 SERGENT Odile
14 SPARFEL-BERLIVET Lydie
15 TOMASI Sophie
16 URIAC Philippe
17 VAN DE WEGHE Pierre
18 VERNHET Laurent
PROFESSEURS ASSOCIES
1 BUREAU Loïc 2 DAVOUST NoëllePROFESSEURS EMERITES
1 CILLARD JosianeMAITRES DE CONFERENCE
1 ABASQ-PAOFAI Marie-Laurence 2 ANINAT Caroline 3 AUGAGNEUR Yoann 4 BEGRICHE Karima 5 BOUSARGHIN Latifa 6 BRANDHONNEUR Nolwenn 7 BRUYERE Arnaud 8 BUNETEL Laurence 9 CHOLLET-KRUGLER Marylène 10 COLLIN Xavier 11 CORBEL Jean-Charles 12 DAVID Michèle 13 DELALANDE Olivier 14 DELMAIL David 15 DION Sarah 16 DOLLO Gilles 17 GILOT David 18 GOUAULT Nicolas 19 HITTI Eric 20 JEAN Mickaël 21 LECUREUR Valérie 22 LE FERREC Eric 23 LE PABIC Hélène 24 LEGOUIN-GARGADENNEC Béatrice25 LOHEZIC-LE DEVEHAT Françoise
26 MARTIN-CHOULY Corinne 27 MINET Jacques 28 MOURET-PLEIBER Liza 29 NOURY Fanny 30 PINEL-MARIE Marie-Laure 31 PODECHARD Normand 32 POTIN Sophie 33 RENAULT Jacques 34 ROUILLON Astrid
ASSISTANT HOSPITALO-UNIVERSITAIRE (AHU)
1 GICQUEL Thomas
ATER
1 SMIDA Imen
2 PASCREAU Gaëtan
Remerciements
J'adresse mes remerciements les plus sincères,
A Madame le Professeur Anne Gougeon, pour avoir accepté de présider mon jury et pour votre enseignement reçu à la faculté.
A Monsieur le Docteur Florian Lemaitre, Directeur de thèse, pour m'avoir accueilli en stage hospitalo-universitaire au laboratoire de pharmacologie du CHU de Rennes et pour m'avoir guidé dans la réalisation de ce travail. Votre sympathie, vos conseils et votre soutien m'ont été précieux. Je vous suis également reconnaissante pour le temps que vous m'avez accordé et pour votre relecture méticuleuse.
A Madame le Docteur Charlotte Pronier, pour avoir accepté de participer à mon jury de thèse, pour l'intérêt que vous avez porté à mon travail et pour votre grande disponibilité.
A Monsieur le Docteur Pierre Fillatre, pour avoir accepté de participer à mon jury de thèse et pour l'intérêt que vous avez porté à mon travail.
A Monsieur Cyril Leven, pour sa disponibilité, ses connaissances et son aide précieuse dans la réalisation des parties statistiques de ce projet.
A l'ensemble de l'équipe du laboratoire de pharmacologie, pour m'avoir accueilli dans leur service lors de mon stage hospitalo-universitaire de 5ème année de pharmacie et pour leur gentillesse.
Cette thèse représente l’aboutissement de mes études de pharmacie, c’est pourquoi je tiens à adresser mes remerciements à toutes les personnes qui m’ont accompagné tout au long de mon parcours.
A Madame le Docteur Anne GOUBIN et à l'ensemble de l'équipe officinale de Saint Méloir des Ondes, Emmanuelle, Florence, Patricia, Lucille et Yvonnick, pour m'avoir fait partager leurs connaissances et pour la confiance qu'ils m'ont accordée. J'ai beaucoup appris à leurs côtés et ils m'ont donné le goût de travailler dans le milieu officinal. Leur gentillesse, leur sympathie et leur soutien pendant la réalisation de cette thèse et lors du stage de 6ème année m'ont été très précieux.
A mes parents, pour m'avoir permis de faire des études et pour m'avoir toujours soutenu lors de ces six années.
A mon frère, pour sa participation à mes révisions, pour m'avoir soutenu et changé les idées quand c'était nécessaire.
A Tatiana, pour son investissement, sa relecture méticuleuse et ses conseils très précieux.
A l'ensemble de ma famille, grands-parents, oncles, tantes, cousins et cousines, pour leur soutien, leurs encouragements et leur présence. J'ai beaucoup de chance d'avoir une famille si unie autour de moi et je vous remercie d'être là dans tous les moments importants.
Enfin, à mes amies Eloïse, Anne et Sarah pour tous les souvenirs partagés lors de ces années d'études.
Table des matières
Remerciements ... 4
Liste des abréviations... 9
Liste des figures et tableaux ... 13
Introduction ... 16
PARTIE 1: Généralités ... 19
1. Histoire naturelle du Cytomegalovirus ... 20
1.1. Classification ... 20
1.2. Structure générale ... 21
1.3. Génome viral ... 24
1.4. Cycle de multiplication ... 26
1.4.1. Tropisme et entrée du virus ... 26
1.4.2. Cycle de réplication ... 28 1.4.3. Dissémination hématogène ... 31 1.4.4. Latence ... 32 1.4.5. Réactivation ... 32 1.5. Epidémiologie ... 32 1.6. Manifestations cliniques ... 34
1.6.1. Infection chez le patient immunocompétent ... 35
1.6.2. Infection chez le patient immunodéprimé ... 35
1.6.3. Infection congénitale... 37
1.6.4. HCMV et cancer ... 37
1.7. Réponse immunitaire au HCMV ... 38
1.7.1. Mise en place de l'immunité innée et adaptative ... 38
1.7.2. Echappement du HCMV au système immunitaire ... 40
1.8. Diagnostic ... 41
1.8.1. Méthodes de diagnostic ... 41
1.8.2. Stratégies diagnostiques ... 43
2. Prise en charge thérapeutique et suivi de la pathologie ... 45
2.1. Molécules antivirales ... 45
2.1.2. Le foscarnet (FOS) ou phosphonoformate (PFA) ... 50
2.1.3. Le cidofovir (CDF) ... 51
2.1.4. L'aciclovir (ACV) et le valaciclovir (VACV) ... 52
2.1.5. Les immunoglobulines intraveineuses ... 54
2.2. Stratégies thérapeutiques ... 55
2.2.1. Traitement préventif... 55
2.2.1.1. Le traitement prophylactique ... 55
2.2.1.2. Le traitement préemptif ... 57
2.2.1.3. Traitement prophylactique versus traitement préemptif ... 58
2.2.1.4. Rôle du traitement immunosuppresseur post-greffe ... 59
2.2.1.5. Prévention de l'infection materno-foetale ... 60
2.2.2. Traitement curatif ... 60
2.2.2.1. Prise en charge de l'infection materno-foetale ... 60
2.2.2.2. Prise en charge du patient infecté par le VIH ... 61
2.2.2.3. Prise en charge du patient transplanté ... 63
2.3. Suivi de la pathologie ... 64 2.3.1. Le suivi clinique ... 64 2.3.2. Le suivi virologique ... 65 2.3.3. Le suivi biologique ... 65 2.3.4. Le suivi immunologique ... 66 2.3.5. Le suivi pharmacologique ... 67
2.4. Résistance aux traitements ... 67
2.4.1. Facteurs de risques ... 68 2.4.2. Mécanismes de résistance ... 68 2.4.3. Diagnostic ... 70 2.4.3.1. Méthodes phénotypiques ... 70 2.4.3.2. Méthodes génotypiques ... 71 2.4.4. Adaptation du traitement ... 72 2.5. Perspectives thérapeutiques ... 74
2.5.1. Molécules en cours d'évaluation ... 74
2.5.1.1. Maribavir ... 74
2.5.1.2. Letermovir ... 75
2.5.1.4. Leflunomide... 77
2.5.1.5. Artesunate ... 78
2.5.2. Vaccin anti-CMV ... 78
3. Suivi thérapeutique pharmacologique (STP) ... 81
3.1. Définition ... 81
3.1.1. Le STP : c'est quoi ? ... 81
3.1.2. Indications du STP ... 83
3.1.3. Les molécules éligibles au STP ... 84
3.1.4. Précautions d'utilisation ... 85
3.1.5. Intérêts et limites ... 87
3.1.6. Exemples d'utilisation ... 88
3.2. Suivi thérapeutique pharmacologique du ganciclovir ... 88
3.2.1. Intérêt ... 88
3.2.2. Indications ... 93
3.2.3. Précautions d'utilisation ... 94
3.2.4. Cibles thérapeutiques ... 94
PARTIE 2 : Etude au CHU de Rennes ... 96
Conclusion ... 108
Liste des abréviations
ACV : Aciclovir
ADN : Acide DesoxyriboNucléique
AMM : Autorisation de Mise sur le Marché AP-1 : Activator Protein-1
ATU : Autorisation Temporaire d'Utilisation AUC : Area Under the Curve
CCMV : Cytomégalovirus du chimpanzé CDF : Cidofovir
CHU : Centre Hospitalo-Universitaire CI50 : Concentration Inhibitrice médiane Cmin : Concentration résiduelle
CMH : Complexe Majeur d'Histocompatibilité CMV : Cytomegalovirus
COX : Cyclo-Oxygenase
CPG : Chromatographie en Phase Gazeuse CSH : Cellules Souches Hématopoïétiques CV : Charge Virale
del : délétion
DFG : Débit de Filtration Glomérulaire dGTP : DesoxyGuanosine Triphosphate
D+/R- : Donneur séropositif/Receveur séronégatif D-/R- : Donneur séronégatif/Receveur séronégatif D+/R+ : Donneur séropositif/Receveur séropositif E (phase) : Early (phase précoce)
ECP : Effet CytoPathogène
EGFR : Epidermal Growth Factor Receptor ELISA : Enzyme-Linked ImmunoSorbent Assay ELISPOT : Enzyme-Linked ImmunoSpot
EMIT : Enzyme Multiplied Immunoassay Technique FOS : Foscarnet
FPIA : Fluorescent Polarization ImmunoAssay GCV : Ganciclovir
GFP : Green Fluorescent Protein HAS : Haute Autorité de Santé HCMV : Cytomegalovirus Humain HE : High Exposure (Haute exposition)
HHV : Human Herpes Virus (Virus de l'Herpes Humain) HPLC : High-Performance Liquide Chromatography HSV : Herpes Simplex Virus
ICAM : Intercellular Adhesion Molecule IE : Immediate Early (Très précoce) Ig : Immunoglobuline
IL : Interleukine INF : Interferon
IR : Indice de Résistance IRL : Internal Repeat Long IRS : Internal Repeat Short IV : IntraVeineux
L (phase) : Late (phase tardive) LCR : Liquide Céphalo-Rachidien LE : Low Exposure (Faible exposition)
LFA : Leukocyte Function-Associated molecule LT : Lymphocytes T
mCBP : Minor Capsid Binding Protein (Protéine mineure de capside) mCP : Minor Capsid Protein (Protéine mineure de Capside)
MCP : Major Capsid Protein (Protéine Majeure de Capside) MIEP : Major Immediate Early Promoter
NABM : Nomenclature des Actes de Biologie Médicale NFĸB : Nuclear Factor-Kappa B
NFS : Numération Formule Sanguine NK : Natural Killer
ORF : Open Reading Frame (cadre de lecture ouvert) PCR : Polymerase Chain Reaction
PCR-RFLP : PCR-Restriction Fragment Length Polymorphism PEPT-1 : Peptide Transporter 1
PFA : Acide PhosphonoFormique PRA : Plaque Reduction Assay
QNAT : Quantitative Nuclear Acid Testing RhCMV : Rhesus Cytomegalovirus
SCP : Smallest Capsid Protein
SIDA : Syndrome d'ImmunoDéficience Acquise STP : Suivi Thérapeutique Pharmacologique t1/2 : Temps de demi-vie
TAN : Temps Avant Négativation
TAP : Transport Antigen Protein (Protéine de Transport des Antigènes) TDM : Therapeutic Drug Monitoring
TLR : Toll Like Receptor (Récepteur de type Toll) TNFα : Tumor Necrosis Factor alpha
TRL : Terminal Repeat Long TRS : Terminal Repeat Short UL : Unique Long
US : Unique Short VACV : Valaciclovir VGCV : Valganciclovir
VIH : Virus de l'Immunodéficience Humaine VO : Voie Orale
VZV : Varicella-Zoster Virus (virus varicelle-zona) WHO : World Health Organization
Liste des figures et tableaux
Figure 1 : Structure d'un virion HCMV ... 21
Figure 2 : Structure génomique simplifiée . ... 24
Figure 3 : Représentation schématique des quatre isoformes du génome viral de HCMV ... 24
Figure 4 : Carte du génome de HCMV. ... 25
Figure 5 : Physiopathologie de l'infection à CMV... 26
Figure 6 : Illustration de l'entrée du HCMV dans la cellule hôte ... 27
Figure 7 : Cycle de réplication du HCMV ... 28
Figure 8 : Dissémination hématogène du CMV au cours d'une infection active ... 31
Figure 9 : Contrôle du HCMV par l'immunité innée et adaptative. ... 38
Figure 10 : Molécules antivirales approuvées dans le traitement du CMV: ganciclovir, valganciclovir, foscarnet, cidofovir, et valaciclovir ... 45
Figure 11 : Absorption et bioactivation du valganciclovir. ... 47
Figure 12 : Stratégie proposée en cas de suspicion de résistance virologique au traitement ... 72
Figure 13 : Algorithme proposé pour la gestion des résistances suspectées aux antiviraux et basé sur le consensus des opinions d'experts.. ... 73
Figure 14 : Définition de l'intervalle thérapeutique. ... 81
Figure 15 : Paramètres pharmacocinétiques et pharmacodynamiques contribuant à la variabilité interindividuelle entre posologie prescrite, concentration sanguine et effet clinique obtenu. ... 82
Figure 16 : Algorithme de décision proposé pour le suivi pharmacocinétique ... 84
Figure 17 : Courbe concentration-temps en administration discontinue. ... 85
Figure 18 : Profil pharmacocinétique type du ganciclovir après administration de 900 mg de valganciclovir chez un patient de 80 kg et présentant un débit de filtration glomérulaire de 80 mL/min ... 90
Figure 19 : Répartition et caractéristiques cliniques des patients. ... 101
Figure 20 : Courbes de Kaplan Meyer. Probabilité d'obtenir une charge virale détectable en fonction du temps : comparaison des groupes HE et LE. ... 104
Tableau 1 : Classification des betaherpesvirus ... 20 Tableau 2 : Rôles des différentes interactions protéines d'enveloppe et cellule hôte
... 28 Tableau 3 : Résumé des manifestations cliniques de l'infection à CMV ... 37 Tableau 4 : Récapitulatif des caractéristiques des inhibiteurs de l'ADN polymérase
virale utilisés dans le traitement de l'infection à HCMV ... 53 Tableau 5 : Recommandations internationales sur les molécules à utiliser en
prophylaxie de l'infection à CMV chez les patients transplantés d'organes solides (en fonction du type de greffe). ... 56 Tableau 6 : Durées recommandées pour le traitement prophylactique du CMV chez
les transplantés d'organes solides en fonction du type de greffe et du statut donneur/receveur ... 57 Tableau 7 : Avantages et inconvénients des traitements prophylactiques et
préemptifs à CMV ... 58 Tableau 8 : Posologies du ganciclovir, valganciclovir, foscarnet, cidofovir et
fomivirsen dans le traitement des rétinites à CMV... 63 Tableau 9 : Posologies recommandées pour le ganciclovir, le valganciclovir et le
valaciclovir chez les patients adultes transplantés présentant une altération de la fonction rénale (en utilisant la formule de Cockcroft-Gault) ... 64 Tableau 10 : Niveaux de résistances au ganciclovir en fonction des génotypes UL97
... 69 Tableau 11 : Exemples de mutations affectant UL54 et entrainant des résistances au ganciclovir ... 69 Tableau 12 : Récapitulatif des candidats pour la vaccination au HCMV ... 80 Tableau 13 : Médicaments dont le suivi thérapeutique pharmacologique (STP) est
proposé par les Sociétés Savantes internationales de Pharmacologie. ... 88 Tableau 14 : Récapitulatif des différentes données pharmacologiques de la
littérature. ... 95 Tableau 15 : Grades de toxicité hématologique utilisés pour l'étude. ... 99 Tableau 16 : Classification des stades d'évolution de la maladie rénale chronique.
... 100 Tableau 17 : Caractéristiques démographiques, biologiques et virales des patients
Tableau 18 : Comparaison du temps avant négativation et du nombre de mutations observés entre les groupes faible et forte exposition... 103 Tableau 19 : Comparaison des toxicités hématologiques observées dans les
Agent infectieux largement répandu au niveau mondial, le cytomegalovirus (CMV) affecte toutes les populations. Membre de la famille des herpesviridae dont il partage des caractéristiques communes (structure, cycle de réplication, capacité à induire une infection latente...), il se distingue par son important génome. Sans conséquence clinique chez la plupart des individus sains, il profite d'un système immunitaire affaibli pour se développer. Patients infectés par le VIH (Virus de l'Immunodéficience Acquise) et patients transplantés sous immunodépresseurs sont ses principales victimes. L'infection est responsable d'une fièvre persistante et peut se propager à différents organes à l'origine de pneumonies, colites, rétinites, hépatites, encéphalites ... Chez le patient transplanté, le rejet de greffe est l'effet indirect de l'infection le plus redouté. Le CMV peut également se transmettre au foetus via le placenta pendant la grossesse et représente la première cause d'infection congénitale virale.
La prise en charge de l'infection par le CMV repose sur l'utilisation de molécules antivirales comme le ganciclovir, le cidofovir, le foscarnet ou encore le valaciclovir. L'ADN polymérase virale, indispensable à la réplication du virus, représente leur cible commune. Compte tenu du risque, un traitement préventif avec deux stratégies possibles est recommandé chez les patients transplantés. On distingue le traitement prophylactique commencé dans les premiers jours post-transplantation et le traitement préemptif qui attend la détection d'une charge virale CMV pour être débuter. Le ganciclovir (GCV) ou sa prodrogue, le valganciclovir représentent les molécules de choix aussi bien en traitement curatif que préventif. L'augmentation de l'incidence des mutations de résistance au ganciclovir et aux autres molécules antivirales rende dans certains cas le traitement inadapté. Pour pallier à ce problème, de nouvelles molécules comme le maribavir, le letermovir ou le brincidofovir sont en cours de développement.
Le suivi clinique, biologique et virologique du patient est indispensable au cours du traitement de l'infection. Toujours dans un but d'améliorer la prise en charge, un suivi pharmacologique peut également s'inscrire dans cette démarche pour maximiser les chances de réussite du traitement et minimiser le risque fréquent sous ganciclovir, d'effets indésirables. Ce suivi est proposé au CHU (Centre Hospitalo-Universitaire) de Rennes. La mesure des concentrations plasmatiques en ganciclovir peut être demandée et, après comparaison avec des valeurs cibles, elle peut aboutir à la modification des posologies.
L'expérience clinique au laboratoire rennais de pharmacologie a parfois montré que des concentrations plasmatiques en ganciclovir supérieures à celles attendues permettaient une bonne amélioration du patient. La zone thérapeutique aujourd'hui utilisée pour les concentrations résiduelles plasmatiques de ganciclovir s'étend entre 1 et 2 µg/ml. Les difficultés rencontrées dans la prise en charge du CMV (résistances aux traitements, effets indésirables hématologiques...) montrent que des améliorations sont à apporter. Dans cette démarche, la révision des concentrations thérapeutiques cibles pourraient peut-être être envisagée. Une étude préliminaire rétrospective a ainsi été menée pour évaluer l'impact de l'exposition au ganciclovir sur l'efficacité et la toxicité du traitement. Des concentrations résiduelles supérieures à la zone thérapeutique utilisée aujourd'hui ne seraient-elles pas associées à une meilleure et plus rapide éradication du virus ?
Avant de présenter l'étude réalisée au CHU de Rennes, il semble important de prendre connaissance des données actuelles sur le cytomegalovirus lui-même, sur les traitements, le suivi thérapeutique et sur les études déjà réalisées sur le sujet.
1. Histoire naturelle du Cytomegalovirus
C'est en 1904 que la maladie des inclusions cytomégaliques a été mise en évidence suite à l'examen de produits d'avortements et de viscères d'enfants mort-nés par Ribbert, Jesionek et Kiolemenoglou. Il faudra attendre 1956 pour que Smith et Rowe isolent le virus responsable de cette maladie et 1960 pour que Weller et al. propose le terme "cytomegalovirus". (1) (2) (3)
1.1. Classification
Avec les virus herpès simplex (HSV), le VZV (virus de la varicelle et du zona) ou encore l'EBV (Epstein Barr Virus), le cytomégalovirus humain appartient à la famille des Herpesviridae. Virus ubiquitaire, son important génome le classe dans la sous famille des βherpesvirinae aux côtés des Muromegalovirus et des Roseolovirus.
Tableau 1: Classification des betaherpesvirus (4)
Virus Genre Virus humains HHV 5 ou cytomegalovirus humain HHV 6A HHV 6B HHV 7B
Virus primates non humains Cytomegalovirus du chimpanzé Cytomegalovirus rhesus
Virus des rongeurs
Cytomegalovirus de la souris Cytomegalovirus du rat Cytomegalovirus Roseolovirus Roseolovirus Roseolovirus Cytomegalovirus Cytomegalovirus Muromegalovirus Muromegalovirus
Le genre cytomegalovirus regroupe le HCMV (cytomegalovirus humain), le CCMV (cytomegalovirus du chimpanzé) et le RhCMV (rhesus cytomegalovirus). (4) Nous nous intéresserons ici seulement au cytomegalovirus humain HCMV connu également sous le nom de HHV-5 (Human Herpes Virus 5).
Le HCMV appartient au groupe 2 des agents biologiques pathogènes (5) définis comme des agents biologiques pouvant provoquer une maladie chez l'homme et constituer un danger pour les travailleurs et dont la propagation dans la collectivité est peu probable ; il existe généralement une prophylaxie ou un traitement efficace.
1.2. Structure générale
Le CMV présente les caractères structuraux de sa famille Herpesviridae (4) : un ADN bicaténaire linéaire de grande taille contenu dans une capside icosaédrique. L'ensemble est entouré d'une enveloppe. Une structure protéique appelée tégument est retrouvé entre la capside et la membrane
Figure 1: Structure d'un virion HCMV. Schéma réalisé par "the human cytomegalovirus study group" et Dr. Marko
Reschke à Marburg, Germany.
D'un point de vue taille, la capside mesure entre 115 et 130 nm de diamètre et le virion complet autour de 150 à 200 nm de diamètre.
Le caractère de virus enveloppé du CMV lui confère une grande fragilité. Sa survie dans le milieu extérieur est très limitée. Il est détruit par l'ébullition, l'eau de javel diluée, les agents chimiques de désinfection usuels et le savon. (6)
L'analyse du protéome très complexe du HCMV à partir de la souche référence de laboratoire AD169, a permis de mettre en évidence quelques protéines structurales (7) :
Protéines de capside :
La capside icosaédrique est composée de 12 pentons et 150 exons.
Pour rappel, les pentons et hexons sont des protomères qui s'associent par liaisons non covalentes pour former des capsomères, unités de base des capsides icosaédriques virales. Les pentons forment les extrémités de l'icosaèdre tandis que les exons occupent les arêtes et faces triangulaires.
Au moins 5 protéines de capside ont pu être mises en évidence :
La protéine majeure de capside (ou MCP pour "Major Capsid Protein") codée par le gène UL86 est la plus abondante, elle forme les pentons et hexons de la capside.
La protéine mineure de liaison à la capside (ou mCBP pour "minor capsid binding protein") codée par le gène UL46 est localisée sur la face interne de la capside et est liée à l'ADN viral.
Ces deux protéines s'organisent autour d'une "pré-capside" qui lie les pentons et exons entre eux. Sont retrouvés :
des fragments de la protéine d'assemblage, codée par UL80.
la protéine mineure de la capside (ou mCP pour Minor Capsid Protein) codée par le gène UL85.
Enfin, la SCP pour Smallest Capsid Protein codée par le gène UL48-49 possède un rôle dans l'assemblage de la particule infectieuse.
Protéines du tégument :
Le tégument peut être défini comme un revêtement amorphe de capside qui maintient l'association entre l'enveloppe et la capside du virion. Il se forme par additions séquentielles de protéines d'abord dans le noyau puis dans le cytoplasme.
Une trentaine de protéines du tégument sont retrouvées. Elles possèdent des rôles divers et sont utiles aussi bien dans les premières étapes de l'infection juste après l'entrée du virus, que dans les stades plus tardifs comme l'assemblage du virion. Certaines de ces protéines peuvent également modifier la réponse de la cellule hôte à l'infection par le CMV.
La ppUL83 ou pp65 est une des protéines clés du tégument car elle est recherchée pour le diagnostic. Elle est la plus abondante et constitue environ 95% du tégument.
Glycoprotéines d'enveloppe :
L'enveloppe est composée d'un double feuillet lipidique externe dérivant de la membrane nucléaire de la cellule hôte et comportant des glycoprotéines virales de surface conditionnant le caractère infectieux du virus.
Il existe une quarantaine de protéines d'enveloppe mais seulement une dizaine ont été caractérisées pour le moment.
Les glycoprotéines communes à d'autres herpesvirus sont retrouvées dans les proportions suivantes : gM et gN > gB (UL55) > gH (UL75), gL (UL115), gO (UL74). Ces complexes protéiques jouent un rôle certain dans l'entrée des herpesvirus dans les cellules hôtes. Par exemple, gB et gH conditionnent l'adhésion du virus à la cellule cible et la fusion des enveloppes cellulaires et virales.
1.3. Génome viral
Le HCMV présente un génome d'environ 235 000 paires de bases. Il est le plus long et le plus complexe de tous les génomes des Herpesviridae.
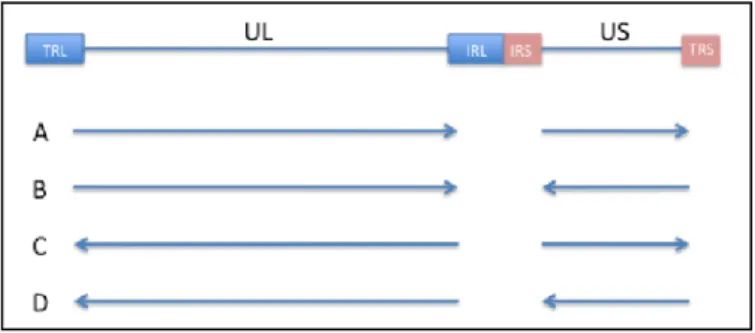
Son organisation est dite de classe E (4). Il est composé de deux domaines : un segment long (L) de 115.106 daltons et un segment court (S) de 36.106 daltons. Chaque segment est composé d'une région centrale unique : UL et Us. On retrouve
des séquences répétées : séquences a, TRL et TRS aux extrémités du génome
complet et IRL et IRS à l'intersection des domaines courts et longs.
Figure 2: Structure génomique simplifiée. Kotenko et al. PNAS February 15.
Nomenclature: UL – Unique long; US – Unique short; TRL – Terminal repeat long; IRL – Internal repeat long; inverted repeat of TRL; TRS –Terminal repeat short; IRS – Internal repeat short; inverted repeat of TRS
Au cours de la réplication, il apparaît 4 isoformes différentes du génome viral selon l’orientation des séquences UL et US.
Figure 3: Représentation schématique des quatre isoformes du génome viral de HCMV (8)
De façon générale, le segment UL contient les gènes viraux conservés entre
les différentes espèces de βherpesvirus et quelques protéines jouant un rôle dans la distribution cellulaire et tissulaire du virus. D'autre part, le segment US présente des
gènes dont la fonction est spécifique au βherpesvirus concerné (ex: rôle dans la restriction d'hôte du CMV). (7)
Le génome présente plus de 200 cadres de lecture ouverte.
Figure 4: Carte du génome de HCMV. En vert sont annotées les ORFs (Open Reading Frames) capables de
coder pour de vrais polypeptides; en rouge les ORFs ne pouvant coder des peptides et en bleus des ORFs encore non reconnues mais dont on suppose fortement qu'elles codent pour des protéines. Chaque marque sur la séquence représente 1000 paires de base. Murphy et al. PNAS November 11, 2003 vol 100 no 23
Les études montrent que le génome des différentes souches de HCMV est homologue à 95%. (9) Cependant, il faut noter que certaines souches cliniques contiennent des différences génotypiques qui pourraient être à l'origine de variations sur le tropisme tissulaire, la virulence ou encore le "potentiel pathogénique" de l'infection par HCMV.
D'un point de vue pratique, ces différences sont à prendre en compte notamment lors du choix des régions cibles pour les techniques de biologie moléculaire. Il faut utiliser les régions hautement conservées pour le diagnostic et les régions variables plutôt pour un typage épidémiologique. Ce polymorphisme génétique peut également être à l'origine de résistances aux traitements spécifiques ciblant une protéine particulière du HCMV. Par exemple, pour la protéase HCMV une mutation au niveau du gène UL80 peut entraîner une non efficacité du traitement qui ne reconnaît pas la protéase. Enfin, certaines études cherchent à montrer la corrélation entre génotype et développement clinique de la maladie mais les résultats restent pour le moment non significatifs.
1.4. Cycle de multiplication
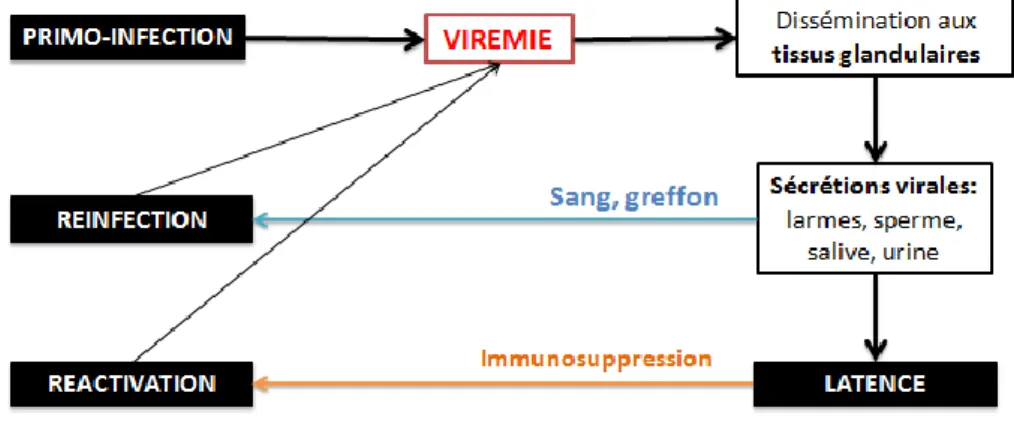
Chez les herpesviridae 3 stades sont retrouvés : l'infection lytique (primo-infection et ré(primo-infection), l'état de latence et la réactivation après latence.
Figure 5: Physiopathologie de l'infection à CMV
1.4.1. Tropisme et entrée du virus
Le HCMV est strictement humain, aucune lignée d'origine animale ne permet sa réplication. In vivo, il peut infecter un grand nombre de types cellulaires : monocytes, macrophages, cellules endothéliales, cellules épithéliales, cellules
musculaires lisses, fibroblastes, cellules intestinales, neutrophiles, hépatocytes et neurones. Il présente donc un très large tropisme tissulaire. In vitro, il est beaucoup plus difficile d'obtenir sa réplication, les souches de fibroblastes embryonnaires humains sont celles essentiellement utilisées. La liaison du HCMV à des récepteurs de type héparane sulfate retrouvés sur la plupart des types cellulaires semble donc indispensable mais non suffisante.
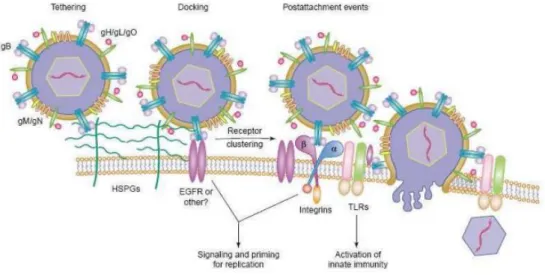
Figure 6: Illustration de l'entrée du HCMV dans la cellule hôte (10)
L'attachement et l'entrée du virus est décrit par Teresa Compton. (10) Pour commencer, les glycoprotéines d'enveloppe virale gM/gN et gB interagissent par liaisons de faible affinité avec des protéoglycanes de type héparane-sulfate au niveau de la cellule hôte. L'attachement et l'internalisation du virion nécessitent des interactions secondaires avec d'autres récepteurs et corécepteurs.
L'interaction cellule/virus induit de nombreux signaux cellulaires : perturbation de l'homéostasie calcique, activation des phospholipases C et A2, libération d'acide arachidonique, activation de facteurs de transcription, NFKB, MAP kinases ...
L'entrée du virus se fait ensuite soit par fusion entre l'enveloppe virale et la membrane cellulaire grâce à gH, soit par endocytose (en fonction du type cellulaire). La nucléocapside et le tégument sont alors libérés dans le cytoplasme. Rapidement, les protéines structurales de la capside sont dégradées et l'ADN est amené vers le noyau. Une fixation aux TLR (Toll Like Receptor) est aussi décrite et permettrait l'activation de la réponse immunitaire innée.
Le tableau suivant résume les interactions entre protéines d'enveloppe et cellule hôte ainsi que leur rôle:
Tableau 2: Rôles des différentes interactions protéines d'enveloppe et cellule hôte selon Teresa Compton 2004
Enveloppe Cellule hôte Rôle de l'intéraction
gM/gN Glycoprotéines héparane sulfate Attachement
gB EGFR (Epidemal Growth Factor Receptor) Intégrines β
TLR2
Amarrage et signal Fusion, internalisation, signal
Activation immunité innée
gH/gL/gO ?? Fusion
1.4.2. Cycle de réplication
Dans le cas d'une infection active, comme les βherpesviridae, le cycle est lent (environ 72h) (1) (11). Cependant, il est peu productif, ce qui le différencie des HSV (Herpes Simplex Virus). L'infection commence donc par la fixation du virus sur la membrane cellulaire puis l'entrée du virus dans la cellule par fusion des membranes ou endocytose. La capside est rapidement dégradée et l'ADN est transloqué dans le noyau.
Au niveau nucléaire commence alors la transcription en 3 phases :
La phase très précoce IE (Immediate Early)
Elle commence environ 1h après l'infection et elle concerne la transcription de gènes codant essentiellement pour des protéines de régulation de la réplication virale.
Deux protéines majeures sont retrouvées : IE1 et IE2 codées respectivement par les gènes UL122 et UL123. Elles sont sous le contrôle d'un même promoteur majeur le MIEP (Major Immediate Early Promoter) qui intéragit avec différents facteurs de transcription de la cellule hôte comme le NFĸB, AP1, St1 ...
IE1 est une phosphoprotéine nucléaire indispensable à l'infection débutante avec un seul virion. Elle contrôle la réplication.
IE2 est un polypeptide nucléaire phosphorylé indispensable à la réplication virale car il régule la transition entre les phases de transcription en activant les promoteurs E (Early) et L (Late).
D'autres gènes très précoces (UL36/38, UL115-119, IRS1, TRS1, US3...) codent pour des protéines auxiliaires dont les rôles sont variés : échappement au système immunitaire, propriétés anti-apoptotiques ...
La phase précoce E (Early)
Elle commence environ 4h après l'infection et elle concerne la transcription de gènes codant pour des protéines non structurales comme des facteurs de réplication de l'ADN viral, des enzymes de réparation, des protéines impliquées dans l'échappement au système immunitaire ...
Sont transcrits:
- UL54 qui code pour l'ADN polymérase et UL44 sa protéine accessoire indispensable à l'avancée de l'enzyme sur le brin matriciel.
- UL83 codant pour la pp65 qui phosphoryle les protéines IE empêchant leur présentation au CMH I.
- UL97 protéine kinase intervenant dans la première phosphorylation du ganciclovir et de l'aciclovir utilisés en thérapeutique.
- US2 et US11 qui transportent et ramènent le CMH I dans le cytosol pour qu'il soit détruit par le protéasome.
- US27 et US28 codant pour des récepteurs aux chimiokines. - ....
La phase tardive L (Late)
Cette phase regroupe la réplication de l'ADN viral dans le noyau et la transcription des gènes codant pour les protéines structurales (protéines de capside, d'assemblage, d'enveloppe...).
La réplication de l'ADN viral commence dans le noyau 16h après l'infection. C'est une synthèse bidirectionnelle à partir d'une seule origine de réplication. Elle suit le modèle du cercle tournant. Il y a formation de concatémères qui sont ensuite clivés au niveau des séquences répétitives a et empaquetés dans des précapsides.
La transcription des gènes L commence plus de 24h après l'infection et fait suite à la réplication de l'ADN. Sont transcrites :
- UL46, 86 (mCBP et MCP), protéines de capside. - UL80 protéine d'assemblage.
- UL55, 75 (gB et gH) glycoprotéines d'enveloppe ...
Il y a ensuite assemblage des protéines de capside et de l'ADN néosynthétisé dans le noyau puis l'ensemble s'enveloppe du feuillet interne de la membrane nucléaire et migre dans le réticulum endoplasmique. Là, il y a perte de l'enveloppe, acquisition du tégument puis de l'enveloppe virale définitive à partir de l'endosome. Les particules mâtures sont retenues dans des vésicules et transportées à la surface via l'appareil de Golgi. Le virion est ensuite libéré par endocytose et peut infecter d'autres cellules.
Remarque: La phase cytoplasmique est caractérisée par une inclusion cytoplasmique caractéristique de l'infection par HCMV ("maladie des inclusions cytomégaliques"). Elle est constituée de virions mâtures et de corps denses (protéines du tégument dans une enveloppe dérivée de la membrane cytoplasmique).
1.4.3. Dissémination hématogène
Les cellules endothéliales sont permissives au HCMV et pourraient contribuer à la dissémination hématogène du cytomégalovirus en infectant les monocytes et les polynucléaires. (13)
Une cellule endothéliale infectée par le HCMV sécrète en réponse de l'IL8 et exprime le complexe ICAM-1. Les polynucléaires présentant à leur surface LFA-1, ligand de ICAM-1, peuvent donc se fixer à la cellule endothéliale infectée. Par migration transendothéliale et contact avec les cellules déjà infectées, les polynucléaires s'infectent. A leur tour, les polynucléaires peuvent infecter d'autres cellules permissives au HCMV.
1.4.4. Latence
Après la primo-infection, comme tous les βherpesviridae, le HCMV persiste toute la vie de l'hôte sous forme latente. (14) L'état de latence correspond à la persistance du génome viral sans production de virions infectieux tout en sachant que la réactivation du génome est possible suite à différents stimuli.
Tout d'abord le HCMV a été trouvé sous forme latente au niveau des monocytes CD14+. Puis, sa présence au niveau des cellules progénitrices de la moelle osseuse et dans la lignée myéloïde qui en découle, a été mise en évidence. Cependant, il n'est jamais retrouvé dans la lignée lymphoïde.
Dans cet état latent, le génome se trouve sous forme épisomale et son expression est réduite aux protéines précoces. Le cycle réplicatif n'est pas complet.
1.4.5. Réactivation
La réactivation du virus qui persistait à l'état de latence, est retrouvée dans un contexte d'immunodépression et d'activation antigénique d'origine infectieuse ou allogénique (greffon, transfusion).
1.5. Epidémiologie
Le cytomégalovirus est un pathogène retrouvé dans le monde entier. En effet, 40 à 100% de la population mondiale présente des anticorps anti-CMV dans le sang. L'infection est endémique sans influence saisonnière. (15) (16)
Le niveau socioéconomique peut influer sur son incidence : les anticorps anti-CMV sont retrouvés chez 50 à 60% des adultes dans les pays développés et chez 90 à 100% d'entre eux dans les pays en voie de développement. L'infection peut être acquise à n'importe quel âge mais en général elle est acquise plus tôt dans les pays en voie de développement. (2) (1) (15)
Les immunodéprimés (receveurs d'organes ou patients atteints du SIDA), les prématurés, les nouveau-nés atteints d'une infection congénitale présentent un risque plus élevé de maladies graves pouvant menacer leur pronostic vital.
Deux pour cent des femmes enceintes séronégatives au début de leur grossesse sont séroconverties au moment de l'accouchement. 32% des femmes développant une primo-infection pendant leur grossesse transmettent le virus par voie placentaire et le risque de maladie sévère chez le fœtus s'élève alors à 20%. Par ailleurs, l'infection congénitale suite à une réactivation ou réinfection chez la mère concerne 1% des femmes séropositives au début de leur grossesse. (9)
L'infection HCMV représente une des infections virales les plus communes chez le transplanté d'organes solides. Elle peut en effet toucher 20 à 60% d'entre eux et constitue une cause significative d'augmentation du risque de mortalité chez les transplantés (3). Ce risque est plus élevé dans les trois premiers mois suivants la transplantation (17) (18).
En transplantation d'organes solides, le CMV peut être responsable :
- D'une primo-infection chez les patients séronégatifs recevant un organe d'un donneur séropositif (D+/R-).
- D'une réactivation ou réinfection chez les patients séropositifs recevant un organe d'un donneur séropositif (D+/R+).
- D'une réactivation chez un patient séropositif recevant un organe d'un donneur séronégatif (D-/R+).
Des facteurs de risques ont pu être mis en évidence (17) (18):
- Absence de contact antérieur du receveur avec le CMV. - Organes ou produits sanguins provenant d'un donneur positif.
- Utilisation d'une thérapie immunosuppressive à base d'anticorps anti-lymphocytaires.
- Survenue d'un ou plusieurs épisodes de rejets aigus. - Coinfections HHV6 et HHV7.
Ainsi, sans traitement préventif, le risque de développer une maladie à CMV chez les transplantés d'organes solides s'élève à plus de 50% lorsqu'il existe une sérologie CMV désappariée entre donneur et receveur (D+/R-). (19)
Avant transplantation d'organes solides, 60% des receveurs sont estimés séropositifs et 40% séronégatifs. Parmi les patients séropositifs, 25% ont un risque de maladie à CMV et 50% d'infection à CMV. Dans 40% des cas le traitement immunosuppresseur réactive une infection latente. (15)
L'incidence de l'infection à CMV chez les transplantés dépend également du type de greffe réalisée. Ainsi les transplantations pancréatiques et pulmonaires présentent les risques les plus importants (50 et 40% respectivement). Suivent dans l'ordre décroissant d'incidence, la transplantation cardiaque (9 à 35%), la transplantation intestinale (22%) , puis hépatique (22 à 29%) et enfin rénale (8 à 32%). (20)
Les traitements prophylactiques mis en place semblent diminuer le risque de développement de la maladie à CMV chez les transplantés d'organes : la mortalité globale est réduite de 40% et le risque de maladies à CMV de 60% après traitement prophylactique. (21) (22)
Chez les patients atteints du SIDA, la maladie à CMV est la plus commune des infections virales opportunistes. Elle se manifeste dans 85% des cas par une rétinite à CMV. Les atteintes gastro-intestinales (10 à 15%) et celles au niveau du système nerveux central (5 à 10%) suivent. (23)
1.6. Manifestations cliniques
Dans un premier temps, il convient de bien définir la différence entre "infection à CMV" et "maladie à CMV". Cette nuance a notamment été précisée dans "l'international consensus guidelines on the management of cytomegalovirus" (24) en 2013.
L'infection à CMV correspond à l'isolement du CMV ou à la détection de protéines ou acides nucléiques viraux dans les fluides ou tissus humains (25). C'est la mise en évidence d'une réplication du virus sans considérer les symptômes.
La primo-infection, détection d'une infection à CMV chez un individu préalablement séronégatif, doit être distinguée de l'infection secondaire, détectée chez un patient qui a déjà révélé une infection à CMV au moins 4 semaines avant. Cette infection secondaire peut être la conséquence d'une réactivation du virus latent ou l'infection par une nouvelle souche différente de la première.
La "maladie à CMV" correspond à la mise en évidence de la réplication virale et des symptômes (fièvre, leucopénie, invasion des tissus...). Virémie et syndrome viral signent une maladie à CMV. Différents tissus peuvent être envahis à l'origine de pneumonies, hépatites, rétinites, cystites, néphrites, myocardites, pancréatites ...
1.6.1. Infection chez le patient immunocompétent
Dans 90% des cas, l'infection est asymptomatique.
D'autres développeront après une incubation longue (30 jours en moyenne) les symptômes suivants : fièvre prolongée en plateau (38 à 40°C pendant 3 semaines), asthénie, arthralgies, céphalées, pharyngites et amaigrissement. D'un point de vue biologique, un syndrome mononucléosique associé ou non à une thrombopénie est retrouvé.
Des complications sévères sont très exceptionnellement retrouvées : hépatites, infections du système nerveux (syndrome de Guillain Barré, méningites, rétinites...) et pneumonies. (13) (2)
1.6.2. Infection chez le patient immunodéprimé
Chez le patient immunodéprimé, le CMV représente un agent pathogène majeur. Les manifestations cliniques sont multiples et peuvent menacer le pronostic vital. Le type d'immunodépression, le statut sérologique donneur/receveur, la nature
des traitements immunosuppresseurs, le type et la quantité de produits sanguins transfusés sont autant de critères qui influencent les manifestations cliniques observées. (13)
Chez le transplanté d'organes solides :
Une fièvre prolongée, une leucopénie, une thrombopénie, une lymphocytose et une augmentation des transaminases sont les manifestations directes de la réplication du CMV. L'atteinte du tube digestif avec diarrhées sévères et risque de perforation digestive représente l'une des manifestations graves de l'infection.
Les effets indirects du CMV chez le transplanté sont importants :
- Augmentation du risque de rejet de greffe.
- Augmentation du risque d'infections secondaires notamment fongiques.
- Augmentation du risque d'athérosclérose (notamment au niveau des coronaires chez le patient transplanté cardiaque).
Chez le greffé de cellules souches hématopoïétiques :
La mortalité est dans ce cas importante. Il y a une augmentation du risque de maladie du greffon contre l'hôte aiguë et/ou chronique puis de décès. Le risque de pneumonie est également important.
Chez le sujet atteint du SIDA :
Les rétinites, les infections du tube digestif (colites à CMV...), du système nerveux (encéphalites à CMV, neuropathies périphériques ...) et du poumon (pneumonies à CMV) sont des manifestations retrouvées chez les patients co-infectés par le VIH et très immunodéprimés (CD4 < 100/mm3). (15) (13)
1.6.3. Infection congénitale
L'infection congénitale a lieu le plus souvent lors d'une primo-infection chez la femme enceinte (le taux de transmission atteint 30 à 60%) et plus rarement lors d'une infection secondaire (transmission dans 0,1 à 3% des cas). Le virus est transmis par le sang maternel puis il se multiplie chez le fœtus qui l'excrète dans le liquide amniotique via les urines.
Dans le cas de transmission materno-foetale, 10% des enfants présentent une infection généralisée à leur naissance. Parmi eux, 30% décèdent précocement, 60% présentent des séquelles plus ou moins graves allant du retard psychomoteur à la surdité isolée et 10% ne présentent aucune séquelle.
Dans 90% des cas les enfants naissent asymptomatiques mais ils peuvent développer des séquelles tardives dans les années suivantes. (2)
Tableau 3: Résumé des manifestations cliniques de l'infection à CMV (2)
Contexte de survenue Principales manifestations cliniques
Adultes immunocompétents, grands enfants:
Primo-infection Asymptomatique (90%) Syndrome mononucléosique Réactivations-réinfections Asymptomatique
Infection congénitale Asymptomatique
Retard psychomoteur, surdité
Embryofoetopathie disséminée, décès
Infection périnatale Asymptomatique
Pneumopathie interstitielle bénigne Infection du nouveau-né prématuré Infection grave avec pneumopathie Primo-infection des personnes
immunodéprimées Transplantation Greffe de moelle Receveur d'organe
Sida (<100 CD4+/mm3 de sang)
Dissémination sanguine avec fièvre persistante
Pneumopathie interstitielle, rejet Atteinte digestive, pneumopathie, rejet Rétinite, colite, atteinte neurologique
1.6.4. HCMV et cancer
Le rôle du HCMV dans l'étiologie de certains cancers est également très largement évoqué. Le HCMV a pu être retrouvé dans les cancers du colon, de la
prostate, de la peau, du sein, des glandes salivaires et dans les gliomes. (26) Il est présent dans les tissus tumoraux mais absent dans les tissus sains.
Il apparaît aujourd'hui de plus en plus clairement que le HCMV possède un rôle d'oncomodulation pour différentes raisons :
- Le HCMV contribue à générer une inflammation chronique en augmentant l'expression de COX-2 ce qui est favorable au développement de la tumeur. - Il active la production de l'IL6 et du TNFα qui ont un rôle connu dans l'initiation
et la promotion des cancers.
- Le HCMV est capable de mettre en place des mécanismes d'échappement au système immunitaire qui sont intéressants pour le développement tumoral. - Pour se répliquer, le HCMV induit un arrêt du cycle cellulaire. La dérégulation
du cycle cellulaire est indispensable au développement tumoral.
- HCMV active les facteurs antiapoptotiques et inhibe l'action, le recrutement ou l'expression des protéines proapoptotiques. Il existe donc une résistance accrue à l'apoptose des cellules infectées par HCMV ce qui favorise la survie cellulaire et le développement des cancers...
1.7. Réponse immunitaire au HCMV
1.7.1. Mise en place de l'immunité innée et adaptative
Entrée du virus et immunité innée :
Lors de la primo-infection chez l'individu sain, la réplication du virus débute le plus souvent dans les cellules épithéliales des muqueuses. (A) La dissémination du virus fait ensuite intervenir la lignée myéloïde notamment les monocytes et CD34+ où le HCMV s'établit.(B) L'état de latence se met alors en place avec restriction de l'expression des gènes viraux.
C'est lors de la différenciation des monocytes en macrophages que l'infection productive débute (C), le virus se multiplie aussi bien dans les cellules endothéliales que dans les fibroblastes, cellules musculaires lisses...
L'immunité innée représente alors la première ligne de défense contre le HCMV. Après pénétration du virus dans la cellule, différents mécanismes sont mis en place par l'hôte : production de cytokines inflammatoires comme des INF de type I, augmentation des molécules costimulatrices... Les TLR (Toll Like Receptor) jouent un rôle majeur dans cette reconnaissance du pathogène par le système immunitaire innée. Par exemple le TLR 2 reconnait les glycoprotéines gB et gH puis permet l'activation de la voie du NFĸB.
Les cellules NK (Natural Killer), les phagocytes et les cellules présentatrices d'antigènes sont également essentielles dans la mise en place de l'immunité innée. Ainsi, les cellules NK sont rapidement activées; elles exercent leur fonction cytotoxique (production d'INFγ, granzymes, perforines) et favorisent la mise en place de l'immunité adaptative. (12) (28)
Contrôle de l'infection par CMV et immunité adaptative :
Après différenciation des monocytes en macrophages, particules virales et corps denses sont pris en charge par les cellules présentatrices d'antigènes (D) entrainant la mise en place de la réponse adaptative. Dans le cas du HCMV, cette réponse est humorale et cellulaire.
La réponse cellulaire mise en place est longue et importante, elle met en jeu les lymphocytes T CD4+ et CD8+. L'activation des cellules T entrainent la lyse des
cellules infectées (E) par les LTCD8+. Le rôle des TCD4+ est annexe mais indispensable à l'activation des effecteurs cytotoxiques.
Les cellules NK activées par les cellules dendritiques peuvent également bloquer la réplication du virus par sécrétion d'INFγ et/ou TNF.
La réponse humorale quant à elle, passe par la production d'anticorps spécifiques de nombreuses protéines du CMV (F). La protéine pp65, les glycoprotéines d'enveloppe gB, gH et gH/gL, la protéine non structurale IE-1, sont ainsi les cibles majeures des anticorps produits par les lymphocytes B. (12) (28)
1.7.2. Echappement du HCMV au système immunitaire
Comme tous les herpesvirus, le HCMV a développé des systèmes d'échappement au système immunitaire pour persister dans l'organisme à l'état de latence. Des mécanismes complémentaires ont ainsi été rapportés (27) (28) (1) :
- Le mode de diffusion du virus : il se dissémine de cellules à cellules ce qui lui permet de ne pas s'exposer à la séroneutralisation.
- L'action concertée de plusieurs protéines virales pour inhiber la présentation au CMH (Complexe Majeur d'Histocompatibilité) de classe 1 :
Pour rappel, les polypeptides viraux sont récupérés et dégradés dans le protéasome. Les fragments viraux obtenus sont alors transportés dans le cytosol jusqu'au réticulum endoplasmique où ils sont pris en charge par le CMH de classe I qui les mène à la surface cellulaire.
La protéine pp65 phosphoryle la protéine IE-1. La présentation des peptides antigéniques dérivés de IE-1 en est alors bloquée.
Huit glycoprotéines virales peuvent pénétrer dans le réticulum endoplasmique et perturber le fonctionnement normal de présentation par le CMH :
Les glycoprotéines codées par US2 et 11 induisent la dislocation des molécules de CMH de classe 1 chargées d'antigènes et les renvoient dans le cytosol.
Celles codées par US3 et US10 bloquent la molécule de CMH dans le réticulum endoplasmique et empêchent le transfert vers Golgi.
US6 code pour une protéine qui inhibe les pompes TAP (Transport Antigen Protein) qui permettent le transport jusqu'au réticulum endoplasmique...
- L'inhibition de la reconnaissance du CMV par les cellules NK : la protéine virale codée par UL18 est homologue au CMH de classe I. Elle limite alors la reconnaissance des cellules infectées par les cellules NK.
- L'échappement aux lymphocytes T : les cellules infectées produisent des protéines homologues aux récepteurs de chimiokines. Les chimiokines sont alors conduites vers ces récepteurs et séquestrées. Monocytes et macrophages ne sont plus attirés et la réponse adaptative cellulaire est diminuée.
1.8. Diagnostic
Ce diagnostic (13) (29) est réalisé :
- En cas de suspicion d'infection materno-foetale.
- Avant et après transplantation d'organes.
- Chez l'immunodéprimé.
1.8.1. Méthodes de diagnostic
Méthode de diagnostic indirect :
C'est la détermination du statut sérologique du patient vis à vis du CMV. Elle a un intérêt limité de part la présence de nombreuses réactions croisées et la difficulté à différencier une primo-infection d'une réactivation. Cependant, elle est indispensable avant transplantations d'organes et peut être utilisée dans le diagnostic d'infection congénitale.
La méthode consiste en la recherche des IgG ou IgM anti-CMV dans un échantillon de sérum par technique ELISA (Enzyme-Linked Immunosorbent Assay). A noter que les IgG s'élèvent après primo-infection et forment de nouveaux pics au cours des réactivations et que les IgM persistent jusqu'à 20 semaines après primo-infection.
Méthodes de diagnostic direct :
Elles consistent en la recherche du génome viral par PCR, antigénémie pp65 ou cultures.
L'isolement du virus sur culture cellulaire est possible mais uniquement sur des cellules fibroblastiques embryonnaires humaines (MCR5). La présence du virus peut alors être mise en évidence par l'apparition, 2 à 3 semaines après inoculation, d'un ECP (Effet CytoPathogène) caractéristique en "banc de poissons" et des cellules présentant une inclusion nucléaire (d'où le nom de cytomégalie). Plus précocément (24 à 48h après inoculation), l'infection de la culture peut être détectée par examen immuno-cytologique. Cette méthode utilise un anticorps monoclonal spécifique des antigènes très précoces, et la détection est réalisée par immunofluorescence ou immunoperoxydase.
L'antigénémie pp65 est une technique couramment utilisée. Cette méthode semi-quantitative détecte et quantifie directement dans le sang l'antigène pp65, protéine majeure du tégument retrouvée quelques heures seulement après infection dans le noyau des cellules infectées. Cette technique utilise un anticorps monoclonal dirigé contre la protéine pp65. La détection se fait ensuite par immunofluorescence : on rapporte le nombre de cellules infectées, dont le noyau est fluorescent, au nombre de cellules analysées (en général 200 000).
Enfin, la recherche des séquences génomiques virales par PCR (Polymerase Chain Reaction) dans le sang total, dans le compartiment leucocytaire, dans le plasma, dans le liquide amniotique, dans l'humeur aqueuse ou encore dans les biopsies est très largement développée. Il existe différentes techniques très sensibles et spécifiques permettant d'obtenir un résultat rapide. La technique QNAT (Quantitative Nuclear Acid Testing) est la méthode de laboratoire préconisée pour le diagnostic et le suivi du traitement du CMV chez les transplantés.
1.8.2. Stratégies diagnostiques
Chez le patient immunocompétent :
Rarement utilisé dans ce cas, le diagnostic d'infection à CMV recherche une séroconversion des anticorps anti-CMV. Une séroconversion des IgG sur deux prélèvements différents ou l'apparition d'IgM anti-CMV mettent en évidence l'infection.
Mise en évidence d'une infection materno-foetale :
Chez la mère, c'est la séroconversion IgG et la mise en evidence d'IgM qui signent une infection maternelle.
Pour confirmer une atteinte foetale, ce sont des techniques de PCR sur liquide amniotique qui peuvent être utilisées. A la naissance, les cultures cellulaires avec les urines de l'enfant, prélevées dans les 15 premiers jours de vie, confirment l'infection fœtale.
Chez les patients immunodéprimés :
Des recommandations internationales (24) ont été publiées à ce sujet :
- Une sérologie est indispensable pour le donneur et le receveur avant transplantation. La recherche des IgG anti-CMV présente une meilleure spécificité par rapport aux IgM ou à la combinaison IgG-IgM.
- Les cultures virales de sang ou d'urine, ayant une faible sensibilité et spécificité, ont un intérêt très limité dans le diagnostic.
- La technique QNAT est à préférer pour le diagnostic, la mise en place du traitement préemptif et le suivi de la réponse thérapeutique. En effet, elle présente une meilleure standardisation (il existe un standard international (WHO: 5.106 UI/mL)), une meilleure précision et une plus grande rapidité. L'antigénémie pp65, moins onéreuse et facile à réaliser, reste une alternative acceptable mais beaucoup moins utilisée actuellement.
- La technique QNAT peut être réalisée sur du sang total ou sur du plasma même s'il est à noter qu'une meilleure quantification semble obtenue avec du sang total.
- L'immunohistochimie (localisation des protéines dans les cellules d'une coupe de tissu par détection d'antigènes au moyen d'anticorps) est la méthode de diagnostic à utiliser pour mettre en évidence une maladie invasive des tissus. Les cultures et la technique QNAT ont dans ce cas un rôle limité mais peuvent aider dans certaines situations.
2. Prise en charge thérapeutique et suivi de la
pathologie
2.1. Molécules antivirales
Il existe un nombre limité de molécules antivirales approuvées pour le traitement et la prévention des infections et maladies à HCMV. Les inhibiteurs de l'ADN polymérase constituent la classe majeure utilisée. Le ganciclovir et sa prodrogue le valganciclovir, le cidofovir, le foscarnet et dans un but uniquement préventif l'aciclovir et sa prodrogue le valaciclovir font partie de cette classe. D'autre part, les immunoglobulines par voie intraveineuse représentent une stratégie utilisable en prévention mais aussi en traitement adjuvant d'une infection à CMV chez des patients immunodéprimés. (23) Enfin, d'autres médicaments comme le leflunomide, le maribavir ou encore l'artesunate sont aujourd'hui utilisés en cas de résistance aux traitements même si pour le moment leur efficacité et leur toxicité restent faiblement évaluées.
Figure 10: Molécules antivirales approuvées dans le traitement du CMV: ganciclovir, valganciclovir, foscarnet,
2.1.1. Le ganciclovir (GCV) et le valganciclovir (VGCV)
Connus sous les noms commerciaux Rovalcyte® (valganciclovir) et Cymevan® (ganciclovir), ces deux molécules antivirales constituent le traitement de référence des infections à CMV. (24)
Mécanisme d'action :
Le ganciclovir ou dihydro-propoxyméthylguanine est un analogue acyclique de la désoxyguanosine. Il entre dans les cellules infectées par l'intermédiaire des transporteurs de purines. (22) N'étant actif que sous sa forme triphosphorylée, il nécessite ensuite l'intervention d'une sérine/thréonine kinase virale pUL97 qui lui ajoute un premier groupement phosphate. (31) Les deux phosphorylations suivantes sont assurées par des kinases cellulaires. Le ganciclovir triphosphorylé obtenu entre alors en compétition avec les nucléotides au niveau de l'ADN polymérase virale pUL54. Il s'incorpore à la place de la dGTP (désoxyGuanosine TriPhosphate), bloque le site catalytique de l'enzyme et inhibe l'élongation de la chaîne d'ADN viral. La réplication du virus est alors inhibée.
La CI50, concentration de ganciclovir pour laquelle la réplication virale est inhibée de 50%, est estimée in vitro à 0,7 µg/mL. (22)
Le valganciclovir est un L-valyl ester du ganciclovir. Il est reconnu comme un substrat par le transporteur intestinal PEPT-1 puis hydrolysé en esters amino-acides par des hydrolases, les valacyclovirases. (32) Transformé en ganciclovir au niveau intestinal et hépatique il exerce ensuite la même action sur l'ADN polymérase virale.
Figure 11: Absorption et bioactivation du valganciclovir. (22)
Nomenclature: dGTP= deoxyguanosine triphosphate; GCV= ganciclovir; PEPT1 = intestinal peptide transporter 1; P-GCV= ganciclovir monophosphate; PP-GCV= ganciclovir biphosphate; PPP-GCV= ganciclovir triphosphate;
Pharmacocinétique :
Le ganciclovir peut être administré par voie intraveineuse, intravitréenne et orale. Sa faible biodisponibilité orale (autour de 10%) a cependant poussé les chercheurs à créer une prodrogue, le valganciclovir dont la biodisponibilité orale atteint les 60%. (23) Une administration de 900mg deux fois/jour de valganciclovir per os est équivalente à une administration de 5mg/kg deux fois/jour de ganciclovir par voie intraveineuse. (33)
Concernant la distribution du médicament, le ganciclovir présente une faible liaison aux protéines plasmatiques (de l'ordre de 1 à 2%). Le valganciclovir est très rapidement transformé en ganciclovir, sa liaison aux protéines plasmatiques n'a donc pas pu être déterminée mais on considère qu'elle est également très faible. Le volume de distribution du ganciclovir après administration intraveineuse est estimé à 0,68 L/kg. (34) De plus, un passage du GCV dans le LCR (Liquide CéphaloRachidien) est décrit. (34)
Le valganciclovir est métabolisé dans la paroi intestinale et le foie en ganciclovir (34) et plus de 90% du ganciclovir est retrouvé sous forme non métabolisée dans les urines. (35)
Le ganciclovir est principalement éliminé par voie rénale par filtration glomérulaire et sécrétion tubulaire active. La demi-vie d'élimination du valganciclovir est estimée à 5,3 +/- 1,5 heures chez le sujet à fonction rénale normale. (22) Chez l'insuffisant rénal, la clairance du ganciclovir est diminuée et sa demi-vie d'élimination augmentée. Il est donc nécessaire d'adapter les posologies. (34)
Utilisation :
Ganciclovir et valganciclovir sont indiqués dans "les infections sévères à CMV (rétinites, pneumonies, colites et atteintes de l'appareil digestif et éventuellement encéphalites) mettant en jeu la vision ou la vie des patients ayant un déficit sévère de l'immunité cellulaire". (33) Le Cymevan® administré exclusivement en perfusion veineuse à vitesse constante est réservé aux hôpitaux alors que le Rovalcyte® sous forme de comprimés est disponible en ville.