THESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
(Faculté des Sciences Fondamentales et Appliquées)
(Diplôme National – Arrêté du 7 août 2006)
Ecole Doctorale : Ingénierie Chimique Biologique et Géologique
Secteur de Recherche : Sciences de la vie
Présentée par :
Jérôme HENRI
************************
Etude comparative de deux ionophores carboxyliques chez la volaille :
Apport de la modélisation pharmacocinétique basée sur la physiologie
************************
Directeur de Thèse :
Pr. Jean-Michel MAIXENT
************************
Soutenue le 14 Novembre 2008
Devant la Commission d’Examen
************************
JURY
Pr. Jean-Michel Maixent, INSERM, Poitiers Directeur
Dr Michel Laurentie, AFSSA, Fougères Co-directeur
Dr Pascal Sanders, AFSSA, Fougères Président
Pr. Arturo Anadon, Faculté de Médecine Vétérinaire, Madrid, Espagne Rapporteur
Pr. Alain Bousquet-Melou, INRA, Toulouse Rapporteur
M. Thierry Dupont, Qualilab, Olivet Examinateur
REMERCIEMENTS
Je remercie le Professeur Arturo ANADON de la faculté de médecine vétérinaire de Madrid, ainsi que le Professeur Alain BOUSQUET-MELOU de l’école vétérinaire de Toulouse qui m’ont fait l’honneur d’être rapporteurs de ma thèse et pour toute l’attention qu’ils ont portée à mon travail.
Je remercie également Monsieur Thierry DUPONT d’avoir accepté d’être le référent en terme d’assurance qualité dans le jury de thèse et d’avoir apporté son jugement éclairé sur nos travaux.
Je remercie le Docteur Pascal SANDERS, directeur du laboratoire d’études et de recherche sur les médicaments vétérinaires et les désinfectants (LERMVD) de l’AFSSA à Fougères, à l’origine de ce projet, de m’avoir accueilli dans son laboratoire, de m’avoir laissé une grande liberté d’action, de m’avoir beaucoup aidé et appris et enfin de m’avoir fait l’honneur d’être le président de mon jury de thèse.
Je remercie le Docteur Michel LAURENTIE dirigeant l’unité de Pharmacocinétique-Pharmacodynamie de l’AFSSA de fougères de m’avoir enseigné la pharmacocinétique et l’autonomie. Je lui exprime toute ma sympathie pour avoir encadré ces travaux et toute ma reconnaissance pour les conseils prodigués.
Je remercie le Professeur Jean-Michel MAIXENT sans qui je ne serais pas arrivé jusque là. Merci d’avoir su guider mes pas. J’en profite pour remercier toute la formation Génie Physiologique et Informatique de Poitiers qui m’a permis de tracer ma voie.
Je remercie Mademoiselle Nathalie CADIEU, assistante qualité au LERMVD pour ses qualités professionnelles et humaines exceptionelles. Je lui exprime toute ma gratittude pour cette collaboration et ma reconnaissance pour la rigueur qu’elle m’a enseignée.
Je remercie le Docteur Brigitte ROUDAUT de m’avoir accueilli au sein de l’unité des Résidus de Médicaments Vétérinaires de l’AFSSA de Fougères et de m’avoir donné les moyens de travailler.
Je remercie tous les analystes qui ont grandement contribué à ce travail, pour leur sympathie et leur enthousiasme : Estelle DUBREIL-CHENEAU, Jacqueline MANCEAU, Yvette PIROTAIS et Marie-Pierre CHOTARD-SOUTIF.
Je remercie également Monsieur Robert MAURICE qui dirige le Service d’Elevage Avicole et Cunicole de l’AFSSA de Ploufragan ainsi que toute son équipe qui ont réalisé toutes les phases animales. Je tiens à tous les remercier pour leur convivialité et leur accueil : Jacques ALLAIN, Louis-Jean BELHOMME, Jacques BOUGEARD, Didier HELLIO, Marc HENRY, Bernard LE BERRE MARIE, Joseph MAURICE, Jean-Michel OIZEL, Jean-François ROBERT, Christophe SZYPULA et Manuel TAVARES.
Je voudrais remercier le Docteur Christine BUREL de l’Unité d’Alimentation Animale de Ploufragan et qui avec son équipe, Eric BOILLETOT et Gilbert POSTOLLEC, ont contribué à la coordination des études in vivo.
Je remercie le Docteur Jean-Michel POUL, de l’unité de Toxicologie Génétique des Contaminants Alimentaires de l’AFSSA à Fougères pour son aide précieuse lors des études de métabolisme in vitro. Merci également à Delhia SEURIN, qui lors de son stage au sein du LERMVD a contribuée à ces travaux.
Je souhaite également remercier les membres de mon comité de thèse : le Professeur Bruno LE BIZEC de l’école vétérinaire de Nantes, le Docteur Hélène LELIEVRE de l’AFSSA à Maisons-Alfort et le Docteur Anne-Marie CHAPEL de l’Agence Nationale du Médicament Vétérinaire à Fougères.
Je remercie l’ensemble du personnel du LERMVD pour la bonne ambiance qu’il règne dans ce laboratoire. Je ne citerais personne pour ne pas faire de jaloux, mais je les remercie tous sans exception. Je remercie plus particulièrement mon amie Valérie FESSARD qui a toujours su être là et trouver les mots.
Bon courage à Steph, Julie, Manue et Perrine pour la fin de leur thèse. Je remercie également les anciens thésards, Rosy, Isabelle, Julien et Marie-Bé avec qui il a toujours été agréable d’échanger. Une pensée toute particulière pour Terence, qui occupera à jamais une place à part pour moi.
Je remercie infiniment mes parents qui m’ont toujours apporté tout leur soutien. Merci à ma sœur, mon beau frère, mon neveu, ma nièce et ma grand mère ainsi qu’à l’ensemble de ma famille et de mes amis. Je vous aime tous.
SOMMAIRE
LISTE DES ILLUSTRATIONS ... 9
LISTE DES TABLEAUX ... 11
LISTE DES ABREVIATIONS ... 12
LISTE DES PUBLICATIONS ET COMMUNICATIONS ... 13
INTRODUCTION GENERALE ... 15
I. ETUDE BIBLIOGRAPHIQUE... 20
I.A. LES ANTICOCCIDIENS ... 20
I.A.1.FAMILLE DES IONOPHORES... 20
I.A.2LES IONOPHORES CARBOXYLIQUES : DES ANTICOCCIDIENS NATURELS... 21
I.A.2.1. Mode d’action chez les bactéries ... 21
I.A.2.2. Cycle de développement des coccidies et action des anticoccidiens... 23
I.A.2.3. Effets à dose pharmacologique chez l’animal... 24
a) Effets directs... 24
b) Effets indirects... 25
I.A.2.4. Symptômes à dose toxique ... 25
I.A.3LE MONENSIN, ANTICOCCIDIEN LE PLUS UTILISE EN ELEVAGE AVICOLE... 25
I.A.3.1. Propriétés physico-chimiques ... 27
I.A.3.2. Activité anticoccidienne... 28
a) Dose titration ... 28
b) Résistance... 28
I.A.3.3. Activité cardiovasculaire... 28
a) Effets pharmacologiques ... 28 b) Mécanismes... 29 I.A.3.4. Pharmacocinétique... 30 a) Absorption... 30 b) Distribution... 31 c) Métabolisme ... 31 d) Excrétion ... 33 I.A.3.5. Toxicité ... 33 I.A.4LA SALINOMYCINE... 36
I.A.4.1. Propriétés physico-chimiques ... 36
I.A.4.2. Activité anticoccidienne... 37
a) Dose titration ... 37
b) Résistance... 37
I.A.4.3. Activité cardiovasculaire... 37
I.A.4.4. Pharmacocinétique... 38
a) Absorption... 38
b) Métabolisme ... 38
I.A.4.5. Toxicité ... 38
I.A.5.2. Utilisation d’additifs coccidiostatiques en France dans l’alimentation des
volailles ... 40
I.B. PHARMACOCINETIQUE VETERINAIRE : OUTILS D’ETUDE DES RESIDUS DANS LES DENREES ALIMENTAIRES D’ORIGINE ANIMALE... 41
I.B.1.CONTROLE DES RESIDUS ET REGLEMENTATION... 41
I.B.2.COMPARAISON DES DIFFERENTES ETUDES NECESSAIRES A L’EVALUATION ET A LA GESTION DU RISQUE LIE A L’USAGE DES ADDITIFS COCCIDIOSTATIQUES ET DES MEDICAMENTS VETERINAIRES... 41
I.B.3.EVALUATION DU RISQUE POUR LA SANTE DU CONSOMMATEUR ET GESTION DE CE RISQUE... 45
I.B.3.1 Etudes animales nécessaires à l’évaluation du risque ... 45
a) Etudes toxicologiques et Dose Sans Effet... 45
b) Etudes de métabolisme, marqueur et tissu cible ... 47
I.B.3.2 Dose Journalière Acceptable ... 48
I.B.3.3 Limite Maximale de Résidus... 48
I.B.3.4 Le temps d’attente comme outil de gestion du risque... 49
a) Lignes directrices ... 51
b) Observations sur l’approche de régression préconisée ... 52
c) Temps d’attente avant abattage des volailles traitées au monensin et à la salinomycine... 53
I.B.4.ADME ... 55
I.B.4.1. Absorption ... 55
I.B.4.2. Distribution... 57
I.B.4.3. Métabolisation ou biotransformation... 58
I.B.4.4. Excrétion... 59
I.B.5.ANALYSE NON COMPARTIMENTALE... 61
I.B.5.1. Théorie du moment statistique... 61
I.B.5.2. Aire sous la courbe... 63
I.B.5.3. Temps moyen de résidence ... 63
I.B.5.4. Méthode logarithmique des trapèzes... 63
I.B.5.5. Paramètres dérivés... 65
I.B.6.ANALYSE COMPARTIMENTALE... 65
I.B.6.1. Le modèle pharmacocinétique... 65
I.B.6.2. Les compartiments... 66
I.B.6.3. Vitesses de transfert... 66
I.B.6.4. Le modèle à deux compartiments ... 66
a) Voie intraveineuse... 66
b) Voie extravasculaire... 68
I.B.7.PHARMACOCINETIQUE DE POPULATION... 69
I.B.7.1. Le modèle de structure ... 69
I.B.7.2. Les modèles d’erreur... 71
a) Variabilité inter-individuelle ... 71
b) Variabilité résiduelle ... 73
I.B.7.3. Expression générale du modèle... 73
I.B.7.4. Estimation... 73
a) Méthodes d’estimation ... 74
b) Fonction objective ... 75
I.B.7.5. Applications en médecine vétérinaire ... 76
b) Animaux de rente ... 76
c) Résidus de médicaments vétérinaires dans l’alimentation... 76
d) Extrapolations inter-espèces... 77
e) Optimisation de schémas posologiques... 77
I.B.8.MODELES PHARMACOCINETIQUES BASES SUR LA PHYSIOLOGIE... 77
I.B.8.1. Le diagramme du modèle ... 79
I.B.8.2. Les paramètres du modèle... 80
a) Les paramètres physiologiques ... 80
b) Les paramètres d’ADME ... 80
I.B.8.3. Les relations mathématiques ... 82
a) La loi d’action de masse... 82
b) Le passage membranaire ... 83
c) Le métabolisme ... 84
d) L’excrétion ... 85
I.B.8.4. Le lumping ... 86
I.B.8.5. Incertitude, variabilité et extrapolations... 86
a) Incertitude et variabilité ... 86
b) Extrapolations inter-doses et inter-durées ... 87
c) Transpositions inter-voies d’administration... 87
d) Extrapolation inter-sujets ou intra-individuelle... 88
e) Transposition inter-espèces ... 88
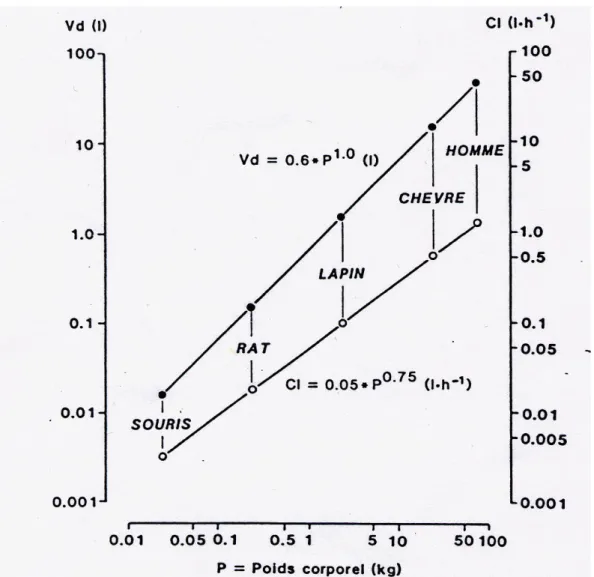
I.B.8.6. Allométrie ... 88
I.B.8.7. Validation du modèle physiologique ... 91
I.B.8.8. Applications... 91
a) Ecotoxicologie... 91
b) Pharmacocinétique humaine ... 91
c) Pharmacocinétique vétérinaire ... 92
I.B.8.9. Bonnes pratiques de modélisation... 92
I.C. PHARMACOPHYSIOLOGIE AVIAIRE : PARTICULARITES ET IMPACT SUR L’ADME... 95
I.C.1.PARTICULARITES ANATOMO-PHYSIOLOGIQUES... 95
I.C.1.1. Système digestif ... 95
a) Anatomie ... 95
b) Physiologie ... 96
I.C.1.2. Débits cardiaque et régionaux chez la volaille... 97
I.C.1.3. Autres considérations physiologiques chez les oiseaux ... 98
a) Généralités... 98
b) Poumons ... 98
c) Reins... 98
I.C.2.CONSIDERATIONS PHARMACOCINETIQUES ET FACTEURS DE VARIATIONS... 98
I.C.2.1. Absorption ... 98
I.C.2.2. Distribution ... 99
I.C.2.3. Métabolisme ... 100
I.C.2.4. Excrétion ... 101
I.C.3.ALLOMETRIE CHEZ LES OISEAUX... 102
I.C.4.MODE D’ADMINISTRATION DES MEDICAMENTS... 102
I.C.4.1. Voie orale ... 102
a) Administration orale... 103
c) Aliment médicamenteux ... 104
I.C.4.2. Voie parentérale... 104
I.C.4.3. Voie topique... 104
I.C.4.4. Inhalation ... 104
I.D. CONCLUSION ... 105
II. ETUDES EXPERIMENTALES ... 107
II.A. AVANT-PROPOS ... 107
II.B. MANAGEMENT DE L’ASSURANCE QUALITE EN RECHERCHE ... 107
II.C. ETUDES IN VIVO... 108
II.C.1.METHODES ANALYTIQUES... 108
II.C.2.OBSERVATIONS SUR L’UTILISATION DE L’ECHANTILLONNAGE DESTRUCTIF DANS LES ETUDES DE BIODISPONIBILITE... 109
II.C.2.1. Matériels et méthodes ... 109
II.C.2.2. Résultats... 109
II.C.2.3. Conclusion ... 109
II.C.3.ETUDE COMPARATIVE DU MONENSIN CHEZ LE POULET, DU MONENSIN CHEZ LE DINDON ET DE LA SALINOMYCINE CHEZ LE POULET... 109
II.C.3.1. Matériels et méthodes ... 110
a) Etudes de biodisponibilité orale ... 110
b) Etudes de résidus... 110
II.C.3.2. Résultats... 111
II.C.3.3. Conclusion ... 111
II.C.4.ETUDE SUR LES POIDS DES TISSUS DES POULETS ET DES DINDONS... 111
II.C.4.1. Matériels et méthodes ... 113
II.C.4.2. Résultats... 113
II.C.5.ETUDE DE CONSOMMATION DES ANTICOCCIDIENS CHEZ LA VOLAILLE... 113
II.C.5.1. Matériels et méthodes ... 113
II.C.5.2. Résultats... 113
II.C.5.3. Conclusion ... 113
II.D. ETUDES IN VITRO ... 115
II.D.1.METHODES ANALYTIQUES... 115
II.D.1.1. Validation de méthode ... 115
II.D.1.2. Plan d’expérience ... 115
II.D.1.3. Résultats de validation... 115
II.D.2.ETUDES DE METABOLISME... 116
II.D.2.1. Métabolisme hépatique in vitro du monensin chez le poulet et le dindon ... 116
a) Méthode... 116
b) Résultats ... 116
c) Conclusion... 116
II.D.2.2. Métabolisme hépatique in vitro de la salinomycine chez le poulet ... 116
a) Méthode... 116
b) Résultats ... 118
c) Conclusion... 118
II.E.1.LE DIAGRAMME DU MODELE... 120
II.E.2.LA CARACTERISATION DU MODELE... 120
II.E.3.L’ADMINISTRATION... 122
II.E.4.PARAMETRES... 122
II.E.5.ANALYSE DE SENSIBILITE... 124
II.E.6.AJUSTEMENT DES PARAMETRES... 126
III. DISCUSSION... 130 ARTICLE 1... 137 ARTICLE 2... 153 ARTICLE 3... 163 ARTICLE 4... 177 ARTICLE 5... 199
ANNEXE 1 : MATERIEL NECESSAIRE POUR LE DOSAGE DU MONENSIN ET DE LA SALINOMYCINE DANS LES MICROSOMES DE VOLAILLE ... 203
ANNEXE 2 : MODE OPERATOIRE POUR LA VALIDATION DES METHODES DE QUANTIFICATION DU MONENSIN ET DE LA SALINOMYCINE DANS LES MICROSOMES HEPATIQUES DE VOLAILLE... 205
ANNEXE 3 : CODE INFORMATIQUE CORRESPONDANT AUX EQUATIONS DIFFERENTIELLES IMPLEMENTEES POUR LE MODELE PHYSIOLOGIQUE 211 ANNEXE 4 : CODE INFORMATIQUE CORRESPONDANT A L’ANALYSE DE SENSIBILITE REALISEE SUR LE MODELE PHYSIOLOGIQUE... 213
LISTE DES ILLUSTRATIONS
Figure 1.1. (page 19) Les modes de transport catalysés par les ionophores neutres (I) et carboxyliques (II) dans les membranes biologiques
Figure 1.2. (page 22) Cycle évolutif des coccidies du genre Eimeria Figure 1.3. (page 26) Structure chimique du monensin
Figure 1.4. (page 35) Structure chimique de la salinomycine
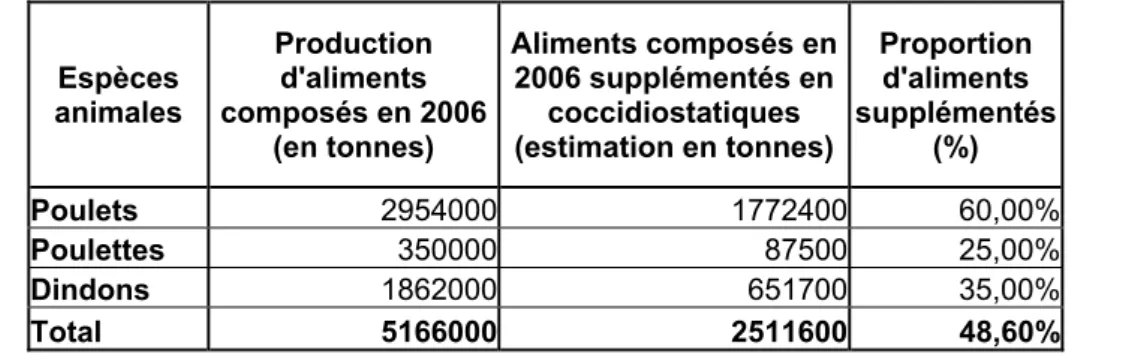
Figure 1.5. (page 39) Répartition des additifs coccidiostatiques utilisés en élevage aviaire en France en 2006
Figure 1.6. (page 42) Chaîne de fabrication des aliments médicamenteux
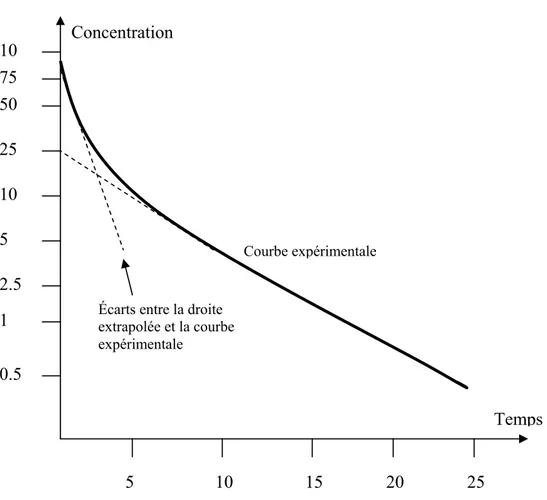
Figure 1.7. (page 46) Déplétion des résidus marqueur et totaux après administration d’une molécule
Figure 1.8. (page 50) Schéma décrivant le calcul du temps d’attente selon une approche de régression linéaire
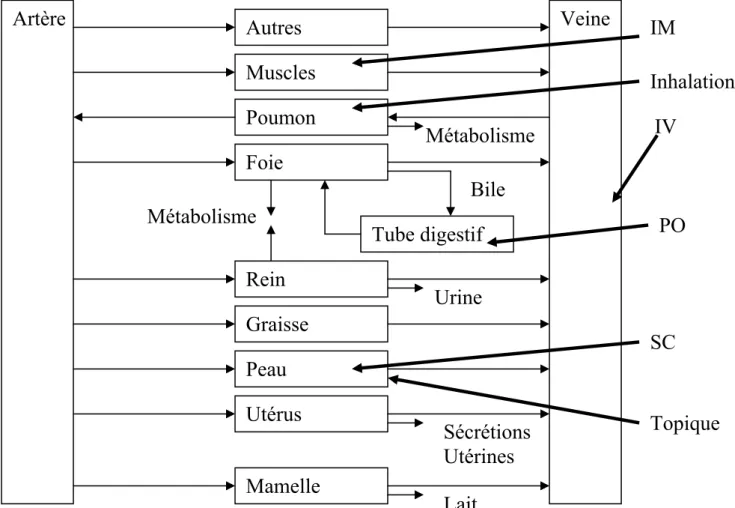
Figure 1.9. (page 54) Mécanismes d’ADME et modes d’administration des médicaments Figure 1.10. (page 56) Répartition de la fraction de dose biodisponible
Figure 1.11. (page 60) Différences de calcul de la clairance entre l’analyse non compartimentale et l’analyse compartimentale
Figure 1.12. (page 62) Méthode linéaire des trapèzes
Figure 1.13. (page 64) Représentation du modèle pharmacocinétique à un compartiment Figure 1.14. (page 67) Variation en fonction du temps, de la concentration en médicament dans un modèle à deux compartiments
Figure 1.15. (page 67) Représentation pharmacocinétique du modèle à deux compartiments avec les processus de transferts
Figure 1.16. (page 70) Modèle à effet mixte liant la clairance d’un médicament à la clairance de la créatinine : Modèle de structure
Figure 1.17. (page 70) Modèle à effet mixte: Variabilité inter-individuelle Figure 1.18. (page 72) Modèle à effet mixte: Variabilité résiduelle
Figure 1.19. (page 78) Diagramme schématique d’un modèle pharmacocinétique basé sur la physiologie d’une femelle ovine en lactation
Figure 1.20. (page 78) Schéma de distribution dans les sous-compartiments d’un tissu
Figure 1.21. (page 89) Représentation log-log de la relation allométrique du volume de distribution (Vd) et de la clairance (Cl) pour un médicament hypothétique
Figure 1.22. (page 94) Anatomie simplifiée du tube digestif des volailles Figure 2.1. (page 112) Consommation journalière de monensin chez un poulet Figure 2.2. (page 112) Consommation journalière de monensin chez un dindon Figure 2.3. (page 112) Consommation journalière de salinomycine chez un poulet
Figure 2.4. (page 114) Profil d’exactitude de la méthode de quantification du monensin dans les suspensions microsomales de volaille
Figure 2.5. (page 114) Profil d’exactitude de la méthode de quantification de la salinomycine dans les suspensions microsomales de volaille
Figure 2.6. (page 117) Essai de métabolisation de la salinomycine 500 µM en présence de microsomes hépatiques de poulet
Figure 2.7. (page 117) Essai de métabolisation de la salinomycine 50 µM en présence de microsomes hépatiques de poulet
Figure 2.8. (page 117) Essai de métabolisation de la salinomycine 5 et 2.5 µM en présence de microsomes hépatiques de poulet
Figure 2.9. (page 119) Diagramme du modèle pharmacocinétique du monensin basé sur la physiologie du poulet
Figure 2.10. (page 123) Analyse de sensibilité aux variations du coefficient de partition foie/plasma sur les profils plasmatiques après administrations uniques et sur les profils tissulaires après administration orale répétée
Figure 2.11. (page 125) Analyse de sensibilité aux variations de la constante d’absorption sur les profils plasmatiques après administrations uniques par voie intraveineuse et orale Figure 2.12. (page 125) Analyse de sensibilité aux variations du coefficient de partition muscle/plasma sur les profils tissulaires après administration orale répétée
Figure 2.13. (page 127) Analyse statistique de l’ajustement du modèle
Figure 2.14. (page 127) Analyse de sensibilité aux variations du coefficient de partition foie/plasma sur les profils tissulaires après administration orale répétée après ajustement
LISTE DES TABLEAUX Tableau 1.1. (page 27) Les différentes formes du monensin
Tableau 1.2. (page 32) Structure chimique des métabolites du monensin sodique identifiés chez le poulet, le dindon et le rat
Tableau 1.3. (page 34) DL50 du monensin par voie orale
Tableau 1.4. (page 41) Comparaison sur la production d’aliments supplémentés pour les différentes espèces de la filière aviaire en 2006
Tableau 1.5. (page 44) Comparaison des études nécessaires à l’évaluation du risque lors de la mise sur le marché d’un additif coccidiostatique et d’un médicament vétérinaire
Tableau 1.6. (page 101) Concentrations en chloramphénicol dans le sang 2h après une administration intramusculaire de 50 mg/kg
Tableau 1.7. (page 102) Différences dans les formules pour le calcul de quelques paramètres physiologiques entre oiseaux et mammifères
Tableau 2.1. (page 108) Bilan qualité de la thèse
Tableau 2.2. (page 113) Fractions de poids corporel des tissus d’intérêt chez le poulet et le dindon
Tableau 2.3. (page 124) Paramètres du modèle physiologique
LISTE DES ABREVIATIONS ADME : Absorption distribution métabolisme excrétion
AESA (EFSA) : Autorité européenne de sécurité alimentaire (European food safety authority) AFNOR : Agence française de normalisation
AFSSA : Agence française de sécurité sanitaire des aliments AUC (ASC) : Area under the curve (Aire sous la courbe) AUMC : Area under the moment curve
Cmax : Concentration maximale
CSAA : Comité scientifique de l’alimentation animale CYP : Cytochrome P450
DJA (ADI) : Dose journalière acceptable (Acceptable daily intake) DL50 : Dose létale 50%
DSE (NOEL) : Dose sans effet (No observed effect level) eFAST : Extended Fourier amplitude sensitivity test EMEA : European medicines agency
FAO : Food and agricultural organization
FARAD: Food animal residue avoidance databank FDA: Food and drug administration
FEEDAP: Panel on additives and products or substances used in animal feed (Groupe scientifique sur les additives et produits ou substances utilises en alimentation animale)
FO : First order
GLS : Generalized least squares (Moindre carrés généralisés)
HPLC/ESI-MS : High performance liquid chromatography/electrospray ionization-mass spectrometry (Chromatographie liquide haute performance couplée à la spectrométrie de masse avec ionisation par electrospray)
ISO : International organization for standardization (Organisation internationale de normalisation)
JECFA : Joint FAO/WHO expert committee on food additives KM: Constante de Michaelis-Menten
Kp : Coefficient de partage tissu/sang
LERAP : Laboratoire d’études et de recherche avicoles et porcines
LERMVD : Laboratoire d’études et de recherche sur les médicaments vétérinaires et les désinfectants
LMR (MRL) : Limite maximale de résidus (Maximal residue limit) MAT : Mean absorption time
MDR : Multi drug resistance
MRT: Mean residence time (Temps de residence moyen)
PBPK : Physiologically based pharmacokinetics (Pharmacocinétique basée sur la physiologie)
Pgp : Glycoprotéine P
PRCC : Partial rank correlation coefficient
Tmax : Temps pour atteindre la concentration maximale
Vdβ : Volume de distribution apparent
Vmax : Maximum velocity (Vitesse maximale de métabolisme) VRT : Variance of the mean residence time
Vss : Volume de distribution à l’état d’équilibre
LISTE DES PUBLICATIONS ET COMMUNICATIONS Publications dans les revues à comité de lecture :
Cheneau E, Henri J, Pirotais Y, Abjean JP, Roudaut B, Sanders P, Laurentie M. Liquid Chromatography-electrospray tandem mass spectrometric method for quantification of monensin in plasma and edible tissues of chicken used in pharmacokinetic studies : applying a total error approach. (2007) J. Chromatogr. B. Analyt. Technol. Biomed. Life. Sci. 850 (1-2), 15-23
Henri J, Manceau J, Sanders P, Laurentie M. Cytochrome P450-dependent metabolism of monensin in hepatic microsomes from chickens and turkeys. Accepté dans J. Vet. Pharmacol. Therap.
Henri J, Burel C, Sanders P, Laurentie M. Bioavailability, distribution and depletion of monensin in chickens : destructive sampling studies. Soumis à J. Vet. Pharmacol. Therap. Henri J, Maurice R, Postollec G, Dubreil-Cheneau E, Laurentie M, Sanders P. Systemic bioavailability and tissue distribution of coccidiostats in poultry: comparison of monensin in chickens and turkeys and salinomycin in chickens. Soumis à J. Vet. Pharmacol. Therap. Henri J, Sanders P, Lelievre H, Cadieu N. Implementation and assessment of the quality management system in research in the Laboratory for studies and research on veterinary drugs and disinfectants of the French food safety agency : special case of PhD student works. Soumis à J. Accred. Qual. Assur.
Communications affichées :
Henri J, Cheneau E, Diop M, Abjean JP, Roudaut B, Sanders P, Laurentie M. Monensin preliminary residue and bioavailability studies to develop a physiologically based pharmacokinetic (PBPK) model in chicken. (2006) 10th International Congress of The European Association for Veterinary Pharmacology and Toxicology, Turin, Italie
Roudaut B, Cheneau E, Sanders P, Pirotais Y, Chotard MP, Burel C, Maurice R, Henri J. Residue depletion studies of two ionophoric coccidiostats: monensin in chicken and turkey tissues and salinomycin in chicken tissues. (2008) EuroResidue Conference on residues of veterinary drugs in food, Egmond aan Zee, Pays-bas.
INTRODUCTION GENERALE
Les additifs anticoccidiens sont largement utilisés en élevage aviaire. La réglementation est en cours d’évolution rapide au niveau européen et les additifs anticoccidiens font l’objet d’un processus d’évaluation du rapport bénéfice/risque par l’Autorité Européenne de Sécurité Alimentaire (AESA). Pour chaque additif, plusieurs options sont possibles. Certains seront interdits et des modalités de contrôle (tissu cible, résidu marqueur) seront à définir tandis que d’autres seront autorisés car ils présentent un intérêt indéniable en élevage dans la lutte contre les coccidioses subcliniques qui sont à l’origine de pertes économiques importantes du fait de déclassements de carcasses ou d’indices de conversion alimentaire modifiés.
Néanmoins, dans le cas des molécules autorisées, il est important d’assurer la sécurité du consommateur en maîtrisant les concentrations résiduelles au niveau des produits de consommation (1). A partir des limites maximales de résidus fixées sur des bases toxicologiques, il est nécessaire pour le consommateur et pour l’éleveur de définir un temps d’attente avant abattage adéquat pour éviter de dépasser ces limites tolérables, pour protéger le consommateur sans pénaliser l’éleveur (205). Ce temps d’attente permet en effet à l’animal d’éliminer, par des processus physiologiques, les molécules qui lui ont été administrées afin de réduire à des niveaux acceptables, les concentrations tissulaires retrouvées ensuite dans les denrées alimentaires. Dans le processus d’évaluation de ce risque, l’industriel utilise des études de déplétion spécifiques à la spécialité, à la posologie et à l’espèce considérée. L’analyse des données de ces études repose sur la pharmacocinétique compartimentale classique et si la posologie ou l’espèce de destination est changée, de nouvelles études sont nécessaires.
La modélisation pharmacocinétique basée sur la physiologie (Physiologically Based PharmacoKinetic) présente une approche nouvelle qui offre des possibilités d’extrapolations (de dose, de durée, de voie d’administration et d’espèce) très intéressantes (231) dans le cas de l’évaluation de l’exposition à des contaminants. Cette technique de simulation se fonde sur la réalité physiologique de l’organisme et présente une signification anatomique. De ce point de vue, elle s’accorde avec les études de résidus dont le but est de décrire les concentrations dans les tissus d’intérêt. Un modèle PBPK est construit comme une série d’organes interconnectés par le système circulatoire permettant ainsi de décrire l’absorption, la distribution et l’élimination du principe actif mais aussi l’apparition d’éventuels métabolites. Chaque compartiment représente un tissu bien défini par ses caractéristiques anatomiques et physiologiques, par sa fonction et son affinité pour la molécule. Les compartiments sont divisés en trois espaces : vasculaire, intersticiel et cellulaire. Chaque tissu d’intérêt pour la molécule est pris en compte (4). Très utilisé en médecine humaine pour l’extrapolation à différents états physiologiques (gestation, obésité, personnes âgées) et dans le processus de développement pharmaceutique (passage de l’animal à l’homme), elle l’est de plus en plus en médecine vétérinaire pour l’extrapolation aux espèces mineures notamment (60). D’usage fréquent chez les mammifères, la modélisation pharmacocinétique basée sur la physiologie, n’a à notre connaissance jamais été appliquée chez les oiseaux.
La pharmacocinétique aviaire est une discipline largement moins documentée que celle des mammifères bien qu’elle présente des spécificités importantes et des variations inter-espèces (76) non négligeables. En effet, une simple extrapolation aux oiseaux des schémas posologiques établis chez les mammifères ne permet pas de définir de façon correcte un
schéma thérapeutique en pathologie aviaire. Les différences anatomiques (système digestif, système porte rénal) et physiologiques (métabolisme) ont une grande influence sur la disposition des principes actifs. La plupart des médicaments sont développés pour les mammifères (75) et ne sont pas formulés pour les oiseaux. Les médicaments peuvent être administrés aux oiseaux individuellement ou par bandes. Pour la volaille, l’eau de boisson et les aliments supplémentés sont les voies d’administration les plus utilisées (245), mais en cas de maladie sérieuse, l’administration parentérale peut être une alternative de choix.
Le sujet de thèse concerne la pharmacocinétique des anticoccidiens utilisés comme additifs alimentaires chez la volaille. Etant donné la grande variété des anticoccidiens, qu’ils soient d’origine synthétique (décoquinate, diclazuril, halofuginone, robenidine et nicarbazine) ou d’origine naturelle tels que les ionophores (lasalocide, maduramicine, monensin, narasin, salinomycine et semduramicine), il a été décidé de s’intéresser a deux anticoccidiens naturels. Les deux molécules retenues, le monensin et la salinomycine, présentent des propriétés biologiques similaires mais des structures chimiques relativement différentes afin de pouvoir établir quelques généralités sur cette famille de molécules. Pour établir une comparaison interespèces, il a été choisit de s’intéresser à la pharmacocinétique de la molécule la plus utilisée, le monensin, non seulement chez le poulet mais aussi chez le dindon. Les modèles physiologiques offrent les possibilités d’extrapolation interspécifique et de posologie compatibles avec nos objectifs. Cet outil permet d’estimer les concentrations tissulaires et donc d’évaluer le risque de retrouver des résidus de molécules à usage vétérinaire suivant différents scénarios dans les espèces de consommation. Cette préoccupation n’intéresse pas que les experts, elle touche aussi le grand public. Elle est totalement justifiée car un nombre croissant de molécules est utilisé dans les espèces de production, ce qui représente un risque d’exposition permanente à des xénobiotiques pour le consommateur et un facteur d’émergence de résistance aux antibiotiques (155). Parallèlement, les résultats des études de biodisponibilité et de résidus seront examinés afin d’en retirer des informations concernant le temps d’attente et les tissus cibles pour les contrôles.
La construction d’un modèle physiologique comporte plusieurs étapes. Dans un premier temps, il faut définir le diagramme représentant le devenir de la molécule avec les organes gouvernant l’absorption, la distribution, le métabolisme et l’élimination du principe actif ainsi que les tissus d’intérêt dans le cadre de la problématique des résidus. Pour chacun des compartiments décrits, il faut déterminer les équations qui vont régir les échanges et les biotransformations impliqués dans ces processus (134). Associés à ces équations, il faut déterminer les paramètres qui devront être obtenus expérimentalement ou trouvés dans la littérature. Il faut ensuite monter les expériences in vitro ou in vivo qui permettront d’affecter des valeurs à ces paramètres et de réaliser des simulations une fois que le mode d’administration est décrit avec la dose, la fréquence et la durée d’administration. Les simulations sont réalisées à l’aide de logiciels (80) permettant de résoudre le système d’équations différentielles implémenté. Les simulations obtenues sont ensuite confrontées par ajustement aux concentrations obtenues après traitement dans les « conditions terrain ». L’impact de cet ajustement sur la valeur des paramètres est alors examiné pour en déterminer la pertinence physiologique. Une analyse de sensibilité sur les paramètres peut alors être réalisée afin de connaître les paramètres les plus influents sur le processus global et de pouvoir réduire le nombre de paramètres aux plus importants pour les futurs investigations. La première partie de ce mémoire sera essentiellement bibliographique. Elle permettra de résumer les propriétés des anticoccidiens qui nous renseigneront sur leur pharmacocinétique et permettront ainsi d’établir le diagramme et les mécanismes mis en jeu dans chacun des
compartiments. Ensuite, nous introduirons la problématique que posent les résidus de molécules vétérinaires et notamment des anticoccidiens, dans les denrées alimentaires en présentant la pharmacocinétique comme un outil permettant d’étudier la présence de ces résidus et donc d’évaluer le risque de contamination de l’alimentation humaine. Les aspects fondamentaux de la pharmacocinétique, ainsi que les techniques de modélisation (pharmacocinétique de population et pharmacocinétique basée sur la physiologie) et leurs applications qui présentent un intérêt croissant en toxicologie et en pharmacologie humaine et vétérinaire seront détaillés.
La seconde partie présente les travaux de thèse qui ont été l’occasion de mettre en pratique une réflexion entamée depuis plusieurs années (25) au sein de l’Agence Française de Sécurité Sanitaire des Aliments (AFSSA) sur le management de la qualité en recherche. En effet, l’Afssa, de part ses missions de sécurité alimentaire, est tenu de garantir auprès des experts et du grand public, les résultats de ses activités d’appui scientifique et technique. Ces dernières étant fortement liées à l’effort de recherche engagé par l’afssa, il a été décidé de concevoir un système permettant de garantir également les résultats de la recherche menée au sein du Laboratoire d’Etudes et de Recherche sur les Médicaments Vétérinaires et les Désinfectants (LERMVD).
Nos travaux ont tout d’abord porté sur la validation des méthodes analytiques selon l’approche de l’erreur totale. La validation analytique étant l’étape préalable à toute étude pharmacocinétique pour évaluer l’exactitude de la méthode de quantification. Les études de métabolisme ont été réalisées in vitro sur des microsomes hépatiques de volaille. Ensuite les études de biodisponibilité orale et de résidus en cours de traitement et à l’arrêt du traitement ont permis de déterminer in vivo les paramètres d’absorption, d’excrétion et de partition indispensables au modèle. Ces études ont également permis d’obtenir des paramètres pharmacocinétiques renseignant sur les conditions de dépassement des limites tolérables en résidus d’anticoccidiens. Les études suivantes ont porté sur le poids des organes de volaille qui au contraire des débits de perfusion (autre paramètre physiologique nécessaire au développement du modèle physiologique) ne sont pas retrouvés dans la littérature. Finalement des études de consommation horaire des additifs anticoccidiens concernés ont été réalisées afin d’obtenir les données d’administration qui permettent d’effectuer les simulations nécessaires à l’obtention des cinétiques plasmatiques et tissulaires après l’arrêt du traitement au monensin chez le poulet.
(IN)O a g a H2O-M+ I b c I (MI)+ (MI)+ (MI)+ I I d e H2O f I Neutre M+ M+ M+-H 2O f H2O-M+ I -b (MI)O (MI)O (MI)O I -d M+- OH2 e II Carboxylique M+ M+ N+- OH 2 I -c N+ N+ I -OH2 - N+ g
Figure 1.1. Les modes de transport catalysés par les ionophores neutres (I) et carboxyliques (II) dans les membranes biologiques (174)
I. ETUDE BIBLIOGRAPHIQUE I.A. Les anticoccidiens I.A.1. Famille des ionophores
Les anticoccidiens ne sont pas des médicaments mais des additifs alimentaires. Il en existe de deux sortes : les produits de synthèse et ceux qui nous intéressent plus particulièrement de part leur structure chimique commune, les polyéthers carboxyliques encore appelés antibiotiques ionophores.
Ces « anticoccidiens naturels » font partis d’un groupe de molécules plus vaste : les ionophores (185), signifiant « transporteurs d’ions ». Ceux-ci constituent un groupe de composés qui possèdent une architecture moléculaire parfaitement adaptée au transport des ions de petite taille au travers des barrières lipidiques. Ils présentent un intérêt considérable de par leur capacité de modifier la perméabilité des systèmes membranaires, naturels et artificiels. Cette propriété leur permet de changer les gradients de concentration de part et d’autre des membranes biologiques et donc d’interférer dans les processus métaboliques liés à la barrière membranaire. Ces composés (de 200 à 2000 Da) forment des complexes liposolubles avec les cations polaires, parmi lesquels certains (K+, Na+, Ca2+) jouent un rôle biologique déterminant. Tandis que les premiers ionophores connus étaient issus du métabolisme des microorganismes, plusieurs composés furent synthétisés plus tard avec des propriétés moléculaires équivalentes. Leur cinétique de complexation/décomplexation et leur vitesse de diffusion en font des transporteurs membranaires plus efficaces que la plupart des enzymes macromoléculaires (186), ils peuvent effectuer jusqu’à 1000 cycles de transport par seconde. Leur capacité de transport tient à la conformation particulière de leur squelette : les atomes d’oxygène sont répartis sur la surface interne d’une cavité d’accueil dans laquelle ils maintiennent un cation prisonnier par des interactions ion-dipôle.
Le fait que ces molécules présentent une forte affinité aux cations a fait que les ionophores ont connu un intérêt marqué en biologie cellulaire, en biochimie et dans l’industrie agroalimentaire. Elles permettent de moduler pharmacologiquement l’activité ionique de systèmes cellulaires isolés ou complexes et ainsi de comprendre les modes d’action à l’origine de nombreux phénomènes biologiques. Les ionophores furent connu à l’origine pour leur effet de stimulation des transporteurs couplés à la production d’énergie dans les mitochondries. Selon le mode de transport engendré, les ionophores sont répartis en trois catégories :
a) Les « quasi-ionophores » sont des molécules polypeptidiques capables de former des pores conducteurs d’ions. Ils sont en cela différents des 2 catégories suivantes d’ionophores.
b) Les ionophores neutres (174) se trouvent initialement à l’intérieur de la membrane puis diffusent à sa surface (figure 1.1.). C’est alors qu’ils se combinent aux cations formant des complexes hydrophiles. L’eau de solvatation de l’ion est expulsée et remplacée par les oxygènes réactifs de l’ionophore contribuant à rendre le complexe lipophile. Cet ensemble apolaire peut alors migrer à l’intérieur de la bicouche phospholipidique. Arrivé à la surface de la membrane opposée, le complexe se dissocie et le ionophore libre retourne à l’intérieur de la membrane. Le résultat net consiste en un passage du cation avec sa charge au travers de la membrane biologique.
Les ionophores neutres, dont la valinomycine est un exemple, ne présentent pas une fortes activités antimicrobienne et ne sont par conséquent pas utilisés comme antibactériens.
c) Les ionophores carboxyliques sont des molécules à chaîne ouverte. Les complexes formés avec les cations sont électriquement neutres et migrent indépendamment du potentiel de membrane, par un phénomène de diffusion passive. Nous allons nous intéresser plus particulièrement à cette catégorie de molécules.
I.A.2 Les ionophores carboxyliques : des anticoccidiens naturels
La plupart des antibiotiques ionophores sont produits par des champignons saprophytes de genre Streptomyces (38) mais d’autres tels que Streptoverticullium, Nocardiopsis, Nocardia et Actinomadura sont connus pour leur capacité à synthétiser ces molécules.
I.A.2.1. Mode d’action chez les bactéries
Tous les ionophores incorporés dans les additifs alimentaires à destination des animaux de rente sont des ionophores carboxyliques. Le mode de transport induit par les ionophores carboxyliques (figure 1.1.) est différent de celui des ionophores neutres. En effet, au pH physiologique de 7.4, le groupement carboxylique est ionisé, ce qui le confine à la surface de la membrane. Lorsque le ionophore anionique rencontre un cation, la complexation s’effectue par formation d’un zwitterion. Les charges alors compensées, le complexe peut s’extraire de la surface polaire. Le squelette lipophilique de l’ionophore permet la diffusion passive du complexe et sa migration vers le coté opposé. Ce mouvement facilite la resolvatation du cation à l’arrivée du complexe sur la face opposée. La diminution de la polarité du ionophore par complexation avec un autre cation (pouvant être remplacé par un proton) rend possible le retour du ionophore sur la face initiale de la membrane par le même mécanisme. Ce qui fait des ionophores carboxyliques des échangeurs de cations passifs. Ce groupe est lui-même subdivisé en polyethers monovalents et divalents suivant la catégorie d’ions qu’ils transportent préférentiellement.
Si le principe d’action de base (facilitation du transport membranaire) ne prête pas à discussion, la détermination précise des modifications métaboliques induites dans les microorganismes (bactéries et protozoaires) est sujette à diverses interprétations, en particulier pour expliquer l’effet létal. Un premier mécanisme proposé (22) repose sur le fait de facilitation du transfert membranaire de sodium. La séquence suivante a été postulée:
- En présence du microorganisme, l’ionophore très liposoluble se loge dans la membrane, dans la partie apolaire de la bicouche lipidique.
- L’organisme unicellulaire produit en permanence un gradient de protons. - L’ionophore fixerait le proton et le libérerait dans le milieu extérieur.
- Il fixerait ensuite un ion sodique dont l’intégration dans l’organisme intéressé serait accrue.
- Ce processus perturbateur du fonctionnement conduirait l’organisme à la mort Ce mécanisme a cependant été rapidement remis en cause car non cohérent avec les mesures physico-chimiques sur des bactéries traitées. Il est aussi apparu que le transport du sodium
est largement influencé par les conditions de pH et de concentrations respectives des milieux extra et intracellulaires :
- Lorsque les deux cotés de la membrane sont au même pH, le transfert du sodium se fait dans le sens du gradient de concentration de cet ion.
- Lorsque la concentration de l’ion est la même des deux côtés de la membrane, le transfert a lieu en sens inverse du gradient de pH.
L’effet létal serait donc une résultante d’une modification de pH ou d’osmolarité. Des études (203) sur les modifications induites par le monensin sur une bactérie cible du rumen, Streptococcus bovis, montrent que les modifications intracellulaires sont en réalité plus complexes. Une baisse du pH est constatée, ainsi qu’une baisse du potassium et une élévation du sodium. Si l’élévation du taux de sodium est cohérente avec une stimulation du transfert membranaire de cet ion, c’est en fait une élévation du pH qui devrait être observée car les mouvements de sortie des protons devraient être augmentés. L’interprétation la plus cohérente est que cette molécule affecte en réalité deux systèmes membranaires de transport :
- l’un facilitant l’entrée de sodium et la sortie de protons, - l’autre facilitant la sortie du potassium et l’entrée des protons.
Ainsi, bien que l’affinité la plus marquée du monensin sur les ions soit pour le sodium, la modification cellulaire définitive dominante résulte d’un effet sur les transports de potassium, sans doute inhérent au gradient initial beaucoup plus élevé de cet ion entre les milieux extra et intracellulaires. Les modifications intracellulaires sont apparues cependant trop faibles pour entraîner la mort de la bactérie, en particulier la baisse du pH à 6.2 est modérée pour une bactérie acidophile capable de se multiplier à pH 5.4. Pour cette raison, la cause de l’effet bactéricide résulterait indirectement de ces modifications de répartition ionique : la production d’énergie disponible pour le microorganisme dépend de transferts d’électrons qui sont assurés chez les bactéries par des systèmes équivalents aux cytochromes des eucaryotes. L’accumulation des protons entraînerait un accroissement et un épuisement de l’ATP utilisé pour les rejeter activement. Sur un autre modèle bactérien (Bacteroïdes succinogenes), ces deux modifications intracellulaires, baisse du pH et baisse de la concentration d’ATP ont été retrouvées, ce qui confirme l’idée d’une accumulation de protons, vis-à-vis de laquelle la bactérie réagit par un accroissement du rejet actif et épuise son ATP. La membrane externe des bactéries gram négatives ne permet pas la pénétration de molécules hydrophobes de poids moléculaire supérieur à 600 et ne sont par conséquent pas susceptibles à l’action des ionophores (259).
I.A.2.2. Cycle de développement des coccidies et action des anticoccidiens Cette action permet deux utilisations zootechniques chez les animaux de rente:
- contrôler et orienter les fermentations des réservoirs gastriques des ruminants (197), - contrôler la prolifération d’agents pathogènes, en particulier les coccidies.
Les coccidies sont des protozoaires du genre Eimeria. Leur cycle évolutif est monoxène, c’est-à-dire qu’il se déroule dans un seul hôte. Il est effectué chez le poulet en 4 à 7 jours selon l’espèce. Les poulets sont sensibles à neuf espèces d’Eimeria mais seulement sept d’entre elles sont couramment rencontrées. Les dindons sont sensibles à sept espèces d’Eimeria. Le cycle de développement de ce parasite, peut être décomposé en trois phases distinctes : sporogonie, mérogonie et gamogonie (figure 1.2.).
- sporogonie, période pendant laquelle les oocystes vont sporuler sous l’effet de facteurs du milieu (température, hygrométrie et oxygénation) pour devenir infectants. Ils renferment alors des sporocystes, contenant chacun des sporozoïtes en forme de banane.
- mérogonie, pénétration du stade infectant dans les cellules de l’hôte et série de multiplications asexuées. Les animaux s’infectent par voie orale, en ingérant des oocystes présents dans l’eau de boisson ou les aliments souillés. Les oocystes sont broyés dans le gésier et libèrent les sporocystes. Les sporocystes excystent au niveau intestinal sous l’effet de facteurs mécaniques et biochimiques. Chaque sporocyste libère deux sporozoïtes qui pénètrent dans les cellules épithéliales de l’intestin puis se transforment en mérontes. La cellule infectée éclate et libère des mérozoïtes qui envahissent les cellules environnantes
- gamogonie, phase sexuée du cycle qui se termine par la fécondation et la formation du zygote. Les mérozoïtes donnent naissance à des macrogamètes femelles et des microgamètes males qui les féconderont. Le zygote résultant de la fécondation s’entoure d’une coque pour évoluer vers l’oocyste qui est libéré dans le milieu extérieur avec les féces.
Les sporozoïtes exposés aux anticoccidiens dans la lumière intestinale présentent un gonflement considérable, de large vacuoles ainsi que des trous à la surface qui laissent suggérer des dommages osmotiques létaux. Le développement d’un sporozoïte qui a infesté son hôte est inhibé à mesure que le ionophore continue son processus de destruction. L’anticoccidien détruit sélectivement les sporozoïtes intracellulaires tandis qu’il laisse relativement intacte la cellule hôte (45). Il a été montré que les anticoccidiens avaient un effets sur la seconde génération de mérozoïtes mais pas sur le développement des gamètes. I.A.2.3. Effets à dose pharmacologique chez l’animal
Chez les animaux, deux types d’effets se distinguent : les effets dépendants d’une action membranaire directe et ceux qui surviennent indirectement.
a) Effets directs
- Des modifications cardiovasculaires sont observées : effets cardiaques chronotropes et inotropes positifs (212), effet presseur et effet coronaro-dilatateur. Ces effets peuvent être imputés à une action membranaire car ils peuvent être obtenus sur préparation traitées par des antagonistes adrénergiques.
- Outre les effets sur la membrane plasmique, les ionophores agissent aussi sur les autres membranes cellulaires, telles que celles des organelles. Le fait a été montré avec les membranes des mitochondries où le monensin favorise la captation du calcium et la sortie des protons (185).
- Une stimulation du transfert des acides aminés. Par exemple, sur des cultures de fibroblastes, les ionophores stimulent la captation du sodium, en échange des protons, et en même temps stimulent la pénétration des acides aminés. Ces transports sont bloqués par l’ouabaïne qui bloque spécifiquement l’ATPase Na+-K+ dépendante (22). L’absorption intestinale des acides aminés se trouve donc probablement modifiée. - Des interférences avec le métabolisme et l’absorption des ions métalliques a été
suggérée pour le sélénium, le calcium, le fer et le cuivre. Avec le sélénium on a montré que des agneaux recevant le monensin comme anticoccidien (5) présentaient
un taux plus élevé de gluthation peroxydase. Le lasalocide, quant à lui, favorise l’incorporation du fer et du cuivre (81).
b) Effets indirects
Le monensin produit une stimulation sympatho-surrénalienne et un accroissement des catécholamines endogènes. Cet effet participe à la stimulation cardiovasculaire qui peut être partiellement antagonisée par la sympathectomie chimique réserpinique (22). L’action est cependant plus complexe dans la mesure où les effets sur la biosynthèse des cathécolamines varient selon la molécule (accroissement avec le lasalocide, diminution avec le monensin) et où les effets à long terme peuvent différer des effets aigus (240).
I.A.2.4. Symptômes à dose toxique
Les principaux symptômes communs à toutes les espèces sont l’anorexie (90), la baisse d’activité, l’ataxie (138), la dyspnée, une diarrhée généralement modérée, des signes d’insuffisance cardiaque, un décubitus puis la mort (233).
Chez le cheval, des coliques sont observées, de la sudation jusqu’à l’apparition d’un état de choc hypovolémique. Chez le mouton, le porc et le chien, les principaux symptômes sont la faiblesse musculaire et la myoglobinurie (138).
Les lésions ont été décrites dans les études expérimentales et à la suite d’accidents dans les élevages. Elles concernent en premier lieu les tissus excitables : le cœur, les muscles striés squelettiques et les nerfs. Les lésions cellulaires sont des lésions des membranes : membrane plasmique, membrane du réticulum sarcoplasmique et membrane des mitochondries. Ce sont les membranes des mitochondries qui sont les premières lesées : l’examen de microphotographies de muscles d’animaux intoxiqués montre un gonflement et une vacuolisation avec accumulation de matériel inerte et perte des crêtes (162). Les muscles se décolorent et cessent de fonctionner, ce qui explique la prédominance des symptômes musculaires et la cause de la mort : l’animal meurt dans un tableau de défaillances cardiaques et de paralysies.
Des lésions d’autres organes ont été rapportées, par exemple une hépatomégalie, une hypertrophie des ganglions lymphatiques, des lésions rénales et des hémorragies de la paroi intestinale (253) avec épaississement. La sévérité des lésions et la nature des organes les plus touchés varient selon l’espèce, le niveau et la durée de l’intoxication (138).
Un aspect particulier de la toxicité des ionophores est la survenue d’interactions par la suite d’emploi simultané d’antibiotiques dont le plus représentatif est la tiamuline. La toxicité de l’ionophore se trouve alors considérablement augmentée. Ces interactions sont interprétées comme le résultat d’un effet de réduction de la biotransformation hépatique de l’ionophore, provoquée par l’autre antibiotique administré simultanément (138). Des incompatibilités ont également été constatées avec le chloramphénicol, l’érythromycine, l’oléandomycine et certains sulfamides (194).
O O O O H CH3 CH3 HO OH H H3C CH3 H CH3 H O HO H3C CH3 R H COONa H3C A B C D E
I.A.3.1. Propriétés physico-chimiques
Nomenclature chimique : Acide2-[5-Ethyltetrahydro-5-[tetrahydro-3-methyl-5-[tetrahydro-6- hydroxy-6-(hydroxymethyl)-3,5-dimethyl-2H-pyran-2-yl]-2-furyl]-2-furyl]-9-hydroxy-.beta.-methoxy-.alpha.,.gamma.,2,8-tetramethyl-1,6-dioxaspiro[4.5]decane-7-butyrique
Formule moléculaire : C36H62O11 [acide libre] C36H61NaO11 [sel de sodium] CAS N° : 17090-79-8 [acide libre]
22373-78-0 [sel de sodium]
Poids moléculaire : 670 g/mol [acide libre]
692 g/mol [sel de sodium]
pKa : 6,6
Hydrosolubilité : 4,8 mg/L [pH 7]
8,9 mg/L [pH 9]
log Kow : 4,2 [pH 5 sel de sodium] 2,8 [pH 7 sel de sodium] 3,8 [pH 9 sel de sodium]
logP : 5,07 [MDL QSAR]
5,43 [KowWin]
Le monensin (figure 1.3.) est un membre de la famille des ionophores carboxyliques isolé à partir du champignon Streptomyces cinnamonensis. C’est un polyether formé de trois cycles éthers à cinq carbones et de deux à six carbones, avec deux groupes hydroxyles terminaux et un groupe acide carboxylique à l’autre extrémité (157). Le monensin se retrouve synthétisé sous quatre formes A, B, C et D. La forme A est majoritaire à plus de 96% et les autres ne représentent pas plus de 2% chacune.
Forme R1 R2
A C2H5 H
B CH3 H
C C2H5 CH3
D ND
Tableau 1.1. Les différentes formes du monensin (ND = Non Déterminé)
En terme quantitatifs, le monensin, qui affecte essentiellement les transferts de sodium, a pour cet ion une affinité dix fois plus élevée que pour le potassium. Ceci n’est pas le cas de tous les antibiotiques ionophores, en effet le lasalocide présente une affinité marquée pour le potassium et une affinité égale pour le calcium et pour le sodium (22).
I.A.3.2. Activité anticoccidienne a) Dose titration
En se basant sur la prévention de la mortalité et l’évolution du gain moyen de poids, une concentration de 120 mg de monensin sodique par kg d’aliment a été jugée efficace contre Eimeria acervulina, E. brunetti, E. maxima, E. mivati, E. necatrix et E. tenella bien que des lésions et quelques oocystes ait été retrouvés chez les poulets traités (214). Des résultats identiques sont retrouvés chez le dindon. Il a été rapporté que la suppression complète de la production d’oocystes n’intervenait que pour une dose de 250 mg/kg d’aliment (9). Même si une augmentation de cette dose a pour conséquence de diminuer la mortalité et les rejets d’oocystes, le gain moyen de poids supplémentaire reste faible. Par conséquent, la dose de 120 mg/kg d’aliment semble être un bon compromis entre un développement normal de la volaille et une action coccidiostatique adéquate (204).
b) Résistance
La résistance aux anticoccidiens est un phénomène répandu, qui a lieu même avec les additifs les plus récents tels que le monensin. Une étude réalisée en Allemagne (219) a permis d’étudier la sensibilité de 10 isolats d’Eimeria : neuf des dix isolats présentaient une résistance à un anticoccidien dont 6 pour le monensin. Une autre étude (62) a comparé l’efficacité de différents additifs dans une ferme dont l’historique laissait suspecter une résistance au traitement sur approximativement 100000 poulets et trois bandes consécutives. Le premier démarrage était porteur d’une résistance contre les anticoccidiens utilisés : nicarbazin, halofuginone et monensin. Une publication plus récente (179) étudie la situation de cette résistance chez des producteurs de poulets néerlandais avec quatre isolats datant de 1996, provenant de fermes avec des problèmes de coccidiose clinique et quatre isolats datant de 1999, provenant de fermes avec des cas de coccidioses subcliniques. Le profil de sensibilité fut établit sur la base de la réduction des lésions dans les groupes traités comparés à un groupe contrôle infecté et non traité. Eimeria acervulina était plus ou moins résistante contre tous les additifs testés dont le monensin. En 1999, quatre autres espèces présentaient des résistances, à l’exception d’une sensible au monensin et au narasin. Les différences entre les résultats observés en 1996 et ceux observés en 1999 peuvent refléter la virulence plus importante des souches issus des cas cliniques par comparaison aux isolats de cas subcliniques mais cela peut également venir de l’emploi de doses moins importantes. Dans les fermes participant à ce programme néerlandais de surveillance de la résistance, l’incidence des coccidioses était de 68% en 1996 et de 91% en 2000. En dépit de l’évidente résistance, il n’a pas été observé d’augmentation des cas cliniques ce qui suggère un phénomène de vaccination spontanée. Des études contradictoires menées aux Etats-Unis ne permettent pas de conclure à une sensibilité (207) ou à une résistance (123) des souches d’Eimeria retrouvées chez les dindons. Des données récentes confirment que quelque soit la volaille élevée, la résistance peut être évitée en alternant les anticoccidiens à chaque démarrage.
I.A.3.3. Activité cardiovasculaire a) Effets pharmacologiques
Le monensin bien qu’utilisé en grande quantité pour son action contre les coccidies chez la volaille et pour son effet promoteur de croissance chez le bétail, a été très étudié pour son action cardiovasculaire comme molécule modèle pour décrire l’action des ionophores
carboxyliques. Une expérience menée chez le chien anesthésié (190) démontre les deux effets distincts du monensin. A faible concentration, 50 µg/kg par voie intraveineuse chez le chien, rapidement, une relaxation des muscles lisses des artères coronaires est obtenue et se manifeste par une augmentation du flux sanguin dans les coronaires. Si la dose est portée à 200 µg/kg, un effet inotrope positif fait suite à la dilatation des coronaires. En parallèle on note une augmentation de la pression sanguine et de la quantité de sang pompée par le cœur (débit cardiaque). Le flux augmente progressivement jusqu’à un plateau entre 10 et 50 µg de monensin par kg d’animal. Des doses plus élevées sont la cause d’une seconde augmentation de ce flux causée par une augmentation de la pression atriale qui dirige le sang dans les coronaires. Une dose de 2,5 µg/kg est suffisante pour doubler le flux basal de 30 mL/min. Ces résultats ont été corroborés (216) et montrent l’utilité du monensin à corriger les effets sur la pression artérielle et le débit cardiaque d’un infarctus aigu du myocarde en faisant la part de la contribution de l’épicarde et de l’endocarde à cette action. Ce type de réponse a également été obtenue chez le chat, le chien conscient, le lapin, le mouton anesthésié ainsi qu’un cochon (189) pour lesquels un choc hémodynamique avait été induit à l’aide d’une endotoxine d’E. coli. Récemment (104), le monensin (50 µg/kg par voie intraveineuse) a prouvé son efficacité à rétablir la pression artérielle (moyenne et systolique), le débit cardiaque et le volume d’éjection après une hypotension hémorragique induite chez le chien anesthésié.
L’effet du monensin sur le débit cardiaque revêt une importance particulière en pharmacocinétique du fait de son impact sur la vitesse de perfusion des organes, ainsi (86) une intraveineuse de 100 µg/kg chez le chien provoque un doublement en 5 minutes du niveau basal de ce paramètre (approximativement 2,5 L/min chez un lévrier et 0,5 L/min chez un colley) perdurant jusqu’à 10 minutes puis revenant progressivement à la normale en une heure.
b) Mécanismes
Les cellules en général, présentent un fort ratio K+/Na+ à l’inverse du milieu extracellulaire. L’action du monensin favorise la perte de K+ intracellulaire pour une quantité équivalente de Na+. Puisque l’augmentation relative de Na+ intracellulaire induite par le monensin est beaucoup plus importante que la perte relative de K+, on en déduit que le gain en Na+ intracellulaire est plus significatif que la perte de K+. Le fait que d’une part il existe une corrélation entre le pouvoir inotrope du monensin et la quantité requise pour libérer une certaine quantité de K+ des érythrocytes principalement en échange de Na+ et que d’autre part les différentes membranes biologiques (érythrocytes et mitochondries) répondent différemment au monensin (108), est en faveur d’un mécanisme d’action fondé sur l’augmentation de Na+ intracellulaire.
Plusieurs des effets du monensin impliquent une augmentation du Ca2+ intracellulaire. Une augmentation de la contractilité implique une augmentation de la disponibilité intracellulaire de Ca2+ afin de déclencher l’action du système actine-myosine. A plus forte dose, le monensin induit progressivement une contracture due à la mobilisation des fibres myocardiques restantes indiquant que l’activité calcique devient trop élevée pour permettre une relaxation de ces fibres (213).
L’activité calcique intracellulaire active aussi les cellules sécrétrices. Des études d’inhibition indiquent que l’effet inotrope du monensin passe en partie par la libération de catécholamines à partir des surrénales et du cœur lui-même (187). Le monensin induit aussi la libération d’acétylcholine au niveau de la jonction neuromusculaire. Dans ce contexte, on observe que
l’augmentation de Na+ intracellulaire produit une augmentation calcique intracellulaire suffisante pour provoquer la stimulation des cellules activables par le calcium.
I.A.3.4. Pharmacocinétique
Dans une étude de 1981, Fahim (85) confirme les effets du monensin et fait le lien entre la pharmacodynamie et la pharmacocinétique du produit. Cette étude montre qu’une injection par voie intraveineuse (100 µg/kg) ou une prise per os (2 mg/kg) chez un chien anesthésié au phénobarbital produisent un effet chronotrope positif ainsi qu’une élévation de la glycémie. Le monensin administré par voie intraveineuse a une demi-vie d’élimination de 2,5 min chez le chien conscient et un Tmax de 90 min par voie orale ; cela coïncide avec le temps d’augmentation maximale de la pression artérielle et du glucose sanguin. Cette demi-vie très courte ne peut pas être liée uniquement à la rapidité des mécanismes d’élimination et doit par conséquent être le fait d’une distribution massive aux tissus. Selon cette étude, la biodisponibilité orale absolue du monensin chez le chien est proche de 100 %. Chez le lapin conscient, des doses plus importantes furent administrées (200 µg/kg en intraveineuse et 10 mg/kg oralement) avec des effets cardiovasculaires moindres et plus lent à se mettre en place que chez le chien, soulignant la variabilité inter-espèces de la pharmacodynamie de cette molécule chez les mammifères. Cependant ces différences s’expliquent plus par la pharmacocinétique du monensin que par sa pharmacodynamie. En effet ces observations sont corrélées avec une clairance plus faible chez le lapin et un passage dans la circulation systémique moins rapide après ingestion. Lors de la même étude, il a été constaté que la majeure partie du monensin apparaît dans les tissus des lapins dans les 10 min suivant l’injection par voie intraveineuse à des concentrations variables suivant la perfusion des tissus (poumons, cœur, reins, foie, muscles et graisse). Ceci amène donc à s’intéresser à la cinétique inter-espèces du monensin. Pour éclaircir ce point de nombreuses études utilisant en majorité du monensin marqué ont été réalisées dans les années 70 jusqu’à la fin des années 80 chez les espèces de destination que sont les poulets et les bovins.
a) Absorption
Du monensin marqué au carbone 14 (66) a été administré par voie orale à 7 poulets males de 5 mois, à 2 veaux (male et femelle) de 3 mois et à 2 poneys Shetland femelles adultes (67) dont la vésicule biliaire avait été canulée pour récupérer la bile. Les doses administrées aux poulets allaient de 2,6 à 100 mg, les veaux ont eux reçu une dose de 10 mg/kg et les poneys plus sensibles au monensin ont reçu une dose de 1 mg/kg. Les données montrent que l’absorption représente de 11 à 31 % du carbone 14 chez le poulet, de 36 à 40 % chez le veau et 18 % chez le poney. Le monensin est donc un produit faiblement absorbé quelquesoit l’espèce de mammifère et même d’oiseau étudiée. La plupart de la radioactivité absorbée est retrouvée dans la bile. Cette proportion est plus faible et plus variable chez les poulets vis-à-vis des veaux. Un plus fort pourcentage de carbone 14 est retrouvé dans le tractus gastro-intestinal, le foie, les reins et la carcasse des poulets auxquels on a administré 100 mg de monensin en comparaison avec les mêmes tissus chez les poulets ayant reçu 12 mg de monensin. Il est possible que les perturbations physiologiques chez les poulets ayant reçu la forte dose contribuent à la rétention plus forte de carbone 14 en diminuant la vitesse d’élimination.
Une étude de biodisponibilité orale absolue du monensin chez 5 poulets (12) a été réalisée avec les résultats suivants : la voie intraveineuse (40 mg/kg) suit un modèle à deux compartiments avec une demi-vie d’élimination de 0,59 ± 0,003 h, un volume de distribution
de 4,11 ± 0,14 L/kg et une clairance totale de 28,36 ± 0,21 mL/kg/min tandis que le gavage par voie orale dans le jabot (40 mg/kg) montre un temps maximal (correspondant à la concentration maximale dans le sérum) de 0,4 ± 0,01 h avec une demi-vie d’absorption de 0,27 ± 0,01 h et une demi-vie d’élimination de 2,11 ± 0,08 h. La biodisponibilité orale absolue annoncée est de 65,1%.
b) Distribution
La première étude sur la distribution du monensin publiée (110) à été réalisée chez les bovins. Le foie était le seul tissu (les autres tissus étant le muscle, la graisse, le rein, le cœur, les poumons et la rate) a contenir de la radioactivité pour un sacrifice 12 h après l’arrêt du traitement que ce dernier ait duré 2 jours ou 5 jours. En complément d’une étude réalisée dans les années 80 (74), deux études (9) ont été réalisées afin d’établir la cinétique d’élimination du monensin marqué au carbone 14 administré pendant 6 jours consécutifs à la dose de 125 mg/kg d’aliments à des poulets. Les résultats sont très semblables concernant la répartition relative de la radioactivité dans les différents organes à 0, 1, 2, 3 et 5 jours d’attente. Pour le dindon, une étude similaire (à la dose de 110 mg de monensin marqué par kg d’aliment pendant 5 jours avec un abattage 6 heures après la fin du traitement) a prouvé que les niveaux résiduels dans le foie, le rein et le muscle étaient similaires à ceux retrouvés chez le poulet à l’exception de la graisse et du tissu adipeux sous-cutané où ces concentrations sont légèrement inférieures.
A coté de cela, deux études ont été menées pour déterminer les résidus de monensin dans les conditions habituelles d’utilisation. Dans la première (171) 4 groupes de 5 poulets males ont reçu la dose de 120 mg/kg d’aliment pendant leur durée de vie et ont été abattus 0, 1, 2 et 3 jours après arrêt de la supplémentation. En utilisant une méthode de chromatographie en couche mince avec une limite de quantification à 0,01 mg de monensin par kg pour la graisse et 0,0125 pour les autres tissus (foie, reins et muscle), il a été montré que les plus fortes concentrations étaient mesurées dans la graisse puis dans le foie et que le monensin n’est détecté que dans le foie et après 2 jours dans aucun tissu. Dans la seconde étude (95), des groupes de 3 poulets ont reçu un aliment de démarrage supplémenté à 100 mg/kg d’aliment pendant 14 jours puis un aliment de finition supplémenté à 120 mg/kg d’aliment et ont été abattus 0, 1, 2 et 3 après l’arrêt du traitement. En utilisant des techniques de chromatographie immunoaffine et d’ELISA quantitative avec une limite de quantification bien plus faible comprise entre 0,0001 mg/kg (foie) et 0,003 mg/kg (peau), il a été confirmé que à l’arrêt du traitement, le plus fort taux résiduel était retrouvé dans la graisse (0,079 mg/kg) suivi de la peau (0,033 mg/kg), le muscle (0,026 mg/kg), le rein (0,019 mg/kg) et le foie (0,015 mg/kg). Des valeurs similaires ont été obtenues après une journée d’attente tandis que le contenu en monensin déclinait rapidement les jours suivants. Pour ce qui concerne les dindons, les animaux ont ingéré un aliment supplémenté à hauteur de 111 mg/kg d’aliment pendant 17 semaines et des temps d’attente avant abattage de 0, 1, 2, 3 et 4 jours ont été appliqués. Le monensin a été dosé en utilisant une méthode semi-quantitative de chromatographie en couche mince couplée à la bioautographie offrant une limite de quantification de 0,05 mk/kg de tissu. Les résultats indiquent que les résidus de monensin sont plus faibles chez le dindon que chez le poulet à l’exception du muscle où le monensin reste détectable un jour après la dernière administration.