HAL Id: dumas-01721475
https://dumas.ccsd.cnrs.fr/dumas-01721475
Submitted on 2 Mar 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
cutanée d’un dispositif transdermique à base d’estradiol
Sylvie Lemaire
To cite this version:
Sylvie Lemaire. Les médicaments transdermiques : étude de la toxicité cutanée d’un dispositif trans-dermique à base d’estradiol. Sciences pharmaceutiques. 1989. �dumas-01721475�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteur
ANNEE:
1989
GRENOBLE 1
SCIENCES TECHNOLOGIE MEDECINE
U.IF.R
DE PHARMACIEDomaine de la Merci - 38700 LA TRONCIH1E
'LES MEDICAMENTS TR,ANSDER,MIQUES ETUDE DE LA TOXICITE CUTAN,EE D'UN DISPOSITIF
TRANSDERMIQUE A BASE D'ESTRADIOl
IHESE
présentée
à
l'UNIVERSITE JOSEPH FOUR·IER de GRENOBLE pour obtenir le grade de Docteur en PhaJ~maciepar Sylvie LEMAIRE
Cette thèse sera soutenl!le publ.iquer:nent le 9 Mai 1989 devant la commission d'Examen :
Madame le Professeur A. VERAIN, Président du jury Madame le Professeur H. BERI'EL
ANNEE: 1989
UNIVERSITE JOSEPH FOURIER
GRENOBLE 1
SCIENCES TECHNOLOGIE MEDECINE
U.F.R. DE PHARMACIE
Domaine de la Merci - 38700 LA TRONCHE
No
D'ORDRE:
LES MEDICAMENTS TRANSDERMIQUES
ETUDE DE LA TOXICITE CUTANEE D'UN DISPOSITIF
TRANSDERMIQUE A BASE D'ESTRADIOL
THE SE
lllllllllllllllllllllllllllll
115 005519 2
présentée
à
l'UNIVERSITE JOSEPH FOURIER de GRENOBLE
pour obtenir le grade de Docteur en Pharmacie
par
Sylvie LEMAIRE
Cette thèse sera soutenue publiquement le 9 Mai 1989
devant la commission d'Examen :
Madame le Professeur A. VERAIN, Président du jury
Madame le Professeur H. BE RIEL
ERRATUM
\
p
.
14
:
Les
f
ibrob
las
tes
:ce
l
lu
les
con
jonc
t
ives
responsab
les
.
.
.
.
p
.
39
:
l
igne
5
:
(dûe
à
la
présence
de
5-me
thoxy-psora
lène)
p
.
66
:
l
igne
8
:
peau
de
r.a1
nude
(à
la
p
lace
de
sour
is)
p
.
78
:dern
ière
l
igne
:
e
l
les
u
t
i
l
isen
t
l
'
irrad
ia
t
ion
par
les
UV-A
e
t
les
UV-B
.
A Madame le Professeur A. VERRAIN,
Je la remercie d1avoir bien voulu présider ce jury.
A Madame le Professeur H. SERIEL,
Je désire lui exprimer toute ma reconnaissance pour avoir accepté de juger ce travai1.
3
-Je remercie le centre SANOFI RECHERCHE pour m1avoir donné la possibilité de réaliser cette thèse.
Je tiens à remercier Monsieur J. UNKOVIC, responsable du laboratoire de Pharmacologie Générale ainsi que Mademoiselle
M. COMBES pour l1aide qu1ils m1ont apportée pendant la rédaction de cette thèse.
Je remercie également Madame C. RAC 1 NE qui a eu la gentillesse d1assurer la frappe de ce document.
5 -SOMMAIRE INTRODUCTION • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • 9
A - PARTIE THEORIQUE
...
11 1 - LA PEAU • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • 12 1.1 HISTOLOGIE ••••••••••••••••••••••••••••••••••••••••••• 121.1.1
L
1épiderme
1.1.2
Le derme
1.1.3
L
1hypoderme
1.1.4
Les annexes cutanées
1.1.4.1
Les glandes sudorales
1.1.4.2
L
1appareil pila-sébacé
1.1.5
La vascularisation cutanée
1.1.6
L
1innervation cutanée
1.2 LA PEAU ORGANE DE PROTECTION ••••••••••••••••••••••••• 21
1.2.1
Rôle mécanique de la peau
1.2.2
La peau, barrière microbiologique
1.2.3
La peau, barrière chimique et physique
1.2.4
La peau, barrière aux radiations
1.2.5
Protection calorique : régulation thermique
1.3 LA PENETRATION PERCUTANEE •••••••••••••••••••••••••••• 23
1.3.1
Rôle du stratum corneum
1.3.2
Mécanisme de 1 •absorption percutanée
1.3.3
Les voies de pénétration
1.3.4
Influence de la nature des molécules sur le mode
de pénétration
1.3.4.1
Pénétration via le stratum corneum
1.3.4.2
Pénétration via les annexes cutanées
2 - LES EFFETS SECONDAIRES EVENTUELS DES PRODUITS DESTINES A
A L
1APPLICATION CUTANEE ••••.••••••••••••••••••••.•••••••• 30
2.1
L
1irritation •••••••••••••••••••••••••••••••••••••••••
30
2.2
La sensibilisation cutanée ou allergie de contact ••••
31
2.3
La photosensibilisation : phototoxicité et
photo-allergie ... 38
2.3.1
La phototoxicité
2.3.2
La photoallergie
3- LES MEDICAMENTS TRANSDERMIQUES •••••••••••••••••••••••••••
42
3.1
GENERALITES -DEFINITION •••••••••••••••••••••••••••••
43
3.2
AVANTAGES ET INCONVENIENTS DES SYSTEMES
TRANS-DERMIQUES A LIBERATION CONTROLEE •••••••••••••••••••••
44
3.3
CHOIX DES MOLECULES ••••••••••••••••••••••••••••••••••
47
3.3.1
Impératifs physico-chimiques
3.3.2
Impératifs de tolérance
3.3.3
Impératifs pharmacologiques
3.4
FACTEURS A PRENDRE EN COMPTE LORS DE LA FORMULATION
o•uN SYSTEME TRANSDERMIQUE A LIBERATION CONTROLEE
48
3.4.1
Concentration en substance active
3.4.2
Liaison protéique
3.4.3
pH
3.4.4
Température
3.4.5
Le véhicule
3.4.6
L
1adhésif
3.5
OPTIMISATION DE L
1ABSORPTION PERCUTANEE D
1UNE DROGUE
A PARTIR o•uN DISPOSITIF TRANSDERMIQUE •••••••••••••••
54
3.5.1
Utilisation des adjuvants de pénétration
3.5.1.1
Définition
3.5.1.2
Mécanisme d•action
3.5.1.3
Les adjuvants de pénétration utilisés
3.5.2
Utilisation de prodrogues
3.5.3
Utilisation possible de 1
1iontophorèse
3.6
ETUDES A REALISER POUR LE DEVELOPPEMENT D
1UN SYSTEME
TRANSDERMIQUE A LIBERATION CONTROLEE •••••••••••••••••
62
3.6.1
Etude du développement de la forme pharmaceutique
3.6.1.1
Etude de l
1absorption percutanée
3.6.1.1.1
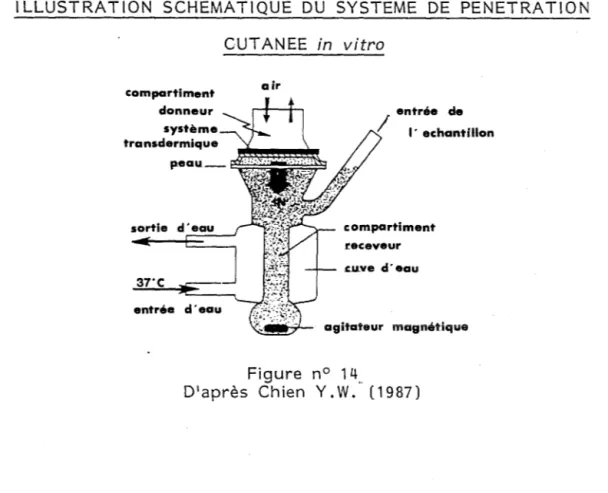
Tests in vitro
3.6.1.1.2
Tests in vivo
3.6.1.2
Etude de la cinétique de libération
3.6.2
Etudes de l
1irritation cutanée et de la
sensibilisation de contact
3.6.2.1
Etude de 1 •irritation cutanée
3.6.2.1.1
Tests in vitro
3.6.2.1.2
Tests in vivo
3.6.2.2
Etude de la sensibilisation de contact
3.6.2.2.1
Tests in vitro
3.5.2.2.2
Tests in vivo
3.6.2.3
Etude de la photosensibilisation
3.6.3
Etudes cliniques des systèmes transdermiques
3.6.3.1
Etude de la bidisponibilité
3.6.3.2
Etude de 1 •efficacité
3.6.3.3
Etude de 1 •irritation cutanée
3.6.3.4
Etude de la sensibilisation cutanée
3.6.3.5
Etude de la photosensibilisation
7
-3.7
LES DIFFERENTS TYPES DE SYSTEMES TRANSDERMIQUES •••••• 83
3.7.1
les systèmes réservoirs membranaires
3.7.1.1
Scopoderm
3.7.1.2
Catapress
3.7.1.3
Nitriderm
3.7.1.4
Estraderm
3.7.2
les systèmes matriciels
3.7.2.1
Nitrodur
3.7.2.2
Deponit
3.7.3
Les systèmes mixtes
3.7.3.1
Nitrodisc
3.7.4
Les systèmes activés par 1
1utilisateur
3.8
MEDICATION PAR VOIE TRANSDERMIQUE :
EXEMPLE DE l
1ESTRADIOL ••••••••••••••••••••••••••••••• 96
3.8.1
Les estrogènes synthétiques et les estrogènes
conjugués administrés par voie orale
3.8.1.1
Toxicité hépatique
3.8.1.2
Toxicité métabolique
3.8.1.3
Toxicité vasculaire
3.8.2
Les autres voies d
1administration des estrogènes
3.8.3
L
1administration transdermique des estrogènes
3.8.3.1
Absorption percutanée de 1 •estradiol
3.8.3.2
Cas du gel hydralcoolique
à1 •estradiol
3.8.3.3
Les dispositifs transdermiques d
1estradiol
B - PARTIE PRATIQUE
CONTRIBUTION A L'ETUDE TOXICOLOGIQUE D'UN SYSTEME
TRANSDERMIQUE •••••••••••••••••••••••••••••••••••••••••••• 106
1 - RECHERCHE DE LA TOLERANCE LOCALE ET DE LA
SENSIBILISATION CUTANEE •••••••••••••••••••••••••••••••••• 107
1.1 PRINCIPE •••••••••••••••••••••••••••••••••••••••••••• 107
1.2 METHODE •••••••••••••••••••••••••••••••••••••••••••••• 108
1.2.1 Les animaux utilisés
1.2.2 Première période :
tolérance locale et induction de la sensibilité
1.2.2.1 Traitement
1.2.2.2 Observations
1.2.3 Deuxième période :
Recherche de la sensibilisation
1.3 RESULTATS •••••••••••••••••••••••••••••••••••••••••••• 112
1.3.1 Tolérance locale
1.3.2 Sensibilisation cutanée
2 - RECHERCHE DE LA PHOTOSENSIBILISATION
...
116 2.1 PRINCIPE ••••••••••••••••••••••••••••••••••••••••••••• 1162.2
METHODE •••••••••••••••••••••••••••••••••••••••••••••• 1162.2.1 Le simulateur solaire
2.2.2 Les animaux utilisés
2.2.3 Première période :
Recherche de la phototoxicité et induction de la
photoallergie
2.2.3.1 Traitement et irradiation
2.2.3.2 Observations
2.2.4 Deuxième période :
Recherche de la photoallergie
2.3 RESULTATS •••••••••••••••••••••••••••••••••••••••••••• 125
2.3.1 Phototoxicité
2.3.2 Photoallergie
CONCLUSION ••••••••••••••••••••••••••••••••••••••••• · •••••••••• 127BIBLIOGRAPHIE •••••••••••••••••••••••••••••••••••••••••••••••• 129
9
Les dispositifs transdermiquesàlibération contrôlée ont été introduits récemment sur le marché pharmaceutique (en1981)et sont depuis en pleine expansion.
En effet, la voie transdermique offre de nombreux avantages par rapport aux autres voies d1administration plus courantes (voies
orale, intraveineuse.•.).
Elle permet en particulier de diminuer les quantités de substance active à administrer et, de ce fait, de diminuer le nombre ou
Il intensité des effets secondaires pouvant être observés.
Dans le cas de 11estradiol utilisé dans le traitement des symptômes
associésàla ménopause, le but était de réaliser un système transdermique qui libère la substance active à une vitesse
constante dans la circulation générale, sans provoquer ~a a i i
des effets secondaires observés lors de son administration orale. L1efficacité de l1estradiol administré par voie transcutanée, ayant
été depuis longtemps démontrée (Oestrogel, mis sur le marché en
1975)il nous a été proposé d1étudier la tolérance, la sensibilisa
-tion et la photosensibilisation de formulation de dispositifs trans -dermiques : études obligatoires pour toute substance destinéeà
être appliquée sur la peau.
Afin de mieux appréhender les problèmes liés aux dispositifs transdermiques, nous étudierons dans une première partie,à
travers les données de la littérature, successivement -L1histologie et les fonctions de la peau.
-La pénétration percutanée.
-Les mécanismes de la tolérance, de la sensibilisation et de la photosensibilisation.
-Les médicaments transdermiques.
Dans une deuxième partie, nous ferons part de notre expérimentation réalisée sur le cobaye.
11
13
-1 - LA PEAU
=========
1 .1 HISTOLOGIE
Le tissu cutané est constitué de trois couches superposées qui sont de la plus externe à la plus interne, l'épiderme, le derme et
l'hypoderme (figure n° 1).
A la peau proprement dite sont annexés divers éléments : les poils et les glandes sébacées, les ongles, les glandes sudoripares
(Wallach et coll., 1973).
1 . 1 . 1 L'épiderme
C'est un épithélium Malpighien, pavimenteux, stratifié, kératinisé, séparé du derme par une membrane basale.
Il possède trois populations cellulaires : les cellules épider-miques ou kératinocytes qui sont les plus nombreuses et dont la fonction principale est la kératinisation, les mélanocytes
responsables de la synthèse de la mélanine et les cellules de Langerhans impliquées dans les réponses immunitaires au niveau cutané.
L'épiderme peut être divisé en quatre zones qui sont de la profondeur à la superficie :
- La couche basale ou
stratum germinativum,
constituée d'une seule rangée de kératinocytes cuboïdes, siège de nombreuses mitoses où débute la croissance des cellules épidermiques.Dans cette rangée entre les kératinocytes se trouvent intercalés les mélanocytes.
- Le corps muqueux de Malpighi ou
stratum spinosum
formé de quatre à huit rangées de kératinocytes polygonaux-La couche granuleuse ou
stratum
granu
losum
constituée de une à quatre couches de kératinocytes aplatis, à forte activité enzymatique et qui produisent la kératine.La couche cornée ou
stratum
cornéum
formée de nombreuses couches (10à15) de cellules complètement kératinisées,anuclées et aplaties, en contact étroit les unes avec les autres et reliées entre elles par de nombreux desmosomes.
Entre ces cellules se trouve une matrice amorphe contenant des restes d'organites cellulaires (Ritschel et coll., 1988).
1. 1. 2 Le derme
C'est un tissu conjonctif où aboutissent les réseaux vasculaires et nerveux et où se développent les annexes cutanées.
Il est constitué :
-D'une charpente fibreuse conjonctive formée principalement de fibres collagènes, de fibres élastiques et de fibres de
réticuline baignant dans une substance fondamentale (gel muco-polysaccharidique).
-De différents types de cellules :
les fibroblastes : cellules conjoncires
e ~ a e
de la syn -thèse des fibres collagènes et de la substance fondamentale les histiocyte'§ cellules apparentées aux macrophages ; les mastocytes cellules contenant des enzymes protéo -lytiques, de l'histamine et de l'héparine.1 .1.3 L'hypoderme
C'est un tissu adipeux d'épaisseur très variable selon la local i-satation, sur lequel repose le derme et qui se moule sur les plans musculo-squelettiques.
Son principal rôle est d'isoler l'intérieur de l'organisme (aux niveaux thermique et mécanique) de l'environnement externe.
--
.
~.
(]
r
.
~
... J
.,
~
---...
u
-
-
·
t
- _:7<
tO -15-DE LA PEAU
STRUCTURE
\..-
---
\
~
<
:
:
:
:)
-~-
.
.
.-
·-9a
6 7 de d'une a~l•cana·sudolr eipar eccr1ne corneuil
2
:
s
.
•e
i ~
4:s.gri osua
S
6:s
:s.sp
.ger•ninativu•7
:der
l
le
tifS•conjonc
ca i a~ e
g
lande
lo•canal eccrine
;udoripare
F. re no 1
~
973D et coll.,1
1 . 1 . 4 Les annexes cutanées
1 .1.4.1 Les glandes sudorales (figure n° 2 )
Il existe deux types de glandes (Wa lia ch et coll. , 1973).
- LES GLANDES ECCRI NES
Ce sont les plus nombreuses, elles sont réparties sur tout le tégument et notamment au niveau des paumes et des plantes de pieds.
La partie secrétrice (segment sudoripare) est située dans
l'hypoderme ou le derme profond tandis que la partie excrétrice (segment sudorifère) traverse le derme et l'épiderme.
Ces glandes sont indépendantes des follicules pileux. Elles
secrètent un liquide : la sueur qui est une solution hypotonique diluée dont les principaux constituants sont :
. Na, Cl, K, urée, lactate.
Elle a un pH compris entre 4,0 et 6,8.
La production de sueur varie de 1 à 12 1/24 h en fonction de la température extérieure et de l'effort effectué.
- LES GLANDES APOCRINES
Elles sont localisées uniquement dans certaines régions du corps . les régions à pilosité sexuelle.
La partie secrétrice est située dans le derme profond voire
l'hypoderme, la partie excrétrice se jette le plus souvent dans le follicule pila-sébacé au-dessus de l'abouchement de la glande sébacée.
Ces glandes secrètent une petite quantité d'un liquide laiteux ou huileux qui peut être coloré et qui renferme des lipides, des pro-téines, des lipoprotéines et des saccharides.
Les bactéries se trouvant à la surface de la peau vont rapidement métaboliser ce liquide sans odeur pour produire une odeur
caractéristique de chaque individu.
17
-LES GLANDES SUDORIPARES ECCRINES ET APOCRINES
Glande sêbacêe
Glande eccrine
til ande a po cri ne
· -
Poil
Figure n° 2
1.1.4.2 L1appareil pilo-sébacé
Il comprend d1une part le follicule pileux : le poil et ses gaines et
d1autre part, les glandes sébacées et le muscle arrecteur du poil qui sont annexés au follicule pileux (figure n° 3).
- LES POILS
Ils naissent à 11intérieur du follicule pilo-sébacé qui est une
invagination épidermique atteignant le derme profond. Le poil peut être divisé en deux parties distinctes :
La partie inférieure ou racine du poi 1, située au-dessous de l'abouchement du canal sébacé ;
La partie supérieure ou tige du poil qui sort du follicule par
l'ostium folliculaire.
- LES GLANDES SEBACEES
ces glandes existent sur tout le corps à 11exception des paumes,
des plantes et des faces latérales des doigts.
Ce sont des glandes acineuses, holocrines qui secrètent le sébum. Elles s1abouchent au follicule pileux par le canal sébacé à
l'intérieur duquel les lipides progressent et vont à la surface cutanée pour former avec l1eau provenant de la sueur, un mince film protecteur.
- LE MUSCLE ARRECTEUR DU POl L
C1est un faisceau de fibres musculaires lisses dont la contraction redresse le poil provoquant l'horripilation ou 11chair de poule11 •
-19
-ANATOMIE DU FOLLICULE PILO-SEBACE
Polil ooino
...
Follicule i e ~~--
,
...
.:...,...
• - COUCftOdeHeftlé - ••- -C:OoiC... ...Hu ..., .. • - -C:llhe:ulo delo 90"Ie ..,_ .•-· -c:utoc;.,.. dupool 1-Figure n° 3 D1aprèsBARBIERetcoll., 19781 .1.5 La vascularisation cutanée
Il existe un important réseau vasculaire au niveau du derme qui joue un rôle important dans la thermorégulation mais aussi dans
11apport des nutriments et l'élimination des déchets au niveau
cutané et contribue à donner sa couleur à la peau.
Le réseau artériel transmet le sang aux follicules pileux, aux glandes sudoripares, à la graisse sous-cutanée et au derme lui-même. L1épiderme lui-même n•est pas directement irrigué (Wallach
et co Il. , 1 9 7 3 ) .
1 .1 .6 L1innervation cutanée
Les différents troncs nerveux proviennent de 11hypoderme et se
subdivisent en formant des plexus dans toute l'épaisseur du derme.
Il existe deux types d1innervations
L1innervation autonome qui assure 11innervation des vaisseaux,
des muscles arrecteurs, des poils et des glandes sudoripares.
L1i nnervation cérébro-spinale qui est responsable de la fonction
21
1.2 LA PEAU ORGANE DE PROTECTION (Barry 1983, Hewitt -1976)
1. 2.1 Rôle mécanique de la peau
Les propriétés mécaniques de la peau, responsables du maintien en place des tissus et qui restreignent les mouvements sont essentiellement dûes au derme mais également à l'épiderme. En effet, la peau est élastique, elle peut accroître jusqu'à 1,5 fois ses dimensions initiales, de façon réversible, grâce au réseau de fi bres élastiques contenu dans le derme qui conserve le
tonus de la peau.
Les fibres collagènes quant à elles, confèrent à la peau sa force de tension : elles interviennent à la traction du fragment de peau jusqu'à la déchirure et dans l'extensibilité de la peau par
glissement des fibres les unes sur les autres.
D'autre part, la résistance à la rupture de l'épiderme est dûe à la nature du
stratum corneum :
sa souplesse dépend de l'existence d'un équilibre entre les lipides, les substances hydrosolubles, hygroscopiques et surtout l'eau. En effet, lestratum corneum
a besoin de 10 à 20 % d'humidité pour maintenir sa souplesse sinon il devient fragile et ne peut plus alors jouer son rôle de pro-tection.1. 2. 2 La peau, barrière microbiologique
Le
stratum corneum
constitue un rempart contre les microorga-nismes. En effet, le turnover que l'on observe à son niveau per-met une élimination constante de squames sur lesquelles adhèrent les microorganismes pathogènes ou non, ceci favorisant la fonc-tion protectrice. En même temps, les glandes cutanées secrète nt des acides gras à chaine courte qui sont bactériostatiques et fongistatiques.1. 2. 3 La peau, barrière chimique et physique
La peau humaine joue un rôle de barrière dans deux directions : Elle contrôle la perte d1eau, d1électrolytes et d1autres substances
endogènes, et elle empêche la pénétration de molécules nuisibles ou indésirables depuis 11environnement extérieur. Ce rôle de
barrière est principalement tenu par le
stratum corneum
(cf 1.3.1). De plus, elle exerce un rôle de tampon et présente
une résistance chimique importante dûe aux propriétés de la kéra-tine.
1 . 2. 4 La peau, barrière aux radiations
Parmi les rayons du spectre solaire que l'atmosphère ne filtre pas certains peuvent abimer les tissus biologiques. Ce sont les ultra-violets de longueurs d1onde comprises entre 290 et 400 nm. L1
irradiation de la peau par ces U.V. et notamment les UVB -290/320 nm peuvent provoquer diverses réactions qui sont notamment l'érythème, l1épaississement de 11épiderme et la
pigmentation qui joue elle-même un rôle de protection. Les U.V. stimulent les mélanocytes qui vont produire de la mélanine et la transférer dans les kératinocytes. Cette mélanine protègera ainsi la peau contre les irradiations futures.
1. 2. 5 Protection calorique - Régulation thermique
La peau constitue plus une zone d1échange avec le milieu
extérieur de température très variable qu1une barrière calorique,
mais elle permet de maintenir le corps à une température à peu près constante : 37°C.
Lorsque 11homme a besoin de conserver sa chaleur, les
thermo-récepteurs cutanés, sur information de Il hypothalamus,
provoquent une vaso-constriction artériolaire réflexe, maximale aux extrémités des membres, au nez et aux orei lies, qui empêche
le sang artériel d1aller se refroidir à la surface.
La protection contre 11élevation thermique se fait par une
vaso-dilatation active qui amène le sang chaud près de la surface cutanée et accentue le mécanisme de refroidissement et, par la sudation induite par les glandes sudorales eccrines.
23
-1.3 LA PENETRATION PERCUTANEE
1. 3.1 Rôle du
stratum corneum
La peau a longtemps eté considérée comme totalement imperméable à l'égard de toutes les substances.
Ce n1est qu•au début du XXe siècle que l'on s•est aperçu qu1elle
présentait une perméablité sélective : elle est très perméable aux substances liposolubles mais ne 11est que très peu à l'eau et aux
electrolytes (Scheuplein, 1980).
En fait la peau ne permet à aucune substance de pénétrer racilement mais permet à toute substance de pénétrer même de taçon infinitésimale.
L'effet de barrière exercé par la peau est essentiellement dû à l'épiderme et plus particulièrement au
stratum corneum
(Michaels et coll., 1975).On admet donc que 90 % de l1effet barrière de la peau est dû au
stratum corneum :
ceci est d1ailleurs prouvé par les expériencesde stripping du
stratum corneum
(La fille et coll., 1979). Lestratum corneum
est une structure hétérogène constituée d1environ 40 % de protéines (principalement de la kératine), de40 % d1eau et de 15 à 20 % de lipides (triglycérides, acides gras
libres, cholestérol, phospholipides).
Il est formé de plusieurs couches de cellules très serrées, aplaties, imbriquées les unes dans les autres, séparées par une phase intercellulaire qui maintient le tout en une masse cohérente. Les protéines se retrouvent dans les phases i nt race liu lai re et intercellulaire tandis que les lipides sont largement concentrés dans la phase extracellulaire et forment la membrane entourant les cellules.
Ce sont les composants lipidiques du
stratum corneum
qui sont directement responsables de sa très faible perméabilité.1. 3. 2 Mécanisme de 11absorption percutanée
Pour une substance donnée 1 11absorption par voie percutanée
correspond à un enchainement de cinq mécanismes de transport qui se font de façon successive :
- Adsorption de la substance à la surface du
stratum corneum.
Diffusion à travers lestratum corneum.
- Passage dans les assises vivantes de l1épiderme.
- Diffusion à travers 11épiderme et le derme jusqu1aux
capillaires.
Transfert dans la circulation sanguine générale.
Les couches superficielles du derme sont tellement riches en
capillaires qu1il est fort probable que les molécules pénètrent dans
la microcirculation juste après avoir quitté l'épiderme :
les zones plus profondes du derme ne jouant aucun rôle dans le processus d1absorption (Barry - 1983
1 Scheuplein - 1980).
Pour pénétrer dans la circulation sanguine une substance devra donc traverser trois zones successives : le
stratum corneum
1 lesassises vivantes de l'épiderme et les couches supérieures du derme : toutes trois formant une membrane composite.
Chacune de ces trois zones possède une constante de diffusion différente mais celle du
stratum corneum
étant de loin la plus faible (de l'ordre de D = 10-10 cm2Js contre D = 10-6 cm2fs pour les deux autres), ce sera la seule à être prise en compte(Scheuplein1 1980).
Lorsqu1une molécule se trouve en contact avec la surface de
11épidermel elle va subir un transport de type passif et le flux
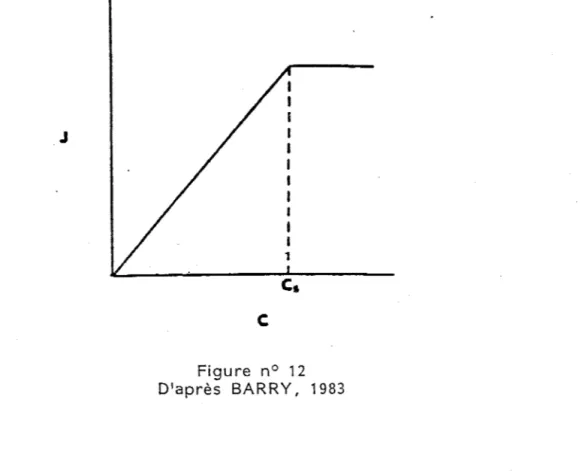
transdermique de cette molécule J sera déterminé par une dérivée de la loi de Fick :
-25
-Le flux transdermique est proportionnel à (Barry, 1983) :
- D : coefficient de diffusion qui dépend de la taille des molécules et de la viscosité du milieu àtraverser.
- K : coefficient de partage peau/véhicule dans lequel se trouve la substance.
-
c
v: concentration de la substance dans le véhicule(Jest proportionnel à C jusqu1à la limite de saturation)
qui correspond à ac i i~ thermodynamique maximum.
et inversement proportionnelà :
- h : épaisseur de la membrane à traverser.
La pénétration percutanée est influencée par d1autres facteurs tels
que :
Les facteurs biologiques : Jlâge,11état et la région de la peau,
la circulation sanguine, l1espèce.
-Les facteurs physico-chimiques active et véhicule.
1. 3. 3 Les voies de pénétration
interactions peau-substance
Lorsqu1une substance est appliquée sur la peau, elle rencontre
d1abord le sébum, les débris cellulaires, les bactéries ainsi que
d1autres substances exogènes qui recouvrent la peau.
Cette substance possède alors trois voies potentielles de pénétration dans les tissus sous-épidermiques (figu re n° 4)
- A travers11appareil pila-sébacé.
-Par Jlintermédiaire des glandes sudorales.
(Ces deux structures occupent une surface de peau très petite de 0,1à1%selon les auteurs).
etàtravers le
s
tra
tum
corneum
qui correspondàla voie majeure de pénétration.Le passage par11une ou l1autre de ces voies se fera en fonction
Il existe trois voies potentielles de pénétration d'une substance diffusant dans les tissus sous-épidermiques cutanés : (1) via les glandes sudorales, (2) àtravers le
stratum
corneum
,
·ou (3) à travers l'appareil pila-sébacé.pore sudoral
sous-épidermique
VOIES DE PENETRATION
m
épidermevivant canal sudoral-1--WI
eccrlne -H-...-glande sébacée glande sudorale ~ eccrine plexus vascul::iro #BŒlitt---4-follicule pileux
:
:
;
-
-
-
-
-+
-
papille J ~ a dermique ---+-derme Figure n° 4 D'après Barry (1983)-27
-1. 3. 41nfluence de la nature des molécules sur le mode de
pénétration
1. 3. 4.1 Pénétration via le
s
tra
tum
corneum
On a vu que le
s
tra
tum
corneum
possédait une structure mixte protéique et lipidique dont la représentation schématique et idéale est la suivante (figure n° 5) :MODELE IDEAL DE STRATUM CORNEUM
l
l
I
l
lL
j
{
J[
:=J
I
I
l
I
l
l
i
1[
JI
Il
Il
Il
~
_
=::J\
J~ c
~
[
phase lipidique interstielle Figure n° 5phase protéique
Les ce-llules correspondent à la phase protéique discontinue. La substance interstitielle correspond à la phase lipidique continue
(Michaels et coll., 1975).
Il existe donc à priori deux passages possibles pour les molécules (figure n° 6)
- Un passage intercellulaire uniquement dans la phase lipidique (1-10 %).
- Un passage transcellulaire où les molécules traversent sans discrimination les zones intercellulaires, les membranes cellulaires puis les cellules (90-99 %) •
Voies possibles de pénétration des drogues à travers le
stratum
corneum
humain : domaines macroscopique et moléculaire.voie intercellulaire
lipides eau cholesterol
Figure n° 6
D1après Barry B.W. (1987)
voie transcellulaire
kératine lipides
29
-Les molécules diffuseront en fait de façon différente en fonction de leur hydrosolubilité et de leur coefficient de partage lipide/ protéine ou huile/ eau.
Pour le passage intercellulaire la barrière lipidique constitue la principale barrière à la pénétration des substances très polaires. Pour le passage transcellulaire, la kératine intracellulaire
constitue la principale zone de résistance à la diffusion membranaire, puisqu1elle présente une structure matricielle
filamenteuse formant une mosaïque de régions polaires et apolaires.
Les molécules vont se partager dans 11une ou l1autre des régions
en fonction de leur polarité et y diffuseront après s1y être
dissoutes.
- Les molécules polaires diffusent dans les régions aqueuses situées près de la surface des filaments protéiques.
- Les moléculaires apolaires suffisamment liposolubles vont se dissoudre à l'intérieur de la substance lipidique entre les filaments.
De ce fait, les substances trop insolubles dans l'eau et/ou qui ont une très faible liposolubilité auront un faible taux de perméation cutanée tandis que les substances qui ont un coefficient de partage lipide/protéine équilibrée auront un taux de perméation relativement élevé (Michaels et coll., 1975).
1. 3. 4. 2 Pénétration via les annexes cutanées
On s1est aperçu que la diffusion des molécules à travers les
annexes cutanées n1était pas négligeable pendant la phase initiale
du processus de diffusion (pendant la première heure suivant 11application) mais que cette voie de passage s1effaçait en faveur
du
strotum corneum
dès que la pénétration des molécules se faisait à flux constant (Barry, 1983 - Wahl berg, 1973).Par contre, pour certaines molécules telles que les ions et les grosses moléculaires polaires, il semblerait que les annexes cutanées fournissent la principale voie d1entrée vers les couches
sous-épidermiques, ceci en dépit de la faible surface cutanée qu 1elles occupent.
En effet, de telles molécules pénètrent si lentement à travers la kératine que la faible quantité qui passe à travers les annexes constituerait la totalité du flux de diffusion du produit.
2 - LES EFFETS SECONDAI RES EVENTUELS DES PRODUITS
========================================================
DESTINES A L'APPLICATION CUTANEE
=======================================
Lorsqu'une substance est mise au contact de la peau, les incidents les plus fréquemment rencontrés sont : l'irritation, l'allergie de contact, la phototoxicité et la photoallergie (Lachapelle, 1981).
Plus rarement, on note l'apparition d'un urticaire de contact, d'acnéigénèse, d'effet dyschromiant et de carcinogénèse.
De ce fait, des études sont systématiquement réalisées pour une nouvelle molécule ou pour une formulation nouvelle d'une molécule déjà connue.
Ce sont :
- La tolérance cutanée : irritation.
- La sensibilisation cutanée : allergie de contact.
- La photosensibilisation : phototoxicité et photoallergie.
2.1 L'l RRITATION
Il s'agit d'une atteinte à l'intégrité du tégument par un produit chimique qui se traduit par des lésions plus ou moins importantes de l'épiderme et par l'apparition d'une réaction inflammatoire dans
le derme sous-jacent.
Les substances présentant une action irritante vont porter
atteinte à l'intégrité morphologique et/ou fonctionnelle des cellules épidermiques : on parle alors de cytototoxicité qui se
caractérisera soit par l'apparition d'un érythème soit par l'apparition d'un oedème soit des deux simultanément, ceci en fonction :
du pouvoir irritant des substances. - de la concentration du produit irritant.
- de la durée et du mode d'application du produit irritant. - de la résistance du tégument à l'agression d'un irritant.
31
-Histologiquement, l1irritation aiguë peut se traduire au niveau des
kératinocytes de deux façons ( Parish, 1986)
- Par une nécrose de coagulation,
- ou par une dégénérescence hydropique.
Le tissu nécrotique est alors considéré comme un corps étranger qui devra être rejeté. Ceci se fera par Jlintermédiaire des cellules dégénérées qui vont libérer des enzymes, des constituants
cytoplasmiques mais surtout des médiateurs de 11inflammation qui
vont attirer les leucocytes : des neutrophiles et en plus faible quantité des macrophages. Ces polynucléaires neutrophiles vont à leur tour libérer des enzymes lysosomiales qui seront chargées de dégrader le tissu endommagé et de le séparer du tissu vivant. Les cellules basales pourront alors proliférer et migr_er pour remplacer JI épiderme endommagé.
2.2 LA SENSIBILISATION CUTANEE OU ALLERGIE DE CONTACT ( Achten, 1979 - Benezra et coll. , 1983
-Lachapelle, 1981 - Parish, 1986).
Ce type d1allergie est déclenché par le contact répété de
susbstances non irritantes lors de la première application. Il s1agit d1un mécanisme d1hypersensibilité de type cellulaire ou
retardée ou encore de type 1 V (selon la classification de Ge li et Coombs) qui met en jeu les lymphocytes T (cellules
immuno-compétentes) et les· macrophages.
L1apparition d1une dermite de contact allergique se déroule en
trois phases
- PREMIERE PHASE : PHASE D11NDUCTION (figure N° 7)
La substance étrangère sensibilisante appelée haptène ou antigène incomplet (molécule de faible poids moléculaire) entre en contact avec le tégument.
Elle pénètre à travers la couche cornée et rejoint les assises vivantes de 11épiderme où elle va se fixer à une protéine
Cet antigène est pris en charge par une cellule de Langerhans ou un macrophage, encore appelés 11cellule présentatrice de
l'antigène11 •
L'antigène pénètre alors dans cette cellule où il subit une
transformation puis est transféré à la membrane cellulaire, où il se liera à un complexe majeur d'histocompatibilité. Cette liaison permet l'expression de l'antigène de surface la : antigène de classe Il qui lorsqu'il est associé à l'antigène transformé, confère
le caractère de spécificité immunologique.
L'antigène transformé et l'antigène 1 a, tous deux présents sur les
cellules de Langerhans, seront reconnus par les lymphocytes T qui devriendront activés (ces lymphocytes possèdent des
récepteurs spécifiques aux antigènes de classe Il).
En même temps, la présence de la substance étrangère dans l'organisme favorise la libération d'un produit cellulaire l'interleukine-1 ou 1 L-1, par stimulation des cellules de
Langerhans, des macrophages et des kératinocytes.
L11 L-1, fabriquée en petite quantité est très active et est encore
appelée le LAF ou facteur d'activation des lymphocytes.
Le contact établi par la fixation de l'antigène la des cellules de Langerhans sur les récepteurs des lymphocytes T, confère à ces lymphocytes la spécificité antigénique et favorise ainsi l'expression des récepteurs à 111 L-1 sur ces mêmes lymphocytes.
-33
--Actr 1 : ~ Ji th l'haptrne diJns l'épithrrrw ttformlllion dt a ~ Transftrt th l'al/ergiM l'trfk g111tg/imr lymplulliqutck ai~~~~ (Décor :la peau et les voies lymphatiques afférentes.)
Figure n° 7
~
8!1'
lyrnptQcvtes T l'lforTMs
au rweaucil a i ~ centra6el
elparloosdelaaurweaudela peau (sen5ib*>ahonpenphertOUe1
- DEUXIEME PHASE : PHASE DE PROLIFERATION DES CELLULES DU SYSTEME IMMUNITAIRE (figure n° 8)
Les lymphocytes T activés subissent une transformation
lymphoblastique et prolifèrent dans les ganglions lymphatiques les plus proches du lieu d1application.
Cette prolifération est la résultante d1un enchaînement
d1évènements :
- L11 L-1 libéré au cours de la phase d1induction se lie aux récepteurs des lymphocytes T nouvellement formés.
- L1association 1 L-1 récepteur stimule à son tour les
lympho-cytes T qui vont alors synthétiser puis libérer Jll L-2 qui induit la prolifération du clone de lymphocytes T spécifiques de
l'antigène.
L11 L-2 est également appelée le TCGF ou facteur de croissance des lymphocytes T.
On observe donc une augmentation du nombre des lymphocytes T-mémoire qui acquièrent des récepteurs de membrane spécifiques de
11allergène et des lymphocytes T-effecteurs qui seront respon-sables des réactions inflammatoires qui apparaîtront lors de la réintroduction de l'allergène.
- 35
--Acte 2: diw!lopJ1D'fDIJt/6IJJ réo,·titm immulliluirt'. 10Ccor :e ~ ~a
glionslymphlltiquea.)
LYMPHOCYTE T
~
Figure n° 8
- TROISIEME PHASE PHASE DE REVELATION (figure n° 9)
Lorsque l'haptène se trouve à nouveau au contact de la peau 1 il
pénètre de façon identique jusqu'au derme (après avoir été
transformé en allergène) mais rencontre cette fois des lymphocytes T-sensibilisés au niveau dermique ou au niveau ganglionnaire. Les lymphocytes T-sensibilisés deviennent activés au contact de l'allergène et libèrent un facteur lymphocytaire mitogène qui provoque une importante transformation lymphoblastique des lym-phocytes T -non sensibilisés 1 ce qui a pour but d'augmenter la
population cellulaire capable de répondre localement à l'agression externe. Ces lymphocytes stimulés synthétisent plusieurs
substances : des produits d'activation des lymphocytes : PAL ou lymphokines.
Ces lympholines vont réguler la réponse immunitaire. Leurs activités se retrouvent sous différents facteurs :
Un facteur chimiotactique qui attire davantage de cellules T sur les lieux de la réaction.
- Un facteur d'inhibition de la migration des macrophages (MlF) qui maintient les cellules présentatrices sur place.
- Un facteur qui augmente la perméabilité vasculaire permettant la sortie des cellules macrophagiques et des lymphocytes hors des vaisseaux.
- Un facteur cytotoxique responsable de l'élimination des cellules susceptibles de porter l'allergène.
Le résultat de la deuxième rencontre allergène-lymphocyte T correspond à une inflammation.
La peau présentera un eczéma de gravité variable allant d'un simple rougissement de la peau (érythème) à l'exsudation de fluides dans le gonflement de l'oedème local, voire formation de vésicules ou de bulles
-37
-- c ~ 3:a~c ~ cheme a~ 1ec ~ma ae contacta ~ e par 11.1" nOIII'f!lltappllcanon $UTlapHildtlam ~ a e mi ~ (Décor : la peau.)
Figure n° 9
2.3 PHOTOSENSIBILISATION : PHOTOTOXICITE ET PHOTOALLERG 1 E ( Harber et coll., 1985)
Toutes les réactions photobiologiques cutanées sont dues à l1absorption d1énergie lumineuse par un produit chimique
(chromophore) qui se trouve au niveau cutané : produit exogène qui a été appliqué localement sur la peau.
Les photons lumineux issus de la lumière solaire ou d1une source
lumineuse artificielle vont provoquer le passage du produit chimique de l1état fondamental à l1état excité par absorption
d1énergie qui sera ensuite réémise sous forme de chaleur, de
vibration, de fluorescence ou qui provoquera la formation de radicaux libres ou une altération photochimique (le plus souvent une oxydation).
Toutes ces modifications vont provoquer dans le vo1s1nage du chomophore des altérations de la membrane cellulaire mais également des organites cytoplasmiques ou du noyau.
Ces processus photochimiques pourront être associés chez 11homme à des réactions biologiques observables qui dérivent soit d1un
mécanisme phototoxique soit d1un mécanisme photoimmunologique.
2.3.1 La phototoxicité (Harber et coll., 1985 - Marzulli et coll., 1985)
Lorsqu1un produit chimique photoactif est appliqué sur la peau en
quantité suffisante, il provoquera une réaction de type irritation primaire s1il reçoit une énergie lumineuse adéquate de longueur
d1onde appropriée (longueur d1onde qui correspond à celle d1une
bande d1absorption du spectre du produit photosensibilisant).
Cette forme d1i rritation activée par la lumière apparaîtra chez
toute personne qui sera en contact avec le produit photoactif et pourra survenir dès la première exposition car elle ne nécessite pas de période de latence.
Du point de vue clinique, la réaction phototoxique se caractérise par un érythème suivi quelques minutes à plusieurs heures après
11exposition d1un oedème (cette réaction est comparée à un coup
de solei 1 exagéré).
Il apparaît ensuite une hyperpigmentation et une desquamation qui seront 1 imitées aux zones exposées.
-39
-Histologiquement, l'épiderme est sévèrement endommagé et le derme présente un oedème avec une infiltration peu importante de polynucléaires (leucocytes).
L'exemple le plus typique est
bergamote (dûe à la présencelade .fthototoxa ice ~ ité de l'essence de
r5 ..,
Vn.-e--tR..,.L,(~
\/l
>vJ't..J<.tM.t. 2.3.2 La photoallergie (Epstein, 1972)Les réactions photoallergiques sont des réponses immunologiques de type retardées qui se différencient des dermites de contact
11ordinaires11 car elles ont besoin de lumière pour se déclencher.
Le produit photosensibilisant va être modifié par l'énergie
lumineuse qu'il absorbe : il se comporte alors comme un haptène, se lieàune protéine porteuse et forme un photoantigène complet qui va stimuler la réponse d'hypersensibilité.
Les réactions photoallergiques s'observent avec des produits de structure chimique différente mais ce sont généralement des
produits de faible poids moléculaire : des haptènes qui absorbent les photons dans la zone des UVA (320-400 nm).
Du point de vue clinique, la dermite de contact photoallergique se présente sous la forme d'une réaction eczémateuse, avec érythème oedémateux, vésiculeux, parfois bulleux.
Elle peut également prendre l'aspect d'un prurigo sous forme de papules érythémateuses, d'un lichenàpapules rouge-violacées ou d'un lupus érythémateux.
Les sites les plus touchés sont le visage, le cou, les bras et la face dorsale des mains.
Histologiquement, les lésions eczémateuses sont accompagnées d1un
oedème péricellulaire épidermique avec acanthose et d'une importante infiltration cellulaire dans le derme.
Parmi les produits allergisants on trouve des écrans solaires, les sulfonamides, les sulfonylcarbamides et les phénothiazines.
La figure n° 10 et le tableau n° 1 récapitulent les différences existant entre photoallergie et phototoxicité.
MECANISME DE LA PHOTOSENSI BI LISATION PH 0 T 0 AL LE R G 1 E - PH 0 T 0 T 0 X 1 C 1 TE PHOTOSENSIBILISANT + LUMIERE ~ ABSORPTION D'ENERGIE
+
EXCITATION~~
Réaction phototoxique"
Etat excité singulet
•
Etat excité triplet
+
Transfert d'énergie, dissipation de chaleur, fluorescence et/ou phosphorescencet
Formation de radicaux et/ou de peroxydes, oxydation, formation de liaisons covalentes, rupture+
Altération de la membrane cellulaire du cytoplasme et du noyau. Réaction photoallergique+
Formation de racicaux libres et/ou oxydation
•
Formation d'un haptène
...
Conjugaison haptène-protéine
+
Prise en charge par les cellules de Langerhans
+
Sensibilisation par l'intermé-diaire des cellules immuno-compétentes ~ 1 nteraction photoantigène, cellule immunocompétente ALTERATION CELLULAIRE
.---
~
COUP DE SOLEIL ECZEMA
Figure n° 10
41
-Tableau n° 1
TABLEAU COMPARATIF PHOTOTOX 1 Cl TE/ PHOTOALLERG 1 E
- Incidence
- Manifestations cliniques Possibilité de réaction à la
première exposition - Période d'incubation
après la première exposition - Développement d'une réaction
persistante à la lumière
- Possibilité d'extension en dehors des zones exposées
Réactions cro1sees avec les produits de structures voisines - Elargissement des réactions
croisées après plusieurs photo patch-tests
-Concentration du produit nécessaire pour obtenir la réaction
- Altération chimique du photo-sensibilisant
- Liaison covalente avec une protéine porteuse
REACTIONS
PHOTOTOXICITE PHOTOALLERGIE Généralement très Variable
élevée (100 %)
Ressemble à un coup Morphologie variable de soleil oui non non oui non oui non oui non fréquent non possible élevée faible parfois oui non oui
L E S
MEDICAMENTS TRANSDERMIQUES43
-3 - LES MEDICAMENTS TRANSDERMIQUES
======================================
3.1 GENERALITES- DEFINITION
La peau a toujours été utilisée comme voie d'administration de substances mais on recherchait tout d'abord une action locale telle qu'une action thérapeutique à visée dermatologique, rhumatologique ou traumatologique ou une action à visée cosmétique.
On l'a ensuite utilisée comme voie d'administration de traitements à visée systémique. On s'est alors aperçu que les formes pharmaceu-tiques traditionnellement utilisées par cette voie : crèmes, onguents, lotions ... , posaient un certain nombre de problèmes non négligeables
Il est difficile d'appliquer une posologie prec1se et la maniabilité des formes pâteuses est médiocre pour les malades ambulatoires.
- Le taux d'absorption systémique des substances appliquées par cette voie est variable, principalement en raison des différences dans la surface d'application pour chaque patient : la surface doit être assez importante pour obtenir l'effet recherché mais pas assez grande pour entraîner des effets secondaires ; il varie également en fonction du malade lui-même.
Le mode d'application peut provoquer des variations d'absorption, par exemple une friction peut augmenter la résorption par vaso-dilatation locale (Shaw et coll., 1981- Traisnel et coll., 1984).
C'est donc pour éviter ces inconvénients que l'industrie pharmaceu-tique s'est tournée vers des systèmes de délivrance transdermique qui permettent de libérer une substance à la dose et à la vitesse souhaitées, on parle alors de systèmes transdermiques à libération contrôlée qui sont définis ci-après :
Les dispositifs transdermiques sont des articles médicamenteux destinés à être appliqués sur la peau sur un site délimité. Ils servent de support à un ou plusieurs principes actifs destinés à exercer une action générale après libération et passage à travers la barrière cutanée.
3.2 AVANTAGES ET INCONVENIENTS DES SYSTEMES TRANSDERMIQUES A LIBERATION CONTROLEE
Les dispositifs transdermiques ont pour but le traitement ou la prévention par voie dermique de troubles systémiques. Cette voie est plus commode et éventuellement plus efficace que les voies traditionnelles : orales et autres parentérales (Barry, 1983 -Cleary, 1985 -Shaw, 1983).
Par rapport aux autres voies, la voie percutanée présente un certain nombre d1avantages :
- Elle élimine les variables qui influencent (!absorption gastro-intestinale :
modification du pH environnant le long du tractus gastro-intestinal d1environ 1 dans Jlestomac à 8 dans 11intestin ;
la prise d1aliments ;
la vidange gastrique la motilité intestinale.
Elle fournit une voie alternative quand la voie orale est impos-sible comme en cas de nausée, d1inconscience ou en cas d1effets
secondaires inacceptables (exemple : la scopolamine provoque une somnolence, des ha Il uci nations ... ) .
Elle évite les risques et les inconvénients de la voie intraveineuse.
- La substance diffuse dans la circulation systémique sans passer dans la circulation portale ni dans le foie. La voie percutanée élimine donc 11effet de premier passage hépatique et évite les
risques d1une métabolisation trop importante de la substance qui
provoque une diminution considérable du taux de substance active passant dans la circulation générale : on peut donc diminuer la dose quotidienne à administrer.
- Les systèmes transdermiques permettent une administration cons-tante, il est donc possible d1utiliser des molécules ayant une
demi-vie plasmatique très courte.
L1administration percutanée à vitesse contrôlée évite la
pene-tration pulsée d1une substance dans la circulation systémique
L1écretage des pics de concentration plasmatique favorise la
disparition d1effets secondaires indésirables qu1on leur
45
-Relation schématique existant entre les concentrations plasmatiques de drogue trouvées après une administration conventionnelle (ligne oscillante : l'administration des doses est représentée par les flèches) après une administration par un système transdermique (ligne horizontale). Gl ::s 0'
..
Cil E /administration pulsée temps 1 7 Figure n° 11 D'après Barry B.W. (1983)- Elle permet un arrêt brutal du traitement en cas de besoin par simple arrachage du dispositif de la peau.
Tous ces avantages peuvent permettre le développement sous cette forme de nouvelles molécules mais aussi donner un nouvel essor à
un produit ancien. Toutefois :
- Il n'est pas possible d'utiliser sous cette forme des substances qui nécessitent pour être efficaces, des taux plasmatiques élevés, ceci à cause de la faible perméabilité de la peau et de l'impossi-bilité de remplir les systèmes avec une quantité trop importante de substance.
Les substances ion1sees ne peuvent être administrées facilement, du fait de la nature li pop hi le de la peau.
- Bien que l'administration transdermique évite l'effet de premier passage hépatique, la drogue peut être soumise à d'autres systèmes enzymatiques.
La microflore présente à la surface cutanée est capable de métabo-liser quelques drogues (ex : nitroglycérine).
Il existe également dans la peau un certain nombre d'enzymes qui peuvent donner lieu à des réactions de métabolisation de phase 1 : réactions d'oxydation, de réduction, d'hydrolyse ainsi qu'à des réactions de conjugaison de phase Il (Hadgraft, 1987).
- Compte-tenu des caractéristiques de l'absorption, l'administration des médicaments par voie percutanée ne peut constituer un trai-tement d'urgence en raison du temps de latence nécessaire à l'établissement d'un gradient de concentration efficace entre le site d'administration et le sang.
- Les adhésifs peuvent ne pas adhérer sur toutes les peaux, ceci en raison de la présence éventuellement gênante des lipides cutanés, de la sueur ou des poils.
- Ce type de système peut être indésirable sur le plan psycholo-gique (en ce qui concerne l'acceptation du patient) ou sur le plan économique.
L'inconvénient majeur de ce mode d'administration est cependant le risque d'apparition d'effets secondaires cutanés lors de
l'application à long terme de ces systèmes, parmi ceux-ci : . Les réactions allergiques qui sont généralement le résultat
d'une hypersensibilité individuelle à l'un des constituants de la couche adhésive ou à la molécule active.
Les réactions d'irritation qui sont généralement induites par la macération de la peau sous occlusion : réactions strictement limitées au site d'application.
L'occlusion à long-terme conduit à l'accumulation de sueur à la surface cutanée et même parfois à l'obstruction des canaux sudo-raux, ce qui peut faire apparaître une mi liai re rouge : réaction inflammatoire intraépidermique souvent accompagnée de démangeai-sons, dûe à la diffusion de la sueur à travers les canaux.
Les réactions d'irritation peuvent également être favorisées par l'association : accumulation de sueur-augmentation de la température locale sous occlusion, pouvant engendrer un climat idéal pour la croissance des bactéries et/ou des levures (Walters,
47 -3.3 CHOIX DES MOLECULES
Bien qu1apparemment les systèmes transdermiques présentent de
nombreux avantages, ils ne peuvent pas être réalisés avec toutes les molécules.
En effet, pour qu1une molécule puisse être mise sous cette forme,
il faut qu1elle réponde à un certain nombre de caractéristiques
(Sauna!, 1984).
3.3.1 Impératifs physico-chimiques
- Stabilité.
Poids moléculaire (1000 (correspond à la limite supérieure de diffusion d1une substance à travers une membrane biologique).
- Point de fusion <250°C (caractéristique en relation avec l'apti-tude que possède une molécule pour la diffusion).
- Solubilité dans l1eau et dans l1huile de paraffine
>
1 mg/ml (ceciest à rapprocher du fait que l1épiderme est une barrière
hydro-lipidique).
pH de la solution saturée, compris entre 4 et 9 (sinon risque de mauvaise tolérance cutanée de la substance).
- Forme non ionisée dans les conditions d1utilisation.
- Bonne constante de diffusion.
3.3.2 Impératifs de tolérance
La substance ne doit pas être irritante ou sensibilisante. Elle doit être bien tolérée pendant une application maximale de 7 jours (période au-delà de laquelle le dispositif se décrochera).
3. 3. 3 Impératifs pharmacologiques
- Activité thérapeutique pouru ne dose <1 0 mg car i 1 semble
impos-sible de faire pénétrer à travers la peau des doses supérieures de principe actif pour des surfaces raisonnables.
- Coefficient thérapeutique le plus élevé possible : permet une sécurité plus grande au niveau de l'administration.
En effet, les variations de perméabilité peuvent être importantes, non seulement entre différents sites d1un même individu, mais
aussi entre différents individus pour un même site.
Ces différences de perméabilité peuvent être dramatiques pour les molécules qui ont un coefficient thérapeutique très étroit.
Mais 11administration de substances de ce type est pourtant
pos-sible par cette voie, il faut alors s1assurer que dans ce cas,
c1est le système et non la peau qui contrôle la libération de la
substance.
Activité pharmacologique vérifiée pour cette voie et pour la quantité de principe actif délivrée.
3.4 FACTEURS A PRENDRE EN COMPTE LORS DE LA FORMULATION D1UN SYSTEME TRANSDERMIQUE A LIBERATION CONTROLEE
L1ensemble constitué par la peau et la forme pharmaceutique active
(système transdermique) est une structure multicouches stratifiées où la vitesse globale du processus de transport dépend de l1étape
qui a la vitesse la plus lente.
Au niveau de cet ensemble, 3 régions peuvent moduler le processus de pénétration ( Zatz, 1983), ce sont :
- Le véhicule : il pourra être choisi de telle façon que le transport soit accéléré ou limité par le système.
- Le
stratum corneum
qui constitue la barrière limitante pour la plupart des molécules.- Les assisses vivantes de 11épiderme et le derme qui jouent parfois
le rôle de barrière pour les molécules très peu hydrosolubles.
Ces différentes barrières sont à considérer comme un tout ; on pourra modifier leur action en jouant sur la formulation du système transdermique.
49
-D1après la deuxième équation de Fick, le flux de substance qui passe
à travers la membrane (que ce soit le stratum corneum ou la membrane microporeuse) par unité de temps et de surface est :
D.K.
J=
Cvh
(cf 1.1.3.2)
Or, on considère que h : 11épaisseur de la membrane est une valeur
constante pour un site d1application et un individu donné, il faudra
faire varier d1autres paramètres au moment de la formulation pour