Analyses génomiques et phénotypiques contrastant les
embryons bovins des races Holstein et Jersey
Thèse
Luis Manuel Baldoceda Baldeon
Doctorat en sciences animales Philosophiae doctor (Ph.D.)
Québec, Canada
iii
Résumé
Au cours des dernières années, la production laitière a été en croissance constante en raison de plusieurs facteurs tels que l‟utilisation d‟individus plus performants. L‟augmentation du nombre d‟enregistrements de vaches de la race Jersey confirme l‟intérêt économique des producteurs pour cette race en raison de la production élevée de protéines et de gras du lait par rapport aux autres races. Cependant, les embryons de la race Jersey ont montré des difficultés dans le processus de cryopréservation lequel peut aider à une commercialisation massive de matériel génétique de cette race. Il a été observé que la race Jersey présente un faible taux de gestation lors du transfert des embryons après la cryopréservation en comparaison aux embryons de la race Holstein. Nous proposons que cette différence entre les deux races bovines soit due à des caractéristiques spécifiques de la race au niveau du phénotype et du génome. Dans un premier temps, les résultats de cette étude ont mis en évidence des différences au niveau du phénotype et du profil lipidique et génomique de l‟embryon Jersey. Celui-ci est caractérisé par un contenu de lipides associé à une faible fonction mitochondriale laquelle déterminera le faible succès à la cryopréservation. Par la suite, nous avons évalué au niveau du phénotype et de la génomique, l‟utilisation de la L-carnitine dans le milieu de culture in vitro afin de compenser cette caractéristique des embryons de la race Jersey. Cette étude sur la supplémentation de L-carnitine a permis d'identifier une faible réponse chez les embryons Jersey qui est expliqué par le faible effet de la L-carnitine sur l‟activité mitochondriale. Afin de définir l‟impact de la fonction mitochondriale sur la viabilité de l‟embryon lors de nos études, nous avons mis au point une méthode pour compenser la dysfonction mitochondriale sur le développement embryonnaire chez le bovin. Enfin, l‟application de la vitamine K2 dans le milieu de culture
in vitro montre un impact positif sur la fonction mitochondriale qui a mené à des
changements phénotypiques et génomiques chez les embryons bovins. En conclusion, ce projet a permis de caractériser et d‟identifier la race comme un facteur qui limite la cryopréservation des embryons et peut influencer sur le métabolisme embryonnaire au niveau des mitochondries. La fonction mitochondriale est une caractéristique importante sur le développement embryonnaire bovin qui peut ouvrir sur des perspectives d‟amélioration de la viabilité embryonnaire.
v
Abstract
For the past decades, milk production has been increasing due to several factors such as the use of high genetic merit individuals. In this regard, Jersey cows have been of interest for the producers because of high protein and fat indexes in their milk compared to others breeds. However, there are some challenges associated with Jersey particularly poor results using embryo cryopreservation which could help to massively commercialize the genetic material of this breed. It was observed that the Jersey breed have low pregnancy rates following embryo transfer of cryopreserved Jersey embryos compared to the Holstein breed. Here, we hypothesised that those differences between these two breeds in embryo cryopreservation are due to specific phenotypic and genotypic characteristics at the embryo level. Initially, the results of this study showed differences on the phenotype, lipid profile and genomic differences of Jersey embryo characterized by the higher lipid droplets content associated with low mitochondrial function which will determine the low success with cryopreservation. Subsequently, we assessed the phenotype and genotype of embryos using L-carnitine supplementation in the in vitro embryo culture medium in order to compensate those characteristics in Jersey embryos. The results of this study revealed moderate beneficial effects of L-carnitine supplementation in Jersey embryos through low effect of L-carnitine on mitochondrial activity. To define the impact of mitochondrial function on the embryo viability during our study, we developed a method to compensate the mitochondrial dysfunction during early embryo development in bovine model. To do that, Vitamin K2 supplementation in the in vitro embryo culture medium was applied which showed a positive effect on the mitochondrial function leading to satisfactory phenotypic and genotypic changes in the embryos. In conclusion, this study resulted in identification and characterization of the cattle breeds effects as a critical factor on cryopreservation performance and embryonic metabolism of the mitochondria. Our results emphasized that mitochondrial function is an important feature of embryonic development in cattle, which can provide opportunities to improve embryonic viability.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations ... xv
Remerciements ... xxi
Avant-Propos ... xxiii
Introduction ... 1
CHAPITRE I : MISE EN CONTEXTE ... 5
1.1 DÉVELOPPEMENT EMBRYONNAIRE ... 5
1.1.1 Folliculogenèse ... 5
1.1.1.1 L'ovogenèse ... 7
1.1.1.2 La stéroïdogenèse ... 8
1.1.2 La fécondation et le développement embryonnaire précoce ... 12
1.2 LES LIPIDES : REVUE ... 18
1.2.1 Les lipides: Généralités ... 18
1.2.2 Structure, nomenclature et propriétés des acides gras ... 21
1.2.2.1 Les acides gras saturés ... 25
1.2.2.2 Les acides gras insaturés ... 26
1.2.2.2.1 Les acides gras monoinsaturés ... 26
1.2.2.2.2 Les acides gras polyinsaturés ... 27
1.2.3 La synthèse des acides gras ... 28
1.2.4 La β-oxydation ou lipolyse des acides gras ... 31
1.2.5 Synthèse des triglycérides et des phospholipides... 34
1.2.6 Élongation et désaturation des acides gras à longue chaîne ... 35
1.2.7 Accumulation des acides gras dans la cellule ... 36
1.2.7.1 La membrane plasmique ... 36
1.2.7.2 Les gouttes lipidiques ... 38
1.2.7.3 Contrôle génomique de l‟accumulation des lipides ... 40
1.3 LES MITOCHONDRIES : REVUE ... 43
1.3.1 Les mitochondries : Généralités ... 43
1.3.2 Structure et morphologie des mitochondries... 44
1.3.3 Fonctions principales des mitochondries : Revue ... 49
1.3.3.1 Phosphorylation oxydative ... 49
1.3.3.2 L‟apoptose ... 54
1.3.3.3 L‟homéostasie du calcium ... 56
1.3.3.4 Production de DRO ... 58
1.3.4 Distribution et activité des mitochondries dans les ovocytes et les embryons ... 60
1.3.5 Génome de la mitochondrie ... 63
1.3.6 Les mitochondries et la reproduction ... 68
viii
1.4.1 Les lipides dans l‟alimentation animale ... 71
1.4.1.1 Effet des lipides dans l‟alimentation sur la fonction ovarienne et les ovocytes .. 72
1.4.1.2 Effet des lipides dans l‟alimentation sur les embryons ... 74
1.4.2 Les acides gras de l‟ovocyte et de l‟embryon : Revue ... 75
1.4.3 Les lipides sur la production in vitro des embryons ... 77
1.4.3.1 Effet de l‟ajout du sérum ou BSA dans la culture des embryons ... 78
1.4.3.1.1 Effet de l‟ajout du sérum ... 78
1.4.3.1.2 Effet de l‟ajout du BSA ... 81
1.4.3.2 Effet de l‟ajout des AG dans la culture des embryons ... 82
1.4.4 Effet des lipides sur l‟efficacité de la cryopréservation ... 83
1.4.4.1 La morphologie des embryons ... 84
1.4.4.2 L‟origine des embryons (in vivo ou in vitro) ... 87
1.4.4.3 Le stade de développement... 90
1.4.4.4 La race ... 91
1.5 HYPOTHÈSES ... 94
CHAPITRE II : Phenotypic and genomic differences between early embryos of the Jersey and Holstein dairy cow breeds. ... 97
2.1 RÉSUMÉ ... 99
2.2 ABSTRACT ... 101
2.3 INTRODUCTION ... 103
2.4 MATERIALS AND METHODS ... 105
2.6 DISCUSSION ... 114
2.7 ACKNOWLEDGMENTS ... 119
2.8 REFERENCES ... 120
2.9 TABLES AND FIGURES ... 124
2.10 SUPPLEMENTAL DATA ... 131
CHAPITRE III : Genetic influences cellular responses of bovine embryos to L-carnitine added to the in vitro production medium. ... 133
3.1 RÉSUMÉ ... 135
3.2 ABSTRACT ... 137
3.3 INTRODUCTION ... 139
3.4 MATERIALS AND METHODS ... 141
3.5 RESULTS ... 149
3.6 DISCUSSION ... 152
3.7 ACKNOWLEDGEMENTS ... 157
3.8 REFERENCES ... 158
3.9 TABLES AND FIGURES ... 163
3.10 SUPPLEMENTAL DATA ... 172
CHAPITRE IV: Improvement of bovine in vitro embryo production by vitamin K2 supplementation ... 173
4.1 RÉSUMÉ ... 175
4.2 ABSTRACT ... 177
4.3 INTRODUCTION ... 179
4.4 MATERIALS AND METHODS ... 181
ix 4.6 DISCUSSION ... 191 4.7 ACKNOWLEDGEMENTS ... 195 4.8 REFERENCES ... 197 4.9 FIGURES ... 201 4.10 SUPPLEMENTAL DATA ... 206 Conclusion ... 207 Bibliographie ... 213
xi
Liste des tableaux
Tableau 1. Perte des ovocytes pendant la méiose ... 8
Tableau 2. Classification des lipides ... 20
Tableau 3. Nomenclature des acides gras. ... 24
Tableau 4. Critères de classification de la qualité des embryons chez le bovin. ... 86
Tableau 5. The most significant phosphatidylcholine (PC) and sphingomyelin (SM) ions identified based on MALDI-MS data obtained from individual bovine oocytes and embryos ... 124
Tableau 6. Genbank accession, primer sequences, annealing temperatures and product size of candidates used for validation of relative gene expression levels in in vivo bovine embryos by quantitative RT-PCR . ... 131
Tableau 7. The most significant phosphatidylcholine (PC) and sphingomyelin (SM) ions identified based on MALDI-MS data obtained from individual bovine oocytes and embryos (in vitro). ... 163
Tableau 8. Genbank accession, primer sequences, annealing temperatures and product size of candidates used for validation of relative gene expression levels in in vitro bovine embryos by quantitative RT-PCR. ... 172
Tableau 9. Characteristics of the primers used for gene candidate transcript quantification ... 206
xiii
Liste des figures
Figure 1. La stéroïdogenèse : Biosynthèse des hormones stéroïdes.. ... 9
Figure 2. La stéroïdogenèse et le modèle « 2 cellules, 2 gonadotrophines » ... 11
Figure 3. Schéma de la nomenclature des acides gras ... 22
Figure 4. Fonctions de l‟ACC1 et de l‟ACC2 sur le métabolisme des lipides ... 30
Figure 5. Microphoto de l‟association entre la goulette lipidique et la membrane du reticulum endosplasmique ... 39
Figure 6. Morphologie de la mitochondrie. ... 45
Figure 7.Micrographie électroniques qui montre plusieurs formes des mitochondries ... 46
Figure 8.Phosphorylation oxydative en lien avec les 4 complexes mitochondriaux. ... 49
Figure 9.Organisation du génome mitochondrial. ... 65
Figure 10. Morphology of bovine embryos in vivo six days after insemination. ... 125
Figure 11. Lipid droplet content of Holstein and Jersey morula-stage in vivo embryos .... 126
Figure 12. Confocal microscopic images of Holstein and Jersey in vivo. ... 127
Figure 13. Quantitative RT-PCR validation of microarray analysis of genes involved in lipid metabolism.. ... 128
Figure 14. MALDI-MS spectra of lipids in Holstein and Jersey in vivo embryos. ... 129
Figure 15. 3D representation of PCA data for Holstein and Jersey in vivo embryo ... 130
Figure 16. Phase contrast images of bovine embryos produced in vitro. ... 164
Figure 17. Confocal imaging of Holstein and Jersey in vitro embryos . ... 165
Figure 18. Lipid droplets in morula-stage bovine embryos produced in vitro ... 166
Figure 19. Fluorescence intensity of Mitotracker Red (A) in in vitro bovine embryos ... 167
Figure 20. Validation by quantitative RT-PCR for gene expression levels in Holstein embryos produced in vitro. ... 168
Figure 21. MALDI spectra of the lipid profiles of bovine embryos produced in vitro ... 169
Figure 22. Relative abundance of lipid species in bovine embryos produced in vitro. ... 170
Figure 23. 3D analysis of the lipid composition of bovine embryos produced in vitro. .... 171
Figure 24. Bovine embryos produced in vitro treated with vitamin K2. ... 201
Figure 25. Effect of vitamin K2 on bovine embryo development in vitro. ... 202
Figure 26. Confocal microscopy images of embryos with vitamin K2 ... 203
Figure 27. Validation by quantitative RT-PCR of bovine embryo with vitamin K2. ... 204
xv
Liste des abréviations
3β-HSD : Δ5-3β-hydroxystéroïde-deshydrogénases Δ5→ Δ4-isomérases. ACC : Acétyl-CoA carboxylase
ADN : Acide désoxyribonucléique
ADNmt : Acide désoxyribonucléique mitochondrial ADP : Adénosine diphosphate
ADRP : Adipose differentiation-related protein AG : Acides gras
AGE : Activation du génome embryonnaire AGMI : Acides gras monoinsaturés
AGNE : Acides gras non estérifiés AGPI : Acides gras polyinsaturés ALA : Acide linolénique (18:3 n-3) ARN : Acide ribonucléique
ARNm : Acide ribonucléique messager
ARNr : Acide ribonucléique ribosomique
ARNt : Acide ribonucléique de transfert ATP : Adenosine triphosphate
CAT : Carnitine-acylcarnitine translocase
cDNA : Acide désoxyribonucléique complémentaire CoA : Coenzyme A
COC : Complexe cumulus ovocyte
CPT-I : Carnitine-palmitoyl CoA transferase I CPT-II : Carnitine-palmitoyl CoA transferase II
xvi
DAG : Diacylglycerol
DRO : Dérivés réactifs de l'oxygène
EIM : Espace intermembrenaire de la mitochondrie FAS : L'acide gras synthase
FADH : Flavine adénine dinucleotide hydrogené FMN : Flavine mononucleotide
FSH : Hormone folliculostimulante
HMG-CoA : Hydroxy-Méthyl-Glutaryl-CoA
IUPAC : International Union of Pure and Applied Chemestry JUT : Jonction utéro-tubaire
LA : Acide linoléique (18 :2 n-6) LDL : Lipoprotéines de basse densité LH : Hormone lutéinisante
LPA : Acide lysophosphatidique GL : Gouttelettes lipidiques GV : Vésicule germinale hpi : Heures post-insémination
NADH : Nicotinamide adénine dinucléotide réduit PHOSOX : Phosphorylation oxydative
P450aro : P450 aromatase
P450scc : P450 Side-Chain Cleavage
P450C17 : P450 17 α-hydroxylase, C17→ 20 lyase PC : Phospholipids phosphatidylcholine
xvii PI : Phosphatidylinositol
PG : Phosphatidylglycerol
PPM : Perméabilité de la membrane mitochondriale PRI : Potentiel rédox intracellulaire
PS : Phosphatidylserine RA : Réaction acrosomique RE : Réticulum endoplasmique
Smac/DIABLO : Second mitochondria-derived activator of caspace / direct inhibitor of apoptosis- binding protein with low pI
StAR : Steroidogenic Acute Regulatory Protein TAG : Triacylglycérol
TCA : Cycle de l'acide citrique
TIP47 : Tail-interacting protein of 47 kilodaltons ZP : Zone pellucide
xix
xxi
Remerciements
Tout d'abord, je me dois de remercier tout spécialement Claude Robert, mon directeur de recherche qui m'a offert la chance d'effectuer mes études doctorales. Je suis très reconnaissant de la confiance qu‟il m‟a donnée et de l‟opportunité de réaliser un projet scientifique original. Merci pour tout ton support et ton encadrement. Je tiens aussi à remercier Patrick Blondin pour avoir accepté la co-direction de mon doctorat ainsi que Christian Vigneault pour leur très grande disponibilité et leurs innombrables conseils au cours de mes études. Ils m‟ont aidé au nom de L‟Alliance Boviteq qui a supporté mon projet de recherche via la production d‟embryons in vivo et in vitro spécialement des embryons Jersey. Aussi, je tiens à remercier Marc-Andrée Sirard pour ses conseils. Un grand merci à Dominic Gagné, Isabelle Laflamme et Alexandre Bastien pour leurs efforts et leur aide en biologie moléculaire, production des embryons et microscopie, ainsi que pour les moments partagés hors du labo. Merci à tous les membres de l‟équipe des étudiants qui ont partagé plusieurs heures de travail de laboratoire à l‟INAF et au Comtois : Isabelle D, Isabelle G, Julie Niemman, Angus, Habib, Sara, Éric, Gael, Rémi, Nicolas S., Nicolas G., Ernesto, Anne-Laure, Florence, Audrey, Annie, etc. Je tiens aussi à remercier mes amis péruviens de toute la vie (los amigos de la agraria y los que conoci en Québec) et les amis français et québécois qui ont été avec moi au cours de mes études.
Quiero agradecer de manera especial a mi familia: mis padres Luis y Lourdes y mi hermano Alan. Desde siempre me han mostrado su amor y apoyo incondicional, a pesar de las dificultades y la distancia. Los amo mucho. Finalement, je tiens à remercier Kim, qui a changé ma vie pendant mon aventure au Québec, pour m'avoir donné de l„inspiration, confiance, son support inconditionnel pendant ces années.
xxiii
Avant-Propos
Il est important de souligner la participation des différents auteurs dans les chapitres présentés dans cette thèse. Tout d‟abord, les analyses des échantillons utilisés dans le chapitre 2 et chapitre 3 ont été réalisées grâce à la collaboration, la gestion et les conseils techniques de Patrick Blondin et Christian Vigneault. Ils ont participé via L‟Alliance Boviteq qui nous a fourni les embryons in vivo et in vitro des vaches Holstein et Jersey. Christina Ramires Ferreira a participé comme conseillère dans l‟interprétation des résultats de la désorption-ionisation laser assistée par matrice (MALDI-MS) des lipides. Isabelle Gilbert et Dominic Gagné ont participé activement à la supervision technique des expériences en microarray et validation PCR présentées dans les chapitres 2, 3 et 4. Mon directeur de thèse Claude Robert a conçu l‟étude et il a supervisé la direction des travaux et la rédaction du manuscrit de tous les chapitres présentés dans cette thèse. Finalement, moi, Luis Baldoceda, j‟ai effectué la plupart des expériences et rédigé le manuscrit. Les chapitres 2, 3 et 4 seront soumis sous la forme d‟articlespour publication dans la revue
1
Introduction
La production laitière mondiale des vaches a progressé énormément et de façon constante au cours des dernières années. Au Canada, la production moyenne des vaches laitières est de 9,774 kg/année. Celle-ci a augmenté de 25 % au cours des 20 dernières années. Un facteur fondamental de cette augmentation est la sélection d‟animaux plus performants. Ainsi, l‟utilisation des races de vaches spécialisées en production laitière est une étape critique chez les producteurs. Il n‟est donc pas surprenant qu‟il y ait une élévation du nombre d‟enregistrement des animaux de races chez les producteurs laitiers au Canada (Statistique Canada 2012). Cependant, la haute sélection génétique des animaux a eu un impact sur certaines caractéristiques reproductives. En effet, il est connu qu‟il existe une corrélation inverse entre la haute production du lait et la reproduction (Dobson et al., 2007).
La baisse de la fertilité des vaches de haute qualité génétique a poussé la recherche à trouver des alternatives de sélection génétique afin de résoudre cette problématique. L‟utilisation des techniques de reproduction assistée est la plus populaire chez les producteurs laitiers. Au cours des dernières années, les technologies comme le transfert des embryons, la production embryonnaire in vitro et la cryopréservation embryonnaire se sont développées pour améliorer l‟efficacité des programmes de sélection génétique (Bousquet
et al., 2003). La cryopréservation à un intérêt économique et génétique important pour
l‟industrie puisqu‟elle permet une commercialisation plus facile et rapide des embryons de haute valeur génétique (Guignot, 2005). La recherche a permis de perfectionner les méthodes de cryopréservation des embryons. Cependant, l‟éfficacité de la cryopréservation embryonnaire peut être affectée par l‟état du développement, l‟espèce, l‟origine des embryons in vitro ou in vivo, l‟état de nutrition de la mère, les conditions de culture, etc. (Hasler, 2001; Massip, 2001; Van Soom et al., 2003; Guignot, 2005; Leroy et al., 2005). Cependant, l‟impact de la race de vache sur la survie post-cryopréservation est peu documenté.
2
Steele et Hasler (2004) ont observé que les embryons de la race Jersey ont un faible taux de gestation après la cryopréservation comparativement aux embryons de la race Holstein en utilisant le même protocole de congélation. Cette étude a suggéré que les embryons de la race Jersey ne montrent pas une bonne performance lors de la congélation en raison de leur haut contenu lipidique comparativement aux autres races. Au Canada, la race Holstein représente 90 % du cheptel national de la population des vaches laitières tandis que la race Jersey représente 3 % (Statistique Canada, 2012). En plus, la race Jersey est économiquement importante dans l‟industrie laitière pour la commercialisation de son matériel génétique qui lui confère une prédisposition à produire un lait riche en gras et en protéines en comparaison aux autres races (Statistique Canada, 2012). Beaulieu et Palmquist (1995) ont suggéré que cette caractéristique est propre à la biochimie cellulaire ce qui pourrait différer au niveau du métabolisme lipidique.
Bien que la littérature n‟en ait pas fait mention, chez les producteurs laitiers, il est connu que les embryons Jersey ont une couleur foncée marquée comparativement aux embryons d‟autres races. Plusieurs études ont démontré que cette caractéristique morphologique de certaines races bovines est probablement corrélée négativement avec sa cryorésistance (Visintin et al. 2002; Van Soom et al. 2003; Leroy et al. 2005). En effet, la couleur foncée des embryons est associée à une accumulation excessive de gouttes lipidiques, lesquelles peuvent avoir une influence sur la survie post-congélation (Abe et al., 1999). La principale difficulté lors de la cryopréservation réside dans la concentration du contenu lipidique des embryons (Abe et al., 1999; Crosier et al., 2001; Abe et al., 2002a; Rizos et al., 2003). Les conditions de culture (par exemple avec sérum), l‟origine des embryons et une faible fonction mitochondriale sont des facteurs potentiels qui ont été le sujet de plusieurs études afin de déterminer l‟origine de l‟accumulation des lipides dans les embryons (Kruip et al., 1983; Thompson et al., 1995, Abe et al., 1999; Sata et al., 1999; Stojkovic et al., 2001, Abe et al., 2002a).
3 Cependant, peu d‟information permet de déterminer l‟effet de la race de vache sur l‟accumulation de lipides des embryons bovins. Ainsi, les raisons pour lesquelles les embryons Jersey ont une suraccumulation de lipides ne sont pas connues. En répondant à cette problématique, ce projet cherche à élucider les causes qui diminuent le succès de la congélation des embryons Jersey avec comme but final, l‟amélioration de la survie après la cryopréservation.
5
CHAPITRE I : MISE EN CONTEXTE
1.1 DÉVELOPPEMENT EMBRYONNAIRE
1.1.1 Folliculogenèse
Les ovaires sont les gonades qui font partie de l'appareil reproducteur interne des femelles. Elles ont plusieurs fonctions, mais la première et la plus importante est la production des ovocytes. Les ovocytes sont des cellules hautement spécialisées qui ont des composantes génétiques maternelles, capables de se fusionner avec un spermatozoïde en un seul noyau et continuer le développement embryonnaire précoce. Le processus de sa croissance et sa longue différentiation sont dépendants des cellules folliculaires qui l‟entourent. Ainsi, les processus de folliculogenèse et d‟ovogenèse sont étroitement reliés (Royère, 2006). La folliculogenèse peut se définir comme la succession des différentes étapes du développement du follicule depuis le moment où il sort de la réserve, constitué pendant la vie embryonnaire lors de l‟ovogenèse, jusqu‟à sa rupture lors de l‟ovulation ou à son involution lors de l‟atrésie (Mermillod et al., 2008). À la fin de la folliculogenèse, l‟ovocyte doit acquérir sa compétence afin de reprendre sa méiose, être fécondé, se développer jusqu‟à l‟activation du génome embryonnaire afin de soutenir le développement jusqu‟au stade de blastocyste et assurer le succès d‟une gestation viable (Sirard et al., 2006).
Dès le vêlage de la femelle chez les mammifères, les ovaires possèdent des stocks importants de follicules primordiaux qui sont constitués par des ovocytes primaires entourés d‟une petite couche de cellules épithéliales et d‟une lame basale (Fair et al., 2003). Ces ovocytes primaires restent inactifs jusqu‟à ce qu‟ils soient stimulés pour compléter leur méiose et leur croissance (Erickson, 1966). Le mécanisme par lequel un certain nombre de follicules primordiaux se développent en follicules primaires, c‟est-à-dire l‟étape suivante de croissance, est peu connu. Les follicules primaires proviennent de l‟activation des follicules primordiaux, étape caractérisée par deux phases (Braw-Tal et Yossefi, 1997). La première phase est caractérisée par la prolifération et la transformation des cellules de la
6
granulosa de forme aplatie à forme cuboïde qui ont une grande activité mitotique. Dans la deuxième phase, l‟augmentation du nombre de cellules de la granulosa est accompagnée par une augmentation rapide de la taille de l'ovocyte (Braw-Tal et Yossefi, 1997; Fair et al., 1997).
La progression vers le stade de follicule secondaire se caractérise par l‟apparition d‟une deuxième couche de cellules de la granulosa (Driancourt, 1991) et par le dépôt initial de glycoprotéines autour de l‟ovocyte qui feront partie de la zone pellucide (ZP). La croissance des ovocytes est accompagnée par la formation d'une ZP. Chez les autres mammifères, la ZP forme un anneau complet autour de l'ovocyte au stade de follicule primaire. Dans l'ovaire bovin cependant, cela se produit beaucoup plus tard, lorsque le follicule atteint le stade tardif préantral (Braw-Tal et Yossefi, 1997).
Selon Braw-Tal et Yossefi (1997), les ovocytes commencent leur croissance quand il y a au moins 40 cellules de la granulosa dans la plus grande section transversale (quatrième génération de cellules folliculaires). Les granules corticaux sont formés au sein du cytoplasme de l‟ovocyte (Fair et al., 1997). Les follicules secondaires deviennent follicules tertiaires (antraux) caractérisés par la prolifération massive et continue de cellules de la granulosa autour de l‟ovocyte appelées cumulus. Le follicule présente aussi une prolifération et une différentiation de certaines cellules qui deviendront les cellules de la thèque interne et externe séparées des cellules de la granulosa par la lame basale. Ce développement comprend aussi la formation de petites cavités ou la formation d‟une cavité remplie de fluide (la cavité antrale) (Driancourt, 1991; Fair et al., 1997).
La croissance des follicules et des ovocytes chez les bovins se fait de façon parallèle jusqu‟à ce que le follicule ait un diamètre de 3 mm (Fair et al., 1995). Ensuite, il a été observé que les ovocytes pouvaient atteindre un diamètre maximal de 120 à 130 µm, alors que les follicules pouvaient continuer leur croissance jusqu‟à un diamètre de 15 à 20 mm avant l‟ovulation (Fair et al., 2003). Ainsi, plusieurs observations ont démontré que les ovocytes provenant de follicules antraux qui ont un diamètre de 1mm ont un faible signe de
7 reprise de méiose (Blondin et Sirard, 1995; Fair et al., 1995). De cette façon, la littérature a conclu que la plupart des ovocytes (110 à 130 µm) provenant des follicules >3 mm ont un certain potentiel de développement important en termes de taux de blastocyste après la fécondation et la culture in vitro (Blondin et Sirard, 1995, Fair et al., 1995, Fair et al., 2003).
1.1.1.1 L'ovogenèse
Les ovaires ont un grand stock de cellules germinales primordiales, lesquelles sont les premières cellules germinales dans l‟ovaire et augmentent en nombre par mitoses. L‟ovogenèse commence au début du développement fœtal et se termine quelques années plus tard chez l'adulte sexuellement mature (Picton et al., 1998). Les cellules germinales primordiales entrent dans les gonades des embryons chez les femelles, elles deviennent alors des cellules appelées ovogonies. Les ovogonies prolifèrent par mitose, laquelle comprend une période de synthèse de l‟ADN (Van den Hurk et Zhao, 2005). La prophase du premier cycle de la mitose des ovocytes chez les bovins se produit entre le 75e et le 80e jour post-conception (Erickson, 1966). La prolifération des ovogonies continue, elles entrent en méiose puis elles se transforment en ovocytes primaires. Les ovocytes passent par les phases de leptotène, zygotène et pachytène avant d‟arrêter au stade diplotène (stade de la prophase méiotique I), lequel se produit au cours de la vie fœtale (Picton et al., 1998 ; Van den Hurk et Zhao, 2005). Les ovocytes sont plus grands que les ovogonies, car ils ont plus d‟organites cytoplasmiques (Picton et al., 1998). Le nombre d‟ovogonies atteint un maximum avant la formation des follicules primaires qui s‟ensuit par une perte de gamètes importante principalement due à un processus apoptotique qui mène à l‟établissement des réserves d‟ovocytes dans le cortex ovarien (Tableau 1). Il est accepté que le nombre d‟ovocytes est fixe dès lors et que la vie reproductive procède par l‟utilisation progressive de ces réserves jusqu‟à leur épuisement ce qui correspond à la ménopause.
8
Tableau 1. Perte des ovocytes pendant la méiose Espèce Nombre maximum
d‟ovocytes Nombre d‟ovocytes à la naissance Perte d‟ovocytes (%) Rongeurs 50 000–75 000 10 000–15 000 80 Brebis 900 000 82 000 91 Vaches 2 700 000 135 000 95 Femmes 2 700 000 700 000 90
(Adapté de Van den Hurk et Zhao, 2005)
Les ovocytes peuvent demereur dans cet état de quiescence en prophase I jusqu'à la fin de la folliculogenèse menant soit à l‟atrésie ou à l‟ovulation suite à la décharge de LH. Le pic de LH induit l‟ovocyte à reprendre la méiose et ensuite à se soumettre à deux divisions de réduction pour devenir un ovule haploïde. Au stade antral de la croissance folliculaire, le noyau des ovocytes est appelé vésicule germinale (GV) (Van den Hurk et Zhao, 2005). Le « Germinal Vesicle Break Down » (GVBD) est le premier indicateur clair et visible de reprise de la méiose. Celui-ci est remarqué par une condensation et un alignement des chromosomes pour une première division méiotique afin d'éliminer la moitié du bagage chromosomique (2N) par l'expulsion du premier globule polaire lors de la méiose I. Ensuite, la deuxième division méiotique est initialisée et la méiose est à nouveau stoppée au stade de métaphase II dans l'attente de la fécondation par le spermatozoïde (1N) (Mattson et Albertini, 1990).
1.1.1.2 La stéroïdogenèse
La stéroïdogenèse est une voie de biosynthèse longue et complexe qui commence habituellement avec le cholestérol et finit avec une série de métabolites stéroïdes (Figure 1). Le cholestérol peut être synthétisé à partir de l‟acétyl CoA par l‟intermédiaire du HMG-CoA, mais cette capacité est limitée.
9 Figure 1. La stéroïdogenèse : Biosynthèse des hormones stéroïdes. Abréviations cyt P450scc : cytochrome P450scc clivage de la latéral du cholestérol, P450aro : P450 aromatase ; 3β-HSD : Δ5-3β-hydroxystéroïde-deshydrogénases Δ5→4Δ isomérases, HOR : 17β-hydroxystéroïde oxydo-réductases. Les flèches en bleu indiquent les réactions catalysées par 3β-HSD et la flèche en jaune indique la réaction catalysée par 17β-HOR. Le cholestérol peut aussi provenir du sang, transporté par les LDL où il est incorporé avec les vésicules lipidiques et est stocké sous forme estérifiée (Robel, 2001).
10
Les hormones trophiques activent une chaîne de réactions qui conduisent à l'hydrolyse des esters de cholestérol en cholestérol libre et le transport du cholestérol vers les mitochondries où il est converti en prégnénolone par le cytochrome P450scc (Hanukoglu, 1992). La prégnénolone sort de la mitochondrie et pénètre le réticulum endoplasmique (RE) où elle est ensuite convertie en progestérone par les Δ5-3β-hydroxystéroïde-deshydrogénases Δ5→4Δ isomérases (3β-HSD). La coupure de la chaîne latérale de la prégnénolone et de la progestérone est assurée par le cytochrome P-450C17 (17 α-hydroxylase, C17→ 20 lyase). Le cytochrome P450aro (aromatase) assure la conversion des androgènes en estrogènes. Enfin, les 17β-hydroxystéroïde oxydo-réductases (17HOR) assurent l‟interconversion de stéroides 17-cétoniques et de leurs homologues 17 β-hydroxylés (Robel, 2001).
Une des fonctions principales des cellules de la granulosa et de la thèque est la production de l‟œstradiol pour la régulation du cycle œstral. Ainsi, la croissance folliculaire et la stéroïdogenèse sont dépendantes de l‟action coordonnée de la FSH et de la LH dans les follicules pré-ovulatoires (Figure 2). Ces hormones ne jouent pas seulement un rôle dans la production d‟hormones stéroïdes sexuelles, elles jouent aussi un rôle essentiel dans la régulation de la stéroïdogenèse des hormones (Soumano et al., 1996; Soumano et Price, 1997). Les récepteurs des hormones gonadotropes sont couplés à l‟adénylate cyclase produit par l‟AMP cyclique, qui représente leur second messager et dont l‟action se distingue en effets rapides et en effets lents sur la stimulation de la stéroïdogenèse (Hillier
et al., 1994 ). L‟effet rapide de l‟action de la LH provoque une mobilisation du cholestérol
à partir des gouttelettes lipidiques (GL) vers le cytochrome P450SCC lequel stimule la sécrétion de la prégnénolone (Hillier et al., 1994, Robel, 2001). Les effets lents sont une conséquence de la stimulation de la transcription des gènes des enzymes stéroïdogènes (Robel, 2001).
11 Les cellules de la granulosa ont des récepteurs à la FSH et les cellules de la thèque ont des récepteurs à la LH au début du développement folliculaire (Fortune, 1986; Soumano et Price, 1997). Les cellules de la thèque sécrètent des androgènes sous la forme d‟androstènediones qui sont stimulés par la LH et non par la FSH (Fortune, 1986). Les cellules de la thèque du follicule dominant possèdent une grande quantité d'ARNm de StAR, ce qui lui assure une bonne entrée de cholestérol dans les mitochondries pour le transformer en androstènedione (Soumano et Price, 1997; Bao et Garverick).
Figure 2. La stéroïdogenèse et le modèle « 2 cellules, 2 gonadotrophines ». Abréviations AMPc : Adénosine monophosphate cyclique, Chol : cholestérol, P : progestérone, T : testostérone, et E2 : œstradiol.
La liaison de la LH à son récepteur sur les cellules thécales stimule l'activité du cytochrome P450c17 nécessaire pour la conversion de la progestine en androstènedione
(Bao et Garverick, 1998). Dans une période de 12 à 24 heures après le début de la lutéolyse, la capacité des cellules de la thèque est grandement améliorée pour répondre à la LH et à la production de l'androstènedione (Fortune et Quirk, 1988). Cette capacité est augmentée par le précurseur de la progestérone fourni par les cellules de la granulosa sous la forme de la prégnénolone (Fortune et Quirk, 1988). Les cellules de la granulosa apparaissent incapables de synthétiser des androgènes, mais elles peuvent convertir des androgènes exogènes en estradiol, ce qui implique in vivo qu‟elles utilisent des androgènes thécales pour synthétiser
12
l‟estradiol. Les deux types de cellules (granulosa et thèque) sont présumés avoir la P450scc nécessaire pour la conversion de cholestérol en progestagènes lesquels sont précurseurs de la synthèse de l‟androstènedione dans les cellules de la thèque (Fortune, 1986). Cependant, les cellules de la granulosa ne produisent pas les androgènes même en présence de précurseurs de la progestérone (Bao et Garverick, 1998). De cette façon, l'androstènedione est importé dans les cellules de la granulosa où il est transformé en estradiol par le cytochrome P450aro (Bao et Garverick, 1998). La capacité des cellules de la granulosa pour aromatiser les androgènes en estradiol augmente pendant 48 heures après le début de la lutéolyse, mais la plus forte augmentation se situe entre 12 et 24 heures après le début de la lutéolyse (Fortune et Quirk, 1988) (Figure 2).
1.1.2 La fécondation et le développement embryonnaire précoce
Lorsque l'ovocyte est retiré de son follicule, dans certains cas, il a la possibilité de reprendre la méiose spontanément. La fusion d‟un spermatozoïde et d‟un ovule entraîne l'expulsion du 2e globule polaire, ainsi que la formation du zygote qui possède le contenu génétique de ces deux cellules germinales et qui est capable de se développer en un embryon viable.
Après l‟ovulation, le complexe cumulus-ovocyte (COC) mature est capté par les cils de l‟infundibulum de l‟oviducte où il est déplacé pour la fécondation (Talbot et al., 2003). L'adhésion entre la matrice de cellules du cumulus et les cils est essentielle pour déplacer le COC sur la surface de l'infundibulum (Talbot et al., 2003 ; Kölle et al., 2009). Cependant, Kölle et al. (2009) ont observé que l‟adhésion du COC à l'épithélium de l‟oviducte est dépendante de la maturation. Ils ont démontré l‟importance des cellules du cumulus, car le COC qui est immature ou dénudé n‟est pas attaché à l‟épithélium de l‟oviducte. Cela démontre que l‟oviducte est un lieu de sélection pour les ovocytes capables d‟être fécondés (Talbot et al., 2003). Une fois que le COC entre dans l‟ampoule, il est rapidement attaché à
13 l‟épithélium de l‟oviducte qui sera le lieu de la fécondation (Talbot et al., 2003; Kölle et
al., 2009).
Les gamètes mâles sont déposés dans le tractus vaginal où ils sont aussi déplacés jusqu‟au lieu de la fécondation (Talbot et al., 2003). Des milliers de spermatozoïdes atteignent l‟utérus après l‟éjaculation, mais seulement des milliers atteignent l'isthme de l'oviducte pour la fécondation (Van Soom et de Kruif., 1998). La transformation des spermatozoïdes qui permet d‟acquérir leur pouvoir fécondant est défini comme la capacitation. Ceci est un effet combiné de plusieurs modifications moléculaires des protéines de la membrane plasmique des spermatozoïdes (glycoprotéines) et des composants lipidiques qui modifient les canaux ioniques dans la membrane plasmique des spermatozoïdes (Abou-Haila et Tulsiani, 2000).
Chez les mammifères, il y a deux barrières anatomiques de l‟utérus pour la sélection des spermatozoïdes mobiles et vigoureux. Le cervix est la première grande barrière qui sert à la sélection du sperme, car seuls les spermatozoïdes mobiles peuvent passer dans le mucus cervical fortement hydraté (Kölle et al., 2010). Chez la vache, le transport des spermatozoïdes dans l'utérus est soutenu par les vagues de contractions des muscles lisses utérins, cette activité contractile est forte pendant l'œstrus, alors que pendant la phase lutéale, les contractions sont faibles et localisées (Talbot et al., 2003).
Le deuxième obstacle anatomique est la jonction utéro-tubaire (JUT). Chez la plupart des mammifères, la lumière est particulièrement tortueuse et étroite et peut devenir encore plus petite en raison d‟un fort repli muqueux et/ou vasculaire du plexus et des ligaments qui compriment la lumière (Hawk, 1983). De plus, le passage des spermatozoïdes est empêché par le mucus qui rempli le lumen étroit ou le JUT ce qui explique pourquoi seulement quelques milliers de spermatozoïdes atteignent l'isthme (Kölle et al., 2010).
La fécondation comprend une série d'événements qui ont comme résultat la fusion des gamètes mâles et femelles. Kölle et al. (2009) ont observé que les COC ont perdu une grande part des cellules du cumulus après l‟ovulation lors de leur déplacement jusqu‟à
14
l'isthme de l'oviducte. Ainsi, le spermatozoïde peut être en contact avec les cellules du cumulus restant et avec la surface de la ZP de l‟ovocyte (Talbot et al. 2003 ; Kölle et al., 2009). De cette façon, les cellules du cumulus peuvent agir comme un filtre physiologique puisque le sperme qui a déjà terminé la réaction acrosomique (RA) est piégé à son bord externe (Florman et al., 1999). Il est suggéré que le sperme subisse la RA à la marge extérieure du cumulus oophorus. En effet, des observations indiquent que les cellules du cumulus sont intégrées au sein d'un acide hyaluronique riche et extracellulaire de la matrice, présentant ainsi une barrière physique aux spermatozoïdes (Florman et al., 1999). Le sperme a ainsi une activité hyaluronidase qui est libérée à la suite de la RA (Florman et
al., 1999; Talbot et al., 2003).
La RA implique une série d‟événements cellulaires : fusion entre la membrane plasmatique et la membrane acrosomique externe, dispersion de la matrice acrosomale et exposition de la membrane externe laquelle est une membrane de surface (Hyttel et al., 1989). Un certain nombre d'inducteurs physiologiques et non physiologiques peuvent réguler la RA. Il s'agit notamment de la progestérone, du liquide folliculaire et des sécrétions des cellules du cumulus contenant des prostaglandines, des sulfates de stérol, des glycosaminoglycanes et des néoglycoprotéines (Abou-Haila et Tulsiani, 2000).
Toutefois, l‟interaction avec la ZP (la couche extracellulaire de l'ovule) est aussi vitale pour déclencher la RA (Abou-Haila et Tulsiani, 2000, Sinowatz et al., 2001). L'interaction entre les gamètes lors de la fécondation est au moins en partie régulée par des groupements glucidiques de la ZP et par des glycoprotéines de liaison de la surface des spermatozoïdes (Sinowatz et al., 2001). La plupart des mammifères ont une ZP composée de trois à quatre glycoprotéines, appelées ZP1, ZP2, ZP3 et ZP4 (Sinowatz et al., 2001). Florman et al. (1999) et Abou-Haila et Tulsani (2000) ont suggéré que ZP3 est le composant critique pour l‟interaction des gamètes et participe à la capacitation des spermatozoïdes. Abou-Haila et Tulsani (2000) ont décrit que ZP3 peut fusionner la membrane plasmique des spermatozoïdes et la membrane externe de l‟acrosome dans plusieurs sites de la région antérieure de la tête du spermatozoïde. Florman et al. (1999) ont décrit aussi que ZP3
15 présente plusieurs caractéristiques d'adhésion avec le spermatozoïde. L‟ovocyte peut ainsi se lier aux spermatozoïdes de façon intégrale et inhiber l'adhérence des autres gamètes compétitifs. Un autre changement important que déclenche la RA est une augmentation du pH intracellulaire du spermatozoïde. Cette hausse est régulée entre autres par les canaux ioniques de Ca2+ sur la membrane plasmique des spermatozoïdes et de la membrane externe acrosome (Abou-Haila et Tulsiani, 2000).
La recherche scientifique a bien documenté les événements de la fécondation en conditions de culture in vitro chez les bovins. Saeki et al. (1991) ont observé que la première évidence de pénétration des spermatozoïdes dans les ovocytes a été observée à 3 hpf mais le taux de pénétration s‟accroît jusqu'à 5 hpf avec un taux maximum (92 %). En plus, ils ont aussi déterminé que la formation pronucléaire a été observée à 9 hpf (Saeki et al., 1991). Dans une autre étude, Van Soom et al. (1992) ont déterminé que la formation d'embryons au stade pronucléaire se produit entre 18 à 20 hpf. Cette différence de temps dans la formation pronucléaire observée dans les deux études précédentes peut être expliquée parce que les embryons bovins produits in vitro peuvent varier considérablement leur rythme de développement à cause des différentes conditions de culture (Van Soom et al., 1992).
Le premier cycle cellulaire inclue quatre phases, soit les phases G1, S, G2 et M. Il s‟agit du stade de formation des pronoyaux jusqu‟à la première division de segmentation séparant le zygote en deux blastomères (Barnes etEyestone, 1990; Van Soom et al., 1992). Le premier clivage du zygote bovin peut se produire entre 23 à 31 hpi en conditions in vivo (Barnes etEyestone, 1990) tandis qu‟en conditions in vitro entre 29 à 32 hpf (Holm et al., 1998; Lequarre et al., 2005). Au cours de son séjour dans l‟oviducte (24 à 48 hpi), les embryons précoces modifient leur vascularisation de l‟oviducte et induisent la formation de cellules sécrétrices, assurant un microenvironnement optimal et la nutrition pendant les premiers jours de vie (Kölle et al., 2009). Le deuxième et troisième cycle cellulaire sont considérablement plus courts que le premier avec une durée globale de 9 heures et de 11 heures respectivement (Holm et al., 1998). Les embryons de 2 à 4 cellules ont été observés entre 36 et 50 hpi en conditions in vivo et entre 36 et 45 hpf en conditions in vitro (Barnes
16
etEyestone, 1990; Van Soom et al., 1992 ; Holm et al., 1998). La transcription du génome embryonnaire commence lors du troisième cycle cellulaire lorsque les premiers ARN ont été transcrits et la formation moléculaire de nucléoles fonctionnelle est établie au cours du quatrième cycle cellulaire (Barnes Eyestone, 1990; Viuff et al., 1998).
Le début du quatrième cycle cellulaire a été observé de 38 à 39 hpf, mais la plupart des embryons à 8 cellules étaient présents de 58 à 86 hpf (Holm et al. 1998). La durée du quatrième cycle cellulaire était de 38,6 à 48,6 heures, avec une moyenne de 43 heures, ce qui est particulièrement long comparativement aux cycles précédents (Holm et al., 2002; Lequarre et al., 2003). C‟est durant le quatrième cycle cellulaire, c‟est-à-dire lors du passage de 8 à 16 cellules, que l‟embryon bovin acquiert la capacité de transcrire son propre génome. Cette étape se nomme l‟«activation du génome embryonnaire» ou Embryonic Genome Activation (EGA) et constitue l‟œuvre centrale d‟un phénomène plus général appelé « transition maternelle embryonnaire » ou Maternal to Embryonic Transition (MET) (Holm et al., 1998; Memili et al. 1998). Durant cette transition, les premiers blastomères subissent des modifications substantielles dans le but de favoriser la transcription. Cependant, plus de 60 % des embryons produits in vitro ne passent pas le stade de la MET (Blondin et al., 1997). Cela est confirmé par Holm et al. (1998) qui ont observé que les blastomères de l'embryon à 8 cellules ont subi un arrêt prononcé du développement ou «lag-phase».
Les embryons complètent le cinquième cycle cellulaire à environ 102 à 106 hpi (Van Soom et al., 1992; Holm et al. 1998). Le nombre d‟embryons augmente très lentement à partir de ce moment en raison des cycles cellulaires longs qui se produisent lorsqu‟il y a entre 8 et 16 cellules (Van Soom et al., 1992).
Au cours du stade de 16 à 32 cellules chez les bovins, l‟embryon est appelé morula. L‟émergence des premières morulas est observée à 116,4 hpi (Holm et al. 1998). Cependant, l'apparition de morulas bien compactées a été observée entre 126 et 162 hpi avec un nombre moyen de cellules variant entre 30,9 et 45,8 cellules (Van Soom et al.,
17 1992). La formation d‟un jeune blastocyste est caractérisée par l‟apparition d‟une cavité remplie de liquide appelée blastocèle. Il montre aussi une différenciation interne visible entre le trophoblaste et la masse cellulaire interne (Linder et Wright, 1983 ; Holm et al. 1998). Le diamètre des blastocystes précoces est d‟environ 160 µm cerné d‟une ZP avec une épaisseur moyenne de 12 µm, laquelle donne un diamètre extérieur total entre 160 et 180 µm. Le jeune blastocyste est constitué d‟environ 100 cellules (Betteridge et Fléchon, 1998).
Les premières cavités du blastocèle sont observées entre 120 à 122 hpi, mais l‟intervalle correspondant entre l‟insémination et la formation du blastocèle est en moyenne de 145 heures (Holm et al. 1998). La différenciation marquée de la couche de trophoblaste externe et la masse cellulaire plus foncée et compacte est évidente chez les blastocystes. Le diamètre global de l'embryon augmente considérablement entre 200 à 220 µm (Holm et al., 2002), avec un amincissement simultané de la ZP à environ 1/3 de son épaisseur initiale au stade de blastocyste expansé (Linder et Wright, 1981). Le nombre de cellules en moyenne est de 160 au cours de cette étape (Betteridge et Fléchon, 1998). La durée moyenne entre la formation du blastocèle et l'expansion permanente de la ZP est de 21,6 heures (Holm et al., 1998). Les blastocystes en éclosion présentent un contenu embryonnaire qui se déverse complètement ou en partie à l‟extérieur de la ZP et présente une forme sphérique et un blastocèle bien défini ou effondré (Linder et Wright, 1983). L‟éclosion du blastocyste a été observée à partir de 174 hpi ou 7 jours post-insémination (Holm et al., 1998).
18
1.2 LES LIPIDES : REVUE
1.2.1 Les lipides: Généralités
Les lipides ont été définis par Christie (1982) comme une variété de substances qui sont de nature biologique et qui ont une solubilité dans les solvants organiques comme par exemple le diéthyl éther, l‟hexane, le benzène, le chloroforme ou le méthanol (Christie, 1982). La littérature scientifique a établi des définitions plus précises des lipides lorsque ceux-ci sont considérés avec une perspective structurelle et de biosynthèse. De cette façon, beaucoup de schémas de classification différents ont été utilisés au fil des années. Par exemple, Fahy et
al. (2005) ont défini les lipides comme des substances hydrophobes ou des petites
molécules amphipathiques qui proviennent toutes ou en partie de la condensation de la base carbanion des thioesters et/ou par la condensation de la base ion carbonium des unités isoprènes.
Christie (1982) a décrit que les lipides ont été subdivisés en deux grands groupes : les lipides «simples» qui produisent au moins deux types de produits par hydrolyse (par exemple, les acides gras, les stérols et les acylglycérols) et les lipides «complexes» qui produisent trois produits ou plus par hydrolyse (par exemple, les glycérophospholipides et les glycosphingolipides). Cependant, Fahy et al. (2005) ont déterminé une classification des lipides, incluant la plupart des noms, en 8 catégories qui sont bien acceptées dans la littérature (Tableau 2). Les catégories sont : les acides gras, les glycérolipides (les triglycérides), les glycérophospholipides, les sphingolipides, les stérols et les prénols.
Les acides gras (AG) représentent le bloc de lipides majeurs de la construction des lipides complexes et est donc la catégorie fondamentale de lipides biologiques. Ils forment un groupe diversifié de molécules se caractérisant par une série répétitive de groupes méthylènes qui leurs confèrent un caractère hydrophobe (Fahy et al., 2005).
19 Les triglycérides sont omniprésents dans la nature et sont des éléments constituants de la membrane des cellules. Les triglycérides contiennent essentiellement du glycérol combiné avec trois acides gras. Les plus connus sont les esters gras de glycérol (acylglycérols) qui comprennent les tri-, di- et mono-acylglycérols. Dans la nutrition, les triglycérides constituent la majorité des lipides dans les huiles de graines et de graisse de stockage dans les tissus animaux (Ratnayake et Galli, 2009).
Les glycérophospholipides sont des constituants des membranes cellulaires dans les aliments et dans les huiles extraites. Ils sont constitués d'un glycérol en union avec deux acides gras et un groupement phosphate relié à un alcool (Ratnayake et Galli, 2009).
Les sphingolipides sont une famille complexe de composés qui partagent une caractéristique structurale commune : ils ont une base sphingoïde qui est convertie en céramides, phosphosphingolipides, glycosphingolipides et autres types de molécules. Les céramides sont une sous-classe importante de produits dérivés de la base sphingoïde avec un alcool aminé et un acide gras lié (Ratnayake et Galli, 2009).
Les stérols sont une classe de lipides qui contiennent un noyau stéroïde commun, une structure de fusion de quatre anneaux avec une chaîne latérale d'hydrocarbures et un groupe alcool. Le plus important est le cholestérol car il est précurseur de nombreux composés et aussi un constituant important des membranes plasmiques (Fahy et al., 2005).
Le terme «saccharolipide» est utilisé pour décrire les composés dont les acides gras sont directement liés à un glucide formant ainsi des structures qui sont compatibles avec la double couche membranaire (Fahy et al., 2005).
20
Les prénols sont les lipides qui sont formés à partir des précurseurs de 5 carbones. Les caroténides, vitamines E et K et les ubiquinones, sont des exemples de cette classe de lipide (Ratnayake et Galli, 2009).
Les polycétydes sont synthétisés par la polymérisation de sous-unités acétyle et propionyle. Ils comprennent un très grand nombre de métabolites secondaires et des produits naturels d'origine animale et végétale, des sources bactériennes, fongiques et marines, et une grande diversité structurale (Fahy et al., 2005).
Tableau 2. Classification des lipides (Adapté de Fahy et al, 2005)
Groupe Exemple
Acides gras et dérivés acides oléiques
Triglycérides mono-, di- et tri-glycérides Glycérophospholipides acides phosphatidylcholines Sphingolipides céramides, phophosphingolipides
Stérols cholestérol, stéroïdes, vitamine D
Saccharolipides UDP-3-0-(3-hydroxy-tetradecanoyl)-
N-acetylglucosamine
Prénols isoprénoïdes, quinones (vitamine E)
21 Moran et al. (2012) ont décrit que les lipides ont plusieurs fonctions biologiques à cause de leurs diverses structures. Par exemple :
La base structurale de toutes les membranes biologiques est la double couche lipidique qui inclut les lipides amphipathiques (glycérophospholipides et sphingolipides) et parfois le cholestérol.
Dans certains organismes, les triglycérides ont une fonction de stockage de molécules pour l‟énergie métabolique.
Les gras aussi fournissent une isolation thermique chez les animaux.
Les cires dans la paroi cellulaire, les exosquelettes, et la peau peuvent protéger les surfaces de certains organismes.
Certains lipides ont des fonctions très spécialisées. Par exemple, les hormones stéroïdes régulent et intègrent une série d‟activités métaboliques chez les animaux. Les eicosanoïdes participent à la régulation de la pression artérielle, de la température du corps, de l‟inflamation et à la contraction du muscle lisse chez les animaux.
1.2.2 Structure, nomenclature et propriétés des acides gras
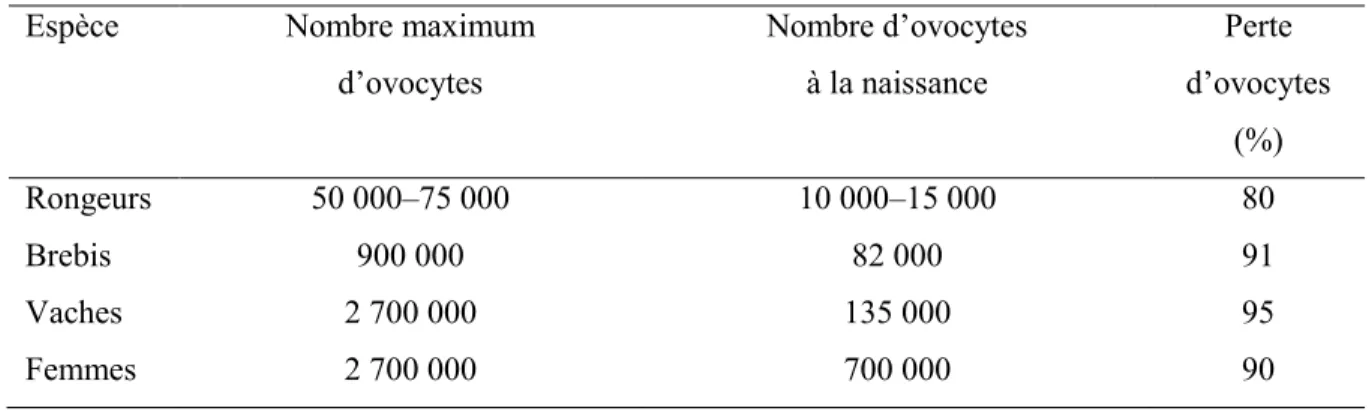
Les acides gras (AG) sont constitués d‟un groupe (-COOH) et d‟une queue aliphatique linéaire comprenant un nombre d'atomes de carbone supérieur à quatre et généralement pair avec une extrémité méthyle (-CH3) (Figure 3) (Ratnayake et Galli, 2009). La concentration des AG « libres » dans les cellules est basse, car en haute concentration, elles peuvent désorganiser la membrane en raison du caractère « acide » du groupe carboxyle (Moran et
22
Nombre d'atomes de carbone
18 : 3 n-3
Position de la lre double liaisonNombre de doubles liaisons
Figure 3. Schéma de la nomenclature des acides gras (ex : l'acide a-linolénique).
Selon Moran et al. (2012), les AG peuvent être différents les uns des autres au niveau de :
La longueur de leur queue d‟hydrocarbures ou leur nombre d‟atomes de carbone : le nombre d‟atomes de carbone dans la plupart des AG sont au nombre de 4 à 24 et sont presque toujours en nombre pair dès qu‟ils sont synthétisés par addition successive de deux unités de carbone. Les AG qui ont entre 4 à 10 carbones sont connus comme des AG à courte chaîne, entre 12 à 14 carbones, ce sont des AG à moyenne chaîne et finalement, les AG de 16 carbones et plus sont appelés AG à longue chaîne.
Le nombre de doubles liaisons carbone-carbone : les AG sans aucune double liaison sont appelé saturés, tandis que les AG qui ont au moins une double liaison sont appelés insaturés et ceux qui ont plusieurs doubles liaisons sont appelés polyinsaturés.
La position des doubles liaisons dans la chaîne, connue aussi comme isomérie de position : il s‟agit des doubles liaisons localisées dans des positions différentes dans la chaîne de carbone. La position des doubles liaisons est indiquée par le symbole Δn dans la nomenclature IUPAC, où n indique la position de l‟insaturation numérotée à partir du premier atome de carbone dans le groupe carboxylique (-COOH).
23 La configuration des doubles liaisons : dans les AG insaturés, la configuration peut être cis ou trans. La configuration des AG dans la nature est usuellement cis, laquelle est caractérisée par la position des deux atomes d‟hydrogène du même côté du plan de la liaison. La configuration trans est caractérisée par les deux atomes d‟hydrogène situés dans l‟autre plan de la liaison.
Dans la nomenclature IUPAC, le carbone carboxyle est marqué comme le C-1 et les suivants sont numérotés de façon séquentielle. Dans la nomenclature commune, les lettres grecques sont utilisées pour identifier les atomes de carbone. Le carbone voisin du carbone carboxyle (C-2 dans la nomenclature IUPAC) est désigné α, et les autres carbones sont lettrés β, γ, δ, ε, et ainsi de suite. La lettre grecque ω est spécifique pour l‟atome de carbone le plus éloigné depuis le groupe carboxyle, quelle que soit la longueur de la queue hydrocarbonée (Moran et al., 2012).
Les AG sont solubles dans les solvants organiques en raison de leur caractère hydrophobe. L‟hydrophobie des AG a une corrélation avec la longueur de leur chaîne carbonée. Cependant, cette hydrophobie est considérablement influencée par le pH et s‟explique aussi par la tendance des AG à s‟associer entre eux pour former une monocouche ou des micelles. L‟évidence des lipides dans la formation de micelles dans une solution aqueuse est le changement rapide de ses propriétés physiques sur une échelle de concentration (Gurr
24
Tableau 3. Nomenclature des acides gras (Adapté de Gurr et al., 2002).
Nom systématique Nom commun Abréviation Point de fusion
(°C) Acides gras saturés
Éthanoïque Acétique 2:0 16.7 Butanoïque Butyrique 4:0 -7.9 Dodécanoïque Laurique 12:0 42.2 Hexadécanoïque Palmitique 16:0 60.7 Eicosanoïque Arachidique 20:0 75.4 Docosanoïque Béhénique 22:0 24
Acides gras monoinsaturés
9-hexadecenoïque Palmitoléique 16:1 n-7 1
9-octadecenoïque Oléique 18:1 n-9 16
9-docosénoique Érucique 22:1 n-9 24
Acides gras polyinsaturés
9-,12- octadécadiénoïque Linoléique 18:2 ω-6 -5
9,12,15-octadecatrienoïque Linolénique C18:3 ω-3 -11
25 Les AG sont généralement liquides (AG insaturés) ou solides (AG saturés) à température ambiante (22°C). Le passage d‟un stade à l‟autre se produit à une température connue comme le point de fusion lequel peut diminuer avec le degré d‟insaturation en configuration cis et augmenter selon la longueur de la chaîne carbonée (Moran et al., 2012). De façon intéressante, le point de fusion des acides gras dépend du nombre de carbone dans la chaîne carbonée, soit pair ou impair. Les acides gras saturés sont très stables, mais les acides gras insaturés sont sensibles à l‟oxydation. Ainsi, les acides gras insaturés doivent être traités dans une atmosphère de gaz inertes et gardés loin des agents oxydants ou des substances provoquant des radicaux libres (Gurr et al., 2002).
1.2.2.1 Les acides gras saturés
La plupart des acides gras saturés ont une chaîne linéaire avec un nombre pair d‟atomes de carbone (Tableau 3). Les acides gras saturés communs ont une longueur de chaîne carbonée comprenant de 14 à 20 atomes de carbone, bien qu‟il soit possible de retrouver dans la nature des chaînes homologues, paires ou impaires, avec 2 à 30 atomes de carbone ou plus (Christie, 1982). La formule chimique générale des acides gras saturés est la suivante :
CH3 - (CH2)n – COOH
De façon générale, les acides gras n‟existent pas comme acides carboxyliques libres en raison de leur affinité avec plusieurs protéines. En fait, quand les acides gras libres sont les constituants majeurs des tissus, cela est dû à des dommages cellulaires qui permettent aux lipases de décomposer les lipides acylés endogènes. Des exceptions à cette règle sont les acides liés à l‟albumine du sang des mammifères. Les acides gras libres sont connus comme AGL, mais ils sont préférablement désignés avec le terme AGNE (acides gras non estérifies) (Gurr et al., 2002).
26
Les AG qui ont entre 4 et 12 atomes de carbone sont trouvés principalement dans le gras du lait, mais les AG avec 10 et 12 atomes de carbone sont aussi trouvés dans certaines huiles de graines. Les AG saturés qui sont très abondants dans la nature sont :
L‟acide myristique (C14) est un composant mineur de la plupart des acides d‟origine animale, mais est un composant majeur dans les huiles de graines de la famille myristicaceae.
L‟acide palmitique (C16) est probablement l‟acide saturé le plus commun et le plus retrouvé dans les gras d‟origine animal et végétal ainsi que dans les huiles.
L‟acide stéarique (C18) est aussi relativement commun et peut occasionnellement être plus abondant que l‟acide palmitique, spécialement dans les lipides complexes (Christie, 1982).
1.2.2.2 Les acides gras insaturés
1.2.2.2.1 Les acides gras monoinsaturés
Les acides gras monoinsaturés (AGMI) avec une chaîne droite entre 10 et 30 atomes de carbone qui contiennent une double liaison en configuration cis ont été retrouvés dans des sources naturelles (Christie, 1982). La formule chimique générale des acides gras monoinsaturés est la suivante :
CH3 - (CH2)n - CH = CH - (CH2)m – COOH
Les AGMI d'une longueur de chaîne donnée peuvent avoir la double liaison dans une certaine position et configuration différente. De cette façon, le système de numérotation le plus utilisé considère le groupe carboxyle comme le premier carbone. Cette description est complète parce que n'importe où sur la chaîne, la position et la configuration de la double liaison ne sont pas spécifiées. Par ailleurs, dans la nomenclature commune, l‟acide est désigné 18:1 ou 18:1(9), de manière à montrer la position de la double liaison sur le
27 carbone 9. En plus, la position de la double liaison peut être indiquée de la manière suivante (n-x) où : n est la longueur de l‟acide et x le nombre d‟atomes de carbone depuis la dernière double liaison jusqu‟au groupe terminal méthyle (Christie, 1982).
Selon Christie (1982) les AGMI les plus abondants dans les tissus animaux et végétaux sont:
• L‟acide oléique (C18:1 n-9) qui est probablement l‟AG le plus abondant et retrouvé dans tous les lipides d‟origine végétale et animale.
• L‟acide palmitoléique (C16:1 n-7) qui est aussi retrouvé dans les gras d‟origine animal et végétal. Cependant, il est aussi présent en faible quantité dans les huiles de poisson et quelques graines.
• L'acide docosénoïque (C22 : 1 n-9).
1.2.2.2.2 Les acides gras polyinsaturés
Tous les acides gras polyinsaturés (AGPI) sont dérivés des AGMI, la position de la double liaison étant une fonction du système biochimique. Ainsi, les mammifères ont des désaturases qui sont capables d'éliminer les atomes d‟hydrogènes uniquement à partir des atomes de carbone entre une liaison double existante et le groupe carboxyle (Gurr et al., 2002). Les AGPI ont tous des doubles liaisons cis ou plus, ont la même structure terminale et sont presque invariablement séparés les uns des autres par un groupement méthylène (Christie, 1982 et Gurr et al., 2002). Les AGPI avec plus d‟un groupe méthylène entre les doubles liaisons ont été trouvés chez quelques bactéries, plantes et organismes marins, mais rarement chez les animaux, bien que les AGPI avec un nombre pair d‟atomes de carbone aient été trouvés chez la plupart des huiles de poisson. Les AGPI ont un point de fusion très bas et ils ont une grande sensibilité à l‟oxydation (Christie, 1982).