Établissement et impacts de la macroalgue non
indigène Codium fragile ssp. fragile dans les
herbiers marins aux îles de la Madeleine
Thèse
Annick Drouin
Doctorat en Biologie
Philosophiæ doctor (Ph.D.)
Québec, Canada
© Annick Drouin, 2013
Résumé
Les invasions biologiques sont reconnues comme une menace importante pour les écosystèmes, en particulier pour les écosystèmes côtiers. Originaire d‟Asie, la macroalgue verte Codium fragile ssp. fragile (synonyme de ssp. tomentosoides, ci-après Codium) a été observée pour la première fois dans l‟est du Canada en 1989 et prolifère depuis sur toutes les côtes du sud du golfe du Saint-Laurent. Cette algue est connue pour s‟établir sur les côtes rocheuses, mais il a récemment été observé qu‟elle est également capable de coloniser les habitats sableux et d‟y former de denses populations en se fixant sur les rhizomes de la plante marine Zostera marina. L‟objectif principal de cette thèse était de connaître les impacts de l‟établissement de Codium dans les herbiers marins des îles de la Madeleine. L‟étude du recrutement de Codium a démontré que l‟expansion de la population de Codium était possible au sein des herbiers marins étudiés, mais que la colonisation était plutôt lente. De plus, il a été observé que le succès d‟établissement de Codium dans les herbiers marins était variable spatialement. Là où Codium peut atteindre une grande biomasse, une expérience in situ a démontré que cela peut avoir un effet négatif sur la densité de zostère et les réserves d‟hydrates de carbone dans les rhizomes. L‟opacité du couvert algal serait le mécanisme expliquant ces observations en ayant pour effet de limiter la croissance clonale de la zostère, ainsi qu‟influencer son allocation d‟énergie. Ces effets n‟étaient cependant pas perceptibles dans les herbiers naturellement envahis. Comme démontré par l‟expérimentation, les effets sur la zostère ont lieu que lorsque Codium atteint une grande densité; or l'abondance de Codium varie annuellement et surtout les grandes biomasses sont peu fréquentes au sein des herbiers naturellement envahis. Il fut également démontré que les thalles de Codium offrent un habitat distinct des tiges de zostère pour l‟épifaune, qui était plus abondante et diversifiée sur Codium. À plus grande échelle, la présence de
Codium dans les herbiers influençait la distribution des poissons en favorisant la densité de
Abstract
Biological invasions are recognized as an important threat to ecosystems, in particular for coastal ecosystems. Native of Asia, the green seaweed Codium fragile ssp. fragile (synonymous of ssp. tomentosoides, herafter Codium) was first observed in eastern Canada in 1989 and has since been proliferous along the coasts of the southern Gulf of the St. Lawrence. This alga is known to establish on rocky shores, but it has recently been observed colonizing soft bottom habitat also, in particular forming dense canopies on eelgrass (Zostera marina) rhizomes. The main objective of this thesis was to identify the impacts of Codium establishment on eelgrass beds of the îles de la Madeleine. The study of
Codium recruitment has shown that population expansion is possible within the studied
eelgrass beds, but the colonization was rather low. Moreover, the success of Codium establishment in eelgrass beds varied spatially. Where Codium can reach a high biomass, An in situ experiment revealed that areas with high biomass of Codium can negatively effect eelgrass density and carbohydrate storage in rhizomes. A possible cause for these observations could be the shading created by algal cover, affecting clonal growth by eelgrass as well as influencing the plants allowance of energy. However, these effects were not detectable in naturally invaded beds. As shown, negative effects on eelgrass beds only occured when Codium biomass was high, an infrequent phenomenon that varied annually in the naturally invaded beds. It was also shown that thalli of Codium offer a distinctly different habitat than eelgrass shoots, resulting in more diverse and abundant epifauna on
Codium. At a larger scale, the presence of Codium in eelgrass beds was found to influence
fish distributions, by promoting higher density of certain species. However, no adverse effects were detected on native fauna.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... v
Liste des tableaux ... xi
Liste des figures ... xiii
Remerciements ... xvii
Avant-propos ... xix
Chapitre 1. Introduction ... 1
1.1. Invasion biologique ... 1
1.2. Succès d’invasion ... 2
1.3. Espèces envahissantes et impacts écologiques ... 4
1.4. Conséquences écologiques des invasions ... 5
1.5. Détection des impacts écologiques liés aux invasions ... 6
1.6. Impacts écologiques des algues envahissantes ... 8
1.7. Synopsis biologique de Codium fragile ssp. fragile ... 9
1.8. Impacts écologiques de Codium ... 10
1.9 Problématique ... 11
Chapitre 2. Dynamics of recruitment and establishment of an invasive seaweed: the influence of propagule sources and environmental factors on Codium fragile within an eelgrass habitat ... 15 2.1. Résumé ... 15 2.2. Abstract ... 16 2.3. Introduction ... 17 2.4. Methods ... 20 2.4.1. Study site ... 20 2.4.2. Recruitment pattern ... 23 2.4.3. Environmental conditions ... 24 2.4.4. Macrophyte attributes ... 24
2.4.5. Statistical methods ... 25
2.5. Results ... 26
2.5.1. Pattern of Codium establishment... 26
2.5.2. Factors linked with Codium establishment ... 33
2.6. Discussion ... 38
2.6.1. Factors linked to Codium establishment ... 39
2.6.2. Conclusion ... 41
Chapitre 3. Detecting the impacts of notorious invaders: experiments vs. observations in the invasion of eelgrass meadows by the green seaweed Codium fragile ... 42
3.1. Résumé ... 42 3.2. Abstract ... 43 3.3. Introduction ... 43 3.4. Methods ... 46 3.4.1. Study area ... 46 3.4.2. Patterns of co-occurrence... 48
3.4.3. Patterns of long-term invasion ... 48
3.4.4. Effect of Codium density ... 49
3.4.5. Statistical analyses ... 52
3.5. Results ... 53
3.5.1. Patterns of co-occurrence... 53
3.5.2. Patterns of long-term invasion ... 55
3.5.3. Effect of Codium density ... 58
3.6. Discussion ... 65
3.6.1. Effects of Codium density ... 65
3.6.2. Experiment vs. patterns in natural invaded beds ... 67
3.6.3. Impacts assessment ... 68
Chapitre 4. Higher abundance and diversity in faunal assemblages due to the invasion of Codium fragile ssp. fragile in eelgrass meadows ... 71
4.1. Résumé ... 71
4.2. Abstract ... 72
4.3. Introduction ... 73
4.4. Methods ... 75
4.4.2. Invertebrate assemblages ... 78
4.4.3. Fish assemblages ... 78
4.4.4. Invertebrate – Algal relationships ... 79
4.4.5. Algal manipulations ... 79 4.4.6. Statistical analyses ... 81 4.5. Results ... 82 4.5.1. Invertebrate assemblages ... 82 4.5.2. Fish assemblages ... 89 4.5.3. Algal characteristics ... 92 4.5.4. Algal manipulations ... 94 4.6. Discussion ... 96 4.6.1. Invertebrate assemblages ... 97 4.6.2. Fish assemblages ... 98 4.6.3. Algal characteristics ... 98 4.6.4. Algal manipulations ... 99 4.6.5. Ecological implications ... 99 Chapitre 5. Conclusion ... 101
5.1. Sommaire des principaux résultats ... 101
5.2. Contributions ... 102
5.3. Est-ce que Codium est une espèce envahissante? ... 103
5.4. Orientations futures ... 105
Références ... 107
Annexe A. Liste des taxons d'invertébrés associés aux macrophytes et nombre d'échantillons de Codium fragile (n=48) et de Zostera marina (n=72) contenant ces taxons. ... 123
Annexe B. Liste des taxons de poissons associés aux macrophytes et nombre d'échantillons de Codium fragile (n=24) et de Zostera marina (n=24) contenant ces taxons. ... 125
Annexe C. Complément de conclusion du chapitre 4 sur l’écologie des principales espèces de poissons obervées dans les herbiers envahis et non-envahis par Codium fragile. ... 127
Liste des tableaux
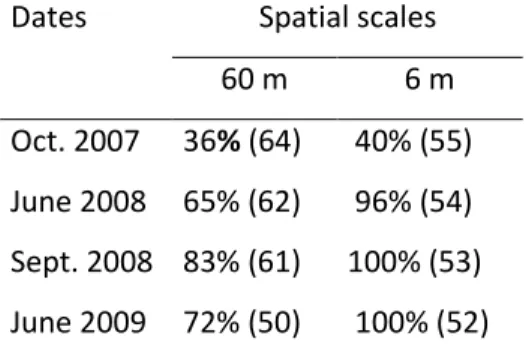
Chapitre 2Table 2.1. Proportion of recruitment blocks (%) with Codium at each sampling date for the coarse (60 m) and the fine (6 m) spatial scales. Numbers in brackets represent the number of recruitment blocks assessed. ... 28 Table 2.2. Measure of the association (Kendall tau) between abundance of a class size of
Codium and the next greater class size at the subsequent sampling date. Bold values
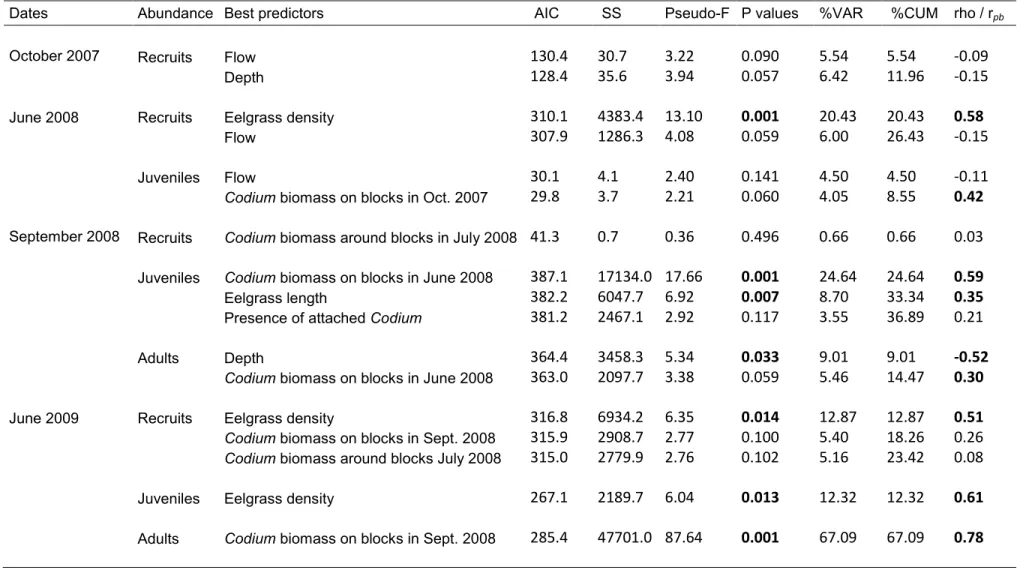
indicate significant correlations. ... 32 Table 2.3. Results of the DISTLM test on Codium abundance for each class sizes (recruits, juveniles, and adults) at each sampling date for the coarse spatial scale (60m) and correlation coefficients (Spearman, rho, or point biserial, rpb) among predictor and
dependant variables. Bold values indicate significant correlations. ... 34 Table 2.4. Results of the DISTLM test on Codium abundance for each class sizes (recruits, juveniles, and adults) at each sampling date for the coarse spatial scale (6 m) and correlation coefficients (Spearman, rho, or point biserial, rpb) among predictor and
dependant variables. Bold values indicate significant correlations. ... 35
Chapitre 3
Table 3.1. Frequency (%) of quadrats in Codium-invaded beds in which Codium cover was ≥50% in Grosse-Île (GI) and Old Harry (OH) bays in 2006 and 2009. ... 56 Table 3.2. Results of nested ANOVA on the influence of bed type (Type - with and without
Codium) on shoot density (shoots m-2), shoot length (cm), and above- and below-ground biomass (g m-2). ... 58 Table 3.3. In situ maximum light intensity and duration of compensating (Hcomp) and saturating (Hsat) light intensity above and under canopy treatments (mean ± SE), recorded from August 19 to October 6, 2008. ... 60 Table 3.4. Results of nested ANOVA on the influence of Codium density (Treatment) and sampling period (Time) on Zostera leaf growth (mg shoot-1 day-1), shoot density (shoots m-2), above- and below-ground biomass (g m-2), and rhizome carbohydrate concentration. See text for details. ... 63
Chapitre 4
Table 4.1. ANOVA results for the influence of macrophyte type (MA – Codium or eelgrass) or bed composition (CO – invaded or non-invaded) on invertebrate and fish assemblage characteristics in multiple areas (AR), beds (BE), and/or bays (BA). MA, CO and BA are fixed factors. ... 83 Table 4.2. PERMANOVA results for the influence of macrophyte type (MA – Codium or eelgrass) or bed composition (CO – invaded or non-invaded) on invertebrate and fish assemblage characteristics in multiple areas (AR), beds (BE), and/or bays (BA). MA, CO and BA are fixed factors. Multivariate analyses were based on Bray-Curtis similarity matrices created using √-transformed abundance data. ... 86 Table 4.3. SIMPER analysis showing the mean abundance of invertebrate species (number sample-1) and fish (number haul-1) for replicates of Codium (C) and eelgrass (E), the proportional (%) and cumulative contribution (Cum %) of the five species that contributed the most to the average dissimilarity (AD) among macrophyte types or bed composition. Data were √-transformed. ... 88
Liste des figures
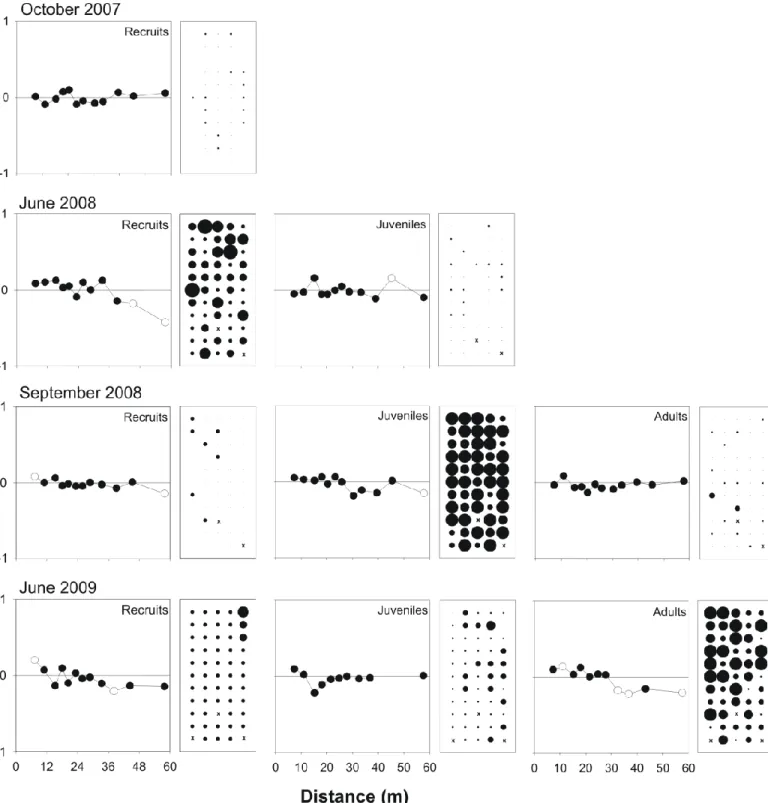
Chapitre 2Figure 2.1. Location of the study area, îles de la Madeleine, eastern Canada, and spatial arrangement of the 65 recruitment blocks (black circles) spaced by 60 m in Old Harry Bay. The black star indicates the location of the 55 recruitment blocks spaced by 6 m. ... 22 Figure 2.2. Spatial structure of the abundance Codium recruits, juveniles and adults at each sampling date. Each map (right) shows the distribution of Codium abundance on recruitment blocks spaced 60 m apart (coarse scale). The size of circles denotes the abundance of Codium (0; 1-25; 26-50; 51-75; 76-100+) on blocks and crosses indicate missing data. Graphs (left) are spatial correlograms showing Moran‟s I by distance (m). White circles indicate significant p-values (p<0.05, based on 999 permutations). ... 29 Figure 2.3. Spatial structure of the abundance Codium recruits, juveniles and adults at each sampling date. Each map (right) shows the distribution of Codium abundance on recruitment blocks spaced 6 m apart (fine scale). ). The size of circles denotes the abundance of Codium (0; 1-25; 26-50; 51-75; 76-100+) on blocks relative and crosses indicate missing data. Graphs (left) are spatial correlograms showing Moran‟s I by distance (m). White circles indicate significant p-values (p<0.05, based on 999 permutations). ... 30 Figure 2.4. Relationship between the total number of recruits observed before June 2009 and the total number of growing fronds observed in June 2009 on the recruitment blocks at (a) coarse and (b) fine scales. ... 37
Chapitre 3
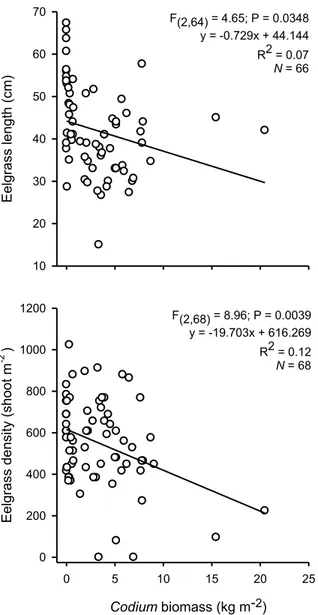
Figure. 3.1. Location of the study sites in Great-Entry Lagoon, îles de la Madeleine, eastern Canada. Black circles indicate the sites where the relationship between Codium and eelgrass was evaluated. The black star indicates the site where the manipulative experiment was done and the “x” marks the site where Codium was harvested for it. Triangles indicate invaded beds (black), where Codium was known to be present since at least three years prior to this study, and non-invaded beds (white). ... 47 Figure 3.2. Relationship between Codium biomass and eelgrass shoot length and density in
Codium-invaded beds. ... 54
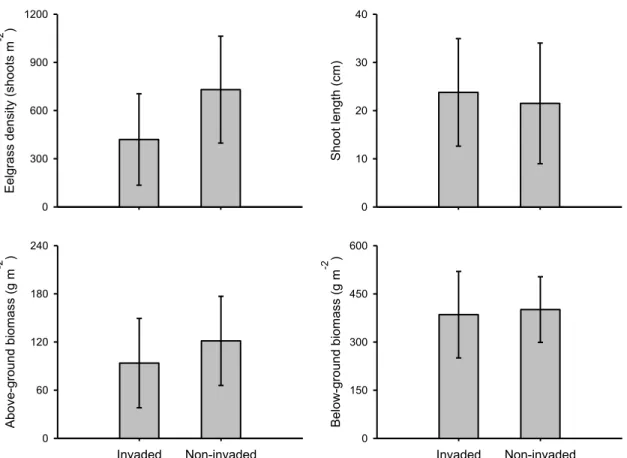
Figure 3.3. Eelgrass population characteristics (mean ± SD) in eelgrass beds were Codium is known to have been established for over three years (Invaded) compared to eelgrass beds with no invasion history (Non-invaded). The corresponding ANOVAs are shown in Table 3.2. ... 57
Figure 3.4. Temporal variation in growth rates of eelgrass shoots and eelgrass density (mean ± SE) under various densities of Codium cover (Low, Medium, High, None – a control for Codium cover with only eelgrass, and Control – eelgrass with stakes) at the end of different growth periods through the four months of the experiment in summer 2008. The corresponding ANOVAs are shown in Table 3.4. Asterisks (*) indicate significant differences between the treatments for a given date (a posteriori Tukey tests). ... 62 Figure 3.5. Leaves per shoot, and above- and below-ground eelgrass biomass (mean ± SE) from core samples collected in plots with various densities of Codium (Low, Medium, High, None – a control for Codium cover with only eelgrass, and Control – eelgrass with stakes) at the beginning (June 23, 2008) and at the end of the experiment (October 8, 2008). Note that raw data for below-ground biomass are presented but that these data were log-transformed for statistical analysis. The corresponding ANOVAs are shown in Table 3.4. 64
Chapitre 4
Figure. 4.1. Location of the study sites in Great-Entry Lagoon, îles de la Madeleine, eastern Canada, and scales at which variation in assemblages were evaluated. Circles correspond to locations where fish were sampled in invaded (black) and non-invaded (white) beds. Squares correspond to locations where invertebrates were sampled in invaded (black) and non-invaded (white) beds. The invertebrate sampling design is illustrated, where circles represent areas of Codium (grey) and eelgrass (white) within a sampled invaded bed. ... 77 Figure 4.2. Mean (± SE) characteristics of invertebrate assemblages associated with
Codium and eelgrass macrophytes in two bays, Old Harry (OH) and Grosse-Île (GI).
Results for the corresponding ANOVAs are given in Table 4.1. Note that for graphical purposes, raw abundance data are presented. Letters and lines above bars indicate significant differences between Codium and eelgrass samples in invaded beds and eelgrass samples between invaded and non-invaded beds, respectively, as tested using Tukey‟s test, p < 0.05. ... 84 Figure 4.3. Non-metric multi-dimensional scaling (MDS) illustrating variation in assemblage structure for all invertebrates, polychaetes only, and fish (√-transformed) among Codium (black), eelgrass in invaded beds (grey), and eelgrass in non-invaded beds (white). Each of the nine sampled beds is illustrated by different symbols: triangle, diamond, and hexagon represent beds from OH, other symbols are from GI. Superimposed clusters represent similarity level of 30%. Results for the corresponding PERMANOVA analysis are given in Table 4.2. ... 87 Figure 4.4. Mean (±SE) characteristics of the fish assemblages from invaded (black) and non-invaded beds (white) in the two studied bays, Old Harry (OH) and Grosse-Île (GI).
Results for the corresponding ANOVAs are given in Table 4.1. Letters above bars indicate significant differences between groups; Tukey‟s test, p<0.05... 91 Figure 4.5. Relationship between Codium size (biomass, length) and morphology (bushiness index) and the number of organisms and species associated with thalli from a bed where Codium was the dominant canopy and one where eelgrass was the dominant canopy. ... 93 Figure 4.6. Mean (±SE) abundance of all invertebrates and of just gastropods associated with experimental Codium with different thallus architecture, natural Codium, and eelgrass canopies. Letters above bars indicate significant differences between groups; Tukey‟s test, p < 0.05. ... 95
À Marie-Claude Drouin, mon modèle de courage et de détermination. C’est une réelle fierté d’être ta petite sœur.
Remerciements
Cette thèse n‟aurait pu débuter sans l‟appui financier de Pêches et Océans Canada., mais aussi du Fonds de recherche du Québec – Nature et technologies, de Québec-Océan, de la
Fondation communautaire Gaspésie – Les Îles, de la Coalition pour la viabilité du sud du
golfe du Saint-Laurent et du Fonds Richard-Bernard.
Elle n‟aura pu se terminer sans l‟appui de plusieurs personnes que je tiens à remercier : Chris McKindsey. Pour la confiance témoignée et la latitude accordée dès mes tout premiers pas dans ce projet. Au-delà de tous les conseils que tu as pu me donner, je n‟oublierai jamais la patience démontrée envers moi. Sache que je n‟ai jamais remis en question le fait de t‟avoir choisi comme directeur.
Ladd Johnson. Merci de partager tes nombreuses connaissances du milieu marin et l‟art du « réseautage ». Je suis très reconnaissante pour ta contribution à ce projet, mais encore plus de m‟avoir accordé un support sans faille lors des aléas de ma vie durant toutes ces années. Julie Turgeon et Claude Lavoie. Merci d‟être vrai et sans détour. Vos commentaires, toujours pertinents, m‟ont orientée quand j‟en avais besoin et m‟ont permis d‟aller plus loin dans mes réflexions.
Tous ceux qui ont passé de nombreuses heures en dry-suit et/ou devant un binoculaire : Maryse Couture-Plante, Karine Richer, Mathieu Morin, Matthieu Huot, Karine Gagnon, Rafael Estrada, Rénald Belley, Brianna Clinick et Philippe Archambault. Un merci tout particulier à Myriam Roy-Latreille, avec qui j‟ai arpenté les lagunes de Grande-Entrée, mais aussi les collines de Havre-aux-Maisons et du chemin de la Martinique.
La gang d‟écologie côtière et benthique de l‟Institut Maurice-Lamontagne : Nathalie Simard (la vraie!), Paul Robichaud, Andréa Weise, François Roy et Isabelle Bérubé, toujours à l‟écoute et prêts à partager leur expertise.
Anaïs Lacoursière-Roussel et Mayi Lekuona, qui sont devenues bien plus que des collègues de labo.
La gang du labo Johnson, dont l‟explosion démographique ressemble étrangement à une invasion. Merci à tous, mais plus particulièrement à Samuel Boyd Collin, Nicolas Le Corre, Paul Edwards et Jordan Ouellette-Plante, avec qui j‟ai partagé fous rires, frustrations, CO2,
et scotch.
Geneviève Parent, pour son écoute et ses conseils, autant sur le plan scientifique que personnel.
Lysandre Landry, pour ton amitié qui a su passer à travers le temps et les tempêtes.
Les gens du Marine Science Center, Nahant (MA) : Matthew Bracken, Cascade Sorte, Kylla Benes, Molly Roberts, Valerie Perini, Brendan Gillis, Natalie Low, James Douglass, Christine Newton et Isaac Rosenthal. Les côtoyer m‟aura permis de retomber en amour avec la recherche scientifique à un moment où j‟en avais grand besoin. Un merci tout spécial à Steeve Smith, Celia Schunter, Silvia Libro, Geneviève Berntachez et Dan Blustein qui m‟ont rapidement offert leur amitié.
Tous ceux qui ont si souvent écouté mes complaintes irrationnelles, souvent éthyliques, et qui ont tous fini par me dire : « Finis donc ton doc! ». Merci à vous Véronique Leclerc, François Martin, André-Pier Bérubé, Robert Gince et Mark Dionne.
Avant-propos
Les chapitres 2, 3 et 4 constituent le corps de la thèse sont présentés sous forme d‟article scientifique.
Le chapitre 2 sera soumis suite à la soutenance de cette thèse.
Le chapitre 3 est publié sous la référence: Drouin A, McKindsey CW, Johnson LE (2012) Detecting the impacts of notorious invaders: experiments versus observations in the invasion of eelgrass meadows by the green seaweed Codium fragile. Oecologia 168:491-502.
Le chapitre 4 est publié sous la référence : Drouin A, McKindsey CW, Johnson LE (2011) Higher abundance and diversity in faunal assemblages with the invasion of Codium fragile ssp. fragile in eelgrass meadows. Marine Ecology Progress Series 424:105-117.
L‟élaboration des plans d‟expérimentations, la collecte des données, l'analyse des données et la rédaction de chaque chapitre ont été réalisées par Annick Drouin sous la supervision de Chris W. McKindsey et Ladd E. Johnson, directeur et codirecteur de thèse.
Les résultats de ce doctorat ont été présentés dans le cadre de conférences régionales, nationales et internationales :
Présentations orales :
Drouin A, McKindsey CW, Johnson LE. (2011) Evaluating the impacts of the
invasive green seaweed Codium fragile in eelgrass meadows: observational vs. manipulative experiments. Sixth International Conference on Marine Bioinvasions, Barcelone, Espagne.
Drouin A, McKindsey CW, Johnson LE (2011) Evaluating the impacts of the
Drouin A, McKindsey CW, Johnson LE (2009) Effets de l‟algue envahissante
Codium fragile ssp. tomentosoides sur la zostère marine (Zostera marina). Forum
québécois des Sciences de la mer, Rimouski (QC).
Drouin A, McKindsey CW, Johnson LE (2008) Effets de l‟algue envahissante
Codium fragile sur les communautés des herbiers marins aux Îles de la Madeleine.
7ième assemblée générale annuelle de Québec-Océan, Rivière-du-Loup (QC).
Drouin A, McKindsey CW, Johnson LE (2008) Effects of the invasive alga Codium
fragile ssp. tomentosoides on epifauna associated with the native plant Zostera marina. Benthic Ecology Meeting (BEM), Providence (RI) États-Unis.
Drouin A, McKindsey CW (2006) QBRAT assessment: Codium fragile ssp.
tomentosoides case study. Quantitative Biological Risk Assessment Tool (QBRAT).
Centre of Expertise for Aquatic Risk Assessment (CEARA), Ottawa (ON). Sur invitation.
Présentations par affiche :
Drouin A, McKindsey CW, Johnson LE (2011) Impacts of the invasive green
seaweed Codium fragile in eelgrass meadows: observations vs. experiments. Canadian Aquatic Invasive Species Network (CAISN), Réunion générale annuelle et conférences, Québec (QC).
Drouin A, McKindsey CW, Johnson LE (2009) Effects of Codium fragile ssp.
tomentosoides on eelgrass. Sixth International Conference on Marine Bioinvasions,
Portland (OR), États-Unis.
Drouin A, McKindsey CW, Johnson LE (2009) Does Codium fragile ssp.
tomentosoides modify invertebrate communities in eelgrass meadows? Canadian
Aquatic Invasive Species Network (CAISN), Réunion générale annuelle et conférences, Halifax (N.-É.).
Chapitre 1. Introduction
1.1. Invasion biologique
Naturellement, les organismes se dispersent et tentent de coloniser de nouveaux espaces. Cependant, la colonisation d‟un nouveau milieu nécessite que celui-ci soit accessible et la présence de barrières écologiques, climatiques ou géographiques contribue à confiner les populations dans des régions distinctes. Dans certaines circonstances des invasions biologiques peuvent se produire, c.-à-d. lorsqu‟une espèce réussit à s‟introduire et à s‟établir (voire persister et proliférer) au-delà des barrières biogéographiques qui lui sont connues (Mack et al. 2000). Une invasion peut se produire via l‟élargissement de l‟aire de répartition d‟une espèce, soit lorsque les conditions climatiques d‟un lieu deviennent favorables, par exemple lors de la colonisation postglaciaire (Power et al. 1973). Des échanges biotiques peuvent aussi se produire lorsque des barrières physiques deviennent finalement franchissables. La formation de l‟isthme de Panama est un exemple de la disparition d‟un obstacle physique ayant permis la migration de plusieurs espèces de mammifères entre l‟Amérique du Nord et l‟Amérique du Sud (Woodburne 2010). De nouveaux territoires peuvent également être colonisés en raison de la capacité de certaines espèces à se disperser sur de longues distances au-delà de certaines barrières physiques. La biodiversité retrouvée sur les îles d‟origine volcanique est d‟ailleurs la conséquence d‟invasions biologiques liées à la capacité de certaines espèces à franchir activement (grande capacité migratoire de certains oiseaux) ou passivement (courants; utilisation d‟un transporteur, tels un autre organisme ou des débris flottants) sur de longues distances. Toutefois, depuis quelques décennies le terme «invasion biologique» est principalement utilisé pour définir les invasions résultant d‟activités humaines. Dans le but de favoriser la productivité ou la qualité des élevages et des cultures, pour des raisons esthétiques, ou encore de façon tout à fait fortuite, les activités humaines favorisent le déplacement d‟espèces au-delà de leurs limites biogéographiques. La fréquence, le nombre d‟individus, ainsi que le nombre d‟espèces impliquées dans les invasions biologiques associées aux activités humaines sont de loin supérieurs à ceux des processus naturels. L‟attention des
d‟abord attirée par Charles Elton (1958), qui mit en lumière certains mécanismes écologiques favorisant le succès d‟une invasion. Depuis, l‟étude des invasions biologiques liées aux activités humaines est considérée comme une sous-discipline dans le domaine de l‟écologie (Pyšek et Hulme 2009) et c‟est d‟ailleurs à ce type d‟invasion biologique que le reste de cette thèse fera référence.
1.2. Succès d’invasion
Certaines invasions biologiques sont bien connues pour avoir eu d‟importantes conséquences écologiques, par exemple la plante ornementale Miconia calvescens; la moule zébrée Dreissena polymorpha ou encore le serpent brun Boiga irregularis (Lowe et al. 2004), mais il est faux de croire que toutes les espèces introduites connaîtront un tel « succès ». En effet, le processus menant à l‟invasion est une succession d‟étapes, où des filtres abiotiques et biotiques influencent la réussite ou l‟échec d‟invasion d‟une espèce. Une espèce doit d‟abord survivre aux conditions du transport au-delà de son aire de distribution d‟origine (étape du transport), puis survivre aux conditions environnementales locales (étape de l‟introduction). Les espèces non indigènes qui parviennent à se naturaliser sont souvent des espèces généralistes qui tolèrent une grande gamme de facteurs physiques, tels que la température, la salinité ou encore certains contaminants. Ensuite, l‟espèce non indigène doit être en mesure de persister dans son nouvel environnement, ce qui implique de survivre au sein de la communauté hôte et de s‟y reproduire (étape de l‟établissement). Plusieurs mécanismes propres aux communautés sont connus pour faciliter ou inhiber l‟établissement d‟une espèce. L‟absence de prédateur ou de parasite avec lequel les espèces introduites ont coévolué peut favoriser l‟abondance et l‟ubiquité d‟une espèce introduite (Keane et Crawley 2002; Prenter et al. 2004). Certaines études ont montré que les communautés ayant une plus grande diversité offrent une plus grande résistance par rapport à l‟invasion puisque la plus grande compétition entre les espèces limiterait la disponibilité des ressources (Levine 2000; Mack et al. 2000). Toutefois, certaines fluctuations saisonnières peuvent survenir dans la disponibilité des ressources, ouvrant temporairement une fenêtre (voire niche) qui favoriserait le succès d‟invasion (Stachowicz et al. 1999; Stachowicz et al. 2002).
Certaines perturbations anthropiques sont connues pour influencer la disponibilité des ressources, telles l‟eutrophisation (disponibilité des nutriments) et la modification d‟habitat (disponibilité d‟espace), et peuvent donc contribuer à l‟établissement d‟espèces non indigènes (Bando 2006). De plus, les interactions directes ou indirectes entre les espèces introduites peuvent faciliter l‟établissement de nouvelles espèces non indigènes ou encore stimuler l‟efflorescence d‟une espèce non indigène déjà établie (Simberloff et Von Holle 1999; Ricciardi 2001; Grosholz 2005). En plus de la survie individuelle, l‟étape de l‟établissement implique la formation d‟une population autoviable. Une croissance rapide, une grande fécondité, la capacité de se propager de façon végétative, ou encore la reproduction sexuelle facultative sont des caractéristiques qui soutiennent le succès démographique d‟une population et qui sont souvent observées chez les espèces envahissantes (Valentine et al. 2007).
La pression de propagules, soit le nombre d‟individus, de fragments, ou de gamètes, arrivant à un lieu, peut également influencer le succès démographique d‟une espèce. Par exemple, l‟arrivée d‟une plus grande quantité de propagules à intervalle régulier aura pour effet de remédier à certains problèmes démographiques liés à la faible taille d‟une population initiale (effets de Allee) comme l‟isolement reproducteur ou la faible diversité génétique d‟une population (Leung et al. 2004). De plus, bien qu‟il existe un certain degré de stochasticité dans le processus d‟invasion, une plus grande pression de propagule peut augmenter les chances que l‟arrivée de propagules ait lieu à un moment où les conditions sont favorables à la survie de l‟espèce et subséquemment à son établissement (Carlton 1996). Bien que la pression de propagule à un lieu donné soit une bonne variable pour prédire le succès d‟invasion d‟une espèce (Colautti et al. 2006), la relation n‟est pas strictement linéaire et le mécanisme interagit avec d‟autres facteurs propres à la nature des espèces introduites et de la communauté hôte (Carlton 1996; Lonsdale 1999). Finalement, une invasion peut se terminer par l'étape de la dissémination, qui nécessite que l‟espèce soit en mesure de se disperser et de s‟établir au-delà du lieu d‟introduction initial. Cette dernière étape signifie que l‟espèce introduite est en mesure de passer plusieurs fois, avec succès, à
travers les filtres abiotiques et biotiques menant à l‟établissement au sein sa nouvelle aire géographique.
Il est estimé que seulement 10% des espèces introduites réussiront à persister dans un nouvel environnement en formant des populations autosuffisantes (Kolar et Lodge 2001). Après une rapide expansion géographique, certaines populations déclinent pour n‟être ensuite présentes qu‟à l‟état de populations isolées ou encore disparaître complètement (Simberloff et Gibbons 2004). Le succès d‟une invasion n‟est jamais garanti et chaque invasion comporte un caractère idiosyncrasique et stochastique, de plus, le succès peut varier dans le temps (Grosholz 2005) et dans l‟espace (Neira et al. 2005).
1.3. Espèces envahissantes et impacts écologiques
Parmi l‟ensemble des définitions d‟espèces envahissantes, il y a généralement consensus autour du fait que les espèces définies ainsi ont atteint le climax du processus d‟invasion biologique, c.-à-d. qu‟elles prolifèrent et se dispersent au-delà de leur lieu d‟introduction (Richardson et al. 2000; Kolar et Lodge 2001; Blackburn et al. 2011). Toutefois, ce ne sont pas toutes les définitions qui intègrent la notion d‟impacts écologiques ou économiques, c.-à-d. que la prolifération et la dispersion se font au « détriment de l‟environnement » (Mack et al. 2000). D‟un côté, le terme est lié au verbe latin invado qui signifie « marcher sur » ou « aller vers » (Gaffiot 2001) et donc il définit bien l‟effet biologique d‟une invasion, soit l‟expansion d‟une population au-delà de certaines barrières. D‟un autre côté, le terme signifie aussi « invasion », « attaque » et « usurpation » (Gaffiot 2001) et est utilisé pour définir une menace ou un fléau. Parce que le terme comporte une connotation négative comprise par l‟ensemble du public, il est suggéré qu‟il soit utilisé en faisant référence aux impacts négatifs (Davis et Thompson 2001). Afin d‟éviter toute ambiguïté dans l‟utilisation des termes reliés aux invasions biologiques, Colautti et MacIsaac (2004) proposent une terminologie faisant référence à la distribution et à la dominance des espèces introduites. Ainsi, une espèce envahissante serait 1) une espèce très répandue au-delà de son aire d‟origine, mais qui n‟est pas nécessairement dominante dans le lieu d‟introduction; 2) une
espèce qui est localisée à un certain endroit et qui y est dominante; ou 3) une espèce très répandue et dominante.
Il importe de reconnaître que toutes les espèces introduites ne sont pas toutes « mauvaises » (Schlaepfer et al. 2011; Simberloff 2003) et les espèces indigènes nécessairement « bonnes » (Carey et al. 2012). Dans le cadre de cette thèse, une espèce envahissante sera définie comme « toute espèce introduite qui occasionne ou est susceptible de causer des impacts écologiques ou économiques négatifs » (Williams et Smith 2007).
1.4. Conséquences écologiques des invasions
Un impact (voire changement, conséquence ou effet) se définit par la variation, soit par l‟augmentation ou la diminution, de la valeur d‟une variable choisie (Downes et al. 2002). Théoriquement, un impact peut survenir à chaque étape du processus d‟invasion, mais puisqu‟une invasion n‟est souvent détectable qu‟une fois l‟étape de dispersion atteinte, c‟est généralement l‟impact des espèces qui réussissent à s‟établir et à devenir dominante qui est évalué. Les impacts peuvent être mesurés à tous les niveaux biologiques (Parker et al. 1999), soit au niveau individuel (croissance, morphologie); génétique (hybridation, interférence dans le flux génique); populationnel (densité, démographie); des communautés (diversité, richesse spécifique); ou écosystémique (disponibilité des ressources, régimes de perturbations, changement physique de l‟habitat). Souvent, une seule variable est prise en compte dans les études d‟impact et il n‟est pas toujours évident d‟évaluer les effets indirects sur les autres niveaux biologiques ou leurs interactions.
Les invasions biologiques peuvent réduire la biodiversité, modifier les habitats, et transformer les écosystèmes en un état instable ou encore moins désirable pour les activités humaines. Elles sont d‟ailleurs fréquemment citées comme l‟une des plus importantes causes de la perte de biodiversité à l‟échelle mondiale (Vitousek et al. 1997; Sala et al. 2000). Toutefois, il est important de considérer qu‟elles peuvent être facilitées ou associées à certaines perturbations de nature anthropique (Bando 2006) et donc ne pas être la cause directe des changements observés au sein d‟une communauté (Didham et al. 2005; Bauer
2012). De plus, bien que les impacts néfastes associés à certaines invasions biologiques justifient la plupart des études faites sur le sujet, les conséquences demeurent méconnues pour plusieurs espèces introduites (Williams 2007) ou encore répertoriées via des corrélations, sans être testées expérimentalement (Thomsen et al. 2009).
Les écosystèmes marins peuvent être affectés par plusieurs mécanismes biologiques liés au processus d‟invasion. Parmi ceux-ci figure la compétition pour l‟espace et les nutriments, pouvant mener à des changements de la composition des macrophytes indigènes (Ceccherelli et Cinelli 1997; Stafford and Bell 2006). La prédation par une espèce exotique sur les espèces indigènes peut aussi entraîner des effets importants sur les niveaux trophiques inférieurs (Albins et Hixon 2008). Les changements dans la structure de l‟habitat peuvent modifier certaines caractéristiques physiques et chimiques de l‟habitat d‟origine, par exemple lors de la végétalisation d‟habitats normalement dénudés (McKinnon et al. 2009) ou encore de la dévégétalisation d‟aires normalement colonisée par des macrophytes (voir Williams 2007). De plus, la formation de salissures sur les structures et les organismes en culture peuvent avoir des répercussions importantes sur la production aquicole (Fitridge et al. 2012).
1.5. Détection des impacts écologiques liés aux invasions
Pour les écologistes, l‟étude des impacts des espèces introduites se veut un moyen d‟acquérir des connaissances sur le fonctionnement des communautés et des écosystèmes. L‟ampleur et la direction des changements observés servent à décrire les liens et l‟équilibre qui existent entre les espèces et leur environnement. L‟étude des effets des espèces envahissantes peut aussi contribuer à atteindre des objectifs de conservation et permettre d‟éviter des impacts majeurs sur l‟économie et la santé humaine. Ultimement, ce type d‟étude pourrait permettre de prédire quelles espèces auront des effets nuisibles afin d‟en prévenir l‟introduction ou encore parvenir à les détecter avant qu‟elles ne soient dominantes pour en faire l‟éradication (Simberloff et Gibbons 2004). Il est à noter que le caractère nuisible d‟une espèce envahissante comporte un aspect subjectif, dans le sens où il réfère
généralement à des effets défavorables pour les activités humaines ou encore sur des espèces ou habitats pour lesquels l‟on accorde une certaine valeur.
Idéalement, la détection d‟impacts écologiques doit se faire de façon à distinguer les effets d‟une perturbation des changements associés à des processus naturels (Downes et al. 2002). L‟utilisation d‟un plan d‟expérience de type BACI (Before/After, Control/Impact), idéalement associé à une expérimentation (ajout ou retrait de l‟espèce non indigène afin de déterminer des liens de causes à effets), se veut une méthode rigoureuse pour évaluer des changements écologiques associés aux invasions biologiques (Parker et al. 1999; Downes et al. 2002). Toutefois, ce type de plan est souvent impossible à réaliser dans le cas des invasions biologiques, notamment parce que les invasions sont souvent non prévisibles et que l‟invasion est largement répandue lorsqu‟arrive le moment d‟en évaluer les impacts, ou qu‟il n‟existe souvent pas de données historiques pour décrire l‟habitat avant l'invasion.
Certains facteurs utilisés pour déterminer la direction et la magnitude d‟un impact lié à une invasion biologique sont communs à plusieurs études, soit l‟étendue occupée par l‟espèce non indigène, l‟abondance et l‟effet per capita (Olenin et al. 2007; Thomsen et al. 2011). Ces éléments peuvent être facilement quantifiables, cependant il demeure difficile de démontrer ou encore d‟évaluer si les changements observés auront un effet sur l‟intégrité des communautés indigènes, c.-à.-d. le maintien des relations fonctionnelles entre les espèces, ou encore sur le maintien des fonctions écosystémiques. De plus grands changements écologiques sont attendus si l‟espèce introduite est taxonomiquement distincte des espèces indigènes, autrement dit, lorsque l‟espèce s‟établit au sein d‟une communauté dans laquelle elle occupe une fonction écologique différente des espèces indigènes (Ricciardi et Atkinson 2004). Néanmoins, chaque invasion possède un caractère unique et donc un impact se détermine aussi selon certains traits de l‟espèce envahissante, de la composition des espèces indigènes, de la disponibilité des ressources et des conditions abiotiques propre au lieu d‟invasion (Thomsen et al. 2011). Tous ces facteurs peuvent varier spatialement et temporellement. Ainsi, il peut être difficile d‟évaluer les effets à moyen et long terme d‟une invasion. Par exemple, une espèce introduite peut être très
abondante au début de l‟invasion et ainsi avoir un impact important sur la communauté hôte, pour ensuite devenir plus rare quelques années plus tard et avoir un impact négligeable (Simberloff et Gibbons 2004; Strayer et al. 2006). À l‟inverse, l‟impact d‟une espèce introduite peut initialement être perçu comme négligeable avant de devenir néfaste suite à des changements au sein de la communauté hôte (Grosholz 2005). Spatialement, il peut également être difficile de quantifier les impacts d‟une invasion, car l‟expérimentation se fait souvent à petite échelle ou encore il n‟est pas possible de prendre des mesures de façon à couvrir toute l‟étendue où une espèce non indigène est établie.
1.6. Impacts écologiques des algues envahissantes
La progression des impacts liés aux algues introduites est typique des producteurs primaires. Il y a d‟abord compétition directe (lumière et nutriment) ou indirecte (via préemption pour l‟espace) avec les espèces indigènes, pouvant mener à une monopolisation de l‟espace par l‟espèce introduite. La dominance de l‟espèce introduite peut alors induire une plus faible abondance et une diminution de la richesse spécifique des macrophytes indigènes (Schaffelke et Hewitt 2007; Williams et Smith 2007; Thomsen et al. 2009).
Les changements de composition des macrophytes peuvent aussi influencer les invertébrés qui y sont associés. Par exemple, les algues introduites ont souvent une palatabilité moindre et ne sont donc pas préférentiellement sélectionnées par les herbivores, qui peuvent néanmoins être en mesure de les consommer (Williams et Smith 2007). Par contre, les algues introduites peuvent soutenir une plus forte abondance d'épiphytes, qui elles offrent une meilleure palatabilité que les algues elles-mêmes (Williams et Smith 2007). Des études ont rapporté que des changements d‟assemblages de poissons et d‟invertébrés sont associés aux algues introduites, incluant une diminution de l‟abondance des animaux indigènes (voir Schaffelke et Hewitt 2007; Williams et Smith 2007). Une méta-analyse a toutefois montré que si l‟ampleur des changements détectés au sein des assemblages de macrophytes pouvait parfois être de magnitude importante et négative, celle des assemblages d‟animaux était généralement non significative (Thomsen et al. 2009).
Les changements de composition des macrophytes peuvent également influencer la structure physique de l‟habitat. Les algues introduites peuvent induire des changements architecturaux, modifier le taux d‟accumulation de sédiments, ou encore influencer la physico-chimie du substrat (Wallentinus et Nyberg 2007). Théoriquement, les changements au niveau des communautés et de l‟habitat peuvent influencer certaines fonctions écosystémiques, par exemple la production primaire, les flux de nutriments et subséquemment la structure trophique, mais il existe encore peu de preuves empiriques à ce sujet (mais voir Rossi et al. 2011; Byers et al. 2012).
1.7. Synopsis biologique de Codium fragile ssp. fragile
D‟origine asiatique, la macroalgue verte Codium fragile ssp. fragile (synonyme de ssp.
tomentosoides, Provan et al. 2008; ci-après Codium) s‟est dispersée au cours du dernier
siècle en Australie, en Nouvelle-Zélande, en Europe et en Amérique du Nord (Trowbridge 1998). Codium fut signalé pour la première fois sur la côte Atlantique en 1957 dans le détroit de Long Island à New York (Bouck et Morgan 1957). Les vecteurs les plus probables de l‟arrivée de Codium sur la côte est de l‟Amérique du Nord seraient le transport maritime ou le transfert d‟huîtres pour l‟aquaculture à partir des côtes européennes (Carlton et Scanlon 1985). Depuis, l‟espèce a proliféré et est maintenant présente de la Caroline du Nord jusqu'au golfe du Saint-Laurent (Garbary et Jess 2000).
Comme c‟est le cas pour plusieurs espèces envahissantes, Codium peut s‟adapter à une grande gamme de conditions environnementales. Codium tolère des salinités de 12 à 42 ‰ ainsi que des températures de -2 à 33°C, ce qui lui permet de survivre autant en milieu estuarien que marin ainsi qu‟aux températures hivernales (Hanisak 1979; Trowbridge 1998). Codium possède également une grande résistance à la dessiccation (Schaffelke et Deane 2005) et peut croître en zone infralittorale jusqu‟à une profondeur de 15 m (Trowbridge 1998). Cette algue se reproduit essentiellement par parthénogénèse ou de façon végétative à partir d‟un utricule isolé (c.-à-d. une cellule filamenteuse formant le
thalle de Codium), d‟un crampon ou d‟un fragment de thalle (Chapman 1999; Nanba et al. 2002; Garbary et al. 2004). La reproduction sexuée n'a jamais été observée in situ ou in
vivo chez cette espèce (Trowbridge 1998). Il est même suggéré que Codium ne produise pas
de gamète mâle (Prince et Trowbridge 2004). Codium se développe sur les substrats durs tels la roche-mère, les blocs rocheux, les cailloux, ainsi que sur les coquilles de mollusques et de crustacés, morts ou vivants (Trowbridge 1998). Dans les milieux meubles, Codium est capable de s‟ancrer et de croître le long de l‟axe des rhizomes d‟angiospermes marines, telle que la zostère marine, Zostera marina (Garbary et al. 2004).
1.8. Impacts écologiques de Codium
Codium figure parmi les algues introduites les plus étudiées à travers le monde (Williams et
Smith 2007). Compte tenu de sa grande plasticité phénotypique, Codium peut croître dans un large éventail d'habitats. Toutefois, avant le début des travaux associés à ce projet les connaissances sur les impacts écologiques de Codium provenaient surtout d'études faites sur la côte rocheuse du nord-ouest de l‟Atlantique. Ce biais peut s‟expliquer par le fait que, contrairement à d‟autres endroits dans le monde où l‟espèce est établie, il n'existe aucune espèce du genre Codium dans ce secteur et donc sa présence y passe plus difficilement inaperçue (Trowbridge 1998). De plus, Codium y a connu une prolifération considérable, en remplaçant les laminaires indigènes ici et là sur près de 900 km de côte (Scheibling 2001).
Le long de la côte est américaine, Codium est reconnu comme une espèce préemptive qui bénéficie de la présence de zones dénudées engendrées par l‟interaction entre l‟oursin vert (Strongylocentrotus droebachiensis) et les laminaires (Scheibling 1986; Scheibling et al. 1999; Scheibling 2001). À la suite de son établissement, la présence de Codium inhibe le recrutement des algues indigènes (Scheibling et Gagnon 2006). Cette modification des assemblages algaux influence les interactions biotiques. Codium possède des défenses chimiques contre les herbivores et est moins nutritif que les algues indigènes (Lyons et al. 2007), ainsi donc certaines espèces indigènes, tels le gastéropode Lacuna vincta et l‟oursin
vert, ne le consomment pas préférentiellement (Chavanich et Harris 2004; Lyons et Scheibling 2007). Toutefois, certaines espèces sont spécialisées pour se nourrir de Codium, comme les sacoglosses Placida dendritica et Elysia maoria, qui peuvent faire diminuer localement les populations de Codium (Trowbridge et Todd 2001; Trowbridge 2002; Harris et Jones 2005).
Codium diffère d'autres espèces d‟algues retrouvées dans l‟étage infralittoral des côtes de
l‟Atlantique Nord-Ouest, notamment par la complexité de son thalle et sa capacité à former des couverts d'algue très dense. Ces caractéristiques pourraient créer un habitat avec des caractéristiques physiques différentes de l‟habitat indigène (plus faible luminosité, plus grande turbidité) et ainsi expliquer la diminution du recrutement de l‟achigan de mer (Tautogalabrus adspersus) dans les peuplements de Codium (Levin et al. 2002), la grande diversité d‟épiphytes associée à Codium (Harris et Jones 2005; Schmidt et Scheibling 2006) ainsi que les différences du recrutement d‟algues et l‟utilisation de l‟habitat benthique par la faune mobile (Schmidt et Scheibling 2007).
1.9 Problématique
Les herbiers marins (formation d‟un peuplement de plantes vasculaires submergées) sont reconnus comme étant des habtiats ayant une grande valeur écologique. Les herbiers marins procurent une panoplie de services écologiques, tels que la production primaire, l‟implication dans le cycle des nutriments, la stabilisation des sédiments et la contribution à la structure trophique des mileux adjacents (Orth et al. 2006). De plus, les herbiers marins offrent un habitat essentiel pour plusieurs espèces en zone côtière (Hemminga et Duarte 2000). La structure complexe engendrée par le feuillage sert d‟habitat à un bon nombre d‟espèces, qui y retrouvent refuge et nourriture. Certains auteurs ont déjà montré l‟importance des herbiers comme pouponnière, autant pour les invertébrés que pour les poissons (Orth et al. 1984, Boström et Bonsdorff 2000, Lazzari et al. 2003). À l‟heure actuelle, plusieurs stresseurs, dont l‟augmentation de la sédimentation, l‟eutrophisation, les perturbations physiques, les maladies, les pratiques de pêches et les espèces envahissantes
Dans l‟est du Canada, les herbiers de zostère se développent généralement dans des zones de moins de deux mètres de profondeur et subissent plusieurs perturbations naturelles, telles la dessication, les vagues et l‟action des glaces, qui influencent la densité, la taille des tiges et la biomasse foliaire (Grant et Provencher 2007). Les études faites dans l‟est du Canada démontrent que les herbiers de zostère marine peuvent avoir une plus grande diversité de gastropodes, de crustacées et de polychètes que d‟autres habitats côtiers à fond meuble (ex. bancs coquillers) et que les juvéniles d‟espèces de poissons pélagiques utilisent ce type d‟habitat (Gotceitas et al. 1997, Grant et Provencher 2007).
Les impacts de Codium au niveau des communautés ont surtout été étudiés dans les zones rocheuses, bien que l‟espèce puisse aussi s‟établir dans des zones à fond meuble tel les bancs coquillers ou les herbiers marins. Des études qui ont comparées les impacts des espèces envahissantes dans différent habitats ont observées les mêmes conséquences entre les divers habitats envahis (voir Alvarez et Cushman 2002). Toutefois, bien qu‟une même espèce envahissante puisse avoir des répercussions similaires dans des milieux différents, il peut être hâtif de généraliser les effets d‟une espèce à tous les endroits envahis. Des différences entre la composition des communautés et les conditions environnementales font en sorte qu‟il est possible que certains des effets observés varient significativement entre deux milieux. L‟invasion d‟algues dans les herbiers marins est un phénomène relativement bien documenté, en particulier celle de l‟algue verte Cauplerpa taxifolia dans la mer Méditerranée. Par contre l‟invasion de Codium dans les herbiers marins des îles de la Madeleine revêt un caractère inhabituel en raison de son mode d‟ancrage sur les rhizomes de la zostère. En effet, les cas d‟algues exotiques répertoriées dans des milieux meubles font surtout état d‟ancrage sur des cailloux (Sargassum muticum, den Hartog 1997), de croissance épibionte (Codium, Thomsen et McGlathery 2005; Gracilaria vermiculophylla, Byers et al. 2012), ou encore de croissance épiphyte sur les feuilles (Undaria pinnatifida, Hewitt et al. 2005). Quant à elle, les algues du genre Caulerpa ne forment pas de crampon typique aux macroalgues, mais plutôt un système de rhizomes et rhizoïdes leur permettant de s‟ancrer directement dans les sédiments (Ceccherelli et Cinelli F 1999; Stafford et Bell 2006; Piazzi et Balata 2008). Le cas le plus similaire à celui exposé dans cette thèse est sans doute celui de S. muticum, qui a la possibilité de s‟ancrer au sein de la rhizosphère
former par Z. marina (Tweedley et al. 2008). Par contre, il est à noter que cette dernière étude fait mention de fragments dérivants qui s‟enfouissent en partie dans les sédiments et donc le maintien des populations dépend surtout de l‟apport de ces fragments.
L‟objectif principal de ce projet de recherche était d'étudier les impacts de Codium dans les herbiers marins où l‟algue y est épiphyte sur les rhizomes. Les principaux résultats de ce travail sont inclus dans trois chapitres, qui se détaillent comme suit :
Le chapitre 2 vise à étudier le recrutement et l‟établissement de Codium à l‟intérieur des herbiers marins. Les patrons de recrutement ainsi que certains facteurs environnementaux peuvent définir la distribution de Codium au sein des herbiers marins et donc permettre d‟estimer son potentiel d‟expansion au sein de ce type d‟habitat.
Le chapitre 3 cherche à déterminer l‟effet de Codium sur la zostère marine. Le couvert algal formé par Codium peut modifier les conditions de luminosité et nuire à la croissance des plants de zostères ainsi qu‟influencer la densité des herbiers.
Le chapitre 4 vise à connaître l‟influence de Codium sur les invertébrés et les poissons associés aux herbiers marins. La morphologie plus complexe de Codium, ainsi que la densité des peuplements peuvent influencer certains paramètres physiques associés au couvert de macrophytes et influencer directement les organismes qui s‟y associent, en plus d‟offrir un habitat distinct aux organismes plus mobiles.
Afin de dresser un portrait réaliste des impacts de Codium, les résultats de cette thèse découlent essentiellement d‟observations sur le terrain et de manipulations in situ. L‟élaboration de chaque chapitre s‟est faite dans l‟optique d‟en arriver à savoir si Codium satisfait les critères d‟une espèce envahissante au sein des herbiers marins, soit d‟être en
mesure d‟y proliférer et de se disperser, mais aussi de savoir si Codium pouvait causer des impacts négatifs importants à la communauté indigène.
Chapitre 2. Dynamics of recruitment and establishment
of an invasive seaweed: the influence of propagule
sources and environmental factors on Codium fragile
within an eelgrass habitat
2.1. Résumé
Connaître la distribution potentielle (c.-à-d. l'abondance et l'étendue) d'une espèce envahissante est d'un grand intérêt pour estimer son impact sur une communauté hôte. La plupart des études ont mis l'accent sur l‟étendue potentielle des populations d'espèces envahissantes à l'échelle régionale, mais peu d‟études relatent le succès d‟établissement des espèces envahissantes à des échelles plus locales. Cette étude examine comment le recrutement de l‟algue verte Codium fragile ssp. fragile (ci-après Codium) varie spatialement et quels sont les facteurs environnementaux associés à son établissement au sein d‟herbiers à zostère marine (Zostera marina). Des blocs de recrutement (ci-après blocs) ont été utilisés afin de standardiser le suivi du nombre de recrues, de juvéniles et d‟adultes de Codium, à deux échelles spatiales (grande résolution, 720 × 240 m2 ; petite résolution, 60 × 24 m2) pendant deux ans. Certains facteurs environnementaux (profondeur; vélocité) ont été mesurés pour chaque bloc, tandis que d'autres (lumière; température) ont été évalués pour un sous-ensemble de 12 blocs. Les caractéristiques des macrophytes autour des blocs ont également été mesurées (densité de tige de zostère; longueur des tiges de zostère; biomasse de Codium). Le recrutement a été observé sur tous les blocs ou sur des structures à proximité de ceux-ci et provenait principalement de propagules unicellulaires (soit de gamètes femelles ou des utricules). Le recrutement variait selon les saisons et était plus faible au cours de l‟été. À grande résolution, le recrutement n'a pas montré de tendance spatiale distincte (ex. gradient ou parcelle), mais le même schéma spatial de recrutement a été observé entre les dates d'échantillonnage, ce qui suggère qu'il y a des secteurs à forte incidence pour le recrutement à cette échelle. À petite résolution, le recrutement était uniforme sur tous les blocs. Pour les deux échelles spatiales, l'abondance de tous les stades de Codium était positivement corrélée à la densité de la zostère marine, tandis que les
densités de juvéniles et d'adultes étaient fortement corrélées à la biomasse de Codium présente sur les blocs à la date d'échantillonnage précédente. Le nombre total de frondes trouvées sur un bloc à la fin du suivi était positivement corrélé avec le nombre cumulé de recrues, plus particulièrement à petite résolution. Cependant, sur certains blocs à grande résolution où des recrues avaient été dénombrées, aucune trace de Codium n‟était présente à la fin de l‟expérience, ce qui suggère que certains facteurs environnementaux semblent limiter la distribution et l'abondance Codium dans les herbiers de zostère. Dans l‟ensemble, les résultats de la présente étude, où le substrat n‟était pas un facteur limitant, ont démontré que l‟expansion de Codium dans les herbiers de zostère marine peut être limitée et la saturation des emplacements adéquats peut prendre plusieurs années.
2.2. Abstract
Knowing the potential distribution (i.e. abundance and spatial extent) of an invasive species is of prime interest to estimate its impacts on a recipient community. Most previous studies have focused on the potential spatial extent of invasive species populations at regional scales, but little is known on how species successfully recruit and establish at more local scales. In this study, we examined how recruitment of the green alga Codium fragile ssp.
fragile (hereafter Codium) can vary spatially and what environmental factors are associated
with Codium establishment in eelgrass (Zostera marina) beds. Standardized recruitment blocks were used to monitor the number of Codium recruits, juveniles and adults at coarse (720 × 240 m2) and fine (60 × 24 m2) spatial scales over two years. Several environmental factors (depth, relative water flow) were measured at each block, while others (light and temperature) were assessed at a subset of 12 blocks. The attributes of the surrounding macrophyte assemblage (eelgrass density, eelgrass length, Codium biomass) were also measured. Recruitment occurred on all blocks or nearby artificial structures (i.e., buoys) and mainly originated from unicellular propagules (i.e. female gametes or utricles). Seasonal variation was observed in recruitment, which was lower during the summer season. At the coarse scale, recruitment did not show any distinct spatial pattern (e.g., gradient or patch), but the same spatial pattern of recruitment was observed among sampling dates, suggesting that there are some “hotspots” for recruitment at this scale. At
the fine scale, recruitment was uniform over all the blocks. The abundance of all stages of
Codium were positively correlated to eelgrass density, while the densities of juveniles and
adults were well predicted by the biomass of Codium on blocks at the previous sampling date at both spatial scales. In general, the total number of fronds found on a block at the end of the experiment was positively correlated with the cumulative number of recruits, especially at the fine scale. However, on some blocks at the coarse scale recruitment occurred, but recruits never grew, suggesting that some environmental factors seem to limit
Codium distribution and abundance in eelgrass beds. Overall, results of the present study,
where suitable substratum was not a limiting factor, showed that expansion of Codium within eelgrass beds can be limited and the saturation of suitable locations may take several years.
2.3. Introduction
The overall impact of an invasive species depends on many species attributes but is ultimately linked to its average abundance and spatial extent (Kolar and Lodge 2001; Olenin et al. 2007; Thiele et al. 2010). In contrast, local impacts depends on the local population dynamics which will also be a key determinant of the scales at which organisms interact with their environment, and thus may better predict the impacts of nascent populations of invasive species within an invaded locality. The spread or expansion of a species‟ distribution is logically a function of time since its initial establishment within a given locality, although spread does not necessarily follow a simple diffusive pattern at most spatial scale. Recruitment of propagules is rarely uniform as dispersal is never uniform, and the suitable habitats required for establishment are heterogeneously distributed across the landscape (Vadas et al. 1992; Thomsen et al. 2006). Subsequent interactions with other species and environmental factors facilitate or inhibit their recruitment (i.e., arrival of new individuals in a community) and ultimately their establishment (i.e., persistence of reproducing populations) in the new environment (Ruiz et al. 2000; Keane and Crawley 2002; Colautti et al. 2004; Bando 2006; Altman and Whitlatch 2007). The eventual local extent of a population of invasive species will thus
depend on coupled dispersal-recruitment dynamics and subsequent interactions with the recipient community and environment.
Most previous studies on the potential spatial extent of invasive species populations have focused on secondary spread of invasive species at regional scales with the goal of predicting the rate of range expansion and identifying vectors of dispersion (e.g. Lyons and Scheibling 2009; Johnson et al. 2012). In contrast, there is little information on how species successfully disperse and establish at more local scales (but see Sepulveda and Marczak 2012) and how recruitment dynamics might affect the local abundance of an invader, and ultimately, contribute to further regional spread.
In this study we examine the local (i.e. within an invaded habitat, < 1km2) invasion dynamics of the green seaweed Codium fragile ssp. tomentosoides (synonymous of ssp.
fragile, Provan et al. 2008, hereafter Codium) in eelgrass beds. Our understanding of the
invasion biology of Codium has been based mostly on studies done on rocky shores where differences in the composition and abundance of mobile macrofauna, epiphytes and turf algae have been documented between Codium and native algae (Harris and Jones 2005; Schmidt and Scheibling 2006; Schmidt and Scheibling 2007). Codium is competitively superior to native algae, principally by occupying primary space and preventing the colonization of native seaweeds (Scheibling and Gagnon 2006). Codium can also colonize soft-bottom habitats where it can attach to small rocks and shells – indeed, the attachment and subsequent removal of commercial shellfish via the increased hydrodynamic drag forces due to Codium has led to its common name, the “oyster-thief”. In certain localities,
Codium can also attach to the rhizomes of eelgrass (Garbary et al. 2004), effectively acting
as an epiphyte. However, rhizomes appear limited in their ability to provide a sufficiently stable attachment surface for Codium, and as the alga grows, dislodgment is more likely to occur, as observed on rocky substrata (D'Amours and Scheibling 2007). In contrast to rocky shore environments, these unattached plants can persist within the hydrodynamically low-energy environments of eelgrass habitats and continue contributing ecologically and demographically.
Recruitment in Codium is particularly complex due to its multiple reproductive mechanisms that operate over different spatial and temporal scales. Sexual reproduction has never been demonstrated, and in spite of occasional reports of male thalli, vegetative propagation occurs in several ways: settlement of parthenogenic female gametes (Trowbridge 1998; Prince and Trowbridge 2004); attachment of isolated utricles (the loosely-compacted filaments that make up the thallus); and attachment of vegetative buds or thallus fragments (Fralick and Mathieson 1972; Trowbridge 1998; Nanba et al. 2002). While Codium buds or fragments may disperse over several kilometers (Gagnon et al. 2011), female gametes apparently have lower mobility and swim for only a few minutes after they have been released (Churchill and Moeller 1972), and thus settlement should occur close (within meters) to adults. However, adult specimens of Codium can be dislodged, drift and form unattached populations within eelgrass beds (A. Drouin, pers. obs.). As with rafting seaweeds (e.g., Durvillaea antarctica; Thiel and Gutow 2005), these drifting Codium may then act as a source of propagules (e.g., female gametes) and allow that type of propagule to be dispersed over greater distances than it would be from attached thalli. Codium‟s potential dispersal range thus depends on reproductive mode, and will vary according to environmental conditions.
As for other invaders, Codium has traits that allow it to survive in a large range of habitats, including tolerance to large fluctuations of salinity, temperature and desiccation (Malinowski and Ramus 1973; Trowbridge 1998; Kim and Garbary 2007). However, within invaded habitats, Codium may still be restricted to or concentrated within microhabitats where environmental stress is minimal or conditions best for growth and survival. In soft-bottom habitats, shading by seagrass leaves and the availability of stable substrata may limit Codium distribution (Malinowski and Ramus 1973) and high sedimentation rates and low light levels may limit its growth (Thomsen and McGlathery 2007). This situation appears to occur in îles de la Madeleine (eastern Canada), where
Codium can form extensive stands within eelgrass (Zostera marina) beds (Simard et al.