Nouvelle stratégie de préparation d’esters d’acides
2,3,3-triarylacryliques et application à la synthèse de
composés polyphénoliques
Thèse
Sébastien Cardinal
Doctorat en chimie
Philosophiae Doctor (Ph. D.)
Québec, Canada
© Sébastien Cardinal, 2016
Nouvelle stratégie de préparation d’esters d’acides
2,3,3-triarylacryliques et application à la synthèse de
composés polyphénoliques
Thèse
Sébastien Cardinal
Sous la direction de :
Résumé
Un nouveau composé polyphénolique formé durant la production du sirop d’érable a été rapporté en 2011. Ce composé, nommé québécol en l’honneur de son origine géographique, a montré jusqu’à maintenant des propriétés biologiques prometteuses. L’approfondissement de son étude a cependant été grandement limité par sa faible abondance dans le sirop d’érable. Afin de contourner ce problème, notre groupe s’est intéressé au développement d’une voie synthèse permettant d’effectuer la préparation de ce produit naturel. En plus d’accéder au québécol, nous voulions également étendre l’application de cette même stratégie à la synthèse d’une variété d’esters d’acides 2,3,3-triarylacryliques, un type d’oléfine tétrasubstituée dont la préparation a été peu explorée et comporte plusieurs défis.
La présente thèse rassemble l’ensemble de nos progrès réalisés ces dernières années dans la synthèse d’esters d’acides 2,3,3-triarylacryliques, la synthèse du québécol et de ses dérivés, ainsi que dans l’évaluation de l’activité anti-inflammatoire de ce produit naturel et d’autres structures apparentées.
Dans un premier temps, notre stratégie de synthèse ayant mené à la synthèse totale du québécol sera d’abord présentée. Elle fait intervenir comme séquence clé la préparation d’un composé gem-dibromoalcène par homologation C-1 d’un -cétoester, suivie de l’installation de deux groupements aryles par des réactions de Suzuki-Miyaura. Nous démontrerons par la suite l’application de cette même séquence à la préparation de cinq classes diverses d’esters d’acides 2,3,3-triarylacryliques.
Dans un second temps, l’évaluation de l’activité anti-inflammatoire du québécol et de plusieurs composés apparentés sera détaillée. Au passage, la préparation de certains dérivés sera discutée, notamment celle de l’isoquébécol, un isomère de constitution inédit. Finalement, les différentes relations structure-activité tirées de ces résultats et permettant d’orienter les recherches futures seront présentées.
Abstract
A new polyphenolic compound was found in 2011 in maple syrup. It is formed during maple syrup processing of Acer saccharum sap. This compound, named quebecol, is structurally similar to common bioactive agents and showed activity against breast and colon cancer cell lines in some preliminary in vitro biological assays. However, the study of this compound has as yet been limited by its low abundance in its vegetal source. To facilitate further research on this compound by solving its availability problem, we decided to work on the total synthesis of quebecol. In addition to getting access to this natural product, we were interested in developing a general synthetic strategy to produce a variety of 2,3,3-triarylacrylic acid esters, a class of tetrasubstituted olefins whose preparation has not been much explored, and involves many challenges.
The following thesis will present our group’s progress over the last years on the synthesis of 2,3,3-triarylacrylic acid esters, the preparation of quebecol and its derivatives, and the evaluation of the anti-inflammatory activity of quebecol and several related structures.
First, we will present our synthetic strategy to form quebecol. It involves two key steps. The first is a C-1 homologation reaction on an -ketoester to produce the dibromoalkene analog. This product is used in the second key step: a double Suzuki-Miyaura cross-coupling with the appropriate arylboronic acid. We will also discuss the extension of this strategy to the development of a methodology for the preparation of 2,3,3-triarylacrylic acid esters with one, two, or three different aryl groups.
Secondly, we will present our evaluation of the anti-inflammatory activity of quebecol and its derivatives. We will discuss the synthesis of some of these derivatives, including isoquebecol (an unprecedented isomer). Finally, we will establish a series of structure-activity relationships regarding the anti-inflammatory activity of quebecol and its general structure by comparing the tested compounds.
Table des matières
Résumé ... iii
Abstract... iv
Table des matières ... v
Liste des tableaux ... x
Liste des figures ... xii
Liste des schémas ... xvi
Liste des abréviations ... xix
Remerciements ... xxiii
Avant-propos et organisation de la thèse ... xxvi
Chapitre 1. Introduction ... 1
1.1. Mise en contexte ... 1
Les aliments fonctionnels et les nutraceutiques ... 1
Contexte actuel et définitions ... 1
Revisiter les aliments traditionnels ... 2
Le sirop d’érable ... 3
La production acéricole au Québec et au Canada ... 3
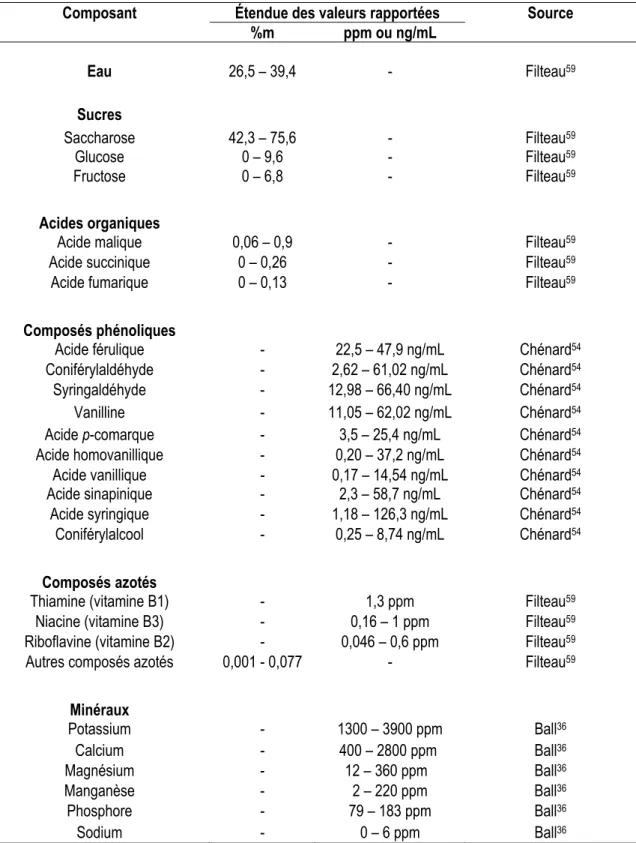
Composition chimique : portrait global ... 6
Les constituants aromatiques du sirop d’érable ... 9
Les composés phénoliques et polyphénoliques... 10
Généralités ... 10
Importance biologique... 12
Les composés phénoliques du sirop d’érable ... 12
Le sirop d’érable comme aliment fonctionnel ou source de nutraceutiques ... 14
Qualités nutritionnelles générales ... 14
Prévention de certaines pathologies ... 15
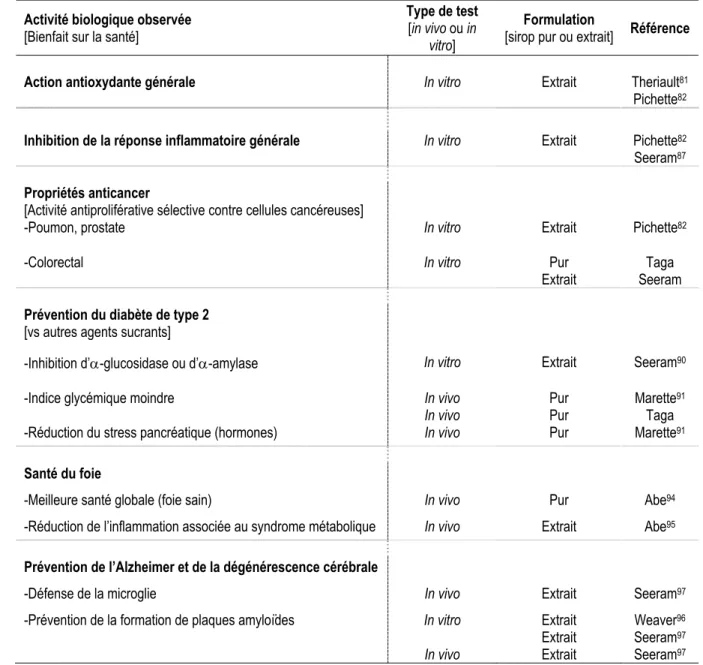
Programme de recherche du groupe de Seeram : exploration du potentiel du sirop d’érable comme aliment fonctionnel et source de nutraceutiques ... 19
1.2. Objets de recherche : fondements et problématiques ... 21
Le québécol ... 21
Origine ... 21
Intérêt structurel ... 22
Activité biologique ... 24
Problématiques ... 25
Intérêt de recherche dans le groupe Voyer ... 26
Les esters d’acides 2,3,3-triarylacryliques ... 28
Importance et intérêt des motifs 1,2,2-triaryléthènes ... 28
Limitations des voies de synthèse rapportées ... 35
1.3. Objectifs ... 37
1.4. Méthodologies et précédents ... 41
Stratégie de synthèse : préparation du québécol et d’esters d’acides 2,3,3-triarylacryliques ... 41
Analyse rétrosynthétique ... 41
Installation de la fonction gem-dibromoalcène ... 44
Le couplage croisé de Suzuki-Miyaura ... 49
Étude de l’activité anti-inflammatoire ... 63
L’inflammation ... 63
L’expression de gènes par la voie NF-B ... 65
Évaluation de l’activité anti-inflammatoire du québécol et de molécules dérivées avec des cellules macrophages stimulées aux LPS ... 69
1.5. Organisation des chapitres ... 73
Chapitre 2. Total synthesis of quebecol [Article I] ... 74
2.1. Avant-propos de l’article... 75
2.2. Résumé de l’Article I ... 76
2.3. Contenu de l’Article I ... 77
Abstract ... 77Introduction ... 77
Synthetic strategy ... 78
Results ... 79
Preparation of ethyl 3,3-dibromo-2-(4-benzyloxy-3- methoxyphenyl)propenoate (2.3) ... 79
Preparation of 4-benzyloxy-3-methoxyphenylboronic acid (2.4) ... 79
Double Suzuki–Miyaura reaction for the preparation of ethyl 2,3,3-tri-(4-benzyloxy-3-methoxyphenyl)propenoate (2.2) ... 80
Preparation of quebecol (2.1) from ethyl 2,3,3-tri-(4-benzyloxy-3- methoxyphenyl)propenoate (2.2) ... 81
Conclusion ... 82
Acknowledgments ... 83
Supplementary data ... 83
General Information ... 83
Preparation and characterization of compounds 2.1-2.11 ... 83
Detailed characterization of compound 2.2 ... 88
Detailed characterization of compound 2.11 ... 91
Detailed characterization of compound 2.1 ... 94
References ... 108
2.4. Résultats et discussions complémentaires ... 109
Voies de synthèse alternatives explorées ... 109
Formation du motif 1,2,2-triaryléthène par une séquence d’addition/élimination ... 109
Améliorations de la voie de synthèse publiée ... 122
Synthèse multi-gramme des partenaires de couplage ... 122
Double couplage de Suzuki-Miyaura en conditions aqueuses ... 123
Recherches menées simultanément dans le groupe de Seeram ... 126
2.5. Partie expérimentale (résultats non publiés) ... 130
Informations générales ... 130
Formation du motif 1,2,2-triaryléthène par une séquence d’addition/élimination ... 130
Addition d’un anion diarylméthane sur un composé carbonylé ... 130
Préparation du 2,3,3-triphénylpropenoate d’éthyle (2.44) ... 131
Réduction des ester d’acides 2,3,3-triarylacryliques ... 132
Synthèse du 2,3,3-triphénylprop-2-énol (2.58)... 132
Synthèse du 2,3,3-tris(4-benzyloxy-3-méthoxyphényl)prop-2-énol (2.57) ... 133
Exploration de la réactivité de l’alcool allylique 2.58 ... 133
Hydrogénation de 2.58 : préparation du 1,1,2-triphénylpropane (2.62) ... 133
Époxydation de 2.58 : préparation du 2,3-époxy-2,3,3-triphénylpropan-1-ol (2.64) ... 134
Ouverture de l’époxyde 2.64 : préparation du 2,3,3-triphénylpropan-1,2,-diol (2.65) ... 134
Chapitre 3. Preparation of 2,3,3-triarylacrylic acid esters using Suzuki-Miyaura
coupling reactions [Article II] ... 135
3.1. Avant-propos de l’article... 136
3.2. Résumé de l’Article II ... 137
3.3. Contenu de l’Article II ... 138
Abstract ... 138
Introduction ... 138
Synthetic strategy and precedents ... 139
Results and discussion ... 141
Conclusion ... 151
Experimental section ... 152
General remarks ... 152
Preparation of Functionalized -Keto Ester Compounds ... 152
Preparation of gem-dibromoalkene compounds ... 154
Double Suzuki–Miyaura Coupling with the Pd2(dba)3/SPhos Catalytic System ... 155
Single Suzuki–Miyaura Coupling with the PdCl2(PPh3)2/TFP Catalytic System ... 157
Second Suzuki–Miyaura Coupling with the PdCl2(PPh3)2/TFP Catalytic System ... 160
One-Pot Preparation of 2,3,3-Triarylacrylic Acid Ester 3.32a from gem-Dibromoalkene Precursor 3.10 ... 164
Acknowledgment ... 164
Supporting Information ... 164
Chapitre 4. Anti-inflammatory properties of quebecol and its derivatives [Article III] . 167
4.1. Avant-propos de l’article... 168
4.2. Résumé de l’Article III ... 169
4.3. Contenu de l’Article III ... 170
Abstract ... 170
Introduction ... 170
Results and discussion ... 171
Preparation of compounds ... 171
Evaluation of anti-inflammatory activity ... 174
Aknowledgments ... 178
Supplementary data ... 178
General Information ... 178
Preparation and/or characterization of tested compounds and precursors ... 179
Protocols ... 182
Determination of anti-inflammatory properties of tested compound: complete results ... 184
References and notes ... 186
Chapitre 5. Synthesis and anti-inflammatory activity of isoquebecol [Article IV] ... 187
5.1. Avant-propos de l’article... 188
5.2. Résumé de l’Article IV ... 189
5.3. Contenu de l’Article IV ... 190
Abstract ... 190Introduction ... 190
Compounds of interest ... 193
Synthesis ... 195
Preparation of North substructure of isoquebecol (Class A) ... 195
Preparation of the South substructures of quebecol and isoquebecol (Class B) ... 195
Preparation of triarylethene precursor of isoquebecol (Class C) ... 196
Preparation of isoquebecol, 2,3,3-triphenylpropanol and precursors (Class D) ... 199
Biological evaluation ... 200
General remarks ... 200
Anti-inflammatory activity of isoquebecol ... 202
Aryl ring functionalization and anti-inflammatory activity ... 202
Anti-inflammatory activity of quebecol and isoquebecol precursors (Class C and D) ... 204
Anti-inflammatory activity of quebecol and isoquebecol substructures (Class A and B) ... 204
Conclusion ... 205
Experimental section ... 206
General information (chemical synthesis) ... 206
Preparation of Class A compounds (North substructures) ... 207
Preparation and/or characterisation Class B compounds (South substructures) ... 210
Preparation of cross-coupling partners for the synthesis of isoquebecol ... 215
Preparation of Class C compounds ... 217
Preparation of Class D compounds: isoquebecol 5.2, 2.3.3-triphenylpropanol 5.3 and precursors ... 218
Evaluation of biological activity of studied compounds ... 220
Acknowledgments ... 220
Supplementary data ... 221
Optimisation of the Suzuki-Miyaura coupling in acqueous conditions : complete experimental results ... 221
NMR spectra of isoquebecol (5.2) ... 223
Determination of cytotoxicity and anti-inflammatory properties of tested compounds: complete results ... 229
References ... 230
Chapitre 6. Conclusions et perspectives ... 232
6.1. Retour sur les objectifs... 232
Objectif 1o :... 232
Objectif 2o :... 233
Objectif 3o :... 235
Objectif 4o :... 235
6.2. Perspectives ... 238
Préparation des deux énantiomères du québécol ... 238
Accès à d’autres types de 1,2.2-triaryléthènes ... 240
Poursuite de l’étude de l’activité anti-inflammatoire du québécol et de ses dérivés ... 241
Évaluation de l’activité biologique du québécol pour de nouvelles cibles... 242
6.3. Sommaire et remarques finales ... 243
Liste des tableaux
Chapitre 1
Tableau 1.1. Aperçu de la composition la matière sèche de la sève d’érable ... 6 Tableau 1.2. Étendue des concentrations (en %m ou en ppm) retrouvées dans la littérature pour les
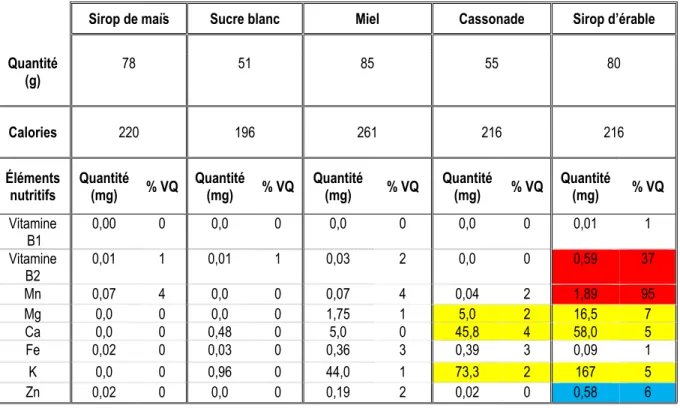
principales espèces quantifiées dans le sirop d’érable ... 8 Tableau 1.3 Classification des composés phénoliques selon Harborne et Simmonds68 ... 10 Tableau 1.4 Comparaison de certains paramètres nutritionnels pour cinq agents sucrants courants. ... 15 Tableau 1.5 Résumé des activités biologiques observées pour le sirop d’érable pur ou des extraits
concentrés ... 18 Tableau 1.6 Activité antiproliférative (CI50) du québécol sur des cellules humaines du côlon (cancéreuses ou
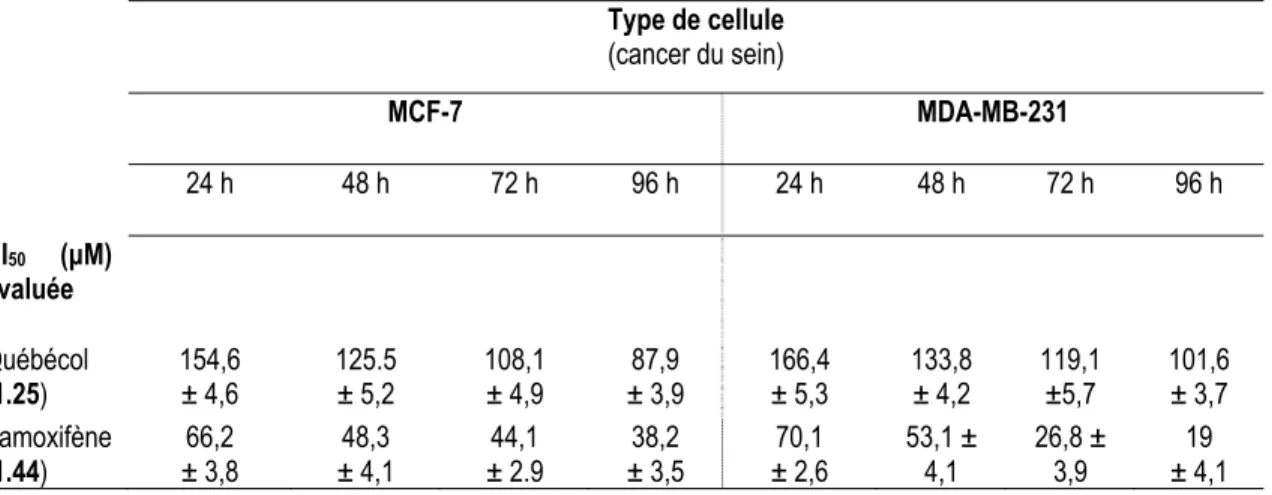
saines) après différents temps d’incubation88 ... 24 Tableau 1.7 Activité antiproliférative (CI50) du québécol et du tamoxifène sur des cellules du cancer du sein
après différents temps d’incubation ... 25
Chapitre 2
Tableau 2.1 Valeurs de pKa des composés diarylméthanes 2.21 et 2.26-2.36.226,227 ... 113 Tableau 2.2 Réaction d’addition d’un anion diphénylméthyle sur un composé carbonylé : études modèles . 114 Tableau 2.3 Application de la réaction d’addition dans la synthèse du québécol et de l’isoquébécol : utilisation
des diarylméthanes 2.37-2.38 et de composés carbonylés fonctionnalisés ... 116 Tableau 2.4 Réaction d’addition d’un anion diphénylméthyle sur un composé carbonylé : seconde série
d’études modèles ... 117 Tableau 2.5 Exploration de la réaction d’addition d’un anion diarylméthane sur un composés carbonylé :
sommaire ... 118 Tableau 2.6 Travail d’optimisation de la réaction de couplage de 2.3 et 2.4 en milieu aqueux avec le système
catalytique Pd2(dab)3/SPhos* ... 124
Chapitre 3
Table 3.1 Single Coupling Attempts on 3.10 Using a SPhos/Pd2(dba)3 Catalytic System. ... 144 Table 3.2 Single Coupling Attempts on 3.10 Using a PdCl2(PPh3)2/TFP Catalytic System. ... 145 Table 3.3 Second SMC on Compound 3.23a–3.25a To Prepare 2,3,3-Triarylacrylic Acid Esters of Class C
3.29a–3.31a. ... 147 Table 3.4 Second SMC on Compound 3.26a To Prepare 2,3,3-Triarylacrylic Acid Esters of Class D 3.29b–
3.31b. ... 148 Table 3.5 Preparation of 2,3,3-Triarylacrylic Acid Esters 3.32–3.34 of Class E ... 149
Chapitre 4
Table 4.1 Hydrogenation experiments on compound 14 ... 173 Table 4.2 Cytotoxicity and anti-inflammatory activity of quebecol and its derivatives ... 175 Table 4.3 Highest non-cytotoxic concentration of quebecol and its derivatives and their effects on IL-6
Table 4.4 Effects of quebecol and its derivatives on IL-8 and IL- secretion. ... 184 Table 4.5 Effects of quebecol and its derivatives on TNF-α secretion and NF-κB activation. ... 184 Table 4.6 Positive control: effect of BAY-11-7082 (Selleckchem, Houston, TX, USA), a commercial inhibitor of
nuclear factor-κB pathway, on LPS-stimulated monocytes/macrophages ... 185
Chapitre 5
Table 5.1 Highest non-cytotoxic concentration and effects on IL-6 secretion of all tested
compounds (5.1-5.21) ... 201 Table 5.2 Suzuki-Miyaura coupling experiments of gem-dibromoalkene 5.44 and boronic acid 5.45 in
acqueous conditions ... 222 Table 5.3 Highest non-cytotoxic concentration (M) and effect on IL-6 secretion of compounds 5.1-5.21 ... 229
Liste des figures
Chapitre 1
Figure 1.1 Quelques exemples de composés phénoliques et polyphénoliques [classe correspondante]. ... 11
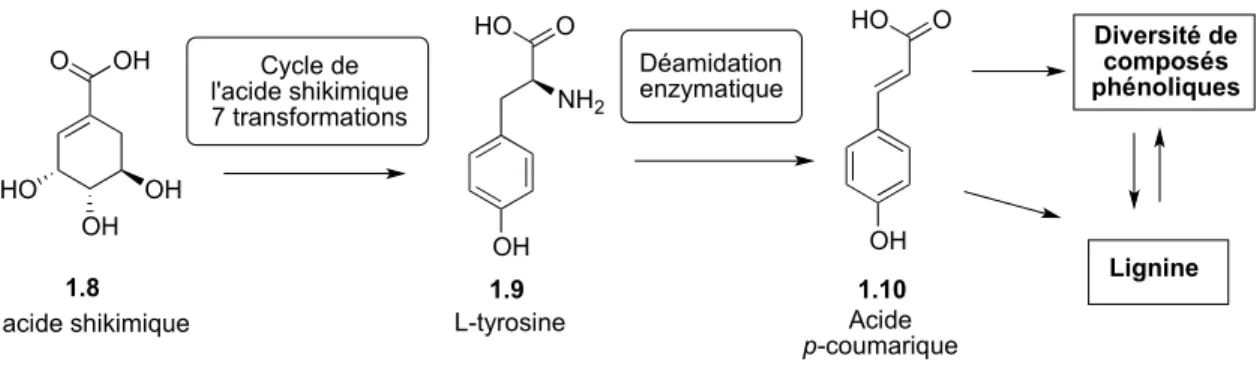
Figure 1.2 Illustration simplifiée de la biosynthèse des composés phénoliques : exemple via la L-tyrosine (1.9). ... 11
Figure 1.3 Structures de quelques composés phénoliques simples dérivés de la lignine et retrouvés dans le sirop d’érable.38,63 ... 13
Figure 1.4 Composés inédits isolés par Seeram à partir d’un extrait.65 ... 20
Figure 1.5 Structure du québécol [ 2,2,3-tris(4-hydroxy-2-méthoxyphényl)propan-1-ol].102 ... 20
Figure 1.6 Les deux isomères (énantiomères) du québécol (1.25). ... 21
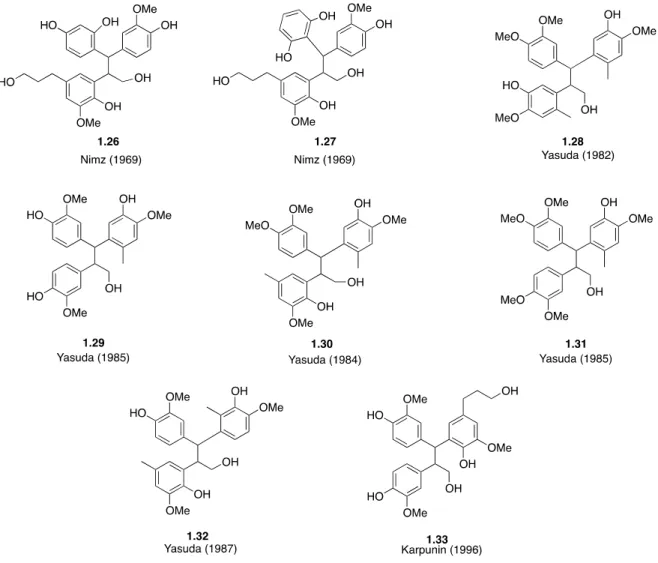
Figure 1.7 Composés phénoliques de type 2,3,3-triarylpropan-1-ol rapportés comme produits de digestion de la lignine.105-112 ... 22
Figure 1.8 Différents composés 2,3,3-triarylpropan-1-ol (1.34-1.38) préparés par Anand à partir des coumarines (1.39-1.43).113,114 ... 23
Figure 1.9 Caractéristiques structurelles attribuant au québécol un potentiel comme agent bioactif : présence de fonctions phénol [en rouge] et similitude avec le tamoxifène (1.44) [en bleu]. ... 24
Figure 1.10 Illustration de la diversité moléculaire pouvant être générée à partir de la structure de base du québécol ... 26
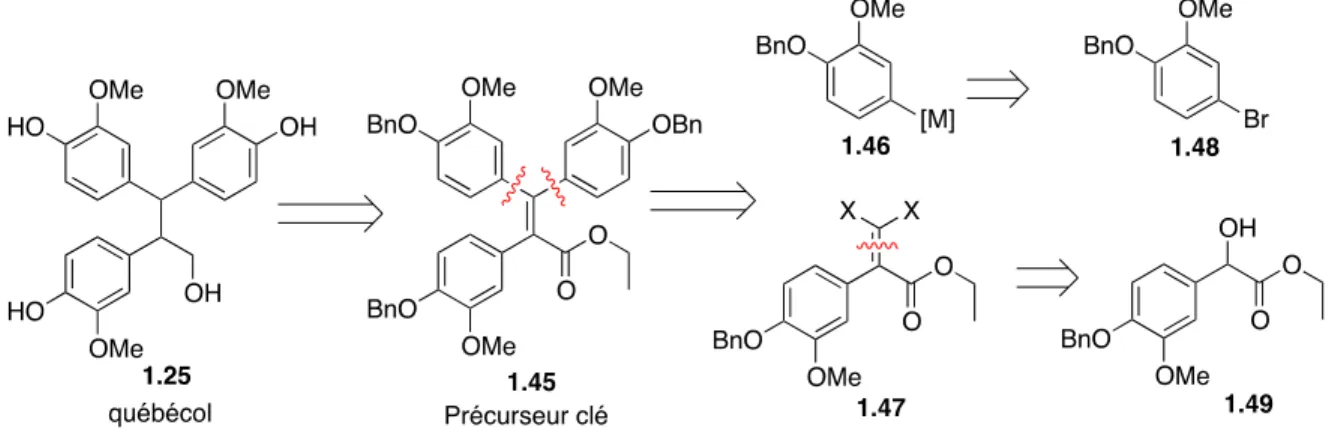
Figure 1.11 Analyse rétrosynthétique à la base de notre stratégie de synthèse du québécol et montrant les principales déconnexions envisagées. [X = halogène, [M] = groupement métallique]. ... 27
Figure 1.12 Le motif ester d’acide 2,3,3-triarylacrylique et un exemple particulier : le précurseur 1.45 du québécol. ... 27
Figure 1.13 Motif général et exemples de composés 1,2,2-triaryléthènes. ... 28
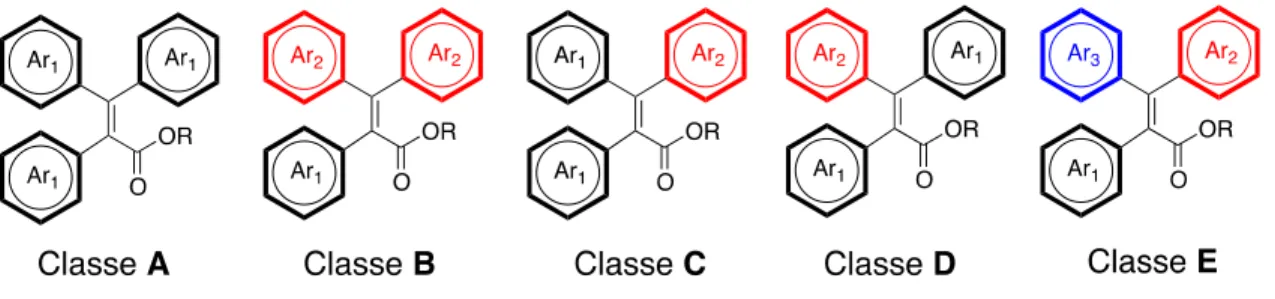
Figure 1.14 Les cinq patrons de substitution possibles des groupements aryles sur l’ester ,-insaturé. ... 35
Figure 1.15 Illustration des Objectifs 1o et 2o. ... 38
Figure 1.16 Vue d’ensemble des structures apparentées au québécol faisant l’objet de l’Objectif 4. ... 39
Figure 1.17 Stratégie de synthèse pour la préparation du québécol 1. 25 : analyse rétrosynthétique complète. ... 41
Figure 1.18 Stratégie de synthèse permettant d’accéder aux différentes classes d’esters d’acides 2,3,3-triarylacryliques à partir d’un précurseur commun [CSM : Couplage(s) de Suzuki-Miyaura]. ... 42
Figure 1.19 Illustration des défis synthétiques impliqués dans la préparation des composés des Classes C à E. [préparation d’un composé de Classe E montrée en exemple] ... 43
Figure 1.20 Mécanisme de l’oléfination de Ramirez sur un aldéhyde. ... 45
Figure 1.21 Résonance générale des fonctions carbonyles du motif -cétoester illustrant le meilleur caractère électrophile du carbonyle ester. ... 47
Figure 1.22 Comparaison basée sur les facteurs électroniques du caractère électrophile d’une cétone non activée et de la fonction carbonyle cétone d’un -cétoester. ... 47
Figure 1.23 Premiers gem-dibromoalcènes d’intérêt pour la poursuite des objectifs de la présente thèse. .... 49
Figure 1.24 Portrait global de la réaction classique de couplage de Suzuki-Miyaura [couplage C(sp2)-C(sp2)]. ... 50
Figure 1.25 Cycle catalytique du couplage de Suzuki-Miyaura entre un bromoalcène et l’acide phénylboronique : illustration des deux mécanismes proposés. ... 52
Figure 1.26 Comparaison entre les composés gem-dibromoalcènes tri- et tétrasubstitués comme substrat de
la séquence de deux couplages. ... 59
Figure 1.27 Plateformes développées portant plusieurs liaisons C-B pour la préparation d’alcènes tétrasubstitués.118,177,178 ... 63
Figure 1.28 Illustration simplifiée de l’activation canonique du facteur de transcription NF-B. ... 67
Figure 1.29 Stimulation de l’activation de la voie NF-B de cellules macrophages avec des lipopolysaccharides bactériens : A. cellule non traitée avec un composé anti-inflammatoire. B. cellule traitée avec un composé anti-inflammatoire. ... 70
Figure 1.30 Illustration du principe derrière le test MTT utilisé pour déterminer la cytotoxicité. ... 70
Figure 1.31 Illustration simplifiée d’un dosage immuno-enzymatique (ELISA) pour la quantification d’une cytokine. ... 72
Chapitre 2
Figure 2.1 Résumé graphique de l’Article 1 ... 76Figure 2.2 Structure of quebecol ... 77
Figure 2.3 Retrosynthetic approach towards quebecol. ... 78
Figure 2.4 1H-NMR spectrum of compound 2.2 (CDCl3) ... 88
Figure 2.5 13C-NMR spectrum of compound 2.2 (CDCl3). ... 89
Figure 2.6 HPLC chromatogram of compound 2.2 (ʎ = 280.4 nm). ... 90
Figure 2.7 1H-NMR spectrum of compound 2.11 (CD3OD) ... 91
Figure 2.8 13C-NMR spectrum of compound 2.11 (CD3OD) ... 92
Figure 2.9 HPLC chromatogram of compound 2.11 (ʎ = 280.4 nm). ... 93
Figure 2.10 1H-NMR spectrum for compound 2.1 (quebecol) (DMSO-d6) [full] ... 94
Figure 2.11 1H-NMR spectrum for compound 2.1 (quebecol) (DMSO-d6) [Zoom 1] ... 95
Figure 2.12 1H-NMR spectrum for compound 2.1 (quebecol) (DMSO-d6) [Zoom 2] ... 96
Figure 2.13 13C-NMR spectrum for compound 2.1 (quebecol) (DMSO-d6). ... 97
Figure 2.14 1H-NMR spectrum for compound 2.1 (quebecol) (acetone-d6). ... 98
Figure 2.15 13C-NMR spectrum for compound 2.1 (quebecol) (acetone-d6). ... 99
Figure 2.16 HPLC chromatograph for compound 2.1 (quebecol) (ʎ=280.4nm). ... 100
Figure 2.17 COSY spectrum for compound 2.1 (quebecol) (acetone-d6) [full] ... 101
Figure 2.18 COSY spectrum for compound 2.1 (quebecol) (acetone-d6) [zoom]. ... 102
Figure 2.19 DQCOSY spectrum for compound 2.1 (quebecol) (acetone-d6) [full]. ... 103
Figure 2.20 DQCOSY spectrum for compound 2.1 (quebecol) (acetone-d6) [zoom]. ... 104
Figure 2.21 HSQC spectrum for compound 2.1 (quebecol) (acetone-d6) [full]. ... 105
Figure 2.22 HSQC spectrum for compound 2.1 (quebecol) (acetone-d6) [zoom 1]. ... 106
Figure 2.23 HSQC spectrum for compound 2.1 (quebecol) (acetone-d6) [zoom 2]. ... 107
Figure 2.24 Accès à un composé de type 1,2,2-triaryléthène via une séquence d’addition/élimination. ... 109
Figure 2.25 Approche rétrosynthétique menant au québécol 2.1 et à l’isoquébécol 2.12 en utilisant la stratégie d’addition/élimination. [Voie A : précurseur ester d’acide 2,3,3-triarylacrylique. Voie B : précurseur alcool allylique protégé.] ... 110
Figure 2.26 Préparation du québécol ou de l’isoquébécol à partir d’un précurseur alcool allylique protégé : rétrosynthèse. ... 111
Figure 2.27 Différentes valeurs de pKa déterminées pour le premier proton dibenzylique du diphénylméthane
(2.21). ... 111
Figure 2.28 Structure des diphénylméthanes d’intérêt dans la synthèse du québécol et de l’isoquébécol. ... 113
Figure 2.29 Effet d’un groupement méthoxy sur l’acidité du motif diphénylméthane. ... 113
Figure 2.30 Différents substrats pour la réaction d’addition associés au québécol et à l’isoquébécol. ... 116
Figure 2.31 Voie de synthèse alternative envisagée à partir de 2.2 pour les dernières étapes de la synthèse du québécol (2.1). ... 119
Figure 2.32 Accès au québécol via l’époxydation de l’alcool allylique 2.57 : rétrosynthèse. ... 121
Figure 2.33 Structure du TPGS-750-M développé par Lipshutz. ... 123
Figure 2.34 Série de composés phénoliques préparés par le groupe Seeram et testés pour leur acitivé anti-proliférative. ... 128
Chapitre 3
Figure 3.1 Résumé graphique de l’Article II ... 137Figure 3.2 Structure of (a) quebecol (1), (b) its key precursor 2, and (c) the general structure of the 2,3,3-triarylacrylic acid ester scaffold ... 138
Figure 3.3 Retrosynthetic approach towards the five possible classes of 2,3,3-triarylacrylic acid esters involving Suzuki–Miyaura coupling (SMC) reactions... 140
Figure 3.4 X-ray diffraction structures of compound 3.24a. ... 146
Figure 3.5 X-ray diffraction structures of compounds 3.32a (up) and 3.32b (down). ... 150
Chapitre 4
Figure 4.1 Résumé graphique de l’Article III ... 169Figure 4.2 (a) Structure of quebecol 4.1, (b) overview of the scope of derivatives studied. ... 171
Figure 4.3 Results of bioassays at different concentrations for compounds 4.1 ... 176
Chapitre 5
Figure 5.1 Résumé graphique de l’Article IV ... 189Figure 5.2 Structures of quebecol, isoquebecol and the 2,3,3-triphenylpropanol model system. ... 191
Figure 5.3 Synthetic strategy designed to access the 2,3,3-triarylpropanol moiety used in the total synthesis of quebecol. ... 192
Figure 5.4 Overview of the scope of compounds studied. ... 193
Figure 5.5 Complete list of compounds included in bioassays classified by substitution on the aromatic ring (Series 1-3) and molecular scaffold (Group A- D). ... 194
Figure 5.6 1H-NMR spectrum for compound 5.2 (isoquebecol) (CD3OD) [full]. ... 223
Figure 5.7 13C-NMR spectrum for compound 5.2 (isoquebecol) (CD3OD) [full]. ... 224
Figure 5.8 COSY spectrum for compound 5.2 (isoquebecol) (CD3OD) [full]. ... 225
Figure 5.9 COSY spectrum for compound 5.2 (isoquebecol) (CD3OD) [zoom]... 226
Figure 5.10 HSQC spectrum for compound 5.2 (isoquebecol) (CD3OD) [full]... 227
Chapitre 6
Figure 6.1 Retour sur l’Objectif 1o : Bilan de la plus longue séquence linéaire impliquée dans notre synthèse totale du québécol. ... 232 Figure 6.2 Retour sur l’Objectif 2o : esters d’acides 2,3,3-triarylacryliques préparés à partir du
gem-dibromoalcène modèle. ... 234 Figure 6.3 Retour sur l’Objectif 4o : ensemble des structures apparentées au québécol évaluées pour leur
activité anti-inflammatoire. ... 236 Figure 6.4 Voies de synthèse énantiosélectives envisagées pour atteindre les deux énantiomères du
québécol 6.2. ... 239 Figure 6.5 Illustration d’une procédure pour effectuer la résolution des deux énantiomères du
québécol 6.2. ... 239 Figure 6.6 Exemple d’une série d’analogues envisageables : exploration des modes de substitution du
Liste des schémas
Chapitre 1
Schéma 1.1 Travaux du groupe de Shimizu : préparation d’esters d’acides 2,3,3-triarylacryliques à partir d’un alcyne.119 ... 29 Schéma 1.2 Préparation du triphénylacrylate d’éthyle (1.56) par Nakajima via un complexe vinylzirconium
(1.55).120 ... 29 Schéma 1.3 Travaux de Kosugi : préparation du triphénylacrylate de méthyle par double addition d’un réactif
organoétain.121 ... 30 Schéma 1.4 Travaux de Larock : double addition d’un acide boronique sur un motif alcyne.122,123 ... 30 Schéma 1.5 Utilisation de la stratégie tricomposant de Larock pour préparer les composés régiomères 1.62 et
1.63.124,125 ... 31 Schéma 1.6 Utilisation de la méthodologie tricomposant de Larock par Scanlan et Iijima.127 ... 31 Schéma 1.7 Travaux du groupe de Wen : utilisation d’un ion iodonium cyclique dans le système tricomposant
de Larock.128 ... 32 Schéma 1.8 Travaux du groupe de Jiang : formation d’un vic-dibromoalcène et double couplage de
Suzuki-Miyaura.129 ... 32 Schéma 1.9 Utilisation de phosphates d’énol par Tanabe pour la synthèse d’esters d’acides
triarylacryliques.117 ... 33 Schéma 1.10 Utilisation d’un motif α,β-diboryl acrylate pour la construction d’esters d’acides
2,3,3-triarylacryliques.118 ... 34 Schéma 1.11 Utilisation d’un motif β-boryl-α-silyl acrylate pour la construction d’esters d’acides
2,3,3-triarylacryliques.118 ... 34 Schéma 1.12 Méthodologies d’accès appliquées à des esters d’acides 2,3,3-triarylacryliques précis.130,131.... 34 Schéma 1.13 Travaux pionniers : préparation de du ,-dibromostyrène par Ramirez. ... 44 Schéma 1.14 Travaux originaux de Corey et Fuchs sur la préparation d’alcynes à partir d’aldéhydes (réaction
de Corey-Fuchs).137 ... 45 Schéma 1.15 Comparaison de la réactivité de la cétone 1.115 dans les conditions originales d’oléfination de
Ramirez [haut] et dans les conditions modifiées de type HWE développées par
Lautens [bas].144 ... 46 Schéma 1.16 Travaux de Suda : installation d’une fonction gem-dibromoalcène sur un motif -céto
-lactone.145 ... 48 Schéma 1.17 Oléfination de Ramirez sur le substrat 1.120 effectué par Burton et Lu.146,147 ... 48 Schéma 1.18 Travaux de Knochel : installation de fonction gem-dibromoalcène sur les -cétoester 1.122 et
1.123.148 ... 48 Schéma 1.19 Homologation de l’-cétoester polyfluoré 1.126 par Sharpe.149 ... 49 Schéma 1.20 Travaux pionniers de Suzuki et Miyaura : couplage allyle-allyle et allyle-aryle (résultats
sélectionnés).152,153 ... 50 Schéma 1.21 Travaux pionniers de Suzuki et Miyaura : couplage aryle-aryle (résultats sélectionnés).154 ... 51 Schéma 1.22 Préparation de deux composés 1,2,2-triaryléthènes tétrasubstitués par McCombie.162 ... 53 Schéma 1.23 Travaux du groupe de Nuckolls : préparation de motifs hexabenzocoronènes
contorsionnés.163 ... 53 Schéma 1.24 Travaux du groupe de Diederich : préparation de chromophores organiques à bande
Schéma 1.25 Préparation d’un variété de tetraaryléthènes à partir du gem-dibromoalcène 1.152.165 ... 54
Schéma 1.26 Préparation d’un motif ,γ,γ-triarylnitroallyle par double couplage de Suzuki-MIyaura.166... 55
Schéma 1.27 Installation de groupements aryles par double couplage de Suzuki-Miyaura sur le gem-dibromoalcène 1.121, préparé à partir de l’-cétoester 1.120.147 ... 55
Schéma 1.28 Utilisation d’un monocouplage sur un motif gem-dibromoalcène dans le cadre de la synthèse de la portion inférieure de la chlorotricolide (1.169).168 ... 56
Schéma 1.29 Utilisation d’un monocouplage sur un motif gem-dibromoalcène dans le cadre de la synthèse de la région octahydronaphtalène (1.172) commune à la kijanolide et la tétronolide.167 ... 56
Schéma 1.30 Démonstration de la différence de réactivité entre des monobromoalcènes (E) et (Z) : exemple tiré de l’étude de Carpita.169 ... 57
Schéma 1.31 Exemple d’un monocouplage d’acide arylboronique avec un gem-dibromoalcène issu des travaux de Shen170 ... 57
Schéma 1.32 Extension du monocouplage de Shen par le groupe de Chelucci pour la synthèse d’alcynes.171 ... 58
Schéma 1.33 Travaux de Molander : préparation d’un alcène trisubstitué par couplage de deux sels de type trifluoroborate de potassium.172 ... 58
Schéma 1.34 Préparation d’une série d’alcènes tétrasubstitués par Shimizu via deux couplages de Suzuki-Miyaura sur le précurseur 1.185.173 ... 60
Schéma 1.35 Travaux de Chapleur : préparation d’une série d’alcènes tétrasubstitués dérivés d’un hydrate de carbone via deux couplages de Suzuki-Miyaura.175 ... 61
Schéma 1.36 Application de la séquence de couplage développée par Chapleur sur le gem-dibromoalcène symétrique 1.208.175 ... 61
Schéma 1.37 Travaux de Tobrman : séquence de deux couplages sur un gem-dibromoalcène tétrasubstitué porteur d’un phosphate d’énol.176 ... 62
Chapitre 2
Scheme 2.1 Preparation of gem-dibromoalkene cross-coupling partner 2.3 ... 79Scheme 2.2 Preparation of the arylboronic acid 2.4. ... 80
Scheme 2.3 Suzuki–Miyaura cross-coupling leading to tetrasubstituted olefin precursor 2.2 ... 81
Scheme 2.4 Final steps leading to quebecol 2.1. ... 81
Schéma 2.5 Utilisation du diphénylméthane dans une séquence d’addition/élimination par Rathore.231 ... 112
Schéma 2.6 Utilisation du diphénylméthane dans une séquence d’addition/élimination par Chow. 230 ... 112
Schéma 2.7 Préparation de l’ester d’acide 2,3,3-triarylacrylique 2.44 par déshydratation de l’alcool 2.43 ou à partir de 2.21 via une séquence d’addition/élimination. ... 115
Schéma 2.8 Expériences de réduction LiAlH4 sur les esters d’acides 2,3,3-triarylacryliques 2.44 et 2.59. ... 119
Schéma 2.9 Exploration des systèmes rapportés par Kadin236 et Buchwald237 pour la réduction sélective de la double liaison du système ,-insaturé. ... 120
Schéma 2.10 Hydrogénation de l’alcool allylique de 2.58. ... 120
Schéma 2.11 Exploration de l’accès au québécol via l’installation d’un époxyde. ... 121
Schéma 2.12 Améliorations apportées à la préparation du synthon -cétoester 2.9. ... 122
Schéma 2.13 Préparation de l’acide arylboronique 2.4 sans chromatographie. ... 123
Schéma 2.14 Application à plus grande échelle des conditions aqueuses développées pour la réaction de double couplage de Suzuki-Miyaura impliquée dans la synthèse du québécol. ... 125
Schéma 2.15 Séquence envisagée pour réduire les purifications lors des dernières étapes de la synthèse du
québécol. ... 125
Schéma 2.16 Première voie de synthèse utilisée par Seeram pour la préparation du québécol (2.1).103 ... 126
Schéma 2.17 Seconde voie de synthèse utilisée par Seeram pour la préparation du québécol 2.1. ... 127
Chapitre 3
Scheme 3.1 Preparation of carbonyl compounds 3.7, 3.8.. ... 142Scheme 3.2 Preparation of gem-dibromoalkene compounds 3.10–3.12. ... 142
Scheme 3.3 Preparation of Class A compounds 3.2, 3.15, and 3.16... 143
Scheme 3.4 Preparation of Class B compounds 3.19 and 3.20. ... 143
Scheme 3.5 Synthesis of 3.32a from 3.10 by a one-pot procedure. ... 151
Chapitre 4
Scheme 4.1 Structure and preparation of South fragments 4.2–4.6. ... 172Scheme 4.2 Preparation of compound 4.13 (North substructure of quebecol). ... 172
Chapitre 5
Scheme 5.1 Synthesis of 5.21: North substructure of isoquebecol. ... 195Scheme 5.2 Preparation of Class B compounds: South substructures of quebecol (Series 1) and isoquebecol (Series 2). ... 196
Scheme 5.3 Preparation of gem-dibromoalkene precursor of isoquebecol 5.41. ... 197
Scheme 5.4 Preparation of the boronic acid synthon 5.42 for the synthesis of isoquebecol. ... 197
Schéma 5.5 Synthesis of 1,2,2-triarylethene precursors of isoquebecol and quebecol (43 and 46, respectively) in a TPGS-750-M (5 wt.% in H2O) solvent system. ... 198
Scheme 5.6 Deprotection of 5.43 to prepare polyphenolic compound 5.8 (Class C). ... 199
Scheme 5.7 Preparation of isoquebecol 5.2 and 2,3,3-triphenylpropanol 5.3 from ,-usaturated esters 5.45 and 5.9. ... 200
Chapitre 6
Schéma 6.1 Résultats préliminaires de l’application de notre séquence clé à la préparation du tamoxifène (6.39). ... 240Liste des abréviations
Ac acétyleADN acide désoxyribonucléique Anhyd anhydrous
Ar aryle
ARN acide ribonucléique
ARNm acide ribonucléique messager Bn benzyle Bu ou n-Bu butyle
cat. Catalytique cod cycloocta-1,5-diène CHA cyclohexylamine CI50 concentration inhibitrice médiane Cp cyclopentadiènyle CSM couplage de Suzuki-Miyaura dba dibenzylidèneacétone DBU 1,8-diazabicyclo[5.4.0]undéc-7-ène DET diéthyltartrate DIPA diisopropylamine DME 1,2-diméthoxyéthane DMF diméthylformamide dppf diphénylphosphinoferrocène DRO dérivés réactifs de l’oxygène
dpbb 1,4-Bis(diphénylphosphino)butane DtBPF di-tert-butylphosphinoferrocène
DIEA N,N-diisopropyléthylamine
DIPA N,N-diisopropylamine
DMSO diméthylsulfoxyde
ELISA enzyme-linked immunosorbent assay
équiv. équivalent equiv ou eq equivalent
ER élément de réponse
Et éthyle
FCEN Fichier canadien sur les éléments nutritifs
FIM Foundation for Innovation in Medicine
FPAQ Fédération des producteurs acéricoles du Québec
GC chromatographie en phase gazeuse (gas chromatography)
GC-MS chromatographie en phase gazeuse couplée à la spectrométrie de masse (gas
chromatography-mass spectromery)
gem geminal
HPLC chromatographie liquide à haute performance (high-performance liquid chromatography) HRMS spectrométrie de masse à hautre résolution (high resolution mass spectrometry) HRP péroxydase du raifort (horseradish peroxidase)
HWE Horner-Wadsworth-Emmons IL interleukine
iPr isopropyle IR infrarouge LDA diisopropylamidure de lithium
LPS lipopolysaccharides bactériens
MAPAQ Ministère de l'Agriculture, des Pêcheries et de l'Alimentation du Québec Me méthyle
MMPs métalloprotéinases matricielles MOM méthoxyméthyléther
m-CPBA acide métachloroperbenzoïque
mp melting point
MTT bromure de 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltétrazolium
NMR nuclear magnetic resonnance
NTCs nanotubes de carbone OTf trifluorométhylsulfonate Ph phényle pin pinacolato Piv triméthylacétyle PMHS polyméthylhydrosiloxane PGE2 prostaglandine E2
RMN résonance magnétique nucléaire RT ou r.t., room temperature
RuPhos 2-dicyclohexylphosphino-2′,6′-diisopropoxybiphényle
SAR structure-activity relationship
sat saturé
s-Bu sec-butyle
scCO2 dioxyde de carbone supercritique
SMC Suzuki-Miyaura coupling SPhos 2-dicyclohexylphosphino-2′,6′-diméthoxybiphényle t-Bu tert-butyle TBDMS tert-butyldiméthylsilyle TBDPS tert-butyldiphényllsilyle Tf température de fusion
TLC thin layer chromatography
TFP tris(2-furyl)phosphine THF tétrahydrofurane TIPS triisopropylsilyle
TMEDA N,N,N,N-tétraméthyléthylènediamine
TNF facteur de nécrose tumorale
TOF time of flight
t.p. température pièce
TPGS-750-M succinate de DL--tocophérolméthoxypolyéthylène glycol
vic vicinal
À Bernard, mon père Pour avoir toujours cru en moi et m’avoir transmis ton émerveillement à étudier la nature
« And now that you don’t have to be perfect, you can be good. »
Remerciements
Rares sont les occasions où l’on peut souligner le passage de tous les gens qui ont marqué notre vie pendant près de 10 années. C’est donc avec un grand plaisir, mais une certaine appréhension que j’ai abordé la rédaction de ces lignes. L’écriture de cette page, je l’ai envisagée plusieurs fois depuis le début de mes études graduées. Au fil du temps, la liste des personnes s’y trouvant a évolué (beaucoup y ont gagné leur place, d’autres l’ont perdue), reflétant à quel point ces dernières années représentent à ce jour les plus marquantes de ma vie.
À tout seigneur, tout honneur, mes premiers remerciements sont dirigés au professeur Normand Voyer, mon directeur de thèse. Normand, tu m’as pris sous ton aile alors que j’étais un étudiant de première année au baccalauréat et tu n’as pas cessé de me faire confiance depuis. Tout en me dirigeant de manière éclairée, tu m’as laissé une latitude qui m’a permis d’acquérir des aptitudes qui me serviront toute ma vie et que je compte bien utiliser en tentant de suivre tes traces. Tout ce que je suis maintenant comme chercheur, je te le dois. Je suis également certain que c’est beaucoup grâce à toi que je pourrai continuer à poursuivre mon projet de carrière après mon passage ici; je ne l’oublierai jamais. Même si ton enthousiasme contagieux n’a plus besoin de présentation pour les membres de notre département, je prendrai quand même la peine de souligner sa grande utilité dans les moments les moins réjouissants de la recherche. Normand, tu représenteras toujours pour moi un mentor d’exception doublé d’une personne aux qualités humaines remarquables.
Un énorme merci doit également être fait au professeur Daniel Grenier, ainsi qu’à Jabrane Azelmat. Votre inestimable collaboration a permis de donner une tout autre dimension à mes travaux. De plus, ce fut un grand plaisir de travailler avec des gens aussi sympathiques que vous. J’espère que nous aurons la chance de collaborer à nouveau dans le futur.
J’aimerais également remercier sans plus attendre les professeurs Pierre Deslongchamps, Denis Giguère et André Pichette d’avoir accepté de faire partie de mon comité d’évaluation, et ce, malgré le délai plutôt serré demandé. C’est d’autant plus apprécié sachant que votre temps est précieux et que cette thèse arrive à une période très chargée de l’année.
Sur le plan plus personnel, mes premiers remerciements vont bien sûr à mes parents : Bernard et Christiane. En plus de m’avoir élevé avec tout votre amour et votre tendresse, vous m’avez montré la détermination, la rigueur, l’humilité et la passion, des valeurs sans lesquelles tout ceci n’aurait pas été possible. Vous m’avez toujours offert un support inconditionnel dans mes choix de vie et je vous en remercie. Maman, merci pour ton écoute, tes conseils et les nombreuses petites attentions que tu as pour moi. Cette persévérance (ou cet
moi et j’en ai toujours été très touché. Même si ton estime de mes talents me semble plutôt démesurée, te rendre fier est et sera toujours pour moi une grande source de bonheur et de motivation. Cette thèse, je te la dédicace. Même si tu as fait d’autres choix de carrière en choisissant la médecine, entre autres pour ta famille, je suis certain tu aurais été un chercheur exceptionnel. Mon amour des sciences fondamentales je le dois à ta curiosité et aux heures passées avec toi à profiter des merveilles de la nature ou à en discuter.
Des remerciements incontournables doivent également être faits à deux collègues : Pierre-Luc Boudreault et François Otis. D’abord, merci à toi Pierre-Luc de m’avoir supervisé alors que j’étais au premier cycle et de m’avoir montré les joies et les peines de la synthèse organique, tout en me laissant beaucoup de liberté. Tu m’as bien préparé aux études graduées. C’est toujours un plaisir de te recroiser et d’échanger à nouveau avec toi. Merci ensuite à toi, François, toi qui es là depuis mon premier jour au laboratoire. Au fil du temps, j’ai découvert en toi une des personnes les plus aimables que je connais, ainsi qu’un ami et un confident précieux. Merci pour toute l’aide que tu m’as fournie le long de toutes ces années et plus particulièrement ces dernières semaines avec la relecture de cette thèse. Merci également à Jean-Daniel et toi de m’avoir ouvert les portes de votre bureau : l’endroit idéal pour une soirée tranquille au Vachon.
De chaleureux remerciements vont également à mes autres collègues passés et présents du laboratoire Voyer : Camille, Charles, Raphaël, Pierre-Alexandre, Jean-Daniel, Christopher, Claudia, Nicolas, Corinne et Gaëlle. Vous avez tous, à votre façon, contribué à l’ambiance unique qui règne dans cette équipe de recherche. Je garderai toujours de précieux souvenirs de ces années où nous avons notamment bâti une certaine réputation sur l’Avenue Myrand. Au fil de toutes ces pérégrinations, certains d’entre vous sont devenus de véritables amis et je vous souhaite le meilleur pour la suite.
J’aimerais également profiter de l’occasion pour remercier les étudiants à qui j’ai eu l’immense plaisir d’enseigner pendant 4 ans. La curiosité, le désir d’apprendre et l’enthousiasme manifestés par plusieurs d’entre vous m’ont permis, dans les moments les plus creux de la recherche, de donner un sens à tous ces efforts.
Des remerciements tout spéciaux vont également à Pierre-Olivier, Marie-Audrey et Patrick pour les longues heures passées à parler des « splendeurs et misères » de la recherche et pour les autres passées à les oublier. À vous trois, j’ajouterais Vincent, Nicolas et Raphaël pour les aventures qui ont rendu ces dernières années inoubliables. Vous tous donnez son sens à l’expression populaire « les amis c’est une famille que l’on choisit ». Merci à vous également Stéphanie, Andréanne et Myriam. Que vous le sachiez ou non, votre passage dans ma vie a forgé mon caractère et m’a permis de devenir la personne que je suis maintenant.
Dans un tout autre ordre d’idée, merci à mes fournisseurs d’endorphine Sauconny Guide 7, Brooks Ravenna
7, Fisher Sports glass et Atomic Redster Skate. Vous m’avez permis de me réaliser au moment où j’en avais
le plus besoin. Merci aussi à Beethoven, à Pink Floyd, à David Bowie, à BeachHouse, au coffret Lifetime 8 disques, à Rachmaninov, à Bob Dylan, à Mendelssohn, au disque A Charlie Brown Christmas, au café, au thé et aux boissons houblonnées pour m’avoir accompagné durant toutes ces longues journées, soirées et nuits de rédaction. À ce qu’on dit, il a fait un temps superbe cet été…
Finalement, merci à toi Cecilia. Même si l’on se connait depuis seulement quelques mois, tu m’as fait voir l’avenir sous un jour plus lumineux et m’as donné l’énergie nécessaire pour accomplir ce travail. Tu es arrivée dans ma vie au moment où ça comptait le plus, comme un cadeau que je n’attendais pas. Il y a beaucoup de toi dans cette thèse. Ta compréhension, ta patience et ton soutien m’ont donné la force d’aborder avec confiance et sérénité cette étape cruciale de mes études; ton amour, lui, me donne le goût d’être une meilleure personne tous les jours. Je crois que la vie a fait croiser nos chemins pour une raison. Même si les prochaines années s’annoncent difficiles et impliquent déjà trois pays, j’ai confiance que nous prendrons tous les moyens possibles pour cultiver ce lien unique et précieux qui nous unit. Il pallone gonfiato ama la sua bella e affascinante gattina nera. Ti amo. Merci d’être la personne que tu es et de rendre le monde plus beau avec ton intelligence, ton sourire, ton esprit et, bien sûr, ton charme !
Avant-propos et organisation de la thèse
La présente thèse porte sur les résultats obtenus dans le cadre du projet principal de mes études doctorales et duquel quatre publications ont été issues (3 publiées et 1 soumise). Les résultats qui y seront présentés s’articuleront autour de ces articles rédigés en anglais. Les autres parties de la thèse ont, quant à elles, été rédigées en français à la première personne du pluriel, comme il est d’usage afin de souligner l’apport du directeur de recherche. La contribution des tous les collaborateurs à ces travaux sera détaillée dans les avant-propos précédant chacun des articles insérés.
La présente thèse est divisée en six chapitres.
Le premier, bien que simplement nommé introduction, constitue plutôt l’ensemble des notions théoriques et des précédents sous-jacents le projet de recherche. Il sert également à expliciter la continuité entre les différents articles. Ce chapitre peut être lui-même divisé en cinq sections.
Tout d’abord, une discussion sur une série de grands thèmes permettra de mettre en contexte nos travaux dans une perspective plus large dépassant la chimie organique. Bien que les sujets traités dans cette section ne sont pas directement associés à nos résultats expérimentaux, Il est selon moi très pertinent de les aborder ici afin de montrer une vision plus globale des enjeux dans lesquels s’inscrivent nos recherches. À la suite de cette mise en contexte, les connaissances actuelles sur nos objets de recherches seront détaillées et les principales problématiques seront soulevées. Nos objectifs de recherche spécifiques seront ensuite clairement énoncés. Finalement, les méthodologies envisagées pour répondre à ces objectifs seront expliquées et les précédents pertinents seront soulignés.
Les quatre chapitres suivants (Chapitre 2 à Chapitre 5) consistent en la transcription des quatre articles rédigés en anglais mentionnés ci-haut. Ils constituent la présentation et la discussion des résultats obtenus dans le cadre de ce projet. Dans le cas du Chapitre 2, une discussion supplémentaire rédigée en français et portant majoritairement sur des résultats non publiés (avec leur partie expérimentale) accompagnera l’article.
Le Chapitre 6 rassemble l’ensemble des résultats obtenus autour des objectifs initialement définis. Une discussion sur certaines perspectives de recherche y sera également retrouvée avant la conclusion finale.
La bibliographie accompagnant les passages rédigés en français de la présente thèse est retrouvée à la fin du document. Les références provenant de ces parties ont été numérotées en continu et sans interruption du Chapitre 1 au Chapitre 6. Les références utilisées à l’intérieur des articles ont plutôt été traitées séparément et incluses avec la transcription de l’article, à l’endroit approprié et selon la numérotation d’origine.
Finalement, quelques remarques plus techniques se doivent d’être mentionnées concernant l’insertion des articles. Certaines remarques particulières seront faites au besoin dans l’avant-propos de chaque article. Les suivantes, plus générales, s’appliquent à l’ensemble :
-Chaque article est précédé d’un avant-propos et d’un résumé en français.
-Certaines normes de présentation peuvent varier d’un article à l’autre et ont été conservées ainsi afin de rester fidèle aux versions publiées (ou à la version soumise de l’Article IV). En guise d’exmple, le terme equivalent sera abrégé par « eq » ou « equiv » selon les articles.
-La partie expérimentale accompagnant chacun des articles est incluse à l’intérieur de chacun des chapitres, selon sa position dans la version publiée. Elle sera trouvée à même le contenu de l’article pour les Chapitres 3 et 5, tandis qu’elle se retrouvera dans la partie Supplementary data pour les Chapitres 2 et 4.
-Les informations supplémentaires (nommée Supporting information ou Supplementary data selon les articles) ont été incluses pour les Chapitres 2, 4 et 5 puisqu’ils contenaient la partie expérimentale ou qu’ils présentaient des données expérimentales jugées pertinentes à la discussion. Celles associées au Chapitre 3 ont été omises, étant donné leur contenu (illustration de tous les spectres RMN et données cristallographiques) et leur volume (80 pages).
-Les numéros pour les schémas, les tableaux ainsi que les numéros de composés ont été conservés par rapport à l’article original, mais sont précédés ici du numéro du chapitre. Par exemple, le composé numéroté comme 2 dans la version originale de l’Article I (Chapitre 2) sera ici décrit comme
2.2.
-Le résumé graphique (graphical abstract) accompagnant la publication originale a été inclus dans les résumés en français et constitue la première figure de chaque chapitre. Se faisant, les numéros de figures ont été décalés d’un par rapport à la publication originale. Par exemple, l’illustration nommée Figure 4 dans la version originale de l’Article I (Chapitre 2) sera ici identifiée comme Figure 2.5.
Chapitre 1. Introduction
1.1. Mise en contexte
Les aliments fonctionnels et les nutraceutiques
Contexte actuel et définitionsL’enrichissement, au courant des dernières décennies, des connaissances scientifiques en matière de nutrition a changé significativement le rapport qu’entretient notre société quant à l’alimentation. Plus que jamais, bon nombre de gens cherchent à obtenir par leur diète des bienfaits pour leur santé dépassant le simple apport énergétique.1,2 La mise en marché, ces dernières années, d’une myriade de nouveaux aliments à valeur ajoutée représente sans doute la manifestation la plus visible de ces préoccupations modernes.3-5 Parmi les exemples les plus notables, soulignons la présence actuelle sur les tablettes de bon nombre d’aliments courants additionnés d’acide gras oméga-3 ou de bactéries probiotiques (yogourts, œufs, boissons, etc.).67
Du point de vue de la recherche, l’établissement de ce nouveau paradigme nutritionnel, en engendrant une convergence sans précédent des intérêts de l’industrie agroalimentaire et de l’industrie pharmaceutique8,9, a mené à l’émergence de disciplines d’études inédites. L’ensemble des recherches issues de cette confluence est généralement décrit et classé en utilisant deux grands thèmes, dont les définitions et les frontières mutuelles peuvent varier légèrement d’une organisation scientifique à une autre : les aliments fonctionnels et les nutraceutiques.10
Le terme aliment fonctionnel a été introduit au Japon en 1984 pour décrire des aliments transformés contenant des ingrédients contribuant à des fonctions physiologiques autres que la nutrition.5,11 Depuis, l’utilisation de ce concept s’est élargie puis raffinée. Santé Canada le définit depuis 1998 de la manière suivante :
« Un aliment fonctionnel est semblable en apparence aux aliments conventionnels, il fait partie de
l’alimentation normale et il procure des bienfaits physiologiques démontrés et(ou) réduit le risque de maladies chroniques au-delà des fonctions nutritionnelles de base.12 »
Selon cette définition et la plupart des autres actuellement acceptées, cette classe regroupe tant les aliments présentant naturellement des vertus nutritionnelles particulières que ceux dont les bienfaits prétendus résultent d’un ajout.10,13-16 Se faisant, une céréale très riche en fibre soluble (réduisant les risques de cancer du côlon) peut être considéré un aliment fonctionnel au même titre que ceux enrichis en omega-3 et probiotiques mentionnés au début de la présente section.17
Le terme nutraceutique, quant à lui, a été introduit en 1989 par le Dr Stephen DeFelice de la Foundation for
Innovation in Medicine (FIM) et origine de la contraction des mots « nutrition » et « pharmaceutique ».18,19 Il est utilisé actuellement pour décrire des constituants bénéfiques à la santé provenant de la diète, mais extraits de leur aliment d’origine. 10,20 Santé Canada donne à ce terme la définition suivante :
« Un produit nutraceutique est fabriqué à partir d’aliments, mais vendu sous forme de pilules ou de
poudres (potions) ou sous d’autres formes médicinales qui ne sont pas généralement associées à des aliments et il s’est avéré avoir un effet physiologique bénéfique ou assurer une protection contre les maladies chroniques.12 »
Suivant cette définition, une distinction peut être faite entre les nutraceutiques et les suppléments alimentaires traditionnels, même si ces deux types de produits peuvent être retrouvés sous les mêmes formulations. En effet, les suppléments servent à pallier une carence en un certain nutriment essentiel, alors que la prise de nutraceutiques vise des bienfaits physiologiques dissociés de la diète et se rapprochant plus de l’effet d’un médicament classique.19 De plus, même si certaines stratégies commerciales tendent à les amalgamer, il est préférable, étant donnée leur origine spécifique à l’alimentation, de discriminer les nutraceutiques des autres produits dits «de santé naturels», dont notamment ceux issus de l’herboresterie.21
Bien qu’elle soit aujourd’hui supportée par une base scientifique et stimulée par l’industrie agroalimentaire, l’idée que l’alimentation puisse jouer un rôle majeur dans la santé globale des individus n’est pas nouvelle. Durant l’Antiquité, Hippocrate de Cos (~ 460-370 av. J.‑C.), connu comme le père de la médecine moderne, a émis l’idée suivante : « Que ton aliment soit ta seule médecine ».22 Une telle déclaration, remontant à plus de 2000 ans, permet de remettre en perspective la recherche sur les aliments fonctionnels et les nutraceutiques et rappelle qu’elle ne repose pas uniquement sur les innovations technologiques de l’industrie agroalimentaire.
Revisiter les aliments traditionnels
Suivant cette ligne de pensée, des scientifiques du monde entier ont, ces dernières années, revisité des ingrédients issus de certaines cuisines traditionnelles en utilisant une approche moléculaire et en mettant à profit les techniques scientifiques modernes. Profitant de l’engouement, tant des milieux académiques qu’industriels, pour les aliments fonctionnels, ces chercheurs ont étudié la composition de certains aliments propres à leur patrimoine alimentaire dans le but d’y découvrir des constituants qui leur attribueraient un caractère d’aliment fonctionnel ou qui pourrait mener au développement de nouveaux nutraceutiques.
Par exemple, bon nombre de recherches, motivées par les bienfaits prétendus et quasi unanimement acceptés du régime méditerranéen, ont été orientées vers les cuisines de certains pays de cette région.23-25 À cet effet, la composition chimique de plusieurs des constituants caractéristiques des cuisines du bassin méditerranéen dont l’huile d’olive26-28, le basilic29, le raisin30 ainsi que certains légumes31 a été largement étudiée ces dernières années. Évidemment, plusieurs autres aliments ont été l’objet de telles recherches ailleurs dans le monde. Afin d’illustrer la grande diversité des objets de ces travaux, soulignons, en guise d’exemple, quelques études portant sur des sujets aussi variés que la cuisine indienne32, le sésame japonnais33, le vinaigre de riz chinois34 ou encore le maïs et les fèves d’Amérique centrale.35
Plus près de chez nous, les cuisines québécoises et canadiennes, même si elles représentent des manifestations culturelles plus récentes à l’héritage plus restreint, ne sont pas non plus dénuées d’attrait pour ce qui est de la recherche sur les aliments fonctionnels et les nutraceutiques. Le sirop d’érable, étant donné sa source végétale particulière et son mode de production unique, représente notamment un aliment de notre coin de pays dont la composition moléculaire suscite un grand intérêt.
Le sirop d’érable
La production acéricole au Québec et au Canada
1.1.2.1.1. Origine du sirop d’érable
Le sirop d’érable est produit par la concentration (en grande partie par évaporation thermique) de la sève de plusieurs espèces d’arbres du genre Acer, majoritairement l’érable à sucre (Acer Saccharum). On estime à 40 L, le volume de sève nécessaire à la production d’un litre de sirop.36 La sève est recueillie dans une période de l’année variant selon les régions et s’étalant sur quelques semaines (de 4 à 8) entre la fin de l’hiver et le début du printemps, soit lorsque la température glisse sous le point de congélation la nuit et remonte au-dessus pendant le cycle diurne de l’arbre.37
L’écoulement de la sève des arbres serait causé globalement, selon les connaissances actuelles, par la formation d’une pression positive à l’intérieur du tronc lors des épisodes de gel-dégel.38 Milburn et O’Malley explique le phénomène en s’appuyant sur des phénomènes physiques accompagnant les variations de température, soit les changements de phase de l’eau et la variation de solubilité des gaz.39 Leur modèle peut être résumé en trois phases. Dans un premier temps, lors du refroidissement, les gaz contenus dans les cellules du tissu xylémique du tronc se contractent et leur solubilité dans le liquide contenu dans la cellule (la sève) augmente. Cette dissolution accrue des gaz crée alors une pression négative qui induit, à son tour, un flux entrant de sève dans la cellule. Dans un deuxième temps, lorsque le point de congélation est atteint, l’eau
sur la paroi cellulaire est la première à se cristalliser et emprisonne la sève emmagasinée par la cellule. L’épaississement de cette couche glacée engendre ensuite une compression supplémentaire des gaz contenus dans la cellule. Finalement, lors du dégel, la forte pression intracellulaire est soulagée par l’expulsion de la sève. Des travaux plus récents, menés par Cirelli ont démontré que des facteurs osmotiques contribueraient également à l’écoulement de la sève.40 La mesure exacte de l’apport de leur participation au phénomène demeure cependant à déterminer.
1.1.2.1.2. Historique
Quoique plusieurs légendes amérindiennes différentes racontent l’origine du sirop d’érable, sa découverte serait plutôt de nature empirique selon les historiens.41 Selon eux, les autochtones auraient d’abord observé au printemps des goûtes de sèves couler depuis de petites entailles faites aux arbres, notamment par les oiseaux. Ils auraient par la suite découvert la formation de petites plaques cristallines au goût sucré formées par l’effet du soleil et du vent sur ces mêmes arbres, d’où l’idée de commencer à recueillir et concentrer la sève. Le sucre obtenu à l’époque prenait la forme d’un sirop très foncé au goût prononcé. Il pouvait représenter une part importante de l’apport calorifique quotidien de certaines populations à certaines périodes de l’année.41
Ce savoir-faire se serait par la suite transmis aux colons européens.42 C’est aux alentours de 1860 qu’aurait vraiment émergé la production artisanale de sirop d’érable telle qu’on la voit aujourd’hui, avec ses symboles phares que sont les érables entaillés et les chaudières métalliques fixées à leur tronc. Depuis, bien qu’il subsiste une certaine part de production artisanale, des innovations technologiques, dont l’introduction de tuyaux de PVC, le développement de système de pompe et la concentration par osmose inverse ont permis une certaine part d’automatisation et ont amélioré le rendement des érablières, donnant ainsi à la production acéricole son statut d’activité économique d’importance. Les détails de toutes les étapes de la production industrielle se retrouvent dans le chapitre de Perkins et van den Berg paru dans un volume de la série
Advances in Food and Nutrition Research.38
1.1.2.1.3. Impact économique
Même si elle représente une activité économique concentrée à une période très brève de l’année, la production de sirop d’érable représente un constituant majeur de l’industrie agroalimentaire, tant canadienne que québécoise. Selon Statistique Canada, 82 % du sirop d’érable exporté dans le monde en 2014 provenait d’entreprises acéricoles canadiennes.43 Les revenus générés par cette production se sont chiffrés à 310 M$ pour cette même période, les principaux marchés parmi les 53 pays importateurs étant les États-Unis, l’Allemagne et le Japon.43
Le Québec constitue la première province productrice, sa contribution représentant environ 90 % du volume national produit. Une étude effectuée par le groupe de recherche ÉcoRessources Consultants pour le compte de la Fédération des producteurs acéricoles du Québec (FPAQ) évaluait que l’ensemble de la filière de l’industrie acéricole (production, transformation, équipement et restauration) avait mené à la création de plus 10 000 nouveaux emplois en 2009, en plus de contribuer pour 735 M$ au PIB canadien.44 Des statistiques plus récentes concentrées à la production québécoise sont retrouvées dans le rapport « Dossier économique :
statistiques acéricoles 2015 » publié en novembre dernier par la FPAQ.45 En 2015, les 13 500 acériculteurs du Québec (répartis dans 7 182 entreprises) ont produit 107,2 millions de livres de sirop d’une valeur de 301 M$. Toujours selon la FPAQ, l’année courante (2016) en serait une record avec une production de 148,2 millions de livres représentant une valeur de 400 M$ pour les acériculteurs québécois.46
Bien que l’industrie de l’érable traverse une période de prospérité au Québec, certaines préoccupations ont émergé ces dernières années, concernant la croissance soutenue de la production américaine et son incidence sur la contribution québécoise au marché mondial. L’avènement d’une compétition étrangère plus imposante aurait, selon les plus récentes statistiques couvrant ces 10 dernières années, engendré un recul de 10 % de l’apport de la production québécoise au marché mondial des produits de l’érable.47 De plus, les acériculteurs seront de plus en plus appelés, au cours des prochaines années, à faire face aux nouveaux défis de production qui émergent avec les conséquences des changements climatiques.48-50 En effet, une étude québécoise récente, utilisant des modèles mathématiques afin de faire des projections quant au début et à la durée de la saison des sucres, a déterminé que les producteurs devront s’attendre à commencer à récolter la sève beaucoup plus tôt et devront se préparer à affronter plus fréquemment des saisons très écourtées par rapport à la moyenne.50 Conformément à ces problèmes, le rapport «Pour une industrie acéricole forte et
compétitive», commandé l’an dernier par le Ministère de l'Agriculture, des Pêcheries et de l'Alimentation du
Québec (MAPAQ) invite l’industrie québécoise à consolider sa position et assurer sa pérennité via, entre autres, la recherche et l’innovation.47
L’étude des composants moléculaires du sirop d’érable, selon une approche orientée vers les nutraceutiques et les aliments fonctionnels, s’inscrit parfaitement dans une telle démarche. En effet, de telles recherches pourraient mener à des découvertes qui attribueraient au sirop un avantage nutritionnel sur les autres agents sucrants courants. L'établissement de telles propriétés, qui donneraient une valeur ajoutée aux produits de l'érable, aurait évidemment un effet bénéfique pour l'industrie acéricole : un des fleurons de l'agroéconomie et de la culture québécoise.
![Figure 1.9 Caractéristiques structurelles attribuant au québécol un potentiel comme agent bioactif : présence de fonctions phénol [en rouge] et similitude avec le tamoxifène (1.44) [en bleu]](https://thumb-eu.123doks.com/thumbv2/123doknet/6438112.170835/51.918.130.546.106.324/caractéristiques-structurelles-attribuant-québécol-potentiel-présence-similitude-tamoxifène.webp)