UNIVERSITE TOULOUSE III – PAUL SABATIER
UFR Physique Chimie Automatique
T H E S E
Pour obtenir le grade de
DOCTEUR DE L’UNIVERSITÉ DE TOULOUSE III
Discipline : CHIMIE MACROMOLECULAIRE ET SUPRAMOLECULAIRE
Présentée et soutenue par
Rodolphe DELONCLE
Le 21
Décembre2007
DENDRIMERES PHOSPHORES A MOTIFS AZOBENZENE :
VERS DES NANOMATERIAUX PHOTOADAPTATIFS
Directeur de thèse : Dr Anne-Marie Caminade
JURY
MM R. MARTINO, Professeur à l’Université Paul Sabatier, Toulouse Président J.-P. DUTASTA, Directeur de recherche au C.N.R.S., Lyon Rapporteur M. TAILLEFER, Directeur de recherche au C.N.R.S., Montpellier Rapporteur J.-P. BOILOT, Professeur à l’Ecole Polytechnique, Palaiseau Examinateur Mlle A.-M. CAMINADE, Directeur de recherche au C.N.R.S., Toulouse
M. J.-P. MAJORAL, Directeur de recherche au C.N.R.S., Toulouse
Recherches effectuées au Laboratoire de Chimie de Coordination 205, route de Narbonne, 31077 TOULOUSE cedex 4
Page | 3
REMERCIEMENTS
Cette thèse a été effectuée au Laboratoire de Chimie de Coordination sous la direction des docteurs Anne-Marie Caminade et Jean-Pierre Majoral. Je les remercie pour m’avoir accueilli dans leur équipe et m’avoir donné les moyens de réaliser ces travaux.
Je souhaite également remercier les docteurs Jean-Pierre Dutasta et Marc Taillefer pour avoir accepté de juger ce travail, ainsi que les professeurs Jean-Pierre Boilot, qui a participé au jury, et Robert Martino pour l’avoir présidé.
Les travaux présentés dans ce manuscrit ont été réalisés en collaboration avec trois autre équipes que je tiens également à saluer. Je remercie donc les docteurs Yves Gnanou et Daniel Taton du Laboratoire de Chimie des Polymères Organiques de Pessac pour les expériences de polymérisation, ainsi que Jean-Pierre Desvergne et André Del Guerzo du Laboratoire de Chimie Organique et Organométallique de Talence qui ont réalisé les expériences de gélification. Le troisième groupe qui a participé à ce travail est celui de Chimie du Solide du Laboratoire de Physique de la Matière Condensée à l’Ecole Polytechnique dirigé par le professeur Jean-Pierre Boilot et le docteur Thierry Gacoin. Je tiens tout particulièrement à les remercier pour m’avoir accueilli pendant un mois pour effectuer les études d’incorporation dans des matrices sol-gel, ainsi que l’ensemble du groupe (ou assimilés…) pour leur bonne humeur et leur disponibilité : Bernard, Mélanie, Damien, Lorraine, Morgan, Mathieu, Khalid, Sandrine, Laetitia, Caroline, Isabelle, Sébastien et Audrey qui a débuté dans l’équipe en même temps que moi et qui m’a permis d’apprécier ce mois « enfermé » dans le campus polytechnique.
Mais ce travail a également été rendu possible par les services communs du LCC grâce à toute l’aide qu’ils m’ont fournie. Je voudrais ainsi plus particulièrement remercier Francis Lacassin et Yannick Coppel pour toutes les discussions en RMN et Phil de la bibliothèque pour les nombreux articles « exotiques » qu’il a déniché pour moi.
Je me dois maintenant de mentionner les membres de l’équipe M avec qui j’ai traversé ces trois années de thèse : Régliss’ (et ses meubles en carton), Clem’ (cheval pouèt pouèt), Cyrille (et ses manips détonantes !!!), Armelle (et son téléphone et sa voiture), Lolo, Grand Greg (et ses problèmes de cheville et de pied…), Bob (le parisien de service), Paul (le swedish dancing baby), Patou
(Porto-Page | 4
cahouètes), P’tit Greg (vive Babylon Circus), Emilyne, Ed, Alexandrine, le clan des espagnoles (Elena, Anna, Mar, Alba), Sabine, Rama, David, Venkat, Marco et j’en oublie certainement…
Au cours de ces années, j’ai également rencontré beaucoup de monde dans les autres équipes dont avec lesquels il y a eu plus que des échanges scientifiques… Je pense ainsi aux « Igaux » (Stéph’, Otro, Alain, Pierre, Isabelle, Emilie, Dung…), Kiki (c’est génial le poker !!!), le petit Vincent (les Senséos sont sensationnelles), Yoyo (LE fan de Catherine Lara), Laure, Cédric, Agnès… Ce séjour a également été rythmé par les péripéties d’une équipe venue du froid. Je tiens donc à saluer les héros, des fois malgré eux, du soap « la vie de Dzi-F » : Lapinou, Schrimpy, Tété, Peu et Jazz…
Je tiens également à remercier tous mes amis qui m’ont aidé au cours de cette thèse. En premier lieu, je souhaite remercier très chaleureusement Fifine (miss matching) et Freddy (vive le pétrole et le Gabon !!!) pour tous les bons moments que nous avons passés ensemble depuis le DEUG. Merci aussi à Clément (alias Marvin ou Caliméro), Adrien (et son fauteuil Ikéa), Stéphanie (vive les Ch’tis !!!), Yiqian (mais il est très bien ce poster…), July (et ses soirées où on pousse les voitures) et Bambinette (les pique nique au bord du lac, c’est chouette !).
Enfin, je souhaite adresser un énorme merci à ma famille pour m’avoir aidé (et supporté…) depuis toujours… C’est un peu grâce à vous que j’ai obtenu ce titre de docteur.
Page | 5
TABLE DES MATIERES
INTRODUCTION GENERALE ... 9
CHAPITRE 1 – AZOBENZENE ET DENDRIMERES ... 11
I. Nanomatériaux et systèmes photochromiques. ... 13
A. Le photochromisme. ... 13
B. Matériaux photosensibles. ... 15
II. L'azobenzène et sa photochimie. ... 17
A. Classification des azobenzènes. ... 18
B. La photoisomérisation. ... 20
III. Les dendrimères azobenzène et leurs utilisations. ... 23
A. Les dendrimères. ... 23
B. Dendrimères photosensibles. ... 30
CHAPITRE 2 - SYNTHESE DU MOTIF AZOBENZENE ... 79
I. Introduction ... 80
II. Modification d’un azobenzène. ... 83
A. Par oxydation d’un alcool benzylique. ... 83
Page | 6
III. Synthèse du 4-aminobenzaldéhyde. ... 87
A. A partir du 4-nitrobenzaldéhyde. ... 88
B. A partir du 4-nitrotoluène. ... 95
IV. Conclusion. ... 95
V. Partie expérimentale. ... 96
CHAPITRE 3 - SYNTHESE DES DENDRIMERES AZOBENZENE ... 101
I. Introduction. ... 103
II. Synthèse des dendrimères à cœur hexafonctionnel. ... 104
A. Synthèse classique des dendrimères. ... 104
B. Synthèse des dendrimères azobenzènes. ... 107
III. Synthèse des bis-dendrons... 115
A. Voie de l’azodiphénol. ... 115
B. Voie de synthèse AB5. ... 117
IV. Caractérisation par RMN de l’azote. ... 122
A. Caractérisation des dendrimères. ... 123
B. Etude de l’isomérisation des dendrimères azobenzènes. ... 129
V. Conclusion. ... 130
VI. Partie expérimentale. ... 131
A. Procédure des études de RMN de l’azote. ... 131
Page | 7
CHAPITRE 4 : PREPARATION DES HYBRIDES DENDRIMERE-POLYMERE EN ETOILE ... 143
I. Introduction. ... 144
II. Les polymérisations radicalaires vivantes contrôlées. ... 144
A. Procédé RAFT. ... 145
B. Procédé ATRP. ... 147
C. Polymères en étoile. ... 148
III. Dendrimères et procédé RAFT. ... 149
A. Le dithiocarbazate. ... 150
B. Le trithiocarbonate. ... 158
IV. Dendrimères et procédé ATRP. ... 159
A. Synthèse des dendrimères. ... 159
B. Essais de polymérisation. ... 161
V. Conclusion. ... 163
VI. Partie expérimentale. ... 163
A. Procédure générale pour les expériences de polymérisation. ... 163
B. Synthèse des produits. ... 163
CHAPITRE 5 : DENDRIMERES ET GELS ... 171
I. Introduction. ... 173
II. Dendrimères pour la formation de gels. ... 173
A. Gélification et dendrimères... 173
Page | 8
C. Essais de gélification. ... 177
III. Matériaux hybrides organiques-inorganiques. ... 181
A. Nanocomposites hybrides organiques-inorganiques et dendrimères. ... 182
B. Le procédé sol-gel. ... 183
C. Synthèse des dendrimères diéthylammonium. ... 185
D. Couches moléculaires de dendrimères azobenzène. ... 187
E. Structures mésoporeuses pour l’élaboration de couches bas indice. ... 190
F. Films sol-gel photochromiques à base de dendrimères azobenzène. ... 192
IV. Conclusion. ... 195
V. Partie expérimentale. ... 196
A. Mesures d’ellipsométrie. ... 196
B. Synthèse des dendrimères. ... 197
CONCLUSION GENERALE ... 201
LISTE DES ABREVIATIONS ... 203
Page | 9
INTRODUCTION GENERALE
Depuis 1959 et la conférence de Richard Feynman introduisant le concept de nanotechnologie, ce domaine n’a cessé de progresser au point d’être considéré de nos jours comme la réponse à de nombreux problèmes allant de la découverte de nouveaux médicaments, à la décontamination de l’eau ou à l’obtention de matériaux ou de moyens électroniques et de communication plus performants. La dépense mondiale pour les nanotechnologies a d’ailleurs été de 5 milliards d’euros en 2004, montrant qu’il s’agit là d’un véritable enjeu pour l’avenir des sciences.
Depuis une vingtaine d’années, les dendrimères sont un des acteurs majeurs de ces nanotechnologies. De par leur architecture unique, ils garantissent des nano-objets à la structure parfaitement définie et monodisperse grâce à leur synthèse étape par étape, hyper-ramifiée et présentant un grand nombre de groupes fonctionnels à leur surface, ce qui conduit à l’apparition de propriétés exceptionnelles trouvant des applications dans de nombreux domaines (catalyse, biologie, matériaux…).
Ainsi, le but du travail que nous allons présenter dans ce manuscrit est l’obtention de nouveaux matériaux photoadaptatifs à base de dendrimères photosensibles. L’introduction de molécules d’azobenzène, un des chromophores les plus connus dans le domaine des matériaux photosensibles, devrait permettre des modifications photoinduites dans les branches du dendrimère conduisant de ce fait à des changements dans les interactions entre les molécules pouvant avoir des conséquences macroscopiques sur le milieu dans lequel elles sont incorporées. En collaboration avec plusieurs laboratoires, nous avons donc envisagé l’élaboration de trois types de nanomatériaux à base de dendrimères azobenzène : des hybrides dendrimère-polymère en étoile, des hydrogels et des hybrides organiques-inorganiques.
Nous commencerons tout d’abord dans le premier chapitre par un rappel des propriétés de l’azobenzène suivi par un tour d’horizon des différents travaux réalisés en vue de son incorporation dans différents types de dendrimères.
Les deuxième et troisième chapitres seront l’occasion de présenter nos travaux de synthèse afin d’obtenir des dendrimères phosphorés incorporant des azobenzènes. Dans un premier temps, nous présenterons la préparation du motif azo que nous avons introduit dans nos molécules puis nous enchaînerons avec la synthèse des dendrimères proprement dite. Nous présenterons alors les
Page | 10 différentes structures dendritiques que nous avons envisagées ainsi que leur caractérisation par RMN de l’azote de manière simple et rapide sans avoir à réaliser la synthèse de molécules enrichies. Le quatrième chapitre marquera le début de nos études en vue de l’obtention de matériaux photosensibles. Le premier type de structure envisagé est des hybrides dendrimère-polymère en étoile. Nous présenterons à cette occasion les travaux que nous avons menés en collaboration avec le LCPO de Pessac pour permettre la polymérisation radicalaire à la surface des dendrimères. Les copolymères hybrides à cœur photosensibles ainsi obtenus pourraient permettre des applications en tant qu’agents à viscosité photocontrôlable par exemple.
Le cinquième et dernier chapitre verra le développement des travaux que nous avons menés afin d’élaborer les deux derniers types de nanomatériaux. Tout d’abord, nous examinerons les études réalisées avec le LCOO de Talence au sujet d’hydrogels. L’élaboration de dendrimères chargés positivement à leur surface permet de disposer d’agents gélifiants qui pourraient se révéler réversibles grâce à la présence du motif azobenzène. De tels systèmes pourraient permettre l’incorporation de substances dans les gels et leur relargage contrôlé par la lumière. Enfin, la dernière catégorie de matériaux réalisés au LPMC de Palaiseau est constituée de films minces de silice incorporant des dendrimères azobenzène chargés positivement. Ce type de structures devrait permettre l’obtention de couches à faible indice de réfraction dans le cas de l’incorporation de dendrimères sans azos, et de systèmes à libération de substances contrôlée par la lumière dans le cas des dendrimères avec azobenzènes.
L’ensemble de ce travail revêt donc un double intérêt. Non seulement il permet l’étude de modifications de la matière à l’échelle nanométrique ayant des conséquences macroscopiques, mais il fournit également la possibilité d’obtenir de nouveaux matériaux photoadaptatifs qui pourraient conduire à de possibles applications, que nous venons d’évoquer.
Page | 11
CHAPITRE 1 – AZOBENZENE ET DENDRIMERES
Table des matières
I. Nanomatériaux et systèmes photochromiques. ... 13
A. Le photochromisme. ... 13
B. Matériaux photosensibles. ... 15
II. L'azobenzène et sa photochimie. ... 17
A. Classification des azobenzènes. ... 18
B. La photoisomérisation. ... 20
1) Spectroscopie. ... 20
2) Mécanisme. ... 21
III. Les dendrimères azobenzène et leurs utilisations. ... 23
A. Les dendrimères. ... 23 1) Introduction. ... 23 2) Synthèse. ... 25 a) Stratégie divergente. ... 25 b) Stratégie convergente. ... 28 B. Dendrimères photosensibles. ... 30 1) Introduction. ... 30 2) Polymères azobenzène. ... 32
Page | 12
a) Mouvements du chromophore : la photo-orientation. ... 33
b) Mouvements de domaines : le photo-switching. ... 35
c) Mouvements macroscopiques et migration de matière. ... 36
3) Dendrimères azobenzène. ... 38
a) Au cœur. ... 38
b) A la périphérie. ... 53
c) Dans les branches. ... 69
Page | 13 Au cours de ce chapitre, nous allons faire quelques mises au point qui nous seront utiles dans le reste de l’exposé. Dans un premier temps, nous allons donc faire un petit rappel sur le photochromisme et sur son apport dans le monde des matériaux. Ensuite, après un résumé sur les propriétés de l’azobenzène, nous ferons le point sur son incorporation dans les dendrimères et quel genre d’application est visé.
Nous allons donc commencer par un rappel sur les nanomatériaux photochromiques.
I.
Nanomatériaux et systèmes photochromiques.
Les nanomatériaux sont une branche très active des nanosciences grâce à leur utilisation dans de nombreux domaines. Dans la suite de cette thèse, nous allons nous intéresser aux nanomatériaux photosensibles. De tels systèmes fonctionnels qui montrent une réponse contrôlée par la lumière ont un très grand potentiel dans de nombreuses applications car ils permettent la manipulation du matériau en évitant tout contact. Cette photosensibilité est obtenue par l’introduction d’un groupement aux propriétés photochromiques dans le matériau. Nous allons donc maintenant faire le point sur le photochromisme et ses possibles applications dans le domaine des matériaux.
A.
Le photochromisme.
Le photochromisme a été décrit pour la première fois par Fritsche en 1867 lorsqu’il observa que le tétracène en présence d’air et de lumière donne un matériau incolore qui se régénère en tétracène par chauffage.1
Ce phénomène est défini comme la transformation réversible d’une espèce chimique, induite dans une ou chacune des directions par l’absorption d’une radiation électromagnétique, entre deux formes A et B ayant des spectres d’absorption différents
1
M. Fritsche, Comp. Rend., 1867, 69, 1035.
Page | 14 (Figure 1).2 Le plus souvent, le processus ne met en jeu l’absorption que d’un seul photon mais il faut savoir que des absorptions à deux photons sont possibles.
Les processus les plus communs impliqués dans le photochromisme sont les réactions péricycliques, les isomérisations cis-trans, les transferts intramoléculaires d’hydrogène, les transferts intramoléculaires de groupements, les processus de dissociation et les transferts électroniques (oxydoréduction).
L’isomérisation cis-trans est le procédé qui apparait dans le cas des stilbènes et des azobenzènes ainsi que quelques récepteurs photochromiques biologiques.
Les transferts intramoléculaires d’hydrogène sont retrouvés pour les anils, benzylpyridines, triazoles et oxazoles par exemple.
Les transferts intramoléculaires de groupements sont observés dans les quinones polycycliques.
Les processus de dissociation sont en fait des ruptures de liaison. Ils peuvent être hétérolytiques comme dans le cas des composés de la famille des triarylméthanes, ou homolytiques pour les tétrachloronaphtalènes, le perchlorotoluène, les hydrazines…
2
Page | 15 Les transferts électroniques, qui sont en fait des réactions d’oxydoréduction, peuvent être observés dans les viologènes et les systèmes proches.
Malgré les différents types de mécanisme, toutes les réactions photochromiques sont des processus non destructifs. Cependant, il existe une perte de performance avec le temps due à une dégradation du chromophore : c’est la « fatigue ». Habituellement, la cause majeure est une oxydation. Seuls les composés montrant une bonne résistance à ce phénomène seront donc utilisés pour des applications.
B.
Matériaux photosensibles.
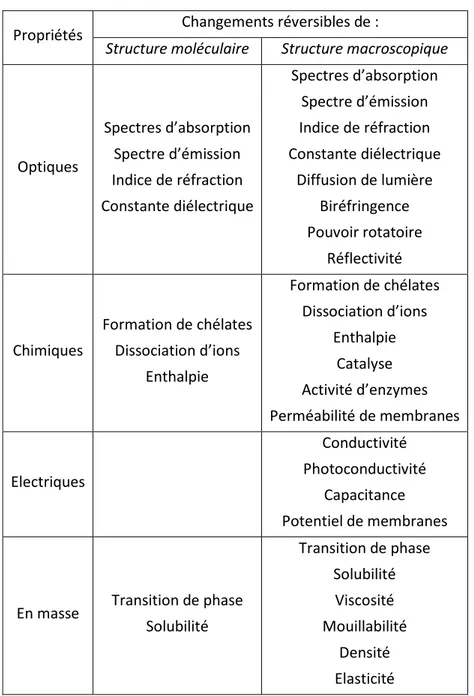
Il est à noter que les transformations réversibles à l’échelle moléculaire peuvent induire des changements conformationnels des molécules de la matrice entourant les photochromes. Alors que les altérations réversibles des propriétés dues aux modifications moléculaires sont plutôt limitées, des différences dans les propriétés physiques et chimiques peuvent être observées quand des molécules photo-isomérisées déclenchent des réarrangements conséquents de leur microenvironnement. Ainsi, sous irradiation, les matériaux photochromiques montrent beaucoup de changements de propriétés dont quelques exemples sont listés dans le Tableau 1.3
Les matériaux organiques qui incorporent des unités photochromiques sont photosensibles macroscopiquement, et leurs propriétés optiques et/ou leur structure peuvent être manipulées par la lumière. Les changements structurels photoinduits des unités photochromiques dans des polymères conduisent à des altérations des propriétés macroscopiques telles que des modifications de transition de phase, viscosité, solubilité, mouillabilité, élasticité… (Tableau 1).
3
K. Ichimura, Photochromism: Molecules and systems, H. Durr, H. Bouas-Laurent, Elsevier Amsterdam, 1990, 903.
Page | 16 Propriétés Changements réversibles de :
Structure moléculaire Structure macroscopique
Optiques Spectres d’absorption Spectre d’émission Indice de réfraction Constante diélectrique Spectres d’absorption Spectre d’émission Indice de réfraction Constante diélectrique Diffusion de lumière Biréfringence Pouvoir rotatoire Réflectivité Chimiques Formation de chélates Dissociation d’ions Enthalpie Formation de chélates Dissociation d’ions Enthalpie Catalyse Activité d’enzymes Perméabilité de membranes Electriques Conductivité Photoconductivité Capacitance Potentiel de membranes
En masse Transition de phase Solubilité Transition de phase Solubilité Viscosité Mouillabilité Densité Elasticité
Tableau 1 : Exemples de changements de propriétés à l’échelle moléculaire et macroscopique.3
Comme nous venons de le voir, l’énergie lumineuse absorbée par les unités photochromiques permet d’obtenir à la fois des modifications de propriétés physiques aussi bien que chimiques du matériau. De manière générale, les applications du photochromisme peuvent être divisées en deux catégories :
-celles liées à un changement dans le spectre d’absorption ou d’émission comme les matériaux optiques à transmission variable, le stockage optique d’informations, les cosmétiques…
Page | 17 -celles liées à des changements d’autres propriétés physiques ou chimiques comme l’indice de réfraction, la solubilité, la viscosité, la mouillabilité…
Ces matériaux peuvent se montrer très intéressants pour des applications dans des systèmes tels que des interrupteurs optiques, des nanovalves, des libérations ciblées de principes actifs, des capteurs chimiques, du stockage optique de données et des machines moléculaires animées par la lumière. Néanmoins, plus de 100 ans ont passé depuis la découverte du photochromisme et malgré le nombre important de recherches dans le domaine, les études se limitent à un nombre relativement restreint de chromophores. Parmi ceux-ci, l’azobenzène est un des plus étudiés car sa réaction de photoisomérisation est la plus propre connue à ce jour. Nous allons donc maintenant nous intéresser à l’azobenzène, à ses propriétés et ses différentes applications.
II.
L'azobenzène et sa photochimie.
L'azobenzène est une molécule composée de deux cycles benzéniques reliés par une double liaison N=N. Le terme "azobenzène" ou simplement "azo" est utilisé pour décrire une très grande variété de molécules qui partagent cette même structure de base; néanmoins, la nomenclature officielle leur attribue le nom de "diazènes".
L'azobenzène a été observé pour la première fois en 1856 par Noble sous forme de "lamelles
cristallines rouges-orangées".
1
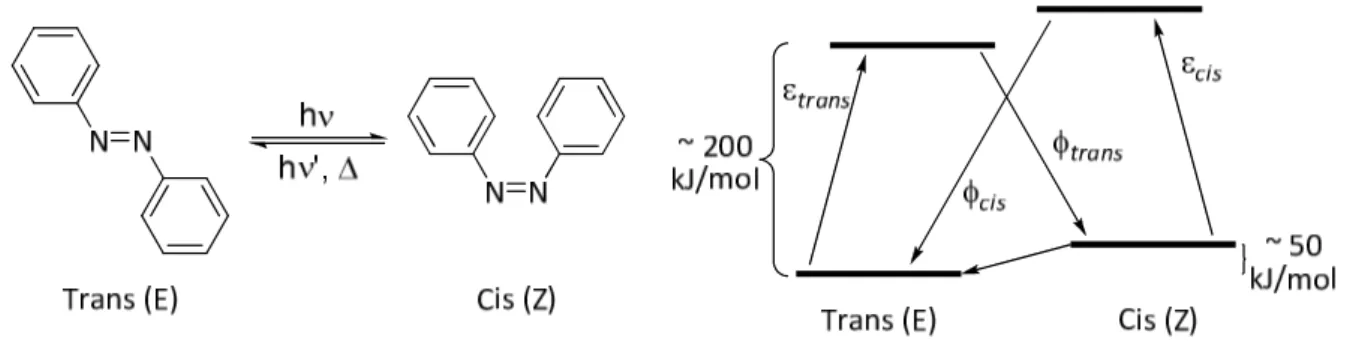
Cependant, ce n'est que bien plus tard, en 1937, que Hartley a observé le phénomène d'isomérisation photochimique et mis en évidence l'existence de deux diastéréoisomères2 : la forme E (trans) et la forme Z (cis) (Figure 2).
1
A. Noble, Annalen der Chemie und Pharmacie, 1856, 98, 253.
2
Page | 18
Figure 2 : Réaction d’isomérisation trans-cis de l'azobenzène et diagramme d’énergie simplifié.3
Dans la majorité des cas, la forme trans est thermodynamiquement la plus stable : la différence d'énergie entre les deux isomères est de l'ordre de 50 kJ/mol à température ambiante.4
La réaction de photoisomérisation consiste à passer de la forme trans à la forme cis par voie photochimiques. Les temps de réaction sont de l’ordre de quelques picosecondes et la barrière d’activation à franchir est d’environ 200 kJ/mol.5 Le retour de la forme cis à la forme trans a lieu soit spontanément par voie thermique, soit par voie photochimique.
A.
Classification des azobenzènes.
Avant d'examiner la photoisomérisation d'un point de vue mécanistique, il est important de faire la distinction entre les différentes classes d'azobenzènes. Rau a défini trois catégories de dérivés azos en fonction de l'ordre relatif des énergies des états singulets de plus basse énergie associées aux transitions n-π* et π-π* : les azobenzènes, les aminoazobenzènes et les pseudo-stilbènes.4
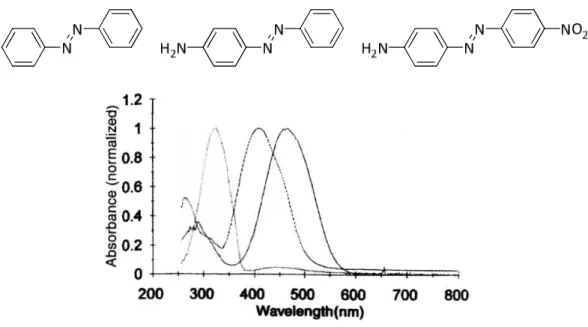
L'assignation d'un système contenant un azobenzène à l'une des catégories peut être faite par simple observation du spectre d'absorption (Figure 3) et l’appartenance à un groupe dépend fortement des substituants portés par la molécule.
3
K.G. Yager, C.J. Barrett, J. Photochem. Photobiol., A Chem., 2006, 182, 250.
4
H. Rau, Photochromism: Molecules and systems, H. Durr, H. Bouas-Laurent, Elsevier Amsterdam, 1990, 165.
5
Page | 19
Figure 3 : Spectres d'absorption des trois classes d'azobenzènes (de gauche à droite : azobenzène,
aminoazobenzène et pseudo-stilbène).4
Les molécules du type azobenzène sont similaires à l’azobenzène non-substitué. Elles sont caractérisées par une bande n-π* de faible intensité dans le visible, bien séparée de la bande π-π* de forte intensité dans l'UV. Pour ces molécules, le retour thermique à la forme trans est lent et il est donc possible d'isoler l'isomère cis.
Les aminoazobenzènes sont substitués en position ortho ou para par un groupe électrodonneur, typiquement, un groupement amine. Cette famille de composés présente un très faible écart entre les bandes n-π* et π-π* et une forte absorption dans le bleu. En fait, leur ordre relatif est déterminé par le solvant. Comparativement au groupe précédent, l'isomérisation retour est plus rapide.
Ce dernier groupe des pseudo-stilbènes est constitué de molécules de type push-pull : elles sont substituées par des groupements donneurs et accepteurs en position para de chaque cycle benzénique. Les composés de cette famille présentent une seule bande d’absorption dans le visible, intense et large, correspondant à une seule bande π-π* qui recouvre la n-π*. Pour ces molécules, le retour à la forme trans est très rapide, de l'ordre de quelques millisecondes en solution à quelques secondes dans une matrice de polymères.
Page | 20
B.
La photoisomérisation.
1) Spectroscopie.
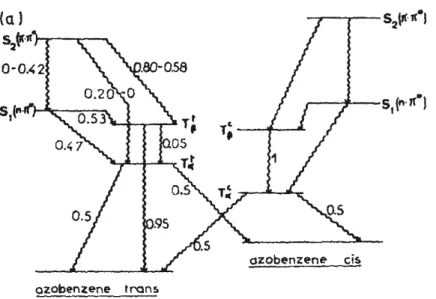
Comme nous l'avons vu précédemment, l'isomérisation est une réaction photochimique. Elle résulte de l'excitation d'un électron appartenant soit à la plus haute orbitale non liante occupée (notée n), soit à la plus haute orbitale π occupée, vers la plus basse orbitale π non occupée (notée π*). La transition n-π* est associée au passage de la molécule de son état fondamental au premier état singulet S1, tandis que la transition π-π* correspond au passage d'un électron de l'état fondamental au deuxième état singulet S2 (Figure 4).
Figure 4 : Diagramme d'énergie de l'azobenzène impliquant les états triplets. Les chiffres indiquent les
probabilités correspondant à la transition électronique.6
L'isomérisation peut être induite soit directement, soit en utilisant les niveaux triplets intermédiaires (Figure 4). En effet, Ronayette et al ont montré que l’isomérisation de l’azobenzène peut être sensibilisée par des composés aromatiques (phénanthrène, naphtalène) grâce à des transferts d’énergie triplet-triplet.6
Cependant, il existe peu de données spectroscopiques concernant les énergies des états triplets du fait de l'absence de phosphorescence et la majorité des études sont des calculs théoriques
6
Page | 21 confrontés aux résultats expérimentaux. La spectroscopie associée à la réaction de photoisomérisation est donc encore mal connue et fait l'objet de nombreuses études
2) Mécanisme.
Le mécanisme de photoisomérisation de l'azobenzène demeure un sujet de controverse depuis de nombreuses années. Deux voies ont été envisagées pour expliquer ce phénomène : l'inversion et la rotation (Figure 5).
Figure 5 : Les mécanismes possibles de la photoisomérisation (inversion et rotation)
Dans un premier temps, la très grande ressemblance entre l'azobenzène et son isostère, le stilbène, a suggéré que leur mécanisme d'isomérisation est le même. L'isomérisation aurait lieu par rotation autour de la liaison centrale N-N avec rupture de la double liaison.
Par la suite, Curtin a proposé un mécanisme d'inversion dans lequel il y a réhybridation des systèmes n et σ du groupe azo. Il en résulte une inversion dans le plan de la molécule d'un des phényles en passant par un état de transition semi-linéaire (mécanisme similaire à celui de l'isomérisation des imines).4
Page | 22 Finalement, Rau et Lüddekcke ont montré que les deux mécanismes sont mis en jeu : la rotation pour une excitation à l'état singulet S2 et l'inversion pour une excitation à l'état singulet S1.
7
Cependant, récemment, Diau a proposé un mécanisme d'isomérisation alternatif, l'inversion concertée, dans lequel les angles des liaisons CNN se plient en même temps et dans le plan de la molécule.8 Ceci montre que malgré les décennies d'investigation, la question n'a toujours pas été tranchée avec certitude, sans doute à cause de données spectroscopiques insuffisantes (très peu de fluorescence et pas de phosphorescence).
Par contre, pour ce qui est du retour thermique de la forme cis à la trans, le mécanisme d'inversion, par analogie avec ce qui se passe pour les imines, semble accepté.5
Même si les aspects mécanistiques et spectroscopiques de l’isomérisation sont encore mal connus, il a été montré que, au cours de la réaction, la molécule d'azobenzène va subir des changements structuraux très importants comme le montrent les modifications de moment dipolaire et de géométrie.
Figure 6 : Changements géométriques au cours de l'isomérisation.9
En effet, la distance entre les deux carbones para passe de 9 Å dans la forme trans à 5,5 Å dans la forme cis (Figure 6). De la même manière, le trans-azobenzène n'a pas de moment dipolaire alors que celui de l'isomère cis est de 3 D.9
La réaction de photoisomérisation de l’azobenzène est la réaction photochimique la plus propre connue à ce jour : il n’existe pas de réaction parasite ce qui fait que la molécule peut subir de très nombreux cycles d’isomérisations et de retours sans être endommagée. De plus, ce processus
7
H. Rau, E. Lüddecke, J. Am. Chem. Soc., 1982, 104, 1616.
8
E.W.G. Diau, J. Phys. Chem. A, 2004, 108, 950.
9
Page | 23 provoque de grands changements structuraux au niveau du chromophore ce qui fait des azobenzènes de bons candidats en tant que constituants d’interrupteurs moléculaires, de dispositifs de stockage optique ou encore des matériaux avec des propriétés physiques ou optiques photomodulables.
III.
Les dendrimères azobenzène et leurs utilisations.
La majorité de la bibliographie concernant l’isomérisation de l’azobenzène et les mouvements photoinduits qui lui sont associés se réfère aux systèmes polymériques ayant le chromophore lié de manière covalente à la chaîne ou dissous dans la matrice. Cependant, il existe un intérêt grandissant pour les dendrimères incorporant des groupements azobenzène dans leur structure et pour leur comportement photochimique. Nous allons donc nous intéresser à ces systèmes et avant toute chose présenter l’objet dendrimère.
A.
Les dendrimères.
1) Introduction.
Les dendrimères sont des macromolécules globulaires avec une structure régulière et hyper-ramifiée (Figure 7).
Figure 7 : Taille et structure des dendrimères PAMAM.10
Ils sont constitués de monomères associés selon un processus arborescent autour d’un cœur central plurifonctionnel. Ils sont synthétisés selon une séquence itérative de réactions dans laquelle chaque cycle conduit à une molécule de génération supérieure. Le mot dendrimère vient du grec dendri- (qui
10
Page | 24 signifie « arbre ») et meros (qui signifie « partie de »), et a été introduit par Tomalia dans le premier article sur les dendrimères poly(amidoamine).11
F F F F F F F F F F F F F F F F F F F F F F F F F F F F F F F F F F F F F F F FF FF F F F F F Surface : ‐ multifonctionnalisation ‐ dimension, forme ‐ effets stériques Intérieur : ‐ cavités ‐ multiplicité de branches ‐ fonctions 2èmegénération 4èmegénération Coeur : ‐ multiplicité ‐ dimension, forme ‐ fonctions
Figure 8 : Représentation schématique d’un dendrimère de quatrième génération.12
La structure dendritique est décrite par un vocabulaire très précis. Tout commence avec le cœur du dendrimère, ou point focal dans le cas des dendrons, qui est le point d’ancrage des branches. C’est lui qui va définir la structure en lui conférant une certaine géométrie en fonction de sa multiplicité (entre 2 et 8). De plus, il peut être porteur d’une fonction spécifique qui va le rendre fluorescent ou le transformer en site catalytique. Sur ce cœur vont donc venir s’accrocher des branches constituées de monomères. Ce sont eux qui vont déterminer les propriétés du squelette dendritique d’après leurs propriétés (forme, rigidité, réactivité, fonctions). Ensuite, nous allons trouver les points de divergence qui vont définir chaque nouvelle génération. La plupart du temps, ce sont des hétéroatomes et leur multiplicité va fixer le nombre de fonctions terminales. Enfin, il y a les fonctions de surface qui vont déterminer une grande partie des propriétés physiques et chimiques du dendrimère telles que la solubilité et la réactivité. Il est à noter que l’intérieur du dendrimère renferme des cavités qui vont pouvoir accueillir des molécules (utilisation du dendrimère en tant que « boîte »).
11
D.A. Tomalia, H. Baker, J. Dewald, M. Hall, G. Kallos, S. Martin, J. Roeck, J. Ryder, P. Smith, Polym. J., 1985, 17, 117.
12
Page | 25 Les premiers dendrimères ont été décrits en 1978 par Vögtle lorsqu’il a rapporté la « synthèse en cascade » de polyamines de bas poids moléculaire.13 Quelques années plus tard, Denkewalter a déposé plusieurs brevets concernant la synthèse de dendrimères de L-lysine.14 Les premières structures dendritiques à vraiment attirer l’attention furent les dendrimères poly(amidoamine) (PAMAM) de Tomalia11 et les dendrimères polyamide ou « arborols » de Newkome15 en 1985. En 1990, Fréchet et Hawker introduirent une méthode de synthèse convergente,16,17 contrairement aux méthodes concurrentes dites divergentes, et enfin, en 1993, Meijer et Mülhaupt présentèrent une version améliorée de la synthèse de Vögtle permettant d’obtenir des poly(propylene imine) (PPI).18,19
2) Synthèse.
Comme nous l’avons vu précédemment, deux approches complémentaires, les stratégies divergente et convergente, ont été utilisées pour la synthèse des dendrimères.20
a) Stratégie divergente.
Historiquement, les premiers travaux dans le domaine des dendrimères suivent la stratégie divergente. Dans ce schéma de synthèse, le dendrimère est préparé à partir d’un cœur plurifonctionnel par la répétition d’une séquence de réactions d’activation et de couplage (Figure 9) : la croissance a lieu de l’intérieur vers l’extérieur.
La première étape est le couplage des fonctions de la périphérie du cœur avec le groupement réactif complémentaire du monomère. Ceci a pour effet d’introduire un point de divergence à chaque site de couplage, augmentant ainsi le nombre de fonctions de surface. La deuxième étape est une activation des fonctions de surface afin d’obtenir des groupements périphériques capables de se coupler avec d’autres monomères et permet l’obtention d’un dendrimère de première génération. Cette étape peut correspondre à la conversion des extrémités en fonctions réactives, au couplage
13
E.W. Buhleier,W. Wehner, F. Vögtle, Synthesis, 1978, 2, 155.
14
R.G. Denkewalter, J.F. Kolc, W.J. Lukasavage, U.S. Pat. 4289872, 1981; U.S. Pat. 4360646, 1982; U.S. Pat. 4410688, 1983.
15
G.R. Newkome, Z. Yao, G.R. Baker, V.K. Gupta, J. Org. Chem., 1985, 50, 2003.
16 C.J. Hawker, J.M.J. Fréchet, J. Am. Chem. Soc., 1990, 112, 7638. 17
C.J. Hawker, J.M.J. Fréchet, Chem. Commun., 1990, 1010.
18
C. Wörner, R. Mülhaupt, Angew. Chem., Int. Ed. Engl., 1993, 32, 1306.
19
E.M.M. Brabander-van den Berg, E.W. Meijer, Angew. Chem., Int. Ed. Engl., 1993, 32, 1308.
20
Page | 26 avec une deuxième molécule, ou à la suppression de groupes protecteurs. L’orthogonalité des conditions de réaction entre les deux étapes permet de prévenir des ramifications incontrôlées.
Cette stratégie de synthèse est idéale pour des productions à grande échelle puisque la quantité de dendrimère double à chaque étape. Cependant, le nombre de fonctions de surface augmentant de façon exponentielle, la probabilité de fonctionnalisation incomplète ou de réaction parasite croît de la même manière. De plus, si le monomère en excès n’a pas été éliminé, de petites impuretés dendritiques peuvent apparaître. Enfin, avec la montée en génération, l’encombrement stérique entre les branches à la périphérie du dendrimère augmente : c’est la théorie du « dense packing » de De Gennes21 qui stipule qu’il existe une limite théorique à la croissance des dendrimères due à la congestion de la surface. Tous ces éléments permettent de dire que les dendrimères de haute génération produits selon cette méthode peuvent contenir un nombre de défauts non négligeable.
21
P.G. de Gennes, H.J. Hervet, J. Physique-Lett. (Paris), 1983, 44, 351.
Figure 9 : Croissance dendritique
Page | 27 A ce jour, la stratégie divergente est la plus employée et les principaux types de dendrimères synthétisés de cette manière sont les dendrimères PAMAM de Tomalia22 et PPI de Meijer,23 les arborols de Newkome24,25 et les dendrimères phosphorés de Majoral (Figure 10).26,27
N N N H2N H2N H2N H2N N N N NH2 NH2 NH2 NH2 n N N H O HN O NH O N N N MeO2C CO2Me CO2Me CO2Me MeO2C CO2Me O O O CONHC(CH2OH)3 (HOH2C)3CHNOC (HOH2C)3CHNOC (HOH2C)3CHNOC CONHC(CH2OH)3 (HOH2C)3CHNOC CONHC(CH2OH)3
(HOH2C)3CHNOC CONHC(CH2OH)3
P N P NP N O O O O OO N N P S N N P S NN PS N NP S N N P S N N P S O O OO O O OO O O O O OHC CHO CHO CHO OHC OHC OHC CHO CHO CHO CHO CHO
Figure 10 : Principaux dendrimères synthétisés par voie divergente (de gauche à droite et de haut en bas :
dendrimère PPI, arborol, dendrimère phosphoré et dendrimère PAMAM)
22
D.A. Tomalia, H. Baker, J. Dewald, M. Hall, G. Kallos, S. Martin, J. Roeck, J. Ryder, P. Smith, Macromolecules,
1986, 19, 2466.
23
D.A. O’Sullivan, Chem. Eng. News, 1993, 20.
24
G.R. Newkome, C.N. Moorefield, G.R. Baker, A.L. Johnson, R.K. Behera, Angew. Chem., Int.Ed. Engl., 1991, 30, 1176.
25
.R. Newkome, C.N. Moorefield, G.R. Baker, M.J. Saunders, S.H. Grossman, Angew. Chem., Int.Ed. Engl., 1991, 30, 1178.
26
N. Launay, A.M. Caminade, R. Lahana, J.P. Majoral, Angew. Chem., Int. Ed. Engl., 1994, 33, 1589.
27
Page | 28 b) Stratégie convergente.
La croissance convergente, introduite par Hawker et Fréchet en 199016,17, tout comme la stratégie divergente, demande une séquence itérative d’étapes d’activation et de couplage pour la montée en génération (Figure 11). Cependant, le nombre de réactions individuelles reste constant (deux ou trois réactions en général) et n’augmente pas de manière exponentielle comme dans l’approche divergente.
La croissance commence à partir de ce qui deviendra l’extérieur de la molécule et progresse vers l’intérieur par un couplage entre les groupements terminaux et chaque branche du monomère. Une fois la réaction effectuée, le seul groupe fonctionnel au point focal du fragment dendritique, ou dendron, peut être activé. Ce fragment peut ensuite être couplé avec les extrémités d’un autre monomère pour obtenir un dendron de génération plus élevée, ou alors réagir avec un cœur polyfonctionnel pour former un dendrimère « multi-dendrons ».
Tout comme la stratégie divergente, la synthèse convergente est un procédé itératif mais le nombre de réactions nécessaires par molécule est plus faible. De plus, les réactions peuvent être conduites avec un plus faible excès de monomère, facilitant ainsi la purification qui peut être effectuée par chromatographie. Ceci est d’ailleurs un des avantages de cette voie de synthèse car elle permet d’obtenir des dendrimères d’une plus grande pureté (Figure 12) : seulement un pic est observé pour un dendrimère préparé par synthèse convergente alors que une molécule obtenue par la voie divergente présente de nombreux défauts.
Figure 11 : Croissance dendritique
Page | 29
Figure 12 : Spectres de masse de dendrimères préparés par les voies convergente (a) et divergente (b).20
Cependant, il ne s’agit pas d’une synthèse idéale car les rendements de réactions ne sont pas quantitatifs et les purifications entraînent une perte de produit d’où une diminution de la masse obtenue à chaque étape. De plus, le couplage ayant lieu au point focal du dendrimère, une gêne stérique peut apparaître entre les gros dendrons (souvent dès la quatrième génération) ce qui va encore diminuer les rendements.
Les méthodes de synthèse convergente les plus utilisées sont celles des poly(aryl éther) de Fréchet et des poly(phénylacétylène) de Moore (Figure 13).28
28
Page | 30
Figure 13 : Principaux dendrimères préparés par synthèse convergente.
Chacune des voies de synthèse que nous venons de présenter ont été utilisées pour obtenir des dendrimères photosensibles grâce à l’incorporation de chromophores dans la structure dendritique. Nous allons maintenant examiner les études réalisées sur de telles molécules et plus particulièrement les dendrimères comportant des unités azobenzène.
B.
Dendrimères photosensibles.
1) Introduction.
Comme nous l’avons vu précédemment, il existe de nombreux systèmes photochromiques pouvant être utilisés pour obtenir des espèces photosensibles. Dans le cas des dendrimères, les deux principaux chromophores utilisés sont le stilbène et l’azobenzène. Cependant, il existe quelques exemples de synthèse et d’études photophysiques sur d’autres types de composés.29,30
29
A. Momotake, T. Arai, Polymer, 2004, 45, 5369.
30
Page | 31 Par exemple, un dendrimère poly(amidoamine) portant un anthracène au cœur a été synthétisé. Il a ainsi été possible d’obtenir un fullerodendrimère par addition [4+2] entre l’anthracène et un fullerène. Ce composé peut ensuite subir une rétro-Diels-Alder pour redonner le C60 et le dendron de départ par chauffage dans le méthanol (Figure 14).
H N N H O O N H N O O N N NH O N O OMe O OMe O NH HN O N OMe O OMe O NH O N MeO O MeO O N OMe O OMe O H N N H O O N H N O O N N NH O N O OMe O OMe O NH HN O N OMe O OMe O NH O N MeO O MeO O N OMe O OMe O h
Figure 14 : Cycloaddition [4+2] d'un fullerène sur un dendrimère portant un anthracène.30
La synthèse de dendrimères photolabiles a également été décrite. Ces composés contiennent le groupement 3,5-dialcoxy-o-nitrobenzyle comme groupe photoclivable et ont montré une photolyse spécifique au niveau de ce lien sous irradiation UV (Figure 15). Ce type de molécule pourrait être utile dans la libération contrôlée de substances par exemple.
Page | 32
Figure 15 : Dendrimère photolabile.30
Néanmoins, dans la suite de ce chapitre, nous nous bornerons aux dendrimères incorporant des motifs azobenzène dans leur structure.
2) Polymères azobenzène.
Comme nous l’avons vu précédemment, l’isomérisation photoinduite de l’azobenzène s’accompagne de grands changements structuraux comme le montrent les modifications de moment dipolaire et de géométrie. Ce mouvement moléculaire peut donner lieu à des déplacements de matière coordonnés à plus grande échelle. Etant donné la propreté de sa réaction d’isomérisation, sa résistance à la fatigue et sa facilité de fonctionnalisation, l’azobenzène a été incorporé dans une grande variété de systèmes : des petites molécules, des systèmes polymériques en tant que dopant, des assemblages supramoléculaires, des cristaux liquides ou encore lié de manière covalente à des polymères. Néanmoins, la stratégie la plus utilisée est l’incorporation d’azobenzène dans un squelette polymérique de manière covalente.
Page | 33
Figure 16 : Les différents niveaux de mouvements photoinduits.31
Ainsi incorporé dans ces systèmes, l’azobenzène va pouvoir subir de nombreux cycles de photoisomérisation qui vont donner lieu à toute une série de mouvements moléculaires qui peuvent être classés en trois catégories : les modifications aux échelles moléculaire, nanométrique et macroscopique (Figure 16). Sous lumière polarisée, les chromophores vont avoir tendance à s’aligner de manière perpendiculaire à la polarisation : c’est le niveau moléculaire. Le deuxième niveau, va être une création de domaines. Emprisonnés dans des cristaux liquides par exemple, l’azobenzène va être gêné dans sa réorientation. Cependant, étant donné que la photoisomérisation est un processus très efficace, le cristal liquide, ou au moins des domaines de ce dernier, vont s’aligner avec les azos selon un mouvement coopératif. Enfin, le dernier niveau est à une échelle encore plus grande et correspond à des mouvements macroscopiques. Ces mouvements créent des motifs à la surface des films et ont généré une littérature très importante à partir de 1995. Nous allons maintenant examiner quelques aspects de ces trois niveaux d’action de l’azobenzène un peu plus en détail.
a) Mouvements du chromophore : la photo-orientation.
Le premier niveau auquel un changement est observable lors de l’isomérisation est la molécule. Ces mouvements moléculaires vont donner lieu à un phénomène de migration de la matière. Une des caractéristiques de ces mouvements moléculaires est qu’ils peuvent donner lieu à une photo-orientation.
31
Page | 34
a) b)
Figure 17 : Mécanisme statistique de photo-orientation des molécules d'azobenzène.32
Ce processus est statistique et est plus marqué dans les systèmes rapides de type pseudo-stilbène. Une molécule azo va absorber de préférence la lumière polarisée selon son axe dipolaire (axe longitudinal de la molécule). A chaque fois qu’un chromophore subit un cycle d’isomérisation
trans-cis-trans, sa position va légèrement varier et ce de manière aléatoire (Figure 17 a). Ainsi, les
molécules qui sont alignées selon la direction de polarisation vont se réorienter alors que les autres qui sont perpendiculaires vont rester immobiles : il en résulte une diminution de la population de molécules orientées selon l’angle de polarisation et un enrichissement en chromophores perpendiculaires.
La photo-orientation est réversible : l’isotropie peut être rétablie avec de la lumière polarisée circulairement ou une nouvelle orientation peut être choisie avec une autre polarisation (Figure 17 b). Le résultat de cette réorientation statistique peut être une forte biréfringence (anisotropie d’indice de réfraction) ou un dichroïsme (anisotropie de spectre d’absorption).33,34
Les applications de ces mouvements moléculaires peuvent être très variées mais celle qui est le plus souvent citée est le stockage optique. En effet, il a été montré que, incorporé dans un système de cristaux liquides, l’isomérisation peut contrôler la phase cristal liquide et la photo-orientation peut être utilisée pour réorienter l’échantillon.35,36 Ainsi, la biréfringence d’un film polymérique peut être
32 K.G. Yager, C.J. Barett, J. Photochem. Photobiol. A Chem., 2006, 182, 250. 33
A. Natansohn, P. Rochon, M. Pezolet, P. Audet, D. Brown, S. To, Macromolecules, 1994, 27, 2580.
34
R. Hagen, T. Bieringer, Adv. Mater., 2001, 13, 1805.
35
K. Ichimura, Chem. Rev., 2000, 100, 1847.
36
Page | 35 changée et ramenée à sa valeur initiale avec un simple laser, ce qui permet d’envisager leur utilisation pour des disques optiques réinscriptibles.37
b) Mouvements de domaines : le photo-switching.
L’isomérisation de l’azobenzène peut être utilisée pour modifier des domaines ou des structures supramoléculaires. Il s’agit en fait du même type de phénomène qu’avec les cristaux liquides puisque l’isomérisation va être amplifiée et observée grâce à des changements à plus grande échelle. Sous irradiation, nous allons pouvoir observer des changements de phase ou de solubilité, des cristallisations, des séparations de phases réversibles, ou encore des modifications de concentration micellaire critique. L’azobenzène va alors pouvoir servir de « photo-commutateur » entre les deux états : c’est le photo-switching.
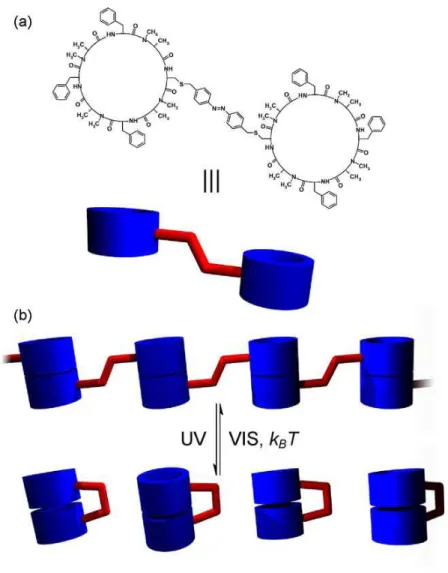
Il a par exemple été montré la possibilité de contrôler la manière dont des molécules vont s’auto-assembler grâce à l’isomérisation. Deux peptides cycliques reliés par un motif azobenzène ont montré des types de liaison hydrogène différents suivant l’état d’isomérisation de l’azobenzène (Figure 18).38
Sous la forme trans, les sous-unités s’organisent sous forme de chaînes linéaires par liaison hydrogène intermoléculaire, alors que sous la forme cis, il y a liaison hydrogène intramoléculaire et formation de sous-unités isolées.
37
Y. Sabi, M. Yamamoto, H. Watanabe, T. Bieringer, D. Haarer, R. Hagen, S.G. Kostromine, H. Berneth, J. Appl. Phys., 2001, 40, 1613.
38
Page | 36
Figure 18 : Structure du dipeptide cyclique et rupture de la structure supramoléculaire par isomérisation.32
c) Mouvements macroscopiques et migration de matière.
La démonstration la plus directe et spectaculaire d’un tel phénomène est le repliement dirigé d’un film de polymère azobenzène de cristaux liquides (Figure 19).
Avec cet exemple, Ikeda et col. ont montré qu’il est possible de contrôler la direction de repliement du film avec la polarisation de la lumière incidente et de plier et déplier l’échantillon en alternant entre deux longueurs d’onde. Cet effet est attribué à une photo-contraction de la surface du film avec une amplitude moins importante dans le film à cause de la perte d’intensité lumineuse due à l’absorption. Ce type de dispositif pourrait se révéler être un photo-déclencheur très efficace pour une utilisation dans des nanomachines.39
Page | 37
Figure 19 : Repliement dirigé d'un polymère azobenzène en fonction de la polarisation de la lumière.39
Un autre type de mouvements observables est la migration de matière. Ce type de modifications à l’échelle micrométrique a été observé pour la première fois en 1995 sur un polymère azobenzène de poly(disperse red 1).40,41
Figure 20 : Image AFM d’un réseau de surface en forme de grille sur deux films de polymère azobenzène.32,33
L’irradiation d’un film de polymère azobenzène avec un réseau d’interférences lumineuses permet la modification de la surface de l’échantillon et l’obtention de l’impression du réseau sur cette dernière.
39
Y. Yu, M. Nakano, T. Ikeda, Nature, 2003, 425, 145.
40
P. Rochon, E. Batalla, A. Natansohn, Appl. Phys. Lett., 1995, 66, 136.
41
D.Y. Kim, S.K. Tripathy, L. Li, J. Kumar, Appl. Phys. Lett., 1995, 66, 1166. 366 nm 366 nm 366 nm 366 nm >540 nm >540 nm >540 nm >540 nm 0° -45° -135° -90°
Page | 38 Des motifs d’une profondeur pouvant atteindre un micron ont été obtenus et plus d’une grille peut être inscrite sur le même échantillon.
Comme nous venons de le voir, la majorité de la bibliographie concernant l’isomérisation de l’azobenzène et les mouvements photoinduits qui lui sont associés se réfère aux systèmes polymériques ayant le chromophore lié de manière covalente à la chaîne ou dissous dans la matrice. Cependant, il existe un intérêt grandissant pour les dendrimères incorporant des groupements azobenzène dans leur structure et pour leur comportement photochimique. Nous allons donc faire le point sur les systèmes dendritiques synthétisés et les études qu’ils ont subies.
3) Dendrimères azobenzène.
L’intérêt porté aux dendrimères comportant des groupements azobenzène et à leur photochimie est grandissant. Le premier dendrimère photosensible avec six azobenzènes à la périphérie a été préparé par Vögtle et col. en 1993.42
Le groupe azo peut être incorporé au cœur du dendrimère ou encore dans les branches ou à la périphérie.43,44,45,46 Nous allons maintenant détailler quelques exemples de synthèse ainsi que les études qui ont été menées et les éventuelles applications suggérées.
a) Au cœur.
Les premiers dendrimères avec une molécule d’azobenzène au cœur ont été synthétisés en 1997 par McGrath et col. (Figure 21).47
42
H.B. Mekelburger, K. Rissanen, F. Vögtle, Chem. Ber., 1993, 126, 1161.
43 A. Dirksen, L. De Cola, C. R. Chimie, 2003, 6, 873. 44
A. Momotake, T. Arai, J. Photochem. Photobiol. C Photochem. Rev., 2004, 5, 1.
45
A. Momotake, T. Arai, Polymer, 2004, 45, 5369.
46
A. Archut, F. Vögtle, Chem. Soc. Rev., 1998, 27, 233.
47
Page | 39 N N O O O O O O O O O O O O O O N N O O O O O O O O O O O O O O h h ' ou
Figure 21 : Structure de dendrimères trans- et cis-azobenzène.47
Il s’agissait de dendrons du type benzyléther introduits en position 4 et 4’ d’un azobenzène. Les dendrimères obtenus, de générations G0 à G2, ont montré une photoisomérisation trans-cis par irradiation UV. Le retour thermique cis-trans à 293 K a aussi été observé avec une constante de vitesse comparable aux azobenzènes classiques. De même, ce retour est possible par simple exposition à la lumière du soleil pendant quelques secondes.
Par la suite, Aida et col. ont préparé des dendrimères voisins ayant les dendrons de type benzyl-éther greffés en position 3, 3’, 5 et 5’ d’un azobenzène (Figure 22).48,49,50
48
D.L. Jiang, T. Aida, Nature, 1997, 454.
49
T. Aida, D.L. Jiang, E. Yashima, Y. Okamoto, Thin Solid Films, 1998, 331, 254.
Page | 40
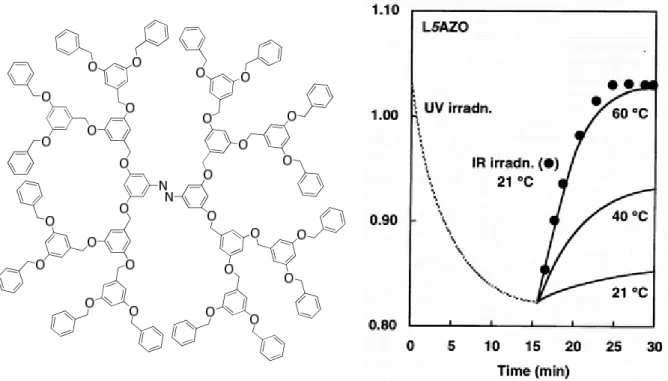
Figure 22 : Structure des dendrimères 3,3’,5,5’-azobenzène et évolution de l’absorbance à 340 nm.48
Ce type de dendrimère a montré une accélération de l’isomérisation retour cis-trans par irradiation infrarouge grâce à un processus de transfert d’énergie intramoléculaire multi-photons. Cette accélération a lieu par irradiation à 1597 cm-1, ce qui correspond à la bande de vibration d’élongation des cycles aromatiques du dendron, et seulement pour les gros dendrimères de quatrième ou cinquième génération. La structure dendritique procure une protection contre la désexcitation par collision et l’énergie absorbée est transférée au cœur où elle provoque l’isomérisation. Cet effet d’antenne a été expliqué par un phénomène de stockage d’énergie à long terme. En effet, ce processus repose sur l’absorption consécutive de 5 photons. L’énergie des quatre premiers photons est stockée dans le dendrimère en attendant l’absorption d’un cinquième ce qui déclenche le transfert de l’énergie sans dissipation vers le cœur et l’isomérisation.51,52
Okada et col. ont proposé une autre explication à ce phénomène. La radiation infrarouge absorbée augmente l’énergie de vibration qui est transférée vers le centre réactionnel dont la température effective augmente ce qui provoque le retour thermique.53
51
Y. Wakabayashi, M. Tokeshi, D.L. Jiang, T. Aida, T. Kitamori, J. Lumin., 1999, 83-84, 313.
52
Y. Wakabayashi, M. Tokeshi, A. Hibara, D.L. Jiang, T. Aida, T. Kitamori, Anal. Sci., 2000, 16, 1323.
53
Page | 41 Toujours dans le but d’élucider les aspects thermodynamiques des réactions photochimiques de l’azobenzène dans les dendrimères, Momotake et col ont synthétisé des composés à cœur azo solubles dans l’eau (Figure 23).54
Figure 23 : Structure des dendrimères et assemblage supramoléculaire en pseudo-micelles.54
De manière intéressante, ces dendrimères ont montré une dépendance de leur spectre d’absorption à la génération, la bande π-π* étant déplacée vers le bleu en augmentant la génération ce qui peut être dû à un effet de protection du cœur azo par le dendron contre les molécules de solvant. De même que dans les autres études, la taille du dendron influence l’efficacité et la vitesse de l’isomérisation trans-cis et du retour thermique ; par contre, une nouvelle dépendance du retour
cis-trans à la température a été mise en évidence. Ces comportements peu habituels peuvent être dus à
la formation d’agrégats : sous la forme cis, les dendrimères dans l’eau peuvent s’associer par interaction hydrophobe pour former une micelle. Ceci rend alors le retour plus lent étant donné qu’il faut d’abord briser l’assemblage avant l’isomérisation. Un autre objectif était l’obtention de micelles photomodulables mais cet aspect de l’étude n’a pas encore été publié.
Dans les cas que nous venons de voir, des études photochimiques ont été menées afin de déterminer les aspects thermodynamiques de la réaction d’isomérisation cis-trans en fonction de la génération
54
Page | 42 du dendrimère.55,56 Ainsi, il a été montré que la génération du dendrimère a une influence sur la photoisomérisation trans-cis : plus la génération est importante, moins la réaction est efficace. Par contre, la taille des dendrons n’a aucune influence sur l’isomérisation thermique cis-trans, ce qui est sans doute dû à la flexibilité du squelette dendritique. Enfin, ces composés ne montrent qu’une faible réduction du rayon hydrodynamique au cours de l’isomérisation.
Figure 24 : Dendron à cœur azobenzène et extrémités vinyle.57
Choi et col. ont récemment rapporté la synthèse et la caractérisation photochimique de dendrons à extrémités vinyles (Figure 24).57 Comme pour les exemples précédents, la photoisomérisation et le retour thermique ont été observés mais une influence de la polarité du solvant sur la vitesse de l’isomérisation cis-trans a été mise en évidence car la réaction est plus lente dans les solvants polaires comme le méthanol que dans le dichlorométhane. Bien qu’aucune application n’ait été proposée pour le moment, les groupes vinyle devraient permettre de fonctionnaliser la surface des dendrons.
55
M. Uda, A. Momotake, T. Arai, Photochem. Photobiol. Sci., 2003, 2, 845.
56
L.X. Liao, F. Stellacci, D.V. McGrath, J. Am. Chem. Soc., 2004, 126, 2181.
57
Page | 43 Néanmoins, le squelette de ces composés est relativement souple donc des dendrimères polyphénylène à cœur azobenzène, à la structure plus rigide, ont également été préparés (Figure 25) afin de vérifier si leur comportement est identique.58
Figure 25 : Structure d'un dendrimère polyphénylène avec un azobenzène au cœur.58
58
D. Grebel-Koehler, D. Liu, S.D. Feyter, V. Enkelmann, T. Weil, C. Engels, C. Samyn, K. Müllen, F.C. De Schryver, Macromolecules, 2003, 36, 578.
Page | 44 De tels dendrimères ont montré une influence de la génération sur la quantité d’isomère cis obtenu lors de l’isomérisation trans-cis mais le phénomène est moins marqué que pour les dendrimères plus flexibles. De plus, un changement de structure important au cours de la réaction, dû à leur structure rigide, a été observé : il s’agit d’une diminution du rayon hydrodynamique qui peut atteindre 38 % pour les gros dendrimères.56
Il ressort de toutes ces études qu’il est difficile de définir une relation entre la génération du dendrimère et son comportement photochimique. Néanmoins ces études sont essentielles pour connaître le comportement des dendrimères et ensuite, envisager des applications comme nous allons le voir maintenant.
Les dendrimères polyphénylènes ont également été étudiés pour leur capacité à former des assemblages supramoléculaires. Une première étude a montré la possibilité d’obtenir des nanofibres de taille micrométrique grâce à des associations inter-dendrimères par π-stacking et à la rigidité du squelette dendritique.59 Néanmoins, l’influence du cœur azobenzène sur ces structures et leur
éventuelle réversibilité n’ont pas été étudiées.
Dans une autre étude, des dendrimères de deuxième et troisième génération portant des chaînes n-dodécyles (Figure 26) ont été utilisés pour des expériences d’auto-assemblage sur des surfaces de graphite pour donner des lamelles.60 La structure macroscopique en bandes est gouvernée par les interactions entre les chaînes alkyles, ce qui a été démontré par les études d’AFM et de STM.
59
D. Liu, S. De Feyter, P.C.M. Grim, T. Vosch, D. Groebel-Koehler, U.M. Wiesler, A.J. Berresheim, K. Müllen, F.C. De Schryver, Langmuir, 2002, 18, 8223.
60
Page | 45 N
N
Figure 26 : Dendrimère polyphénylène à cœur azobenzène.
Parquette et col. ont mis au point un système de dendrons étirables (Figure 27).61 Les dendrons pliés adoptent une conformation en hélice compacte lorsque les azobenzènes sont sous leur forme trans. La conformation en hélice est donc assurée par les deux trans-azobenzènes mais aussi par la conformation préférentielle syn-syn du 2-méthoxyphtalimide et de la 2,6-dicarboxamidepyridine grâce à des liaisons hydrogène intramoléculaires. Par photoisomérisation, il y a rupture de l’hélice et la structure s’étend significativement, ce qui est vérifié par l’augmentation de rayon hydrodynamique, et ce phénomène augmente avec la génération.
61
Page | 46
Figure 27 : Rupture de la structure en hélice par isomérisation des azobenzènes.61
Ghosh et col. ont rapporté la synthèse et les études photochimiques sur des dendrimères PAMAM à cœur azobenzène.62,63 La photoisomérisation réversible avec des irradiations à 260 et 320 nm a été mise en évidence. Ce type de dendrimères a été proposé pour des utilisations en relargage contrôlé de substances.
Figure 28 : Dendrimère PAMAM à cœur azobenzène.63
62
S. Ghosh, A.K. Banthia, Tetrahedron Lett., 2001, 42, 501.
63
Page | 47 Dans le même groupe de recherche, Bhattacharjya et col. ont préparé des dendrimères à cœur azobenzène incorporant des unités 1,2-isopropylidènefuranose (Figure 29).64,65
Figure 29 : Dendrimère à cœur azobenzène incorporant des cycles 1,2-isopropylidènefuranose (gauche) et
images MEB de xérogels dans l’eau et une solution 1 mM de CaCl2 (droite).65
Les propriétés d’isomérisation ont été étudiées montrant l’efficacité de ces dendrimères chiraux en tant que systèmes photosensibles. De plus, le dendrimère de génération zéro a été utilisé dans la conception de gels. Les expériences ont montré que la gélification est due aux interactions hydrogène des branches et à l’agrégation des azobenzènes. Par contre, le système s’est révélé insensible aux irradiations UV sans doute à cause de contraintes trop grandes au niveau du cœur azo. Récemment, Chen et col. ont également rapporté l’utilisation de dendrons à point focal azobenzène dans la formation d’organogels.66
64
A. Ray, S. Bhattacharya, S. Ghorai, T. Ganguly, A. Bhattacharjya, Tetrahedron Lett., 2007, 48, 8078.
65
A. Srivastava, S. Ghorai, A. Bhattacharjya, S. Bhattacharya, J. Org. Chem., 2005, 70, 6574.
66
Page | 48
Figure 30 : Organogel réversible à base de dendrons azobenzène.66
Les dendrons poly(Gly-Asp) sont synthétisés à partir d’acides aminés naturels (glycine et aspartate) et présentent un azobenzène au point focal. Les études menées ont montré que les moteurs de la gélification sont les liaisons hydrogène et le π-stacking. Les gels obtenus sont sensibles à la température et à un rayonnement UV : le gel se dissout par chauffage mais aussi par irradiation à 365 nm à cause des groupements azobenzène. De plus, le phénomène est réversible car par refroidissement ou exposition à la lumière naturelle, le gel se reforme.
Des dendrons à point focal azobenzène de génération zéro à trois ont été incorporés dans des silices par Vögtle et col. (Figure 31).67
Figure 31 : Dendron azobenzène et image SEM des sphères de MCM-41 fonctionnalisées.67
67
P. Sierocki, H. Maas, P. Dragut, G. Richardt, F. Vögtle, L. De Cola, F. Brouwer, J.I. Zink, J. Phys. Chem. B, 2006, 110, 24390.
Page | 49 Les études photophysiques ont permis de déterminer les constantes de vitesse de la photoisomérisation et du retour thermique et les propriétés de fluorescence à basse température. Par la suite, les molécules ont été attachées de manière covalente aux murs de pores de MCM-41 (nanosphères de silice) et de films 2D hexagonaux. Une fois greffés, les dendrons montrent un effet dendritique dans l’isomérisation thermique : plus la génération est importante, plus le processus est lent. Les expériences de fluorescence à basse température ont permis de mettre en évidence une isomérisation réversible dans les pores. De tels systèmes pourraient permettre de contrôler la taille des pores par irradiation lumineuse pour des applications en libération de substances ou en membranes sélectives.
Des dendrimères présentant trois azobenzènes au cœur ont été synthétisés par McGrath et col. (Figure 32).68
Figure 32 : Structure du dendrimère avec trois azobenzènes au cœur.68
68

![Figure 14 : Cycloaddition [4+2] d'un fullerène sur un dendrimère portant un anthracène](https://thumb-eu.123doks.com/thumbv2/123doknet/2177663.10369/31.892.243.660.235.853/figure-cycloaddition-un-fullerene-sur-dendrimere-portant-anthracene.webp)