HAL Id: hal-02599969
https://hal.inrae.fr/hal-02599969
Submitted on 16 May 2020HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Une approche multi-compartiments (macroinvertébrés
benthiques, diatomées, macrophytes et faune piscicole)
afin d’évaluer l’impact de rejets industriels sur un cours
d’eau landais : mise en évidence d’indicateurs de toxicité
M. Laine
To cite this version:
M. Laine. Une approche multi-compartiments (macroinvertébrés benthiques, diatomées, macrophytes et faune piscicole) afin d’évaluer l’impact de rejets industriels sur un cours d’eau landais : mise en évidence d’indicateurs de toxicité. [Rapport de recherche] irstea. 2013, pp.124. �hal-02599969�
LAINÉ Manon
Rapport pour la structure
LAINÉ Manon
Stage Master 2 mention Sciences de la Terre et Environnement, Ecologie spécialité Biodiversité et Ecosystèmes Continentaux
parcours « BIODIVERSITE ET SUIVIS ENVIRONNEMENTAUX»
Université Bordeaux 1 (2012-2013) Stage effectué du 04 février au 31 juillet 2013
Une approche multi-compartiments
(macroinvertébrés benthiques, diatomées,
macrophytes et faune piscicole)
afin d’évaluer l’impact de rejets industriels sur un
cours d’eau landais : mise en évidence
Sommaire
Table des tableaux : ... 1
Introduction : ... 1
1 Matériel et méthodes : ... 4
1.1 Le site d’étude : ... 4
1.2 Acquisition des données biologiques et environnementales :... 5
1.2.1 Macroinvertébrés benthiques : ... 5 1.2.2 Faune piscicole : ... 6 1.2.3 Macrophytes : ... 7 1.2.4 Diatomées : ... 7 1.2.5 Données environnementales : ... 8 1.3 Outils d’analyses : ... 8
1.3.1 Les données biologiques : ... 9
1.3.2 Les données environnementales : ... 17
1.3.3 Pertinence des indicateurs toxiques : ... 18
2 Résultats et discussion ... 20
2.1 Les données biologiques : ... 20
2.1.1 La faune piscicole : ... 20
2.1.2 Les macrophytes : ... 28
2.1.3 Les MIB : ... 34
2.1.4 Les diatomées : ... 46
2.2 Les données environnementales : ... 59
2.3 Pertinence des indicateurs de toxicité: ... 62
2.3.1 Analyse PLS-DA : ... 62
2.3.2 Analyse RLQ : ... 73
3 Discussion ... 78
3.1 Physico-chimique versus biologie : ... 78
3.2 Variations saisonnières : ... 79
3.3 Compartiments biologiques : ... 79
3.3.1 La faune piscicole : ... 80
3.3.2 Les macrophytes : ... 81
3.3.4 Les diatomées : ... 87
3.4 Complémentarité des indicateurs : ... 91
3.4.1 Chaine trophique : ... 91
3.4.2 Convergence des indicateurs : ... 91
3.4.3 Suivi de la gestion : ... 93
Conclusion : ... 95
Sommaire des annexes ... 99
Annexe 1 : Tableaux des différentes métriques testées pour les 4 compartiments biologiques. .... 99
Annexe 2 : Packages R et fonctions associées à chaque test. ... 105
Annexe 3 : Résumé sur les indices SPEAR pesticides et organiques : ... 106
Table des illustrations
Figure 1 : Carte du Luzou avec la position des quatre stations, de la pisculture de Laluque et de la MLPC. ... 4 Figure 2 : Démarche pour obtenir les distributions de fréquence relatives des notes pour chaque modalité. ... 9 Figure 3 : Schéma représentant le principe de l’analyse RLQ. ... 19 Figure 4 : Diagrammes bqtons, basé sur les abondances, représentant les richesses spécifiques, les indices de Shannon et les indices de Pielou pour les 4 stations échantillonnées. ... 20 Figure 6 : Echelle de l’indice IPR avec la position des stations échantillonnées sur l’axe. ... 21 Figure 5 : Biomasse (kg/ha) totale des stations. ... 21 Figure 7 : Diagrammes-bâton empilés représentants pour les trois traits biologiques les abondances relatives des modalités pour les quatre stations. ... 25 Figure 8 : Diagrammes-bâton empilés représentants pour les trois traits biologiques les biomasses relatives des modalités pour les quatre stations échantillonnées ainsi que pour la station de
référence Landaise. ... 26 Figure 9 : Diagrammes-bâton représentant les moyennes des richesses spécifiques, des indices de Shannon et des Pielou pour les quatre stations. Les barres d’erreur représentent les écarts types. .. 28 Figure 10 : Diagrammes-bâton représentant les indices IBMR des quatre stations pour les deux campagnes. Les barres horizontales représentent les limites des classes de qualité de l’indice. ... 29 Figure 11 : Diagrammes-bâton empilés représentant les recouvrements relatifs de chaque modalité pour les quatre stations. A droite, la campagne 1, à gauche la campagne 4. PH = Phanérogames ; BR=Bryophytes ; HET=Hétérotrophes ; ALG=Algues. ... 30 Figure 12 : Diagrammes-bâtons représentant les fréquences relatives des 13 traits biologiques testés. ... 32 Figure 13 : AFC réalisée sur le tableau Taxons-Abondances. A gauche, projections des relevés sur les axes 1 et 2 avec un regroupement des relevés par station. A droite, projection des relevés sur les axes 1 et 2 avec un regroupement des relevés par campagne. ... 34 Figure 14 : Diagrammes-bâton représentant les moyennes pour chaque station de la richesse
spécifique, l’indice de Shannon et l’indice de Pielou. Les barres d’erreur représentent les écarts-types. ... 35 Figure 15 : Diagrammes-bâton représentant la moyenne des indices IBGN, SPEARpesticides et
Figure 16 : Analyse de co-inertie entre les abondances des taxons (tableau Taxons-Abondances) et les traits biologiques des taxons (tableau Taxons-Traits). A gauche, position moyenne des stations sur le plan factoriel 1 et 2. A droite, position moyenne des campagnes sur le plan factoriel 1 et 2... 37 Figure 17 : Position des 63 modalités de traits biologiques sur le plan factoriel 1 et 2. ... 38 Figure 18 : Profil des fréquences relatives des modalités des onze traits biologiques de la station de référence AmP. Les flèches représentent une augmentation (flèche vers le haut) ou une diminution (flèche vers le bas) significative de la modalité pour les stations AmL (vert), AvP (rouge) et AvL
(orange) par rapport à la station de référence AmP. ... 39 Figure 19 : Analyse de co-inertie entre les abondances des taxons (tableau Taxons-Abondances) et les traits écologiques des taxons (tableau Taxons-Traits). A gauche, position moyenne des stations sur le plan factoriel 1 et 2. A droite, position moyenne des campagnes sur le plan factoriel 1 et 2... 41 Figure 20 : Position des 55 modalités de traits écologiques sur le plan factoriel 1 et 2. ... 42 Figure 21 : Profil des fréquences relatives des modalités des onze traits écologiques de la station de référence AmP. Les flèches représentent une augmentation (flèche vers le haut) ou une diminution (flèche vers le bas) significative de la modalité pour les stations AmL (vert), AvP (rouge) et AvL
(orange) par rapport à la station de référence AmP. ... 43 Figure 22 : Diagrammes-bâton représentant le nombre de cellules vivantes, le ratio (Nombre de cellules vivantes/ Nombre de cellule morte), le poids sec, la MSSC et la concentration de chlorophylle moyenne pour les quatre stations sur lame de verre prélevées à t15 et sur lame de verre prélevées à t30. Les barres d’erreur représentent les écarts-types. ... 46 Figure 23 : Diagramme-bâton représentant le taux de croissance des quatre stations. Les barres d’erreur représentent les écarts-types. ... 47 Figure 24 : AFC sur les abondances transformées en log+1. En bas à droite, histogramme des valeurs propres. En haut à gauche, projections des relevés sur les axes 1 et 2 avec un regroupement des relevés par station. En haut à droite, projection des relevés sur les axes 1 et 2 avec un regroupement des relevés par campagne. En bas à droite, projection des relevés sur les axes 1 et 2 avec un
regroupement par support d’échantillonnage. ... 48 Figure 25 : Diagrammes-bâton représentant la richesse spécifique, l’indice de Shannon et l’indice de Pielou en fonction des quatre stations pour les différents supports d’échantillonnage. Les barres d’erreur représentent l’écart-type. ... 49 Figure 26 : Diagrammes-bâton représentant le pourcentage de formes tératogènes en fonction des quatre stations pour les différents supports d’échantillonnage. Les barres d’erreur représentent les écarts-types. ... 50 Figure 27 : Diagrammes-bâton représentant les valeurs de l’indice IPS en fonction des quatre stations pour les trois supports d’échantillonnage. Les barres d’erreur représentent les écarts-types. ... 51
Figure 28 : Diagrammes-bâton représentant les valeurs de l’indice IBD en fonction des quatre stations pour les trois supports d’échantillonnage. Les barres d’erreur représentent les écarts-types. ... 51 Figure 29 : Analyse de co-inertie. En haut, projections des relevés sur les axes 1 et 2 avec un
regroupement des relevés par campagne. En bas, projection des relevés sur les axes 1 et 2 avec un regroupement des relevés par stations. ... 52 Figure 30 : Position des modalités des quatre traits sur le plan factoriel 1-2. ... 53 Figure 31 : Diagrammes-bâton représentant le profil des quatre stations pour le trait « Pionnières ». Les barres d’erreur représentent les écarts type. Les flèches indiquent une hausse ou une baisse de la modalité dans les stations AvP (rouge) et AvL (orange) par rapport à la station AmP. Les flèches en trait plein correspondent à une variation significative et les pointillés à des variations non
significatives (test de Kruskal-Wallis). ... 54 Figure 32 Diagrammes-bâton représentant les profils « Biovolume » des stations pour les différents supports d’échantillonnage. La modalité 1 correspond à la classe <99µm3, 2 à 100-299µm3, 3 à 300-599µm3, 4 à 600-1499µm3 et 5 à >1500µm3. Les barres d’erreur correspondent aux écart-types. ... 55
Figure 33 : Diagrammes-bâton représentant les profils « Guildes de Passy » des stations pour les différents supports d’échantillonnage. La modalité L correspond aux low-profile, H à high-profile, M à mobile, et V à variable. Les barres d’erreur correspondent aux écart-types. ... 56 Figure 34 : Diagrammes-bâton représentant les profils « Forme de croissance » des stations pour les différents supports d’échantillonnage. La modalité A correspond à adnées, P à pédonculées, C à coloniales, et NC à non-coloniales. Les barres d’erreur correspondent aux écart-types. ... 57 Figure 35 : Cercle de coorélation de l’ACP sur le plan 1-2. La variable supplémentaire « aniline » est représentée en bleue. ... 59 Figure 36 : ACP sur les données environnementales. Projection des relevés sur les axes 1 et 2 avec un regroupement par stations et par campagnes. ... 60 Figure 37 : Cercle de corrélation de l’analyse PLS-DA sur les indicateurs MIB. Les stations sont
représentées selon le code couleur par des triangles. Tous les indicateurs sont présentés sur le cercle en bleu. ... 62 Figure 38 : Diagrammes-bâton représentant pour chaque indicateur sa note VIP sur la dimension 1 pondérée de son signe. Les indicateurs ayant une │VIP│≥1 sont principaux pour la construction de l’axe (gris foncé), 0.8 ≤│VIP│<1 : indicateur important (gris), │VIP│>0.8 : indicateur sans impact sur la construction de l’axe (gris clair). ... 63 Figure 39 : Cercle de corrélation de l’analyse PLS-DA sur les indicateurs Diatomées. Les stations sont représentées selon le code couleur par des triangles. Tous les indicateurs sont présentés sur le cercle en bleu. ... 66 Figure 40 : Diagrammes-bâton représentant pour chaque indicateur diatomées sa note VIP sur la dimension 1 pondérée de son signe. Les indicateurs ayant une │VIP│>1 sont principaux pour la
construction de l’axe (gris foncé), 0.8<│VIP│<1 : indicateur important (gris) , │VIP│>0.8 : indicateur sans impact sur la construction de l’axe (gris clair). ... 66 Figure 41 : Cercle de corrélation de l’analyse PLS-DA sur les indicateurs Macrophytes. Les stations sont représentées selon le code couleur. ... 68 Figure 42 : Diagrammes-bâton représentant pour chaque indicateur Macrophytes sa note VIP sur la dimension 1 pondérée de son signe. Les indicateurs ayant une │VIP│>1 sont principaux pour la construction de l’axe, 0.8<│VIP│<1 : indicateur important, │VIP│>0.8 : indicateur sans impact sur la construction de l’axe. ... 68 Figure 43 : Diagrammes-bâton représentant pour chaque indicateur Macrophytes sa note VIP sur la dimension 2 pondérée de son signe. Les indicateurs ayant une │VIP│>1 sont principaux pour la construction de l’axe, 0.8<│VIP│<1 : indicateur important, │VIP│>0.8 : indicateur sans impact sur la construction de l’axe. ... 69 Figure 44 : Cercle de corrélation de l’analyse PLS-DA sur les indicateurs phanérogames. Les stations sont représentées selon le code couleur. ... 70 Figure 45 : Diagrammes-bâton représentant pour chaque indicateur phanérogames sa note VIP sur la dimension 2 pondérée de son signe. Les indicateurs ayant une │VIP│>1 sont principaux pour la construction de l’axe, 0.8<│VIP│<1 : indicateur important, │VIP│>0.8 : indicateur sans impact sur la construction de l’axe. ... 70 Figure 46 : Cercle de corrélation de l’analyse PLS-DA globale. Les stations sont représentées selon le code couleur. ... 72 Figure 47 : Projection des relevés regroupés par station (à gauche) et par campagne (à droite) sur le plan 1-2 de l’analyse RLQ sur les traits biologiques des MIB. ... 73 Figure 48 : Distribution des différentes modalités des 11 traits biologiques sur l’axe 1 de l’analyse RLQ-MIB... 74 Figure 49 : Projection des relevés regroupés par station (à gauche) et par campagne (à droite) sur le plan 1-2 de l’analyse RLQ sur les traits biologiques des Diatomées. ... 76 Figure 50 : Distribution des différentes modalités des traits biologiques sur l’axe 1 de l’analyse RLQ-diatomées. ... 77 Figure 51 : Distribution des différentes modalités des traits biologiques sur l’axe 2 de l’analyse RLQ-diatomées ... 77
Table des tableaux
Tableau 1 : Caractéristiques des quatre stations. (* : Source : SIE Adour Garonne
http://adour-garonne.eaufrance.fr/ et Geoportail-IGN http://www.geoportail.gouv.fr/accueil) ... 5
Tableau 2 : Date des campagnes pour les différents compartiments biologiques et la physicochimie. 5 Tableau 3 : Biomasse moyenne des espèces caractéristiques de la référence Landaise. ... 6
Tableau 4 : Température moyenne de l’air en janvier et juillet sur les quatre stations. ... 7
Tableau 5 : Liste des éléments physico-chimiques quantifiés avec leur abréviation et l’unité utilisée. 8 Tableau 6 : Tableau résumé les différentes guildes pour chaque traits biologiques. ... 10
Tableau 7 : Tableau des 13 traits biologiques phanérogames et des 56 modalités associées. ... 12
Tableau 8 : Les 11 traits et 63 modalités biologiques ... 14
Tableau 9 : Les 11 traits écologiques et les 55 modalités. Codes utilisés dans le rapport. ... 15
Tableau 10 : Les 4 traits biologiques diatomées associés aux 15 modalités. ... 17
Tableau 11 : Tableau synthétisant les valeurs théoriques, les valeurs observées et les scores des métriques pour les métriques IPR basées sur les occurrences d’espèces pour les 4 stations. ... 23
Tableau 12 : Tableau synthétisant les valeurs théoriques, les valeurs observées et les scores des métriques pour les métriques IPR basées sur les abondances d’espèces pour les 4 stations. ... 23
Tableau 13 : Tableau résumant les différents indicateurs de pollution toxique testés en comparaison avec la station de référence AmP. «NE» : Indicateurs non exploitables (manque de données) ... 27
Tableau 14 : Tableau résumant les différents indicateurs de pollution toxique testés en comparaison à la référence landaise. « - » : Indicateurs non exploitables (manque de données) ... 27
Tableau 15 : Tableau résumant les indicateurs de toxicité testés et ceux permettant de discriminer les stations de la station de référence AmP. « NE» : Indicateurs non exploitables (manque de données) ... 33
Tableau 16 : Les différents indicateurs testés. Lorsque l’indicateur est marqué d’une croix pour une station, ce dernier permet donc de discriminer la station de la référence AmP. ... 45
Tableau 17 : Nombre de relevés (sur 4) ayant plus de 1% de formes tératogènes en fonction des quatre stations pour les différents supports d’échantillonnage. ... 50
Tableau 18 : Résumé des indicateurs de toxicité sur le maillon « diatomées » testés. Les indicateurs discriminant les stations de la référence AmP sont notés par une croix. ... 58
Tableau 19 : Qualité de représentation des variables environnementales (estimateur cos²) sur les axes 1 et 2 de l’ACP. Les variables surlignées en bleu (cos²≥0.50) sont bien représentées sur les axes associés. ... 59 Tableau 20 : Indicateurs taxonomiques et indiciels ayant un VIP>1 (en noir) ou un 0.8<VIP<1 (en gris) sur l’axe 1 de la PLS-DA. ... 64 Tableau 21 : Traits biologiques ayant un VIP>1 (en noir) ou un 0.8<VIP<1 (en gris) sur l’axe 1 de la PLS-DA. ... 64 Tableau 22 : Traits écologiques ayant un VIP>1 (en noir) ou un 0.8<VIP<1 (en gris) sur l’axe 1 de la PLS-DA. ... 65
Introduction :
Depuis toujours, les cours d’eau sont au cœur du développement des civilisations et subissent, de ce fait, de fortes pressions anthropiques de différentes natures. Depuis 2000, la Directive Cadre Européenne sur l’Eau (DCE, 2000) vise le bon état des masses d’eau d’ici 2015 et place les communautés biologiques comme l’élément central de l’évaluation de l’état des masses d’eau. Cette évaluation s’appuie sur la prise en compte de quatre compartiments biologiques : les macroinvertébrés benthiques (MIB), les macrophytes et le phytobenthos, le phytoplancton et l’ichtyofaune.
Plusieurs méthodes d’évaluation de l’état des cours d’eau existent. Initialement, les réponses biologiques de ces différents compartiments face aux perturbations anthropiques (principalement l’eutrophisation) ont été étudiées via des métriques basées sur la sensibilité des taxons par le biais des indices de saprobie ou de trophie. Plus récemment, les traits fonctionnels des taxons ont été utilisés pour caractériser l’état écologique des masses d’eau et le type de perturbation présente (Archaimbault 2003, Lavoie et al. 2012, Marzin et al. 2012). En France, l’évaluation des cours d’eau s’appuie sur plusieurs outils dont des indices biologiques qui sont propres à chaque compartiment biologique tels que l’IBGN (AFNOR 2004a), l’IBD (AFNOR 2007), l’IBMR (AFNOR 2003a) et l’IPR (AFNOR 2011). Ces indices, principalement sensibles à la pollution trophique de par leur construction initiale, sont en perpétuelle évolution pour s’adapter aux besoins et permettre une meilleure détection des pressions anthropiques (ex : I2M2 (Mondy et al. 2012), IPR+ (Pont et al. 2011)). De même, de nouveaux indices apparaissent pour détecter et évaluer d’autres perturbations spécifiques tels que les pollutions phytosanitaires (Liess and Von Der Ohe 2005).
Généralement, les quatre compartiments biologiques sont étudiés séparément. Cependant, la complémentarité des quatre compartiments biologiques dans l’évaluation de l’état des masses d’eau a été démontrée dans plusieurs études (Hering et al. 2006, Johnson et al. 2006, Cellamare et al. 2012, Marzin et al. 2012). En effet, les différents compartiments ne présentent pas la même sensibilité aux dégradations générales et leurs réponses à une même pression diffèrent.
La masse d’eau « Luzou » est un cours d’eau Landais qui a été identifié par l’Agence de l’Eau Adour-Garonne lors de l’état des lieux de 2004 (actualisé en 2006) comme risquant de ne pas atteindre le bon état écologique d’ici 2015. De ce fait, une étude a été réalisé par Irstea afin de préciser les réponses des différents compartiments biologiques (MIB, diatomées, macrophytes et ichtyofaune) au regard des pressions qui s’exercent sur ce cours d’eau (Rosebery et al. 2010) . Il a alors été identifié que ce cours d’eau subissait deux impacts majeurs : des rejets de type trophique dus à la présence de la pisciculture de Laluque et des rejets de type toxique issus d’un complexe industriel, la MLPC. De plus, un seuil est présent au sein de l’usine sur le cours d’eau.
La pisciculture produit une pollution estimée à 2,5 tonnes/an de matières en suspension, 2,58 tonnes/an d’azote et 456 kg/an de phosphore. Le site industriel est une usine classée Seveso II, spécialisée dans la production d’agents de vulcanisation destinés majoritairement au marché de la transformation du caoutchouc. Elle produit environ 15 000 tonnes de produits chimiques par an. L’usine détourne une partie du débit du Luzou vers ses installations pour refroidir et laver les cuves de réaction. Les eaux usées sont envoyées dans des bassins de décantation puis après décantation (plus ou moins poussée), l’eau est évacuée par trop plein (au droit de l’usine) dans le Luzou.
Les effluents de la pisciculture ne sont pas considérés comme une menace pour le Luzou. En effet, dans un milieu aussi peu biogène que l’écosystème landais caractérisé par un substrat sableux et un pH acide, l’enrichissement trophique tend à faciliter l’installation d’une flore et d’une faune diversifiées (Rosebery et al. 2010). En revanche, les effluents de l’usine ont un impact fort et très délétère sur l’écosystème. Il a été observé, à l’aval de l’usine, une rupture brutale de la diversité biologique et de la biomasse ainsi que l’apparition de taxons et de formes biologiques résistantes à la pollution. Le principal composé rejeté identifié comme problématique est l’aniline. Ce composé organique aromatique est classé comme « dangereux pour l’environnement et très toxique pour les organismes aquatiques » (INRS 2010). Le seuil est considéré comme gênant les migrations de montaison ou de dévalaison de la faune piscicole. Cependant, cette première analyse comporte de nombreuses lacunes et ne permet pas la caractérisation globale de l’impact subi par l’écosystème.
C’est dans ce contexte que se situe cette étude. Elle aura pour but d’évaluer l’impact de la pollution toxique émise par la MLPC sur les 4 compartiments biologiques échantillonnés et de mettre en évidence différents indicateurs de cette pollution, afin de produire une
différentes métriques taxonomiques (abondance et indices basés sur l’abondance), indicielles (basées sur la présence d’organismes bio-indicateurs) et fonctionnelles (basées sur les traits biologiques et/ou écologiques) entre différents sites vont être étudiées. Cela permettra d’identifier des indicateurs de toxicité des rejets de l'usine, basés exclusivement sur les réponses biologiques. Les caractéristiques physico-chimiques du milieu seront étudiées afin de mettre en évidence les pressions majoritaires s'exerçant sur le Luzou. Ce travail montrera en outre l’intérêt de l’étude du compartiment biologique, vis-à-vis des lacunes qu’engendre d’une simple analyse physico-chimique du milieu. La mise en relation de ces indices avec les caractéristiques physico-chimiques du milieu permettra d'identifier, ou non, les pressions majoritaires s'exerçant sur le Luzou, et de sélectionner les métriques les plus pertinentes pour le suivi spécifique de cette masse d'eau.
1 Matériel et méthodes :
1.1 Le site d’étude :
Le Luzou (masse d’eau FRFR233) est un affluent de l’Adour de 28 km situé dans les Landes. Comme tout cours d’eau landais, le Luzou est caractérisé par un pH acide, une faible conductivité, un substrat sableux et une pauvreté en nutriments. Afin d’évaluer l’impact des rejets du site industriel sur les différents compartiments biologiques, quatre stations ont été suivies : la station Amont lointain (AmL), la station Amont proche (AmP), la station Aval proche (AmP) et la station Aval lointain (AvL) (figure 1).
Figure 1 : Carte du Luzou avec la position des quatre stations, de la pisculture de Laluque et de la MLPC. (Source carte : http://adour-garonne.eaufrance.fr/)
Les caractéristiques des quatre stations sont décrites en détail dans le tableau 1.
La station AmP est considérée comme la station de référence dans cette étude. En effet, l’impact des rejets de la pisciculture est supposé s'être dissipé donc n’impactant pas la station
Tableau 1 : Caractéristiques des quatre stations. (* : Source : SIE Adour Garonne http://adour-garonne.eaufrance.fr/ et Geoportail-IGN http://www.geoportail.gouv.fr/accueil)
AmL AmP AvP AvL
Lambert 93 X * 381632 385686 387414 389923
Lambert 93 Y * 6313519 6312556 6312572 6310416
Distance à la source * 11,18 km 16,05 km 18,38 km 22,70 km
Altitude * 40m 30m 25m 17.5m
Pollution supposée Trophique - Toxique forte Toxique
Pente du cours d’eau * 2,5‰ Surface du bassin versant
drainé * 132km²
Ces quatre stations ont fait l’objet de plusieurs campagnes d’échantillonnage pour différents compartiments biologiques et la physico-chimie (tableau 2).
Tableau 2 : Date des campagnes pour les différents compartiments biologiques et la physicochimie.
1.2 Acquisition des données biologiques et environnementales :
1.2.1 Macroinvertébrés benthiques :
Les données MIB ont été obtenues sur quatre campagnes (tableau 2) et ont été réalisées par le bureau d’étude ECCEL Environnement. Les prélèvements ont été réalisés selon la norme XP T90-333 (AFNOR 2009). Les prélèvements ont nécessité un filet de type Surber de 1/20m² dans les eaux courantes et un filet de type troubleau emmanché dans les zones lentiques. Douze microprélèvements ont été réalisés, huit dans les habitats dominants (superficie >5%) et quatre dans les habitats marginaux (superficie <5%). Les échantillons sont stockés dans des pots et fixés au formaldéhyde 4% avant analyse au laboratoire. Le tri, la détermination et le dénombrement se fait selon la norme XP T90-388 (AFNOR 2010). Les échantillons sont passés sous loupe binoculaire après une filtration sur une colonne de tamis (5mm, 2mm, 0.5mm). Les échantillons, triés par taxons, sont alors stockés dans des tubes et fixés à l'alcool à 70%. Les individus sont déterminés au niveau du genre sauf pour les Oligochètes qui sont considérés comme une entité taxonomique et pour certains Diptères déterminés au niveau de la tribu, de la sous-famille ou de la famille. Les données par station
Macro-invertébrés Diatomées Macrophytes Ichtyofaune
Physico-Chimie C1 Automne Sept. 2009 Sept. 2009 Sept. 2009 Sept. 2009 Sept. 2009
C2 Hiver Nov. 2009 Nov. 2009 - - Nov. 2009
C3 Printemps Avril 2010 Avril 2010 - - Avril 2010
correspondent à la somme des 12 microprélèvements. Ce sont ces 12 relevés qui seront utilisés pour les analyses statistiques.
1.2.2 Faune piscicole :
Les données sur la faune piscicole sont issues d’une seule campagne d’échantillonnage (tableau 2) réalisée par la Fédération des Landes pour la Pêche et la Protection des Milieux Aquatiques (FDAAPPMA40) selon la norme NF EN 14011(AFNOR 2003b). Une pêche électrique de deux passages a été réalisée sur les quatre stations. L’échantillonnage a nécessité un IG600 (appareil délivrant un courant continu) et 2 à 3 épuisettes. Deux pêches successives ont été réalisées sans remises à l’eau des individus entre les deux pêches. Les poissons capturés sont triés et stockés dans des bassines. Ils sont ensuite dénombrés, mesurés et pesés. Dans le cas où il y a un grand nombre d’individus, ils sont simplement dénombrés en lot puis pesés. Les Lamproies de planer et les Anguilles ont été endormies à l’eugénol afin de faciliter les mesures.
La FDAAPPMA40 a créé une base de référence des peuplements des cours d’eau landais à laquelle nous pourrons comparer les résultats des pêches (tableau 3).
Tableau 3 : Biomasse moyenne des espèces caractéristiques de la référence Landaise.
Biomasse moyenne (kg/ha)
Vairon / Chabot 7,62 Goujon 10,56 Loche franche 3,07 Lamproie de planer 1,57 Brochet 10,43 Anguille 28,45
Autres (migrateurs ou cyprinidés d’eau douce) 5,56
Les données environnementales des stations ont été mesurées sur le terrain : - la longueur de pêche (décamètre)
- la largeur moyenne (par le biais de transects)
- la hauteur minimale / maximale / moyenne (perche graduée) - la conductivité, la température et le pH (sonde WTW).
Les températures moyennes en Juillet et en Janvier (tableau 4) sont issues de la base de données IPR disponible sur le site de l’ONEMA « Base de données thermiques utilisée dans le cadre du calcul de l'IPR » (Rogers and Pont 2005).
Tableau 4 : Température moyenne de l’air en janvier et juillet sur les quatre stations.
AmL AmP AvP AvL
T°C en Janvier 6.87 6.9 6.86 6.94
T°C en Juillet 21.22 21.3 21.3 21.4
1.2.3 Macrophytes :
Les données macrophytiques ont été récoltées sur 2 campagnes d’échantillonnage par Irstea (tableau 2). La campagne 1 (automne) correspond à la fin de saison de végétation tandis que la campagne 4 (été) correspond au début de la période de végétation. Les campagnes ont été réalisées conformément à la norme NF EN 14184 (AFNOR 2004b) . Le recouvrement de chaque faciès (lotique ou lentique) est évalué en pourcentage ainsi que le recouvrement total de la station. Pour chaque faciès, toutes les espèces visibles à l’œil nu sont déterminées in situ puis leur surface de recouvrement est évaluée. Les espèces dont la détermination est difficile sur le terrain sont prélevées, conditionnées puis transportées au laboratoire afin de pouvoir les déterminer.
1.2.4 Diatomées :
Les données diatomées ont été échantillonnées sur les quatre campagnes (tableau 2) selon la norme NF EN 13946 (AFNOR 2003c) par Irstea. Six substrats artificiels (lames de verre) sont immergés dans des cagettes sur chaque station : 3 lames sont relevées après 15 jours d’exposition (t15) et 3 lames relevées après 30 jours (t30) d’exposition. En parallèle trois prélèvements par station sur substrat naturel dur (sur galet dans le meilleur des cas, sinon sur macrophytes) ont lieu à t30.
Pour chacun des réplicats à t15 et t30, le poids sec, la matière sèche sans cendre (MSSC), la concentration en chlorophylle-a (CHLa) dans le biofilm, ainsi que la densité de diatomées (mortes et vivantes), sont mesurés en laboratoire.
Afin de déterminer la composition taxonomique de communautés, les trois réplicats sont mixés pour t15, t30 et galet. Les préparations sont alors montées sur lames de verre (attaque
H2O2 à chaud et montage dans du Naphrax © (Brunel Microscopes Ltd)). Les lames sont
observées sur microscope Leitz DMRB à contraste Nomarski et sous objectif ×100 à immersion. Pour chaque lame, 400 individus minimum sont dénombrés et identifiés au niveau spécifique.
1.2.5 Données environnementales :
L’eau a été prélevée en même temps que les campagnes diatomées (tableau 2). Les analyses physico-chimiques ont été réalisées par l’IPL de Bordeaux durant les campagnes 1 et 2 puis par le Laboratoire d’analyse des Landes à Mont de Marsan (LD40) pour les campagnes 3 et 4. Les éléments qui sont quantifiés sont détaillés dans le tableau 5.
Tableau 5 : Liste des éléments physico-chimiques quantifiés avec leur abréviation et l’unité utilisée.
Eléments Abréviation Unité
Aluminium brut Al µg/L
Calcium Ca mg/L
Chlore Cl mg/L
Conductivité Cond. µs/cm
Demande biologique en O2 DBO5 mg(O2)/L
Fer brut Fe µg/L
Bicarbonate HCO3 mg/L
Manganèse Mn µg/L
Matière en suspension MES mg/L
N kjeldahl Nk mg(N)/L
Ammonium NH4 mg/L
Nickel Ni mg/L
Nitrite NO2 mg/L
Nitrate NO3 mg/L
Saturation en oxygène O2 sat %
pH pH -
Phosphate PO4 mg/L
Phosphore total Ptot mg(P)/L
Sulfate SO4 mg/L
Température T °C
Titre Alcalimétrique complet TAC °Fr
Zinc brut Zn brut mg/L
Zinc dissous Zn dis. mg/L
Les concentrations maximales théoriques en aniline dans le milieu ont été calculées en utilisant les données issues de l’autosurveillance de la MLPC pour l’année 2010 (51 dates de rejets dans le milieu naturel) et le QMNA5 :
( ) ( )
( )
⁄
1.3 Outils d’analyses :
1.3.1 Les données biologiques :
Dans cette première partie, les données biologiques vont être analysées afin de tester différentes métriques et ainsi déterminer les indicateurs de toxicité pour les quatre compartiments biologiques. Trois types de métriques sont utilisées : les métriques taxonomiques basées sur l’abondance des taxons, les métriques indicielles basées sur la présence de taxons bio-indicateur et les métriques fonctionnelles basées sur les traits biologiques et écologiques des taxons. Les deux premiers types de métriques sont donc basés sur les tableaux Taxons×Relevés propre à chaque compartiment. La dernière métrique est elle basée sur un tableau Relevés×Traits propre à chaque compartiment.
Nous allons tout d’abord détailler la méthode utilisée (commune aux quatre compartiments) afin d’obtenir les tableaux Relevés×Traits puis nous présenterons les analyses réalisées sur chaque compartiment.
Méthode de création des tableaux Relevés×Traits:
Pour chaque taxon des quatre compartiments biologiques différents traits fonctionnels ont été répertoriés. Chaque trait présente plusieurs modalités (deux au minimum) pour lesquelles chaque taxon possède une note d’affinité. Ceci permet d’obtenir un tableau Taxons×Traits pour chaque compartiment.
Les quatre compartiments sont analysés séparément. Les tableaux Taxons×Traits subissent une transformation selon un codage flou (Chevenet et al. 1994). Les profils fonctionnels de chaque relevé sont calculés à partir des tableaux Taxons×Relevés et Taxons×Traits. Le tableau Taxons×Relevés est usuellement en abondance. Dans le cas des macrophytes, le recouvrement de chaque taxon est assimilé à l’abondance. La faune piscicole possède deux tableaux Taxons×Relevés, un en abondance et un autre en biomasse. Ils seront tous les deux utilisés. Pour calculer les profils fonctionnels de chaque relevé, la démarche présentée dans la figure 2 a été appliqué sur chaque trait pour les quatre compartiments. Nous obtenons le tableau Relevés×Traits, soit la distribution en fréquence relative des sommes de notes d’affinités, pondérées par l’abondance (ou recouvrement ou biomasse) des taxons présents dans le relevé.
1.3.1.1 La faune piscicole
A partir des données issues des 2 pêches électriques plusieurs paramètres ont pu être estimés par la méthode de DeLury (1947) : l’effectif estimé, la variance et l’efficacité de pêche. Lorsque les conditions de Seber et Le Cren (1967) ne sont pas respectés, ces paramètres ne sont pas estimés. A partir de la surface échantillonnée et de l’effectif (estimé ou non) la densité par hectare a pu être calculée afin de s’affranchir des différences de surface échantillonnées. De même à partir de la surface échantillonnée et du poids de chaque
individu, il a été possible de calculer la biomasse (kg.ha-1).
Les données poissons ont été obtenues à partir d'une seule campagne d’échantillonnage, il n’y a donc pas de réplicats de pêche. De ce fait, aucun test statistique n’a pu être réalisé afin de tester la significativité des résultats. Seules des observations sommaires pourront être réalisées.
Dans un premier temps, la richesse spécifique, l’indice de diversité de Shannon et l’indice d’équitabilité de Pielou ont été calculés à partir des abondances issues des deux pêches cumulées. L’indice IPR a pu être élaboré grâce au document disponible sur le site de l’ONEMA (Rogers and Pont 2005). Le calcul repose uniquement sur les données issues de la première pêche. Le détail des différentes métriques composant l’IPR seront elles aussi analysées.
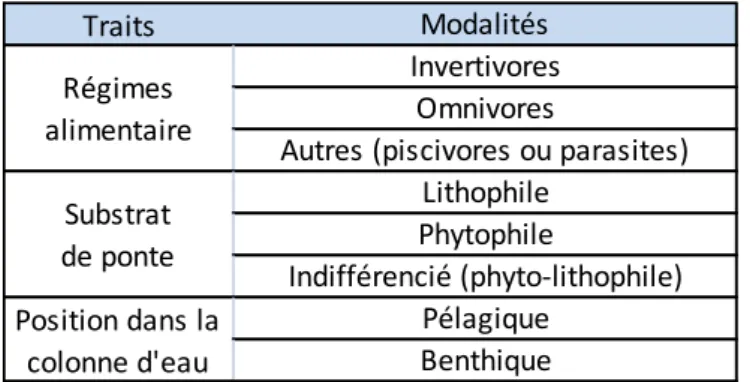
Les traits des espèces présentes (Keith and Allardi 2001) ont été analysés : leur régime alimentaire, leur substrat de ponte et leur position dans la colonne d’eau (tableau 6). Pour chacune des modalités, les taxons seront affectés d’une note 0 ou 1 (0 pas d’affinité pour la modalité et 1 affinité pour la modalité). Selon le procédé présenté précédemment, deux tableaux de fréquences relatives des modalités pour chaque trait ont été réalisés : l’un sur la base des abondances, l’autre sur la base des biomasses. Les différences de fréquences des traits entre les stations (sur la base de l’abondance) et entre les stations et la référence landaise (sur la base de la biomasse) seront comparées.
Tableau 6 : Tableau résumé les différentes guildes pour chaque traits biologiques.
Traits Modalités
Invertivores Omnivores
Autres (piscivores ou parasites) Lithophile Phytophile Indifférencié (phyto-lithophile) Régimes alimentaire Substrat de ponte
1.3.1.2 Les macrophytes :
Les données macrophytes sont issues de deux campagnes d’échantillonnage. Les tests et les analyses statistiques ne pourront donc pas être utilisés dans cette partie car le nombre de réplicats est trop faible.
Dans un premier temps, la richesse spécifique, l’indice de diversité de Shannon ainsi que l’indice d’équitabilité de Pielou ont été étudiés sur les recouvrements. Par la suite, l’indice IBMR (calculé selon la norme NF T90-395 (AFNOR 2003a)) a été calculé pour les quatre stations, puis analysé pour les deux campagnes d’échantillonnage. Les cotes spécifiques moyennes des stations ont aussi été analysées.
Les espèces ont ensuite été regroupées par groupes floristiques (algues, bryophytes, hétérotrophes et phanérogames). Le recouvrement moyen relatif de ces quatre types floristiques a été comparé entre les stations.
Pour finir, nous avons utilisé les traits biologiques des phanérogames (Willby et al. 2000) (tableau 7). Les traits « Enracinement aux noeuds », « Rapport (biomasse souterraine) / (biomasse aérienne) fort », « Feuilles sempervirentes » et « Amphibie » n’ont pas été analysés car il est nécessaire d’avoir au moins deux modalités pour un trait afin de pouvoir calculer des fréquences relatives. Chaque taxon se voit attribuer une note d’affinité du trait (0 absence du trait ; 1 expression occasionnelle du trait ; 2 expression du trait) pour chaque trait. La méthode présentée précédemment, permet d’obtenir le tableau Relevés×Traits représentant la fréquence relative des sommes des notes d’affinité pondérée par le recouvrement des espèces pour les modalités du trait étudié. Les fréquences relatives des différents traits seront comparées entre les quatre stations.
Remarque :
L’index morphologique est calculé selon :
( )
Afin de réaliser le calcul, des classes de taille sont utilisées pour la hauteur et l’extension latérale de la canopée : (1) <1cm ; (2) 1-10 cm ; (3) 10 à 40 cm ; (4) 40-100cm ; (5) <100cm.
Plus l’indice est fort, plus la plante occupe un grand espace (en hauteur ou en largeur). Inversement plus l’indice est faible, plus la plante occupe un espace restreint.
1.3.1.3 Les MIB :
Afin d’analyser les données obtenues sur les MIB, plusieurs analyses sont réalisées. Dans un premier temps, les données d’abondance (tableau Taxons×Relevés) ont été exploitées. Par la suite ces données ont été couplées aux données de traits biologiques et écologiques (tableau Taxons×Traits) afin d’analyser les traits des différentes stations.
Le tableau Taxons×Relevés :
Afin de caractériser la communauté de MIB, une analyse factorielle de correspondances (AFC) a été réalisée sur les données d’abondances (transformées au préalable en log(abondance+1)).
La richesse spécifique, l’indice de diversité de Shannon et l’indice d’équitabilité de Pielou ont été calculés pour chacun des relevés. Ces indices ont été comparés entre stations grâce à des tests de Kruskal-Wallis.
De même, l’indice IBGN a été calculé ainsi que les indices SPEARpesticides (Liess and Von Der Ohe 2005) et SPEARorganic (Beketov and Liess 2008) par le biais de l’application en
ligne (http://www.systemecology.eu/spear/spear-calculator/). Les indices moyens ont été
comparés entre les stations par des tests de Kruskal-Wallis.
Le tableau Taxons×Traits
Par la suite nous avons travaillé sur les 11 traits biologiques (tableau 8) et les 11 traits écologiques (tableau 9) développés par Tachet et al. (2010). Pour chaque modalité, les taxons se voient attribuer une note allant de 1 à 5 selon son affinité à la modalité (0aucune affinité, 5 très forte affinité). Avec le procédé décrit précédemment, le tableau Relevés×Traits est obtenu. A partir de ce tableau, des tests de Kruskal-Wallis ont été appliqués afin de comparer la fréquence relative des modalités entre les quatre stations.
Enfin, une analyse de co-inertie a permis de coupler les tableaux Taxons×Relevé et Taxons×Traits afin de confronter les données de la structure faunistique avec les caractéristiques biologiques et écologiques. Pour cela, une analyse des correspondances multiples (ACM) a été préalablement réalisée sur les données Taxons×Traits.
1.3.1.4 Les diatomées :
Dans un premier temps, les caractéristiques quantitatives du phytobenthos vont être étudiées : le poids sec, la matière sèche sans cendre (MSSC), la concentration en
chlorophylle-a, le ratio et le nombre de diatomées vivantes, des
échantillons prélevés à t15 et t30 vont être comparés entre les quatre stations grâce à des tests de Kruskal-Wallis. Par la suite le taux de croissance déterminé (pente du profil de cinétique de croissance) pour chaque station. Ces taux de croissance seront comparés entre les stations par des tests de Kruskal-Wallis.
Concernant les analyses qualitatives, deux tableaux Taxons×Relevés sont disponibles pour les analyses diatomées : un tableau brut comportant 234 taxons et un sous-tableau contenant les taxons ayant une abondance, toutes lames confondues, supérieure ou égale à 5 (soit 107 taxons).
Afin de caractériser la communauté de diatomées présentes, une AFC sur le tableau de 107 taxons est réalisé selon les mêmes modalités que celles utilisées pour les macroinvertébrés (§ *****, i.e. transformation log(abondance+1)).
La richesse spécifique, l’indice de diversité de Shannon et l’indice d’équitabilité de Pielou ont été calculés sur le tableau de 234 taxons pour les quatre stations. De même, l’indice IBD a été calculé pour les quatre stations selon la norme NF T30-354 (AFNOR 2007). L’indice IPS à lui aussi été calculé. Ces indices ont été comparés entre stations grâce à des tests de Kruskal-Wallis.
Le pourcentage de formes tératogènes ainsi que le nombre de relevés ayant au moins 1% de formes tératogènes (comptage établi sur le tableau de 234 taxons) ont été comparés entre stations par des tests de Kruskal-Wallis.
Pour finir, les traits biologiques ont été étudiés (tableau 10). Ces traits sont issus de la
base de données Irstea (https://hydrobio-dce.cemagref.fr/) , de Rimet and Bouchez (2012) et
Passy (2007). Pour chaque modalité, une note de 0 (i.e. « pas d’affinité ») ou de 1 (i.e. « affinité ») a été attribuée à chaque taxon en fonction de son affinité pour chaque modalité. La procédure présenté précédemment a été appliquée afin d’obtenir un tableau représentant la distribution de fréquence relative des affinités pondérés par l’abondance des taxons pour chaque relevé (tableau Relevés×Traits). Un test de Kruskal-Wallis a ensuite été réalisé afin de
comparer les stations entre elles pour les différentes modalités d’un trait. Afin de pousser l’analyse plus loin, les fréquences relatives des modalités ont été comparées (test de Kruskal-Wallis) au sein de chaque trait pour les quatre stations sur les traits qui ne répondaient pas au test précédent.
Tableau 10 : Les 4 traits biologiques diatomées associés aux 15 modalités.
1.3.2 Les données environnementales :
Dans cette seconde partie, les données environnementales vont être analysées afin de caractériser les stations d’un point de vue physico-chimique. Cela permettra de comparer les résultats physico-chimiques avec les résultats biologiques précédents.
Les données physico-chimiques comportent dans plusieurs relevés des valeurs de
paramètres inférieures au seuil de détection. Les paramètres Ni brut, NO2 et PO4 présentent
respectivement 9, 8 et 9 relevés sur 16 pour lesquels les valeurs sont inférieures au seuil de détection pour les stations amont et aval, sur les campagnes 3 et 4 notamment. Ces paramètres ne sont donc pas pris en compte dans la suite des analyses car les variations entre les stations ne sont pas observables pour 2 campagnes sur 4. Pour les autres paramètres, lorsque les relevés présentent une valeur inférieure au seuil de détection, celle-ci est remplacée par
⁄ (Helsel 1990) pour réaliser les analyses statistiques.
Traits Modalités Guilde de Passy Low profile High profile Mobile Variable Biovolume (µm3) <99 100-299 300-599 600-1499 >1500 Forme de croissance Adnate Pedunculate Colonial Non-colonial Forme pionnière Non.pioneer Pioneer
Afin d’intégrer l’aniline dans les paramètres environnementaux, une moyenne des concentrations maximales théoriques dans le milieu calculé sur l’année 2010 a été réalisée, soit 0,44µg/L. Nous faisons alors l’hypothèse que les sites amont (AmL et AmP) présentent une concentration en aniline nulle. En effet, l’aniline est un composé utilisé dans les produits phytosanitaires, les matières colorantes, l’industrie du caoutchouc (cas de la MLPC) et en tant qu’intermédiaire de polyéthuranes (INRS 2010). La pisciculture n’est donc pas usagère de ce composé. Nous supposons par la suite que les sites aval (AvP et AvL) présentent une concentration moyenne d’aniline de 0,44µg/L pour les quatre saisons d’échantillonnage (en supposant que la concentration moyenne d’aniline utilisée par l’usine varie peu d’une année à l’autre). Nous ne pouvons pas être plus précis car nous ne possédons pas de données d’autocontrôle sur l’année 2009 et les données de l’Agence de l’Eau ne nous permettent pas d’avoir le débit mensuel du cours d’eau.
Afin de mettre en évidence la structure des stations en fonction des paramètres environnementaux, une analyse en composante principale (ACP) va être réalisée. Les données sont préalablement normalisées (transformation des données). Ensuite une analyse de redondance des paramètres est faite grâce à des tests de corrélations de Spearman deux à deux. Lorsque des variables seront identifiées comme redondantes et ayant la même signification écologique, seule l’une d’entre elles sera conservée, les autres seront supprimées de l’analyse. L’ACP sera réalisée sur les variables environnementales restantes. La variable « aniline » ne sera pas prise en compte dans la construction de l’ACP et sera rajoutée en temps que variable supplémentaire a posteriori pour ne pas influencer artificiellement les axes.
1.3.3 Pertinence des indicateurs toxiques :
Dans cette dernière partie, nous allons déterminer quels sont les indicateurs les plus pertinents pour discriminer les stations entre elles.
Dans un premier temps, une PLS-DA (Partial Least Squares Discriminant Analysis) a été appliquée sur les compartiments biologiques MIB (4 réplicats), diatomées (4 réplicats) et macrophytes (2 réplicats) séparément. Cette analyse n’a pas pu être réalisée sur les données de l’ichtyofaune du fait de l’absence de réplicats. Cette analyse, qui est adaptée à un grand nombre de variables (colonnes) pour un faible nombre d’objets (lignes), va permettre de discriminer au mieux les stations entre elles.
Pour cela, un tableau Relevés×Indicateurs est utilisé pour chaque compartiment. Ces tableaux contiennent les indicateurs identifiés précédemment comme présentant une variation entre les stations permettant de mettre en évidence d’une perturbation toxique sur les stations aval. Les données sont centrées-réduites au préalable et les relevés sont regroupés par station sur l’analyse. Afin de déterminer quels sont les indicateurs qui ont la plus grande importance dans la construction de l’analyse, la valeur VIP (Variable Importance in the Projection) est calculée pour chaque indicateur. Afin d’observer en même temps la position de l’indicateur sur la dimension étudiée, la valeur VIP a été pondérée par le signe de la variable sur la dimension considérée.
Afin d’observer quels sont les compartiments qui permettent de discriminer au mieux les stations, une PLS-DA a été appliquée sur les trois compartiments regroupés en ne conservant que les campagnes 1 et 4 selon les mêmes modalités.
Dans cette dernière partie, les compartiments MIB et diatomées (les seuls possédants un nombre de réplicats suffisant pour pouvoir appliquer les tests statistiques) ont été analysés séparément par le biais d’une analyse RLQ. Cette analyse permet d’observer si la réponse des taxons au gradient de pollution
physico-chimique peut s’expliquer par les traits des espèces. La même démarche a
été appliquée pour les deux compartiments biologiques (les traits biologiques et écologiques des MIB seront traités indépendamment).
L’analyse RLQ (figure 3) permet de mettre en relation le tableau de données environnementales (nommé R) et le tableau de traits des taxons (Q) avec l’aide du tableau de relevé taxonomique (L). Des analyses préliminaires sont réalisées sur chacun des tableaux :
- AFC sur le tableau L (données transformées en log(abondance+1) ).
- ACP sur le tableau R pondérée par le poids des lignes issus de l’AFC (même caractéristiques de l’ACP réalisée au paragraphe ******).
- ACM sur le tableau Q pondérée par le poids des colonnes issus de l’AFC (traits en codage flou).
2 Résultats :
2.1 Les données biologiques :
2.1.1 La faune piscicole :
Attention ! Aucun test statistique n’a pu être réalisé car seule une campagne de pêche
électrique a eu lieu.
2.1.1.1 Métriques taxonomiques :
La richesse spécifique, l’indice de diversité de Shannon ainsi que l’équitabilité de Pielou mettent en avant des différences entre les quatre stations (figure 4). Les stations amont présentent la même richesse spécifique, 6 espèces. La station AvP ne présente qu’une espèce, le Vairon. La station AvL possède plus d’espèces que les stations amont, cependant cette augmentation est faible (deux espèces seulement).
Les indices de Shannon et de Pielou des mêmes profils similaires. Les stations AmL, AmP et AvL présentent peu de différences. La station AvP a un score de 0 pour ces 2 indices car elle ne possède qu’une seule espèce.
Figure 4 : Diagrammes bqtons, basé sur les abondances, représentant les richesses spécifiques, les indices de Shannon et les indices de Pielou pour les 4 stations échantillonnées.
Ces 3 indices discriminent donc la station immédiatement à l’aval de l’usine des trois autres stations. La station AvL n’est pas différenciée.
Aucun de ces indices ne permet de mettre en évidence l’enrichissement trophique sur la station AmL.
Nous avons par la suite utilisé la biomasse totale des stations ce qui nous permet de prendre la référence landaise « REF » ou AmP en tant que référence (figure 5). Les deux stations amont ont des biomasses proches de la biomasse de la référence landaise. On peut cependant noter que la biomasse à la station AmL est plus forte qu’à la station AmP , ce qui peut traduire l’enrichissement trophique du à la pisciculture. La station AvP présente une biomasse de 0, le nombre d’individus (2) étant trop faible pour calculer une biomasse. La station AvL présente une biomasse de 12, ce qui est faible en comparaison à la biomasse de référence landaise ainsi que à la station AmP.
Les biomasses totales des stations amont sont proches de la biomasse de référence alors que les biomasses des stations aval sont beaucoup plus faibles que la référence. La biomasse chute à l’aval proche de l’usine puis réaugmente par la suite à la station AvL mais reste néanmoins très faible.
La biomasse permet donc de différencier les stations aval de la station de référence AmP ainsi que de la référence landaise.
La biomasse permet également de différencier la station AmL de la station de référence AmP.
2.1.1.2 Métriques indicielles :
L’IPR a été calculé pour les quatre stations (figure 6). La Lamproie marine ainsi que le Flet n’entrent pas en jeu dans cet indice.
Figure 6 : Echelle de l’indice IPR avec la position des stations échantillonnées sur l’axe.
La station considérée comme référence, AmP, présente un indice de 14,62 soit une classe de qualité « Bonne ». La station AmL est classée comme « état moyen ». La station AvP a un indice de 52,27 et est classé comme « Très mauvais ». Enfin la station AvL présente un indice de 22,48, soit une classe moyenne.
L’IPR permet donc principalement de mettre en évidence la pollution à l’aval proche de l’usine. En effet, la station AvP est très fortement déclassée par rapport aux autres stations. L’indice ré-augmente en station AvL, mais reste cependant légèrement plus faible que sur la station AmP.
La perturbation présente sur la station AmL du à la pisciculture est mise en évidence par l’indice IPR, qui présente une légère chute .
Les métriques de l’indice IPR ont été analysées en détail afin de déterminer quelles sont les métriques déclassantes pour les différentes stations (plus une métrique a un score fort, plus elle est déclassante pour la station). Les résultats obtenus pour la station AvP sont mis à titre indicatif. L’IPR permet de mettre en évidence un impact extrême sur le milieu, mais ses métriques ne sont pas interprétables du fait de la biomasse nulle et de la présence de deux individus d’une seule espèce.
La première partie (tableau 11) correspond aux métriques basées sur les occurrences d’espèces. Le nombre total d’espèce théorique et observé varie très fortement pour la station AmP avec 1 espèce observée pour 7,33 espèces attendues. Les stations AmL, AmP et AvL présentent des variations moins fortes. Les stations amont présentent un nombre d’espèce lithophile proche des valeurs attendues. En revanche, la station AvL présente une seule espèce. Enfin aucune espèce rhéophile n’est présente sur les 4 stations. Le nombre attendu étant faible (environ1,3), peu de différences sont alors observées.
Comme attendu, la métrique du nombre total d’espèce va donc être fortement déclassante dans cette première partie pour la station AvP. Les trois autres stations ont des scores qui sont proches les uns des autres et ne se différenciées que très peu.
Les métriques basées sur le nombre d’espèces déclassent fortement la station AvP avec un score de 18,22. Les autres stations présentent des scores proches les unes des autres.
Tableau 11 : Tableau synthétisant les valeurs théoriques, les valeurs observées et les scores des métriques pour les métriques IPR basées sur les occurrences d’espèces pour les 4 stations.
AmL AmP AvP AvL
Nombre total d’espèces (NTE) Théorique 7,29 7,53 7,33 7,20 Observée 4 5 1 6 Score métrique 3,64 2,42 9,35 0,93 Nombre d’espèces lithophiles (NEL) Théorique 2,52 2,46 2,40 2.26 Observée 2 2 1 1 Score métrique 2,22 2,10 4,21 3,85 Nombre d’espèces rhéophiles (NER) Théorique 1,40 1,42 1,35 1.29 Observée 0 0 0 0 Score métrique 4,86 4,78 4,66 4,52 SCORE TOTAL 10,72 9,3 18,22 9,3
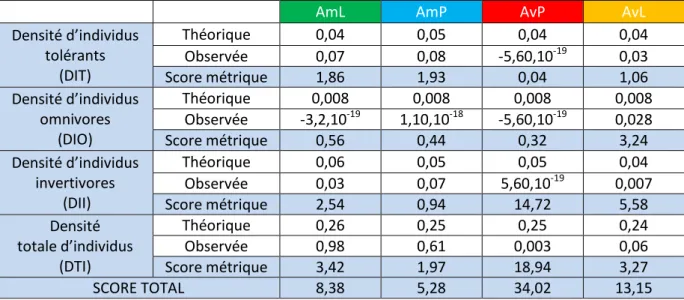
La seconde partie (tableau 12) correspond aux métriques qui sont basées sur les abondances d’espèces. Excepté la Densité totale d’individu, les résultats de la station AvP ne sont pas robustes.
La densité d’individus tolérants est quasiment la même pour les trois stations.
Les densités d’individus omnivores présentent une hausse par rapport aux valeurs théoriques pour la station AvL, les stations amont présentes elles une baisse de cette densité.
La densité d’individus invertivores est faible qu’attendue pour la station AvL. Les scores des stations amont sont proches des valeurs attendus.
La densité totale d’individus observée est plus faible qu'attendue en théorie pour les stations AvP et AvL avec des scores respectifs de 0,003 et 0,06 au lieu de environ 0,25. En revanche les stations AmL et AmP présente des scores supérieurs aux valeurs théoriques avec 0,98 et 0,61. La densité est donc plus forte à l’amont qu’à l’aval.
Tableau 12 : Tableau synthétisant les valeurs théoriques, les valeurs observées et les scores des métriques pour les métriques IPR basées sur les abondances d’espèces pour les 4 stations.
AmL AmP AvP AvL
Densité d’individus tolérants (DIT) Théorique 0,04 0,05 0,04 0,04 Observée 0,07 0,08 -5,60,10-19 0,03 Score métrique 1,86 1,93 0,04 1,06 Densité d’individus omnivores (DIO) Théorique 0,008 0,008 0,008 0,008 Observée -3,2,10-19 1,10,10-18 -5,60,10-19 0,028 Score métrique 0,56 0,44 0,32 3,24 Densité d’individus invertivores (DII) Théorique 0,06 0,05 0,05 0,04 Observée 0,03 0,07 5,60,10-19 0,007 Score métrique 2,54 0,94 14,72 5,58 Densité totale d’individus (DTI) Théorique 0,26 0,25 0,25 0,24 Observée 0,98 0,61 0,003 0,06 Score métrique 3,42 1,97 18,94 3,27 SCORE TOTAL 8,38 5,28 34,02 13,15
La densité totale d’individus va entrainer un déclassement fort de la station AvP dans cette seconde partie, les autres métriques ne sont pas exploitable du fait de la présence d’une seule espèce. La densité totale entraine également un déclassement moindre des stations AmL et AvL. Les individus invertivores étant indicateurs de bonne qualité du milieu et les individus omnivores étant présents dans les milieux pollués, ces métriques vont entrainer un déclassement de la station AvL. De même, la station AmL présente un déclassement du à la faible présence d’individu invertivores. Enfin, une forte densité d’individus tolérants étant un indicateur de mauvaise qualité, cette métrique va entrainer un faible déclassement des stations AmL, AmP et plus faiblement AvL. Ce sont principalement les métriques basées sur l’abondance qui mettent en évidence les différences entre les stations AmP, AmL et AvL.
Comme attendu, les métriques « Nombre total d’espèces », et « Densité totale d’individus » permettent de mettre en évidence la pollution impactant la station AvP. Les métriques « Densité totale d’individus », « Densité d’individus omnivores » et « Densité d’individus invertivores » mettent en évidence la présence d’une perturbation sur la station AvL.
Les métriques « Densité d’individus invertivores » et « Densité totale d’individus » mettent en évidence la perturbation présente sur la station AmL.
2.1.1.3 Métriques fonctionnelles :
Attention ! Les résultats présentés pour la station AvP sont mis uniquement à titre indicatif. En effet, l’absence de faune piscicole sur cette station ne permet pas de décrire la population, celle-ci étant absente. Ces résultats ne sont donc pas à prendre à compte.
Nous avons par la suite analysé les guildes en termes d’abondances (figure 7). Pour les régimes trophiques, nous observons que les stations AvL et AmL présentent une légère baisse de taxons invertivores par rapport à la station AmP. Les « autres régimes alimentaires » (i.e. parasites ou carnassiers) ne sont pas présents. De même pour les substrats de ponte, les stations AvL et AmL présentent une légère baisse de taxons phyto-lithophile par rapport à la station AmP. Les espèces phytophiles strictes ne sont pas présentes sur les stations. Enfin, les stations AmL (et AvL présentent moins d’espèces benthiques que AmP, avec une baisse plus forte sur la station AvL. La station de référence AmP présente quasiment 50% d’espèces benthiques en termes d’abondance.
Figure 7 : Diagrammes-bâton empilés représentants pour les trois traits biologiques les abondances relatives des modalités pour les quatre stations.
Le trait « Position dans la colonne d’eau » présente les variations les plus fortes qui permettent de mettre en avant principalement la perturbation présente sur la station AvL avec une diminution de ¾ de l’abondance des espèces benthiques. Les autres traits présentent des variations moins marquées.
La même analyse a été réalisé sur les biomasses d’espèces (figure 8), ce qui permet d’inclure la référence landaise « REF ».
Pour le trait « Régime alimentaire », la référence landaise présente des espèces « autres » contrairement aux stations échantillonnées. Les modalités « invertivores » et « omnivores » sont présentes sur les stations AmL, AmP, AvL et REF en proportions variables. La station AmP présente une très forte proportion d’invertivores en comparaison à la référence landaise tandis que les stations AmL et AvL présentent des proportions proche de REF. On peut observer que les stations AmL et AvL présentent une baisse de taxons invertivores en comparaison avec la station référence AmP.
La station REF présente les trois modalités du trait « Substrat de ponte » avec une prépondérance d’espèce lithophiles. La station AmL présentent une forte proportion d’espèce mixte (litho-phytophile) par rapport à la référence landaise, la station AmL présente une proportion semblable. La station AvL ne présente que des espèces lithophiles. On peut de plus observer une chute des espèces mixtes sur les stations AvL et AmL par rapport à AmP.
Enfin, les biomasses du trait « Position dans la colonne d’eau » des stations amont sont semblables au profil de la référence landaise. La station AvL présente une faible proportion de biomasse d’espèces benthiques (en comparaison à REF et à AmL), moins de 20%
Figure 8 : Diagrammes-bâton empilés représentants pour les trois traits biologiques les biomasses relatives des modalités pour les quatre stations échantillonnées ainsi que pour la station de référence Landaise.
Les biomasses ne permettent donc pas de statuer sur la station AvP car sa biomasse est nulle. Les traits « régime alimentaire » et « substrat de ponte » permettent de différencier les trois stations restantes de la référence landaise. Ces différences sont dues à la présence du Brochet (espèce piscivore et phytophile) dans la référence Landaise. La non-présence de cette espèce est plus due à des modifications des berges (empêchant la ponte dans les prairies inondées). On peut observer une diminution des traits « invertivores » et « litho-phytophiles » sur les stations AmL et AvL par rapport à la station de référence AmP. Enfin, la guilde « position dans la colonne d’eau » permet de différencier la station AvL de la référence landaise et de la station de référence AmP avec une forte baisse des espèces benthiques.
Les traits mettent en évidence la perturbation toxique. La position dans la colonne d’eau semble être un bon indicateur avec une très forte baisse des espèces benthiques (abondance et biomasse) au profit des espèces pélagiques. Cette station présente, comme AmL, une chute des taxons invertivores et litho-phytophiles.
La perturbation trophique sur la station AmL est mise en évidence par une modification des traits « Régime alimentaire » et « Substrat de ponte ». Cependant ces traits mettent aussi en évidence la perturbation toxique sur la station AvL.
2.1.1.4 Résumé :
De manière générale, les différents indicateurs d’impact toxique répondent bien à la pollution toxique présente dans le Luzou. Les tableaux 13 et 14 résume les différents indicateurs testés ainsi que les stations qui permettent de discriminer de AmP ou de la référence landaise.
Tableau 13 : Tableau résumant les différents indicateurs de pollution toxique testés en comparaison avec la station de référence AmP. «NE» : Indicateurs non exploitables (manque de données)
AmL AvP AvL
Richesse spécifique (ab) x
Indice de Shannon (ab) x
Indice de Pielou (ab) x
Biomasse x x x
Guilde trophique (ab) x NE x
Guilde reproduction (ab) x NE x
Position - colonne d'eau (ab) NE x
Guilde trophique (biomasse) x NE x
Guilde reproduction (biomasse) x NE x
Position - colonne d'eau (biomasse) NE x
IPR x X x Métrique NTE X Métrique NEL NE Métrique NER NE Métrique DIT NE Métrique DIO NE x Métrique DII x NE x Métrique DTI x x x
Tableau 14 : Tableau résumant les différents indicateurs de pollution toxique testés en comparaison à la référence landaise. « - » : Indicateurs non exploitables (manque de données)
AmL AmP AvP AvL
Biomasse x x
Guilde trophique (biomasse) x x NE x
Guilde reproduction (biomasse) x x NE x
2.1.2 Les macrophytes :
Attention ! Aucun test statistique n’a pu être réalisé pour mettre en évidence la véracité des observations, le nombre de réplicats étant trop faible.
2.1.2.1 Métriques taxonomiques :
La richesse spécifique, l’indice de diversité de Shannon et l’indice d’équitabilité de Pielou ont été calculés sur les recouvrements moyennés des deux campagnes pour chaque station (figure 9).
Les stations amont possèdent des richesses spécifiques semblables, aux environs de 9 espèces. Nous observons une chute de la richesse spécifique à la station AvP mais cette chute est faible. La station AvL présente une richesse spécifique plus forte que les stations amont, environ 15 espèces.
Les indices de Shannon et de Pielou ont des profils similaires avec des différences plus marquées pour l’indice de Pielou. Les stations AmP, AmL et AvL ont des indices semblables. La station AvP présente des indices très faibles.
Figure 9 : Diagrammes-bâton représentant les moyennes des richesses spécifiques, des indices de Shannon et des Pielou pour les quatre stations. Les barres d’erreur représentent les écarts types.
La richesse spécifique ne semble donc pas être un bon indicateur de la pollution due aux rejets industriels. En revanche, les indices de Shannon et de Pielou semblent eux permettre de différencier la station AvP de la station AmP grâce à des indices très faibles. En revanche, aucune métrique ne met en évidence la persistance de la pollution sur la station AvL.
Aucune de ces métriques ne semble mettre en avant la pollution du à la pisciculture sur la station AmL.