Implications de l’hétérogénéité comportementale et
biologique pour la vaccination contre les virus du
papillome humain au niveau de la population :
modélisation mathématique, revue systématique et
méta-analyse
Thèse
Talía Malagón
Doctorat en épidémiologie
Philosophiæ doctor (Ph.D.)
Québec, Canada
© Talía Malagón, 2016
Implications de l’hétérogénéité comportementale et
biologique pour la vaccination contre les virus du
papillome humain au niveau de la population :
modélisation mathématique, revue systématique et
méta-analyse
Thèse
Talía Malagón
Sous la direction de :
iii
Résumé
Objectifs : Dans plusieurs pays la couverture vaccinale contre les virus du papillome humain (VPH) est associée aux déterminants sociaux des comportements sexuels et la participation au dépistage du cancer du col utérin. Ces vaccins protègent uniquement contre certains types de VPH, donc leur impact futur sur les VPH non-vaccinaux demeure incertain. L’hétérogénéité comportementale entre individus et biologique entre types de VPH affectera l’efficacité populationnelle de la vaccination contre les VPH. Les objectifs spécifiques de cette thèse étaient 1) de modéliser comment une couverture vaccinale inégale entre filles préadolescentes qui différeront selon leur activité sexuelle et leur participation au dépistage du cancer du col affectera l’efficacité populationnelle de la vaccination, 2) faire une synthèse et comparer les estimés d’efficacité croisée des vaccins contre les VPH dans des populations ADN-négatives aux VPH et 3) d’identifier, avec la modélisation, les devis d’étude épidémiologique qui réduisent les biais dans l’estimation des interactions biologiques entre types de VPH.
Méthode : Nous avons utilisé des modèles de transmission dynamique et une revue systématique de la littérature pour répondre aux objectifs. 1) Nous avons modélisé une couverture vaccinale inégale entre filles qui différeront selon leur activité sexuelle et leur participation au dépistage, et examiné les changements post-vaccination dans l’inégalité dans la prévalence des VPH et l’incidence des carcinomes malpighien (SCC) du col de l’utérus entre femmes ayant différents comportements. 2) Nous avons effectué une revue systématique et méta-analyse des efficacités croisées des vaccins contre les VPH estimées dans des populations ADN-négatives aux VPH. 3) Nous avons développé des modèles de transmission dynamique et d’interaction de deux types de VPH pour simuler les études épidémiologiques d’interactions entre les VPH.
Résultats : Pour l’objectif 1), notre modèle de transmission prédit que l’efficacité populationnelle du vaccin dépendra de la distribution du vaccin dans la population. Après la vaccination, les inégalités absolues dans l’incidence de l’infection et des SCC entre groupes de femmes qui diffèrent selon leur activité sexuelle et leur participation au dépistage devraient diminuer. Inversement, les inégalités relatives pourraient augmenter si les femmes plus sexuellement actives et celles qui ne se font jamais dépister ont une couverture vaccinale moins élevée que les autres. Le taux d’incidence des SCC demeurera élevé chez les femmes qui ne sont jamais dépistées après la vaccination. L’efficacité croisée vaccinale et les interactions biologiques entre VPH ne sont pas encore assez bien caractérisées pour pouvoir prédire l’impact du vaccin sur les types de VPH non-vaccinaux. Pour l’objectif 2), notre méta-analyse des essais cliniques des vaccins suggère que le vaccin bivalent a une efficacité croisée significativement plus élevée que le quadrivalent contre les infections persistantes et lésions précancéreuses avec les VPH-31, 33 et 45. Les essais cliniques plus longs estiment une efficacité croisée plus faible. La modélisation des études épidémiologiques d’interactions pour l’objectif 3) montre que l’estimation des interactions biologiques entre types de VPH dans les études épidémiologiques est
iv
systématiquement biaisée par la corrélation entre le temps à risque d’infection avec un type de VPH et le temps à risque d’infection avec d’autres types de VPH. L’ajustement pour des marqueurs d’activité sexuelle ne réussit pas à contrôler ce biais. Une mesure valide des interactions biologiques entre types de VPH peut être obtenue uniquement avec des études épidémiologiques prospectives qui restreignent les analyses à des individus susceptibles ayant des partenaires sexuels infectés.
Conclusion : L’hétérogénéité comportementale entre individus et l’hétérogénéité biologique entre VPH affecteront l’efficacité populationnelle du vaccin contre les VPH. Dans les contextes où les déterminants sociaux des comportements sexuels et la participation au dépistage sont aussi associés à la couverture vaccinale chez les préadolescentes, l’inégalité relative dans l’incidence des SCC risque d’augmenter. Ces comportements demeureront des facteurs de risque importants du cancer du col à l’avenir. L’effet à long terme du vaccin sur les types de VPH non-vaccinaux demeure incertain. Quoique nos résultats suggèrent que les vaccins offrent une efficacité croisée contre certains types de VPH, celle-ci pourrait diminuer après quelques années. Des interactions compétitives entre VPH pourraient exister malgré les associations observées entre les incidences des infections VPH, donc une augmentation post-vaccination de la prévalence des VPH non-vaccinaux demeure possible. Des devis d’analyse plus complexes sont nécessaires pour mesurer de façon valide les interactions biologiques entre les VPH dans les études épidémiologiques.
v
Abstract
Objective: In many countries, uptake of the human papillomavirus (HPV) vaccine is associated with many of the same social determinants as cervical cancer and its behavioural risk factors, most notably sexual activity and screening participation. HPV vaccines only protect against a handful of oncogenic HPV types, so their impact on non-vaccine HPV types is uncertain. This behavioural heterogeneity between individuals and biological heterogeneity between HPV types will affect the population-level impact of HPV vaccination. The specific objectives were to 1) model how differential vaccine uptake between preadolescent girls who will have different sexual and cervical cancer screening behaviours can affect vaccination effectiveness, 2) review and compare estimates of HPV vaccine cross-efficacy in HPV-negative populations, and 3) use transmission modelling to identify the epidemiological study designs which reduce bias in the estimation of biological interactions between HPV types.
Methods: We used transmission dynamic models and a systematic review of the literature to address these objectives. 1) We modeled different vaccine uptakes between preadolescent girls who will have different sexual and cervical cancer screening behaviours, and examined the predicted post-vaccination changes in inequalities in the prevalence of HPV and the incidence of cervical squamous cell carcinomas (SCC) between women with different behaviours. 2) We performed a systematic review and meta-analysis of HPV vaccine cross-efficacy in HPV-negative populations. 3) We developed dynamic transmission models of two HPV types to simulate epidemiological studies of biological interactions between HPV types.
Results: For objective 1), our transmission dynamic model predicts that the population-level effectiveness of HPV vaccines will depend on its uptake distribution in the population. Absolute inequalities in the prevalence of infection and the incidence of SCC between women with different sexual and screening behaviours should diminish following vaccination. Inversely, relative inequalities between these women could increase if those who are more sexually active and who are never screened also have the lowest vaccine uptake. The incidence rate of SCC will remain high in women who are never screened post-vaccination. HPV vaccines’ cross-efficacy and the biological interactions between HPV types were not sufficiently quantified to allow predicting the impact of HPV vaccination on non-vaccine HPV types. For objective 2), our meta-analysis of vaccine clinical trials suggest that the bivalent vaccine has a significantly higher efficacy than the quadrivalent vaccine against infections and lesions with HPV-31, 33, and 45. Longer clinical trials estimate lower cross-efficacies. The simulation of epidemiological studies for objective 3) revealed that the estimation of biological interactions between HPV types in epidemiological studies is systematically biased by the correlation between the times at-risk for infection with different HPV types, which results in a cross-sectional and prospective correlation between their infection incidences. Adjusting for sexual behaviour markers does not control this bias. A valid measure of biological
vi
interactions between HPV types can only be obtained in prospective epidemiological studies which restrict analyses to times where individuals have an infected partner and thus are at-risk of infection.
Conclusions: Behavioural heterogeneity between individuals and biological heterogeneity between HPV types will affect the population-level impact of HPV vaccination and should be considered in mathematical models and epidemiological studies. In contexts where the social determinants of sexual activity and screening are also associated with vaccine uptake in preadolescent girls, relative health inequalities may increase. These behaviours will remain important risk factors for cervical cancer in the vaccine era. The long-term effect of HPV vaccines on non-vaccine HPV types remains uncertain. While our results suggest that vaccines offer cross-efficacy against certain HPV types, this cross-cross-efficacy could wane within a few years. Competitive interactions between HPV types could exist despite observed associations between the incidences of different HPV type infections, so a post-vaccination increase in non-vaccine HPV types remains possible. More complex analysis designs are required to validly measure biological interactions between HPV types in epidemiological studies.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... ix
Liste des figures ... x
Liste des abréviations et des sigles ... xii
Liste des publications ... xiii
Liste des présentations et affiches ... xiv
Remerciements ... xvi
Avant-propos ... xvii
1 Introduction ... 1
1.1 Pertinence ... 1
1.2 État des connaissances ... 3
1.3 Objectifs ... 32
1.4 Méthodologie ... 33
2 Modélisation de l’impact de l’association entre l’activité sexuelle et la vaccination sur l’efficacité populationnelle de la vaccination contre les VPH ... 49
2.1 Résumé ... 50 2.2 Abstract ... 51 2.3 Introduction ... 52 2.4 Methods ... 54 2.5 Results ... 55 2.6 Discussion ... 61
Appendix – Supplementary material ... 64
3 Modélisation de l’impact de l’association entre la participation au dépistage et la vaccination sur l’efficacité populationnelle de la vaccination contre les VPH ... 65
3.1 Résumé ... 66 3.2 Abstract ... 67 3.3 Introduction ... 68 3.4 Methods ... 69 3.5 Results ... 72 3.6 Discussion ... 77
viii
4 Revue systématique et méta-analyse de l’efficacité croisée des vaccins bivalent et quadrivalent contre
les VPH non-vaccinaux ... 85 4.1 Résumé ... 86 4.2 Abstract ... 87 4.3 Introduction ... 88 4.4 Methods ... 88 4.5 Results ... 90 4.6 Discussion ... 96
Appendix – Supplementary material ... 100
5 Interactions biologiques entre VPH ... 105
5.1 Résumé ... 106 5.2 Abstract ... 107 5.3 Introduction ... 108 5.4 Methods ... 109 5.5 Results ... 114 5.6 Discussion ... 119
Appendix – Supplementary material ... 122
6 Conclusion ... 123
6.1 Résumé des résultats principaux ... 123
6.2 Impact de l’hétérogénéité comportementale sur l’efficacité populationnelle de la vaccination ... 124
6.3 Efficacité croisée vaccinale ... 129
6.4 Interactions biologiques entre VPH ... 132
Bibliographie ... 137
Annexe – Structure du modèle d’interaction et mesures d’association ... 172
Technical Appendix... 173
1. HPV interaction model description ... 174
1.1. Model description ... 174
1.2 Model variables and parameters ... 178
1.3 Differential equations ... 181
2 Calculation of epidemiological measures of association between HPV types (interaction estimates) ... 202
2.1 Cross-sectional measures of association ... 203
ix
Liste des tableaux
Tableau 1–1. Associations entre facteurs de risque comportementaux, facteurs de risque
sociodémographiques/ économiques et états de santé associés au VPH. ... 13 Tableau 1–2. Études épidémiologiques évaluant les associations entre un premier type de VPH et un ou plusieurs différents types de VPH. ... 22 Table 3–1. Vaccine uptake distribution scenarios. ... 71 Table 4–1. Characteristics of trials evaluating vaccine efficacy against non-vaccine HPV types in HPV-naive populations. ... 92 Table 4–2. References for outcome data in HPV naive populations. ... 100 Table 4–3. Assessment of quality and risk of bias within randomized clinical trials of HPV vaccine efficacy against non-vaccine types. ... 100 Table 4–4. Rate of infection and CIN2+ cases in the control arm of FUTURE I/II and PATRICIA trials in HPV-naive populations (except where otherwise noted). ... 102 Table 5–1. Base case parameter values and sensitivity analyses ranges. ... 112
x
Liste des figures
Figure 1-1. Cadre conceptuel de l’association entre les facteurs sociodémographiques et socioéconomiques, les facteurs de risque comportementaux individuels, les facteurs de risque d’infection des partenaires sexuels
et les états de santé associés aux VPH. ... 34
Figure 1-2. Distribution des types de VPH détectés dans les CIN lors des essais cliniques et efficacité vaccinale estimée. ... 40
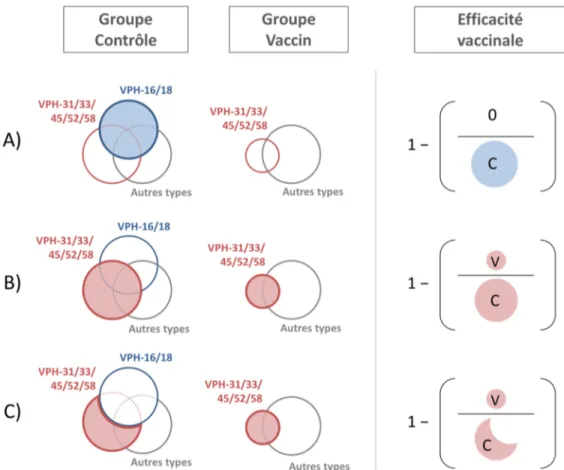
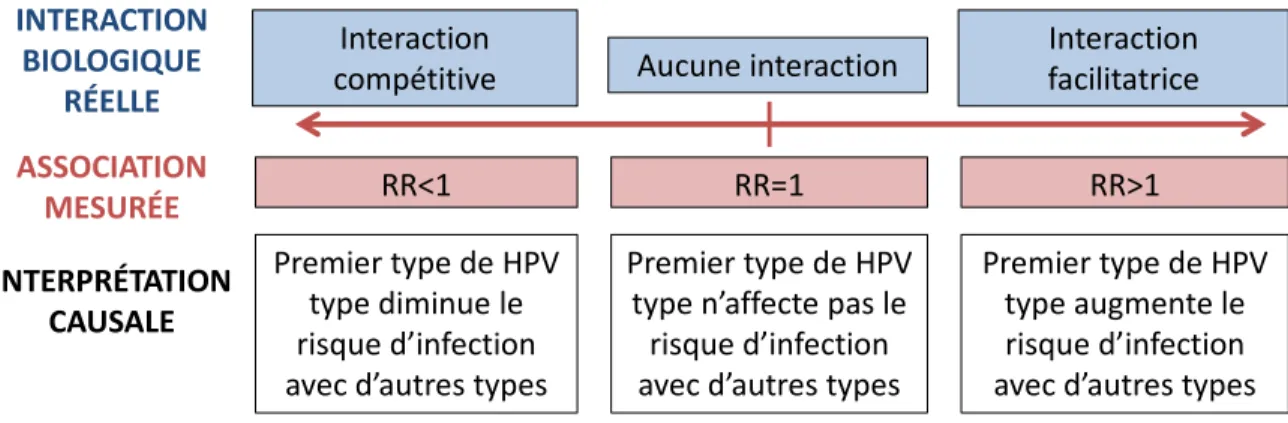
Figure 1-3. Cadre conceptuel de la relation entre l’interaction biologique réelle qui existe entre types de VPH, l’association mesurée dans une étude sans biais, et l’interprétation de cette association. ... 42
Figure 1-4. Exemple de corrélation entre le temps à risque d’infection avec un premier type de VPH (1) et le temps à risque d’infection avec un deuxième type de VPH (2). ... 43
Figure 1-5. Démarche pour identifier avec un modèle de transmission le biais causé par la corrélation entre le temps à risque d’infection avec un premier type de VPH (type 1) et le temps à risque d’infection avec un deuxième type de VPH (type 2). ... 44
Figure 2-1. Distribution of sexual activity levels and of HPV-16/18 prevalence per level of sexual activity in females before vaccination. ... 55
Figure 2-2. Impact of distribution of vaccine uptake on the population-level reduction in prevalence of HPV-16/18 following vaccination. ... 57
Figure 2-3. Relative change from pre-vaccination HPV-16/18 prevalence per sexual activity level in females following uniform vaccine uptake in all sexual activity levels. ... 59
Figure 2-4. Impact of different distributions of vaccine uptake on HPV-16/18 prevalence by sexual activity levels. ... 60
Figure 2-5. Ratio of % change reduction of HPV-16/18 prevalence in females at equilibrium. ... 64
Figure 3-1. Pre- and 70 years postvaccination SCC incidence rates by screening level. ... 73
Figure 3-2. Absolute difference between prevaccination and 70 years postvaccination SCC incidence rates by screening level. ... 74
Figure 3-3. Absolute difference between prevaccination and 70 years postvaccination SCC incidence rates with portion attributable to herd effects. ... 75
Figure 3-4. Pre- and postvaccination inequalities between screening behavior levels. ... 76
Figure 3-5. Screening history of SCC cases by time since last Pap test by age group. ... 81
Figure 3-6. Absolute and relative inequality 70 years post-vaccination. ... 82
Figure 3-7. Pre- and post-vaccination inequalities between screening behaviour levels with a quadrivalent and nonavalent vaccine at 50% vaccination coverage. ... 83
Figure 4-1. Study selection. ... 91
Figure 4-2. HPV vaccine efficacy against persistent infection (≥6 months) with individual non-vaccine type HPVs. ... 94
Figure 4-3. HPV vaccine efficacy against cervical intraepithelial neoplasia grade 2 or worse (CIN2+) detected with non-vaccine type HPVs, including and excluding lesions co-infected with HPV 16 or HPV 18. ... 95
Figure 4-4. Approaches used to determine the causal attribution of lesions with a high-risk (HR) non-vaccine type co-infected with HPV-16/18. ... 103
Figure 4-5. HPV vaccine efficacy against 6-month persistent infection with vaccine HPV types. ... 104
Figure 4-6. HPV vaccine efficacy against CIN2+ with any non-vaccine type tested by the trial, including and excluding lesions co-infected with HPV-16/18. ... 104
xi
Figure 5-2. Measures of association between HPV types 1 and 2 in absence of interactions. ... 115 Figure 5-3. Adjusted measures of association between HPV types 1 and 2 under different natural history parameter assumptions. ... 116 Figure 5-4. Sexual activity-level stratified measures of association between HPV types 1 and 2 under different sexual behavior parameter assumptions for A) the high sexual activity level and B) the low sexual activity level. ... 117 Figure 5-5. Estimated adjusted measures of association between HPV types 1 and 2 when we model
interactions. ... 118 Figure 5-6. Prevalence odds ratio of HPV-33 infection in HPV-16 infected vs. uninfected sexually active women in HPV-ADVISE, by age and sexual activity level. ... 122 Figure A1-1. Transitions rates between health states for a single HPV type i. ... 175 Figure A1-2 Flow diagram of health states. ... 175 Figure A1-3. Infection incidence rates for individuals susceptible to both HPV types 1 and 2 when their partner is A) only infected with HPV type 1, B) only infected with HPV type 2, and C) coinfected with both HPV types 1 and 2. ... 177
xii
Liste des abréviations et des sigles
ADN : Acide désoxyribonucléique
CIN : Néoplasie intra-cervicale (cervical intraepithelial neoplasia)
FUTURE : Females United to Unilaterally Reduce Endo/Ectocervical Disease
HIV : Virus de l’immunodéficience humaine (human immunodeficiency virus)
HPV : Virus du papillome humain (human papillomavirus)
HPV-ADVISE : HPV Agent-based Dynamic model for VaccInation and Screening Evaluation
HSV-2 : Virus de l’herpès de type 2 (herpes simplex virus 2)
IRR : Rapport de taux d’incidence (incidence rate ratio)
ITS : Infection transmise sexuellement
OR : Rapport de cotes de prévalence (prevalence odds ratio)
PATRICIA : Papilloma Trial Against Cancer In Young Adults
QUALY : Année-personne sans invalidité (quality-adjusted life years)
RR : Risque relatif
SCC : Carcinome malpighien du col de l’utérus (squamous cell carcinoma)
STI : Infection transmise sexuellement (sexually transmitted infection)
VIH : Virus de l’immunodéficience humaine
VLP : Pseudo-virions (virus-like particles)
xiii
Liste des publications
Malagón T, Lemieux-Mellouki P, Laprise JF, Brisson M. Bias due to correlation between the times at-risk for infections in epidemiological studies measuring biological interactions between STIs: case study using HPV type interactions. Am J Epi 2016 (Accepté)
Brisson M, Laprise JF, Chesson HW, Drolet M, Malagón T, Boily MC, Markowitz LE. Health and Economic Impact of Switching from a 4-Valent to a 9-Valent HPV Vaccination Program in the United States. J Natl Cancer Inst 2015;108(1). pii: djv282
Malagón T, Drolet M, Boily MC, Laprise JF, Brisson M. Changing inequalities in cervical cancer: modeling the impact of vaccine uptake, vaccine herd effects, and cervical cancer screening in the post-vaccination era. Cancer Epidemiol Biomarkers Prev 2015;24:276-85.
Laprise JF, Drolet M, Boily MC, Jit M, Sauvageau C, Franco EL, Lemieux-Mellouki P, Malagón T, Brisson M. Comparing the cost-effectiveness of two- and three-dose schedules of human papillomavirus vaccination: a transmission-dynamic modelling study. Vaccine 2014;32:5845-53.
Malagón T, Joumier V, Boily MC, Van de Velde N, Drolet M, Brisson M. The impact of differential uptake of HPV vaccine by sexual risks on health inequalities: A model-based analysis. Vaccine 2013;31:1740-7.
Brisson M, Drolet M, Malagón T. Inequalities in Human Papillomavirus (HPV)-associated cancers: implications for the success of HPV vaccination. J Natl Cancer Inst 2013;105:158-61.
Malagón T, Drolet M, Boily MC, et al. Cross-protective efficacy of two human papillomavirus vaccines: a systematic review and meta-analysis. Lancet Infect Dis 2012;12:781-9. Éditorial dans : The Lancet Infect Diseases 2012;12(10):742-3.
Van de Velde N, Boily MC, Drolet M, Franco EL, Mayrand MH, Kliewer EV, Coutlée F, Laprise JF, Malagón T, Brisson M. Population-level impact of the bivalent, quadrivalent, and nonavalent human papillomavirus vaccines: a model-based analysis. J Natl Cancer Inst 2012;104:1712-23. Éditorial dans : J Natl Cancer Inst 2012;104(22):1698-1701.
xiv
Liste des présentations et affiches
Présentations
Malagón T (présentateur), Drolet M, Laprise JF, Boily MC, Brisson M. Inequalities in cervical cancer: role of
vaccine herd immunity in protecting women with low screening participation. EUROGIN 2013, 3-6 novembre
2013, Florence, Italie.
Malagón T, Drolet M, Laprise JF, Boily MC, Brisson M. Évaluation de l'impact d'une association potentielle
entre la vaccination contre les VPH et la participation au dépistage du cancer du col de l'utérus sur l'efficacité populationnelle du vaccin et sur les inégalités. Conférence des étudiants de l’URESP, 2 avril 2013, Québec,
Canada.
Malagón T, Van de Velde N, Drolet M, Laprise JF, Boily MC, Brisson M (présentateur). Cross-protection: how
do we interpret trial data, and how important is it at a population-level? EUROGIN 2012, 8-11 juillet 2012,
Prague, République tchèque.
Brisson M (présentateur), Van de Velde N, Drolet M, Laprise JF, Malagón T, Boily MC. The impact of
vaccination on HPV-related diseases in men & women: a model-based analysis. EUROGIN 2012, 8-11 juillet
2012, Prague, République tchèque.
Malagón T (présentateur), Drolet M, Boily MC, Brisson M. Protection croisée des vaccins contre le virus du
papillome humain (VPH) : une revue systématique de la littérature. Journée annuelle de la recherche de la
Faculté de médecine, 31 mai 2012, Québec, Canada.
Malagón T (présentateur), Drolet M, Boily MC, Brisson M. Issues in comparing and interpreting clinical trial
measures of cross-protection. 27th International Papillomavirus Conference and Clinical Workshop, 17-22
septembre 2011, Berlin, Allemagne.
Van de Velde N (présentateur), Malagón T, Drolet M, Laprise JF, Boily MC, Brisson M. Modeling the
effectiveness of the bivalent, quadrivalent, and nonavalent vaccines. 27th International Papillomavirus
Conference and Clinical Workshop, 17-22 septembre 2011, Berlin, Allemagne.
Affiches
Malagón T, Boily MC, Drolet M, Brisson M. Mesures d’interactions entre virus du papillome humain (VPH) :
modélisation de l’impact des biais associés à l’hétérogénéité sexuelle et l’immunité. Journée scientifique du
xv
Malagón T, Drolet M, Brisson M. Mesurer les interactions entre les virus du papillome humain (VPH) dans les
études épidémiologiques: modélisation de l’impact des biais associés à l’activité sexuelle et la transmission simultanée des types. Journée de la Recherche des Étudiants (SP-POS), 5 mai, Québec 2014, Canada.
Malagón T, Van de Velde N, Laprise JF, Drolet M, Boily MC, Brisson M. Examining the potential
population-level impact of maldistribution of HPV vaccine by future screening participation. 28th International
Papillomavirus Conference, 30 novembre-6 décembre 2012, San Juan, Puerto Rico.
Romanowski B, Malagón T, Drolet M, Brisson M on behalf of the PATRICIA Study Group. End-of-study results
of PATRICIA: consistency of the HPV-16/18 AS04-adjuvanted vaccine efficacy (VE) from infection to CIN3+.
28th International Papillomavirus Conference, 30 novembre-6 décembre 2012, San Juan, Puerto Rico.
Brisson M, Van de Velde N, Malagón T, Laprise JF, Boily MC. Impact of cross-protection: from clinical trial
results to population-level effectiveness. 27th International Papillomavirus Conference and Clinical Workshop,
17-22 septembre 2011, Berlin, Allemagne.
Boily MC, Van de Velde N, Drolet M, Laprise JF, Malagón T, Brisson M. HPV vaccine programs : when can
we know we are reaching objectives? 27th International Papillomavirus Conference and Clinical Workshop,
xvi
Remerciements
J’aimerais remercier les personnes suivantes qui ont contribué à ce doctorat :
Mon directeur de recherche, Marc Brisson, pour ses conseils, son enthousiasme pour les idées stimulantes, son accessibilité, son engagement et sa perspicacité. Ses rétroactions constantes et son sens critique m’ont permis de beaucoup apprendre sur la recherche et l’écriture, et m’ont permis de produire des études dont je suis fière. Il a toujours cherché à promouvoir le développement de mes habiletés et ma carrière, et grâce à lui j’ai eu de nombreuses opportunités tout au long de mon doctorat qui m’ont aidée à évoluer en tant que scientifique, épidémiologiste et modélisatrice.
Mélanie Drolet, pour ses bons conseils, sa bienveillance et son expertise épidémiologique et méthodologique. Elle a toujours réussi à m’encourager et a grandement contribué à me donner un sentiment d’appartenance à l’équipe.
Jean-François Laprise, pour m’avoir aidée à commencer à utiliser HPV-ADVISE et les serveurs de calculs au début de mes recherches, et par la suite pour ses conseils judicieux et pour nos discussions qui me donnaient toujours matière à réflexion.
Marie-Claude Boily, pour m’avoir accueillie à Imperial College à Londres pour un séjour excitant et stimulant, et pour m’avoir encouragée à développer mes habilités en modélisation, ainsi que ses commentaires précieux sur mes travaux.
Élodie Bénard et Philippe Lemieux-Mellouki, pour leurs rétroactions sur cette thèse et les articles qui y sont insérés, ainsi que leur camaraderie.
Les IRSC et le CHU de Québec pour leur soutien financier, ainsi que Calcul Canada pour l’accès à leurs serveurs de calcul et à la formation en calcul informatique de pointe.
Mes parents, Rachel Desroches et Jaime Malagón, pour leur soutien émotionnel, leur écoute et leurs encouragements continuels.
Finalement, M. Marcel Ouellette, qui m’a enseigné le calcul différentiel il y a longtemps (même s’il disait que je ne l’utiliserais jamais) et qui m’a été d’une grande inspiration personnelle en tant qu’enseignant et francophone minoritaire.
xvii
Avant-propos
La présente thèse de doctorat répond à des questions de recherche originales, développées dans le cadre de l’élaboration de mon projet de thèse et issu des priorités de recherche du Dr. Marc Brisson. Ces travaux de recherche ont été subventionnés par des bourses de recherche des Instituts de recherche en santé du Canada (IRSC) et du CHU de Québec. Le corps de cette thèse est composé de quatre articles scientifiques, dont trois qui ont été publiés et un qui est en préparation pour la soumission. Ma contribution à l’élaboration de chaque article est détaillée ci-dessous.
Le premier article intitulé « The impact of differential uptake of HPV vaccine by sexual risks on health inequalities:
a model-based analysis. » a été publié dans Vaccine le 25 mars 2013. Je suis la première auteure de cet article,
avec Véronique Joumier, Marie-Claude Boily, Nicolas Van de Velde, Mélanie Drolet et Marc Brisson comme co-auteurs. Le modèle mathématique a été conçu et programmé par Nicolas Van de Velde, Marie-Claude Boily et Marc Brisson. Les simulations qui servent de base pour cet article avaient été effectuées par Véronique Joumier. Sous la direction de Marc Brisson et Mélanie Drolet, j’ai élaboré un plan d’analyse des résultats de simulations, interprété les résultats et rédigé la première version du manuscrit en tant que première auteure.
Le deuxième article intitulé « Changing Inequalities in Cervical Cancer: Modeling the Impact of Vaccine Uptake,
Vaccine Herd Effects, and Cervical Cancer Screening in the Post-Vaccination Era » a été publié dans Cancer Epidemiology, Biomarkers & Prevention le 24 janvier 2015. Je suis la première auteure de cet article, avec
Mélanie Drolet, Marie-Claude Boily, Jean-François Laprise et Marc Brisson comme co-auteurs. Le modèle mathématique a été conçu et programmé par Nicolas Van de Velde, Marie-Claude Boily et Marc Brisson. J’ai modifié le programme original afin d’obtenir des résultats stratifiés par niveau de dépistage et par âge et afin de valider les couvertures vaccinales stratifiées par niveau de dépistage. J’ai effectué les simulations qui servent de base pour cet article. Sous la direction de Marc Brisson et Mélanie Drolet, j’ai élaboré un plan d’analyse des résultats de simulations, interprété les résultats et rédigé la première version du manuscrit en tant que première auteure.
Le troisième article intitulé « Cross-protective efficacy of two human papillomavirus vaccines: a systematic
review and meta-analysis. » a été publié dans The Lancet Infectious Diseases en octobre 2012. Je suis la
première auteure de cet article, avec Mélanie Drolet, Marie-Claude Boily, Eduardo Franco, Mark Jit, Jacques Brisson et Marc Brisson comme co-auteurs. Le plan d’analyse a été élaboré par Marc Brisson, Mélanie Drolet et moi-même. J’ai effectué la revue systématique de la littérature et la méta-analyse des résultats. J’ai rédigé la première version du manuscrit en tant que première auteure.
xviii
Le quatrième article intitulé « Bias due to correlation between the times at-risk for infections in epidemiological studies measuring biological interactions between STIs: case study using HPV type interactions. » est accepté et sera publié dans le journal American Journal of Epidemiology. Je suis la première auteure de cet article, avec Jean-François Laprise, Philippe Lemieux-Mellouki et Marc Brisson comme co-auteurs. Marie-Claude Boily, Jacques Brisson et Eduardo Franco ont également fourni plusieurs rétroactions qui ont aidé à la rédaction. J’ai développé la question de recherche. J’ai programmé et validé les modèles qui ont servi à l’analyse, généré les simulations, et analysé et interprété les résultats. J’ai rédigé la première version du manuscrit en tant que première auteure, ainsi que rédigé la description du modèle.
Les numéros des tableaux et figures ainsi que l’ordre des références dans chaque article ont été modifiés afin de respecter leur ordre d’apparition dans cette thèse.
1
1 Introduction
1.1 Pertinence
Les virus du papillome humain (VPH) sont des infections transmises sexuellement (ITS) très prévalentes au Canada et ailleurs1-3. Avant la vaccination, on estimait que 80% des femmes seraient infectées avec un VPH
génital au cours de leur vie4. L’infection avec un VPH oncogène est une cause nécessaire du cancer du col de
l’utérus5 et est associée avec divers cancers anogénitaux, de la tête et du cou et les condylomes anogénitaux 6-9. Au Canada, le cancer du col de l’utérus est le troisième cancer le plus fréquent chez les femmes de 15-44
ans 10, et environ 1 450 nouveaux cas de cancer du col sont diagnostiqués chaque année11,12. Plusieurs types
de VPH oncogènes existent : 70% des cancers du col de l’utérus sont causés par les types VPH-16 et 18, 20% sont causés par les types VPH-31, 33, 45, 52 et 58, alors que les autres cas sont associés à d’autres types oncogènes de moindre importance13,14. Les types non-oncogènes VPH-6 et 11 causent la majorité des
condylomes anogénitaux9. Les coinfections avec plus d’un type de VPH sont fréquemment observées15-17. Il est
présentement incertain s’il existe des interactions biologiques entre les différents types de VPH affectant leur histoire naturelle d’infection.
Les facteurs de risque comportementaux les plus associés à l’infection par les VPH et à l’incidence du cancer du col de l’utérus sont respectivement l’activité sexuelle18 et une faible participation aux programmes de
dépistage du cancer du col19,20. L’hétérogénéité associée à ces comportements dans la population explique en
partie les inégalités dans le fardeau du cancer du col de l’utérus entre groupes sociodémographiques et socioéconomiques21-24. Les femmes de certaines minorités ethniques, ayant un faible niveau d’éducation et un
faible revenu présentent souvent plus de comportements sexuels qui augmentent le risque d’infection par les VPH25-27, se font moins dépister24,25,28-30, et ont conséquemment un plus grand fardeau d’infection et de
maladie21,31-33.
La vaccination des filles contre les VPH a été ajoutée aux calendriers de vaccination scolaire entre 2007-2009 au Canada34. Trois vaccins préventifs contre les VPH sont homologués au Canada : les vaccins bivalent
(CervarixMC), quadrivalent (GARDASIL®) et nonavalent (GARDASIL®9)35,36. Ceux-ci protègent respectivement
contre les VPH-16/18, les VPH-6/11/16/18 et les VPH-6/11/16/18/31/33/45/52/58. Présentement, le Québec utilise le vaccin quadrivalent pour la vaccination de routine des filles préadolescentes37. Tous les vaccins ont
montré, dans des essais cliniques chez des femmes, une efficacité vaccinale prophylactique très élevée (≥90%) contre l’incidence d’infections persistantes et des lésions précancéreuses cervicales associées à ces types de VPH38-40. Les vaccins bivalent et quadrivalent pourraient également offrir une efficacité croisée partielle contre
2
Quoique les programmes de vaccination aient le potentiel de réduire substantiellement le fardeau global des maladies associées aux VPH, leur succès dépendra de la couverture vaccinale globale et de la couverture chez les individus les plus à risque d’infection et de maladie (ceux qui ont une activité sexuelle plus élevée et qui participent moins au dépistage). Des études réalisées dans plusieurs contextes suggèrent que la couverture vaccinale est plus faible chez des minorités ethniques et des enfants de parents ayant un faible statut socioéconomique et ayant un faible niveau d’éducation30,42-44. Parce que ces populations sont souvent celles qui
présentent plus de facteurs de risque comportementaux, l’efficacité populationnelle de la vaccination pourrait être moins grande que prévue et les inégalités dans l’incidence d’infection et de cancers associés aux VPH pourraient potentiellement augmenter. La vaccination peut accorder une protection indirecte aux individus non-vaccinés à travers l’immunité de groupe, mais celle-ci dépend des réseaux de contacts sexuels entre individus vaccinés et non-vaccinés45. L’effet de la vaccination sur des populations ayant différents facteurs de risque
comportementaux reste donc incertain.
L’effet qu’aura la vaccination sur les types de VPH non-inclus dans le vaccin (types non-vaccinaux) demeure également incertain. Si des interactions compétitives existent entre les VPH, la réduction de la prévalence des types de VPH vaccinaux pourrait mener à une augmentation de la prévalence des types de VPH non-vaccinaux oncogènes, réduisant ainsi l’efficacité populationnelle de la vaccination46,47. Cet effet pourrait être mitigé par
l’efficacité croisée des vaccins46,48. Pour prédire l’impact de la vaccination sur les types de VPH non-vaccinaux,
il est donc nécessaire d’avoir des données sur l’efficacité croisée vaccinale et sur les interactions entre les types de VPH. Les études épidémiologiques mesurant l’efficacité croisée vaccinale et les interactions biologiques entre des VPH souffrent cependant de nombreux biais qui ont fait l’objet de plusieurs critiques17,41,49-51.
L’importance de ces biais n’a jamais été adéquatement analysée, donc la validité des mesures d’efficacité croisée vaccinale et d’interactions biologiques demeure incertaine.
Les modèles de transmission dynamique sont particulièrement bien adaptés pour évaluer l’efficacité populationnelle (effectiveness) potentielle des interventions contre des agents infectieux, car ils peuvent intégrer les effets non-linéaires produits par la transmission. L’efficacité populationnelle à long terme de la vaccination demeure encore inconnue en raison des longs intervalles entre la vaccination, la prévention de l’infection et la progression vers le cancer. Les modèles de transmission dynamique peuvent reproduire les dynamiques d’infection des VPH, l’histoire naturelle complexe des maladies associées et les effets directs et indirects des programmes de vaccination52. Les études de modélisation ont généralement conclu que la vaccination des filles
préadolescentes contre les VPH devrait substantiellement réduire les infections avec les VPH-16 et 18 et les cancers du col associés53,54, et que celle-ci est une intervention coût-efficace selon les seuils acceptés54,55.
Cependant, au moment d’entamer ce doctorat peu d’études de modélisation incorporaient suffisamment d’hétérogénéité comportementale et biologique dans leur structure pour évaluer les effets directs et indirects
3
d’une couverture vaccinale inégale entre des individus ayant différents facteurs de risque comportementaux, et les effets des interactions biologiques et de l’efficacité croisée vaccinale sur les types de VPH non-vaccinaux.
La présente thèse de doctorat s’intéresse à l’impact de cette hétérogénéité comportementale entre individus et cette hétérogénéité biologique entre les VPH sur l’efficacité populationnelle de la vaccination contre les VPH. L’hétérogénéité comportementale entre individus affectera l’efficacité populationnelle de la vaccination, parce que celle-ci dépend de la protection directe et indirecte accordée par la vaccination aux individus qui sont le plus à risque d’infection et de cancer. Le premier objectif sera donc de modéliser comment une couverture vaccinale différente par niveaux d’activité sexuelle et par niveaux de participation au dépistage affectera l’efficacité populationnelle de la vaccination, et comment elle modifiera les inégalités dans la prévalence d’infection des VPH et l’incidence du cancer du col de l’utérus. L’hétérogénéité biologique des VPH pourrait affecter l’efficacité populationnelle de la vaccination, parce que le vaccin pourrait avoir des effets indirects sur l’écologie des VPH s’il y a une efficacité croisée vaccinale et des interactions biologiques. Cependant, les études épidémiologiques étudiant ces deux phénomènes présentent des résultats hétérogènes et souffrent de plusieurs biais. Le deuxième objectif sera donc de faire une synthèse des estimés d’efficacité croisée vaccinale et d’identifier les sources d’hétérogénéité entre ces estimés. Le troisième objectif sera d’évaluer, avec la modélisation, les biais affectant l’estimation des interactions biologiques entre les VPH dans différents devis d’études épidémiologiques.
1.2 État des connaissances
1.2.1 Épidémiologie des VPH et des maladies associées
1.2.1.1 Histoire naturelle de l’infection par les VPH
Plus d’une quarantaine de types de VPH peuvent infecter la région anogénitale56. Les VPH génitaux sont
hautement transmissibles57,58, et leur prévalence mondiale (tous types confondus) chez les femmes est
d’environ 10-12%3,59. Au Canada, la prévalence des VPH oncogènes est de 12% chez les femmes de 15-69
ans1. La prévalence d’infection avec les VPH est généralement plus élevée (24-45%) chez les femmes de
20-24 ans, et diminue généralement par la suite avec l’âge1,31,34,60-62. La majorité des infections incidentes
disparaissent dans les 12 mois suivant l’apparition de l’infection63,64, mais une faible proportion peut persister
pendant plusieurs années et éventuellement progresser vers un des cancers associés aux VPH5.
La réduction de l’incidence d’infection avec l’âge est due en partie à la diminution de l’acquisition de nouveaux partenaires sexuels avec l’âge65, mais est potentiellement également due au traitement des lésions cervicales66
et à l’acquisition d’une certaine immunité naturelle à la suite de l’infection58,65,67,68. On connaît encore mal les
4
développent une réponse immunitaire qui réduit le risque de réinfection. Jusqu’à 70% des femmes et 15% des hommes développent des anticorps contre les protéines L1 de la capside virale des VPH à la suite d’une infection71,72. Les femmes qui développent des anticorps ont un taux de réinfection avec le même type de VPH
plus faible que les femmes qui n’ont pas ces anticorps73-75. Ces anticorps sont majoritairement spécifiques à
chaque type de VPH76,77, mais une certaine réactivité croisée à d’autres types apparentés a été montrée in
vitro77-79. Ceci suggère que l’immunité naturelle développée à la suite d’une infection avec un type de VPH
pourrait non seulement prévenir la réinfection avec le même type, mais également fournir une protection contre l’infection avec d’autres types apparentés, un phénomène surnommé l’immunité croisée naturelle.
La prévalence des VPH est plus élevée chez certaines minorités ethniques30,31,80-83, les individus avec un faible
statut socioéconomique30,31,80-82,84,85, avec un faible niveau d’éducation31,82,84,85 et résidant dans des régions à
faible revenu86,87 (Tableau 1–1). Aux États-Unis, les femmes noires de 14-59 ans ont une prévalence d’infection
avec les VPH de 39% alors que les femmes blanches ont une prévalence d’infection de 24%, et les femmes vivant sous le seuil de la pauvreté ont une prévalence d’infection de 38% alors que celles vivant au-dessus ont une prévalence de 24%31. Au Manitoba, les femmes autochtones de ≥30 ans ont une cote d’infection prévalente
3.3 fois plus élevée que les femmes blanches du même âge83.
1.2.1.2 Maladies associées aux VPH
L’infection avec un type de VPH oncogène est une cause nécessaire du cancer du col de l’utérus5,88, et est
associée à divers cancers anogénitaux (vulve, vagin, pénis, anus) et cancers de la tête et du cou5-8. Quinze
types de VPH (VPH-16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 et 82) ont été classifiés comme étant des types à haut risque (HR) oncogène, les autres étant considérés comme des types potentiellement oncogènes (VPH-26, 53 et 66) ou à bas risque oncogène89. Les types VPH-16 et 18 causent environ 70% des
cancers du col de l’utérus13,14. Les types VPH-31, 33, 35, 45, 52 et 58 causent environ un 20% additionnel des
cancers du col de l’utérus13. Les autres cancers anogénitaux et de la tête et du cou VPH-positifs sont
majoritairement associés aux types VPH-16 et 186-8. Les proportions des cancers de la vulve, du vagin, du pénis,
de l’anus et de l’oropharynx détectés avec un VPH sont respectivement de 69%, 75%, 63%, 89-93% et 63-7%90.
Les types de VPH à bas risque oncogène sont responsables des condylomes anogénitaux, dont 86% sont causés par les types VPH-6 et 119.
En 2008, 610 000 nouveaux cas de cancer ont été attribués aux VPH mondialement, dont 530 000 cancers du col de l’utérus91. Le cancer du col de l’utérus a le taux d’incidence le troisième plus élevé et le taux de mortalité
le quatrième plus élevé des cancers féminins mondialement92. Les taux d’incidence et de mortalité associés au
cancer du col de l’utérus sont plus élevés dans les pays à faible revenu que dans les pays à revenu élevé, en grande partie à cause de l’absence de programmes de dépistage92,93. Au Canada, environ 1 450 nouveaux cas
5
de cancer du col sont diagnostiqués chaque année12. Le taux d’incidence du cancer du col ajusté pour l’âge est
de 7/100 000 femmes-années et est au douzième rang des cancers féminins12. Les taux d’incidence du cancer
du col au Canada par groupe d’âge sont de 4/100 000 personnes-années chez les femmes de 20-29 ans, de 14/100 000 personnes-années chez les femmes de 30-49 ans et de 11/100 000 personnes-années chez les femmes de 50 ans et plus94. Les taux d’incidence des cancers de l’oropharynx, de l’anus, des organes génitaux
féminins et du pénis ajustés pour l’âge étaient respectivement de 0.4, 1.3, 3.6 et 0.7/100 000 personnes-années au Canada en 200795.
Les taux d’incidence et de mortalité du cancer du col de l’utérus sont plus élevés chez les minorités ethniques 96-99, les individus à faible statut socioéconomique100,101, faible niveau d’éducation23,24,33,101,102 et vivant dans des
régions à faible statut socioéconomique10,23,33,97,103,104 (Tableau 1–1). Par exemple, aux États-Unis le taux
d’incidence du cancer du col de l’utérus est plus élevé chez les femmes noires que chez les femmes blanches (14.4 vs. 9.5/100 000 femmes-années), et plus élevé dans des régions où une forte proportion d’individus vivent sous le seuil de la pauvreté que dans les régions plus riches (12.4 vs. 8.4/100 000 femmes-années)97. Au
Canada, les femmes des Premières Nations ont un taux d’incidence du cancer du col et un taux de mortalité du cancer du col 1.73 et 2.03 fois plus élevés que la population générale98. Au Québec, les femmes dans le dernier
quintile de défavorisation matérielle ont un taux de mortalité du cancer du col de l’utérus 1.72 fois plus élevé que les femmes dans le premier quintile105.
1.2.2 Comportements associés au risque du cancer du col de l’utérus
1.2.2.1 Vaccination contre les VPH
1.2.2.1.1 Efficacité vaccinale
Trois vaccins contre les VPH, Gardasil®, CervarixMC et Gardasil®9, ont été homologués au Canada en 2006,
2010 et 2015, respectivement36,106. Ces vaccins contiennent des pseudo-virions (virus-like particles ou VLP),
soit des capsides de virus reconstituées sans le génome à partir de protéines virales L1. La protéine virale L1 est spécifique à chaque type de VPH107. Le vaccin bivalent CervarixMC contient les protéines L1 des VPH-16 et
18108. Le vaccin quadrivalent Gardasil® contient les protéines L1 des VPH-6, 11, 16 et 18109, et le vaccin
nonavalent Gardasil®9 rajoute à celles-ci les protéines L1 des VPH-31, 33, 45, 52 et 5840. Tous les vaccins
suscitent de fortes réponses immunogènes contre leurs types de VPH respectifs, qui sont fortement supérieures aux réponses immunogènes suscitées par des infections naturelles40,107,110,111. Des essais cliniques randomisés
dans des populations de jeunes femmes susceptibles à l’infection ont démontré des efficacités vaccinales prophylactiques supérieures à 90% contre l’incidence des infections persistantes avec ces types de VPH vaccinaux40,109,112, et de près de 100% contre l’incidence des lésions précancéreuses cervicales infectées avec
6
Les essais cliniques suggèrent également que les vaccins induisent une certaine efficacité contre d’autres types de VPH non-vaccinaux41,113-115, un phénomène surnommé l’efficacité croisée vaccinale. Ces estimés d’efficacité
croisée vaccinale contre des types de VPH non-vaccinaux sont cependant plus faibles et plus variables entre essais cliniques que les estimés d’efficacité contre les types vaccinaux. L’efficacité croisée vaccinale pourrait être induite par la similarité entre les protéines L1 de certains types de VPH phylogénétiquement rapprochés107,116. Des études d’immunogénicité ont révélé que la vaccination génère des anticorps pouvant
neutraliser certains types de VPH apparentés aux types vaccinaux78,117-120. Les titres d’anticorps générés contre
des types de VPH non-vaccinaux sont beaucoup moins élevés que les titres d’anticorps générés contre les types de VPH vaccinaux117,120. Le vaccin bivalent génère des titres d’anticorps contre les types non-vaccinaux
plus élevés que le vaccin quadrivalent119,121. Les titres d’anticorps contre les types non-vaccinaux sont
également moins élevés chez les individus qui reçoivent moins de trois doses du vaccin (uniquement une dose du vaccin ou uniquement deux doses espacées de 1-2 mois)120,122. Il est donc possible que l’efficacité croisée
vaccinale diffère par vaccin, et que celle-ci dépende du nombre de doses reçues.
1.2.2.1.2 Durée de protection vaccinale
La durée de la protection vaccinale reste inconnue. Les essais cliniques avec les plus longues durées montrent que l’efficacité demeure élevée contre l’infection et les lésions avec les types de VPH vaccinaux jusqu’à au moins 4-5 ans pour les vaccins quadrivalent et nonavalent et jusqu’à au moins 9 ans pour le vaccin bivalent40,109,123. Les titres d’anticorps contre les types de VPH vaccinaux demeurent également très élevés lors
des années suivant la vaccination40,124. Ceci suggère que la protection vaccinale sera de longue durée125.
La durée de l’efficacité croisée des vaccins bivalent et quadrivalent est toutefois beaucoup moins certaine. Les titres d’anticorps contre les types de VPH non-vaccinaux déclinent sous le seuil de la détection ou aux niveaux attendus à la suite d’une infection naturelle dans les deux années suivant la vaccination126. Toutefois, le niveau
d’anticorps nécessaire afin de prévenir l’infection avec un VPH demeure inconnu73,127-129. Des études in vitro
suggèrent qu’un niveau très faible d’anticorps pourrait être suffisant pour neutraliser les virions et prévenir une infection127,130. Le déclin des titres d’anticorps avec les années n’indique donc pas forcément le déclin de la
protection vaccinale.
1.2.2.1.3 Programmes de vaccination
En 2012, 51 pays avaient introduit un programme de vaccination contre les VPH, soit 45 pays à revenu élevé et 6 à revenu faible ou moyen131-133. Tous les programmes de vaccination ciblent les filles pré-adolescentes, dans
le but de les protéger avant le début de l’activité sexuelle132,133. L’Australie et les États-Unis ont récemment
également ajouté la vaccination des garçons à leur programme134,135. Le vaccin utilisé, les caractéristiques des
7
des pays ont choisi le vaccin quadrivalent pour leur programme132. Le Royaume-Uni avait commencé
initialement un programme national avec le vaccin bivalent, mais utilise désormais depuis 2012 le vaccin quadrivalent132. Les Pays-Bas et certaines régions d’Espagne utilisent le vaccin bivalent136,137. Quelques pays
dont la Suisse, le Danemark, les Pays-Bas, le Mexique et le Royaume-Uni ont récemment opté pour un calendrier de vaccination à deux doses plutôt que les trois doses recommandées138. Ces décisions ont été
premièrement supportées par des études suggérant que l’immunogenicité des vaccins chez des filles de 9-13 ans vaccinées avec deux doses espacées de 6 mois était non-inférieure à celle chez des femmes vaccinées avec 3 doses139 et que deux doses étaient suffisantes pour induire une mémoire immunitaire140, puis
subséquemment par des données suggérant que l’efficacité vaccinale contre les infections VPH-16/18 avec deux doses semble non-inférieure à l’efficacité avec trois doses141 et par des études de modélisation
mathématique évaluant l’impact potentiel de deux par rapport à trois doses138. La couverture vaccinale dans les
pays à revenu élevé varie de <50% à 90%132.
La vaccination des filles contre les VPH a été ajoutée aux calendriers de vaccination scolaire des provinces et territoires canadiens entre 2007-2009142. Les programmes de vaccination scolaire canadiens utilisent le vaccin
quadrivalent143-152. L’année scolaire à la vaccination varie entre la quatrième et la huitième année scolaire35,142.
Le Québec vaccine les filles en 4ème année de primaire143. L’Île du Prince Édouard (IPE), l’Alberta, la
Nouvelle-Écosse, le Manitoba et le Québec ont également ajouté la vaccination des garçons préadolescents aux calendriers de vaccination scolaire en 2013, 2014, 2015, 2016 et 2016, respectivement144,145,153,154. La majorité
des provinces administrent trois doses du vaccin35, mais le Québec et la Colombie-Britannique utilisent
respectivement depuis 2013 et 2014 un calendrier de vaccination à deux doses143,146. Quoique le Québec ait
initialement recommandé un calendrier allongé de vaccination à trois doses (0, 6, 60 mois) en 2008, la troisième dose n’a effectivement jamais été administrée en raison de la recommandation de ne conserver que les 2 premières doses du calendrier en 2013. La proportion de filles qui complètent leur série de vaccins varie grandement entre les provinces et territoires canadiens: selon des données datant de 2013, par ordre de couverture croissante on trouve le Manitoba (43%), les Territoires du Nord-Ouest (47%), l’Alberta (61%), la Colombie-Britannique (66%), le Yukon (67%), l’Ontario (70%), la Saskatchewan (73%), le Nouveau-Brunswick (76%), la Nouvelle Écosse (76%), le Québec (77%), l’Île du Prince Édouard (85%) et Terre-Neuve (91%)155-157.
1.2.2.1.4 Facteurs associés à la vaccination
Les facteurs associés à l’initiation et la complétion de la série de vaccins varient d’un système de santé à l’autre. Dépendamment du contexte, l’initiation et la complétion de la vaccination peuvent être plus faibles chez certaines minorités ethniques30,44,158-160, les immigrants161, et chez les enfants de parents à faible niveau
d’éducation162, faible revenu162 ou d’autres marqueurs de faible statut socioéconomique30,44,161,163-165 (Tableau
8
des cliniques ou par des médecins (ex. Pays-Bas, États-Unis)44,161,162,164. Au début du programme de vaccination
des États-Unis, l’initiation de la vaccination était fortement associée à la détention d’une police d’assurance et le revenu43,162,166. Cependant, un programme de remboursement du vaccin chez les enfants non-assurés et
autochtones (Vaccines for Children) a contribué à augmenter l’initiation de la vaccination chez les adolescentes de 13-17 ans sous le seuil de la pauvreté (67%) et chez les autochtones (73%), qui est présentement plus élevée que chez les adolescentes au-dessus du seuil de pauvreté (55%) et d’autres ethnicités (53-68%)167.
Inversement, aux Pays-Bas 63% des filles résidant dans un quartier de niveau socioéconomique élevé avaient initié la vaccination, par rapport à 53% de celles résidant dans un quartier de niveau socioéconomique faible44.
Dans les systèmes de santé avec vaccination scolaire (ex. Canada, Royaume-Uni), les inégalités dans la participation sont plus souvent associées à la non-complétion de la série de trois doses du vaccin plutôt que l’initiation42,158,160,168,169. Au Royaume-Uni, 85% des adolescentes de race blanche ont reçu les 3 doses du vaccin
par rapport à 69% des adolescentes de race noire158. En Ontario, 76% des filles qui habitent les quartiers dans
le dernier quintile de revenu ont complété leur série de 3 vaccins, par rapport à 89% des filles qui habitent les quartiers dans le premier quintile de revenu42. Au Québec, la couverture vaccinale en 4ième année du primaire
avec 2 doses du vaccin est de 67% dans les régions sociosanitaires où ≥20% des individus sont des immigrants, comparé à 84% dans les régions sociosanitaires où <5% des individus sont des immigrants170.
1.2.2.2 Dépistage du cancer du col
Le dépistage du cancer du col de l’utérus permet de détecter les lésions précancéreuses afin de les traiter avant leur progression vers le cancer171. Présentement au Canada, le dépistage est généralement effectué par un
examen cytologique (test Pap) du col de l’utérus94. La détection de cellules anormales à la suite d’un examen
cytologique mène à une colposcopie et/ou une biopsie. Le traitement est indiqué dans le cas d’un diagnostic de lésions précancéreuses de haut grade (néoplasies intra-cervicales (CIN) de grade 2/3) ou de cancer lors de la colposcopie/biopsie94,171.
1.2.2.2.1 Efficacité du dépistage
La participation fréquente (intervalles de 1 à 3 ans) au dépistage du cancer du col constitue un facteur protecteur important contre le cancer du col, surtout les carcinomes malpighien du col de l’utérus (squamous cell
carcinoma, SCC)19,20,171-173. Il est estimé qu’un dépistage très fréquent (intervalle de 1-2 ans) réduit le risque de
cancer du col de l’utérus de 96%173. Environ 50% des cancers du col de l’utérus au Canada sont diagnostiqués
chez des femmes dont le dernier test cytologique remonte à plus de cinq ans ou qui n’ont jamais été dépistées174.
Les études évaluent souvent uniquement la non-participation au dépistage dans un intervalle donné comme facteur de risque, et ne distinguent pas entre les femmes ayant déjà été dépistées, mais depuis un intervalle plus grand que celui recommandé, et les femmes n’ayant jamais été dépistées. Cependant, même les femmes
9
ayant de longs intervalles entre dépistages ont un risque moins élevé de cancer du col que les femmes n’ayant jamais été dépistées19,173,175. Comparées aux femmes avec un intervalle de dépistage de <3.5 ans, le taux
d’incidence du cancer du col est 2.2 fois plus élevé chez les femmes ayant un intervalle de 3.5-5.5. ans, et 5.6 fois plus élevé chez les femmes n’ayant jamais été dépistées19.
1.2.2.2.2 Programme de dépistage
Au Canada, le dépistage du cancer du col a fait ses débuts en 1949 en Colombie Britannique176,177. Avant 2012,
les lignes directrices canadiennes recommandaient un dépistage par examen cytologique pour les femmes de 18-69 ans à des intervalles annuels jusqu’à l’obtention de deux tests normaux, suite à quoi la fréquence de dépistage serait aux trois ans171. Depuis 2012, les lignes directrices déconseillent le dépistage par examen
cytologique pour les femmes de <25 ans et l’intervalle recommandé pour les 25-69 ans est de trois ans171. Ces
changements sont attribuables au manque d’évidence quant à l’efficacité du dépistage chez les femmes plus jeunes171,178-180 et aux évidences suggérant qu’un intervalle de cinq ans ou moins accorde une protection
substantielle contre le cancer19,20,181.
La couverture du programme de dépistage (aussi appelé le « taux » de participation au dépistage) signifie la proportion de femmes ciblées par le programme ayant eu un test cytologique dans l’intervalle recommandé (soit les trois dernières années au Canada)94,182. Au Canada, 72-80% des femmes de 20-69 ans ont eu un test Pap
dans les trois dernières années94. Cette proportion ne varie pas substantiellement selon l’âge lorsqu’on corrige
pour les hystérectomies94,174. Onze pourcent des femmes canadiennes de 18-69 ans déclarent n’avoir jamais
eu un test Pap183.
1.2.2.2.3 Impact du dépistage
Les taux d’incidence et de mortalité du cancer du col de l’utérus sont en déclin depuis plusieurs décennies dans les pays développés93,97,184,185 et au Canada177,178,186. Au Canada, les taux d’incidence de cancer du col ajustés
pour l’âge ont diminué de 58% entre 1972-2006 (de 22.3 à 9.4/100 000 femmes-années) et les taux de mortalité ajustés pour l’âge ont diminué de 83% entre 1952-2006 (de 7.7 à 2.2/100 000 femmes-années)178. Les déclins
dans les pays développés coïncident avec l’augmentation du nombre de tests effectués et de la proportion de femmes dépistées selon les intervalles recommandés93,178,186-188. Cette réduction reflète en grande partie la
diminution de l’incidence des SCC, qui constituent la majorité (70%) des cancers du col174,186,189-191. Les taux
d’incidence de SCC ajustés pour l’âge ont diminué de 51% entre 1970-1996 au Canada, passant de 13.4 à 6.7/100 000 femmes-années191. Les adénocarcinomes du col de l’utérus sont moins bien prévenus par le
dépistage avec des tests cytologiques189,192, et leur taux d’incidence augmente dans plusieurs pays186,190,193. Le
taux d’incidence des adénocarcinomes ajusté pour l’âge a augmenté de 41% au Canada entre 1970-1996 (de 1.3 à 1.8/100 000 femmes années)191. Des études d’âge-cohorte-période suggèrent que 1) le risque de SCC
10
diminue avec les années calendaires (la période), et que cet effet serait attribuable à l’introduction des programmes dépistage et 2) les risques des SCC, d’adénocarcinomes et d’autres cancers associés aux VPH sont plus grands pour les cohortes nées à partir des années 1940, potentiellement à cause d’une augmentation de l’activité sexuelle et/ou d’autres facteurs de risque184,194-196. Il est donc probable que, sans dépistage, les taux
d’incidence du cancer du col de l’utérus auraient été en augmentation dans plusieurs pays développés et comparables aux taux mesurés dans les pays sans programme de dépistage (60 à 100/100 000 femmes-années)194. Cette hypothèse est supportée par l’augmentation également observée dans les taux d’incidence
des cancers de l’anus et de l’oropharynx standardisés pour l’âge depuis les années 1970197,198.
1.2.2.2.4 Facteurs associés à la participation au dépistage
La participation différentielle au dépistage est un facteur important contribuant aux inégalités observées d’incidence et de mortalité du cancer du col de l’utérus21,23,24. La non-participation au dépistage du cancer du
col est généralement plus élevée chez certaines minorités ethniques21,25,30,199,200, les immigrantes25, les femmes
à faible revenu ou sans assurance25,30,199-202 et les femmes ayant un faible niveau d’éducation21,24,25,30,199-204
(Tableau 1–1). Par exemple, aux États-Unis, 24% des femmes avec un revenu familial de <15 000$ déclarent ne pas avoir eu un test Pap dans les 3 années précédentes, par rapport à 9% des femmes avec un revenu familial de ≥50 000$202. Dans la plupart de ces études, on a uniquement évalué la proportion des femmes qui
n’ont pas été dépistée dans un intervalle donné. Cette définition de la non-participation ne permet pas de distinguer les femmes pour qui le dernier dépistage remonte à plus longtemps que l’intervalle évalué, et les femmes qui n’ont jamais été dépistées. Cependant, les facteurs associés à un intervalle plus long depuis le dernier dépistage et les facteurs associés à ne jamais avoir été dépistée sont parfois différents25. Au Canada,
21% des femmes immigrantes n’ont jamais eu de test Pap par rapport à 5% des femmes nées au Canada, mais une fois le dépistage entamé, la proportion de femmes dont le dernier dépistage remonte à plus de 3 ans est similaire dans les deux groupes (9 et 10% de femmes immigrantes et nées au Canada parmi celles ayant déjà été dépistées, respectivement)25.
Les différences dans la participation au dépistage sont généralement attribuées à des barrières d’accès aux soins de santé et des différences dans l’adoption de comportements axés sur la santé23,202. Au Canada, le
financement public du dépistage au début des années 1970 a été associé à une réduction de l’inégalité relative et absolue du taux de mortalité entre le premier et le dernier quintile de revenu : le rapport de taux de mortalité est passé de 2.7 à 1.7 et la différence absolue de taux de mortalité est passée de 4.6 à 1.1/100 000 femmes-années entre 1971-199610. Cependant, malgré les réductions substantielles dans les taux d’incidence et de
mortalité du cancer du col observées depuis l’implantation de programmes de dépistage, des différences absolues et relatives dans les taux d’incidence et de mortalité persistent encore entre populations sociodémographiques10,33,100,205.
11
1.2.2.3 Comportements sexuels et caractéristiques des réseaux sexuels (mixing
sexuel)
1.2.2.3.1 Facteurs de risque d’activité sexuelle de l’individu
Avoir déjà eu des relations sexuelles, le nombre de partenaires à vie et le nombre de partenaires récents constituent les marqueurs d’activité sexuelle individuels qui sont le plus associés à l’infection prévalente et incidente avec les VPH34,80,87,206-214. Les femmes ayant eu ≥2 partenaires dans la dernière année ont une cote
d’infection prévalente 6.2 fois plus grande que les femmes ayant eu ≤1 partenaire208. Au Canada, les femmes
rapportant >3 partenaires à vie ont une prévalence d’infection avec un VPH oncogénique de 19%, alors que les femmes rapportant ≤3 partenaires à vie ont une prévalence d’infection de 7%34. Les femmes ayant initié l’activité
sexuelle à ≤15 ans ont une cote d’infection prévalente 2.6 plus grande que les femmes ayant initié l’activité sexuelle à ≥20 ans34, mais l’association dans cette étude n’était plus significative une fois ajustée pour d’autres
marqueurs d’activité sexuelle. En effet, l’âge d’initiation de l’activité sexuelle est fortement associé au nombre de partenaires à vie et à d’autres facteurs de risque d’activité sexuelle215-217. L’activité sexuelle est également
associée à une augmentation du risque de cancers associés aux VPH18,218. Le risque de cancer du col est 2.8
fois plus élevé chez les femmes ayant eu ≥6 partenaires sexuels à vie que chez les femmes ayant eu 1 partenaire sexuel à vie18.
1.2.2.3.2 Facteurs de risque d’infection des partenaires et des réseaux sexuels
(mixing)
Les marqueurs individuels d’activité sexuelle ci-dessus sont associés au risque d’infection car ils augmentent le risque d’être exposé à un partenaire infecté avec un VPH, la cause nécessaire de l’infection. Cependant, la probabilité qu’un individu soit exposé à un partenaire infecté dépend également des facteurs de risque d’infection de ses partenaires214,219. Les femmes qui ont un partenaire masculin ayant eu >10 partenaires à vie
ont une cote d’infection incidente 11 fois plus grande que les femmes qui ont un partenaire masculin ayant eu un seul partenaire à vie214. Cette relation demeure significative après l’ajustement pour les comportements
sexuels de la femme. Également, les femmes initiant leur première relation sexuelle avec un partenaire beaucoup plus âgé (≥10 ans) ont une cote d’infection incidente 5.6 fois plus grand que les femmes initiant leur activité sexuelle avec des partenaires plus rapprochés en âge (≤4 ans)212. Deux individus ayant le même
comportement sexuel peuvent donc avoir différents niveaux d’exposition à l’infection selon les caractéristiques de leurs partenaires. Les marqueurs individuels d’activité sexuelle sont donc des marqueurs imparfaits de la réelle exposition à l’infection51,220. Les caractéristiques des partenaires, potentiellement plus importantes, sont