Université de Sherbrooke
Coordination antéropostérieure pendant la locomotion chez le chat adulte intact et suite à une lésion partielle de la moelle épinière
Par Yann Thibaudier Programme de Physiologie
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de philosophiae doctor (Ph.D.)
en Physiologie
Sherbrooke, Québec, Canada Janvier, 2016
Membres du jury d’évaluation Alain Frigon, Programme de physiologie Ahmed Chraibi, Programme de physiologie
Nathaly Gaudreault, École de réadaptation
Trevor Drew, Département de neurosciences, Faculté de Médecine, Université de Montréal
“It always seems impossible until it's done.” ― Nelson Mandela
1
R
ÉSUMÉCoordination antéropostérieure pendant la locomotion chez le chat adulte intact et suite à une lésion partielle de la moelle épinière
Par Yann Thibaudier Programme de Physiologie
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du diplôme de philosophiae doctor (Ph.D.) en Physiologie, Faculté de médecine et des sciences de la santé, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4 Une coordination appropriée entre les pattes antérieures et postérieures chez les mammifères terrestres est essentielle pour maintenir une stabilité pendant la locomotion quadrupède. Il a été fortement suggéré que les voies propriospinales et le retour sensoriel pourraient jouer un rôle important dans la coordination antéropostérieure. Cependant, les mécanismes neurophysiologiques impliqués dans la coordination entre les membres antérieurs et les membres postérieurs pendant la marche demeurent méconnus. Suite à une lésion partielle de la moelle épinière, plusieurs déficits de la coordination antéropostérieure ont pu être dénotés chez l’animal non-humain et chez l’humain. Malgré tout, les effets d’une lésion partielle sur la coordination antéropostérieure n’ont pas encore été clairement caractérisés. Au regard du nombre considérable de blessés médullaires présentant des troubles de l’équilibre et de la coordination entre les bras et les jambes après avoir récupéré la marche, il semble essentiel de mieux comprendre ces mécanismes. L’objectif du projet était d’offrir une meilleure caractérisation de la coordination antéropostérieure chez le chat intact et suite à une hémisection latérale de la moelle épinière. Pour ce faire, un tapis roulant partitionné transverse permettant de dissocier les vitesses de locomotion entre les pattes antérieures et postérieures a été utilisé. Huit chats implantés chroniquement pour réaliser des enregistrements électromyographiques ont été entrainés dans diverses conditions de locomotion partitionnée et non-partitionnée. Parmi ces 8 chats, 6 ont subi une hémisection latérale du côté droit de la moelle épinière entre la 5ème et la 6ème vertèbre thoracique (T6). Des analyses cinématiques et électromyographiques ont été réalisées chez les chats intacts et 8 semaines après la lésion partielle de la moelle épinière. Les résultats obtenus démontrent que la coordination antéropostérieure est contrôlée par des influences bidirectionnelles et asymétriques entre les pattes antérieures et postérieures. De plus, lorsque la vitesse de locomotion des pattes antérieures était plus élevée que celle des pattes postérieures, une dissociation du rythme était observée avec les pattes antérieures réalisant davantage de pas chez le chat intact. Suite à la lésion, cette dissociation était également observée lors de la locomotion non-partitionnée. Cependant, que ce soit avant ou après la lésion, quand une telle dissociation apparaissait, une nouvelle forme stable de coordination antéropostérieure apparaissait consistant à réaliser deux pas des pattes antérieures pendant un pas des pattes postérieures (coordination 2-1). Finalement, la coordination antéropostérieure pouvait être modulée par l’utilisation du tapis roulant partitionné et une coordination 1-1 pouvait être restaurée suite à la lésion en faisant marcher les pattes
postérieures à une vitesse plus élevée. À partir de ces résultats, nous avons proposé un nouveau modèle théorique du contrôle neurophysiologique de la coordination antéropostérieure. Qui plus est, un raffinement des échelles d’évaluation de la récupération locomotrice suite à des lésions de la moelle épinière s’avère indispensable afin d’inclure une caractérisation détaillée de la coordination antéropostérieure. Finalement, d’un point de vue clinique, ces résultats suggèrent que de nouvelles stratégies thérapeutiques basées sur la coordination antéropostérieure pourraient être envisagées afin de renforcer la récupération locomotrice suite à des lésions de la moelle épinière.
Mots clés : Coordination antéropostérieure, Lésion de la moelle épinière, Locomotion, Tapis roulant partitionné transverse
2
S
UMMARYInterlimb coordination during locomotion in the intact adult cat and after a partial spinal cord injury
By Yann Thibaudier Physiology Program
Thesis presented at the Faculty of medicine and health sciences for the obtention of Doctor degree diploma philosophiae doctor (Ph.D.) in Physiology, Faculty of medicine and health
sciences, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4
An appropriate coordination between the forelimbs and the hindlimbs in terrestrial mammals is essential to maintain stability during quadrupedal locomotion. It is thought that propriospinal pathways and sensory feedback contribute to the control of forelimb-hindlimb coordination. However, the neurophysiological mechanisms involved in this coordination during locomotion remain poorly defined. After a partial spinal cord injury, several impairments of interlimb coordination have been observed in non-human animal models and human patients. Despite this, the effects of a partial lesion on forelimb-hindlimb coordination have not been clearly characterised. Patients with spinal cord injury have pronounced deficits with their equilibrium and a deficient control of interlimb coordination could be a main contributor. The purpose of these studies was to better characterize forelimb-hindlimb coordination in intact cats and following a lateral hemisection of the spinal cord. A transverse split-belt treadmill was used to independently control the speed of the forelimbs and of the hindlimbs. Eight cats were chronically implanted for e;ectromyography and trained to perform various tied-belt and transverse split-belt locomotor conditions. Among these 8 cats, 6 were hemisected at the 6th thoracic segment of the spinal cord on the right side. Electromyographic and kinematic analyses were performed in the intact state and 8 weeks post-hemisection. The results demonstrate that interlimb coordination is controlled by bidirectional and asymmetrical influences between the forelimbs and the hindlimbs. Moreover, when the forelimbs stepped faster than the hindlimbs, dissociation of the forelimb and hindlimb rhythms occurred, with the forelimbs taking more steps. After the lesion, this dissociation was observed, even during tied-belt locomotion. However, in both intact and injured cats, when such dissociation occurred, a new stable form of forelimb-hindlimb coordination appeared, consisting of two forelimb steps for one hindlimb step (2-1 forelimb-hindlimb coordination). Finally, the transverse split-belt treadmill could modulate forelimb-hindlimb coordination and 1-1 coordination could be restored after the lesion during transverse split-belt locomotion with a faster hindlimb speed. From these results, we propose a theoretical model of the neurophysiological control of interlimb coordination. Moreover, a refinement of performance scales evaluating the locomotor recovery after spinal cord injury is necessary to include a detailed characterisation of interlimb coordination. Finally, from a clinical
perspective, these results suggest that new therapeutic strategies based on interlimb coordination could be used to strengthen locomotor recovery after spinal cord injuries. Keywords : Interlimb coordination, Spinal cord injury, Locomotion, Transverse split-belt treadmill
3
T
ABLE DES MATIÈRES1 Résumé ... iii
2 Summary ... v
3 Table des matières ... vii
4 Liste des figures ... xi
5 Liste des abréviations ... xii
1 Introduction... 1
1. Locomotion ... 1
1.1. Généralités ... 1
1.2. Contrôle neurophysiologique de la locomotion ... 3
1.2.1. Le générateur de patron central... 4
1.2.2. Le retour sensoriel ... 9
1.2.3. Les voies supraspinales ... 12
2. La coordination antéropostérieure ... 15
2.1. Principes et généralités ... 15
2.1.1. Chez l’animal quadrupède... 15
2.1.2. Chez l’humain ... 19
2.1.3. Utilisation du tapis roulant partitionné transverse ... 22
2.2. Contrôle neurophysiologique de la coordination antéropostérieure ... 26
2.2.1. Voies propriospinales ... 26
2.2.2. Longs réflexes propriospinaux ... 29
2.2.3. Voies supraspinales ... 35
3. Lésions de la moelle épinière... 36
3.1. Définitions et chiffres ... 36
3.2. Déficits et récupération locomotrice ... 37
3.2.1. Lésion complète ... 37
3.2.2. Lésions partielles ... 38
3.3. Coordination antéropostérieure suite à une lésion ... 39
3.3.1. Effets d’une lésion sur la coordination antéropostérieure chez l’animal ... 42
3.3.2. Effets d’une lésion sur la coordination antéropostérieure chez l’humain ... 44
3.4. Utilisation de la coordination antéropostérieure pour récupérer d’une lésion ... 45
3.4.1. Utilisation de la coordination antéropostérieure chez l’animal ... 45
4. Hypothèses/problématique ... 47 4.1. Objectif 1 ... 48 4.2. Objectif 2 ... 48 2 Article 1 ... 49 Abstract ... 51 Introduction ... 52 Experimental Procedures ... 54
Animals and ethical considerations... 54
Experimental protocol ... 54
Data acquisition and analysis ... 56
Statistical analysis ... 56
Results ... 57
Transverse split-belt walking: hindlimbs walking faster than the forelimbs ... 60
Transverse split-belt walking: forelimbs walking faster than the hindlimbs ... 66
Interlimb coordination and adaptation with split-belt speed ratios greater than 2:1 ... 71
Discussion ... 72
A bidirectional asymmetrically organized system ... 73
Flexible sequences of footfall patterns ... 75
Spinal and supraspinal mechanisms involved in inter-girdle coordination... 76
Conclusions ... 77
References ... 78
3 Article 2 ... 87
Abstract ... 89
Introduction ... 90
Materials and Methods ... 92
Animals and ethical considerations... 92
Experimental protocol ... 92
Data acquisition and analysis ... 93
Statistical analysis ... 95
Results ... 96
Footfall patterns and periods of support during tied-belt and transverse split-belt locomotion ... 96
Bilateral coordination during tied-belt and transverse split-belt locomotion ... 105
Coordination between the fore- and hindlimbs during tied-belt and transverse split-belt locomotion ... 107
Discussion ... 111
Modulation of limb support patterns ... 111
The spatiotemporal control of interlimb coordination ... 112
A new form of interlimb coordination ... 113
2:1 coupling patterns during locomotion after incomplete spinal cord injuries ... 115
Concluding remarks ... 116
References ... 117
4 Article 3 ... 124
Abstract ... 126
Introduction ... 127
Materials and Methods ... 128
Ethical approval ... 128
Surgical procedures ... 129
Experimental protocol ... 130
Data acquisition and analysis ... 131
Histological procedures ... 132
Statistical analysis ... 133
Results ... 133
Tied-belt locomotion before and after spinal hemisection ... 133
Transverse split-belt locomotion before and after spinal hemisection ... 141
Discussion ... 147
Forelimb-hindlimb coordination after incomplete spinal lesions ... 147
The control of interlimb coordination ... 148
Functional/clinical implications ... 151
References ... 152
5 Discussion... 159
Influence bidirectionnelle et asymétrique ... 159
Nouvelle forme de coordination antéropostérieure ... 163
Évaluation et modulation de la coordination antéropostérieure suite à une hémisection ... 165
Contrôle de la coordination antéropostérieure ... 167
Forces et faiblesses du projet ... 170
Perspectives fondamentales et cliniques ... 172
Conclusions ... 173
6 Liste des références ... 175
7 Remerciements ... 195
8 Annexe I ... 197
4
L
ISTE DES FIGURESFigure 1. Chronophotographie du cycle de marche par Étienne-Jules Marey en 1886. ... 2
Figure 2. Exemple d’électromyographie d’un patron locomoteur chez le chat adulte intact. 4 Figure 3. Contrôle neurophysiologique de la locomotion. ... 5
Figure 4. Calcul de l’intervalle de phase. ... 16
Figure 5. Séquence latérale versus diagonale. ... 17
Figure 6. Tapis roulant partitionné transverse. ... 23
Figure 7. Contrôle neurophysiologique de la coordination antéropostérieure. ... 27
Figure 8. Réflexes propriospinaux et spino-bulbo-spinaux. ... 32
Figure 9. Impact théorique de divers types de lésions sur la coordination AP. ... 41
Figure 10. Représentation schématique du polygone de sustentation au cours de la locomotion quadrupède. ... 161
Figure 11. Modèle théorique du contrôle neurophysiologique de la coordination antéropostérieure. ... 168
5
L
ISTE DES ABRÉVIATIONS 5HT AP AVC BB CPG DA EMG F FNM H IP L LG MG NA OTG R S SCI SP SR Srt Tri VL Sérotonine / Serotonin Antéropostérieure / Forelimb-Hindlimb Accident vasculaire cérébral / Stroke Biceps brachiiGénérateur de patron central / Central pattern generator Dopamine
Electromyographie / Electromyography Patte antérieure / Forelimb
Fuseau neuromusculaire / Muscle spindle Patte postérieure / Hindlimb
Iliopsoas Gauche / Left
Gastrocnémien latéral / Lateral gastrocnemius Gastrocnémien médial / Medial gastrocnemius Noradrénaline / Norepinephrine
Organe tendineux de Golgi / Golgi tendon organ Droite / Right
Soléaire / Soleus
Lésion de la moelle épinière / Spinal cord injury Péronier superficiel / Superificial peroneal Radial superficiel / Superficial radial Sartorius
Triceps brachii
1
I
NTRODUCTIONLa coordination entre les pattes antérieures et postérieures ou coordination antéropostérieure (AP) est essentielle pour maintenir la stabilité lors de la coordination quadrupède. Chez l’humain, une coordination AP est également présente entre les bras et les jambes lors de la locomotion bipède. Bien que cette coordination soit perturbée dans de nombreuses pathologies et notamment suite à des lésions partielles de la moelle épinière, les mécanismes neurophysiologiques du contrôle de cette coordination sont encore mécompris. Le travail de mon doctorat se focalise autour de la compréhension de la coordination AP chez le chat intact et suite à une lésion partielle de la moelle épinière en utilisant un tapis roulant partitionné transverse permettant de dissocier les vitesses des pattes antérieures et postérieures de l’animal. La première partie de mon introduction permettra de définir et développer le principe de locomotion ainsi que son contrôle neurophysiologique. Puis dans une deuxième partie, nous parlerons plus spécifiquement de ce qui est connu actuellement sur la coordination AP chez le mammifère quadrupède mais également chez l’humain. Finalement, nous terminerons cette introduction par une présentation des connaissances sur les lésions de la moelle épinière ainsi que son impact sur la coordination AP.
1. Locomotion
1.1. Généralités
La locomotion se définit pour un organisme vivant comme la capacité de se mouvoir dans son environnement. Elle peut adopter différentes formes telle que la marche, la course, la nage ou encore le vol. Dans le règne animal, cette capacité permet d’évoluer dans le milieu afin de se nourrir, de rencontrer des partenaires ou encore d’échapper aux dangers. Elle s’avère donc essentielle dans la survie et la reproduction d’une espèce.
Du fait de son importance capitale, la locomotion et plus précisément la marche attise depuis longtemps la curiosité scientifique. Cependant les avancées de nos connaissances à propos du patron locomoteur se sont faites de concert avec l’évolution des technologies
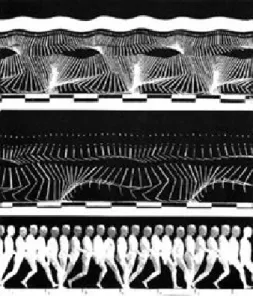
d’analyse. Les premiers écrits s’intéressant au comportement locomoteur remontent à Aristote (384-322 avant JC). En se basant sur des observations visuelles, il propose que le mouvement se fasse par l’intermédiaire de deux éléments : un élément mobilisé et un élément mobilisateur (Baker, 2007). Dans le cas de la locomotion, l’élément mobilisé serait le corps alors que l’élément mobilisateur serait l’esprit. Ce n’est que bien plus tard que Giovanni Borelli (1609-1679) offre une vision biomécanique de la locomotion en se basant sur des analyses quantifiables du mouvement telle que les forces musculaires estimées (Baker, 2007; Medved, 2000). Ce n’est toutefois qu’avec l’apparition et le développement de la technologie de l’image que la caractérisation de ce comportement locomoteur a pu faire un bond en avant. Au XIXè siècle, Étienne-Jules Marey et Edward Muybridge furent les premiers à étudier la cinématique du patron locomoteur en réalisant des décompositions photographiques du mouvement chez différentes espèces d’animaux incluant l’humain (Marey, 1879; Muybridge, 1955). Les travaux d’Edward Muybridge vont notamment entrainer une reconsidération au niveau artistique de la représentation du mouvement animal (Manjila et al., 2015). Cependant ce sont les travaux d’Étienne-Jules Marey chez le cheval qui auront le plus d’impact sur la vision scientifique du patron locomoteur (Baker, 2007; Pozzo, 2003). Il décrit ainsi l’existence de différents modes de locomotion et la mise en place d’adaptation de la coordination lors des phases de transitions entre ces modes (Marey, 1879). La figure 1 représente un enregistrement chronophotographique du cycle de marche réalisé par Marey en 1886.
Cette photographie représente l’un des premiers enregistrements cinématiques permettant la décomposition du cycle de marche en plusieurs images successives. Nous pouvons y voir très clairement l’enchainement de phases d’appuis et de balancements ainsi que les angles articulaires.
Jusqu’à aujourd’hui, les avancées de nos connaissances sur le patron locomoteur se sont fait par l’évolution des techniques de la biomécanique, avec notamment l’apparition de l’électromyographie (EMG) permettant de mesurer l’activité électrique musculaire, et de la cinématique, avec l’apparition du cinéma puis du numérique (Lauder and Madden, 2008). Ces avancées ont permis de caractériser la marche qui est le mode de locomotion le plus emprunté chez les espèces se déplaçant avec appui sur leurs membres. La marche est plus lente que la course et se différencie de cette dernière par la présence constante d’au moins un appui au sol. Elle peut être décomposée en une succession de cycle de marche correspondant à la période entre deux contacts d’un même pied au sol. Le cycle de marche peut lui-même être décomposé en une phase d’appui, allant du contact au décollage d’une jambe, et une phase de balancement, allant du décollage jusqu’au contact de la jambe. Au cours de la phase d’appui, nous observons principalement une activité EMG des muscles extenseurs tel que le vaste latéral (extenseur du genou) et le gastrocnémien (extenseur de la cheville / Fléchisseur du genou) alors que pendant la phase de balancement, nous observons principalement une activité EMG des muscles fléchisseurs tel que le sartorius (Fléchisseur du genou) ou encore le tibial antérieur (Fléchisseur de la cheville). Afin de permettre une augmentation de vitesse, la durée du cycle de marche va diminuer notamment par une diminution de la durée de la phase d’appui alors que la phase de balancement reste relativement invariante (Frigon, 2012; Gossard et al., 2011). Un enregistrement de l’activité EMG et des phases du cycle de marche chez le chat intact lors de la locomotion quadrupède est donnée à titre d’exemple dans la figure 2.
1.2. Contrôle neurophysiologique de la locomotion
D’un point de vue neurophysiologique, le contrôle de la locomotion est réalisé par l’interaction des générateurs de patrons centraux (CPGs) au niveau de la moelle épinière avec le retour sensoriel de la périphérie et les voies supraspinales. Une schématisation
reprenant l’ensemble des voies qui vont être décrites dans les paragraphes qui vont suivre est présentée en figure 3.
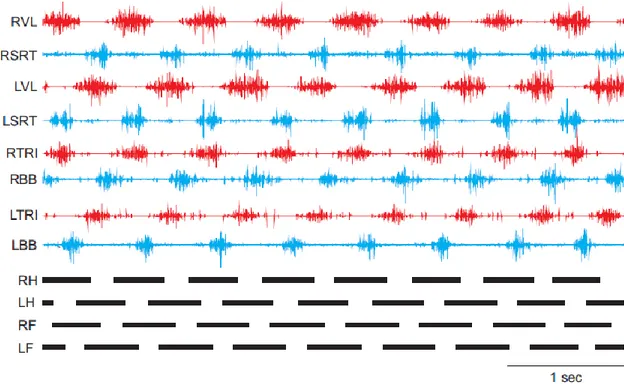
Figure 2. Exemple d’électromyographie d’un patron locomoteur chez le chat adulte intact.
Dans la partie haute de la figure, nous pouvons voir les enregistrements de muscles extenseurs (rouge) et fléchisseurs (bleu) pour les 4 pattes de l’animal. En dessous, les bandes noires représentent les phases d’appuis pour la patte postérieure droite (RH) et gauche (LH) et la patte antérieure droite (RF) et gauche (LF) alors que les espaces blancs représentent les phases de balancements. R = Droite (Right); L = Gauche (Left); VL = Vaste latéral (Extenseur du genou); SRT = partie antérieure du Sartorius (Fléchisseur de la hanche/extenseur du genou); TRI = Triceps brachii (Extenseur du coude); BB = Biceps Brachii (Fléchisseur du coude).
1.2.1. Le générateur de patron central
Dès le début du 20ème siècle, Charles Sherrington fut le premier a démontrer qu’un patron locomoteur pouvait être induit chez le chat ou le chien ayant une lésion complète de la moelle épinière (spinalisé). Étant donné l’absence de voies supraspinales dans ces préparations, Sherrington en conclut que le patron de marche devait être le résultat d’actions réflexes provenant de la périphérie et agissant sur des centres spinaux (Sherrington, 1910). Toutefois, ce n’est qu’en 1911 que le concept de CPG fut proposé par
Graham-Brown suite à une expérience démontrant l’alternance rythmique de l’activité des extenseurs et des fléchisseurs chez un chat spinalisé et dont les racines dorsales avaient été sectionnées caudale à la lésion afin d’éliminer le retour sensoriel en provenance de la périphérie (Brown, 1911; Jankowska et al., 1967a, 1967b). Un CPG peut alors se définir comme un réseau de neurones présent dans la moelle épinière capable de générer un patron d’activités rythmiques de façon autonome. Pour ce qui a trait à la locomotion, il existerait un CPG par membre nécessitant ainsi une interaction entre les CPGs pour permettre la coordination entre les membres. D’un point de vue anatomique, les CPGs des pattes postérieures se situent au niveau lombaire (L3-S1 chez le chat avec une rythmogenèse plus importante pour les segments L3-L5) (Delivet-Mongrain et al., 2008; Grillner and Zangger, 1979; Langlet et al., 2005; Marcoux and Rossignol, 2000) alors que les CPGs des pattes antérieures se situent au niveau cervical (C4-T1 chez le chat) (Yamaguchi, 2004).
F E F E Extéroception récepteurs cutanés Proprioception Organes tendineux de Golgi Fuseaux neuro-musculaires
Retour Sensoriel
Générateurs de patrons
centraux (CPGs)
Voies supraspinales
Principaux faisceaux Faisceau cortico-spinal Origine : cortex fronto-pariétalRôle : locomotion volontaire Faisceau rubro-spinal Origine : Noyau rouge Rôle : Exécution automatique
de tâches motrices apprises Faisceau vestibulo-spinal Origine : Noyau vestibulaire
Rôle : Posture et équilibre Faisceau réticulo-spinal Origine : Formation réticulée Rôle : Initiation et modulation
de la locomotion Neuromodulation
Sérotonine (5HT) Origine : Noyaux du raphé
Noradrénaline (NA) Origine : Locus Coeruleus
Dopamine (DA) Origine : Région hypothalamique A11
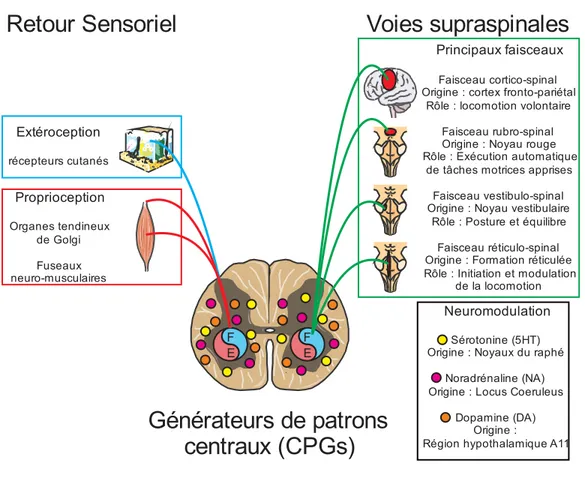
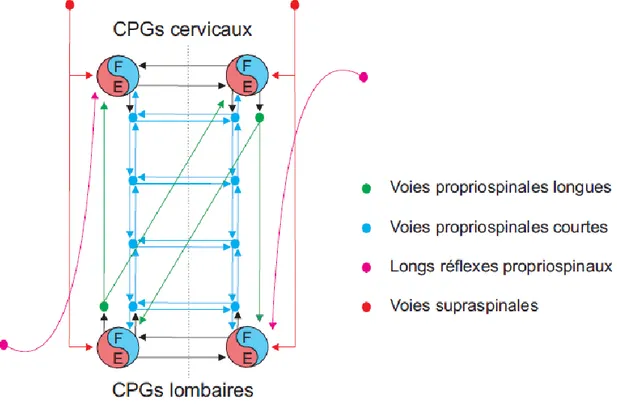
Figure 3. Contrôle neurophysiologique de la locomotion.
Au centre du schéma se trouve la moelle épinière comprenant les générateurs de patrons centraux (CPG, symbole du Yin et du Yang) permettant de produire un patron d’activité rythmique en absence de voies supraspinales et de retour sensoriel. Cependant, en condition
normale, ces CPGs interagissent avec le retour sensoriel (à gauche) et les voies supraspinales (à droite). Du point de vue du retour sensoriel, nous pouvons distinguer l’extéroception (notamment les pressions sur la peau) et la proprioception (longueur et contraction musculaire). Du point de vue des voies supraspinales, 4 faisceaux principaux sont impliqués dans le contrôle locomoteur à savoir les faisceaux cortico-spinal, rubro-spinal, vestibulo-spinal et réticulo-spinal. En plus de cela, les voies supraspinales vont pouvoir moduler le patron locomoteur par le biais de neuromodulateurs (sérotonine, noradrénaline et dopamine) provenant de différents noyaux (Raphé, Locus coeruleus, Région hypothalamique A11).
1.2.1.1. Modélisation
Bien que le fonctionnement des CPGs demeure encore aujourd’hui relativement incompris, de nombreux modèles théoriques ont été proposés (McCrea and Rybak, 2008).
Le premier modèle proposé par Graham-Brown (1914) et appuyé par la suite par Anders Lundberg, Elzbieta Jankowska et autres, est un modèle de CPG à deux demi-centres. La base de ce modèle veut que deux groupes de neurones (un extenseur et un fléchisseur) s’inhibent réciproquement. Un processus de fatigue entrainerait progressivement la diminution de l’activité d’un des groupes jusqu’à l’activation du groupe opposé permettant ainsi l’alternance de flexion et d’extension (Brown, 1914, 1911; Jankowska et al., 1967a, 1967b).
Bien que ce modèle permette d’expliquer le principe de base d’alternance des phases, il s’est vite avéré trop simpliste pour expliquer l’ensemble des caractéristiques du comportement locomoteur produit au niveau spinal. En effet, la locomotion ne correspond pas à une simple alternance entre extenseurs et fléchisseurs mais à une véritable activation musculaire complexe et séquentielle. À partir de cette constatation, Grillner (1981) a proposé un modèle de générateur d’unité de bouffée (unit burst generators) se basant sur le principe qu’il existerait une unité (mini CPG) par articulation permettant une activation plus flexible (simultanée ou non) des différentes articulations au cours de la locomotion (Grillner, 1981).
Malgré la flexibilité que propose ce modèle, il ne permet toujours pas d’expliquer la complexité des résultats observés au cours des études de locomotion. En effet, certaines
expériences montrent que l’amplitude de l’activité musculaire peut être modulée en absence de modification de la cadence locomotrice nécessitant ainsi la mise en place d’un modèle basé sur cette indépendance de la rythmicité et de la formation du patron d'activité (Hultborn et al., 1998; Perret and Cabelguen, 1980). Il a ainsi été proposé un modèle à deux niveaux de contrôle, un premier niveau gérant le rythme (« rhythm generator ») et un deuxième niveau produisant et coordonnant le patron d’activité des différents muscles (« pattern formation »).
Cependant, aucun modèle n’est encore parvenu à ce jour à reproduire l’ensemble des observations scientifiques sur le comportement locomoteur. Afin de produire un patron d’activité rythmique complexe et flexible pouvant répondre aux différentes contraintes environnementales et internes, il est probable que le fonctionnement neurophysiologique du CPG emprunte des caractéristiques des deux modèles précédemment proposés (McCrea and Rybak, 2008).
1.2.1.2. Neurones impliqués
Les modèles précédents permettent de rendre compte d’un fonctionnement général des CPGs sans pour autant élucider les cellules impliqués. Certaines études ont donc tenté de caractériser les neurones impliqués dans les différentes tâches contrôlées par les CPGs.
L’une des principales questions était de comprendre comment le rythme produit par les CPGs pouvait être généré. Il semblerait que ce rythme soit produit par des interneurones glutamatergiques excitateurs projetant de façon ipsilatérale (Kiehn, 2006). En effet, des expériences utilisant des bloqueurs synaptiques de l’inhibition ont démontré que le rythme pouvait être produit en absence d’inhibition chez la lamproie (Cangiano and Grillner, 2005, 2003), le rongeur (Bonnot et al., 2002; Bracci et al., 1996a, 1996b; Kjaerulff and Kiehn, 1997; Kremer and Lev-Tov, 1997) et le chat (Kato, 1987; Noga et al., 1987). De ce fait, il a été proposé que les neurones responsables de la production du rythme puissent posséder des propriétés intrinsèques de pace-maker chez le rongeur (Brocard et al., 2013; Peña et al., 2004; Smith et al., 2000; Tazerart et al., 2008). Il a notamment été montré qu’une sous-population d’interneurones exprimant le facteur de transcription Hb9 possédait des
caractéristiques de neurones pace-maker notamment un rebond post-inhibiteur important et une oscillation de potentiel de membrane prononcée lors d’épisodes de locomotion fictive (activité de type locomotrice enregistrée au niveau des nerfs musculaires/racines ventrales sans présence de mouvement) sur préparation de moelle épinière isolée de souris (Wilson et al., 2005, 2007).
Les CPGs sont également capables de produire une alternance entre l’activité des muscles fléchisseurs et extenseurs d’une même patte. Lorsque l’inhibition glycinergique est bloquée, une activation synchrone des fléchisseurs et extenseurs est observée chez le rat démontrant un rôle primordial des neurones inhibiteurs dans cette alternance (Beato and Nistri, 1999; Cazalets et al., 1998; Cowley and Schmidt, 1995). De plus, celle-ci peut être préservée dans une moitié de moelle épinière isolée (seulement un côté) suggérant que les voies commissurales croisant la ligne médiane ne seraient pas nécessaires (Bonnot et al., 2002; Kato, 1987; Kjaerulff and Kiehn, 1997). Les deux principaux interneurones inhibiteurs projetant ipsilatéralement sur les motoneurones à savoir les interneurones Ia et les cellules de Renshaw, ont donc été proposés pour accomplir ce rôle. En effet, ces interneurones sont activés de manière rythmique pendant la locomotion chez le chat (McCrea et al., 1980; Noga et al., 1987; Pratt and Jordan, 1987). Toutefois, avec les récentes avancées en génétiques, différentes populations de neurones ont pu être caractérisées chez la souris en se basant sur l’expression des facteurs de transcription au cours du développement (Goulding et al., 2014; Kiehn, 2006). Les neurones V1, se développant à l’aide du facteur de transcription Pax6, ont ainsi pu être caractérisés comme des neurones inhibiteurs projetant de façon ipsilatérale et dont font partie les interneurones Ia et les cellules de Renshaw. Malgré l’absence des neurones V1 chez des souris Pax6-/-, la coordination entre fléchisseurs et extenseurs est maintenue suggérant qu’une autre population de neurones inhibiteurs n’ayant pas été encore identifiée serait impliquée dans cette alternance (Kiehn, 2006; Sapir, 2004).
Finalement, les circuits impliqués dans la coordination gauche/droite ont également été étudiés. Afin de coupler les CPGs gauche et droite, des neurones commissuraux (croisant la ligne médiane de la moelle épinière) sont nécessaires (Kiehn, 2006). Des expériences
électrophysiologiques sur moelle épinière de rongeur ont permis de montrer qu’il existait des connections inhibitrices monosynaptiques et disynaptiques (via des projections excitatrices sur les interneurones Ia et les Cellules de Renshaw) permettant une alternance entre les côtés gauche et droit (Butt and Kiehn, 2003; Kjaerulff and Kiehn, 1997; Quinlan and Kiehn, 2007). Il a été proposé que les neurones caractérisés génétiquement comme V0d (GABA/Glycinergique) et V0v (Gluatamatergiques) pourraient correspondre aux connections inhibitrices monosynaptiques et disynaptiques, respectivement (Lanuza et al., 2004; Talpalar et al., 2013). De plus, il semblerait que les neurones V0d permettent une alternance gauche-droite principalement à une faible vitesse de locomotion alors que les neurones V0v seraient plutôt impliqués dans une alternance à des vitesses plus élevées (Shevtsova et al., 2015; Talpalar et al., 2013). En plus de ces connections inhibitrices, des connections excitatrices monosynaptiques semblent être également présentes et permettraient aux côtés gauches et droits de fonctionner en synchronie comme cela peut être observé lors du galop de l’animal. Une population de neurones commissuraux excitateurs projetant directement sur les motoneurones a été identifiée génétiquement (V3) et pourrait être impliqué dans cette fonction de synchronisation (Shevtsova et al., 2015; Zhang et al., 2008).
1.2.2. Le retour sensoriel
Bien que le patron d’activité rythmique puisse être produit uniquement par les CPGs, ceux-ci interagissent avec le retour sensoriel afin de permettre un ajustement face aux contraintes environnementales et intrinsèques. Ces différentes sources d’informations vont être captées par différents récepteurs sensoriels. Ces informations vont par la suite être conduites au niveau spinal par les racines dorsales afin d’aller influencer les motoneurones et interneurones et ainsi moduler le comportement locomoteur.
1.2.2.1. Proprioception
La proprioception permet la perception des informations concernant l’état du corps et de ses éléments internes. Elle regroupe principalement deux grands types de récepteurs : les fuseaux neuro-musculaires (FNM) et les organes tendineux de Golgi (OTG). Les FNM,
localisé au niveau du muscle, sont constitués de fibres intrafusales parallèles aux fibres musculaires extrafusales. Ils vont permettre d’apporter des informations concernant la longueur du muscle à la moelle épinière via les fibres Ia (composante active principalement et un peu passive) et II (uniquement composante passive). Les OTG localisé au niveau du tendon vont permettre d’apporter des informations concernant la force de contraction à la moelle épinière via les fibres Ib.
Au cours de la locomotion, il a été démontré que les afférences des groupes I et II jouaient un rôle important notamment dans la transition de la phase d’appui à la phase de balancement chez le chat (Pearson, 2008; Rossignol et al., 2006). En effet, certaines évidences démontrent que l’extension de la hanche contribuerait au contrôle de cette transition de phase. Chez le chat spinal chronique, si l’on empêche l’extension de la hanche, la phase de balancement n’est plus initiée. Néanmoins, si nous étendons de nouveau doucement la hanche alors la phase de balancement revient lorsque la hanche atteint un angle proche de celui observé lors d’une locomotion normale (Grillner and Rossignol, 1978). De plus, chez un animal paralysé par l’addition de curare, bloquant la transmission synaptique à la jonction neuromusculaire et empêchant tout mouvement de l’animal, une activité de type locomotrice (locomotion fictive) peut être observée au niveau des décharges motrices enregistrées sur les nerfs s’apparentant à l’activité musculaire observée lors d’une locomotion réelle. Il a été montré que lors de la locomotion fictive chez le chat spinal, une extension de la hanche provoque la fin de la bouffée des extenseurs et le début de la bouffée des fléchisseurs (Andersson and Grillner, 1983, 1981). Des observations similaires ont également été reportées chez le chat décérébré (Hiebert et al., 1996). Ces résultats démontrent que le retour sensoriel provenant de la hanche peut moduler le patron locomoteur en initiant ou retardant la transition de la phase d’appui à la phase de balancement.
Le chargement des muscles extenseurs de la cheville semble également jouer un rôle important dans la transition de la phase d’appui à la phase de balancement. En effet, chez le chat décérébré, un chargement de la cheville par maintien d’étirement ou par stimulation des racines ventrales provoque une inhibition de la bouffée des fléchisseurs (Duysens and
Pearson, 1980). L’inhibition de la flexion par les afférences de type I des muscles extenseurs de la cheville a par la suite été confirmée par plusieurs études chez le chat décérébré et intact (Hiebert et al., 1995; Pearson et al., 1992; Whelan and Pearson, 1997; Whelan et al., 1995). En effet, ces études montrent qu’une stimulation des afférences primaires du gastrocnémien latéral et soléaire (LGS) ou du gastrocnémien médial (MG) lors de la phase d’appui entraine un prolongement de cette phase retardant l’initiation de la phase de balancement.
1.2.2.2. Extéroception
L’extéroception permet la perception de l’environnement extérieur et son impact sur le corps. Dans la locomotion, les principaux récepteurs impliqués dans l’extéroception sont les mécanorécepteurs en provenance de la peau. Ces récepteurs vont être de plusieurs types et vont permettre d’apporter des informations concernant le contact cutané avec l’environnement pouvant aller de la simple pression fine à des stimuli douloureux. Au cours de la locomotion, ces informations vont permettre d’adapter le patron locomoteur en fonction des caractéristiques de l’environnement rencontrées.
L’une des adaptations les plus connues est certainement le réflexe permettant de contourner un obstacle rencontré au cours de la locomotion. En effet, lors de la phase de balancement, si une patte ou une jambe percute un obstacle, alors les récepteurs cutanées de la face dorsale de la patte/jambe vont capter l’information ce qui va provoquer une augmentation de l’activité des fléchisseurs produisant une élévation de la patte/jambe pour surmonter l’obstacle (Duysens et al., 1990; Forssberg et al., 1977; McCrea et al., 1998; Nielsen and Sinkjaer, 2002; Quevedo et al., 2005). De plus, pour maintenir l’équilibre pendant cette réponse réflexe, une augmentation de l’activité des extenseurs du côté controlatéral permettant d’augmenter le support de poids est également observée.
Lors de la locomotion sur tapis roulant chez le chat décérébré, il a été démontré que les afférences cutanées de la face plantaire de la patte quant à elle, permettent de renforcer l’activité des extenseurs quand le support de poids est nécessaire sur cette patte (Duysens and Pearson, 1976). Cependant, si l’information captée est de type douloureux, une
augmentation de l’activité des fléchisseurs permettant un retrait de la patte est alors observée.
1.2.3. Les voies supraspinales
En plus de l’influence du retour sensoriel, le patron locomoteur va pouvoir être initié et modulé à partir de voies supraspinales. Les CPGs seraient sous le contrôle de structures supraspinales via 4 principaux faisceaux : corticospinal, rubro-spinal, vestibulo-spinal et réticulo-spinal (Amstrong, 1988; Drew et al., 2004; Le Ray et al., 2011; Nathan et al., 1996; Takakusaki, 2008).
1.2.3.1. Faisceau corticospinal
Le faisceau corticospinal (ou pyramidal) est la voie qui permet de relier directement le cortex à la moelle épinière. Il prend son origine au niveau du cortex fronto-pariétal incluant le cortex moteur primaire, l’aire motrice secondaire et le cortex somatosensoriel. La plupart (75-90%) de ses fibres croisent la ligne médiane au niveau de la Medulla oblongata du tronc cérébral (décussation pyramidale) et vont ainsi projeter du côté controlatéral de la moelle épinière (Jang, 2014). Ce faisceau est responsable de la motricité volontaire et va donc devenir particulièrement important lors de tâches de locomotion complexes demandant une certaine précision telle que la marche sur une échelle par exemple (Amstrong, 1988; Drew et al., 2002).
1.2.3.2. Faisceau rubro-spinal
Le faisceau rubro-spinal prend son origine au niveau du noyau rouge magnocellulaire situé dans le tegmentum mésencéphalique (Gruber and Gould, 2010). Il fait une décussation au niveau du mésencéphale avant de projeter vers les parties latérales des lamina V-VI et dorsales des lamina VII et IX de la moelle épinière via le funiculus dorsolatéral. Le faisceau rubro-spinal et ses corps cellulaires au niveau du noyau rouge ont progressivement décliné au cours de l’évolution des mammifères (Massion, 1967). Il a été proposé que ce faisceau initialement impliqué dans l’execution automatique de capacités motrices apprises a été progressivement remplacé par le faisceau corticospinal (ten Donkelaar, 1988). Bien qu’il
demeure principalement vestigial chez l’humain, il semble tout de même impliqué dans le contrôle du tonus postural ainsi que dans la coordination des muscles distaux des bras.
1.2.3.3. Faisceau vestibulo-spinal
Le faisceau vestibulo-spinal prend son origine au niveau des noyaux vestibulaires situé à la jonction ponto-médullaire du tronc cérébral. Ce faisceau peut être subdivisé en deux parties : le faisceau vestibulo-spinal latéral provenant du noyau vestibulaire latéral pontique et qui se projette ipsilatéralement via le funiculus latéral et le faisceau vestibulo-spinal médial provenant du noyau vestibulaire médullaire médial, supérieur et inférieur et qui se projette à la fois ipsilatéralement et controlatéralement via le funiculus antérieur. Ces deux faisceaux se terminent au niveau des interneurones des laminae VII et VIII. Le faisceau vestibulo-spinal est principalement impliqué dans la posture et l’équilibre.
1.2.3.4. Faisceau réticulo-spinal
Le faisceau réticulo-spinal semble être le principal système de fibres descendantes impliqué dans l’initiation de la locomotion (Sakai et al., 2009). Constitué principalement de neurones glutamatergiques, le faisceau reticulo-spinal prend son origine au niveau de la formation réticulée située dans le tronc cérébral. Il peut être subdivisé en deux parties. Tout d’abord, le faisceau reticulo-spinal médial qui prend son origine au niveau de la formation réticulée pontique (noyau réticulé pontique caudalis et noyau réticulé pontique oralis) et se projette sur les neurones des laminae VII et VIII de la moelle épinière. Il est notamment responsable de l’activité excitatrice antigravitaire des muscles extenseurs. Enfin, le faisceau reticulo-spinal latéral prend son origine au niveau de la formation réticulée médullaire (principalement le noyau gigantocellulaire) et se projette sur les neurones des laminae VII et IX. Il est notamment responsable d’inhiber l’excitation des muscles extenseurs axiaux du mouvement (Le Ray et al., 2011; Nathan et al., 1996). Le faisceau reticulo-spinal est sous l’influence directe de la région locomotrice mésencéphalique (RLM) située au niveau de la jonction ponto-mésencéphalique qui fut définie en 1966 par l’équipe de Shik chez le chat décérébré comme étant une région induisant un rythme locomoteur lorsqu’elle était stimulée électriquement (Alam et al., 2011; Garcia-Rill et al., 2004; Shik et al., 1966). Qui
plus est, une augmentation de l’intensité de stimulation entrainait une accélération de la cadence de locomotion pouvant même provoquer une transition de la marche vers la course (Shik et al., 1966).
1.2.3.4. Neuromodulation de l’activité locomotrice
En plus de ses voies descendantes impactant directement l’activité des neurones de la moelle épinière, certains noyaux du tronc cérébral vont également relâcher des neuro-modulateurs au niveau spinal afin de moduler cette activité. Ces neuroneuro-modulateurs peuvent influencer le comportement locomoteur soit en modulant les propriétés électriques intégratives des motoneurones et interneurones, soit en modulant les connections synaptiques entre ces interneurones et motoneurones (Heckman et al., 2007; Miles and Sillar, 2011). Les principaux neuromodulateurs pouvant affecter la locomotion sont la sérotonine (5HT) provenant des noyaux du raphé, la noradrénaline (NA) provenant du locus coeruleus et la dopamine (DA) provenant de la région hypothalamique A11.
Il a été montré que la 5HT pouvait initier l'activation du réseau locomoteur chez le lapin (Viala and Buser, 1971), le rat (Cazalets et al., 1992; Feraboli-Lohnherr et al., 1999) et la souris (Landry et al., 2006; Madriaga et al., 2004; Ung et al., 2008). À l’inverse, la 5HT ne parvient pas à initier la locomotion chez le chat spinal, cependant elle peut moduler l’activité locomotrice en augmentant l’amplitude et la bouffée des activités EMGs lors d’un comportement locomoteur existant (Barbeau and Rossignol, 1991, 1990).
Certaines études ont montré que la NA permettait d’induire une activité locomotrice chez le chat spinal (Barbeau and Rossignol, 1990; Chau et al., 1998a, 1998b; Forssberg and Grillner, 1973; Kiehn et al., 1992). À l’inverse, dans une préparation de moelle épinière isolée de rat, la NA ne parvient à produire qu’un faible patron d’activité de type locomotrice (Gabbay and Lev-Tov, 2004; Kiehn et al., 1999; Sqalli-Houssaini and Cazalets, 2000). Toutefois, dans les deux préparations, lorsqu’un comportement locomoteur est déjà présent, la NA entraine un ralentissement du rythme et une augmentation de l’amplitude de l’activité EMGs ou des racines ventrales (Chau et al., 1998a, 1998b; Kiehn et al., 1999; Sqalli-Houssaini and Cazalets, 2000).
La DA n’est pas aussi efficace pour induire une activité locomotrice que la 5HT ou la NA. En effet, la DA ne parvient pas à induire la locomotion chez le chat spinal (Barbeau and Rossignol, 1990). Chez le rongeur, les résultats sont plus disparates et il semblerait qu’une activation spécifique des récepteurs D1/D5 puisse induire ou jouer un rôle dans l’induction de la locomotion (Barrière et al., 2004; Kiehn and Kjaerulff, 1996; Lapointe et al., 2009; Madriaga et al., 2004). Du point de vue de la modulation de l’activité locomotrice déjà présente, il semblerait que chez le chat la DA puisse augmenter l’amplitude de l’activité des fléchisseurs alors que chez le rongeur, elle diminue le rythme et augmente l’activité des racines ventrales (Barrière et al., 2004; Whelan et al., 2000).
2. La coordination antéropostérieure
2.1. Principes et généralités
Au cours de cette thèse, le terme coordination antéropostérieure (AP) sera employé lors de la locomotion quadrupède pour parler de la coordination entre les pattes antérieures et postérieures de l’animal. Bien qu’il soit moins approprié, ce terme sera également utilisé chez l’humain pour parler de la coordination entre les bras et les jambes que ce soit lors de la locomotion quadrupède ou bipède.
2.1.1. Chez l’animal quadrupède
Afin de maintenir un équilibre dynamique lors de la locomotion quadrupède, une bonne coordination entre les membres s’avère nécessaire. La coordination gauche-droite a été largement étudiée et ses mécanismes partiellement présentés dans la partie CPG. Les études sur la coordination antéropostérieure sont moins nombreuses mais permettent cependant d’établir les fondements de celle-ci.
2.1.1.1. Types de coordination
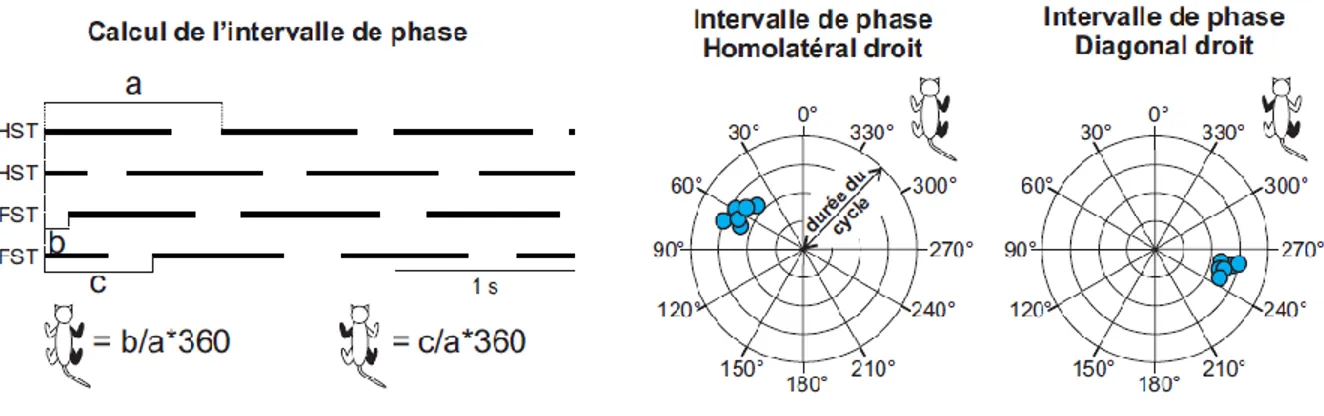
Une méthode couramment utilisée pour évaluer la coordination antéropostérieure est de mesurer l’intervalle de phase entre le contact d’une patte postérieure avec le contact de la
patte antérieure homolatérale ou diagonale (Fig. 4). L’intervalle de phase se calcule en mesurant le temps entre les deux contacts normalisé par rapport à la durée du cycle de la patte postérieure (D’Angelo et al., 2014; English and Lennard, 1982; English, 1979; Orsal et al., 1990). Ces valeurs sont fréquemment mises en degrés (multiplié par 360) afin d’exprimer leur nature continue et leur distribution possible (English and Lennard, 1982).
Figure 4. Calcul de l’intervalle de phase.
Le calcul de l’intervalle de phase est présenté pour le couplage homolatéral et diagonal comprenant la patte postérieure droite. Pour le couplage homolatéral droit, la durée entre le contact de la patte postérieure droite et le contact de la patte antérieure droite (b) est divisée par la durée du cycle de la patte postérieure droite (a) puis la valeur est multipliée par 360 afin d’être représentée sur un graphique circulaire ou chaque point correspond aux valeurs pour un cycle. Pour le couplage diagonal droit, la durée entre le contact de la patte postérieure droite et le contact de la patte antérieure gauche (c) est divisée par la durée du cycle de la patte postérieure droite (a) puis la valeur est multipliée par 360 afin d’être représentée sur un graphique circulaire. RHST = Phase d’appui de la patte postérieure droite; LHST = Phase d’appui de la patte postérieure gauche; RFST = Phase d’appui de la patte antérieure droite; LFST = Phase d’appui de la patte antérieure gauche.
À partir de cette méthode, English et Lennard (1982) ont défini 4 grands types de coordination AP chez le chat, à savoir le trot pour des valeurs d’intervalle de phase homolatérale comprise entre 135° et 225°, le « pacing » pour des valeurs entre 315° et 45°, le couplage latéral pour des valeurs comprises entre 45° et 90° et entre 270° et 315°, et enfin le couplage diagonale pour des valeurs comprises entre 90° et 135° et entre 225° et 270°. Ces valeurs pour le couplage latéral et le couplage diagonal ont été choisies en se basant sur les travaux d’Hildebrand (1976) suggérant un lien plus important entre les pattes homolatérales ou diagonales, respectivement (Hildebrand, 1976). Cependant, cette nomenclature peut paraitre déstabilisante étant donné qu’elle est contradictoire avec les notions de séquences latérales et diagonales (Shapiro et al., 2014). En effet, lors de la
marche quadrupède, la plupart des animaux ont tendance à utiliser naturellement une séquence de coordination AP dite latérale. Cela signifie que le contact d’une patte postérieure est suivi par le contact de la patte antérieure homolatérale (Hildebrand, 1989; Lemelin et al., 2003; Stevens, 2006). À l’inverse, les primates non-humain ont tendance à adopter une séquence diagonale caractérisée par le contact d’une patte postérieure suivi par le contact de la patte antérieure controlatérale (Hildebrand, 1989; Larson et al., 2000; Lemelin et al., 2003; Prost, 1965; Schmitt, 2003; Stevens, 2006, 2008; Vilensky, 1989; Young et al., 2007). Ces deux modes de coordination AP sont schématisés dans la figure 5. De nombreuses études tentent d’expliquer cette différence mais les raisons demeurent méconnues. Parmi les principales hypothèses, les contraintes environnementales (Lemelin et al., 2003; Stevens, 2006), l’inclinaison de la surface (Hildebrand1967) (Stevens, 2008; Vilensky et al., 1994), l’évolution du système nerveux central vers un contrôle plus cortical (Vilensky, 1989) et la modification de localisation du centre de gravité (Young et al., 2007) ont notamment été proposées.
Figure 5. Séquence latérale versus diagonale.
Deux types de séquences de coordination AP peuvent se distinguer lors de la locomotion quadrupède. Chez la plupart des mammifères, nous observons une séquence latérale (à gauche sur le schéma) caractérisée par le contact d’une patte postérieure suivi par le contact de la patte antérieure homolatérale. À l’inverse, le primate non-humain utilise une séquence de type diagonale (à droite sur le schéma) caractérisée par le contact d’une patte postérieure suivi par le contact de la patte antérieure diagonale. Un contact sur le schéma est représenté
par la patte en noire et l’ordre des contacts au cours du cycle de marche par le numéro à l’intérieur des chats.
2.1.1.2. Modulation de la coordination antéropostérieure
Plusieurs paramètres peuvent moduler la coordination AP et apporter une transition d’un mode de coordination à un autre. En effet, il a été clairement établi que le patron locomoteur pouvait être grandement influencé par la vitesse de locomotion et l’impact de cette variable a donc été évalué sur la coordination AP. Lors de la locomotion sur tapis roulant, Frigon et al. (2014) ont montré que le chat adulte utilise un couplage latéral à faible vitesse (0,3-0,4m/s) alors qu’il va avoir tendance à utiliser un mélange de couplage latéral et de « pacing » à des vitesses plus élevées (0,5-1,0m/s) (Frigon et al., 2014). Pour des vitesses encore plus grandes, d’autres modes de locomotion tel que le trot ou encore le galop peuvent être adoptés par les animaux. La transition entre ces modes s’accompagne d’ajustements au niveau de la coordination AP (Maes and Abourachid, 2013). Il a notamment été montré que lors d’une transition de la marche vers le trot, une diminution de la durée de la phase de balancement était observée sur les pattes postérieures mais pas sur les pattes antérieures. À l’inverse, lors de la transition du trot vers la course, des modifications sur les paires de pattes diagonales étaient observées avec une augmentation et une diminution de la durée de la phase de balancement du premier pas des pattes postérieures et du second pas des pattes antérieures (Afelt et al., 1983; Maes and Abourachid, 2013; Vilensky et al., 1991).
En plus de l’impact de la vitesse sur la coordination AP, celle-ci semble également affectée suivant si la locomotion se fait sur le sol ou sur un tapis roulant. En effet chez le chat, une tendance à adopter une coordination de type « pacing » a été observée sur le tapis roulant alors qu’un couplage latéral est naturellement présent sur le sol (Blaszczyk and Loeb, 1993; Wetzel et al., 1975). Cette tendance au « pacing » semble être particulièrement prononcée lorsque le chat marche à l’extrémité avant du tapis et il a été suggéré que la perception de la tâche comme imprévisible puisse être à l’origine de ce changement de patron locomoteur (Blaszczyk and Loeb, 1993). En effet selon les auteurs, en marchant en avant et en utilisant une coordination de type « pacing », le chat serait plus prompt à agrandir sa longueur de pas en cas d’augmentation soudaine de la vitesse.
2.1.2. Chez l’humain
Malgré l’évolution de sa locomotion vers une marche bipède, l’humain conserve une coordination AP avec les bras et les jambes s’exerçant une influence mutuelle (Dietz, 2011; Zehr and Duysens, 2004). En effet, Delwaide et al. (1977) ont montré que la position des bras pouvait moduler l’activité réflexe provoquée par la percussion du tendon du soleus, du quadriceps ou encore du biceps femoris (Delwaide et al., 1977). De plus, il a été montré que des mouvements passifs de flexion-extension des épaules facilitaient le réflexe de Hoffman (réflexe H) du soleus au niveau des jambes (Hiraoka and Nagata, 1999) alors que des mouvements actifs de balancement des bras réduisaient son amplitude (Hiraoka, 2001). Dans la même direction, une activité rythmique de pédalage des bras provoquait une inhibition significative des réponses observées lors de réflexe H du soleus (Frigon et al., 2004). Finalement, il a été montré que cette diminution du réflexe H apparaissait de manière corrélé avec la fréquence du mouvement des bras (Hundza and Zehr, 2009). Ces résultats démontrent clairement que les bras peuvent influencer l’activité observée au niveau des jambes. Bien que l’influence inverse ait été peu évaluée, une récente étude montre que lors d’une tâche de pédalage simultanée des bras et des jambes, une diminution volontaire de la cadence des jambes provoquait également une diminution involontaire de la cadence des bras ainsi qu’une augmentation de la variabilité de celle-ci (Sakamoto et al., 2014, 2006b). La coordination AP chez l’humain est donc bien présente avec une influence qui semble être bidirectionnelle. Dans les sous-parties qui suivent, nous allons discuter de l’influence que peut avoir cette coordination AP lors d’activités locomotrices chez l’humain qu’elles soient de type quadrupède ou bipède.
2.1.2.1. Locomotion quadrupède
Durant les premiers mois de sa vie, le nourrisson humain va adopter une marche quadrupède (Freedland and Bertenthal, 1994; Patrick et al., 2012; Righetti et al., 2015). Toutefois, cette locomotion va être différente de celle observée chez l’animal puisque le nourrisson humain marche principalement sur les mains et les genoux et non pas sur les pieds. Malgré ces différences, les mécanismes de locomotion quadrupède observés chez le
bébé humain sont très proches de ceux des autres mammifères. En effet, une augmentation de vitesse est corrélée à une diminution de la durée du cycle principalement causée par une diminution de la durée de la phase d’appui alors que la durée de la phase de balancement reste relativement invariante (Patrick et al., 2012; Righetti et al., 2015). Bien que durant la première semaine de locomotion quadrupède chez le nourrisson, la coordination AP soit très variable, celle-ci devient très consistante dans les semaines qui suivent (Freedland and Bertenthal, 1994). A ce stade, les bébés utilisent une séquence de coordination latérale s’éloignant ainsi de ce qui peut être observés chez les primates non-humain mais se rapprochant de celle des autres mammifères (Patrick et al., 2012; Righetti et al., 2015).
Afin de mieux comprendre si cette différence entre le nourrisson et les primates non-humain provient de l’état peu avancé de développement du système nerveux à cet âge, la locomotion quadrupède a également été étudiée chez l’humain adulte que ce soit lors d’une marche pieds-mains (Patrick et al., 2009; Sparrow and Newell, 1994; Sparrow, 1989) ou genoux-mains (Patrick et al., 2009; Wannier et al., 2001). Dans les deux cas, une fois encore une augmentation de vitesse se faisait par une réduction de la durée du cycle et de la phase d’appui mais pas de la phase de balancement (Patrick et al., 2009; Sparrow and Newell, 1994). De plus, une coordination AP stable avec une séquence latérale était utilisée excluant ainsi l’hypothèse que les primates non-humains utilisent une séquence diagonale due à l’augmentation de l’importance corticale dans le contrôle neurophysiologique de la locomotion (Patrick et al., 2009).
Il est intéressant de noter qu’une pathologie chez l'adulte humain liée à l’équilibre dénommée le syndrome Uner Tan a récemment été décrite comme provoquant l’incapacité d'utiliser une forme de locomotion autre qu’une marche quadrupède sur les pieds et les mains (Shapiro et al., 2014; Tan, 2010). Cette pathologie a été retrouvée dans plusieurs familles résidant en Turquie ayant une atteinte au niveau vestibulaire et s’accompagnant souvent de déficience mentale. Une première description de la coordination AP dénote l’utilisation d’une séquence diagonale chez l’ensemble de ces patients (Tan, 2010, 2008, 2006) par opposition à la locomotion quadrupède chez l’humain sain. Toutefois, une étude plus récente est venue contredire ces résultats en réalisant une analyse cinématique
montrant qu’une séquence latérale chez ces patients était presque exclusivement utilisée et non diagonale comme il avait été précédemment proposés (Shapiro et al., 2014). Une meilleure caractérisation de la coordination AP chez des patients ayant le syndrôme Uner Tan pourrait permettre de mieux caractériser les mécanismes sous-jacents de la coordination AP chez l’humain.
2.1.2.2. Locomotion bipède
En plus de ces études sur la locomotion quadrupède chez l’humain, il a été aussi clairement démontré que l’homme maintenait une coordination AP lors de la marche bipède avec un balancement actif des bras (Dietz, 2011, 2002). En effet, deux forces interviennent dans le balancement des bras à savoir la gravité et la contraction musculaire au niveau de l’épaule et du coude (Pontzer et al., 2009). La coordination AP généralement adoptée lors de la marche bipède est un balancement du bras en anti-phase avec la jambe homolatéral (c’est-à-dire que le bras recule quand la jambe avance) et au même rythme que celle-ci (Wagenaar and Van Emmerik, 2000; Webb et al., 1994).
Il est intéressant toutefois de noter qu’à faible vitesse de locomotion (<2,7 km/h), l’humain adopte une autre forme de coordination AP (Craik et al., 1976; Donker et al., 2001; Webb et al., 1994). En effet, les bras vont alors avoir un plus faible mouvement de balancement mais avec une fréquence deux fois plus élevée que celle des jambes. Malgré cette différence de fréquence, une certaine forme de coordination AP caractérisée de 2:1 semble maintenue. En effet, le premier et le deuxième balancement du bras vont se faire en phase et en anti-phase avec la jambe homolatérale, respectivement (Craik et al., 1976; Donker et al., 2001).
Plusieurs études se sont intéressées à comprendre quel était le rôle du balancement des bras durant la marche (Meyns et al., 2013). Ce balancement permet notamment d’augmenter la stabilité. En effet, bien que ce rôle n’ait pas encore été clairement démontré lors d’une tâche de locomotion sans perturbation (Collins et al., 2009; Ortega et al., 2008), il apparait clair que le balancement des bras s’avère fondamental pour maintenir l’équilibre lorsque la stabilité est perturbée (Bruijn et al., 2010; Marigold et al., 2003; Pijnappels et al., 2010). Le
balancement des bras pendant la marche aurait également pour effet de diminuer le cout métabolique de la tâche (Collins et al., 2009; Ortega et al., 2008; Umberger, 2008; Yizhar et al., 2009). Finalement, les bras agiraient en anti-phase avec les jambes homolatérales pour contrer le moment rotationnel autour de l’axe vertical provoqué par les jambes durant la marche (Herr and Popovic, 2008).
Toutefois, il est tout à fait possible de marcher de manière bipède sans qu’aucun mouvement des bras ne soit observé (maintenu le long du corps par exemple) et l’importance de la coordination AP chez l’humain a donc été négligée. Cependant, même sans mouvement des bras, une activité rythmique des muscles du Teres major/latissimus dorsi (adducteur, rotateur médial et extenseur de l’épaule) et du deltoïde moyen (abduction de l’épaule) a tout de même été dénotée lors de la marche bipède (Ballesteros et al., 1965). De plus, cette activité était coordonnée avec le patron locomoteur suggérant qu’une coordination AP est toujours présente même lorsque le mouvement des bras n'est pas visible. Qui plus est, bien que le mouvement des bras ne semble pas nécessaire chez l’humain sain, il a été proposé que l’utilisation des bras pourrait se révéler particulièrement importante dans un état pathologique tel que la maladie de parkinson (Dietz, 2011), l’accident vasculaire cérébrale (Dietz, 2011; Klimstra et al., 2009; Stephenson et al., 2010) ou encore les lésions de la moelle épinière (Tester et al., 2012, 2011).
2.1.3. Utilisation du tapis roulant partitionné transverse
Des avancées importantes sur la compréhension des mécanismes de coordination gauche-droite ont été faites à l’aide d’un outil permettant de dissocier les vitesses gauche et gauche-droite : le tapis roulant partitionné (D’Angelo et al., 2014; Dietz et al., 1994; Forssberg et al., 1980; Frigon et al., 2015, 2013; Reisman et al., 2005; Torres-Oviedo et al., 2011; Yang, 2005). Pour étudier la coordination AP, quelques études ont également utilisé un tapis roulant partitionné de façon transverse (Figure 6) permettant de dissocier les vitesses des pattes antérieures et postérieures chez le chat ou chez l'homme (Akay et al., 2006; Cruse and Warnecke, 1992; MacLellan et al., 2013). Ce type de tapis roulant sera utilisé dans les études expérimentales de cette thèse.
Figure 6. Tapis roulant partitionné transverse.
Afin d’étudier la coordination AP, il est possible d’utiliser un tapis roulant partitionné transverse permettant de dissocier la vitesse des pattes antérieures et postérieures. Ce type de tapis roulant sera utilisé au cours des expériences de cette thèse.
En 1992, Cruse et Warnecke furent les premiers a utiliser un tapis roulant partitionné transverse chez des chatons intacts âgés de 4 mois (Cruse and Warnecke, 1992). Lorsque des vitesses différentes étaient utilisées entre les pattes antérieures et postérieures (de 0,3 à 0,46m/s), un même rythme était conservé entre les deux paires de pattes (Rythme 1 :1), peu importe que ce soit l’avant ou l’arrière du tapis qui ait une vitesse supérieure. Lors de la locomotion partitionnée, la durée du cycle employée était proche de celles observées lors de la locomotion non-partitionnée à 0,46m/s. En ce qui concerne la coordination AP, bien que les intervalles de phase aient été mesurés dans cette étude, une comparaison entre les conditions n’a pas été faite et toutes les valeurs ont été regroupées quel que soit la vitesse de locomotion. Toutefois, les auteurs ont essayé de comprendre l’influence que pouvait exercer les pattes antérieures sur les pattes postérieures et inversement en évaluant comment la durée des phases des pattes antérieures ou postérieures était modulée au regard de leur moment d’apparition dans le cycle des pattes postérieures ou antérieures, respectivement. Leurs observations suggèrent qu’il y aurait une influence bidirectionnelle avec une phase de balancement de la patte antérieure se déclenchant préférentiellement lorsque la patte postérieure homolatérale se rapprocherait de celle-ci et une phase d’appui