THÈSE
En vue de l’obtention du
DOCTORAT DE L’UNIVERSITÉ DE TOULOUSE
Délivré par l'Université Toulouse 3 - Paul Sabatier
Présentée et soutenue par
Lise RABILLER
Le 24 septembre 2020
Les opioïdes : un verrou à la régénération chez le mammifère
adulte ? Dialogue avec le système immunitaire et l'innervation
sensorielle
Ecole doctorale : BSB - Biologie, Santé, Biotechnologies
Spécialité : PHYSIOPATHOLOGIE
Unité de recherche :
STROMALAB - Cellules stromales, homéostasie, plasticité et réparation
tissulaire
Thèse dirigée par
Béatrice COUSIN et Cécile BERTHEZENNE
Jury
M. Emmanuel BOURINET, Rapporteur M. Patrick COLLOMBAT, Rapporteur
M. Ali MOJALLAL, Rapporteur
Mme Isabelle CASTAN LAURELL, Examinatrice Mme Béatrice COUSIN, Directrice de thèse
Mme Cécile DROMARD BERTHEZENE, Co-directrice de thèse Béatrice COUSIN et Cécile DROMARD BERTHEZENE
Remerciements
Collombat d’avoir accepté d’évaluer ce manuscrit et les travaux effectués durant mes 4
années de thèse. Je les remercie également pour la discussion très riche que nous avons pu
avoir durant la soutenance de thèse. Isabelle Castan, merci d’avoir accepté de faire partie du
jury et de l’avoir présidé, et merci pour tes conseils et ton aide tant quand j’étais en cours que
quand je suis devenue mini-enseignante parmi vous.
Cécile, merci de m’avoir donné une chance de venir travailler sur ce projet, et quel projet ! En
toute objectivité, c’est le plus chouette de tous les projets. J’ai beaucoup appris en travaillant
avec toi que ce soit en neurophysiologie ou sur un plan plus personnel lors de nos nombreuses
discussions au coin café. Merci de m’avoir écouté quand ça n’allait pas et de m’avoir remonté
le moral dans les moments de doutes et de difficultés inhérent à une thèse. J’ai adoré faire
équipe avec toi et porter ce magnifique projet le plus loin possible, il en vaut largement la
chandelle. Merci également pour l’autonomie que tu as su me donner et la confiance que tu
as placé en moi, qui m’ont permis de m’épanouir pleinement et de me faire évoluer de
stagiaire, à doctorante, à mini-chercheuse (j’arrive pas à le croire). Pour terminer je souhaite
également te remercier pour la découverte et l’initiation au monde de l’enseignement. Bon
courage pour la suite, et je suis persuadée que la suite de ce projet sera tout aussi belle !!! J
Merci pour tout, vraiment !
Anne, nos chemins se sont croisés en troisième année de licence. Tout a commencé par de
nombreuses discussions suscitées par mes interrogations, qui ont continué pendant ces 8
dernières années. J’ai été stimulé par chacune d’entre, elles m’ont toujours émerveillé et
motivé à donner le meilleur de moi-même. Votre dévouement pour ce métier (que ce soit
dans la recherche ou dans l’enseignement) m’a porté pendant toutes ces années et a
entretenue ma passion pour ce monde (un peu fou) de la recherche ! Merci d’avoir su me faire
confiance pendant toutes ces années, et de m’avoir donné les outils pour que je puisse avoir
(un peu plus) confiance en moi dans ce monde jonché de perpétuel doute. Merci pour tout !
Louis, merci de m’avoir ouvert les portes du STROMALab il y a de ça 6 ans maintenant. J’ai eu
la chance de grandir et m’épanouir dans ce laboratoire, professionnellement bien sûr mais
également personnellement. Mon chemin a été ponctué par de nombreuses discussions
science, qui m’ont poussé à remettre les dogmes en question et poussé dans mes
retranchements, et pour tout ça, merci.
Merci à tout(e)s les STROMALabien(ne)s pour votre soutien quotidien mais également d’avoir
rendu ce long chemin plus agréable ! Corinne, pour ta (très précieuse) aide en imagerie.
Manue pour tes conseils et ta patience pour m’expliquer les mystères de la biologie
moléculaire. Jean Gérard pour nos discussions personnelles et tes mots d’encouragement.
Sophie B pour nos discussions philosophiques (et pour les autres qui l’étaient moins, sans en
citer …) dehors sur la terrasse en pause autour d’un café. Nico pour ta bonne humeur
constante. Mélanie pour ton calme et ta bonne humeur. Jenny pour ta bonne humeur, tes
conseils au labo et dans mes débuts de mini-enseignante. Sophie D, merci de m’avoir supporté
dans mes débuts au cytomètre (tard le soir parfois), et merci pour les indénombrables
discussions en bas à Rangueil qui ont su me remotiver quand ça n’allait plus trop. Yannick,
merci pour avoir toujours une réponse quand il faut m’aider sur les commandes en biochimie
ou quand il faut m’aider à trouver un produit en biologie moléculaire. Elodie « i » pour m’avoir
donné les clefs de ce super chouette projet il y a 6 ans (j’ai bien pris soin de ce gros bébé et je
me suis éclatée). Isabelle A, pour être toujours motivée quand il s’agit de science et de la
partager. Merci pour ton aide depuis le Master ! Philippe et Paul pour votre bonne humeur
en duo. Virginie RG, merci d’avoir partagé un bout de route sur le projet immuno avec nous
et d’avoir passé autant d’heure au cytomètre, heureusement que tu étais là ! Isabelle merci
d’avoir su gérer mes requêtes de dernière minute et avoir toujours su trouver le dossier
magique contenant les informations que je cherchais. Suzy j’ai au moins glissé ma tête 1500
fois au coin de ta porte en 6 ans, alors merci d’avoir géré mes nombreuses demandes de
dernière minute en gestion qui m’ont à chaque fois sauvé la mise !
Mais je voudrais aussi remercier,
Mimi, merci pour tes conseils de manière générale, merci mille fois de m’avoir donné tous les
meilleurs conseils de bonne conduite en laboratoire, de m’avoir expliqué soigneusement
toutes les bases de la culture cellulaire, et de m’avoir aidé un nombre incalculable de fois en
biologie moléculaire.
gestes de chirurgie (pas merci pour les supers photos de moi avec les lunettes loupes en pièce
sacrifice ahah). Tu m’as ouvert la voie sur tant de manips ! Merci mille fois pour tout ça, je te
dois beaucoup. Merci d’avoir rendu les séjours en zones plus sympas, merci d’avoir toujours
eu la solution à d’innombrables problèmes rencontrés, et merci pour ta bonne humeur !
Clément, merci pour la tonne de seringue/min que tu es capable de faire, pour ton aide sur
les manips capsa (pas les plus simples…), pour tes solutions trouvées en 1 minute pour régler
des problèmes (toujours) de dernière minute et pour ton aide de régisseur professionnel lors
de la soutenance. Reste multitâche !
Béa, merci pour tout. Pour l’aide en cytométrie (durant des heures, et ce depuis le Master 2),
pour l’aide lors de la rédaction de la demande FRM, d’abstracts ou encore dernièrement de
ma thèse. Mais aussi pour le coaching perso dans les moments durs (de rédaction
entre-autre), pour les « coups de pieds aux fesses » pendant les coups de mou, et de m’avoir aidé à
porter ce (très chouette) projet immuno depuis toutes ces années.
Marielle, assieds-toi faut que j’te parle… merci pour toutes les questions que tu m’as posé
auxquelles je n’avais souvent aucune réponse à te donner (ahah) et merci pour ce duo exclusif
que nous avons formé en pharmacie, autour de lipectomies, d’aliquots de Naloxone, ou de
supers reprises de Diam’s. Je me rappellerai soigneusement de tous les conseils précieux que
tu m’as partagé et merci pour tes encouragements pendant toutes les étapes un peu rude
d’une thèse !
Luc, merci pour les conseils et la précieuse aide sur le projet neuro. J’ai été ravie de partager
un bout de chemin et projet avec vous.
Audrey C, merci pour ta douceur et tes remarques toujours constructives et bienveillantes sur
le projet. Merci pour tes encouragements depuis le Master, ça ne parait rien, mais ça
réchauffe dans les moments difficiles. Je suis ravie d’avoir pu faire quelques expériences en
collaboration avec toi et Damien, les résultats sont très intéressants et j’espère qu’ils auront
droit à une petite suite !
Coralie et Amandine, merci pour votre bonne humeur toujours au rendez-vous et vos conseils
sur la vie en thèse/en post doc/de chercheur. Amandine, j’espère qu’après ces mois
incertains, tu me feras re-voyager comme tu l’as fait l’année dernière. Je garde en mémoire
nos discussions autour d’un peu de science et de beaucoup d’autres choses. Que la force des
fascias soit avec vous pour longtemps ! J
Audrey V, merci pour ta franchise et merci de m’avoir fait autant rire, merci de m’avoir
regardé avec ce regard qui dit « mais Lise tu fais exprès là ? », quand j’avais un petit bobo (ou
que j’étais presque en train de mourir très objectivement…) Merci de m’avoir aidé à
relativiser, merci pour tous tes conseils sur la façon de vivre une thèse et la recherche en
général, ne change rien !
Claude K (chef !) et Etienne M pour vos conseils (toujours) avisés que ce soit en enseignement
ou en recherche, et pour m’avoir fait rire beaucoup de fois avec vos anecdotes d’étudiants… J
Lionel M et Bruno G pour votre disponibilité, votre aide très précieuse et votre investissement
sur le projet douleur/régénération. Merci de m’avoir formée un peu aux techniques d’étude
du comportement et à la physiologie des opioïdes !
Agnès C et Marie pour votre aide sur le projet immuno/régénération. Marie, on se souviendra
des manips lipidomiques qui nous ont donné du fil à retordre… Merci pour ton aide précieuse,
sans toi, j’aurai abandonné à l’étape d’extraction ahah J
Marie-Laure, « caféééééé ? », merci pour ta patience dans ma formation cytométrie, merci
pour les nombreux encouragements (jusqu’à exhiber Mini !!!), merci d’avoir été là tout
simplement. Ta joie de vivre et les nombreuses discussions qu’on a eu m’ont fait avancer j’en
suis plus que persuadée. On se retrouvera et je t’attends (encore, round 2) à Montréal ! J En
attendant continue d’animer ce bon vieux STROMAcomité des fêtes comme il ce doit !
Nono l’affro, que dire. Merci pour ta bonne humeur et pour tous les fous rires qu’on a pu
dans tout l’open space (oui on t’a vu ne mens pas !). N’oublie pas, on ne désespère pas de la
situation, on la laisse glisser (un peu comme quand tu fais un bon vieux moonwalk).
Loïc (Alias l’échappé), Hélène, « yyyyyeeeesssss », le clan des trois Dr, crus 2016, mes
camarades de promo, on a été dans la même galère (et dans la même super aventure à la fois)
depuis le début ! Je vous souhaite une belle suite d’aventure en science ou ailleurs, on se
croisera très certainement ! Loïc, merci pour ton humour (non je déconne :P), on a partagé de
nombreuses soirées au labo et certaines dans les bars (quand tu ne t’échappais pas), ta
détermination et tes grandes qualités en tant que pharmacien ET scientifique te feront aller
très loin j’en suis intimement convaincue. Hélène, peu importe où ta route ira après cette
année, en science ou ailleurs, je te souhaite une belle réussite !
David, Chloé, Margot, on ne s’est pas croisé longtemps, mais nul doute qu’on se serait bien
entendu ! Vous apportez de la légèreté au labo, restez comme vous êtes !
Léa, pour ta douceur et ta bonne humeur toujours au rendez-vous, toujours motivée pour
aller décompresser et boire des coups, ce fut un plaisir de partager un petit bout d’aventure
avec toi.
Silveric, stagiaire de choc. T’as su canna(lise)r, moi et ma phobie des centrifugeuses, et ça, ce
n’est pas rien ! T’as été d’une aide très précieuse pendant ces deux dernières années lors de
tes deux stages ici. Tu as essuyé d’un coup de main toutes les choses affreuses que je te
donnais à faire… (ahah, je plaisante !). J’espère que le projet a su te plaire et je te souhaite
que de belles choses pour la suite ! On aura l’occasion de se recroiser autour d’une bière, je
n’en doute pas !
Damien, merci pour ton aide quand il s’agit de faire des bêtises, et merci pour ton humour
toujours au sommet (il réchauffe les cœurs gelés par le froid glacial Canadien raconte les
légendes !). Chercheur brillant que tu es déjà, je sais que la suite sera belle et constructive
pour toi, et de toute façon, on aura le temps de se raconter tout ça autour de supers bonnes
poutines (ou tarte citron meringuée :P) futur copain de McGill J ! Dernière ligne droite, t’es
Éclate-toi, la soutenance n’est pas du tout qu’un mauvais moment à passer ! N’oublie jamais
que si tu as des questions en termes d’immigration, je suis là même si je suis aussi larguée que
toi sur le sujet ahaha…
Adèle, je ne sais par où commencer. Merci d’avoir poussé les portes de STROMALab, cette
aventure n’aurait jamais eu le même goût sans toi dans les parages. Je te remercie pour ton
soutien sans faille et pour ta bonne humeur inégalable ! T’es la best partner in lab ever, la best
partner in bière at lab ever (c’est presque comme « lab », mais tu rajoutes « bière » à côté) et
j’espère bien croiser ta route en science ou ailleurs ! Mais je n’ai pas trop de doute
là-dessus J. Je sais aussi que tu vas nous faire une super thèse (ça va aller comme sur des
roulettes héhé), t’as toute l’étoffe d’une chercheure aguerrie (curieuse, intelligente,
travailleuse, n°1 au moonwalk dans les couloirs et j’en passe des bleus et des pas fraîches) et
j’espère vraiment être là pour voir la concrétisation de ton travail acharné (plzzz envoie moi
un ticket VIP pour assister aux coulisses de cette préparation) ! Surtout, reste comme tu es,
ce monde a besoin de gens comme toi (et moi aussi d’ailleurs) ©. PS : tu sais où me trouver à
Montréal, si jamais……….
Philippe Gongora, mon professeur d’SVT (science de la Vie surtout, et de la Terre), de la
seconde à la terminale S (spé bio inclus !), qui m’a fait découvrir le monde passionnant de la
biologie et qui a (j’en suis intimement convaincue), largement contribué à m’amener là où je
suis aujourd’hui. Merci d’avoir répondu présent le jour de ma soutenance, ça m’a beaucoup
touché, et merci de m’avoir donné goût à la biologie si tôt. Je n’oublierai pas vos qualités,
parmi lesquelles la pédagogie fait partie.
Enfin,
Laurette, Victor, mes acolytes (et quels acolytes ©) de mes premiers jours sur ce sol
Toulousain. Plus de 15 ans que ça dur, et ça ne va pas s’arrêter de si tôt ! On a « grandi »
ensemble, fait pleins de bêtises ensemble (ça reste entre nous), partagé plein de choses
ensemble. On se connaît par cœur, et vous avez toujours été là pour moi, dans les moments
durs comme dans les beaux, et cette page me permets de verbaliser (peut-être pour la
faille dans beaucoup d’étapes, et je ne vous remercierai jamais assez pour ça. Je vous aime
fort, pour très longtemps, des amitiés comme ça sont écrites et faites pour durer une vie ©.
Billou, malgré la séparation géographique, tu as été un de mes premiers repères dans cette
nouvelle vie Toulousaine. A chaque fois qu’on se voit c’est toujours aussi cool, même si tu
rentres quand je m’apprête à repartir, je sais qu’on continuera à se voir pour encore de
nombreuses années.
Montas la Zup, Hugro et Thidou, qu’est-ce qu’on a pu rigoler en seconde, en cours d’svt ou
d’espagnol. C’est d’ici que tout part, et je suis heureuse de pouvoir encore rigoler aux éclats
avec vous 12 ans plus tard. Loulou, nos chemins se sont brièvement croisés en 4
èmependant
ce fabuleux voyage scolaire dans la fin fond de l’Espagne, mais tout à réellement prit sens en
1
èreS4, et à la fac, copine de Biologie. Shirley, si j’ai eu mon Bac c’est surement grâce à tes
fiches et à ta façon de me raconter la Biologie. Notre amitié ne se résume pas à ça, en sont
témoins les nombreux moments qu’on a partagé depuis !
Célia, Cyrine, Inès, Marion et Sara, mon (super et meilleur) gang de biologie. Mes supportrices
des premières heures sur les bancs de la fac, vous m’avez toujours soutenu et pour ça je ne
vous remercierai jamais assez. Merci de m’avoir écouté parler de cette thèse, de m’avoir
regardé manger/dormir/respirer « régénération/opioïdes », de m’avoir toujours dit que je
pouvais le faire et d’avoir été là le jour de la concrétisation de tout ça. Vous avez rendu cette
thèse plus légère grâce à tous ces moments passés ensemble à côtés de certaines longues
journées au laboratoire, à toutes ces soirées, à tous ces voyages aux quatre coins du globe et
surtout à tous ces moments de rigolade interminable. On a partagé tellement de choses, et
on me dit dans l’oreillette que ce n’est que le début ! Notre route va continuer longtemps
ensemble je n’en ai jamais douté, elle sera ponctuée par tout autant de bon moments (et bien
plus encore) qu’on a su déjà partager, et ce, même si je pars de l’autre côté de l’océan (je vous
y attends secrètement) ©©© - Restez toute comme vous êtes, j’ai vraiment de la chance de
vous avoir rencontré. Je vous aime (très fort).
s’agit de ma connerie (oh combien encombrante) mais aussi de ce long parcours semé
d’embûches. Tu as été ma bûcheronne helper, toujours là pour m’aider à soulever des
montagnes (even if je n’ai pas la force requise) lors de ce long chemin, et me conseiller quand
j’en avais besoin (c’est-à-dire tous le temps, you know). Continus de tracer ta route dans ton
domaine, tu excelles et c’est beau à voir, tu as tellement de qualité, be confident (et je suis
toujours là si tu as besoin J). On se chamaille comme on s’aime et c’est ça le plus important.
Still the sœur you are, j’ai besoin de toi malgré ce que je fais croire sometimes© Love you gros
comme ma connerie (imagine un peu).
Papa, Maman, la liste de ce pourquoi je vous remercie risquerait d’être aussi longue que cette
thèse alors je vais essayer de faire précis/concis… Merci pour toute votre aide depuis toutes
ces années d’études, si je suis là aujourd’hui c’est en grande (pour pas dire entièrement) grâce
à vous ! Vous m’avez inculqué tellement de jolies valeurs pour évoluer dans ce monde. Merci
d’être fiers de moi, et merci de m’avoir écouté parler biologie (= chinois) avec des étoiles dans
les yeux ! Vous m’avez toujours poussé à faire ce qui me plaisait, et à me dire que j’étais
capable de le faire, c’est chose faite ! Je vous aime fort fort fort©.
Thibault, (Choupi ©), tu as su rendre cette année tellement agréable (et je pèse vraiment mes
mots). Partager ce magnifique début d’une longue aventure avec toi, je n’aurai pas pu
imaginer mieux. Tu me fais rire, tu m’apprends des millions de choses (reste toujours aussi
curieux !), on s’écoute et ON avance ENSEMBLE. Quand je regarde tout ce qu’on a vécu, je sais
que la suite sera forcément belle, drôle, et pleine d’amour à tes côtés. Tu m’as supporté,
porté, et encouragé pendant toute cette dernière ligne droite, et je te remercie vraiment fort
mieux et plus vite pour ça J. Let’s go to our best life, first stop: Montréal. Tu m’apaises et me
rends la plus heureuse du monde Thibault Bru, je crois que des simples mots ne suffisent plus
à décrire ce que je ressens. Je t’Aime avec un grand A, gros comme la terre ©.
Table des matières
TABLE DES MATIERES ... 1 ABREVIATIONS ... 3 TABLE DES ILLUSTRATIONS ... 7 RESUME SCIENTIFIQUE ... 9 RESUME GRAND PUBLIC ... 12 INTRODUCTION ... 13 CHAPITRE I. DE LA REGENERATION A LA CICATRISATION. ... 13
I Régénération : modèles d’étude et étapes précoces ... 14 A Généralités ... 14 B Les espèces modèles servant à l’étude de la régénération ... 14 C Les étapes précoces des processus de régénération ... 18 II De la perte de la capacité de régénération à la cicatrisation : cas du mammifère adulte ... 23 A La régénération chez le mammifère ... 23 B La cicatrisation ... 27 CHAPITRE II. INNERVATION ET REGENERATION ... 29
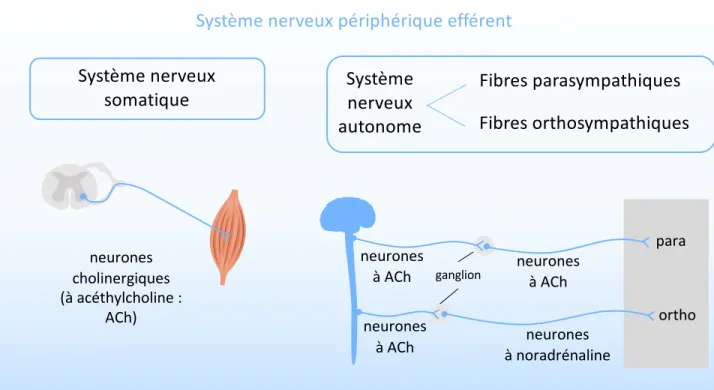
I Organisation du système nerveux ... 29 A Le système nerveux périphérique afférent ou sensoriel ... 30 B Le système nerveux périphérique efférent ou moteur ... 32 C Les boucles sensori-motrices ... 33 II Le système nerveux contrôle la régénération chez les espèces non mammaliennes ... 34 A Ce que nous apprennent les invertébrés ... 34 B Ce que nous apprennent les vertébrés non mammaliens. ... 36 III Le système nerveux contrôle la réparation chez le mammifère ... 40 A Le système nerveux contrôle la régénération au stade néonatal. ... 40 B Le système nerveux contrôle la régénération chez le mammifère adulte ... 40 C Le système nerveux contrôle la cicatrisation chez le mammifère adulte ... 42 CHAPITRE III. SYSTEME IMMUNITAIRE ET REGENERATION ... 45
I Organisation générale et rôles du système immunitaire ... 45 A Le système immunitaire inné ... 46 B Le système immunitaire adaptatif ... 54 C Les différentes phases de la réponse inflammatoire au cours des processus de réparation ... 55 D Implication du système immunitaire au cours de la réparation ... 57 E Dialogue entre système nerveux et système immunitaire ... 63 CHAPITRE IV. OPIOÏDES ... 66
A Mécanismes moléculaires à l’origine de la nociception ... 67 B Méthodes d’évaluation de la douleur ... 68 II Les opioïdes ... 70 A Opioïdes endogènes et exogènes ... 70 B Récepteurs aux opioïdes et signalisation intracellulaire ... 72 C Effets des opioïdes sur la réponse inflammatoire ... 74 III Implication des opioïdes au cours des processus de réparation tissulaire ... 76
ETUDE EXPERIMENTALE ... 78
I Modèle d’étude des processus de cicatrisation et de régénération chez le mammifère adulte : le tissu adipeux inguinal sous cutané (TAsc) murin. ... 80 A Innervation du TAsc ... 80 B TAsc et cellules immunitaires ... 82 C Les cellules souches/stromales mésenchymateuses du TAsc ... 82 D ASCs et médecine régénératrice ... 83 II Effet(s) des opioïdes sur la réponse inflammatoire aiguë au cours des processus de régénération tissulaire. ... 86
A Contexte scientifique ... 86 B Démarche expérimentale ... 87 C Résultats et Interprétations ... 88 D Résultats complémentaires. ... 93 III Les nocicepteurs sont indispensables à la régénération chez la souris adulte. ... 97 A Contexte scientifique ... 97 B Résultats et interprétations ... 99 C Résultats complémentaires ... 104 5 Importance des voies nociceptives ascendantes ... 107 DISCUSSION ... 109
I Importance de la réponse inflammatoire au cours des processus de régénération ... 109 II Identification des fibres nerveuses qui contrôlent la régénération ... 114 III Dialogue entre le système immunitaire et le système nerveux au cours de la régénération. ... 118 IV Les capacités de régénération ont disparu au cours de l’évolution ... 119 A Mise en cause de la complexification du système immunitaire ? ... 119 B Mise en cause du système opioïde ? ... 120 BIBLIOGRAPHIE ... 123
Abréviations
15-dPGJ2 15-Deoxy-Delta-12,14-prostaglandin J2
LOX Lipoxygénase
AA Acide Arachidonique
ACh Acétylcholine
AMPc Adenosine MonoPhosphate cyclique
ARN Acide Ribonucléique
ASC Adipose Stromal Cell
ASICs Acid-Sensing Ion Chanels
ATP Adenosine TriPhosphate
BMP Bone Morphogenic Protein
CCL Chemokine C-C motif ligand
CD Cluster de Différenciation
CGRP Calcitonin Gene Related Peptide
CGRPRL Calcitonin Gene Related Peptide Receptor Like
COX Cyclooxygénase
CSH Cellule Souche Hématopoïétique
CSM Cellule Stromale Mésenchymateuse
CXCL Chemokin C-X-C motif ligand
DAMGO [D-Ala2,N-Me-Phe4,Gly5-ol]-Enkephalin acetate salt
DAMP Damaged Associated Molecules Pattern
DOR Delta Opioid Receptor
EAOs Espèces Actives de l'Oxygène
EGF Epihtelial Growth Factor
ERK Extracellular signal- Regulated Kinase
FALCs Fat-Associated Lymphoid cluster
FCγ Fragment Constant gamma
FGF Fibroblast Growth Factor
G-CSF Granulocyte Colony Stimulating Factor
GDNF Glial-Derived Neurotrophic Factor
GIRK G protein-regulated Inward Rectifying K+ channels
Hh Hedgehog
HMGB1 High Mobility Group Box 1
Hox Homéobox
HTM High Threshold Mechanoreceptors
IB4 Isolectine B4
ICV Intracérébroventriculaire
IFNγ Interféron gamma
IL Interleukine
ILC2 Innate Lymphocyte de type 2
IR Index de Régénération
KO Knockout
KOR Kappa Opioid Receptor
LB Lymphocyte B LOX Lipoxygénase LP Lipectomie LPS Lipopolysaccharide LT Lymphocyte T LTA4 Leucotriène A4 LTB4 Leucotriène B4
LTM Low Threshold Mechanoreceptors
M-CSF Macrophages Colony Stimulating Factor
MAPK MAP Kinase
MCP1 Monocytes Chemoattractant Protein 1
MCT1 Monocarboxylate transporteur isoforme 1
MCT4 Monocarboxylate transporteur isoforme 4
MEC Matrice Extracellulaire
MMP Métalloprotéases
MO Moelle Osseuse
MOR Mu Opioid Receptor
Mph Macrophages
MPO Myélopéroxidase
P2X3 Récepteur Purinergique
MRL Murphy Roth Large
nAG newt Anterior Gradient
NalM Naloxone Méthiodide
NET Neutrophil Extracellular Traps
Nf-kB Nuclear factor-kappa B
NGF Nerve Growth Factor
NK Natural Killer
NK-1 Neurokinine 1 (Substance P)
NOX NADPH Oxydase
OGF Opioid Growth Factor
Opr Opioid receptor
ORL1 Opioid Receptor Like 1
OSM Oncostatine M
PAMP Pathogen Associated Molecules Pattern
PDGF Platelet-Derived Growth Factor
PECAM Platelet Endothelial Cell Adhesion Molecule
PENK Pro enképhaline
PGD2 Prostaglandine D2
PGE2 Prostaglandine E2
PGF2 Prostaglandine F2
PGI2 Prostaglandine I2
PKA Protéine Kinase A
PKB Protéine Kinase B
POMC Proopiomélanocortine
PPARγ Peroxisome Proliferator-Activated Receptor gamma
PPRE PPARγ response element
RAGE Receptor for Advanced Glycation Endproducts
RCPG Récepteur Couplé aux Protéines G
ROC Regeneration Organizing Cells
RTK Récepteur Tyrosine Kinase
RXR Retinoid X Receptor alpha
S1P Sphingosine 1 Phosphate
SC Sous cutané
SDF-1 Stromal cell-derived factor 1
SI Système Immunitaire
SN Système Nerveux
SNC Système Nerveux Central
SNP Système Nerveux Périphérique
Srap starfish regeneration associated protease
STAT Stignal Transducer and Activator of Transcription
TA Tissu Adipeux
TAsc Tissu Adipeux sous-cutané
TGFβ Tissue Growth Factor-beta
TH Tyrosine Hydroxylase
TLR4 Toll Like Receptor 4
TNFα Tumor Necrosis Factor-alpha
tPA tissue-type Plasminogen Activator
TrkA Tropmyosin receptor kinase A
TRPA1 Transient Receptor Potential Ankyrin 1
TRPM8 Transient Receptor Potential Mucolipin 8
TRPV1 Transient Receptor Potential Vanilloid 1
TTX Tétrodotoxine
TXA2 Thromboxane A2
UCP1 Uncoupling Protein 1
uPA urokinase-type Plasminogen Activator
Table des illustrations
Figure 1. Espèces capables de régénérer : des invertébrés aux vertébrés.
Figure 2. Régénération morphallactique et épimorphique chez l’hydre.
Figure 3. Espèces capables de régénérer : les invertébrés.
Figure 4. Espèces capables de régénérer : les vertébrés non mammaliens.
Figure 5. Schéma illustrant les processus d’hémostase post lésionnelle.
Figure 6. Étapes précoces de la régénération : formation de l’épithélium de fermeture, mise en
place de la cape épithéliale et formation du blastème au cours des processus de régénération ; exemple du membre chez l’axolotl.
Figure 7. Mammifères adultes capables de régénérer.
Figure 8. Cicatrisation : exemple de la peau.
Figure 9. Organisation du système nerveux.
Figure 10. Les fibres sensorielles afférentes.
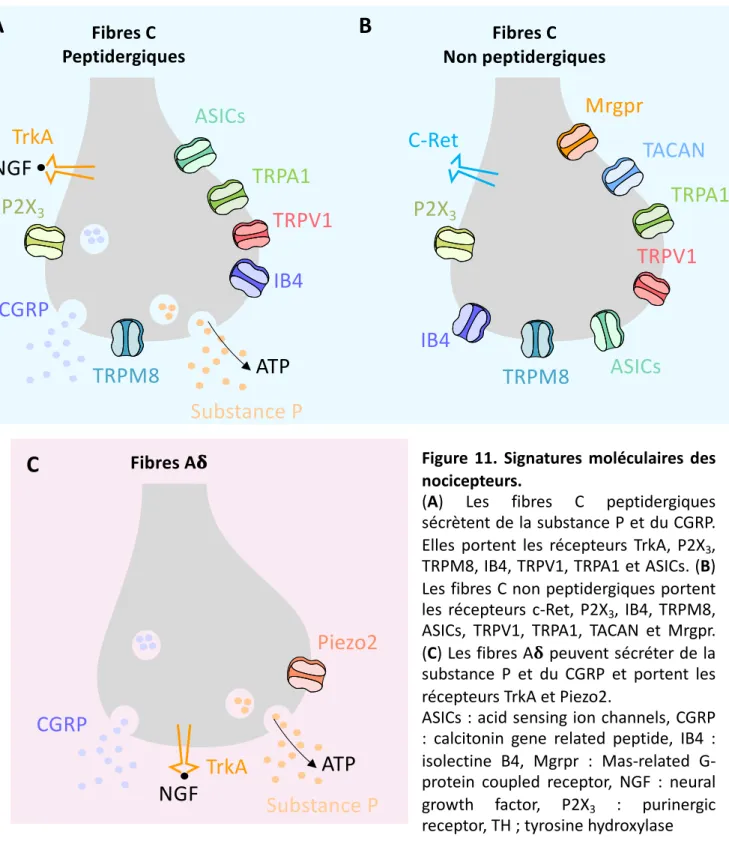
Figure 11. Signatures moléculaires des nocicepteurs.
Figure 12. Système nerveux périphérique efférent.
Figure 13. Arc réflexe polysynaptique.
Figure 14. Système nerveux et régénération de l’hydre.
Figure 15. Système nerveux et régénération du ver planaire.
Figure 16. Système nerveux et régénération de l’étoile de mer.
Figure 17. Système nerveux et régénération du membre chez la salamandre.
Figure 18. Système nerveux et régénération chez le poisson zèbre.
Figure 19. Système nerveux et régénération chez le mammifère adulte.
Figure 20. Publication d’articles scientifiques sur le thème « cellules immunitaires et
régénération »
Figure 21. Acteurs cellulaires et moléculaires du système immunitaire inné.
Figure 22. Médiateurs lipidiques dérivés de l’acide arachidonique.
Figure 23. Activation et la production d’espèces actives de l’oxygène par la NADPH oxydase 2
membranaire.
Figure 24. La réponse inflammatoire suite à une lésion tissulaire.
Figure 25. Acteurs cellulaires et moléculaires de la réponse inflammatoire : phase d’inflammation et de résolution de l’inflammation.
Figure 26. Schéma simplifié de la signature métabolique des macrophages pro- et
anti-inflammatoires.
Figure 27. La production d’EAOs est indispensable aux processus de régénération.
Figure 28. Expression d’IL1b au cours de la régénération de la moelle épinière chez le poisson
zèbre.
Figure 29. Corrélation entre l’évolution du système immunitaire et les capacités de régénération.
Figure 30. Voies centrales (supra spinales) de la douleur.
Figure 31. Voies ascendantes et descendantes impliquées dans la sensibilité nociceptive.
Figure 32. Canaux ioniques et activation des nocicepteurs.
Figure 33. Action des médiateurs périphériques de l’inflammation sur les terminaisons des nocicepteurs.
Figure 34. Méthode d’évaluation de la sensibilité nociceptive.
Figure 35. Signalisation moléculaire de la nociception.
Figure 36. Innervation efférente et afférente du TAsc.
Figure 37. Nombre de publications scientifiques sur le thème « Cellules mésenchymateuses du
TA et médecine régénérative».
Figure 38. Présentation du tissu adipeux sous-cutané et de la lipectomie.
Figure 39. Modèle de régénération induite du TAsc.
Figure 40. Résumé Graphique des résultats de l’article 1.
Figure 41. Apoptose cellulaire post LP en condition de cicatrisation (NaCl) ou de régénération
(NalM).
Figure 42. La NalM modifie le profil métabolique des cellules du front de lésion 3 jours après la lipectomie.
Figure 43. Implication de PPARγ au cours de la régénération du TAsc.
Figure 44. Étude à grande échelle de l’expression génique des macrophages dans différentes conditions de réparation tissulaire.
Figure 45. Effet d’HMGB1 sous sa forme réduit sur les ASCs de Tasc après lésion.
Figure 46. Les ASCs présentes sur le front de lésion 24 heures après la lipectomie, ont une morphologie différente entre les conditions cicatrisante et régénérante.
Figure 47. Les souris invalidées pour le précurseur des enképhalines (penk) régénèrent
spontanément leur TAsc.
Figure 48. Évaluation de la douleur chez les souris MRL et C57BL/6 en condition basale.
Figure 49. Évaluation de la douleur chez les souris MRL et C57BL/6 après injection intra-péritonéale de Morphine.
Figure 50. Évaluation de la douleur et la régénération du TAsc.
Figure 51. Dénervation sensorielle.
Figure 52. Dénervation sensorielle 21 jours après traitement à la capsaïcine.
Figure 53. Résumé Graphique des résultats de l’article 2.
Figure 54. Effet de la capsaïcine sur la biologie du TA.
Figure 55. Effet du CGRP sur la réponse inflammatoire précoce induite par la lipectomie.
Figure 56. Niveau d’expression du récepteur au CGRP et de ses co-récepteurs dans les ASCs.
Figure 57. Effet du CGRP sur la prolifération et la migration des ASCs.
Figure 58. Effet de la substance P sur la régénération du TAsc et la migration des ASCs.
Figure 59. Implication des voies nociceptives ascendantes au cours des processus de
régénération ?
Résumé scientifique
L’étude des processus de réparation tissulaire constitue, de nos jours, un axe majeur de recherche dans le domaine biomédical. En effet, la capacité d’un tissu à régénérer après une lésion a été progressivement perdue au cours de l’évolution, laissant place au développement d’un tissu fibrotique associé à une perte de fonction, aussi appelé cicatrisation. L’étude de la régénération chez les espèces encore dotées de cette capacité, comme chez l’hydre, le poisson zèbre ou encore la salamandre, a permis de mettre en évidence le rôle substantiel du système immunitaire et de l’innervation. En revanche, la nature du verrou mis en place au cours de l’évolution, empêchant la régénération d’avoir lieu chez le mammifère reste très peu documentée. Des résultats publiés précédemment par mon laboratoire montrent qu’il est possible de déclencher les processus de régénération chez une souris C57BL/6 qui n’en n’est pas capable spontanément, grâce à l’administration d’un antagoniste des récepteurs aux opioïdes, la Naloxone Méthiodide. Les opioïdes exogènes comme la Morphine, en plus des opioïdes sécrétés de façon endogène après une lésion, sont utilisés depuis très longtemps pour prendre en charge la douleur péri-opératoire. Par ailleurs, les opioïdes sont décrits comme étant i) de puissants immunosuppresseurs et ii) capables d’agir sur les fibres sensorielles à l’origine de la perception douloureuse, en inhibant l’activité de ces dernières. Lors de ma thèse nous avons donc proposé que les opioïdes puissent constituer un verrou au processus de régénération chez les mammifères en empêchant la mise en place d’une réponse inflammatoire adéquate et/ou l’activation efficace des fibres sensorielles suite à une lésion. D’une part, nos résultats montrent, i) que la signature cellulaire (neutrophiles, monocytes, macrophages) et moléculaire (cytokines, chémiokines et médiateurs lipidiques) des phases précoces de l’inflammation post-lésionnelle permet de prédire l’issue de la réparation tissulaire (i.e cicatrisation versus régénération), ii) que les neutrophiles sont la source cellulaire d’espèces actives de l’oxygène (EAOs) requises pour permettre la régénération et iii) que les macrophages dérivés de l’hématopoïèse endogène du tissu adipeux sous cutané permettent au tissu de régénérer grâce à leur haut potentiel d’élimination des neutrophiles (aussi appelé efférocytose), contrairement aux macrophages d’origine médullaire qui, eux, favorisent la mise en place d’une cicatrice. D’autre part, nous montrons grâce à l’utilisation i) du test comportemental Von Frey classiquement utilisé dans le domaine de la douleur et ii) d’un outil développé au laboratoire basé sur la mesure de la pupille, que la régénération induite après un traitement à la Naloxone Méthiodide est associée à une perception douloureuse significativement augmentée. La douleur pouvant être un reflet de l’activation des fibres sensorielles, nous avons donc spécifiquement détruit ces dernières. Cette dénervation des fibres sensorielles inhibe la régénération induite après un traitement à la
Naloxone Méthiodide. Enfin, les fibres sensorielles semblent être indispensables en raison de leur sécrétion locale du neuropeptide CGRP, qui contrôlerait i) la mise en place de la réponse inflammatoire requise à la régénération et ii) le remodelage tissulaire en activant la migration des cellules mésenchymateuses vers le site de lésion. L’ensemble de ces résultats nous permet aujourd’hui de proposer comme traitement péri-opératoire/post-lésionnel, la co-administration de Morphine et de CGRP, permettant ainsi à la régénération tissulaire d’avoir lieu tout en gérant la douleur, chez le mammifère adulte.
English version :
Inhibition of regeneration mechanisms and induction of tissue fibrosis are classic outcomes of tissue repair in adult mammals. Because fibrosis leads to loss of tissue function, studying the processes of tissue repair remains a major issue in regenerative medicine. Studying regeneration in species with this ability, such as hydra, planarian, zebrafish or salamander, has highlighted the substantial role of immune system and innervation during regeneration processes. The nature of the locks developed during the evolution that prevent regeneration in mammals remains poorly documented. Previously published results from my laboratory showed that administration of an opioid receptor antagonist, also called Naloxone Methiodide, can induce tissue regeneration in a non-regenerative strain of mice (C57Bl/6). Exogenous opioids such as morphine, in addition to those being endogenously secreted after injury, have been used for decades in the management of perioperative pain. Opioids are also described as i) potent immunosuppressors and ii) able to act on the sensory fibers to silence electrical activity of these fibers. During my thesis, we hypothesized that opioids could be a lock for regeneration processes by preventing an acute and intense inflammatory response and/or the activation of sensory fibers after injury. On one hand, our results demonstrate for the first time in mice, i) that the cellular (neutrophils, monocytes, macrophages) and molecular (cytokines, chemokines and lipid mediators) signature of the early phases of post-lesional inflammation can predict the outcome of tissue repair (i.e scar healing versus regeneration), ii) granulocytes are the cellular source of reactive oxygen species required for regeneration, and iii) that, unlike classical macrophages derived from medullar hematopoiesis which promote scar formation after injury, macrophages derived from endogenous hematopoiesis of subcutaneous adipose tissue allow tissue regeneration thanks to their high neutrophil clearance potential after Naloxone methiodide treatment. On the other hand, by using the behavioral Von Frey test and the measurement of pupil diameter in order to assess pain perception, we also show that the regeneration induced after Naloxone Methiodide treatment is strongly correlated with an increase in pain perception. As pain depend on harmful signals detection by sensory fibers, we specifically destroyed these peripheral neurons. This denervation leads to the inhibition of previously induced tissue regeneration. Moreover, these sensory fibers appear to act through their
peripheral secretion of the CGRP neuropeptide. This molecule could control the establishment of adequate inflammatory response and initiate efficient tissue remodeling by activating mesenchymal cells migration to the injured area. Altogether, our results allow us to propose co-administration of Morphine with CGRP as a perioperative/post-lesional treatment allowing tissue regeneration and pain management.
Résumé grand public
La capacité à régénérer a été progressivement perdue au cours de l’évolution au profit de la cicatrisation qui, bien que beaucoup plus rapide, conduit à une perte fonctionnelle du/des tissu(s) lésé(s). Limiter la mise en place d’un tissu cicatriciel en identifiant et promouvant les mécanismes de régénération constitue donc l’enjeu majeur de la médecine régénérative. Sur un modèle murin d’agression tissulaire massive, nous montrons que i) une réponse inflammatoire importante mais transitoire est requise pour permettre la régénération de l’organe lésé et ii) le signal douloureux généré au niveau du site de lésion, permet la sécrétion locale de molécules pro-régénérantes. Ces résultats originaux nous permettent de proposer une stratégie thérapeutique pour prendre en charge la douleur après une lésion, tout en permettant la régénération chez le mammifère.
English version :
The ability to regenerate has been lost during evolution since organisms such as hydra or salamander are able to rebuild an entire organ after ablation while the mammal is not. Instead, the adult mammal displays scar healing, a much faster repair process but that leads to an irreversible loss of tissue functions. Using a model of induced-regeneration after massive resection in rodents, we demonstrate that i) an acute (massive but transient) inflammatory response is essential for a complex tissue regeneration and ii) the detection of pain signal by sensory fibers within the injured tissue induce the local secretion of pro-regenerative molecules. These original results allow us to propose a therapeutic strategy allowing tissue regeneration and efficient pain management.
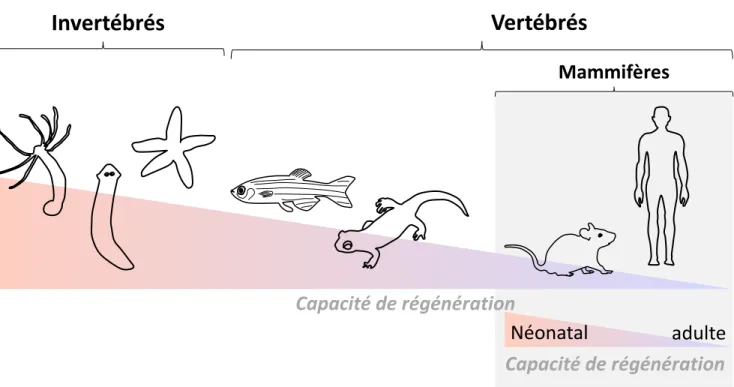
Figure 1. Espèces capables de régénérer : des invertébrés aux vertébrés.
De gauche à droite : Capacité de régénération chez les invertébrés (l’hydre, le ver planaire et l’étoile de
mer), les vertébrés non mammaliens (le poisson zèbre et la salamandre), et chez les mammifères (la souris
et l’homme). Les capacités de régénération sont décroissantes au cours de l’évolution et décroissantes au
cours de la vie chez le mammifère. (Adapté de Forbes et coll. 2014)
Capacité de régénération
Invertébrés
Vertébrés
Mammifères
Capacité de régénération
Néonatal
adulte
Introduction
Chapitre I. De la régénération à la cicatrisation.
Tous les êtres vivants sont capables à des degrés divers, de pouvoir, en réponse à une agression, réparer la partie du corps lésée. L’organisme peut être atteint à différents niveaux (tissus, organes, membres) et l’intensité de la lésion peut être variable (lésion superficielle, ablation partielle, ablation totale d’un organe ou d’un membre entier). Quel que soit le niveau auquel l’organisme est atteint et l’intensité du dommage, deux types de réparation littéralement opposés peuvent se mettre en place : une régénération ou une cicatrisation.
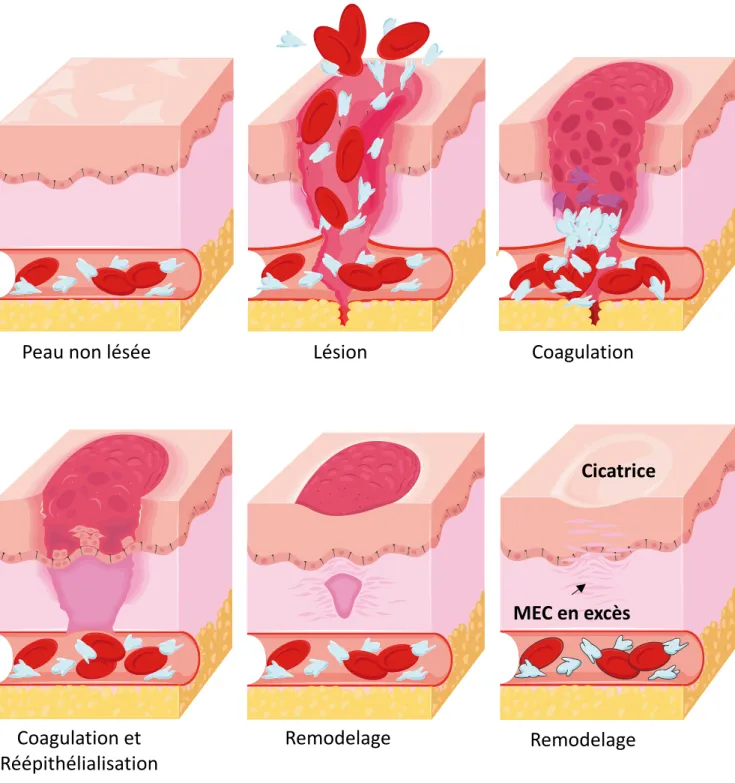
Selon l’Encyclopédie Universalis, la régénération désigne les phénomènes de réparation au cours desquels un individu retrouve son intégrité ; elle permet la récupération à l’identique de la forme et de la fonction de la partie lésée. Par exemple, chez le poisson zèbre, la régénération de la nageoire caudale après section permet de reformer les rayons osseux ainsi que la peau, les vaisseaux et les nerfs, et donc de récupérer une nageoire intègre et fonctionnelle2. Ce processus de régénération peut s’appliquer non seulement aux tissus, aux organes ou à un membre entier, comme la patte chez la salamandre, mais également de manière encore plus impressionnante, à l’organisme entier comme c’est le cas chez le ver planaire qui est capable de régénérer son corps à partir d’un fragment. Cette capacité de régénération a progressivement disparu au cours de l’évolution des espèces, jusqu’à devenir quasiment nulle chez les mammifères adultes2,3 (Figure 1). Après une lésion, on assiste chez ces derniers, à la mise en place de façon précoce et très rapide, d’un tissu conjonctif fibreux qui permet de refermer la plaie rapidement. Cette réponse à une lésion tissulaire correspond à la cicatrisation, qui aboutit systématiquement à la perte de fonctionnalité du tissu lésé, ainsi qu’à une incapacité à récupérer sa morphologie initiale.
Dans ce chapitre, nous allons successivement présenter i) les organismes / tissus modèles utilisés dans le domaine de la régénération, ii) les grandes étapes cellulaires et moléculaires des processus de réparation qui opposent la régénération à la cicatrisation et iii) les rares exceptions subsistant chez le mammifère adulte où la régénération persiste.
Régénération morphallactique
1h post lésion
2-4h post lésion
Pas d’apoptose Pas de prolifération cellulaire Remodelage Amputation de la tête
Régénération épimorphique
Amputation mi-gastriqueLes cellules souches interstitielles entrent dans le cycle
cellulaire 90 minutes Post-amputation
1h post lésion
4h post lésion
Figure 2. Régénération morphallactique et épimorphique chez l’hydre.
(A) La régénération morphallactique après amputation de la tête de l’hydre comprend un processus de
remodelage des cellules restantes sans prolifération cellulaire ni apoptose. (B) La régénération
épimorphique après amputation mi-gastrique de l’hydre met en jeu une prolifération de cellules
progénitrices pour former un bourgeon précurseur du membre/organe.
B
A
I
Régénération : modèles d’étude et étapes précoces
A
Généralités
Depuis plusieurs décennies, les études permettant d’identifier les étapes et les éléments clefs nécessaires à la régénération sont menées sur des organismes de complexité variable, allant des invertébrés (l’hydre, le ver planaire ou encore l’étoile de mer) aux vertébrés non mammaliens (tels que le poisson zèbre, et les amphibiens urodèles comme la salamandre, le triton ou l’axolotl). Si les mammifères sont capables de régénérer certains tissus au stade fœtal et néonatal, ils en sont en revanche majoritairement incapables au stade adulte (Figure 1).
La régénération est un phénomène complexe, initié lors d’une agression de l’organisme, et qui fait intervenir plusieurs acteurs cellulaires et moléculaires, coordonnés dans le temps et l’espace. Historiquement, deux types de régénération ont été définis par Thomas Hunt Morgan en 1901 : la morphallaxie et l’épimorphose4 (Illustré en Figure 2A et 2B avec l’amputation de la tête et du corps de l’hydre respectivement). La morphallaxie se définit comme une régénération tissulaire en l’absence de prolifération et d’apoptose cellulaire. Cette régénération se fait par remaniement des tissus restants
via des étapes de dédifférenciation et de re-différenciation cellulaire pour former des tissus nouveaux
par métaplasie (Encyclopédie Universalis). L’épimorphose, elle, se définit comme une régénération au cours de laquelle les tissus régénérés se mettent en place à partir d’un bourgeon cellulaire appelé blastème (que nous définirons mieux dans le paragraphe C). Ce blastème est formé par la prolifération et l’accumulation de cellules multipotentes indifférenciées à partir desquelles se remettront en place les différents tissus (Encyclopédie Universalis).
B
Les espèces modèles servant à l’étude de la régénération
1
Les invertébrés
i
L’hydre
L’hydre appartient à la famille des cnidaires. Depuis plus de deux cents ans, elle constitue un modèle d’étude de la régénération. Dans les années 1740, Trembley et collaborateurs (coll.) ont découvert que couper une hydre en plusieurs morceaux conduisait à la formation de plusieurs petites hydres (Figure 3A). Le corps de l’hydre est composé d’une tête avec des tentacules à une extrémité, et d’un pied à l'autre extrémité, reliés par une colonne creuse où se situe le système digestif. L’hydre ne contient que 3 populations cellulaires principales qui « s’auto-renouvellent » : Les cellules épithéliales de l’ectoderme, les cellules épithéliales de l’endoderme et les cellules souches interstitielles provenant majoritairement de l’ectoderme5,6. De nombreuses études montrent que tout fragment isolé du corps de l'hydre, pour peu qu’il soit composé de quelques centaines de cellules épithéliales, peut régénérer
Figure 3. Espèces capables de régénérer : les invertébrés.
(A) Régénération de l’hydre après amputation de la tête, du tronc ou du pied (Adapté de Rottinger et coll.
2017) La partie rose correspond à la partie qui régénère. (B) Régénération du ver planaire après amputation
dans divers plan le long de l’axe antéro-postérieur. Ce dernier peut régénérer un nouvel organisme en entier
avec la même orientation antéro-postérieure en une semaine (Kiyokazu 2003).
B
A
en une version miniature de l'animal7,8,9. De même que la dissociation des cellules qui composent l’hydre sont capables de donner naissance à une nouvelle hydre après réagrégation et réorganisation et ce, en seulement 4 à 7 jours10.
La régénération se met en place de deux façons différentes chez l’hydre ; par morphallaxie après toute amputation à distance du milieu du tube gastrique, et par épimorphose lorsque le plan de coupe est situé en position mi-gastrique (Figure 2). Dans le cas de l’épimorphose, les cellules situées sur le plan de coupe rentrent en apoptose et sécrètent le facteur Wnt3a11. L’activation de cette très conservée voie de signalisation Wnt permettra notamment de stimuler la prolifération compensatoire des cellules situées à proximité, pour permettre la régénération de la tête l’hydre. Cette voie de signalisation est contrôlée par une autre famille de gènes très conservée ; la famille des gènes Homéobox (Hox). Bien que le nombre d’études soit très limité concernant la réelle fonction de ces derniers au cours des processus de régénération, leur expression est augmentée chez l’hydre après amputation de la tête12.
La capacité fascinante qu’a l’hydre à régénérer après amputation est aussi dûe à un remaniement drastique de la matrice extracellulaire (MEC) dans les heures suivant l’amputation. Très rapidement, les composants de la MEC se rétractent pour permettre aux cellules de l’endoderme et de l’ectoderme de communiquer directement les unes avec les autres. Ces cellules vont alors sécréter activement des composés de la MEC et permettre aux cellules de migrer et reconstituer la partie manquante du corps de l’hydre13. Toute perturbation pharmacologique de la synthèse de cette MEC ou des interactions entre les cellules et la MEC, conduit à l’inhibition de la régénération de l’hydre13.
ii
Le ver planaire
La capacité de régénération exceptionnelle du ver planaire a été découverte il y a plus de cent ans par Thomas Hunt Morgan qui a observé que cet animal pouvait générer un nouveau ver à partir d’un simple fragment de son corps14 (Figure 3B). Ceci est possible grâce à la présence de cellules souches réparties le long de l’axe antéro-postérieur du ver planaire, les néoblastes, qui sont capables de se différencier en cellules matures spécifiques d’un tissu en fonction de leur position sur cet axe15,16. La meilleure illustration de l’importance de ces néoblastes est l’impossibilité pour un ver préalablement irradié (les néoblastes étant alors majoritairement détruits), de régénérer. L’injection d’une dizaine de néoblastes dans un ver planaire irradié suffit à ce dernier pour qu’il récupère ses capacités de régénération17. Après lésion, les néoblastes sont recrutés aux abords du site de lésion et prolifèrent, formant ainsi un amas de cellules indifférenciées (appelé blastème, que nous décrirons plus loin dans ce chapitre) qui permettront de reformer la partie manquante par épimorphose.
A l’échelle moléculaire certains facteurs de croissance de la famille des EGFs (Epidermal Growth Factors) régulent la prolifération des cellules souches (néoblastes) lors de la régénération du ver17.
C’est notamment la fixation de la Neuregulin7 sur son récepteur EGFR3 qui régule la division asymétrique des néoblastes et donc la taille du blastème pro-régénérant18 ; et l’utilisation d’ARN interférant codant pour Egfr3 supprime la capacité de régénération du ver planaire18. La voie de signalisation de ces facteurs de croissance peut se superposer à la signalisation Wnt et Hedgehog (Hh), qui sont, elles, requises pour maintenir la polarité antéro-postérieure, aussi bien pour le maintien de l’homéostasie qu’au cours de la régénération. Il a notamment été rapporté que la voie Wnt était requise pour la spécialisation de la partie postérieure du ver lors de sa régénération19,20. La production de Wnt est assurée par les cellules souches sous le contrôle d’un gène appartenant à la famille des gènes Hox : Dijslet21.
Le ver planaire ne fait pas figure d’exception concernant l’implication de la MEC au cours des processus de régénération. Quatre gènes codant pour des métalloprotéases (MMP : enzymes protéolytiques spécialisées dans la dégradation de la MEC) ont été identifiés chez le ver (contre plus de 20 chez le mammifère), et l’inhibition de ces gènes inhibe la régénération spontanée du ver planaire22.
iii
L’étoile de mer
L’étoile de mer est un échinoderme composé d’un disque central d’où partent 5 bras ou plus23. La cavité corporelle est constituée d'un cœlome complexe formé de trois composantes principales : le système digestif et gonadique, le système périhémal correspondant aux appareils vasculaire et lymphatique, et enfin un système hydraulique pour permettre la locomotion23. Cet animal est capable de régénérer aux stades larvaire et adulte. Chez l’adulte, une régénération est observée lors de la reproduction asexuée qui se fait par auto-amputation (phénomène de fission au cours duquel chaque partie redonne une étoile de mer entière) ou après une attaque par un prédateur23. Selon les équipes scientifiques mais aussi selon la classe d’étoile de mer utilisée, ce sont les mécanismes de régénération du bras, du système nerveux (SN), ou encore du système gastrique qui sont étudiés. L’étude de la régénération du bras de l’étoile est la plus courante et permet clairement de mettre en évidence trois phases lors de la régénération : i) une phase de fermeture de la plaie (que l’on pourrait assimiler à l’épithélium de fermeture, que nous présenterons plus loin dans ce chapitre), ii) une première phase de régénération précoce et iii) une seconde phase de régénération, dite tardive. La fermeture de la plaie correspond successivement à l’hémostase, la ré-épithélialisation et la formation d’un tissu de granulation provisoire formant un œdème. Après une à deux semaines, alors qu’aucun tissu régénéré n’est visible, la 2ème phase intervient pour permettre de reconstruire le bras à proprement parler. Enfin, trois à quatre mois post-amputation, le SN et les systèmes de locomotion se différencient pour finaliser la formation du bras24.
Les études s’intéressent, désormais, à l’aspect moléculaire de cette régénération. Elles montrent ainsi une activation transitoire du gène Srap (pour starfish regeneration associated protease) ainsi que
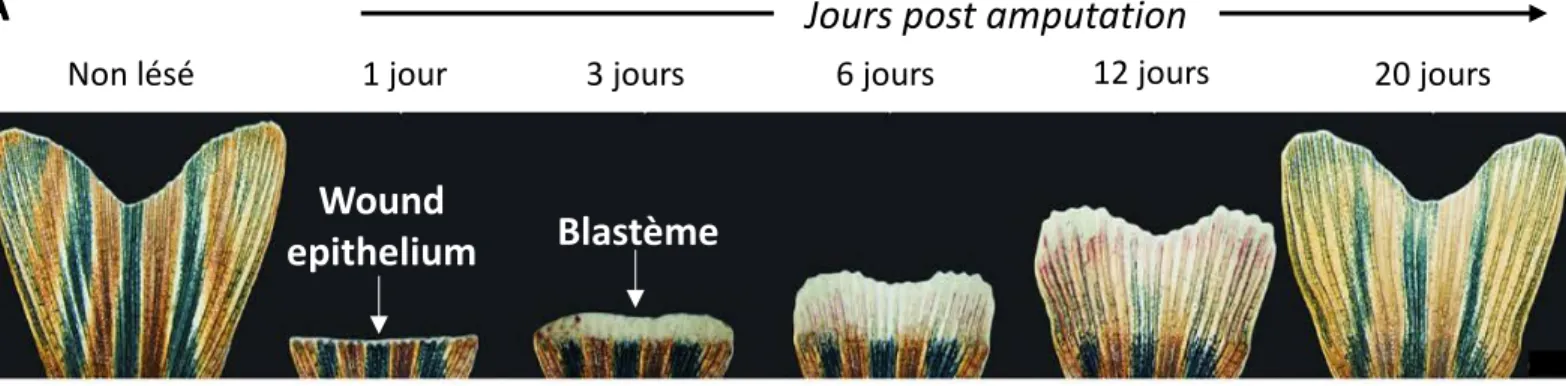
Figure 4. Espèces capables de régénérer : les vertébrés non mammaliens.
(A) Cinétique de régénération de la queue du poisson zèbre: de la mise en place du wound épithélium, en
passant par la formation du blastème jusqu’à la régénération (Sehring et coll. 2019). (B) cinétique de
régénération du membre après amputation chez la salamandre à différents temps post-amputation (Goss
1969).
A
B
Non lésé
1 jour
3 jours
6 jours
12 jours
20 jours
Jours post amputation
Wound
epithelium
Blastème
7
21
25
28
32
42
70
d’une dizaine de gènes Hox, que ce soit au stade larvaire ou adulte25,26,27, suggérant de nouveau, un rôle clef pour ces gènes. Cependant, ces études restent encore descriptives chez l’étoile de mer et ne permettent pas de mettre en évidence de véritables liens de cause à effet entre ces gènes et les processus de régénération.
Malgré des outils pharmacologiques et moléculaires limités pour étudier ces invertébrés, et bien que ces animaux soient éloignés de nous sur l’échelle de l’évolution, ils nous permettent d’aborder les grands principes de la régénération (morphallaxie et épimorphose), ainsi que les changements morphologiques qui s’opèrent au cours des grandes étapes de cette dernière. Au-delà de la capacité exceptionnelle qu’ont l’hydre et le ver planaire à régénérer l’entièreté de leur corps en seulement quelques jours, les différentes études sur ces organismes modèles mettent en lumière l’implication de voies de signalisation très conservées au cours de l’évolution (Wnt, Hh et gènes Hox). Ces voies de signalisation et gènes ont également des rôles déterminants au cours du développement de l’organisme, et il n’est donc pas surprenant de les voir impliqués au cours des phénomènes de régénération. Aussi, des événements de remodelage tissulaire ont commencé à être identifiés chez ces espèces, parmi lesquels le remodelage de la MEC, qui en étant « permissive », accompagne la migration et la prolifération des progéniteurs au cours de la régénération.
2
Les vertébrés non mammaliens
Même si cette capacité incroyable de régénération de l’organisme entier n’est pas retrouvée dans les groupes zoologiques plus évolués, certaines espèces au sein des vertébrés ont gardé cette rare aptitude à régénérer, à l’échelle des tissus, des organes ou d’un membre entier.
i
Le poisson zèbre
Les modèles classiques d’étude de la régénération chez le poisson zèbre sont des lésions de la nageoire dorsale, pectorale ou caudale. La nageoire pectorale, par exemple, repousse totalement par épimorphose en 20 jours après son amputation (Figure 4A). Chez cet organisme modèle, un autre organe fait l’objet de nombreuses études depuis quelques années : le cœur28,29. Ces modèles ont permis de décrypter, de nouveau, le rôle pivot joué par les gènes Hox et nous révèlent aussi l’implication de deux grands systèmes dans la régénération, le système nerveux (SN) et le système immunitaire (SI).
Chez le poisson zèbre, l’origine des cellules qui participent à la régénération est variable en fonction de l’organe ou du tissu lésé. Ces cellules sont issues i) soit d’une prolifération de cellules initialement différenciées (c’est le cas lors de la régénération cardiaque, les cardiomyocytes se dédifférencient et
prolifèrent pour participer à la régénération cardiaque30), ii) soit d’ une trans-différenciation de cellules différenciées (Lu et coll. décrivent une trans-différenciation des cellules a en cellules b dans le pancréas, après lésion de cet organe31) ou encore iii) d’une différenciation de précurseurs et/ou de cellules souches résident(e)s en cellules spécialisées spécifiques des différents tissus (comme c’est le cas pour les cellules souches satellites Pax7+ lors de la régénération du muscle32).
Les nombreux outils génétiques disponibles chez cette espèce facilitent grandement l’identification des acteurs moléculaires clefs ; ainsi, des expériences de gain et perte de fonctions ont montré notamment l’implication des voies de signalisation du FGF (Fibroblast Growth Factor) et de Wnt33,34 sous contrôle de l’acide rétinoïque.
ii
Les amphibiens : exemple des urodèles
Les amphibiens de l’ordre des Urodèles, auquel appartiennent la salamandre, le triton et l’axolotl, sont les vertébrés qui ont gardé la capacité de régénérer la plus fascinante puisqu’ils sont capables de régénérer entièrement et en 70 jours, une patte amputée (Figure 4B). Ces animaux sont également capables de régénérer, leur queue, leur moelle épinière, leur cristallin, ainsi qu’une partie du cœur35,36,37. Il est intéressant de noter que chez les urodèles, cette capacité de régénération existe au stade larvaire comme au stade adulte alors que chez les amphibiens de l’ordre des anoures, comme par exemple le Xénope, cette capacité disparait lors de la métamorphose38. La régénération du membre reste le meilleur exemple pour étudier un phénomène complexe de régénération. Les différents apports scientifiques de ce modèle seront développés ultérieurement dans ce chapitre, mais aussi dans les chapitres 2 et 3 portant sur le SN et le SI.
Les études menées chez ces espèces « pionnières » ont permis de clarifier les grandes étapes du processus de régénération, ainsi que les principaux acteurs cellulaires et moléculaires fondamentaux que nous allons présenter dans la partie suivante.
C
Les étapes précoces des processus de régénération
1
Mise en place de l’hémostase
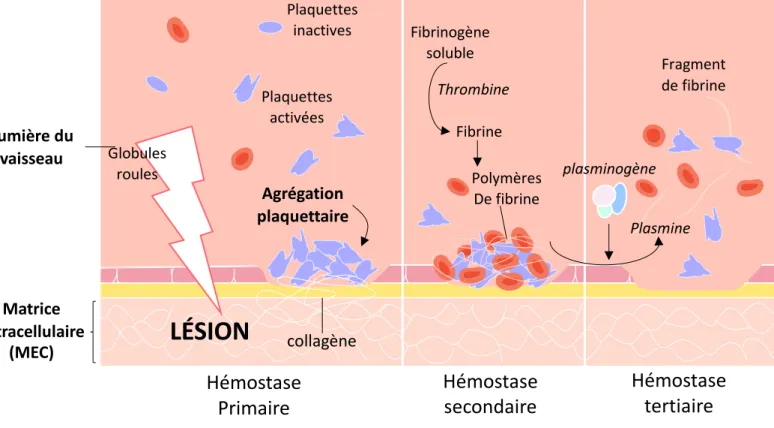
On désigne sous le nom d’hémostase, l’ensemble des phénomènes grâce auxquels l’organisme permet l’arrêt d’une hémorragie (Encyclopédie Universalis). La rupture de l’intégrité tissulaire suite à une lésion entraîne systématiquement des brèches vasculaires. La formation d’un caillot au niveau de ces dernières est donc indispensable pour stopper l’hémorragie. L’hémostase se déroule en trois temps que sont l’hémostase primaire, secondaire et tertiaire, grâce à un équilibre très complexe faisant
Figure 5. Schéma illustrant les processus d’hémostase post lésionnelle.
Suite à une lésion tissulaire, une brèche vasculaire va se créer. Une accumulation de collagènes et de
plaquettes va venir combler cette brèche, formant ainsi le clou plaquettaire lors de l’hémostase primaire.
Lors de l’hémostase secondaire, la thrombine va permettre la production de fibrine, pour consolider le clou
plaquettaire. Enfin, dans la phase d’hémostase tertiaire, le clou plaquettaire sera désagrégé,
majoritairement sous l’effet de la plasmine.
LÉSION
Hémostase
Primaire
Hémostase
secondaire
Hémostase
tertiaire
Plaquettes inactives Plaquettes activées