© Jérome Lamontagne, 2020
Effets de Bacillus subtilis et de Bacillus Licheniformis
utilisés comme probiotiques sur la concentration en
acides gras à chaîne ramifiée du lait et sur les
performances des vaches laitières
Mémoire
Jérome Lamontagne
Maîtrise en sciences animales - avec mémoire
Maître ès sciences (M. Sc.)
Effets de Bacillus subtilis et de Bacillus licheniformis
utilisés comme probiotiques sur la concentration en
acides gras à chaîne ramifiée du lait et sur les
performances des vaches laitières
Mémoire
Jérome Lamontagne
Sous la direction de :
Yvan Chouinard, directeur de recherche Rachel Gervais, codirectrice de recherche
ii
Résumé
L’objectif de ce projet de recherche était de déterminer les effets d’une supplémentation de probiotiques du genre Bacillus sur les performances de production de vaches de race holstein en mi-lactation et sur le profil en acides gras de leur lait. Pour ce faire, six vaches multipares porteuses d’une canule ruminale ont été utilisées selon un dispositif en chassé-croisé répliqué et randomisé. Les vaches ont ainsi reçu soit 200 g/j de poudre de lactosérum comme traitement témoin ou 200 g/j de BioPlus 2B (Chr Hansen, Milwaukee, WI), un probiotique commercial de Bacillus subtilis et de Bacillus licheniformis, représentant un apport quotidien de 6,4 × 1011 UFC et utilisant la poudre de lactosérum comme diluant. La
production laitière, la composition du lait et son profil en acides gras, les paramètres de fermentation ruminale et le microbiote ruminal ont été évalués. Les traitements n’ont pas affecté les performances laitières. L’utilisation du probiotique a cependant augmenté la concentration relative d’anteiso 13:0 et d’anteiso 15:0 et tendait à augmenter la concentration totale d’acides gras à chaîne ramifiée dans les matières grasses du lait lorsque comparé au traitement témoin. Les traitements n’ont pas modifié le pH, l’azote ammoniacal ou les concentrations en acétate, propionate et butyrate du rumen. Cependant, le probiotique a augmenté la concentration ruminale d’isovalérate et tendait à augmenter celle de l’isobutyrate. Cette expérience a permis d’observer la sensibilité du profil en acides gras du lait face aux modifications du microbiote ruminal. Les bactéries probiotiques du genre Bacillus pourraient donc être utilisées dans un protocole de maximisation des acides gras à chaîne ramifiée du lait pour permettre une augmentation du niveau de ces acides gras dans les produits laitiers.
iii
Abstract
The aim of the study was to determine the effect of a Bacillus-based direct-fed microbial on dairy performance of mid-lactating Holstein dairy cows and on their milk fatty acid composition. To this end, six multiparous cows fitted with a rumen cannula were used in a randomized replicated crossover design. Cows received 200 g/d of either whey powder, as a control, or BioPlus 2B (Chr Hansen, Milwaukee, WI), a commercial direct-fed microbial providing Bacillus subtilis and Bacillus licheniformis, representing a daily dose of 6.4 × 1011 cfu, and using whey powder as a carrier. Milk production, composition and fatty acid
profile, as well as ruminal parameters and microbiota were evaluated. Bacillus concentration in the rumen increased with the addition of the direct-fed microbial supplement. Treatment did not affect ruminal pH, NH3-N and concentrations of acetate, propionate, and butyrate.
However, direct-fed Bacillus increased ruminal concentration of isovalerate and tended to increase the concentration of isobutyrate. Treatments did not affect milk performance. The direct-fed Bacillus increased the relative concentration of anteiso 13:0 and anteiso 15:0 in milk fat, and tended to increase total concentration of branched-chain fatty acids as compared with control. This trial indicates that milk fatty acid composition is sensitive to ruminal microbiota modifications. Direct-fed Bacillus could be used as part of a standard protocol aiming to produce milk enriched in branched-chain fatty acids.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures ... vi
Liste des tableaux ... vii
Liste des abréviations ... viii
Remerciements ... x
Avant-propos ... xii
Introduction ... 1
Liste des ouvrages cités ... 3
Chapitre 1 Revue de littérature ... 4
1.1 La matière grasse laitière ... 4
1.1.1 Structure des composés lipidiques ... 4
1.1.2 Synthèse et composition de la matière grasse du lait ... 6
1.1.3 Structure et synthèse des acides gras à chaîne ramifiée ... 10
1.2 Importance des acides gras à chaîne ramifiée... 12
1.2.1 Les acides gras à chaîne ramifiée comme biomarqueur de la santé et du métabolisme de la vache laitière ... 12
1.2.2 Rôles en santé humaine ... 14
1.3 Facteurs influençant la production d’acides gras à chaîne ramifiée ... 17
1.3.1 Les microorganismes du rumen ... 17
1.3.2 Effet du stade de lactation et de la race sur les acides gras à chaîne ramifiée du lait ... 21
1.3.3 Effet de l’alimentation ... 22
1.4. Utilisation de bactéries du genre Bacillus comme probiotiques ... 25
1.4.2 Effet sur les populations microbiennes du rumen ... 33
1.4.3 Effet sur le profil en acides gras du lait ... 33
Conclusion ... 35
v
Chapitre 2 : Effects of direct-fed Bacillus subtilis and Bacillus licheniformis on production performance and milk fat concentrations of branched-chain fatty acids in mid-lactating
Holstein cows... 44
Résumé ... 44
Abstract ... 45
2.1 Introduction ... 46
2.2 Materials and Methods ... 47
2.2.1 Cows, Experimental Design, and Treatments ... 47
2.2.2 Sampling and Analysis ... 47
2.2.3 Statistical Analysis... 52
2.3 Results and Discussion ... 53
2.3.1 Microbial Analysis ... 53 2.3.2 Rumen Fermentation ... 54 2.3.3 Animal Performance ... 56 2.3.4 Milk FA Composition ... 57 Conclusion ... 61 References ... 62 Conclusion générale ... 66
Annexe A. Matériel supplémentaire ... 68
vi
Liste des figures
Figure 1.1. Schéma de l’acide palmitique (16:0). ... 4 Figure 1.2. Schéma d’un triacylglycérol où R’, R’’ et R’’’ sont des acides gras estérifiés ... 5 Figure 1.3. Schéma d’un phospholipide. ... 5 Figure 1.4. Synthèse et sécrétion des lipides du lait chez le ruminant. ... 6 Figure 1.5 Exemple de structure de différents isomères d’acides gras saturés à 15 atomes
de carbone. ... 10
Figure 1.6. Schéma de la synthèse de certains acides gras à chaîne ramifiée. ... 11 Figure 1.7. Origine et synthèse des acides gras à chaîne ramifiée du rumen. AGV = acides
gras volatils. ... 12
Figure 1.8. Représentation de l’association entre l’équation du pH ruminal prédit à partir du
profil en acides gras du lait de vache et le pH observé (a) et représentation des valeurs résiduelles en fonction des valeurs de pH prédites à partir de cette équation (b) obtenue de vache ayant reçu différents suppléments lipidiques. ... 13
Figure 1.9. Profil comparatif des principaux acides gras de la peau et du vernix chez
l’humain. ... 15
Figure 1.10. Consommation quotidienne par personne, selon un régime moyen
nord-américain, en acides gras à chaîne ramifiée (AGCR). ... 16
Figure 1.11. Schéma simplifié de la dégradation des glucides dans le rumen. ... 26 Figure 1.12. Taxonomie de deux espèces du genre Bacillus. ... 29 Figure 1.13. Effet d’une dose de 2,6 × 109 UFC/j d’un mélange de Bacillus subtilis et de
Bacillus licheniformis sur la production laitière et la teneur en matière grasse et en protéine du lait de brebis allaitantes... 31
Figure 1.14. Effet d’une dose de 1,0×1011 UFC/j de Bacillus subtilis natto (Peng et al., 2012,
et Sun et al., 2013) ou d’une dose de 2,0×1011 UFC/j de Bacillus subtilis (Qiao et al., 2010)
sur la production laitière corrigée à 4 % de matières grasses de vaches de race holstein. ... 32
vii
Liste des tableaux
Tableau 1.1. Teneur des principaux acides gras du lait de vache... 9 Tableau 1.2. Concentration en acides gras à chaîne ramifiée du lait de vache (g/100 g
d’acides gras) ... 17
Tableau 1.3. Description et principaux substrats de croissance de quelques bactéries et
archæa du rumen ... 19
Tableau 1.4. Liste des principaux organismes utilisés comme probiotiques dans
l’alimentation des animaux de ferme et leur concentration respective en acides gras à chaîne ramifiée (AGCR ) ... 27
Table 2.1. Ingredients and chemical composition of TMR ... 48 Table 2.2. Composition and administration rate of experimental treatments ... 49 Table 2.3. Relative abundance of selected rumen microbiome of cows receiving a direct-fed
microbial supplement ... 55
Table 2.4. Ruminal pH, NH3-N, and VFA profile of cows receiving a direct-fed microbial
supplement ... 56
Table 2.5. Dry matter intake, milk yield and milk composition of cows receiving a direct-fed
microbial supplement ... 57
Table 2.6. Milk fat concentration of odd- and branched-chain fatty acids for cows receiving
a direct-fed microbial supplement ... 59
Table 2.7. Yield of odd- and branched-chain fatty acids for cows receiving a direct-fed
viii
Liste des abréviations
Abréviations françaises
AGCIR Acide gras à chaîne impaire ou ramifiée
NDF Fibre au détergent neutre
AGCR Acide gras à chaîne ramifiée UFC Unité formatrice de colonies AGV Acide gras volatil
Abréviations anglaises
ADF Acid Detergent Fiber NEL Net Energy for Lactation
BCFA Branched-Chain Fatty Acid NRC National Research Council
BW Body Weight OBCFA Odd- and Branched-Chain Fatty Acid CFU Colony-Forming Unit OCFA Odd-Chain Fatty Acid
CON Control OM Organic Matter
CP Crude Protein PCA Primary Coordinate Analysis
DFB Direct-fed Bacillus subtilis and Bacillus licheniformis
PCR Polymerase Chain Reaction
DIM Days in Milk PUFA Polyunsaturated fatty acid
DM Dry Matter SCC Somatic Cell Count
FA Fatty Acid SD Standard Deviation
FAME Fatty Acid Methyl Ester SEM Standard Error of the Mean GC Gas Chromatography TMR Total Mixed Ration
MUN Milk Urea Nitrogen VFA Volatile Fatty Acid NDF Neutral Detergent Fiber
ix
Autant que savoir, douter me plaît.
-Dante
x
Remerciements
Ce mémoire étant le fruit de centaines d’heures de travail et de recherche passées en compagnie de personnes fabuleuses, j’aimerais profiter de l’occasion pour les remercier, eux qui ont su enrichir mon cheminement et qui m’ont permis d’accomplir ce travail.
D’abord un grand merci à Rachel Gervais pour ton professionnalisme, ta rigueur, ton écoute, ton enthousiasme et ta disponibilité. Tes conseils toujours à propos m’ont permis de devenir un meilleur professionnel. Merci de m’avoir toujours accordé du temps malgré ton horaire très chargé. Je garderai pour toujours une immense fierté de t’avoir eu comme directrice. Merci à Yvan Chouinard à qui je dois beaucoup. Merci de m’avoir accepté dans votre équipe comme stagiaire puis comme étudiant gradué. Je te serai toujours reconnaissant de m’avoir permis de vivre cette expérience de vie. Tes conseils et enseignements me resteront utiles tout au long de ma carrière.
Merci à Daniel Rico pour son aide durant toutes les étapes du projet. La touche microbiologique que tu as amenée au projet était vraiment un gros plus et m’a permis de développer un fort intérêt pour ce domaine de recherche. Tu as fait un excellent codirecteur. J’aimerais également remercier Jennifer Ronholm et son équipe d'avoir accepté d’effectuer les analyses métagénomiques de nos échantillons. Votre expertise fut un atout important de ce projet. Thank you.
Yolaine, Micheline et Nancy, merci pour votre professionnalisme et pour votre aide lors des analyses. Vous êtes des personnes très agréables à côtoyer et je garderai un excellent souvenir de vous.
Je remercie aussi les stagiaires d’été qui m’ont aidé aux différentes étapes du projet. Particulièrement à Claudia, ton aide fut très précieuse à plusieurs reprises. Muchas gracias. Merci à Marguerite, Stéphanie et René et les autres étudiants de notre équipe de recherche et du département, pour leurs bons conseils, leur bonne humeur et leur aide durant le projet. Un grand merci au Centre de recherche en sciences animales de Deschambault et à tout son personnel pour avoir permis la réalisation parfaite de la phase animale. J’aimerais remercier particulièrement Annie, Carl, Jonathan, Sébastien et Yan.
xi
Merci à Anne-Sophie pour ton support et ta présence tout au long de mes études. Je t’aime. À mes frères et sœurs, Jean-Philippe, Marie-Josée, Louise et Simon. Merci d’être présents pour moi. Vous êtes fantastiques!
À mes parents, merci de m’avoir appuyé tout au long de mon cheminement scolaire. Ce sont votre support et vos sacrifices qui m’ont permis de me rendre jusqu’ici. Je vous en serai éternellement reconnaissant.
xii
Avant-propos
Ce mémoire a été rédigé avec l’intégration d’un chapitre sous forme d’article scientifique dont je suis l’auteur principal. Les coauteurs de l’article sont les chercheurs R. Gervais, D. E. Rico, J. Ronholm, P. Y. Chouinard ainsi que l’auxiliaire de recherche C. M. Perdomo. L’article « Effects of direct-fed Bacillus subtilis and Bacillus licheniformis on production performance and milk fat concentrations of branched-chain fatty acids in mid-lactating Holstein cows » a été produit grâce à la collaboration de l’ensemble des coauteurs et sera soumis pour publication dans le « Journal of Dairy Science ».
1
Introduction
La qualité nutritionnelle des produits agricoles est recherchée à la fois par les consommateurs et les producteurs. Ces derniers visent à améliorer la désirabilité de leurs produits dans un contexte de diversification des habitudes alimentaires et de prise de conscience des consommateurs sur l'impact qu'ont les produits alimentaires sur leur santé.
Ces dernières années, plusieurs études ont permis d’outiller les producteurs laitiers sur des façons d’enrichir naturellement le lait de leurs vaches en acides gras bénéfiques pour la santé humaine comme les acides gras n-3 ou les acides linoléiques conjugués, souvent en modifiant l’alimentation des animaux (Chouinard et al., 2001 ; Leduc et al., 2017). Le lait, faisant partie intégrante de la diète canadienne et québécoise (AGECO, 2020), est déjà une source importante de ces acides gras et de plusieurs autres aux vertus souvent négligées ou méconnues comme les acides gras à chaîne ramifiée (AGCR ; Jensen, 2002). Ceux-ci, présents dans notre alimentation presque uniquement dans les produits provenant de l’élevage des ruminants, sont actuellement étudiés pour leurs bénéfices potentiels en santé humaine. En effet, les AGCR peuvent être employés autant comme agent thérapeutique, lorsqu’utilisés à forte concentration, que comme prébiotique lorsque consommés à plus faible dose (Yang et al., 2000 ; Ran-Ressler et al., 2008). Cependant, même dans le lait, la concentration de ces acides gras reste limitée, ne représentant habituellement que 1 à 2 % du gras laitier total (Vlaeminck et al., 2006).
Certaines bactéries probiotiques, comme les Bacillus spp., peuvent cependant synthétiser ces acides gras pour les intégrer à leur paroi cellulaire (Kaneda, 1991). Considérant qu’une part considérable des acides gras du lait provient de la formation et de la transformation des acides gras alimentaires dans l’environnement ruminal de la vache, on peut penser que la modification du microbiote ruminal, par exemple par l’ajout de bactéries probiotiques, pourrait permettre de modifier le profil en acides gras du lait en favorisant particulièrement les AGCR. Un essai effectué chez la brebis en lactation a également montré que ces bactéries peuvent améliorer les performances de lactation des ruminants (Kritas et al. 2006).
2
Par conséquent, l’objectif des travaux de recherche de ce mémoire est d’évaluer l’effet de l’ajout de probiotiques à base de Bacillus subtilis et de Bacillus licheniformis sur les performances de production et le profil en acides gras du lait des vaches laitières. À terme, ce projet permettra d’identifier les impacts d’un mélange commerciaux de ces probiotiques sur l’environnement ruminal, la productivité des vaches, ainsi que sur la concentration du lait en AGCR. Notre hypothèse est que des apports alimentaires d’un mélange de Bacillus
subtilis et de Bacillus licheniformis augmentent la production laitière et la teneur en AGCR
du lait. Si cette hypothèse est vérifiée, ce projet permettra de moduler la qualité nutritionnelle du lait commercial avec un impact limité sur le coût de production. Il sera ainsi possible d’augmenter les apports nutritionnels en AGCR pour les consommateurs en permettant le développement d’un marché de niche pour un lait contenant de plus fortes proportions de ces acides gras.
Afin de mettre en contexte et d’expliquer le raisonnement ayant mené à l’énoncé de notre hypothèse, la première section de ce mémoire, après une courte mise en contexte sur le gras laitier, traitera des AGCR du lait, de leur importance quantitative, de leurs effets sur le métabolisme et la santé et des moyens déjà étudiés pour moduler leur concentration dans le lait. Le second chapitre traitera de notre projet de recherche portant sur l’utilisation de Bacillus spp. comme probiotique chez la vache de race holstein en lactation.
3
Liste des ouvrages cités
AGECO. 2020. Faits saillants laitiers québécois. Consommation. http://www.groupeageco.ca/fsl/ (Page consultée le 8 mars 2020)
Chouinard, P. Y., L. Corneau, W. R. Butler, Y. Chilliard, J. K. Drackley et D. E. Bauman. 2001. Effect of dietary lipid source on conjugated linoleic acid concentrations in milk fat. J. Dairy Sci. 84:680-690.
Jensen, R. G. 2002. The composition of bovine milk lipids: January 1995 to December 2000. J. Dairy Sci. 85:295-350.
Kaneda, T. 1991. Iso- and anteiso-fatty acids in bacteria: biosynthesis, function, and taxonomic significance. Microbiol. Rev. 55:288-302.
Kritas, S. K., A. Govaris, G. Christodoulopoulos et A. R. Burriel. 2006. Effect of Bacillus
licheniformis and Bacillus subtilis supplementation of ewe’s feed on sheep milk
production and young lamb mortality. J. Vet. Med. 53:170-173.
Leduc, M., R. Gervais, G. F. Tremblay, J. Chiquette et P. Y. Chouinard. 2017. Milk fatty acid profile in cows fed red clover- or alfalfa-silage based diets differing in rumen-degradable protein supply. Anim. Feed Sci. Technol. 223:59-72.
Ran-Ressler, R. R., S. Devapatla, P. Lawrence et J. T. Brenna. 2008. Branched chain fatty acids are constituents of the normal healthy newborn gastrointestinal tract. Pediatr. Res. 64:605-609.
Vlaeminck, B., V. Fievez, A. R. J. Cabrita, A. J. M. Fonseca et R. J. Dewhurst. 2006. Factors affecting odd- and branched-chain fatty acids in milk: A review. Anim. Feed Sci. Technol. 131:389-417.
Yang, Z., S. Liu, X. Chen, H. Chen, M. Huang et J. Zheng. 2000. Induction of apoptotic cell death and in vivo growth inhibition of human cancer cells by a saturated branched-chain fatty acid, 13-methyltetradecanoic acid. Cancer Res. 60:505-509.
4
Chapitre 1 Revue de littérature
1.1 La matière grasse laitière
1.1.1 Structure des composés lipidiques
Les lipides sont essentiels au bon fonctionnement des organismes vivants. Ces composés, ayant comme caractéristique commune d’être hydrophobes, mais solubles dans les solvants organiques, sont de nature variée et remplissent plusieurs rôles dans les organismes vivants qu’ils soient d’ordre structurel (ex. : phospholipides), hormonal (ex. : stéroïdes) ou de réserve énergétique (ex. : triacylglycérols).
Les acides gras sont les composés de base des huiles et des graisses dans notre alimentation. Ce sont des chaînes carbonées débutant par un groupement carboxyle (-COOH) et ayant un groupement méthyle (CH3-) à l’autre extrémité (Figure 1.1; Christie et
Han, 2010). On les retrouve entre autres sous forme de triacylglycérols (Figure 1.2), c’est-à-dire 3 acides gras estérifiés à une molécule de glycérol, ou comme composants des phospholipides (Figure 1.3), principales molécules de structure des membranes cellulaires.
5
Figure 1.2. Schéma d’un triacylglycérol où R’, R’’ et R’’’ sont des acides gras estérifiés
Figure 1.3. Schéma d’un phospholipide. Tirée de Bourbonnais (2014).
6
1.1.2 Synthèse et composition de la matière grasse du lait
Les lipides présents dans le lait sont principalement des triacylglycérols en émulsion dans la matrice laitière sous forme de globules de gras (Jensen, 2002). Les cellules alvéolaires de la glande mammaire produisent des triacylglycérols (ou triglycérides) réunis en microgouttelettes de gras qui, en s’unissant près de la membrane apicale, forment des gouttelettes de plus grande dimension (Mather et Keenan, 1998; Figure 1.4). Grâce au mode de sécrétion par apocytose, ces gouttelettes de gras sont recouvertes d’une membrane de phospholipides, de protéines, d’enzymes et de lipides polaires provenant de la membrane de la cellule épithéliale sécrétrice de la glande mammaire (Mather et Keenan, 1998) pour former les globules au moment de leur éjection.
Figure 1.4. Synthèse et sécrétion des lipides du lait chez le ruminant. Tirée de Chilliard et al. (2001).
7
On dénombre plus de 400 acides gras différents dans le lait de vache représentant de 95 à 98 % des lipides du lait (Palmquist et al., 1993 ; Jensen, 2002). Bien que la majorité du gras du lait soit composé d’acides gras à chaîne paire linéaire saturée (environ 70 %), on retrouve également dans le lait des acides gras mono- et polyinsaturés, des acides gras conjugués, des acides gras à chaîne impaire et des acides gras à chaîne ramifiée (AGCR; Lindmark Månsson, 2008). Cette diversité s’explique par l’origine de ces lipides qui peuvent être apportés par l’alimentation, synthétisés ou modifiés par les bactéries du rumen puis de nouveau modifiés par les cellules de la glande mammaire (Chouinard, 2008). Environ 40 % des acides gras du lait sont également synthétisés de novo par les cellules épithéliales à partir d’acétyl-CoA et de β-hydroxybutyrate (Chilliard et al., 2001; Figure 1.4). Cette voie de synthèse des acides gras peut s’interrompre à chaque étape de l’élongation, générant des acides gras dont la chaîne comporte entre 4 et 16 atomes de carbone. Ce processus permet ainsi la sécrétion d’une grande variété d’acides gras néosynthétisés à chaînes courte et moyenne dans la matrice laitière (Chilliard et al., 2001; Le reste des acides gras du lait (60 %) sont prélevés directement du plasma et proviennent de l’alimentation, des microorganismes du rumen ou des réserves de graisse de la vache. Les acides gras provenant des réserves corporelles de la vache sont principalement le 16:0, le 18:0 et le 18:1 (Chilliard et al., 2001). Ceux-ci sont donc présents en plus grande proportion dans le lait en début de lactation lorsque les réserves corporelles sont fortement mobilisées du fait d’un déficit énergétique important (Chilliard et al., 2001).
Si l’on exclut les suppléments lipidiques protégés, les acides gras provenant de l’alimentation sont, quant à eux, en grande partie modifiés pas les microorganismes du rumen. Ceux-ci procèdent à l’hydrogénation des acides gras insaturés de la diète dans le but ultime de les rendre entièrement saturés. De cette manière, les acides linoléique (18:2 cis-9, cis-12; famille des 6) et linolénique (18:3 cis-9, cis-12, cis-15; famille des n-3), fortement représentés dans l’alimentation des ruminants sont modifiés à 80 et 92 %, respectivement (Doreau et Ferlay, 1994). Le processus s’effectue en plusieurs étapes. C’est pourquoi l’on retrouve dans le lait des acides gras particuliers intermédiaires de ces réactions d’hydrogénation comme les acides gras trans (ex. : 18:1 trans-11) et les acides linoléniques conjugués (ex. : 18:2 cis-9, trans-11). Des acides gras néoformés par les bactéries comme des acides gras à chaîne impaire (ex. : 15:0, 17:0) et des AGCR (ex. :
8
captation par la glande mammaire lors de la synthèse de la matière grasse laitière. Plusieurs facteurs comme la génétique, le stade de lactation, l’âge, l’alimentation et la saison affectent la production et la concentration des différents acides gras du lait (Palmquist et al., 1993).
Tableau 1.1).
Le reste des acides gras du lait (60 %) sont prélevés directement du plasma et proviennent de l’alimentation, des microorganismes du rumen ou des réserves de graisse de la vache. Les acides gras provenant des réserves corporelles de la vache sont principalement le 16:0, le 18:0 et le 18:1 (Chilliard et al., 2001). Ceux-ci sont donc présents en plus grande proportion dans le lait en début de lactation lorsque les réserves corporelles sont fortement mobilisées du fait d’un déficit énergétique important (Chilliard et al., 2001).
Si l’on exclut les suppléments lipidiques protégés, les acides gras provenant de l’alimentation sont, quant à eux, en grande partie modifiés pas les microorganismes du rumen. Ceux-ci procèdent à l’hydrogénation des acides gras insaturés de la diète dans le but ultime de les rendre entièrement saturés. De cette manière, les acides linoléique (18:2 cis-9, cis-12; famille des 6) et linolénique (18:3 cis-9, cis-12, cis-15; famille des n-3), fortement représentés dans l’alimentation des ruminants sont modifiés à 80 et 92 %, respectivement (Doreau et Ferlay, 1994). Le processus s’effectue en plusieurs étapes. C’est pourquoi l’on retrouve dans le lait des acides gras particuliers intermédiaires de ces réactions d’hydrogénation comme les acides gras trans (ex. : 18:1 trans-11) et les acides linoléniques conjugués (ex. : 18:2 cis-9, trans-11). Des acides gras néoformés par les bactéries comme des acides gras à chaîne impaire (ex. : 15:0, 17:0) et des AGCR (ex. :
iso 18:0, anteiso 15:0; Chilliard et al., 2001) s’ajoutent au pool disponible pour une
captation par la glande mammaire lors de la synthèse de la matière grasse laitière. Plusieurs facteurs comme la génétique, le stade de lactation, l’âge, l’alimentation et la saison affectent la production et la concentration des différents acides gras du lait (Palmquist et al., 1993).
9
Tableau 1.1. Teneur des principaux acides gras du lait de vache
Chaîne de carbone Nom
Concentration (g/100 g d’acides gras) 4:0 Acide butyrique 2-5 6:0 Acide caproïque 1-5 8:0 Acide caprylique 1-3 10:0 Acide caprique 2-4 12:0 Acide laurique 2-5 14:0 Acide myristique 8-14 15:0 Acide pentadécanoïque 1-2 16:0 Acide palmitique 22-35 16:1 Acide palmitoléique 1-3 17:0 Acide margarique 0,5-1,5 18:0 Acide stéarique 9-14 18:1 Acide oléique 20-30 18:2 Acide linoléique 1-3 18:3 Acide linolénique 0,5-2 Adapté de Jensen (2002).
Le lait est consommé quotidiennement, sous différentes formes, par une grande majorité de la population. Autour de 25 % des gras consommés par les sociétés occidentales proviennent effectivement du lait (Chilliard et al., 2001). Ainsi, le lait est un véhicule intéressant pour introduire des composés lipidiques bénéfiques et essentiels, comme certains acides gras, dans l’alimentation humaine. Nous n’avons qu’à penser aux différents produits laitiers enrichis en acides gras n-3 ou en acides linoléiques conjugués.
10
1.1.3 Structure et synthèse des acides gras à chaîne ramifiée
Les AGCR ont comme particularité de comprendre généralement un groupement méthyle (CH3-) supplémentaire à leur avant-dernier carbone (iso) ou au précédent (anteiso;
Figure 1.5 ; Nichols et al., 2011).
Figure 1.5 Exemple de structure de différents isomères d’acides gras saturés à 15 atomes de carbone. Iso 15:0 et anteiso 15:0 sont des acides gras à chaîne ramifiée.
Tirée de Ran-Ressler et al. (2014).
Chez la plupart des organismes vivants, la production de novo d’acides gras se fait à partir d’une molécule d’acétyl-CoA sur lequel l’ajout successif de malonyl-CoA mène à la formation de l’acide palmitique selon la réaction suivante (Alberts et Greenspan, 1984) :
𝐴𝑐é𝑡𝑦𝑙‑𝐶𝑜𝐴 + 7 𝑚𝑎𝑙𝑜𝑛𝑦𝑙‑𝐶𝑜𝐴 + 14 𝑁𝐴𝐷𝑃𝐻 + 14 𝐻
⇒ 𝑎𝑐𝑖𝑑𝑒 𝑝𝑎𝑙𝑚𝑖𝑡𝑖𝑞𝑢𝑒 + 7 𝐶𝑂₂ + 14 𝑁𝐴𝐷𝑃 + 6 𝐻₂ 0 + 8 𝐶𝑜𝐴 L’acide palmitique peut ensuite être modifié, par exemple par désaturation ou élongation, afin d’obtenir les différents acides gras nécessaires à l’organisme.
Cependant, la lipogenèse diffère chez d’autres microorganismes pouvant initier la formation de leurs acides gras à partir de l’acétyl-CoA, mais aussi à partir d’une gamme de diverses molécules comme précurseurs. Certaines bactéries peuvent en effet utiliser un acide aminé à chaîne ramifiée comme la leucine, l’isoleucine ou la valine ayant subi une transamination et une décarboxylation pour obtenir les amorces isovaléryl-CoA,
2-15:0
Iso 15:
11
méthylbutyryl-CoA et isobutyryl-CoA, respectivement (Kaneda, 1977 ; Kaneda, 1991, Figure 1.6). Cette lipogenèse alternative mène à la formation des principaux AGCR qui peuvent ensuite être modifiés par divers processus du métabolisme microbien. Certaines bactéries, dont des espèces des genres Ruminococcus, Fibrobacter, Propionibacterium ou Bacillus, font la synthèse de leurs AG exclusivement de cette manière et ont donc des membranes lipidiques hautement riches en AGCR (Kaneda, 1991).
Figure 1.6. Schéma de la synthèse de certains acides gras à chaîne ramifiée. Adaptée de Vlaeminck et al. (2006a).
La voie métabolique menant à la production d’un ACGR plutôt qu’un autre dépend de l’espèce de bactérie et de la présence des précurseurs de ces acides gras (Hirosuke et al., 1994). Selon Fievez et al. (2012), dans l’environnement ruminal, les bactéries cellulolytiques sont associées à la production des AGCR de type iso- alors que les bactéries amylolytiques sont associées à la production d’AGCR de type anteiso- (Figure 1.7). anteiso 15:0 anteiso 17:0 iso 16:0 iso 14:0 iso 17:0 iso 15:0
12
Figure 1.7. Origine et synthèse des acides gras à chaîne ramifiée du rumen. AGV = acides gras volatils. Adaptée de Fievez et al. (2012).
1.2 Importance des acides gras à chaîne ramifiée
1.2.1 Les acides gras à chaîne ramifiée comme biomarqueur de la santé et du
métabolisme de la vache laitière
Les AGCR ainsi que les acides gras à chaîne impaire du lait sont considérés comme outil pour prédire l’état de la fermentation ruminale des vaches et comme indicateur de leur santé métabolique (Fievez et al., 2012). Les acides gras à chaîne impaire et ramifiée du lait (AGCIR) proviennent des bactéries qui quittent le rumen et qui sont digérées par le ruminant. Ces acides gras peuvent ensuite être légèrement modifiés par le métabolisme de la vache avant d’être incorporés à la matière grasse du lait (Keeney et al., 1962 ; Vlaeminck et al., 2015). Puisque les AGCIR du lait sont fortement influencés par l’alimentation de la vache et par la composition microbienne du rumen, il est théoriquement possible d’utiliser le profil en acides gras du lait comme indicateur de la santé métabolique du ruminant. Par exemple, les bactéries cellulolytiques du rumen sont affectés négativement par une diminution du pH ruminal (Russell et Wilson, 1993). Il y aura alors une diminution de la production d’AGCR iso- dans le rumen et une diminution subséquente de leur concentration dans le lait (Fievez et al., 2012 ; Baumann et al., 2016). L’équation suivante, proposée par Baumann et al. (2016), permet d’estimer le pH ruminal (Figure 1.8) grâce à la proportion de différents acides gras du lait.
Isoleucine, 2-méthylbutyrate (acide
aminé ramifié ou AGV ramifié)
Acides gras à chaîne ramifiée iso- (iso 14:0,
iso 15:0, iso 16:0, iso 17:0)
Valine, leucine, isobutyrate, isovalérate (acide aminé ramifié ou
AGV ramifié)
Acides gras à chaîne ramifiée anteiso- (anteiso 15:0, anteiso 17:0) Bactéries amylolytiques Bactéries cellulolytiques
13
𝑝𝐻 = 6,24 − (0,56 × 4: 0) + (1,67 × 𝑖𝑠𝑜14: 0) + (4,22 × 𝑖𝑠𝑜15: 0) + (9,41 × 22: 0)
Figure 1.8. Représentation de l’association entre l’équation du pH ruminal prédit à partir du profil en acides gras du lait de vache et le pH observé (a) et représentation des valeurs résiduelles en fonction des valeurs de pH prédites à partir de cette équation (b) obtenue de vache ayant reçu différents suppléments lipidiques. ● : témoin, ▲ : huile de soya, ■ : Energy Booster 100 (mélange d’acides gras saturés) perfusé dans le rumen, ♦ : Energy Booster 100 perfusé dans l’abomasum. Adaptée de Baumann et al. (2016).
De plus, les AGCIR pourraient être utilisés pour mesurer la production d’acides gras volatils (AGV) et de méthane du rumen (Fievez et al., 2012). Il existe en effet une relation importante entre certains AGCIR du lait et les AGV produits dans le rumen, qui sont issus du métabolisme des mêmes bactéries. Vlaeminck et al. (2006b) ont d’ailleurs proposé une série d’équations empiriques prédisant la production ruminale des différents AGV. Ils concluent que les concentrations en acides gras iso 14:0 et iso 15:0 du lait sont positivement corrélées avec la proportion d’acétate du rumen, que la concentration d’iso 16:0 est positivement corrélée à la proportion de propionate alors que celles du
14
iso 14:0 et du iso 15:0 y sont négativement corrélées et que celles du iso 15:0 et du anteiso 15:0 sont négativement corrélées à la proportion de butyrate.
1.2.2 Rôles en santé humaine
De nombreux travaux scientifiques montrent, contrairement à la croyance populaire, que la consommation de graisses laitières est associée à un risque plus faible de maladies cardiovasculaires (Elwood et al., 2010, Yamagishi et al., 2008) et de diabète (Elwood et al., 2010, Yakoob et al., 2016). Cependant, étant donné le nombre élevé de différents types d’acides gras présents dans les matières grasses laitières (près de 400 ; Jensen, 2002), il est difficile d’identifier ceux qui pourraient expliquer ces résultats positifs pour la santé.
La plupart des acides gras nécessaires à notre organisme peuvent être synthétisés par lipogenèse à partir d’autres molécules. Cependant, la consommation de certains acides gras est essentielle à la bonne santé des individus, ceux-ci ne pouvant être obtenus que par l’alimentation. Les cas les plus connus de ces acides gras essentiels sont sans contredit ceux des familles n-3 et n-6 qui ne peuvent être synthétisés de novo par l’homme, et demeurent indispensables à notre santé.
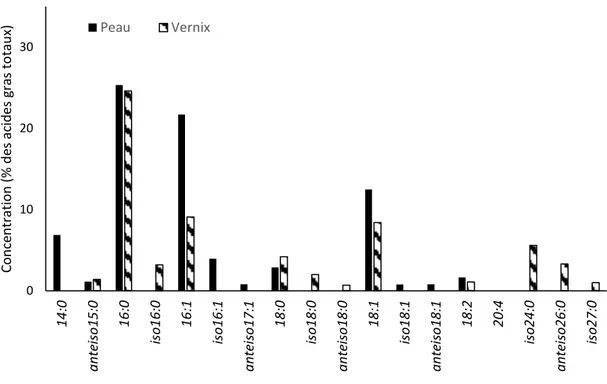
Bien que les AGCR soient connus depuis longtemps, ce n’est que récemment que des recherches ont mis en évidence le potentiel de ces molécules sur la santé humaine. Présents à l’état de traces dans la plupart de nos organes, on en retrouve cependant en quantité importante dans la peau et le vernix (Figure 1.9 ; Nicolaides et Ray, 1965).
15
Figure 1.9. Profil comparatif des principaux acides gras de la peau et du vernix chez l’humain. Adaptée de Nicolaides (1974) et Rissman et al. (2006)
Il a été montré, par des travaux sur des modèles animaux, que l’ingestion des AGCR du vernix par le nouveau-né pouvait potentiellement améliorer la santé gastro-intestinale du nourrisson en plus de prévenir les entérocolites nécrosantes chez l’enfant prématuré (Ran-Ressler et al., 2008 ; Ran-Ressler et al., 2011). Une ingestion d’AGCR serait en effet efficace pour réduire l’inflammation de l’intestin en induisant une réduction de la libération d’interleukines des cellules épithéliales soumises à un challenge de lipopolysaccharides (Yan et al., 2017). De plus, il a été montré que les AGCR permettent de réduire les symptômes de certains désordres neurologiques comme la maladie du sirop d’érable (Jia et al., 2016). Finalement, des propriétés anticancérigènes ont été attribuées à certains AGCR. En effet, l’iso 15:0 provoque l’apoptose rapide des cellules cancéreuses tout en ayant une faible toxicité envers les cellules saines (Yang et al., 2000). Cet acide gras agirait en affectant l’intégrité des mitochondries des cellules cancéreuses (Wongtangtintharn et al., 2005 ; Cai et al., 2013). Il est également avancé que les AGCR de la peau participent, jusqu’à un certain degré, à la fonction de barrière protectrice de celle-ci (Nicolaides, 1974). 0 10 20 30 14 :0 a n te is o 15: 0 16 :0 is o 1 6: 0 16 :1 is o 1 6: 1 a n te is o 17: 1 18 :0 is o 1 8: 0 a n te is o 18: 0 18 :1 is o 1 8: 1 a n te is o 18: 1 18 :2 20 :4 is o 2 4: 0 an te is o 26 :0 is o 2 7: 0 Con ce n tra tio n (% d es a cides gras to ta u x) Peau Vernix
16
Les AGCR sont produits en quantité appréciable par plusieurs bactéries gram positives (Shaw, 1974). De ce fait, une portion des AGCR de nos tissus provient du métabolisme de notre flore intestinale (Van Zanten et al., 2014). Cependant, la très grande majorité de la consommation quotidienne d’AGCR des Nord-Américains est issue d’aliments provenant de l’élevage des ruminants, tels les produits laitiers et la viande de bœuf (Figure 1.10 ; Ran-Ressler et al., 2014). En effet, les bactéries du rumen, riches en AGCR, sont digérées par le ruminant. Les AGCR sont ensuite intégrés aux triacylglycérols fabriqués par le métabolisme de l’animal. Dingess et al. (2017) ont d’ailleurs démontré qu’une alimentation plus riche en produits laitiers et en viande bovine permet d’augmenter la concentration d’AGCR dans le lait maternel.
Figure 1.10. Consommation quotidienne par personne, selon un régime moyen nord-américain, en acides gras à chaîne ramifiée (AGCR).
Adaptée de Ran-Ressler et al. (2014).
Produits laitiers Produits laitiers + bœuf Total des AGCR C on somm a ti on d’ A G C R ( m g/ j)
17
1.3 Facteurs influençant la production d’acides gras à chaîne
ramifiée
Le lait est une source majeure d’AGCR dans notre alimentation. En général, de 1,5 à 2,5 % des acides gras du lait sont à chaîne ramifiée (Vlaeminck et al., 2006a). Cependant, la concentration du lait en AGCR est très variable selon les études (Tableau 1.2).
Tableau 1.2. Concentration en acides gras à chaîne ramifiée du lait de vache (g/100 g d’acides gras) n Moyenne Médiane Écart-type CV1(%) Min. Max.
iso 13:0 64 0,040 0,027 0,036 90,0 0,011 0,144 iso 14:0 82 0,089 0,083 0,031 34,8 0,038 0,179 iso 15:0 103 0,224 0,210 0,059 26,3 0,124 0,510 iso 16:0 80 0,209 0,201 0,050 23,9 0,115 0,370 iso 17:0 93 0,272 0,214 0,164 60,3 0,124 0,910 anteiso 13:0 64 0,083 0,080 0,024 28,9 0,025 0,135 anteiso 15:0 101 0,462 0,451 0,090 19,5 0,290 0,760 anteiso 17:0 73 0,501 0,489 0,125 25,0 0,150 0,790
Données provenant de 26 études représentant 138 traitements différents. Adapté de Vlaeminck et al. (2006a).
1CV : Coefficient de variation
On remarque que la teneur du lait en AGCR est fluctuante avec des coefficients de variation supérieurs à 25 % pour la plupart d’entre eux. Cela peut signifier que plusieurs facteurs différents jouent un rôle fondamental dans l’accumulation de ces acides gras dans le lait. Il appert que l’écosystème ruminal et l’alimentation pour ne nommer que ceux-ci, influent sur la concentration du lait en AGCR (Vlaeminck et al., 2006a).
1.3.1 Les microorganismes du rumen
Les microorganismes du rumen sont en grande partie responsables de la diversité des acides gras présents dans le lait des ruminants. Le rumen, d’un volume d’environ 200 litres chez la vache adulte de race holstein, est un biofermenteur performant où les microorganismes utilisent les aliments ingérés par l’animal pour produire une multitude de composés nécessaires à leur croissance et utiles pour l’hôte (Nagaraja, 2016). La biomasse totale du rumen est composée de bactéries (109 à 1011/g), d’archaea
18
méthanogènes (105 à 108/g), de champignons unicellulaires anaérobies (103 à 104
spores/g) et de protozoaires (104 à 106/g; Nagaraja, 2016).
1.3.1.1 Les bactéries du rumen
Les bactéries du rumen sont le plus important groupe de microorganismes et peuvent représenter de 40 à 90 % de la biomasse (Nagaraja, 2016). De ce nombre, plus de la moitié de ces bactéries sont directement associées aux particules alimentaires (Nagaraja, 2016). Celles-ci sont historiquement réparties en fonction de leur principal substrat de croissance. Ainsi, on distingue des bactéries fibrolytiques, protéolytiques, lipolytiques et amylolytiques, ainsi que les bactéries utilisant les acides organiques (Tableau 1.3). Les différentes espèces et types de bactéries interagissent entre elles de façon positive ou négative (Nagaraja, 2016). La présence de certaines bactéries, par leurs exsudats métaboliques, peut être en effet nécessaire à la croissance d’autres bactéries alors que certains microorganismes peuvent, au contraire, inhiber la croissance d’autres bactéries, par exemple, par la production de bactériocines (Nagaraja, 2016). Un bel exemple de ce phénomène a été exposé par Miura et al. (1980). Ceux-ci démontrent que Ruminobacter
amylophilus produit des acides aminés à chaîne ramifiée en présence d’amidon et
d’ammoniac. Ces acides aminés sont ensuite utilisés par Megasphaera elsdenii pour produire des AGCR qui, eux, sont nécessaires à la bonne croissance de bactéries cellulolytiques comme Ruminococcus albus, dont les parois cellulaires sont constituées en grande partie de ces acides gras. Comme autre exemple, la présence de vitamines du complexe B, produit par certains microorganismes, peut être nécessaire au développement d’autres espèces (Wolin et Miller, 1988). D’autres microorganismes sont dépendants de la production d’acides organiques produits par des bactéries cellulolytiques (Wolin et Miller, 1988). Ces exemples montrent la complexité des interactions entre les différents microorganismes du rumen, on comprend alors pourquoi l’addition d’un nouveau microorganisme ou la modification de l’alimentation peut bouleverser l’écosystème ruminal de façon parfois imprévisible.
Comme indiqué dans le Tableau 1.3, la plupart des bactéries fibrolytiques ont des membranes cellulaires riches en AGCR. Ainsi, une augmentation de la concentration de bactéries fibrolytiques dans le rumen devrait causer une hausse de la quantité d’AGCR absorbée par la vache et sécrétée dans le lait.
19
1.3.1.2 Les champignons unicellulaires du rumen
Les champignons microscopiques vivant dans le rumen sont des organismes habituellement fibrolytiques qui, bien qu’étant moins efficaces que les bactéries dans les processus de fermentation, permettent une meilleure dégradation des particules de fourrages plus lignifiées ce qui améliore, tout compte fait, le processus de dégradation totale de la fibre (Dehority, 2003). Ceux-ci sont d’autant plus efficaces lorsqu’ils croissent dans un milieu à l’écosystème diversifié (Dehority, 2003). Les cinq genres de champignons fonctionnellement importants et fréquemment retrouvés dans le rumen sont
Neocallimastix, Orpinomyces, Anaeromyces, Piromyces et Caecomyces (Dehority, 2003;
Nagaraja, 2016).
Tableau 1.3. Description et principaux substrats de croissance de quelques bactéries et archæa du rumen Microorganisme Description et principaux substrats de croissance
Ruminococcus albus
• Bactérie cellulolytique et hémicellulolytique. Coque anaérobie formant des capsules. Fermente le cellobiose. Produit de l’acide acétique, formique et lactique ainsi que du H2, de l’éthanol et du
CO2. Parois riches en acides gras à chaîne ramifiée
Ruminococcus flavefaciens
Bactérie cellulolytique et hémicellulolytique. Coque anaérobie. Fermente le glucose et le cellobiose. Produit de l’acide acétique, formique et succinique. Parois riches en acides gras à chaîne ramifiée
Fibrobacter succinogenes
Importante bactérie cellulolytique. Bacille anaérobie. Fermente le glucose et le cellobiose. Produit de l’acide acétique et succinique.
Butyrivibrio fibrisolvens
Bactérie hémicellulolytique et légèrement cellulolytique. Bacille coudé anaérobie. Hydrolyse l’amidon et fermente d’autres glucides selon la souche. Produit de l’acide butyrique, formique, lactique ainsi que de l’éthanol, du H2 et du CO2. Activité protéolytique
marquée.
Prevotella ruminicola
Bactérie hémicellulolytique. Bacille anaérobie. Hydrolyse l’amidon et fermente la majorité des sucres solubles. Produit de l’acide acétique, formique et succinique. Importante activité protéolytique. Parois riches en acides gras à chaîne ramifiée.
Streptococcus bovis
Bactérie amylolytique. Coque anaérobie facultative. Fermente aussi d’autres glucides solubles. Produit principalement de l’acide lactique causant une acidification rapide du rumen. Activité protéolytique marquée.
20
Microorganisme Description et principaux substrats de croissance
Ruminobacter amylophilus
Bactérie amylolytique. Bacille anaérobie. Fermente uniquement l’amidon et le maltose. Produit de l’acide acétique, formique et succinique. Importante activité protéolytique.
Selenomonas Ruminantium
Bactérie amylolytique. Bacille recourbé anaérobie. Important producteur de H2S et reste actif à de fortes acidités ruminales
(pH < 4,4). Produit principalement de l’acide lactique, acétique et propionique. Activité protéolytique marquée.
Succinivibrio dextrinosolvens
Bactérie glycolytique et uréolytique. Bacille recourbé anaérobie. Fermente les sucres simples et produit de grande quantité d’uréase. Produit de l’acide acétique et succinique.
Megasphaera elsdenii
Bactérie utilisant les acides organiques. Coque anaérobie. Fermente plusieurs sucres solubles et acides aminés en plus du lactate et du glycérol. Produit de l’acide acétique, propionique, butyrique, des acides gras volatils à chaîne ramifiée ainsi que du CO2 et du H2. Transforme les acides aminés à chaîne ramifiée en
acides gras à chaîne ramifiée.
Methanobrevibacter ruminantium
Importante archaea méthanogène. Coccobacille anaérobie. Utilise le CO2, le H2 et le formate pour produire du CH4.
Tiré et adapté de Miura et al. (1980), Kaneda (1991) et Dehority (2003).
1.3.1.3 Les protozoaires du rumen
Les protozoaires vivant dans le rumen sont des organismes très spécifiques qui ne croissent que dans cet environnement spécialisé et ne se transmettent que par contact direct entre deux ruminants (Dehority, 2003). Les genres et espèces de protozoaires colonisant le rumen varient en fonction de l’espèce, de la situation géographique et de l’alimentation de l’hôte (Dehority, 2003). Le rôle et l’importance de ceux-ci dans l’écosystème ruminal sont sujets à débat puisque peu d’effets sur l’animal sont attribuables à leur absence complète du rumen, mis à part une augmentation des bactéries, une baisse de la concentration en ammoniac et une légère baisse de la digestibilité de la matière organique (Dehority, 2003). Les protozoaires sont cependant les plus grands producteurs d’hydrogène de l’écosystème ruminal, ce qui permet la croissance des archaea méthanogènes (Nagaraja, 2016). Chez le mouton, une absence de protozoaires permettrait ainsi une réduction de la production journalière de méthane de 20 à 30 % (Kreuzer et al., 1986). Les protozoaires du rumen peuvent donc être considérés comme des symbiotes bénéficiant de l’environnement sécuritaire et de l’apport
21
en nutriments du rumen, mais n’ayant que peu d’impacts directs, qu’ils soient positifs ou négatifs, sur son hôte. Les protozoaires contiennent généralement moins d’AGCR, pour une même masse, que les bactéries du rumen (7,8 % en moyenne vs 10 %), mais ces derniers sont deux fois plus riches en anteiso 17:0 que les bactéries (Or-Rashid et al., 2007). Cette caractéristique pourrait ainsi être utilisée pour suivre l’évolution des protozoaires dans le rumen (Or-Rashid et al., 2007).
1.3.2 Effet du stade de lactation et de la race sur les acides gras à chaîne ramifiée
du lait
Récemment, Bainbridge et al. (2016) ont mis en évidence l’effet du stade de lactation et de la race sur les teneurs en AGCR du lait. Leurs travaux ont montré qu’il y a interaction entre ces deux facteurs. Ainsi, selon l’étude, la production relative d’AGCR à un certain stade de lactation diffère en fonction de la race de l’animal (holstein vs jersiaise; Bainbridge et al., 2016). Malgré cela, les chercheurs en arrivent à la conclusion que le stade de lactation est un des facteurs principaux à considérer pour maximiser les AGCR du lait (Bainbridge et al., 2016). Ces résultats concordent avec ceux de Craninx et al. (2008) qui spécifiaient que le stade de lactation influençait la concentration de certains AGCR comme le iso 14:0, l’anteiso 15:0 et le iso 17:0. Cependant, une étude de Stoop et al. (2009), qui établissait le profil en acides gras de près de 2000 vaches Holstein-Friesian, n’a pas permis de noter de changements dans la concentration totale des AGCR après le 63e jour en lactation. Dans cette étude, les AGCR n’ont cependant pas été étudiés de
façon individuelle. Ainsi, il appert que la production d’AGCR du lait est moindre en début de lactation, lorsque les réserves corporelles de l’animal sont fortement mobilisées. On retrouve également des concentrations intéressantes d’AGCR dans les tissus et le lait d’autres ruminants comme la chèvre, le mouton ou d’autres bovidés (yak, buffle). Dans la plupart des cas, les concentrations des principaux AGCR sont comparables, bien que différents AGCR mineurs puissent se retrouver en plus grande quantité chez une espèce par rapport à une autre (Alonso et al., 1999). Par exemple, une même diète peut affecter différemment la concentration relative des différents AGCR du lait lorsqu’administrée à des vaches ou des chèvres laitières (Toral et al., 2015).
22
1.3.3 Effet de l’alimentation
1.3.3.1 Rapport fourrages:concentrés
Plusieurs auteurs ont établi que la proportion de fourrages dans la ration avait une influence sur la teneur en gras du lait et sur les concentrations relatives des différents acides gras, dont les AGCR. Salawu et al. (2002) ont en particulier montré que la concentration des acides gras iso à chaîne impaire (iso 15:0 et iso 17:0) augmentait proportionnellement avec la teneur en NDF de la ration. Dewhurst et al. (2003) ont observé des résultats semblables où une augmentation des apports en fourrages favorisait la concentration des acides gras iso- sans impact sur les acides gras anteiso-. Il est avancé que la majorité des AGCR de type iso- sont produits par des bactéries cellulolytiques, alors que les acides gras anteiso- seraient davantage issus du métabolisme des bactéries amylolytiques (Fievez et al., 2012). Une telle relation n’a cependant pas été clairement établie dans l’étude de Patel et al. (2013), où seule une légère augmentation de la concentration en iso 15:0 a été observée avec une hausse du rapport fourrages:concentrés, ou dans l’étude de Bas et al. (2003) chez la chèvre, où les concentrations de tous les AGCR du contenu duodénal ont été augmentées par une hausse de la teneur en fourrages de la ration. Vlaeminck et al. (2006c) ont également remarqué que l’ensemble des AGCR, autant iso- que anteiso-, produits par les bactéries du rumen, augmentaient proportionnellement au rapport fourrages:concentrés, ce qui semble contraire à l’hypothèse que les AGCR anteiso- sont favorisés par une augmentation des concentrés. Somme toute, on peut conclure que le rapport fourrages:concentrés influence l’activité des différents groupes de microorganismes du rumen permettant ainsi, en règle générale, une augmentation de la concentration totale en AGCR du lait (Bas et al., 2003 ; Vlaeminck et al., 2006c).
Sur le plan nutritionnel, une corrélation positive peut être observée entre la teneur en NDF de la ration et la concentration en AGCR du lait (Vlaeminck et al., 2006a). Cependant, la concentration en AGCR est négativement corrélée avec le niveau de protéine, d’amidon et de gras de la ration (Vlaeminck et al., 2006a)
23
1.3.3.2 Type de fourrage
Le type de fourrage utilisé peut avoir une influence sur la concentration en AGCR du lait. Comme indiqué précédemment, une variation de la teneur en cellulose et en amidon de la ration peut influencer la concentration des différents AGCR du lait. L’utilisation de fourrages plus fibreux devrait donc augmenter les concentrations d’AGCR. Ainsi, chez la chèvre laitière, une alimentation à base d’ensilage de tige de maïs (77,6 % de NDF) augmente d’environ 50 % la concentration en iso 14:0, iso 15:0, iso 16:0, iso 18:0 et
anteiso 17:0 du contenu duodénal, lorsque comparée à une alimentation à base de foin
de luzerne (55,3 % de NDF; Bas et al., 2003). Cependant, des conclusions contraires sont tirées par Schulz et al. (2018) qui ont observé un effet linéaire positif sur les concentrations du lait de vache en iso 14:0, iso 16:0 et iso 18:0 lorsque l’ensilage de maïs a été remplacé par de l’ensilage de trèfle rouge. Leduc et al. (2017) ont également montré qu’une alimentation à base de trèfle rouge permettait d’augmenter les concentrations relatives d’AGCR par rapport à une alimentation à base de luzerne. La ration à base de trèfle était d’ailleurs plus riche en fibre et plus pauvre en protéine brute que la ration à base de luzerne. L’étude de Leduc et al. (2017) fait aussi état d’une diminution de la concentration des bactéries Ruminococcus albus et Ruminococcus flavefaciens lorsque les animaux ont été nourris avec la ration à base de trèfle. Une diminution de la concentration de ces bactéries peut être un signe d’une diminution généralisé des bactéries cellulolytiques ce qui semble en contradiction avec les résultats obtenus concernant les AGCR du lait. En effet, ces bactéries cellulolytiques qui colonisent le rumen sont riches en AGCR de type
iso- (Ifkovits et Ragheb, 1968 ; Dehority et al., 2003). En se basant sur la concentration
en AGCR de ces bactéries, une baisse de leur nombre devrait faire diminuer la teneur en AGCR du lait, alors que le contraire est observé. La plus faible disponibilité de l’azote dans la ration à base de trèfle rouge en serait la cause principale, puisque ces bactéries sont sensibles à une pénurie d’azote facilement utilisable (Belanche et al., 2012). Des résultats similaires ont été obtenus par Halmemies-Beauchet-Filleau et al. (2014) en comparant l’effet d’une diète à base de trèfle rouge et une diète à base de graminées (fléole et fétuque). Cette fois-ci, la diète à base de graminées, plus riche en fibre, a permis d’obtenir une plus grande concentration dans la plupart des AGCR de type iso- que la ration riche en trèfle rouge.
24
Toutefois, des variations du profil en acides gras du lait peuvent être observées pour une même espèce de fourrage en modifiant la façon dont celle-ci est servie aux animaux. En effet, l’alimentation à base d’herbe fraiche (pâturage) ou sous forme de foin maximise les concentrations d’AGCR du lait comparativement à un même fourrage servi sous forme d’ensilage (Villeneuve et al., 2013). Des conclusions similaires sont rapportées dans une étude d’Elgersma et al. (2004) où les concentrations d’AGCR dans le lait diminuent rapidement (4 jours) suivant la transition d’une alimentation au pâturage à une alimentation à base d’ensilages.
1.3.3.3 Suppléments alimentaires
Les suppléments lipidiques sont une source dense d’énergie pour le ruminant utilisée pour prévenir le déficit énergétique en début de lactation (Palmquist et Jenkins, 1980). Certains acides gras sont cependant dommageables pour certaines populations microbiennes, lorsque présents en trop grandes concentrations (Ferguson et al., 1990). Il est généralement accepté que plus le niveau d’insaturation des acides gras utilisés comme supplément est important, plus ceux-ci ont un impact sur les populations microbiennes (Vlaeminck et al., 2006a). Les acides gras insaturés et ayant des doubles liaisons de configuration -cis sont également plus dommageable pour les microorganismes que leurs contreparties saturées ou de configuration trans. Une diète complémentée en huile de palme, riche en 16:0, est donc moins dommageable pour les populations microbiennes, permettant une plus grande proportion d’AGCR dans le lait, qu’une diète complémentée d’huiles végétales insaturées comme celles de soya et de tournesol (Vazirigohar et al., 2018). Ainsi, une supplémentation en huile de soya a des conséquences néfastes sur le microbiote fermentaire du rumen en inhibant la croissance de plusieurs bactéries cellulolytiques (Maia et al., 2007). Par le fait même, l’ajout d’huile insaturée à la ration ne permet pas d’augmenter la concentration en AGCR du lait (Baumann et al., 2016 ; Vazirigohar et al., 2018). Une supplémentation en gras permet cependant d’augmenter la production laitière et peut donc augmenter la sécrétion totale d’AGCR sur une base journalière (Baumann et al., 2016). Il a également été démontré qu’une augmentation du rapport fourrages:concentrés permet de contrer les effets délétères de l’huile végétale insaturée sur les populations microbiennes et, ultimement, sur la concentration en AGCR du lait (Vazirigohar et al., 2018).
25
L’huile de poisson, bien que riche en acides gras polyinsaturés, pourrait être une exception à cette règle. Des effets positifs sur la concentration en AGCR du lait ont été observés chez la chèvre par l’ajout à la ration de ce type de supplément, particulièrement sur les niveaux d’iso 15:0 et d’iso 17:0, bien que la production laitière soit réduite (Shingfield et al., 2003). Ces effets semblent cependant moins importants chez la vache où seul le iso 17 :0 est augmenté par l’ajout d’huile de poisson à la ration (Toral et al. 2015). Cela démontre que l’utilisation de différentes sources lipidiques a des effets sur les concentrations d’AGCR du lait bien que des études supplémentaires soient nécessaires pour comprendre le mode d’action de ces suppléments et prévoir leurs impacts sur le profil en acides gras du lait.
L’effet d’une perfusion intraruminale d’AGV a aussi été étudié en considérant que certains de ceux-ci sont des précurseurs d’AGCR. Une supplémentation en acétate, propionate, valérate ou isovalérate n’a pas eu d’effets importants sur les concentrations d’AGCR du lait, démontrant ainsi que les bactéries du rumen n’utilisent pas davantage les AGV supplémentaires de l’environnement ruminal pour la synthèse d’AGCR (French et al., 2012). Ces éléments ne seraient donc pas le facteur limitant la production bactérienne d’AGCR.
1.4. Utilisation de bactéries du genre Bacillus comme
probiotiques
Les probiotiques sont des cultures de microorganismes vivants pouvant être administrés à un animal ou un être humain et qui ont un effet bénéfique grâce à une amélioration des propriétés de sa microflore indigène (Havenaar et al., 1992). Ceux-ci sont de plus en plus utilisés dans l’alimentation des animaux d’élevage, que ce soit comme promoteurs de croissance, en remplacement des antibiotiques comme soutien au système immunitaire ou pour améliorer la productivité des animaux d’élevage (Bajagai et al., 2016). Les modes d’action des probiotiques varient d’une espèce à l’autre, mais il est reconnu que ceux-ci favorisent l’établissement d’un microbiote sain en réduisant les risques de colonisation du tube digestif par des organismes pathogènes. Les probiotiques augmentent finalement la digestion et l’absorption des nutriments et peuvent stimuler l’immunité (Bajagai et al., 2016).
26
Chez les ruminants, les effets bénéfiques observés par l’ajout de probiotiques à la ration sont multiples, mais ne se produisent pas toujours de manière constante pour l’ensemble des animaux ou l’ensemble des souches ou produits commerciaux utilisés (Uyeno et al., 2015). Il est essentiel de bien comprendre les processus de fermentation ruminale pour bien cerner l’impact qu’ont les probiotiques sur cet environnement (Figure 1.11). Le rumen est un milieu complexe contenant de grandes concentrations de microorganismes. Les glucides provenant des fourrages et des aliments concentrés sont hydrolysés par les microorganismes pour produire des oses qui seront ensuite fermentés en AGV et en lactate, ainsi que du CO2 et du méthane (Chiquette, 2010).
Figure 1.11. Schéma simplifié de la dégradation des glucides dans le rumen. Tirée de Chiquette (2010).
Il a été observé que les probiotiques administrés aux ruminants stimulent l’environnement ruminal en favorisant la croissance des microorganismes, en stabilisant le pH, en modifiant les processus de fermentation et en améliorant la digestibilité des nutriments et leur rétention (Yoon et Stern, 1995 ; Uyeno et al., 2015). L’ajout de probiotiques à la ration permettrait également d’augmenter la production de propionate du rumen, principal précurseur du lactose du lait, et réduirait les risques d’acidose métabolique (Krehbiel et al., 2003). Ces modes d’action permettent, en général, d’améliorer l’efficacité alimentaire de la vache et donc d’accroitre sa productivité dans une proportion importante des
27
expérimentations (Yoon et Stern, 1995 ; Krehbiel et al., 2003), bien que certaines études n’aient montré que des effets minimaux, même lors de supplémentation sur de longues périodes (Raeth-Knight et al., 2007). Le Tableau 1.4 présente différents microorganismes vendus commercialement et utilisés comme probiotiques dans les animaux d’élevage au cours des dernières années.
Tableau 1.4. Liste des principaux organismes utilisés comme probiotiques dans l’alimentation des animaux
de ferme et leur concentration respective en acides gras à chaîne ramifiée (AGCR )
Genre Espèce AGCR, % des acides
gras totaux Aspergillus oryzae -1 Bacillus subtilis licheniformis 95 91 Bifidobacterium animalis bifidium thermophilus -- - Candida pintolepesii - Clostridium butyricum - Enterococcus faecium - Lactobacillus acidophilus bulgaricus casei lactis plantarum reuteri rhamnosus salivarius thermophilus - - - - - - - - - Pediococcus acidilactici - Propionibacterium acidipropionici freudenreichii shermanii jensenii 50 63 59 57 Saccaromyces cerevisiae - Streptococcus faecium faecalis - 21 Tiré de Bajagai et al. (2016) et de Kaneda (1991).
28
Chez la vache laitière, les probiotiques les plus utilisés sont des genres Lactobacillus et
Bifidobacterium ainsi que les levures Aspergillus oryzae et Saccaromyces cerevisiae
(Yoon et Stern, 1995 ; Uyeno et al., 2015). Cependant, de nombreuses autres espèces ont été étudiées et ont démontré un potentiel intéressant (Yoon et Stern. 1995).
De la liste du Tableau 1.4, seuls les probiotiques du genre Bacillus, et dans une moindre mesure ceux du genre Propionibacterium, sortent du lot par leur grande proportion d’AGCR pouvant ainsi potentiellement être utilisés pour permettre l’enrichissement du lait. Les principaux types d’AGCR présents dans leurs membranes sont l’iso et l’anteiso 15:0, représentant ensemble près de 50 % des acides gras, ainsi que l’iso et l’anteiso 17:0, représentant ensemble près de 25 % des acides gras (Bishop et al., 1967). Les proportions relatives d’acides gras iso et anteiso dépendraient principalement du milieu de culture du microorganisme (Kaneda, 1991). En effet, les principaux facteurs affectant la composition des membranes d’une bactérie synthétisant des AGCR sont la présence relative d’amorces ou de composés permettant leur synthèse et l’abondance des différentes autres classes d’acides gras (saturés, insaturés et autres) dans l’environnement immédiat de la bactérie (Kaneda, 1991).
Les bactéries firmicutes du genre Bacillus sont des bacilles sporulantes allant de préférablement aérobies à aérobies facultatives (Logan et De Vos, 2009 ; Figure 1.12). La majorité des espèces sont non-pathogènes, à l’exception de Bacillus anthracis, l’agent responsable de l’anthrax et de Bacillus cereus qui peut être classifié d’agent opportuniste (Logan et De Vos. 2009). Certains produits alimentaires, comme le nattō, un produit de fermentation de la fève de soya, dépendent de la présence de bactéries du genre Bacillus comme agent de fermentation (Bacillus subtilis subsp. Natto; Elshaghabee et al., 2017).
Bacillus spp. est retrouvé communément dans le sol, l’air, l’eau, les flores intestinales
humaines et animales, ainsi que sur les aliments et les végétaux (Elshaghabee et al., 2017).
Les espèces et les souches utilisées comme probiotiques sont cependant habituellement extraites du système gastro-intestinal d’un animal (Mingmongkolchai et Panbangred, 2018). La capacité de Bacillus spp. à former des spores fait de ce genre de bactérie un candidat intéressant comme probiotique, lui permettant de survivre à des environnements hostiles comme l’acidité de l’estomac des monogastriques et de permettre sa distribution sous forme sèche (Elshaghabee et al., 2017).