PROCESSUS ÉCOLOGIQUES DÉTERMINANT LES
CHANGEMENTS FAUNIQUES LE LONG D’UNE
CHRONOSÉQUENCE APRÈS COUPE EN FORÊT
BORÉALE
Thèse
HÉLÈNE LE BORGNE DOCTORAT EN BIOLOGIE Philosophiae Doctor (Ph.D.)Québec, Canada
© Hélène Le Borgne, 2017PROCESSUS ÉCOLOGIQUES DÉTERMINANT LES
CHANGEMENTS FAUNIQUES LE LONG D’UNE
CHRONOSÉQUENCE APRÈS COUPE EN FORÊT
BORÉALE
Thèse
HÉLÈNE LE BORGNE
Sous la direction de :
III
Résumé
Comprendre comment les communautés changent dans le temps et les facteurs influençant la répartition des espèces est un aspect central de l’écologie. Bien que les changements dans les communautés animales à la suite de perturbations aient été largement décrits, peu d'études ont examiné les processus qui structurent ces communautés, en particulier durant la succession écologique résultant des activités anthropiques. L’objectif de ma thèse était donc de mieux comprendre les processus biologiques influançant l’organisation des communautés de petits mammifères et de coléoptères, de même que la répartition d’une espèce clé de l’écosystème, le campagnol à dos roux (Myodes gapperi), durant la succession forestière en forêt boréale aménagée. Dans un premier temps, nous avons donc examiné comment la succession peut influencer les processus de structuration des assemblages d’espèces. Puis, dans un second temps, nous nous sommes intéressés plus spécifiquement à une espèce clé typiquement associée aux vieilles forêts pour investiguer les mécanismes qui influencent leur organisation spatiale et donc leur répartition dans les peuplements. Enfin, nous avons étudié leur utilisation de l’habitat à plus fine échelle (micro-habitat) en caractérisant leurs déplacements afin de mieux comprendre les liens qui existent entre les animaux et les attributs fins de l’habitat durant la succession. L’étude a montré que les assemblages d’espèces étaient similaires dans les peuplements 50-60 ans après coupe et dans les forêts matures. De façon générale, la structuration des communautés lors de la succession forestière semble résulter à la fois de processus stochastiques et déterministes, ces derniers étant plus étroitement liés aux interactions interspécifiques qu’aux caractéristiques de la végétation. Par la suite, nous avons utilisé les théories de sélection d’habitat et d’approvisionnement pour identifier les processus qui peuvent expliquer l'augmentation d’abondance relative des campagnols à dos roux lors de la succession forestière. Les résultats indiquent que la compétition apparente avec la souris sylvestre (Peromyscus maniculatus) limiterait la répartition des campagnols, et que des changements dans la force relative de ce processus durant la succession forestière expliqueraient les changements de répartition observés. La gestion durable des forêts doit maintenir certains attributs de l'habitat nécessaires au rétablissement des
IV
espèces de peuplements matures, mais ces attributs peuvent être difficiles à identifier car leur utilisation peut varier fortement pendant la succession. Nous avons donc identifié certains attributs importants pour le campagnol, puis tenté d’expliquer certaines variations dans leur utilisation durant la succession forestière en évaluant les déplacements à fine échelle du petit mammifère. Nos analyses démontrent, par exemple, que les campagnols sélectionnent fortement le bois mort comme route de déplacement durant la succession forestière, et aussi que cette sélection est moins forte en milieu de succession que dans les coupes récentes et dans les forêts matures. Ces variations dans les relations animaux-habitat durant la succession peuvent s’expliquer par des ajustements comportementaux aux changements dans la couverture qu’offre la canopée prenant place à mesure que la forêt vieillie. En conclusion, cette thèse améliore les connaissances des processus régissant la répartition de la faune boréale, et cela grâce à la combinaison originale de l’étude des communautés, de la dynamique des populations et du comportement animal.
V
Abstract
Understanding how communities change over time and the process influencing species distribution are recurrent themes in ecological research. Although changes in animal communities following disturbances have been widely examined, few studies have investigated the process structuring communities, particularly during ecological succession resulting from anthropogenic disturbances. The main objective of my thesis was to better understand the biological processes influencing the organization of small mammal and beetle communities, as well as the distribution of a key species, the red-backed vole (Myodes gapperi), during forest succession in managed boreal forests. First, we examined how forest succession influences the process structuring species assemblages. Then, we focused more specifically on red-backed voles to investigate the processes influencing their spatial organization along a chronosequence of post-logging stands. Finally, we studied their use of habitat at a fine scale (micro-habitat) by assessing the interplay between their movements and habitat attributes characterizing post-harvested stands during ecological succession. The study showed that assemblages 50-60 years after clearcutting were similar to those found in old-growth forests. Generally, community assembly during forest succession seem to be driven by both stochastic and deterministic processes, the latter being linked to interspecific interactions more strongly than to vegetation attributes. Then, we combined habitat selection and optimal foraging theories to evaluate the processes that can explain the increase in red-backed vole abundance during post-logging forest succession in boreal ecosystems. Our results suggest that apparent competition with deer mice (Peromyscus maniculatus) limits the density of red-backed voles, and changes in the relative strength of this process during forest succession can explain patterns of vole distribution and abundance. Sustainable management must maintain habitat features needed for the recovery of species typical of mature forest, an objective that may be challenging because animal-habitat relationships can vary dynamically during succession. We thus identified key habitat attributes for red-backed voles, and then tried to explain some variations in the use of those attributes during forest succession by studying fine-scale movements during forest succession. We found, for
VI
example, that voles selected coarse woody debris as a travel path during forest succession, and that this selection was weaker in mid-seral forests than in recent cuts and old-growth forests. Such variations in animal-habitat relationships observed during forest succession can be explained by behavioural adjustments to changes in the availability of canopy cover occurring as stands mature. Overall, this thesis improves our knowledge of the processes driving wildlife distribution dynamics, by its combination of studies on community assembly, population dynamics and animal behaviour.
VII
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des figures ... x
Liste des tableaux ... xiii
Remerciements ... xvi
Avant-propos ... xviii
Introduction ... 1
1. Perturbations et succession écologique ... 1
a. Perturbations et conséquences sur la biodiversité ... 1
b. Succession écologique ... 2
c. Résilience et résistance des communautés ... 3
2. Facteurs influençant la répartition des animaux ... 4
a. Sélection d’habitat et réponses fonctionnelles ... 4
b. Interaction inter- et intra-spécifiques ... 6
c. Hétérogénéité de l’habitat ... 7
3. La forêt boréale du Québec ... 8
a. La forêt boréale et ses perturbations ... 8
b. Etudes et connaissances sur les effets des coupes forestières ... 10
4. Utilisation des théories et outils écologiques pour comprendre la répartition animale après perturbations anthropiques ... 11
a. Structuration des communautés et modèles nuls ... 12
b. Isodar ... 13
c. Densité à l’abandon (GUD) ... 14
d. Analyse des déplacements ... 16
5. Espèces cibles – coléoptères et petits mammifères ... 17
6. Objectif et organisation de la thèse ... 18
Chapitre 1 ... 20
Temporal dynamics in animal community assembly during post-logging succession in boreal forest ... 20
Résumé ... 21
Abstract ... 23
Introduction ... 24
Methods ... 26
Study Area ... 26
Small mammal sampling ... 27
Beetle sampling ... 27
Vegetation sampling ... 28
Statistical Analysis ... 29
Species co-occurrence database ... 29
Analyses of species composition patterns ... 30
Null model analysis of species co-occurrence patterns ... 31
Results ... 33
VIII
Random and non-random patterns of species co-occurrence ... 33
Contribution of habitat attributes and interspecific interactions to non-random patterns ... 34
Discussion ... 35
Acknowledgements ... 38
Chapitre 2 ... 44
Ecological processes determining the distribution dynamics of vole populations during forest succession ... 44
Résumé ... 45 Abstract ... 46 Introduction ... 47 Methods ... 50 Study area ... 50 Experimental Design ... 50
Small mammal sampling ... 51
Giving-up densities ... 51 Vegetation attributes ... 52 Statistical analysis ... 53 Isodars ... 53 GUDs ... 54 Results ... 55
Effects of logging on forest attributes ... 55
Intraspecific and interspecific competition ... 56
Predation risk ... 57
Discussion ... 57
Acknowledgements ... 61
Chapitre 3 ... 71
Functional responses in habitat use explain changes in animal-habitat interactions during forest succession ... 71
Résumé ... 72 Abstract ... 73 Introduction ... 74 Methods ... 76 Study Area ... 76 Tracking individuals ... 77 Data analysis ... 78
Step selection function ... 78
First-passage-time and residency time ... 79
Results ... 81
Forest attributes during post-logging forest succession ... 81
Step selection function ... 81
First passage time and Residency time... 82
Discussion ... 83
Acknowledgements ... 86
Conclusion générale ... 95
1. Composition et structuration des communautés durant la succession forestière 95 a. Composition des communautés durant la succession ... 95
IX
b. Processus de structuration des communautés durant la succession ... 96
2. Changement d’abondance et facteurs limitants la répartition du campagnol à dos roux durant la succession forestière ... 99
3. Influence de la végétation sur les déplacements du campagnol à dos roux durant la succession forestière ... 101
4. Implications pour la conservation ... 102
5. Futures recherches ... 105
Bibliographie ... 108
Annexe 1 ... 122
Annexe 2 ... 124
1. Isodar theory to assess density-dependent habitat selection ... 124
2. Optimal foraging theory to assess perceived risk of predation and missed opportunity costs. ... 126
X
Liste des figures
Figure I.1: a) Exemple de relation entre la valeur adaptative et la densité des individus
dans deux habitats de qualité différentes, A étant de meilleure qualité que B. b) Isodar issu du tracé de la densité de l'habitat A en fonction de la densité de l'habitat B, d’après Morris (1988). ... 14
Figure 1.1: Ordination plots based on Sorensen indices representing dissimilarity in
assemblage patterns among boreal forest age classes for a) small mammals, b) ground-dwelling beetles, and c) flying beetles. The ellipses enclose 80 % of the variability in compositional differences accounted for by the first two axes. We used solid lines for old-growth forest, and dashed lines for cut stands of different age after clear-cutting. Age classes: C-1, C-2, C-3, and C-4: 4–20, 21–30, 31–50, and 51–70-years-old clear-cut stands, respectively, OF is for old-growth forest of at least 120-years-old. ... 41
Figure 1.2: Percentage of significantly aggregated (grey bars) and segregated (black
bars) pairwise species co-occurrences among small mammals (a and b), ground-dwelling beetles (c and d) and flying beetles (e and f) under different unconstrained (a, c, and e, respectively) and habitat-constrained (b, d, and f, respectively) null models (two algorithms: fixed–equiprobable: HCFE and fixed– fixed: HCFF). The significant outcomes under unconstrained FE and FF models are included as background to visualize changes in the significant aggregated and segregated percentage of co-occurrences with the corresponding constrained HCFE and HCFF null models. The significant species co-occurrences from the unconstrained null model that became non-significant under habitat constraint are enclosed between two arrows (indicating pair associations, primarily due to habitat effect). The dotted bars indicate new significant associations under habitat-constrained null models (indicating that the species pairs were segregated within their shared habitat [HCFF] or the newly aggregations were patterns cancelled by the concurrent or opposite effects of habitat heterogeneity indices [HCFE]). HC null models were constrained by either TSL: time-since-logging, or NS: number of different species in the stand, or NDC: number of tree diameter classes in the stand, or DS: dominant tree species in the stand, or CWD: coarse woody debris. ... 43
Figure 2.1: Variation in canopy cover (a), coarse woody debris (b), and moss cover (c)
with forest succession (stands undergoing regeneration 5 to 66 years after logging, and old-growth forest), which were sampled in black spruce boreal forest of northeastern Quebec (Canada) in 2011. ... 67
Figure 2.2: Observed relative abundance and 95 % confidence intervals (dotted lines)
of red-backed vole in stands undergoing regeneration (ranging from 5 years to 66 years after logging) that were sampled for two consecutive years in black spruce boreal forest of northeastern Quebec (Canada). The open circles represent data for 2010 and filled circles for 2011. Large open and filled circles represent mean abundances and their standard errors in old-growth forest for 2010 and 2011, respectively. ... 68
Figure 2.3: Abundances of red-backed voles in pairs of old-growth forest and cut
XI
(NU = 0.96 + 2.12NC -10.04 [Dmoss x NC]) according to the difference in moss
cover between cut and uncut stands, in black spruce boreal forest of northeastern Quebec (Canada) in 2011. The dashed line represents the relationship expected when moss cover is most abundant in cut stands (value of -0.12, which matches the first quartile value of differences in moss cover between habitats). The solid line represents the relationship expected when moss cover is most abundant in uncut stands (value of 0.09, which matches the third quartile value of differences in moss cover between habitats). The diagonal line (dotted line) in the figure shows equal abundance in each habitat, as a reference. ... 69
Figure 2.4: Variation in ΔGUD (i.e., GUD50open – GUD50cover) during forest succession
(stands undergoing regeneration 5 to 66 years after logging, and old-growth forest), which were sampled in black spruce boreal forest of northeastern Quebec (Canada) in 2010 and 2011. The grey line represents the relationship expected when deer mice were absent and the dark line when mice were present. ... 70
Figure 3.1: Variation in moss cover (a), canopy cover (b), and coarse woody debris (c)
with forest succession in black spruce boreal forest of northeastern Quebec (Canada) in 2012. Abbreviations: RC = recent cuts; MS = mid-successional stands; OGF = old-growth forests. ... 91
Figure 3.2: Variation of individual step selection function coefficients for coarse
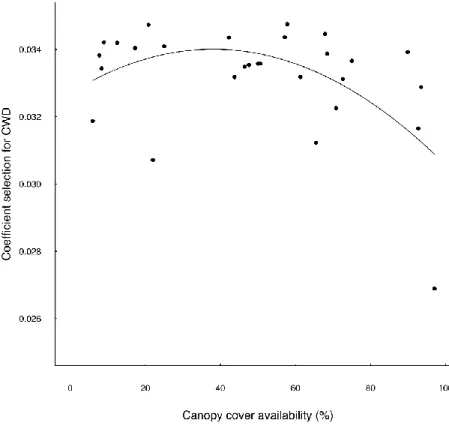
woody debris as a function of canopy cover (% closure) availability that was estimated at random locations along individual paths travelled by red-backed voles in black spruce boreal forest of northeastern Quebec. ... 92
Figure 3.3: Mean of the variance of the log-transformed first-passage time as a function
of circle radius (m) for both 2011 and 2012 data of 34 trajectories of red-backed voles in black spruce boreal forest of northeastern Quebec (Canada). ... 93
Figure 3.4: Relative risk of red-backed vole leaving a 15.9-m2 circular patch as a
function of the canopy cover availability along the path, for three levels of canopy cover that were estimated at patch locations using the model presented in Table 3.3. For illustrative purposes, risk of departure was modelled for the mean canopy cover observed among recent cuts (dotted line, mean = 17.08 %), mid-successional stands (dashed line, mean = 77.67 %) and old-growth-forest (solid line, mean = 58.21 %) in black spruce boreal forest of northeastern Quebec (Canada). ... 94
Figure A1.1. The contribution of different habitat attributes for segregated (first
number) and aggregated (second number) pairwise species co-occurrences detected by comparing unconstrained null models (FF and FE models, respectively) with habitat-constrained null models (HCFF and HCFE models, respectively) for ground-dwelling beetles. The habitat type explained a total of 17 % and 49.5 % of segregated (first number) and aggregated (second number) pairwise species co-occurrences, respectively (meaning that interspecific interactions explained 83 % and 50.5 %, respectively). See text for significant co-occurrences detected by habitat-constrained null models that were regarded as non-significant by unconstrained null models. Values in bold are cited in the results section, the others were considered too marginal to be highlighted in the results section. ... 122
Figure A1.2. The contribution of different habitat attributes for segregated (first
XII
comparing unconstrained null models (FF and FE models, respectively) with habitat-constrained null models (HCFF and HCFE models, respectively) for flying beetles. The habitat type explained a total of 29.3 % and 49.2 % of segregated (first number) and aggregated (second number) pairwise species co-occurrences, respectively (meaning that interspecific interactions explained 70.7 % and 50.8 %, respectively). See text for significant co-occurrences detected by habitat-constrained null models that were regarded as non-significant by unconstrained null models. Values in bold are cited in the results section; the others were considered too marginal to be highlighted in the results section. .. 123
Figure A3.2. Variation of random (individual-level) coefficients of step selection
functions for (a) moss cover, (b) canopy cover, and (c) coarse woody debris among stages of forest succession in black spruce boreal forest of northeastern Quebec (Canada) in 2012. Abbreviations: RC = recent cuts; MS = mid-successional stands; OGF = old-growth forests. ... 134
XIII
Liste des tableaux
Table 2.1: Potential mechanisms and their predicted directional changes in alternative
hypotheses regarding variation of GUDs and isodar (expected significant isodar) that explain the increase in red-backed vole abundance during post-harvest boreal forest succession. NC and NU: Abundance of red-backed vole in cut stands and
uncut old-growth stands, respectively; Nvoles and Nmice refer to the abundance of
red-backed voles and the presence of deer mice; T refers to time-since-logging (years). The shaded area represents the predictions that were supported by field observations. ... 62
Table 2.2: Parameter estimates and 95% confidence intervals (CI) of the model
explaining variations in ΓGUD (i.e., GUDsupplemental – GUD50open), mean GUDs,
and in ΔGUD (i.e., GUD50open – GUD50cover), in cut stands and old-growth uncut
stands of the black spruce boreal forest of the Côte-Nord region of Québec (Canada). The models follow our predictions, with model 1 corresponding to hypothesis 1.1, model 2 and 3 to hypothesis 1.2 and 1.3, model 4 to hypothesis 2.1, and model 5 to hypothesis 2.2. Nmice refers to the presence/absence of deer
mice in the habitat (site), T refers to time-since-logging in years. ... 63
Table 2.3: Parameter estimates and 95 % confidence intervals (CI) of the best isodar
explaining variations in vole abundance in uncut stands (NU) and in cut stands
(NC) of the black spruce boreal forest of the Côte-Nord region of Québec
(Canada). Nmice refers to the presence/absence of deer mice in the habitat (site), T
refers to time-since-logging in years, Dmoss refers to differences in forest moss
cover between cut and uncut stands, and Nc refers to density in cut stands. ... 65 Table 3.1: Parameter estimates, standard errors (SE) and P-values for mixed-effects
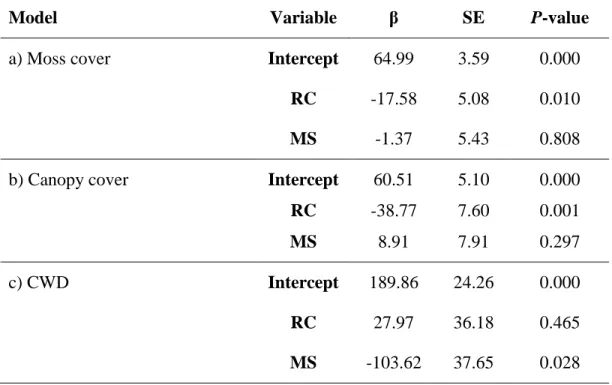
linear models explaining variation in a) moss cover, b) canopy cover, and c) CWD in recently cut (RC) and mid-successional stands (MS) compared to old-growth stands in black spruce boreal forest of northeastern Quebec (Canada) in 2012. 87
Table 3.2: Random-effects step selection function for 28 red-backed voles that were
tracked during summer 2012 in black spruce boreal forest of northeastern Québec (Canada). Parameter estimates (β), standard errors (SE), and 95 % confidence intervals (CI) are presented. ... 88
Table 3.3: Parameter estimates (β), standard errors (SE) and P-values from a
mixed-effects Cox proportional hazards model predicting the risk that a red-backed vole left a 15.9-m2 circular habitat patch, as a function of moss cover (%), canopy cover (%), and CWD volume (m3.ha-1) at the patch’s location, and the overall canopy cover over the path (pCanopy), i.e., pCanopy is the mean value of canopy cover (% closure) availability estimated at random location along each path. ... 89
Table A2.1: Models predicting abundances of red-backed voles in old-growth, uncut
stands of black spruce boreal forest in the Côte-Nord region of Québec (Canada) in 2011. Candidate models consider vole abundance in cut (NC) and uncut (NU)
stands, together with time-since-logging in years (T), and the difference in coarse woody debris (DCWD), canopy cover (Dcanopy), and moss cover (Dmoss) between cut
and uncut stands. Characters in boldface type indicate the selected isodar model. ... 128
XIV
Table A3.1: Relative level of support for competing models explaining variation in the
selection (i.e., individual coefficients of step selection functions) for coarse woody debris during travel of red-backed voles in black spruce boreal forest at different stages of succession in northeastern Quebec (Canada) during summer 2012. K is the number of parameters in the model, and AICc values and differences in AICc (ΔAICc) relative to the best model are presented. Values in boldface type indicate the top-ranking model. pCanopy and pCWD represent the mean value of canopy cover and CWD availability estimated at random locations along each path. .. 129
Table A3.2: Top-ranking mixed-effects linear model (i.e., model 3 of Table A1)
explaining variation in random coefficients of step selection functions for coarse woody debris. pCanopy represents the mean value of canopy cover availability that was estimated at random locations along each of 28 red-backed vole pathways. Parameter estimates (β), standard errors (SE), and P-values are presented. ... 130
Table A3.3: Parameter estimates (β), standard errors and P-values of a mixed-effects
Cox proportional hazards model predicting the relative risk of leaving a 15.9-m2
circular patch for red-backed vole with during forest succession. Abbreviations: RC = recent cuts, MS = mid-successional stands. Old-growth forest was used as the reference successional stage. ... 131
Table A3.4: Model selection among mixed-effects Cox proportional hazards models
predicting the risk of leaving a 15.9-m2 circular patch by red-backed voles during ecological succession following harvesting in boreal forest of Northeastern Quebec during summer 2012. AIC values and differences in AIC (ΔAIC) relative to the top-ranking model are presented. Values in boldface type indicate the selected model. pMoss, pCanopy and pCWD represent the mean value of moss cover, canopy cover and CWD availability estimated at random location along each pathway. Abbreviations: RC = recent cuts and MS = mid-successional stands. ... 132
XV
« Faites que le rêve dévore votre vie afin que la vie ne dévore pas votre rêve » Antoine de Saint-Exupéry
XVI
Remerciements
Cette thèse n’aurait jamais pu aboutir sans l’aide précieuse de nombreuses personnes, j’aimerai donc les remercier.
Merci à Daniel Fortin, mon directeur de recherche, pour avoir réussi à nous pousser, ce projet de doctorat et moi-même, aussi loin que possible; pour ses conseils statistiques, ses révisions de manuscrits, et pour ses profondes connaissances en écologie.
Je tiens à remercier les membres de mon comité de doctorat, Serge Payette et Christian Hébert. Leurs commentaires avisés et leurs encouragements furent très appréciés! Je remercie également Christian Hébert pour m’avoir accueilli et aidé pendant ces longs mois d’identifications d’insectes, et m’avoir donné de précieux conseils tout au long de la rédaction de mon premier chapitre et pour ses connaissances sur les insectes et la foresterie.
Un grand merci aussi à Angélique Dupuch, pour ses révisions de manuscrits, pour toutes les discussions intéressantes au sujet des petits mammifères et des coléoptères que nous avons eues dans son bureau qui m’était toujours ouvert, pour son aide inestimable et sans limites et enfin pour ses conseils toujours précieux en statistiques! Elle m’a aidée énormément pour la conception et la mise en œuvre de mes expériences sur le terrain la première année. Je ne pense pas que j’aurais pu finir cette première année de terrain avec toutes ces maladresses et allergies sans elle. Merci de m’avoir poussée à persévérer, à aller plus loin et pour tous tes encouragements.
Les deux étés que j’ai passé sur le terrain se sont passés sous des conditions parfois très difficiles avec beaucoup de pluie et de mouches, de longues journées de travail, vivre en camping et un terrain souvent accidenté. À travers tout ça, j’ai eu beaucoup de plaisir avec tous mes assistants de terrain et j’espère qu’ils ont vécu de belles expériences tout en apprenant beaucoup sur la recherche en écologie. J’aimerais les remercier :
XVII
Andréanne Beardsell, Maxime Cotnoir, Pascal Royer-Boutin, Marie-Hélène Chabot (été 2011), Michael Leblanc, Antoine Daignault, Julie Martineau et Chrystel Losier (été 2012), et finalement Orphé Bichet (pour les 2 étés).
Je tiens aussi à remercier tous les membres du labo Fortin pour leur soutien et l’excellente atmosphère de travail présente tout au long de mon doctorat. Merci tout particulièrement à Marie-Claude Labbé, Orphé Bichet et Chrystel Losier, mes collègues de bureau, pour toutes les discussions que nous avons eu en écologie et en aménagement forestier, et pour les pauses pendant les longues journées de travail dans un bureau avec une fenêtre qui donne sur une fenêtre et qui prenait l’eau! Un gros merci à Orphé pour m’avoir supportée pendant tous mes moments de stress et avoir vécu mes nombreuses frustrations et succès avec moi. Merci aussi pour tout ce chocolat fourni pendant ces longues années! Merci à Marie Sigaud pour toute son aide précieuse, nos discussions et son soutien durant tout notre doctorat. Finalement, merci à Sabrina Courant, Léa Harvey, Jerod Merkle, Carolyn Nersessian, Qing Zhao, Mathieu Basille, Olivia Tardy et Julie Martineau pour toutes les conversations lors des midis discussion du labo.
Pour finir, le plus gros des mercis à mes parents et à mes petites sœurs pour leur aide morale et financière tout au long de mon doctorat et pour leur révision de mes manuscrits. Ils m’ont toujours soutenue et ont survécu à toutes ces années éloignées mais jamais très loin! Merci d'être venu me visiter à Québec et avoir su m’aider quand j’en avais besoin.
XVIII
Avant-propos
Ce doctorat est présenté sous la forme d’une thèse avec insertion de trois articles scientifiques. La thèse inclut une introduction générale et une conclusion générale qui lient l’ensemble des articles. En tant qu’auteur principal des trois articles, j’ai élaboré les objectifs de recherche, j’ai planifié et réalisé l'échantillonnage sur le terrain, j’ai effectué les analyses statistiques et j’ai rédigé les manuscrits. Mon directeur de recherche, Daniel Fortin, a largement contribué aux étapes de l'élaboration des objectifs et des protocoles d'échantillonnage, ainsi qu'à l'analyse statistique et la rédaction d'articles.
Dans le chapitre 1, nous avons utilisé les données de captures de campagnols à dos roux et les relevés de végétation de David Pinaud, qui a aussi contribué à la rédaction du chapitre 1. Orphé Bichet a également contribué à la planification du design expérimental et à la rédaction du chapitre 1. Christian Hébert (Centre de foresterie des Laurentides) et Angélique Dupuch (Institut des Sciences de la Forêt Tempérée, UQO) ont contribué à la planification du design expérimental, aux analyses statistiques et à la rédaction du chapitre 1. Angélique était aussi impliquée dans la planification du design expérimental, les analyses statistiques et la rédaction du chapitre 2. Daniel Fortin était aussi impliqué dans la planification du design expérimental, les analyses statistiques et la rédaction du chapitre 3.
Finalement, je voudrais souligner ma contribution à un article hors thèse, celui d’Orphé Bichet et al. (2016) publié dans Ecological Applications et pour lequel je suis quatrième auteure. Pour cet article, j’ai planifié et identifié l’ensemble de la collecte de données de coléoptères ainsi qu’une partie des données de petits mammifères, j’ai aidé à la préparation de la base de données pour les analyses statistiques, et j’ai aidé à la révision du manuscrit.
1
Introduction
1. Perturbations et succession écologique
a. Perturbations et conséquences sur la biodiversitéUne perturbation est un évènement qui va modifier la structure ou le fonctionnement des communautés et modifier la disponibilité des ressources, ce qui peut produire une perte d’organismes au sein des écosystèmes (White & Pickett, 1985; White & Jentsch, 2001). La perturbation est donc une composante clé des écosystèmes, pouvant affecter les systèmes terrestres, d’eau douce ou encore marins. Les perturbations se produisent sur un intervalle de temps relativement court et peuvent être d’origines abiotiques (e.g. ouragans, tornades, éruptions volcaniques), biotiques (e.g. insectes ravageurs, herbivores) ou d'une combinaison des deux (e.g. feux nécessitant des conditions abiotiques propices à l'inflammation ainsi qu'une source de carburant, qui est biotique) (Turner, 2010). Les activités humaines peuvent également être à la source de perturbations, telles que la pollution, la chasse, ou encore l’altération et la perte d’habitat, qui vont avoir un impact important sur les organismes vivants (Morris et al., 2009). Par exemple, la perte d’habitat est l’une des menaces principales auxquelles doivent faire face les espèces au Canada (Venter et al., 2006). Les perturbations anthropiques peuvent ainsi modifier la composition des communautés biologiques à travers diverses activités en augmentant les taux d'invasion et d’extinction d'espèces, ce qui peut alors modifier les propriétés des écosystèmes et les biens et services qu'ils fournissent à l'humanité (Hooper et al., 2005).
L’extinction est un processus naturel, mais elle se produit actuellement à un taux anormalement élevé en raison des activités humaines (Chapin et al., 2000; Brooks et al., 2006). Les perturbations naturelles et anthropiques jouent donc un rôle déterminant dans la répartition des animaux et donc dans la structuration de la biodiversité (Sousa, 1984). Le déclin de certaines espèces en faveur d’autres, conduit à une réorganisation des assemblages d’espèces favorisant ainsi une certaine homogénéisation des communautés animales (McKinney & Lockwood, 1999). La disparition d’espèces ou de groupes fonctionnels entiers peut non seulement altérer la capacité d’un écosystème
2
à remplir certaines fonctions, mais aussi sa résistance et résilience face aux changements (Chapin et al., 2000). Un des défis actuels consiste donc à concevoir des stratégies pour conserver la biodiversité, sachant que nos connaissances des processus la régissant sont incomplètes et que les changements naturels et anthropiques sur les systèmes naturels sont inévitables (Moritz, 2002). Sans changements majeurs dans les comportements humains et dans les politiques, les perturbations anthropiques vont continuer à altérer la biodiversité. Ainsi, être capable d'identifier les principales caractéristiques de l'environnement et des organismes qui permettent la coexistence des espèces et favorisent la résilience de l’écosystème s’avère particulièrement utile pour orienter les politiques de conservation et de réhabilitation (Walker & del Moral, 2003; Morris et al., 2009). En effet, les processus permettant la coexistence des espèces devraient également contrôler les patrons de biodiversité locale, de sorte qu’une meilleure compréhension de ces processus devrait permettre de réduire notre empreinte écologique sur les écosystèmes (Caro, 2007).
b. Succession écologique
Les perturbations vont ainsi modifier l'état du système et la trajectoire d'un écosystème, et sont donc des facteurs clés de l'hétérogénéité spatiale et temporelle (Turner, 2010). De plus, comprendre pourquoi et comment les communautés peuvent changer dans le temps est un thème récurrent en écologie; ce qui a fait de l’étude des perturbations comme processus structurant les écosystèmes un sujet majeur de recherche en écologie. Un écosystème est un système dynamique qui tend à changer et aller vers un état d’équilibre qui va dépendre du contexte biotique et abiotique. La succession écologique décrit ce processus de développement depuis un stade initial vers un stade final d’équilibre plus stable(Walker & del Moral, 2003). À la suite des perturbations, les espèces pionnières caractérisées par des traits fonctionnels spécifiques (e.g., petite taille, renouvellement de population rapide) leur permettant de survivre en milieu plus ouverts ou sur des sols nus, vont alors bénéficier des conditions laissées en place (Aubin et al., 2013). Les effets directs des perturbations sur la répartition d’une espèce peuvent également avoir des répercussions plus indirectes sur d’autres espèces, et donc avoir un effet sur les communautés locales et l’écosystème de façon générale. Par
3
exemple, la perte de diverses espèces de requins peut avoir un impact qui se propage jusqu’au bas de la chaîne alimentaire, notamment en contribuant à l’augmentation de mésoprédateurs et en modifiant le nombre de consommateurs primaires (Ruppert et al., 2013). La surexploitation des océans par la pêche peut donc affecter les interactions trophiques avec notamment des remplacements d’espèces et donc des changements dans la composition de la communauté (Stevens, 2000). En altérant les écosystèmes de façon différente des perturbations naturelles, les perturbations anthropiques mènent à des patrons spatiaux distincts et de nouvelles trajectoires de succession sont alors mises en place. En particulier, les perturbations anthropiques comme celles associées à la foresterie conduisent à une succession de communautés fauniques qui est souvent différente de celle induite par les perturbations naturelles comme les feux de forêt (Buddle et al., 2000; Zhao et al., 2013). Les perturbations anthropiques peuvent donc avoir des effets à la fois sur les espèces en particulier et sur les communautés en général, et ce, à différentes échelles spatiales. Par exemple, la coupe forestière altère la composition de la forêt à l’échelle du peuplement, tout en diminuant la proportion de vieilles forêts à l’échelle du paysage (Bouchard & Pothier, 2011; Boucher et al., 2015).
c. Résilience et résistance des communautés
Les régimes de perturbations d’un écosystème font référence à la dynamique spatiale et temporelle des perturbations sur une longue période de temps. Ces régimes sont caractérisés entre autres, par la fréquence (nombre de perturbations par unité de temps), l’étendue (la surface perturbée), l’intensité (énergie d’une perturbation par unité de surface et de temps) et la sévérité (effet d’une perturbation sur les communautés) des perturbations (Turner, 2010). Lorsque plusieurs perturbations surviennent dans un cours laps de temps, l’écosystème peut alors s’engager vers des états d’équilibres différents de celui d’avant perturbation. Ces états alternatifs peuvent être irréversibles et avoir une composition en espèces distincte de l’écosystème initial (Walker & del Moral, 2003; Turner, 2010). La stabilité des écosystèmes face aux perturbations dépend notamment de leur résilience, résistance et robustesse (Pimm, 1984; Donohue et al., 2013). La résistance est la capacité d'un écosystème à maintenir sa structure et ses fonctions après perturbation, tandis que la résilience est la capacité du système à
4
absorber les changements, ou à revenir à un état initial stable ou à un fonctionnellement similaire (Holling, 1973; Pimm, 1991). Un écosystème peut donc être considéré résistant à une perturbation lorsque celle-ci n’entraîne que des changements mineurs dans sa composition (Sutherland, 1990). La résilience d’un écosystème sera influencée par les processus démographiques, les interactions biotiques et les conditions environnementales (Walker et al., 2004). Par exemple, un écosystème forestier résilient aura la capacité de se reconstituer à la suite d’une perturbation majeure (incendie, coupe, épidémie d’insecte) à partir de la banque de graines du sol, des communautés résiduelles, des propagules apportées par l'air, l'eau ou les animaux, ou encore de la faune du paysage environnant (Walker & del Moral, 2003; Fourrier et al., 2013). Les perturbations ont donc un rôle essentiel dans la répartition des espèces et l’organisation des communautés. Dans le contexte actuel de perte de biodiversité, il semble donc essentiel de bien comprendre comment les espèces animales réagissent aux perturbations anthropiques sur le long terme.
2. Facteurs influençant la répartition des animaux
a. Sélection d’habitat et réponses fonctionnellesBeaucoup d'espèces n'occupent pas la totalité de leur aire potentielle de répartition alors qu'elles pourraient survivre et se reproduire ailleurs que dans les zones qu'elles occupent. Plusieurs processus peuvent en effet limiter la répartition des espèces et les patrons de biodiversité, comme la dispersion, la sélection de l’habitat, les interactions entre organismes ou encore le climat (Krebs, 2001). La sélection d’habitat est donc un des principaux processus qui régit la répartition des animaux et de ce fait les patrons de biodiversité.
L’habitat peut être défini comme le type d'endroit où un animal vit, ou plus précisément, comme l’ensemble des ressources et des conditions nécessaires à son occupation par une espèce (Hall et al., 1997; Boitani & Fuller, 2000), et à l’intérieur duquel la densité de la population et au moins un des paramètres de croissance de population sont différents de ceux des habitats adjacents (Morris, 2003). La sélection
5
d’habitat est le processus par lequel les individus utilisent, ou occupent, un ensemble non aléatoire d’habitats parmi ceux qui sont disponibles (Morris, 2003). Les individus choisissent les milieux qui maximisent leur chance de survie, leur reproduction et donc leur valeur adaptative (Brown & Kotler, 2004). La sélection d’habitat a ainsi des conséquences sur la valeur adaptative et est responsable de la répartition des espèces du fait de l'utilisation sélective des ressources de l'habitat (McLoughlin et al., 2006; Jain & Balakrishnan, 2011). Pour comprendre les mécanismes sous-jacents à la coexistence des espèces, les effets directs des prédateurs, des compétiteurs et de l’environnement sur la sélection de l’habitat doivent être vérifiés (Indermaur et al., 2010). Les études de sélection de l'habitat sont donc souvent utilisées pour répondre aux problématiques de gestion et de conservation des populations et leurs habitats essentiels (Fortin et al., 2005; Losier et al., 2015). Un des problèmes rencontrés dans ces études est que la sélection peut varier entre les populations (Rettie & Messier, 2000), voire même entre les membres d’une population (Osko et al., 2004). Ces variations peuvent influencer notre perception des relations animaux-habitat et éventuellement créer un obstacle à l’utilisation des modèles de sélection d’habitat (Osko et al., 2004). Comprendre les raisons de ces variations et déterminer comment la sélection d’habitat s’organise dans le temps et dans l’espace constitue donc un défi, et les réponses fonctionnelles pourraient fournir une explication pour ces variations (Fortin et al., 2008).
Les réponses fonctionnelles dans la sélection de l'habitat se produisent lorsque les individus changent leur sélection en fonction de la disponibilité de caractéristiques particulières de l'habitat (Mysterud & Ims, 1998). Elles ont été largement utilisées pour expliquer l’aspect dynamique de la répartition spatiale des animaux. Les réponses fonctionnelles sont liées au fait que les espèces doivent faire des compromis dans leurs sélection d’habitat entre des milieux offrant différents types de ressources comme des sites d’alimentation ou avec couvert anti-prédateur (Mysterud & Ims, 1998). On peut donc s’attendre à ce que les animaux modifient leurs comportements pour continuer d’acquérir les ressources nécessaires à leurs reproductions et survie lorsque la disponibilité de ces ressources change. Les réponses fonctionnelles dans la sélection d'habitat ont été rapportées chez différentes espèces tels que les ours blancs Ursus
6
maritimus (Mauritzen et al., 2003), le cerf élaphe Cervus elaphus (Godvik et al., 2009) et le caribou des bois Rangifer tarandus (Losier et al., 2015). L’étude de la sélection d’habitat et des réponses fonctionnelles peut donc aider à comprendre comment les animaux peuvent s'ajuster aux variations des caractéristiques de l'habitat durant la succession après perturbations.
b. Interaction inter- et intra-spécifiques
Tout comme la sélection d’habitat, les interactions biologiques (compétition et prédation) jouent un rôle majeur dans la répartition des organismes et les patrons de biodiversité (Krebs, 2001). En effet, les espèces interagissent et certaines espèces peuvent présenter des patrons de cooccurrence ou d’évitement (Azeria et al., 2009). La prédation influence la répartition des proies par la consommation d’individus, de même que par son influence sur leur sélection d’habitat et leur répartition dans des environnements hétérogènes (Lima & Dill, 1990). La compétition peut également affecter la répartition des individus et donc la sélection d’habitat, la dynamique des populations et les patrons de biodiversité (Krebs, 2001; Boonstra & Krebs, 2006). On distingue différents types de compétition, tels que la compétition par exploitation et la compétition par interférence. La première se produit lorsque des individus d'une même espèce, ou de plusieurs espèces, sont affectés par la quantité de ressource qui subsiste après qu’elle ait été exploitée par d’autres individus. Dans le cas de la compétition par interférence, les individus interagissent directement, un individu empêchant un autre d’exploiter les ressources sur une portion d’habitat (Schmidt et al., 2005). Finalement, un troisième type de compétition, la compétition apparente, peut également jouer un rôle important dans la répartition des espèces. Il y a compétition apparente entre deux espèces de proie lorsque la réponse numérique du prédateur suivant l’augmentation de population de la première espèce de proie cause une diminution de la population de la deuxième espèce proie (Holt, 1977). Puisque les perturbations anthropiques ont un impact important sur l’environnement et la biodiversité, il semble nécessaire de bien comprendre les effets des modifications de l’habitat sur la compétition et la prédation (Morris et al., 2009).
7 c. Hétérogénéité de l’habitat
La différenciation des niches écologiques dans les environnements hétérogènes est considérée comme l’un des principaux mécanismes de coexistence des espèces (Kotler & Brown, 1999). La séparation des niches des espèces implique en général plusieurs dimensions comme l’alimentation, l’espace et le temps (Jones et al., 2001). Cette séparation entraîne une diminution du chevauchement de l’utilisation des ressources, ce qui diminue à son tour la compétition et permet donc la coexistence des espèces (Jones et al., 2001). Selon la théorie des niches écologiques, l’hétérogénéité de l’habitat permet d’augmenter la diversité en espèces (Hutchinson, 1957). En effet, plus un habitat est complexe, plus les ressources peuvent être divisées et exploitées différemment, et plus la faune et la flore y seront diversifiées (Tews et al., 2004). La végétation est donc considérée comme l’un des déterminants de la biodiversité faunique. Sa structure et sa composition varient dans le temps et l’espace et sont ainsi à l’origine de l’hétérogénéité des habitats fauniques. La composition végétale est définie comme la variété et la proportion des différentes espèces végétales. La structure, quant à elle, réfère à l’arrangement spatial de différents attributs de l’habitat et à la variété de ces structures telles que les arbres, les chicots, ou encore les débris ligneux au sol de différentes tailles et conditions dans les forêts (Franklin et al., 2002). Ces deux composantes sont des déterminants de la biodiversité animale trouvée dans un habitat. La composition agit en effet sur l'abondance et le type de ressources alimentaires disponibles, et peut donc avoir une influence importante sur la qualité et la quantité de ressources alimentaires disponibles pour la faune (Holmes & Robinson, 1981). Par exemple, les espèces d’arbres peuvent fournir différentes opportunités d’alimentation aux oiseaux et ainsi influencer leur présence ou leur abondance et donc les patrons de diversité (Holmes & Robinson, 1981). La structure influence, entre-autre, l'efficacité avec laquelle les animaux se déplacent à travers l'environnement pour s'alimenter. La structure influence aussi les comportements d’alimentation des oiseaux à travers la manière dont ils perçoivent et obtiennent leur nourriture (Robinson & Holmes, 1984). Les perturbations semblent donc également avoir des répercussions plus indirectes sur la répartition des espèces à travers son lien avec l’hétérogénéité d’un peuplement ou d’un paysage. Alors que les patrons de répartition des espèces en
8
fonction des perturbations anthropiques de l’habitat ont été largement décrits, peu d’études se sont spécifiquement intéressées aux mécanismes responsables de ces patrons durant la succession forestière.
3. La forêt boréale du Québec
a. La forêt boréale et ses perturbationsLa forêt boréale est l'écosystème forestier le plus étendu au monde puisqu'il couvre 11% de la surface terrestre de la Terre (Kuusela, 1992; Fourrier et al., 2013). La forêt boréale de l’Amérique du Nord s’étend de Terre-Neuve-et-Labrador à l’est jusqu’en Alaska à l’ouest. Cet écosystème est en constant changement notamment à cause des perturbations naturelles qu’on y rencontre. Les perturbations naturelles pouvant influencer un écosystème forestier sont nombreuses (e.g. senescence, épidémie d’insectes, vent, etc.). Le feu et les épidémies d’insectes sont notamment des perturbations qui peuvent, dans de nombreux écosystèmes forestiers, interagir et affecter la succession, le cycle des nutriments et la composition des espèces forestières (McCullough et al., 1998). Le feu est la perturbation naturelle principale de la forêt boréale sur la région de la Côte Nord et l’intervalle de temps moyen entre des feux successifs est de 270 ans (Bouchard et al., 2008; Gauthier et al., 2010a). Un peuplement issu d’un feu développe d’abord une structure régulière, car les arbres sont au même stade de croissance. Plus tard durant la succession, les perturbations secondaires (i.e. épidémies d’insectes, chablis, sénescence des arbres) créent une dynamique de trouées qui engendrent de vieilles forêts inéquiennes avec des peuplements d’arbres d’âges divers et de structure irrégulière.
Un nouveau facteur de perturbation s’est ajouté avec le développement de l’industrie forestière au XIXème siècle. Au cours du dernier siècle, au moins au Canada, la zone de coupe à blanc a considérablement augmenté (Hart & Chen, 2006), et ce taux plus élevé est particulièrement évident dans certaines zones de la forêt boréale où le cycle de feu est plus long que l'âge de rotation des coupes (Fourrier et al., 2013). L’exploitation forestière constitue un des principaux moteurs économiques du
9
Canada, y compris dans plusieurs régions québécoises. Depuis plusieurs années, il y a une volonté de développer des aménagements forestiers durables qui intègrent des objectifs à la fois écologiques et économiques. L’aménagement forestier écosystémique repose souvent sur une exploitation des peuplements forestiers qui imite des perturbations naturelles afin de mieux conserver la biodiversité (Gauthier et al., 2010b). L’aménagement forestier écosystémique joue notamment sur les techniques sylvicoles utilisées et la fréquence de rotation de coupe. Ainsi, la stratégie de rétablissement du caribou forestier implique qu’une rotation de 50 ans pourrait être appliquée, et donc qu’après cette période la forêt retrouve les attributs qui lui sont essentiels (Courtois et al., 2004; Gauthier et al., 2010b; Canada. Environment Canada., 2012). Cette période de temps est considérablement plus courte que le cycle de feu naturel dépassant les 270 ans observés dans la forêt boréale de l’Est du Québec (Bouchard et al., 2008), et pourrait donc modifier les assemblages d'espèces au cours de la succession sans retrouver la biodiversité initiale observée.
Le régime de perturbation engendré par l’aménagement forestier peut donc différer du régime naturel sur plusieurs aspects au niveau de sa fréquence, son étendue, sa sévérité et sa disposition dans l’espace (Angers et al., 2005). Les traitements sylvicoles adaptés à des peuplements dont la structure est régulière, tels que les Coupes avec Protection de la Régénération et des Sols (CPRS), sont les traitements les plus communs dans la forêt boréale de l’Amérique du Nord (Youngblood & Titus, 1996; Hart & Chen, 2006). Les coupes à blanc comme les CPRS sont des coupes caractérisées par une faible rétention d’arbres (i.e. <10% de rétention), et sont donc des traitements sylvicoles plus adaptés à des peuplements dont la structure est régulière. En effet, dans le cas d’une CPRS, toutes les tiges marchandes (diamètre à hauteur de poitrine > 9 cm) sont récoltées tout en protégeant la régénération existante, ramenant le peuplement en début de succession avec une structure d’âge et de hauteur similaire. Effectuer ces coupes dans les forêts où les peuplements ont majoritairement une structure irrégulière pourrait donc ne pas permettre de maintenir la biodiversité locale. En conséquence, les coupes tendent à causer le remplacement d’espèces animales associées aux forêts matures par des espèces de milieux ouverts ou généralistes (Saint-Germain et al., 2005; Le Blanc et al., 2010; Bichet et al., 2016).
10
b. Études et connaissances sur les effets des coupes forestières Au cours des dernières décennies, de nombreuses études ont ainsi documenté les processus de perturbations naturelles dans les écosystèmes de la forêt boréale, et cela dans le but de maintenir ces processus autant que possible à travers à la gestion forestière (Bergeron et al., 1999, 2006). Il y a notamment eu une augmentation et une concentration particulière des études sur les perturbations des écosystèmes forestiers (Attiwill, 1994). La plupart des études comparant les communautés animales dans les peuplements coupés en forêt boréale et dans les peuplements naturels se sont cependant concentrées sur les impacts à court terme et seulement sur quelques espèces, voire un seul taxon (Punttila et al., 1991; Saint-Germain et al., 2005; Hodson et al., 2010b; Légaré et al., 2011). Par exemple, une question fondamentale soulevée par Niemelä (1999) demeure : combien de temps faut-il aux assemblages d'espèces pour se rétablir après l'exploitation forestière? De telles informations sont nécessaires pour déterminer les rotations entre les récoltes qui permettraient de mieux préserver la biodiversité régionale. En effet, si les rotations sont trop courtes, les communautés animales peuvent ne pas avoir suffisamment de temps pour se diriger vers des communautés forestières typiques de l’écosystème locale (p.ex., écosystème de vieilles forêts). Le temps nécessaire au rétablissement de la biodiversité d’origine reste incertain (Imbeau et al., 2001). Les études avec des observations directes et répétées de l’impact des coupes sur la faune sont essentielles pour fournir les preuves des changements temporels dans les communautés mais sont souvent limitées à quelques années (Le Blanc et al., 2010; Martineau et al., 2016). Les chronoséquences sont donc souvent des outils essentiels et nécessaire pour pouvoir étudier la dynamique temporelle des communautés sur différentes échelles de temps (Walker et al., 2010). Afin de mieux comprendre l’impact de la foresterie sur la biodiversité animale, il est ainsi possible d’évaluer les changements de qualité de l’habitat pour diverses espèces pouvant coexister le long d’un gradient de succession après coupe forestière. Peu d’études se sont toutefois intéressées à ces changements (Hodson et al. 2010b), de sorte que nos connaissances des facteurs responsables des changements de biodiversité durant la succession forestière restent encore fragmentaires.
11
Les études des effets des perturbations anthropiques peuvent utiliser entre autres des approches expérimentales afin de mener des recherches fondamentales et améliorer les connaissances des mécanismes qui opèrent dans la nature (e.g. Boulet et al., 2000; Lemaître et al., 2010), ou des études plus appliquées comparant l’utilisation d’habitats issus de perturbations variant selon leur étendue, fréquence, etc. (e.g. Boulet et al., 2003; Hodson et al. 2010b). Peu de chercheurs se sont intéressés aux contributions complémentaires que ces deux approches peuvent avoir en regard de la compréhension des effets des activités humaines sur les écosystèmes et la faune en particulier. L’étude du comportement et de la répartition des animaux durant la succession forestière après coupe et dans les forêts matures (à l’aide de divers expérimentations et outils écologiques) devrait donc nous permettre d’améliorer notre compréhension de ces liens de causalité entre la perturbation de l’habitat et la répartition des organismes; et éventuellement permettre d’apporter des informations nécessaires à une gestion durable. Il existe notamment plusieurs théories écologiques qui peuvent permettre d’évaluer les processus sous-jacents aux patrons de répartition des espèces, notamment durant la succession écologique.
4. Utilisation des théories et outils écologiques pour
comprendre
la
répartition
animale
après
perturbations anthropiques
Plusieurs théories et outils ont ainsi été développés afin de mieux comprendre les processus déterminant la répartition des espèces, certaines sur les assemblages et d’autres sur la sélection d’habitat. L’ensemble offre une base robuste pour le design et l’analyse d’études visant à mieux comprendre ces processus. J’expliquerai brièvement certaines de ces théories écologiques et outils qui semblent particulièrement pertinents pour comprendre les patrons de biodiversité et la répartition animale dans des paysages hétérogènes.
12
a. Structuration des communautés et modèles nuls
On distingue deux types de facteurs pouvant influencer la structuration des communautés : stochastiques et déterministes (Azeria et al., 2012). Les facteurs stochastiques représentent les processus aléatoires de colonisation, d’extinction et de spéciations des espèces (Hubbell, 2001). Les processus déterministes regroupent les contraintes environnementales (i.e. conditions du milieu qui permettent aux espèces de survivre et se développer), de dispersion (i.e. les espèces capables de coloniser le site), de coexistence (i.e. interactions biotiques entre les espèces) (Belyea & Lancaster, 1999). Les effets des processus déterministes et stochastiques sur la structuration des communautés peuvent fortement dépendre de modifications de l'habitat (Chase, 2007) et de la succession écologique (Ellwood et al., 2009). Même si les perturbations telles que l'exploitation forestière sont connues pour affecter les communautés (Koivula & Niemelä, 2003), l’impact relatif sur les processus stochastiques et déterministes restent incertains.
Ces processus peuvent être dévoilés en utilisant des modèles nuls. Cette approche est basée sur des analyses de cooccurrence impliquant la comparaison de données de terrain (i.e. présence d’espèces) à des patrons de cooccurrence générés par randomisation (Gotelli, 2000; Peres-Neto et al., 2001; Gotelli & Ellison, 2002). Le but de telles comparaisons est de déterminer si les espèces d’une communauté sont plus ou moins similaires à ce qui est attendu sous l’hypothèse d’un assemblage aléatoire, et de révéler ainsi l’influence d’autres facteurs. En effet, si les processus stochastiques sont responsables de la structuration de la communauté, les cooccurrences d’espèces ne devraient pas être différentes de celles aléatoires. Inversement, si les espèces coexistent plus ou moins que ce qui est attendu aléatoirement, des processus déterministes structurent la communauté (Larsen & Ormerod, 2014). De plus, en incluant des contraintes de l’habitat dans les modèles nuls, il est alors possible d’identifier les processus sous-jacents aux patrons de répartition des espèces et de distinguer entre un effet de l’habitat et les interactions interspécifiques (Peres-Neto et al., 2001).
13 b. Isodar
Plusieurs études ont utilisé les isodars afin d’évaluer si la sélection de l’habitat change selon la densité d'individus pour diverses espèces (Poysa, 2001; Ramp & Coulson, 2002; Hodson et al., 2010b). Les isodars permettent de comprendre comment les patrons de sélection varient selon les variations de structure d'habitat provenant de perturbations et, ainsi, déterminer les conséquences de ces perturbations de l’habitat en termes de valeur adaptative (Pusenius & Schmidt, 2002; Hodson et al., 2010b). Au fur et à mesure que la densité de population augmente dans un habitat, la valeur adaptative va diminuer du fait du partage des ressources (Fretwell & Lucas, 1970). Selon la distribution libre idéale, les individus vont en premier lieu se regrouper dans les habitats de meilleure qualité (Fig I.1a), puis les individus devraient obtenir une valeur adaptative égale en se déplaçant dans des habitats de qualité inférieure mais avec une densité moindre (Fretwell & Lucas, 1970). À l’équilibre, la valeur adaptative moyenne est alors la même dans toutes les parcelles et les individus ne peuvent pas l’augmenter en changeant de parcelle. La variation locale de la densité des individus peut donc être évaluée selon les principes théoriques de la sélection optimale des habitats, notamment grâce aux isodars (Morris, 1988), et ainsi révéler l’effet de la modification du milieu sur les animaux. Dans un contexte où les individus peuvent choisir d’occuper un habitat parmi deux adjacents, l’isodar indique comment les animaux devraient se répartir pour que tous aient une valeur adaptative équivalente (Fig I.1b).
14
Figure I.1: a) Exemple de relation entre la valeur adaptative et la densité des individus
dans deux habitats de qualité différentes, A étant de meilleure qualité que B. b) Isodar issu du tracé de la densité de l'habitat A en fonction de la densité de l'habitat B, d’après Morris (1988).
Les habitats peuvent varier qualitativement au niveau des structures ou du type de ressource, et quantitativement dans la disponibilité des ressources (Morris, 1988). L'ordonnée à l'origine de l'isodar (Fig 1.b) montre la différence relative entre les deux habitats en termes de valeur adaptative maximale qui peut être atteinte à faible densité (quantitatif). La pente reflète le taux relatif avec lequel la valeur adaptative diminue dans chaque habitat à mesure que la densité d'individus augmente (qualitatif). Des habitats adjacents de qualité équivalente devraient produire un isodar avec une ordonnée à l'origine de zéro et une pente d’un (Morris, 1988). Un changement dans la qualité des habitats altère la relation entre la valeur adaptative et la densité des individus, ce qui devrait entraîner une variation dans l’abondance relative des individus parmi les habitats et donc dans l’isodar. Cette approche peut donc permettre de comprendre les conséquences des changements de structure d'habitat provenant des perturbations anthropiques sur la qualité de l’habitat perçue par la faune et sur les interactions de compétition (Hodson et al., 2010b).
c. Densité à l’abandon (GUD)
Des facteurs comme la prédation ou la qualité globale de l’habitat sont d’importants processus à prendre en compte dans l’étude de la répartition animale et peuvent
Densité de population V al eu r ad ap ta ti v e
Densité dans l’habitat B
D en si té d an s l’ h ab it at A Habitat A Habitat B (a) (b)
15
influencer les comportements d’alimentation des espèces animales (Brown, 1988). Ainsi, il est possible d’évaluer comment varie l’importance de ces facteurs de façon spatiales ou temporelles en caractérisant les variations dans l’effort d’approvisionnement des animaux. En effet, selon le théorème de la valeur marginale et la théorie d’approvisionnement optimal, un individu qui s'approvisionne dans une parcelle de nourriture devrait exploiter cette parcelle jusqu'à ce que les bénéfices énergétiques gagnés par l'acquisition de nourriture égalisent les coûts d'approvisionnement (Charnov, 1976; Brown, 1988). Un individu qui se comporte de manière optimale devrait abandonner la parcelle de nourriture lorsque son taux de gain est égal aux coûts métaboliques d’approvisionnement (C), aux coûts de prédation (P) et aux coûts des opportunités manquées (COM) de ne pas s’engager dans des activités alternatives (p.ex., se rechercher un partenaire sexuel ou s’alimenter ailleurs) (Brown, 1988). La densité de ressource laissée alors dans la parcelle de nourriture une fois qu’elle a été abandonnée par une espèce donnée (densité de nourriture à l’abandon [GUD], de l’anglais « giving up densities ») reflète ainsi les coûts liés à l’exploitation de la parcelle. En contrôlant expérimentalement certains de ces coûts associés à l’approvisionnement, il est alors possible d’utiliser des mesures de densités à l’abandon pour déterminer comment des changements dans l’environnement peuvent influencer la perception qu’ont les animaux du risque de prédation et de l’intensité de la compétition.
Pour pouvoir déduire les différences de qualité entre deux habitats à partir des données de GUD, les effets spécifiques des coûts d’alimentation (risque de prédation, métabolique, et opportunités manquées) doivent être identifiés (Rieucau et al., 2009). Un risque de prédation élevé, un coût métabolique important ou encore une forte abondance de nourriture dans l’environnement immédiat peuvent en effet produire des GUD élevés, ce qui ne permet pas d’en déduire la qualité de l’habitat (Rieucau et al., 2009). Il est néanmoins possible de clarifier les divers coûts associés à l’approvisionnement en adoptant une approche expérimentale. Par exemple, les coûts de prédation associés à l'approvisionnement peuvent être estimés en mesurant la différence de GUD dans une paire expérimentale de parcelles de nourriture, distante de 1-2 m et dont l'une est localisée sous un épais couvert anti-prédateur (GUDC) et l'autre
16
est placée en milieu plus ouvert (GUDO) (Morris & Davidson, 2000; Andruskiw et al.,
2008; Lemaître et al., 2010). L’effort d’approvisionnement sera alors moindre dans la parcelle plus risquée (GUDO > GUDC). La différence d’effort d’approvisionnement
entre ces deux parcelles adjacentes (ΔGUD = GUDO – GUDC) offre une mesure du
risque de prédation telle que perçu par l’animal. Les patrons d’exploitation des parcelles de nourriture peuvent ainsi montrer comment le risque de prédation peut restreindre l'exploitation de la nourriture et donc la répartition des individus dans des habitats modifiés par des perturbations telles que les coupes totales. D’autre part, le modèle de Rieucau et al. (2009) permet de calculer les coûts d’opportunités manquées en ajoutant une mangeoire avec plus de nourriture que dans les autres. Les coûts associés aux opportunités manquées seront inférieurs dans la mangeoire supplémentaire (GUDS) que dans la mangeoire initiale (GUDO), car la nourriture
alternative dans l'habitat se compose alors de toutes les sources alimentaires naturelles et du bac initial qui a moins de nourriture que le supplémentaire. Cette comparaison des GUD entre la mangeoire supplémentaire et l’initiale (ΓGUD= GUDS – GUDO) ne
devrait pas varier à l'intérieur d’un même habitat, mais pourrait différer entre les habitats. Ainsi, un risque de prédation faible va produire de petites valeurs de ΔGUD, alors qu’une nourriture abondante dans l’habitat produira des valeurs élevées de ΓGUD.
Les compromis entre maximiser les gains d'énergie et minimiser le risque de prédation peuvent ainsi créer une variation spatiale considérable dans l'effort d'approvisionnement. Les perturbations agissant sur la structure de l’habitat, il semble donc important d’étudier les déplacements dans l’habitat le long d’un gradient de succession pour pouvoir mieux comprendre les mécanismes par lesquels les perturbations influencent la répartition des proies dans les différents stades de successions.
d. Analyse des déplacements
Les espèces mobiles se déplacent dans l’environnement pour accéder aux ressources dont elles dépendent. L’étude des stratégies de déplacement peut donc informer sur le processus menant à la répartition spatiale des animaux, et par là même sur les