Trois essais en analyse bioéconomique de la résistance
aux antibiotiques
Thèse
Isaora Zefania DIALAHY
Doctorat en Économique
Philosophiae doctor (Ph.D.)
Québec, Canada
Trois essais en analyse bioéconomique de la résistance
aux antibiotiques
Thèse
Isaora Zefania DIALAHY
Sous la direction de :
iii
RESUMÉ
Cette thèse, organisée en trois essais, porte sur l’économie de la santé des populations et traite l’analyse bioéconomique de la résistance aux antibiotiques. Elle aborde les enjeux sociaux économiques de l’utilisation inter-temporelle des antibiotiques en considérant l’efficacité de traitement comme une ressource renouvelable ou non renouvelable. Nos résultats d’analyse visent une contribution scientifique à la gestion parcimonieuse, efficace et durable des antibiotiques disponibles. Un tel objectif apparait aujourd’hui comme une alternative viable à la capacité limitée du marché à offrir de nouveaux antibiotiques contre les bactéries résistantes. Nous combinons ici (1) une approche épidémiologique, qui permet de modéliser la transmission des maladies infectieuses et l’efficacité de traitement des antibiotiques, et (2) une approche économique qui consiste à modéliser la demande d’antibiotiques et le taux de traitement de la population.
Le premier essai (chapitre I) porte sur l’analyse dynamique de l’usage médical d’antibiotiques dans un contexte de la résistance bactérienne. Nous comparons ici le taux de traitement médical avec le taux de traitement socialement optimal. Nous postulons un modèle avec un médecin représentatif qui traite la population avec un seul antibiotique. La demande d’antibiotique dépend de la fraction d’individus prêts à payer pour obtenir le traitement. L’utilité instantanée du médecin dépend du revenu de son travail et du niveau d’altruisme par lequel il intègre le bien-être de la population dans son objectif. Sous ces hypothèses, les résultats de simulation montrent une forte incitation à prescrire l’antibiotique lorsque le médecin est altruiste et lorsqu’il bénéficie d’une rémunération fixe lui garantissant une ressource financière stable en tout temps. Dans cette situation, le médecin accorde une priorité à la guérison des patients et surutilise l’antibiotique, accélérant ainsi l’effet de la résistance bactérienne. Ce qui n’est pas le cas lorsque le médecin est rémunéré à l’acte qui sous-utilise l’antibiotique à court et à moyen termes. En prescrivant moins l’antibiotique, il anticipe qu’une hausse de l’infection augmente son revenu dans le futur.
Le second essai (chapitre II) analyse la demande d’antibiotiques en accès libre lorsque deux antibiotiques sont disponibles. Le modèle épidémiologique développé à cet effet montre une interaction entre les réservoirs d’efficacité de traitement. Les fonctions d’interaction spécifiées ici peuvent avoir un effet positif (mutualisme) ou défavorable (prédation) à l’évolution des efficacités de traitement des antibiotiques. Les résultats de simulation montrent que les patients utilisent d’abord l’antibiotique doté d’un rapport qualité cout élevé (qualité relative) et ayant la plus forte guérison additionnelle. Cet avantage de traitement tend vite à diminuer sous l’effet de la résistance alors que l’efficacité de traitement de l’antibiotique substitut s’apprécie. Les patients vont ensuite utiliser les deux antibiotiques en même temps. Cet effet de substitution est en particulier favorisé par l’interaction positive entre les efficacités de traitement. A l’état stationnaire, cet effet mutualisme disparait et l’un des antibiotiques ne sera plus utilisé.
Le troisième essai (chapitre III) examine l’ordre optimal de l’utilisation des antibiotiques dans un cadre social. L’objectif du planificateur social consiste à maximiser le bien-être agrégé de la population, y compris celui des individus en bonne santé. Le cout social d’utilisation d’un antibiotique inclut à la fois le cout de production pharmaceutique et les couts externes de traitement liés à la résistance aux antibiotiques et au risque de contagion des infections. Les résultats d’analyse montrent qu’on doit utiliser les antibiotiques par ordre séquentiel lorsqu’un antibiotique domine sur l’autre à la fois en termes de qualité relative (rapport qualité-coût social) et de qualité nette (différence qualité-coût social). En revanche, il convient d’utiliser les deux antibiotiques simultanément lorsqu’ils ont chacun un avantage de traitement sur l’autre, l’un en termes de qualité relative et l’autre en termes de qualité nette.
iv
ABSTRACT
This thesis adds to the literature of population health by taking an economic perspective. Specifically, it focuses on the bioeconomic analysis of antibiotic resistance. It addresses the socioeconomic issues of the inter-temporal use of antibiotics by considering treatment efficacy of an antibiotic as a renewable or non-renewable resource. Our analysis informs the scientific debate on the parsimonious, effective and sustainable management of available antibiotics. This type of management now appears as a viable alternative to the limited ability of the market to offer new antibiotics capable of dealing with resistant bacteria. We combine (1) an epidemiological approach, which allows the modelling of the transmission of infectious diseases and antibiotic efficacy treatment, and (2) an economic approach, which consists in modelling the demand for antibiotics as well as the private and socially optimal treatment rate of antibiotics.
This thesis is organized in three essays. The first essay (Chapter I) focuses on the dynamic analysis of a physician’s prescription rate/ use of antibiotics in a context of bacterial resistance. We compare the physician’s treatment of medical treatment with the socially optimal treatment rate. We postulate a model with a representative physician who treats the population with a single antibiotic. The demand for antibiotics depends on the fraction of individuals willing to pay for the treatment given a prevailing level of antibiotic resistance. The physician's instant utility depends on the income from his work and the level of his/her altruism towards the population welfare. Under these hypotheses, the results show a strong incentive to prescribe the antibiotic when the physician is altruistic and receives a fixed remuneration at all times. In this case, the physician gives priority to healing patients and overuses the antibiotic, accelerating therefore the effect of bacterial resistance. This is not the case when the physician is paid via a fee for services, he/she underutilizes the antibiotic in the short and medium term. By prescribing the antibiotic less, he/she anticipates that an increase in infection will increase his/her remuneration in the future.
The second essay (Chapter II) analyzes the demand of the antibiotics available under open access (generic industry) when two antibiotics are available. The epidemiological model developed for this purpose shows an interaction between the reservoirs of treatment efficiency. The interaction functions specified here may have a positive (mutualism) or unfavourable (predation) effect on the evolution of antibiotic treatment efficiencies. Simulation results show that patients first use the antibiotics with the high quality-cost ratio (relative quality) and the greatest additional recovery rate. This advantage tends to decrease under the effect of rising bacterial resistance while the treatment efficiency of the substitute antibiotic increases. Patients will then use both antibiotics simultaneously. This substitution effect is in particular favoured by the positive interaction between the treatment efficiencies. At steady state, this mutualism effect disappears and only one of the antibiotics (depending on the bio-economic parameters) will be used.
The third essay (Chapter III) examines the optimal order of the use of antibiotics from social point of view. The goal of the social planner is to maximize the aggregate welfare of the population, including that of healthy individuals. The social cost of using an antibiotic includes pharmaceutical production costs, the external costs of treatment related to antibiotic resistance and the risk of contagion. The results of the analysis show that the antibiotics should be used in sequential order when one antibiotic dominates the other in terms of relative quality (social quality-cost ratio) and net quality (social quality-cost difference). On the other hand, both antibiotics should be used simultaneously when one dominates in terms of relative quality and the other in terms of net quality.
v
TABLE DES MATIÈRES
RESUMÉ iii
ABSTRACT iv
TABLE DES MATIÈRES v
LISTE DES TABLEAUX vii
LISTE DES FIGURES viii
REMERCIEMENTS ix
AVANT PROPOS x
INTRODUCTION 1
Chapitre I : Analyse dynamique de l’usage médical d’antibiotiques 3
1.1. Introduction ... 4
1.2. Modèle épidémiologique avec une infection et un antibiotique ... 6
1.3. Modélisation économique de l’usage médical d’antibiotiques ... 9
1.4. Optimum social ... 20
1.5. Simulations numériques ... 24
1.6. Conclusion ... 31
Chapitre II : Demande d’antibiotiques en accès libre sous l’effet de substitution des efficacités de traitement 32 2.1. Introduction ... 33
2.2. Modèle épidémiologique avec deux infections et deux antibiotiques ... 34
2.3. Modèle de demandes d’antibiotiques ... 40
2.4. Taux de traitement en accès libre ... 43
2.5. Dynamiques comparatives ... 44
2.6. Conclusion ... 48
Chapitre III : Ordre optimal d’usage d’antibiotiques et interaction d’efficacités de traitement 49 3.1. Introduction ... 50
3.2. Utilité sociale ... 52
3.3. Programme social ... 53
3.4. Taux de traitement social ... 56
vi
3.6. États stationnaires en optimum social ... 71 3.7. Dynamiques comparatives ... 75 3.8. Conclusion ... 79 CONCLUSION 81 ANNEXES A 83 ANNEXES B 88 ANNEXES C 92 RÉFÉRENCES 97
vii
LISTE DES TABLEAUX
1.1 Valeurs de base des paramètres 25
1.2 État stationnaire et valeurs propres (en annexes A) 85
2.1 Valeurs de base des paramètres 38
2.2 Fitness-cost et durée de la phase d’usage simultanée d’antibiotiques 48
3.1 Valeurs de base des paramètres 59
3.2 Ordre d’utilisation des antibiotiques pour le traitement de l’infection 1 60 3.3 Ordre d’utilisation des antibiotiques pour le traitement de l’infection 2 63 3.4 Comparaison du bien-être de la population : accès libre versus optimum social 69 3.5 Liste des figures connexes à la dynamique comparative au taux de guérison additionnel 77 3.6 Liste des figures connexes à la dynamique comparative au fitness-cost 78
viii
LISTE DES FIGURES
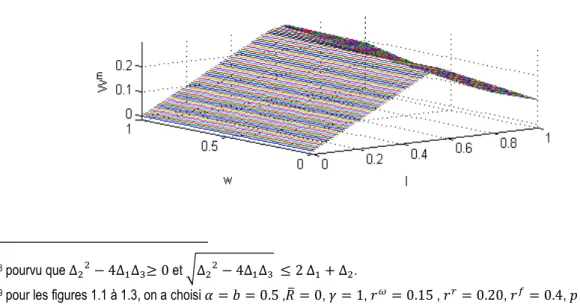
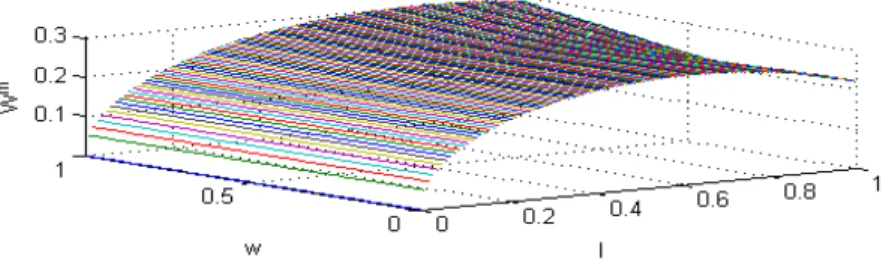
1.1.a Fonction valeur du médecin ( ) et taux de traitement médical ( ∗) avec → −∞ 14 1.1.b Fonction valeur du médecin ( ) et taux de traitement médical ( ∗) avec = 1 15 1.1.c Fonction valeur du médecin ( ) et taux de traitement médical ( ∗) avec = 0 16 1.2 Altruisme, taux de prescription médical, infection et efficacité de traitement 27 1.3 Système de rémunération, taux de prescription médical, infection et efficacité de traitement 28
1.4 Traitement des patients et poids accordé aux individus en santé 30
1.5 Degré de substituabilité entre et , taux de prescription, infection et efficacité de traitement
(en annexes A) 86
1.6 Infection et efficacité de traitement en cas de prise en compte des individus en santé ( = 1)
(en annexes A) 87
2.1 Infection 1 ( ) et efficacités de traitement ( , , ) (dynamique biologique) 39 2.2 Effets d’interaction entre les efficacités de traitement (dynamique biologique) 40 2.3 Dynamique comparative des taux de traitement de l’infection 1 en accès libre et couts de
production d’antibiotiques 45
2.4 Dynamique comparative des taux de traitement de l’infection 1 en accès libre et taux de
guérison additionnels 46
2.5 Dynamique comparative des taux de traitement de l’infection 1 en accès libre et fitness-cost
∆ , ∆ (%) 47
2.6 Fonctions d’interaction entre les efficacités de traitement (modèle biologique) (en annexes B) 90 2.7 Effets d’interaction entre les efficacités de traitement en accès libre (en annexes B) 91 3.1 Usage optimal des antibiotiques 1 et 2 pour le traitement de l’infection 1 61 3.2 Usage optimal des antibiotiques 1 et 2 pour le traitement de l’infection 2 64 3.3 Infection 1 et efficacités de traitement des antibiotiques en accès libre et en optimum social 67
3.4 Convergence vers les états stationnaires et 72
3.5 Convergence vers les états stationnaires et 73
3.6 Taux de traitement, prix social relatif et cout de production 76
3.7 Taux de traitement et taux de guérison additionnels 77
3.8 Taux de traitement social et fitness-cost ∆ (%) 79
3.9 Infection 1 ( ) et efficacités de traitement ( ) en optimum social (en annexes C) 92 3.10 Infection 1 ( ) et efficacités de traitement ( ) en optimum social (en annexes C) 93 3.11 Couts externes de traitement de l’antibiotique 2 en optimum social (en annexes C) 94 3.12 Effet de résistance et fitness-cost ∆ (%) en optimum social (en annexes C) 95 3.13 Effet de renouvellement des efficacités de traitement et fitness-cost ∆ (%) en optimum social
ix
REMERCIEMENTS
Au terme de la rédaction de ma thèse doctorale, je remercie Dieu pour tous ses bienfaits, son amour et pour sa présence permanente à mes côtés. Par son Fils Jésus Christ, Il a exhaussé mes prières et m’a permis de jouir de la réussite et de persévérer à toutes les épreuves de ma vie.
Ce travail, qui, certes, cumulait de milliers d’heures de recherche, serait loin d’être à ce niveau s’il n’avait bénéficié de l’attention, des soins et de la réflexion d’un grand nombre de personnes. Je suis heureux de pouvoir exprimer ici ma gratitude envers eux.
Mes remerciements vont d’abord à l’endroit de mon Directeur de thèse, le Professeur Markus Herrmann. Sa grande disponibilité, ses conseils et orientations m’ont guidé en permanence tout au long de la réalisation de ma thèse. J’ai beaucoup appris grâce à son sens poussé de la rigueur scientifique. Ses compétences et ses nombreux feedback à l’égard de mon travail sont d’une valeur inestimable et ont contribué de manière significative à faire progresser ma thèse. C’est avec un immense plaisir que je lui adresse mes sincères remerciements d’avoir cru en moi et d’avoir permis que j’aille jusqu’au bout de ma thèse.
Je tiens également à remercier toute l’équipe de la CREATE et du département Économique pour le cadre de travail agréable ainsi que le confort matériel mis à ma disposition pour le bon déroulement de ma recherche doctorale. Aussi, voudrais-je rendre hommage à tout le corps administratif et professoral du département Économique. Je citerai particulièrement Sylvain Dessy, Jean-Yves Duclos, Philippe Barla, Guy Lacroix, Michel Roland, Benoit Carmichael, Kevin Moran, Carlos Ordás Criado, Bernard Fortin, Stephan Gordon, Martine Guay, Josée Desgagnés, Diane Nadeau, Jacinthe Morin et Ginette Therrien.
Je témoigne également toute ma gratitude envers le FQRS, le département d’économique et la Faculté des sciences sociales qui ont assuré le soutien financier de mes études et de ma recherche doctorale.
Je formule toute ma reconnaissance à mes collègues étudiants pour leur solidarité et leur collaboration envers ma personne. Je me permets de citer particulièrement Koumou Gilles, Bodel Aymele, Laingo Manitra, Safa Radueg, Sara Trabelsi, Ibrahima Sarr, Koffi Akakpo, Setou Diarra, Nono Simplice, Guelmbaye Ngarsandje, Bahareh Mosadegh, Jean Armand et Melissa Huguet.
Je voudrais enfin exprimer ma profonde gratitude envers ma famille pour leur soutien permanent à mon endroit. Puissent être remerciés particulièrement mon père, ma mère, mes frères et sœurs et Luna qui m’ont supporté tout au long de mon parcours. Je remercie chaleureusement toutes celles et ceux qui m’ont côtoyés à l’Université Laval.
x
AVANT PROPOS
La présente thèse, rédigée en trois essais, traite l’« Analyse bioéconomique de la résistance bactérienne ». Le premier essai de ma thèse (chapitre I) présente une analyse dynamique de l’usage médical des antibiotiques. Ce chapitre modélise en particulier le comportement du médecin représentatif qui prend conscience de la situation que la prescription d’antibiotiques a un effet à long terme sur l’efficacité de traitement représentant une externalité négative. Il s’agit d’un modèle simplifié avec un antibiotique et une seule infection. Les deux derniers essais (chapitres II et III) n’incluent pas le comportement du médecin mais introduit la possibilité d’avoir des antibiotiques substituts. Ces chapitres modélisent en particulier le cas des bactéries pouvant être multi-résistantes et établissent l’ordre dans lequel les antibiotiques devraient être utilisés pour y faire face. Notons que les chapitres de la présente thèse sont en cours de traduction pour concrétiser des articles à paraitre dans des revues scientifiques avec comité de lecture pour publication. J’affirme être l’auteur principal de mes trois chapitres de thèse.
Dans cette thèse, je me suis chargé d’établir les modèles théoriques, de les résoudre et de procéder aux simulations numériques. Je dois fournir un cadre d’analyse objective pour un usage efficace (et possiblement plus parcimonieux) des antibiotiques disponibles. Les résultats de mon analyse doivent compléter la solution fondée uniquement sur la recherche de nouveaux antibiotiques sans toutefois nuire à l’incitation à l’innovation. L’approche inter-temporelle que j’adopte tout au long de cette thèse permet de planifier l’utilisation des antibiotiques à un horizon fini et relativement long. Cela permet d’avoir une solution approximative à la gestion durable des efficacités de traitement des antibiotiques.
1
INTRODUCTION
En raison du développement de la résistance bactérienne, on s’inquiète aujourd’hui de la façon dont notre société utilise les antibiotiques. La résistance bactérienne affecte la qualité des antibiotiques en réduisant leur efficacité de traitement. Ces médicaments ne sont plus aujourd’hui aussi efficaces qu’auparavant pour traiter les maladies infectieuses et cela engendre des conséquences à la fois sur les populations et sur les économies. La résistance aux antibiotiques est à l’origine de 700 000 décès par an dont 200 000 parmi les nouveaux nés (Nations Unies, 2016)1. La perte économique est estimé à une centaine de milliards de dollars US par an d’ici 2050, soit environ une réduction de 1,1 à 3,8% de la production mondiale selon un rapport britannique publié en 2016 par Goldman Sachs2. A défaut d’antibiotiques substituts, on doit non seulement craindre une guérison moins rapide mais l’inefficacité totale du traitement, qui est, sans doute, le pire des scenarios sanitaires. Un rapport récent de l’Organisation Mondiale de la Santé (OMS) tient à alarmer le monde sur la découverte d’une douzaine de familles de bactéries résistantes, communément appelées « super-bactéries », pour lesquelles il devient urgent de développer de nouveaux antibiotiques (World Health Organization (WHO), media centre, 2017). Cette agence de santé des Nations Unies tire régulièrement la sonnette d’alarme sur le risque accru causée par la résistance aux antibiotiques à en croire la citation suivante.
«L’efficacité des antibiotiques est l’un des piliers de notre santé, nous permettant de vivre plus longtemps, en meilleure santé, et de bénéficier de la médecine moderne. Si nous ne prenons pas des mesures significatives pour mieux prévenir les infections mais aussi pour modifier la façon dont nous produisons, prescrivons et utilisons les antibiotiques, nous allons perdre petit à petit ces biens pour la santé publique mondiale et les conséquences seront dévastatrices.» (Dr Keiji Fukuda, OMS, Genève 2014).
Chaque année, l’OMS consacre même un rapport (WHO, Antimicrobial resistance Global Report on Surveillance, 2014) permettant de suivre l’évolution annuelle de ce phénomène à travers le monde. Ce rapport souligne notamment, dès 2014, qu’il manque des mesures efficaces permettant d’endiguer la résistance bactérienne. Et, sans actions urgentes, le monde se dirige vers une ère post-antibiotique dans laquelle, même des infections courantes ou des blessures mineures encore traitables, peuvent être de nouveau mortelles » (Dr Keiji Fukuda, OMS, Genève 2014). Cette situation engage la société dans un défi majeur qui est celui de l’usage optimal d’antibiotiques. L’utilisation de ces médicaments, uniquement lorsqu’ils sont prescrits par les médecins, figure parmi les mesures qui font consensus. Cette mesure permet entre autres aux autorités sanitaires de contrôler le niveau de traitement.
Cependant, la question de savoir si les décisions de prescription médicales sont réellement optimales face à la résistance aux antibiotiques, n’est pas encore assez traitée dans la littérature économique. Des études théoriques et empiriques montrent qu’une population de bactéries devient résistante grâce à l’usage même d’antibiotiques (Wilen et Msangi (2002), Harbarth et Samore (2005)). Ces médicaments sont décrits comme un bien dont la qualité pourrait décroitre avec son utilisation. Une telle perception de l’utilisation des médicaments fait l’objet d’un champ de recherche récent en économie de la santé et des ressources naturelles. Cela consiste à modéliser l’efficacité de traitement des antibiotiques comme une ressource
1 Assemblée générale des Nations Unies – Réunion sur le haut niveau de résistance aux antibiotiques (AG/11825 du 21-09-2016), https://www.un.org/press/fr/2016/ag11825.doc.htm
2
naturelle (voir par exemple Herrmann et Laxminarayan (2010)). Cette approche est celle que j’adopte dans mes travaux de thèse.
Cette thèse, intitulée « Trois Essais en Analyse Bioéconomique de la Résistance aux Antibiotiques », porte sur l’économie de la santé et l’épidémiologie. L’approche bioéconomique développée à cet effet comporte deux volets essentiels. D’abord, à l’aide d’un modèle épidémiologique, je dérive le système dynamique qui représente l’évolution des infections et les efficacités de traitement des antibiotiques. Je développe ensuite un modèle économique permettant de dériver la demande d’antibiotiques en accès libre et les taux de traitement en optimum social. La situation d’accès libre correspond ici au cas d’industries génériques qui disposent de la technologie nécessaire à la production d’antibiotiques étant donné le niveau d’efficacité de traitement disponible. La concurrence conduit à ce que chaque firme n’ait pas d’intérêt à réduire l’utilisation des antibiotiques, considérés ici comme un bien dont l’efficacité de traitement peut être gérée comme une ressource. Chaque firme pharmaceutique poursuivra son effort de production jusqu’à ce que son cout égalise le revenu de ses ventes d’antibiotiques. Cette situation rendra nul le profit sur le marché pharmaceutique et s’accompagnera, à l’équilibre, de la dissipation de la rente. Il s’ensuit une baisse relativement forte de production et de la qualité des antibiotiques en vente sur le marché. Cela conduira à la perte de brevet d’exploitation pour la plupart des antibiotiques, une situation semblable à la « malédiction des ressources » en accès libre (Hardin, G. (1960)). L’optimum social offre une solution à cette situation en tenant compte particulièrement de la perte d’efficacité de traitement lorsqu’on met en vente les antibiotiques.
Je me concentre ici aux enjeux socioéconomiques du traitement des maladies infectieuses dans le contexte de résistance aux antibiotiques. Les modèles d’analyse s’appuient sur l’optimisation dynamique afin de pouvoir prendre en compte les effets externes de traitement à moyen et à long termes. Cette thèse prend en compte plusieurs aspects de l’usage des médicaments allant de l’état de santé de la population y compris le risque de contagion des maladies, au mode de rémunération des médecins, en passant par l’altruisme médical, le profit des firmes pharmaceutiques, à l’effet de substitution des antibiotiques et l’ordre dans lesquels ces médicaments doivent être utilisés. La résolution des modèles développés ici reposent sur la programmation dynamique et des simulations numériques. Ces outils d’optimisation sont par ailleurs aussi utilisés assez souvent en économie de l’environnement et des ressources naturelles, lorsqu’il s’agit, par exemple, de déterminer l’ordre optimal d’utilisation des ressources fossiles dans un contexte d’accumulation de Gaz à Effet Serre (GES).
Organisée en trois chapitres, cette thèse explore des approches à la fois positives et normatives. Le chapitre I traite l’analyse dynamique de l’usage médical d’antibiotiques. Dans ce chapitre, j’étudie le comportement d’un médecin représentatif qui poursuit un objectif intemporel. On comparera le taux de traitement médical avec le taux de traitement socialement optimal. Le chapitre II analyse la demande d’antibiotiques en accès libre sous l’effet de substitution des efficacités de traitement. Le chapitre III examine l’ordre optimal de l’utilisation d’antibiotiques lorsque les efficacités de traitement des antibiotiques sont liées tant au niveau de la demande qu’au niveau de l’offre. Ces deux derniers chapitres s’appuient sur un modèle épidémiologique généralisant les modèles existants avec des antibiotiques substituts. Les annexes de la présente thèse sont organisées en trois sections. La section A (annexes A) correspond au chapitre I, la section B (annexes B) est reliée au chapitre II et la section C (annexes C) est celle du chapitre III.
3
Chapitre I : Analyse dynamique de l’usage médical d’antibiotiques
Résumé
Ce chapitre développe une approche dynamique de l’usage médical d’antibiotiques dans un contexte de la résistance bactérienne. Nous proposons ici un cadre épidémiologique simplifié avec une infection et un antibiotique. Nous considérons le cas d’un médecin représentatif qui fixe un horizon de planification et choisit un plan de traitement selon son propre objectif. Nous postulons une fonction d’utilité permettant au médecin d’arbitrer entre son intérêt altruiste à l’égard de l’état santé de la population et son intérêt individualiste en lien avec l’induction de la demande de soins dans le but de tirer davantage de profit. Les résultats de simulation montrent une plus forte incitation à prescrire à mesure que le médecin devient de plus en plus altruiste et un faible niveau de traitement lorsqu’il est rémunéré en fonction du volume d’actes effectués. Enfin, une comparaison avec l’optimum social permet de soulever que le bien-être de la population traitée par le médecin est inférieur au niveau socialement optimal mais que l’écart de traitement est de plus en plus faible à mesure que le niveau d’altruisme augmente.
4
1.1.Introduction
L’émergence accrue de la résistance bactérienne à l’échelle mondiale (WHO, Antimicrobial Resistance Global Report on Surveillance, 2014) constitue une menace majeure à l’efficacité de traitement des antibiotiques. Il existe des travaux tant empiriques que théoriques3 qui montrent que la résistance bactérienne est elle-même attribuée à l’usage relativement fréquente des antibiotiques. La prise en compte de cet effet externe de traitement occupe une place importante dans la modélisation bioéconomique du traitement des maladies infectieuses.
Nous citons entre autres les travaux de Herrmann et Gaudet (2009) qui comparent l’usage de l’antibiotique en accès libre avec celui en optimum social en tenant compte du coût de production. Ils développent un modèle économique dans lequel la demande d’antibiotique découle de la considération des individus d’être en bonne santé tandis que les dynamiques de l’efficacité de traitement et de l’infection sont basées sur un modèle épidémiologique. Le prix de l’antibiotique y est déterminé sur un marché concurrentiel, par des firmes produisant avec un coût marginal constant. La demande d’antibiotique dépend de la fraction d’individus disposés à payer en fonction du prix et de la qualité de traitement ce médicament. En optimum social, la détermination du taux d’utilisation de l’antibiotique est confiée à un planificateur central dont l’objectif est la maximisation du bien-être de tous les individus. Les résultats de simulation montrent que le taux de traitement en accès libre peut être, à l’équilibre stationnaire, plus ou moins élevé que taux de traitement socialement optimal. La différence s’explique par l’ampleur du coût de production qui agit sur le niveau de prix de l’antibiotique. Il existe des configurations des paramètres qui débouchent sur des états d’équilibre identiques mais les sentiers du taux de traitement demeurent différents dans les deux approches. Notons également que l’efficacité de l’antibiotique y est considérée à la fois comme une ressource non-renouvelable et renouvelable. Laxminarayan et Brown (2001) examinent l’utilisation optimale de deux antibiotiques et considèrent leur efficacité comme une ressource non renouvelable. Ils concluent que les taux de traitement des antibiotiques et leur ordre d’utilisation dépendent de la différence qu’on observe dans les évolutions de la résistance bactérienne et dans les coûts de production pharmaceutiques. En particulier, on devrait utiliser d’abord l’antibiotique qui coute moins cher à produire et qui est doté d’une efficacité de traitement plus élevée. D’autres auteurs comme Filippini et Masiero (2012) mettent l’accent sur l’hétérogénéité des patients entre ceux qui ont un comportement dit « myope » dont la demande d’antibiotique est dictée par l’habitude de consommation, et ceux qui prennent de l’antibiotique de façon rationnelle selon leurs caractéristiques socio-économiques. Le modèle suppose que les deux types de patients s’exposent aux désutilités futures, c’est-à-dire la perte d’efficacité de traitement due à l’utilisation présente de l’antibiotique de la consommation d’antibiotique. Les principaux résultats soulignent l’importance de l’usage rationnel tout en recommandant une politique d’intervention permettant de mieux contrôler l’usage des antibiotiques au moyen des campagnes d’incitation et d’information au lieu de subventionner les couts d’usage de l’antibiotique. Les auteurs mentionnent également que l’utilisation des antibiotiques de manière myope entraine une perte d’efficacité de traitement plus rapide.
Parallèlement, il existe aussi une littérature économique consacrée à l’usage médical de l’antibiotique dans le cadre d’une relation médecin-patient. L’analyse de cette relation est traditionnellement abordée sous l’angle de la demande de médicament induite par l’offre de traitement du médecin. La demande du patient est donc,
5
du moins en partie, contrainte par la décision médicale. C’est le cas notamment dans le travail de De Jaegher et Jegers (1999) qui analysent la demande de médicament dans un marché concurrentiel avec des médecins soumis à une éthique professionnelle. Ils montrent la capacité des médecins à inciter les patients plus aisés à se soigner davantage et la répercussion de cette situation sur les charges de fonctionnement du système d’assurance.
Bardey et Lesur (1996) partagent l’approche de De Jaegher et Jegers (1999) pour analyser l’efficacité du système de soin de santé. Ils concluent que la demande de médicament induite par la décision médicale pourrait entraîner un comportement d’aléas moral du patient dû à l’erreur de prescription. Cette situation conduit à un niveau de traitement socialement sous-optimal. Ces auteurs soutiennent qu’il faut envisager une politique mixte dans laquelle le soin est offert à la fois par des médecins privés et des médecins publics afin de rendre le marché de médicament plus efficace.
L’analyse de la relation médecin-patient a connu une évolution avec le modèle du médecin altruiste, lequel devient un agent qui agit exclusivement dans l’intérêt des patients. C’est le cas dans le travail de Liu-Alberta et Ma (2012) qui analysent l’effet de cet altruisme sur le niveau de traitement accordé aux patients. Dans leur modèle, ils présentent deux types de comportement du médecin : altruiste dans lequel le médecin s’engage à soigner le patient exclusivement en fonction de la sévérité de sa maladie du patient et non-altruiste où il se contente uniquement de la maximisation de son propre profit. Ils observent ensuite que si tous les médecins sont soumis à un contrat simple qui garantit un paiement constant de la part du système d’assurance, ils vont se comporter de manière non-altruiste. Par contre, s’ils reçoivent un paiement qui varie en fonction de l’effort de diagnostic de la maladie des patients, il leur sera bénéfique d’adopter un comportement altruiste. La modélisation dynamique de l’usage des médicaments développée jusqu’ici n’intègre pas le comportement du médecin. C’est le cas par exemple du travail de Herrmann et Gaudet (2009) dans lequel les patients expriment une demande effective de traitement hors du système de santé. Il s’agit alors d’un cadre d’analyse partiel car des études montrent que le médecin décide du niveau de soin accordé aux patients selon son propre objectif. Néanmoins, lorsque le comportement du médecin est incorporé dans d’autres modèles, la dimension temporelle n’y est pas prise en compte. C’est le cas par exemple du travail de De Jaegher et Jegers (1999) qui analysent la relation médecin-patient dans le cadre l’induction de la demande de soins mais développent une approche statique. Or, le contexte de la résistance bactérienne, tel qu’elle survient est un enjeu inter-temporel prenant en compte l’évolution de l’infection et de l’efficacité du traitement.
Ce chapitre propose une nouvelle approche qui intègre à la fois le médecin et l’aspect dynamique de la modélisation de l’usage d’antibiotiques. Nous considérons le cas d’un médecin représentatif qui maximise un objectif intertemporel et traite la population avec un seul antibiotique. L’utilité instantanée du médecin dépend du revenu de son travail et du poids (niveau d’altruisme) qu’il accorde au bien-être de la population qu’il soigne. Nous combinons une approche à la fois épidémiologique et économique. Le modèle épidémiologique divise la population en compartiments différents par rapport à la maladie. Nous pouvons y distinguer les individus en bonne santé, les individus infectés par une souche résistante et les individus infectés par une souche susceptible au traitement. A l’aide de ces compartiments, nous pouvons définir l’efficacité de traitement de l’antibiotique comme le rapport entre les individus infectés par la souche susceptible et la population infectée.
6
Le modèle économique permet de caractériser l’usage médical de l’antibiotique et sa comparaison avec l’usage socialement optimal. La volonté de payer par les patients pour l’antibiotique résulte d’un modèle de différenciation (Hermann et Gaudet, 2009). Chaque individu est caractérisé par sa valorisation de vivre en bonne santé (type). La spécificité de notre modèle réside dans le fait que le médecin pourrait contrôler la fraction d’individus infectés dans un contexte où les patients conservent leur type comme une information privée non révélée. Le médecin choisit ensuite le plan de traitement qui maximise son utilité inter-temporel. Nous postulons une fonction d’utilité permettant de caractériser le comportement du médecin comme étant plus ou moins altruiste. Nous avons également spécifié différents types de système de rémunération du médecin à savoir le payement à l’acte, le payement fixe et le système de payement mixte. Le médecin pourrait aussi tenir compte des utilités des individus en bonne santé afin de prévoir le risque de propagation de la maladie. Nous nous intéressons également au niveau de traitement choisi en optimum social. Le planificateur social maximise le surplus global qui agrège les utilités présentes et futures des individus en bonne santé et infectés moins le coût de production de l’antibiotique. Le prix socialement optimal est fixé tel qu’il égalise la valeur marginale sociale du traitement et le coût marginal social de l’utilisation de l’antibiotique.
En raison de la complexité du modèle biologique, nous effectuons des simulations numériques afin de caractériser le sentier de traitement médical et le niveau de traitement socialement optimal. Les résultats de simulation montrent que le taux de traitement médical peut être supérieur ou inférieur au taux de traitement en optimum social selon les configurations exogènes des paramètres. Une nette tendance à la forte utilisation de l’antibiotique apparait chez les médecins plus altruistes. Il est aussi important de noter que la rémunération à l’acte engendre une sous-utilisation de l’antibiotique en raison du fait que le médecin anticipe de tirer profit du niveau plus élevé de l’infection dans le futur (effet de la demande induite). Enfin, un médecin altruiste qui tient compte des individus en bonne santé a tendance à prescrire plus d'antibiotiques.
Ce chapitre est organisé comme suit. Dans la section 1.2, nous présentons le modèle épidémiologique avec une infection et un antibiotique. Il s’appuie sur un système dynamique montrant l’évolution de l’efficacité de l’antibiotique et de l’infection. On développe le modèle dynamique de l’usage médical d’antibiotiques à la section 1.3 et l’optimum social à la section 1.4. La section 1.5 présente les résultats de simulation numériques qui compare les allocations médicales et les allocations socialement optimales. On conclut notre premier essai à la section 1.6. Ce chapitre est également relié aux annexes A.
1.2.Modèle épidémiologique avec une infection et un antibiotique
Dans cette sous-section, nous reprenons le modèle de base SIS développé par Kermack et McKendrick (1927). Ce modèle décrit la propagation de l’infection au sein de deux groupes d’individus sains et infectés au temps , noté respectivement et .
Modèle SIS
Afin de prendre en compte de l’usage de l’antibiotique, nous allons présenter une version modifiée du modèle SIS, reprise par Laxminarayan et Brown (2000), qui considère que les individus malades peuvent être infectés soit par la souche susceptible , soit par la souche résistante face à l’antibiotique . Les patients guérissent naturellement au taux s’ils sont infectés par la souche résistante et au taux s’ils sont infectés par la souche susceptible. Le taux de guérison additionnel grâce à la prise d’un antibiotique est noté . Le
7
taux de transmission de la maladie est représenté par ! et la fraction des patients traités avec l’antibiotique par .
Modèle épidémiologique SIS, Kermack et McKendrick (1927)
Nous considérons un système fermé où il n’y a ni entrée ni sortie (i.e. absence de naissance et de mortalité). La taille de la population reste alors constante et est normalisée à " = 1. On considère une population de taille " = 1. On a alors : # $%&'(& )*+é-+/00010002+ (& )*+é-= 1 (1.1.1)
Selon l’identité (1.1.1) et la dynamique présentée dans la Figure ci-haut, la dynamique des individus non-infectés est donnée par l’équation comme la différence entre les infectés nouvellement rétablis et les susceptibles nouvellement infectés :
3 = 4 +/000000100000025 +
6é+789:-− !/00010002+ (&
)*+é-(1.1.2) Les dynamiques de la population infectée sont données par le système :
3 = ! − 4 + 5 (1.1.3)
3 = ! − (1.1.4)
L’équation (1.1.3) donne la dynamique instantanée de la population infectée par la souche susceptible, comme la différence entre la population nouvellement infectée par cette souche (! ) et la population du compartiment rétablie naturellement au taux ou après prise d’antibiotique au taux + . L’équation (1.1.4) représente la dynamique de la population infectée par la souche résistante à l’antibiotique, comme la différence entre la population nouvellement infectée par cette souche (! ), et la population du compartiment rétablie naturellement au taux .
L’efficacité de guérison de l’antibiotique est définie à l’aide de la variable qui est définie comme le rapport entre la population infectée par la souche susceptible et la population infectée (Laxminarayan-Brown, 2000). On a :
=((; (1.1.5)
8
L’équation (1.1.5) indique que plus il y a d’individus infectés par la souche susceptible, plus l’efficacité de traitement de l’antibiotique et élevée L’équation (1.1.6) présente la perte d’efficacité de traitement comme le taux d’individus infectés par la souche résistante.
Modélisation de l’efficacité de traitement et de l’infection
La dynamique de la population infectée s’obtient par addition des équations (1.1.3) et (1.1.4), comme la somme des variations des individus infectés par la souche susceptible et des individus infectés par la souche résistante. On a :
3 = 3 + 3 = ! − 4 + 5 − (1.1.7)
Or, d’après (1), = 1 − et d’après (1.1.5) et (1.1.6), on a = et = 1 − . Ainsi, la relation (1.1.7) devient
3= <! 1 − − + 4∆ − 5 = , (1.1.8)
où ∆ = − , communément appelé « fitness-cost », mesure le cout biologique de la résistance à l’antibiotique (Herrmann et Gaudet, 2009). En effet, ce cout résulte du fait qu’une bactérie résistante consacre une partie de son énergie à la pression de sélection liée au traitement à l’antibiotique. Cela entraine un cout biologique pouvant réduire sa capacité de survie contrairement à une souche susceptible qui pourrait consacrer toute son énergie à sa survie. Cet écart de compétitivités pourrait se traduire par une différence de croissance entre une souche susceptible et une souche résistante et pourrait être favorable au renouvellement de l’efficacité de traitement de l’antibiotique, notamment lorsque le fitness-cost est positif ∆ = − > 0.
L’équation (1.1.8) donne la croissance (nette) instantanée de l’infection qui s’exprime comme la différence entre la croissance de la population infectée au taux ! + ∆ et la croissance de la population guérie au taux + . Elle indique que la population infectée décroît à mesure qu’elle bénéficie d’un traitement efficace. En l’absence de traitement un taux guérison naturel inferieur à ! + ∆ entraine une croissance irréversible de la maladie. Par ailleurs, si l’efficacité de traitement est non renouvelable ∆ = 0 , le taux de croissance de l’infection décroit strictement en fonction de l’efficacité quelle que soit le niveau du taux de traitement . Si, l’efficacité de traitement est renouvelable ∆ > 0 , la croissance de l’infection sera positive ou négative selon le cas de figure où on se situe de part et d’autre du seuil de traitement ̅ =∆@. Ces cas de figure reflètent le phénomène de la résistance bactérienne.
En dérivant par rapport au temps la relation (1.1.5), on obtient la dynamique de l’efficacité de traitement comme
3 = 3 − 3 (1.1.9)
En substituant 3 et 3 par leurs expressions définies en (3) et (7), la relation (9) devient
3 = 4∆ − 5 1 − (1.1.10)
L’équation (1.1.10) décrit la dynamique de l’efficacité de traitement de l’antibiotique. Elle indique qu’avec ∆ = 0, on assiste à une décroissance logistique tendant vers l’inefficacité de traitement l’antibiotique = 0 pour > 0. Donc, toute trajectoire de l’efficacité de traitement partant du niveau initial A∈ C0 , 1 ne pourra pas converger vers un niveau stationnaire = 1. Si ∆ > 0, l’efficacité de
9
traitement pourrait augmenter pour atteindre son niveau maximal = 1 tant que le taux de traitement se situe en dessous du seuil d’utilisation ̅ =∆@. Au-delà de ce seuil, l’utilisation de l’antibiotique devient relativement fréquente au point que certaines bactéries peuvent résister davantage au traitement et, donc, accentuer la perte d’efficacité. Si on fait abstraction du renouvellement, l’efficacité de traitement de l’antibiotique devient de plus en plus réduite, et donc, le taux de croissance de l’infection devient de plus en plus important. Et, même si l’efficacité de traitement est renouvelable, le traitement elle ne parviendra à réduire le niveau d’infection que si l’effet total de guérison [− + 4∆ − 5 ] domine sur l’effet de transmission de la maladie [! 1 − ].
1.3.Modélisation économique de l’usage médical d’antibiotiques
Cette section s’intéresse à la modélisation de la relation médecin-patients. Nous considérons le cas d’un médecin représentatif.
Un modèle de la relation médecin-patients
Nous considérons un modèle dans lequel le système est réduit à deux types agents économiques pour ne retenir que la relation médecin-patient : un médecin représentatif et un continuum d’individus de taille " qu’on normalise à 1. La présence de l’infection donne lieu à une demande d’antibiotique de la part des patients et une offre de traitement de la part du médecin. Puis, nous allons voir comment le taux de traitement qui résulte d’une telle l’interaction affecte la dynamique de l’efficacité de traitement. Nous retenons par ailleurs la gestion de l’efficacité de l’antibiotique comme une ressource renouvelable ou non-renouvelable. On suppose donc que les agents expriment leurs préférences directement à travers l’utilisation de cette ressource en comparant le bénéfice marginal et le coût d’acquisition de l’antibiotique.
A l’instar des travaux de De Jaegher-Jegers (2000), notre modèle vise, d’une part, à analyser la relation médecin-patients sous l’hypothèse de l’induction de demande de soins. Le médecin décide de prescrire plus ou moins l’antibiotique en fonction de son propre intérêt et contraint ainsi la demande de traitement des patients. Ces derniers peuvent également exercer une certaine influence sur le choix du médecin par leur volonté à payer pour obtenir le médicament (Freidson (1960)). A l’instar de Herrmann et Gaudet (2009), la décision d’achat des patients pourrait dépendre notamment du rapport qualité prix de l’antibiotique et de leur volonté à payer. Nous soutenons, d’autre part, l’hypothèse d’altruisme par laquelle le médecin intègre l’utilité des patients comme un argument dans sa fonction d’objectif (Liu et Ma (2013)). Cependant, dans notre modèle, le médecin pourrait également tenir compte de l’état de santé des individus en bonne individus et considère dans ce cas l’utilité globale de la population comme un argument dans sa fonction d’objectif.
Hypothèses du modèle
Le modèle comporte un continuum d’individus qui se distingue selon leur type D ∈ C0 , 1E qui caractérise leur valorisation d’être en bonne santé. Le type est une information privée, la réalisation du paramètre D est a priori dictée par la loi de distribution cumulative F . . L’expression F D désigne la fraction d’individus de type inférieur ou égal à D.
10
• Soit la fraction d’individus infectés parmi la population
• Parmi les patients infectés, le médecin choisit une fraction à qui il va prescrire l’antibiotique • Parmi les patients détenant une prescription d’antibiotique, une certaine fraction décide de l’acheter
en fonction de sa valorisation d’être en bonne santé
Selon cette séquence de choix, le taux de traitement effectif est donné en fonction du taux de prescription médical et le taux d’achat de l’antibiotique exprimé par les patients.
En cas d’infection, le patient peut espérer la guérison avec une probabilité GH donnée par
GH = IGG += avec traitement+ 1 − sans traitement (1.2.1)
L’expression (1.2.1) signifie que le patient peut être infecté soit par la souche susceptible avec la probabilité (et peut guérir naturellement au taux ) soit d’une souche résistante avec la probabilité 1 − (et peut ainsi guérir naturellement au taux ). Le terme additionnel indique que la prise d’antibiotique augmente l’espérance de guérison uniquement lorsque le patient est infecté par une souche susceptible. Le taux de guérison additionnel du traitement est donc nul si le patient est infecté par la souche résistante. Nous faisons abstraction de la possibilité de procéder à un test médical permettant de savoir a priori la nature de la souche bactérienne qui a infecté le patient.
Demande d’antibiotique
Chaque patient est caractérisé par sa valorisation d’être en bonne santé D (D ∈ C0 , 1E) (Herrmann et Gaudet, 2009). Si l’individu est en bonne santé, son utilité vaut
T D = D (1.2.2)
S’il est infecté, son utilité dépend de sa possibilité d’être traité ou non. Son espérance d’utilité devient T D = UGG D + 4D sans traitementD − V5 avec traitement (1.2.3)
où V est le prix de l’antibiotique que le patient prend comme donné (avec V ∈ 0 , 1E) et D − V exprime le bénéfice net additionnel de la prise d’antibiotique. Un patient de type D décide d’acheter l’antibiotique si D − V ≥ 0, c’est-à-dire si D ≥ DX avec DX V, = U V 1 si ≥ V si < V (1.2.4)
La fraction des patients prêts à acheter l’antibiotique est alors donnée par la probabilité de DX d’être dépassée, soit par Z [D ≥ DX\ = 1 − F4DX5. Cette fraction exprime le taux d’achat de l’antibiotique. Le taux de traitement effectif est, sous l’hypothèse d’indépendance, exprimé par le produit du taux de prescription médical
11
et le taux d’achat d’antibiotique, soit = <1 − F4DX5=.4 En substituant la valeur de DX, on obtient la fonction de la demande d’antibiotique donnée par :5
] V, , = ^1 − F _ V `a , ≠ 0 (1.2.5)
La relation (1.2.5) indique que l’efficacité de traitement étant = 0, la demande d’antibiotique est nulle. Elle exprime une demande du patient qui dépend à la fois du prix de l’antibiotique et de la décision de prescription médicale. Elle permet d’expliquer la relation médecin-patient sous l’effet de l’induction : La demande de médicament est induite par le comportement du médecin qui a le « pouvoir discrétionnaire » de choisir le niveau de prescription (Bardey, 2004). Le médecin pourrait décider d’accorder la prescription à tous les patients et, donc, = 1, ce qui permet de traiter tous les patients prêts à acheter l’antibiotique. Lorsque ∈ 0 , 1 , une partie d’entre eux seulement sera soigné et lorsque = 0, la demande d’antibiotique est nulle même si des patients sont prêts à l’acheter. Ainsi, la variable agit pour déterminer en partie la demande de médicament.
A partir de la relation (1.2.5), nous pouvons déduire la demande inverse d’antibiotique comme
Z , , = F' c1 − ] d , ≠ 0 . (1.2.6)
La relation (1.2.6), Z représente la fonction de prix ou de demande inverse de l’antibiotique. Dans le cas d’une distribution uniforme, cette fonction devient
Z , , = c1 − ] d , ≠ 0 (1.2.7)
La relation (1.2.7) indique une fonction de demande linéaire à l’efficacité de traitement de l’antibiotique. Si l’antibiotique est inefficace pour traiter la maladie ( = 0), la demande inverse est nulle. Si l’antibiotique est efficace pour le traitement ( > 0), le niveau de demande inverse pour l’antibiotique est d’autant plus important que le médecin augmente le niveau de prescription (eZ e⁄ > 0) ou qu’il y a plus de patients à soigner (eZ e⁄ > 0).6
Fonction d’utilité du médecin
Nous considérons le cas d’un médecin représentatif dont l’objectif consiste à traiter les patients sur un horizon de planification g . A chaque instant , il choisit un taux de prescription qui maximise son objectif inter-temporel étant donné le niveau d’infection et le niveau d’efficacité de traitement .
Nous supposons que l’utilité instantanée du médecin dépend de l’utilité des individus et de son revenu de traitement . L’élément clé de l’arbitrage intra-temporel entre ces deux arguments est un coefficient h
4 soit par le produit Taux de prescription ( ) × Taux d’achat <1 − F4DX5=. Ce produit resulte de l’indépendance entre le type de patient et la décision médicale de prescription de l’antibiotique. Ainsi, parmi une fraction choisie par le médecin, une faction <1 − F4DX5= choisira d’acheter l’antibiotique.
5 Soit égale à Z j = jk lm é ( )× Taux de prescription ( ) × Possibilité d’achat <1 − F4DX5= 6 On vérifie que eZ e
n
⁄ = ]⁄ n2 > 0 et eZ e⁄ = ] n 2
12
(h ∈ C0 , 1E) qui détermine le niveau d’altruisme du médecin. Plus h est élevé, plus le médecin se préoccupe de l’état de santé des individus sujets à la maladie. L’introduction du paramètre h permet de tenir compte à la fois les notions d’altruisme et de la demande de médicament induite par le comportement du médecin qui offre le traitement (McGuire, 2000). Le revenu brut du médecin est donné par :
= H + q , H ≥ 0,q ≥ 0 (1.3.1)
Le cas avec H = 0 ( = q ) constitue une forme de rémunération à l’acte, où q désigne le revenu médical par patient. Le cas avec q = 0 ( = H) présente une forme de rémunération fixe. Le cas avec H > 0 et q > 0 ( = H + q ), correspond à un médecin confronté à une forme de rémunération mixte (Echevina et Fortin, 2011). Ainsi, considérons l’utilité agrégée de tous les individus (malade et en bonne santé) tel que perçu par le médecin. Elle est donnée par :
, , = 1 − r D stA dF D + v w xr G D sy A dF D + r<G D + D − V= sy dF D z { + 1 − r G D A dF D | = 12 1 − + c12 G + }12 41 − DX5 − V41 − DX5~d , (1.3.2)
Dans (1.3.2), le premier terme exprime l’utilité des individus en bonne santé (1 − ) étant donné le poids que le médecin leur accorde. Pour simplifier, nous traitons deux cas avec =1 lorsque le médecin tient compte du bien-être des individus en santé et = 0 lorsqu’il considère uniquement les individus infectés ( ). Le second terme (pondéré par ) représente, d’une part, l’utilité des patients à qui le médecin décide de prescrire l’antibiotique (au taux ) et, d’autre part, l’utilité des patients non traités par le médecin (au taux 1 − ).
Nous supposons par ailleurs que le médecin subisse une désutilité de travail liée à la prescription que nous représentons à l’aide d’un coût de traitement convexe de type • , = m où m > 0. Ce cout porte essentiellement sur le volume de prescription ( ) et non pas sur le cout d’accueillir les patients (c’est-à-dire le cout lié au temps passé par le médecin avec les patients, qui est ici supposé nul). Afin de justifier cette hypothèse, on peut s’imaginer que le médecin passe plus de temps avec les patients qui recevront plus tard une prescription. Défini dans un cadre statique, le coût de traitement est présenté dans certains travaux comme étant le cout d’opportunité du temps alloué par le médecin aux patients, soit la meilleure autre utilisation de son temps de travail (Ferguson (1985), Escare et Pauly (1998)).
L’utilité instantanée du médecin est ensuite représentée à l’aide d’une fonction CES de type :
13
avec X , = − m désigne le revenu net du médecin.7 Les propriétés asymptotiques de la fonction CES permettent de généraliser les préférences du médecin à l’aide des fonctions d’utilité standards de types Leontief ( → −∞), Cobb-Douglas ( → 0) et linéaire ( → 1) (Jehle et Reny, 2001) telles que
, , ≡ ƒ njk„C , , E, , , X†C X , E, … '† h , , + 1 − h X , si → −∞ si → 0 si → 1 (1.3.2)
Une valeur de très négative ( → −∞) correspond au cas où le revenu du médecin ( X) et l’utilité de la population ( ) sont des compléments parfaits, c’est-à-dire lorsqu’il n’y a pas de substitution possible entre X et . La valeur de proche de 0 ( → 0) présente le cas où la substitution entre X et est possible afin de maintenir le même niveau d’utilité. Et, le cas avec → 1 est celui auquel le revenu du médecin ( X) et l’utilité de la population ( ) sont des substituts parfaits.
Dans la sous-section suivante, nous nous servons de ces propriétés de afin d’avoir un portrait graphique du gain instantané du médecin et du niveau de prescription.
Portrait de l’utilité instantanée du médecin
Afin d’avoir un aperçu (statique) de l’utilité instantanée du médecin, nous considérons les niveaux d’infection et d’efficacité de traitement de l’antibiotique ( , ) comme des donnés. Il choisit le taux de traitement optimal ∗, solution du problème de maximisation suivant :
max
ˆ∈CA , E , ,
(1.3.3)
Le problème (1.3.3) est celui d’optimisation statique. Les conditions de premier ordre pour une solution ∗ à ce problème sont données par
∗‰∈ C0 , 1E= 0 = 1 si e e ∗, , ‰ < 0 = 0 > 0 , (1.3.4) avec e e = ƒ Š− 1 − h m c X , − 1 2 m d €' + h‹Œ• '€€ Žj ≠ 0 0 Žj = 0 , ‹ =C − 4V + 3V E } cG + − 4 V + 3 V − d + ~ €' 2€ , • = 1 − h c X , −12 m d€+ hc }G + c − 4V + 3V d − ~ + d € 2€ .
7 Nous supposons que X , ≥ 0 , ce qui implique d’imposer (0 ≤*≤ q ≤ 1 et 0 ≤ H ≤ 1) ou (0 ≤ q <*≤ 1 et q −*≤ H ≤ 1).
14
Le cas de figure avec → −∞ suppose que et X sont des compléments parfaits. Le médecin manifeste à la fois un intérêt pour le revenu de son travail et un intérêt pour l’état de santé de la population. Dans un cadre statique, il doit choisir un taux de traitement ∗ qui le rend indifférent entre l’utilité globale des individus et son revenu net, soit ∗, , = X ∗, . En simplifiant cette égalité, la valeur de ∗ peut être obtenue via la résolution de l’équation
‘ = −∆ , − ∆ , + ∆ , = 0 , (1.3.5)
avec :
∆ , = m , ∆ , = ^ 41 − DX5 − V41 − DX5a
∆ , = H + q − 12 1 − −12 G
Nous supposons par ailleurs que ≥ V (la qualité de l’antibiotique pondérée par le taux de guérison additionnel est supérieure à son prix d’achat). Dans ce cas, ‘ décroit avec , ce qui assure l’unicité de la solution au problème (1.3.3) définie dans (1.3.4). Pour une solution intérieure, on a : 8
∗ =−∆ + ’∆ − 4∆ ∆
2 ∆ .
(1.3.6)
On y voit que ∗ et ∆ , évolue en sens inverse. Les figures 1.1.a, 1.1.b et 1.1.c présentent, d’une part, l’utilité instantanée du médecin ( ) et, d’autre part, le taux de prescription optimal au sens du médecin ( ∗), en fonction du niveau de l’infection ( ) et de l’efficacité de traitement de l’antibiotique ( ).9
La figure 1.1.a) traite le cas du médecin qui considère son revenu net (X) et l’utilité de la population ( ) comme des compléments parfaits ( → −∞).
Figure 1.1. a) : Utilité maximisée du médecin ( ) et taux de traitement médical ( ∗) avec → −∞
Utilité maximisée du médecin ( ) avec → −∞
8 pourvu que ∆ − 4∆ ∆ ≥ 0 et ’∆ − 4∆ ∆ ≤ 2 ∆ + ∆ .
9 pour les figures 1.1 à 1.3, on a choisi h = q = 0.5 , H = 0, = 1, = 0.15 , = 0.20, = 0.4, V =0.1, m =0.1.
15
Taux de traitement médical ( ∗) avec → −∞
Comme ∆ , est strictement croissante en et en (1.3.6), le taux de prescription qui maximise l’utilité du médecin pour les valeurs plus élevées de , sera égal à ∗ = 1. Le taux de prescription sera nul ( ∗ = 0) dans le cas contraire (figure 1.1.a). Notons que est croissante en alors que X décroissant en . Ainsi, lorsque les configurations de , se situent à un niveau tel que , , < X , , le médecin doit opter pour un taux de traitement élevé afin d’atteindre l’égalité , , = X , où aucune substitution n’est possible entre X et .
La figure 1.1.b présente le cas du médecin qui considère son revenu net ( X) et l’utilité de la population ( ) comme des substituts parfaits ( = 1).
Figure 1.1. b) : Utilité maximisée du médecin ( ) et taux de traitement médical ( ∗) avec = 1
Utilité maximisée du médecin ( ) avec = 1
16
Le taux de substitution entre le revenu du médecin et le bien-être de la population est égal à 1. Quel que soit le niveau de revenu du médecin, toute diminution d’unité supplémentaire du bien-être de la population sera toujours compensée par une unité supplémentaire du revenu. Ainsi, lorsque l’infection est plus élevée et que le médecin juge plus important le gain du revenu procuré par le traitement, il sera disposé à traiter moins de patients pour maintenir son niveau d’utilité (figure 1-b).
La figure 1.1.c présente le cas intermédiaire avec → 0 qui traduit des préférences Cobb-Douglas où et X sont substituts imparfaits.
Figure 1.1. c) : Utilité maximisée du médecin ( ) et taux de traitement médical ( ∗) avec = 0
Utilité maximisée du médecin ( ) avec = 0
Taux de traitement médical ( ∗) avec = 0
Ici, le taux auquel le médecin est disposé à sacrifier son revenu pour une augmentation du bien-être de la population afin de maintenir son niveau d’utilité, est constant et est égal à ” = †
'† 6
•. On note également que ce taux de substitution est croissant avec le taux d’altruisme.10 Un médecin caractérisé par un niveau d’altruisme élevé, est disposé à sacrifier une plus grande part de son revenu au profit d’une hausse marginale de l’utilité de la population. Ce qui est le cas lorsque le niveau d’infection ( ) est élevé alors que l’efficacité de traitement de l’antibiotique ( ) est relativement faible. Ce cas de figure incite le médecin à accorder plus d’intérêt pour le bien-être de la population (figure 1.1.c). En revanche, lorsque la qualité de l’antibiotique devient trop faible ( < –@), le médecin s’abstient de soigner car son utilité devient décroissante en . A l’exception du cas où le médecin considère l’utilité de la population et son revenu comme des compléments parfaits, une forte efficacité de traitement de l’antibiotique le conduit généralement à traiter tous les patients.
17
Cette possibilité de soigner tous les patients tient généralement lorsque le taux de maladie est très élevé. En revanche, le médecin s’abstient de soigner en présence de faible taux d’infection lorsque et X sont des compléments parfaits. Il y a peu de patients alors que l’utilité globale des individus étant élevée grâce à la forte valeur de , ce qui implique , , > X , et donc le médecin ajuste avec un taux de traitement
→ 0 afin d’accroître son niveau d’utilité. Ce qui n’est pas le cas lorsque et X sont substituables. Avec un niveau faible d’infection, le médecin est prêt à sacrifier moins de revenu pour une hausse marginale de afin de garder le même niveau d’utilité (figure 1.1.c).
Programme inter-temporel du médecin
Considérons un horizon de traitement g pouvant être fini (g < ∞) ou infini (g = ∞). L’objectif du médecin consiste à choisir un plan de traitement „ ∗ …+t —ˆ qui maximise la somme actualisée de ses utilités instantanées selon le programme
n˜™ˆ+ ∈CA , Eš l— '›ˆ+ , , ,
ˆ
+tA œ , (1.4.1)
sous les contraintes
3 = _!41 − 5 − + <∆ − 41 − DX5 = ` (1.4.2)
3 = <∆ − 41 − DX5 =41 − 5 (1.4.3)
0 = A , 0 = A
Le Hamiltonien en valeur courante du programme du médecin est défini par :
• , , = , , ,
+ ž <! 1 − − ̅ + 4∆ − 41 − DX5 5 =
+ Ÿ <4∆ ̅ − 41 − DX5 5 1 − = (1.4.4)
Dans l’équation (1.2.4), ž et Ÿ sont les variables adjointes mesurées en valeur courante associées respectivement aux variables d’état et . La variable ž représente la valeur d’une variation marginale de l’efficacité de l’antibiotique. La variable Ÿ exprime la valeur d’une variation marginale de l’infection tel que perçu par le médecin.
Les conditions d’efficacité statiques nécessaires pour un optimum au problème du médecin sont données par ∗‰∈ C0 , 1E= 0 = 1 si ¡ˆ ˆ ∗, , − 41 − DX5Cž + Ÿ 1 − E ‰< 0= 0 > 0, avec e ⁄e défini en (1.3.4).
Pour une solution intérieure, on a :
18 e
e ∗, , = 41 − DX5 Cž + Ÿ 1 − E
(1.4.6)
Dans l’équation (1.4.6), le terme de gauche représente, pour le médecin, le gain marginal de prescription et le second membre exprime son coût d’opportunité de l’usage d’antibiotique. L’expression ž + Ÿ 1 − désigne la somme du coût médical de l’infection évalué au prix implicite ž et le coût médical de la perte d’efficacité de traitement évalué au prix implicite Ÿ . Le terme 41 − DX5 représente la guérison additionnelle espérée du traitement étant donné la probabilité d’achat de l’antibiotique. Cela implique qu’il convient de prescrire l’antibiotique à un patient supplémentaire si l’utilité marginale nette de la prescription est au moins égale à la valeur marginale de prescription étant donné la fraction des patients prêts à acheter l’antibiotique.
Les conditions d’efficacité dynamique sont données par :
ž3 = ¢ ž −ee − ž <! 1 − 2 − − 41 − DX5 = (1.4.7) Ÿ3 = ¢ Ÿ −ee − Cž + Ÿ 1 − 2 E4∆ − 5 − VŸ , (1.4.8) avec e e = C 1 − h ‹ €+ h• E '€ € < 1 − h 4q − m 5‹ €' + h • =, e e = C 1 − h ‹ €+ h• E '€ € • , ‹ = X , −12 m , • = cG + − 4 V + 3 V2 − d + , • =^ _ + 3V ` + G − 4 V − a } cG + c − 4V + 3V d − d + ~ €' 2€ • = }∆ + c − 3V d~ } cG + c − 4V + 3V d − d + ~ €' 2€ ,
Les conditions de transversalité sont données par :
g ž g l'›ˆ—ˆ= 0 , g ≥ 0 (1.4.9)
g Ÿ g l'›ˆ—ˆ