Séparation des éléments de terres rares par extraction par solvant :
Estimation des constantes d’équilibre d’extraction pour la simulation du
procédé
Mémoire
Keven Turgeon
Maîtrise en génie des matériaux et de la métallurgie
Maître ès sciences (M. Sc.)
Québec, Canada
Séparation des éléments de terres rares par extraction par solvant :
Estimation des constantes d’équilibre d’extraction pour la simulation du
procédé
Mémoire
Keven Turgeon
Sous la direction de :
Claude Bazin, directeur de recherche
Dominic Larivière, codirecteur
III
Résumé du mémoire
Ce mémoire porte sur la séparation des éléments de terres rares (ETR) par le procédé d’extraction par solvant. L’objectif est de développer un diagramme d’écoulement permettant la séparation des ETR présents dans une solution de lixiviation d’un minerai d’ETR. Pour ce faire, un simulateur permettant de prédire la distribution des ETR dans les phases d’un mélangeur-décanteur qui sont à l’équilibre chimique a été développé. Ce simulateur utilise les constantes d’équilibre chimique de la réaction de transfert entre phases de chaque élément présent en solution. Une méthode d’analyse juste et précise des ETR avec un spectromètre à émission atomique à plasma induit par micro-onde (MP-AES) a été développée. Des tests d’extraction par solvant sont réalisés en laboratoire et les données sont traitées afin de produire des constantes d’équilibre d’extraction qui sont utilisées en simulation. Une étude de la cinétique des extractions a permis de déterminer que trente secondes d’agitation dans une ampoule à décanter sont suffisantes pour atteindre l’équilibre chimique dans le cas des extracteurs utilisés. Une méthode novatrice de réconciliation de donnée permettant de balancer les résultats des tests d’extraction est appliquée aux données brutes des tests expérimentaux. Cela permet d’estimer des constantes d’équilibre d’extraction plus reproductibles que celles obtenues par les méthodes classiques de traitement de données de tests d’extraction. Le simulateur prédit les concentrations à l’équilibre dans les phases aqueuses et organiques pour une ou plusieurs extractions consécutives. Un diagramme d’écoulement permettant la séparation des ETR en deux sous-groupes (ETR légers et SEG avec ETR lourds) est développé pour le traitement d’une solution réelle d’ETR produite par le traitement du minerai de terres rares de la mine Niobec. Le diagramme d’écoulement développé a été simulé et testé expérimentalement. Les résultats expérimentaux obtenus sont similaires aux prédictions du simulateur pour l’ensemble du procédé, ce qui tend à démontrer la validité de l’approche proposée pour l’estimation des constantes d’équilibre et de l’approche utilisée pour la simulation du procédé d’extraction par solvant.
IV
Abstract
This thesis discusses the separation of rare earth elements (REE) using the solvent extraction process. The objective is to develop a flow sheet allowing the separation of the REE present in a leaching solution of REE ore. To achieve this, a simulator to predict the distribution of REE in the phases of a mixer-settler that are in chemical equilibrium was developed. This simulator uses the chemical equilibrium constants of each element present in solution. A method for accurate and precise analysis of REE with a microwave-induced plasma atomic emission spectrometer (MP-AES) was also developed. Solvent extraction tests are performed in the laboratory and the data is processed to produce extraction equilibrium constants that are used in the simulation. A study of the kinetics of the extraction process shows that thirty seconds of agitation in a separating funnel are sufficient to reach the chemical equilibrium in the case of the extractors used. An innovative data reconciliation method for balancing the extraction test results and estimating the equilibrium constants for the species transferred between the phases is applied to the raw data of experimental tests. It is shown that the proposed method provides more reproducible extraction equilibrium constants than standard data processing methods. A simulator based on the estimated equilibrium constants has then been written to predict the equilibrium concentrations in the phases of one or several consecutive extractions. A flow sheet allowing the separation of REE into two subgroups (light REE and SEG with heavy REE) is developed. The flow sheet consisting of three extraction steps, three scrubbing stages and two stripping stages is simulated and tested at a laboratory scale on a leaching solution of REE ore. The experimental results obtained are similar to the predictions of the simulator for the whole process showing the validity of the simulation method based on the use of the equilibrium constants.
V
Table des matières
Résumé du mémoire ... III Abstract ... IV Table des matières ... V Liste des tableaux ... VIII Liste des figures ... X Liste des abréviations et des sigles ... XII Remerciements ... XIII
1 Introduction ... 1
1.1 Les éléments de terres rares ... 1
1.2 La production des ETR et la place de l’extraction par solvant ... 2
1.3 Théorie de l’extraction par solvant ... 7
1.4 L’extraction par solvant de plusieurs espèces dans une même phase aqueuse ... 12
1.5 L’extraction par solvant dans l’industrie ... 14
1.6 Conception et opération d’une usine d’extraction par solvant ... 18
1.7 Objectifs de la maîtrise ... 19
1.8 Contexte du projet ... 21
1.9 Division du mémoire ... 22
2 Méthodologie expérimentale ... 23
2.1 Analyses chimiques des ETR ... 23
2.1.1 Fonctionnement du MP-AES ... 24
2.1.2 Protocole d’analyse... 26
2.1.3 Justesse et précision des analyses ... 27
2.2 Déroulement d’un test d’extraction par solvant en laboratoire ... 31
2.3 Cinétique de réaction d’extraction ... 34
2.4 Traitement des données par méthodes classiques ... 37
2.4.1 Méthode graphique avec les diagrammes de McCabe-Thiele ... 38
2.4.2 Calcul direct des constantes d’équilibre ... 40
2.4.3 Détermination des Keq avec la méthode de régression linéaire ... 42
2.4.4 Problématique des méthodes de calculs directs des Keq ... 44
3 Estimation des constantes d’équilibre par réconciliation de données ... 45
3.1 Introduction à la réconciliation de données ... 45
3.2 Choix du modèle d’erreur ou de l’écart-type des mesures ... 48
VI
3.4 Résultats des séries de tests de réconciliation et d’estimation des Keq ... 49
3.5 Exemple de l’application du processus de réconciliation de données à une solution réelle 55 3.6 Détection de biais dans le processus de réconciliation de données par l’analyse des résidus réduits ... 57
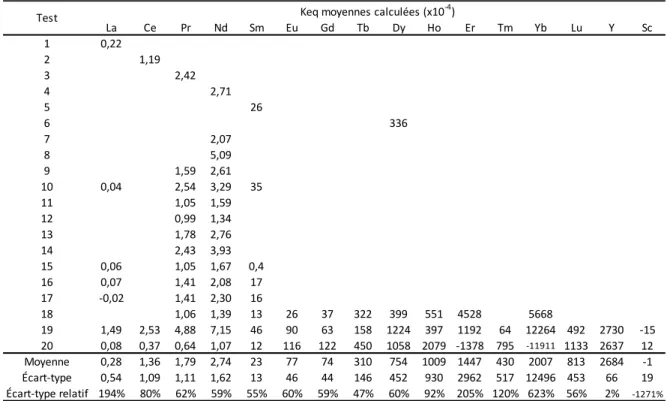
3.7 Facteurs de séparation des ETR ... 62
3.8 Comparaison entre les constantes d’équilibre estimées avec des tests sur des solutions synthétiques et sur des solutions réelles ... 64
3.9 Comparaison entre les constantes d’équilibre pour les procédés d’extraction et d’élution partielle ... 65
3.10 Vérification de l’hypothèse des solutions idéales par l’analyse des effets des différentes variables sur les constantes d’équilibre estimées ... 66
3.10.1 Effet du nombre d’ETR en solution sur les constantes d’équilibre estimées . 67 3.10.2 Effet de la concentration initiale totale sur les constantes d’équilibre ... 67
3.10.3 Effet du pH initial sur les constantes d’équilibre ... 68
3.10.4 Effet de la concentration en extracteur ... 69
3.10.5 Influence des paramètres initiaux sur l’estimé des constantes d’équilibre ... 69
3.11 Résumé des observations sur les tests d’extraction par solvant expérimentaux et de la méthode de réconciliation de données développée ... 71
4 Simulation du procédé d’extraction par solvant des ETR ... 72
4.1 Simulation du procédé d’extraction par solvant ... 72
4.2 Simulation des opérations de séparation des ETR ... 74
4.3 Méthode proposée pour la simulation des opérations de séparation des ETR et essais de validation de la méthode ... 74
4.4 Simulation et expérimentation de la séparation des ETR légers, des SEG et ETR lourds à partir d’une solution synthétique d’ETR avec un circuit d’extraction par solvant à co-courant. ... 80
4.4.1 Évaluation du procédé de la figure 39 ... 84
4.5 Production des ETR légers, SEG et ETR lourds à partir d’une solution réelle provenant de la lixiviation du minerai de Niobec avec un circuit d’extraction par solvant à co-courant ... 85
5 Conclusion ... 93
5.1 Retour sur les travaux effectués ... 93
5.2 Perspectives de travaux futurs ... 95
6 Bibliographie ... 98
7 Annexes ... 101
7.1 Annexe A : Recherche des conditions d’équilibre des réactions de transfert pour la simulation de l’opération d’extraction des éléments de terres rares ... 101
VII
7.1.1 Exemple d’application ... 104 7.2 Annexe B : Production de la solution d’ETR à partir du minerai de Niobec (méthode A) ... 107 7.3 Annexe C : Production de la solution d’ETR à partir du minerai de Niobec (méthode B) ... 109
VIII
Liste des tableaux
Tableau 1. Paramètres instrumentaux du MP-AES utilisés pour l’analyse des ETR ... 28
Tableau 2. Concentrations en ppm mesurées par le MP-AES et valeurs de références fournies pour le minerai OKA-2 ... 29
Tableau 3. Concentration en ETR de la solution synthétique utilisée pour déterminer la cinétique d’extraction ainsi que les composés utilisés pour produire la solution ... 35
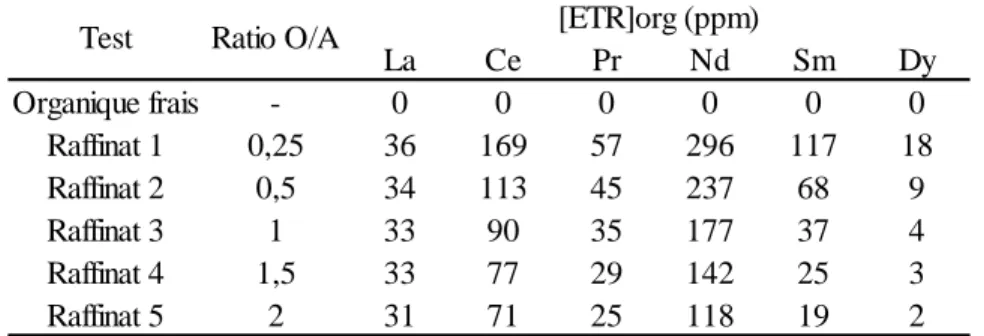
Tableau 4. Concentrations et pH mesurés dans la phase aqueuse pour la solution mère et les raffinats ... 37
Tableau 5. Concentrations en ETR calculées dans la phase organique avec les mesures du tableau 4 ... 38
Tableau 6. Constantes d’équilibre d’ETR calculées pour chaque test ... 41
Tableau 7. Valeurs utilisées pour la détermination de la Keq du Nd ... 42
Tableau 8. Keq du Nd extrapolé avec la méthode des logarithmes et la moyenne de la méthode directe... 43
Tableau 9. pH calculés et mesurés pour les raffinats d’une série de tests ... 46
Tableau 10. Conditions des séries de tests ... 51
Tableau 11. Concentrations en ETR de la solution initiale pour chaque série de tests ... 52
Tableau 12. Keq estimées par la méthode de réconciliation de données de chaque série de tests ... 53
Tableau 13. Keq calculées par la moyenne des Keq estimées pour chaque série de tests selon la méthode décrite à la section 2.4.2 ... 53
Tableau 14. Résultats réconciliés et constantes d’équilibre estimées pour la série de tests 19 (concentration en mg/L) ... 56
Tableau 15. Concentrations réconciliées utilisées pour calculer les constantes d’équilibre pour La, Ce et Pr de chaque raffinat (en mol/L) ... 57
Tableau 16. Facteurs de séparations obtenues par régression linéaire des Keq pour les séries de tests réconciliées ainsi que valeurs de la littérature en italique (McCallum et al., 2014) 64 Tableau 17. Constantes d’équilibre (x10-4 ) estimées avec des tests sur des solutions synthétiques et sur des solutions réelles ... 65
Tableau 18. Constantes d’équilibre (x10-4 ) estimées avec des tests d’extraction et d’élution partielle ... 66
Tableau 19. Résultats des tests de Student appliqués sur la pente de la régression entre Keq;Nd et les variables causales et coefficients de corrélation calculés ... 70
Tableau 20. Constantes d’équilibre estimées pour les éléments de terres rares ... 71
Tableau 21. Exemple de composition d’une solution mère alimentant le circuit de la figure 34, concentrations en g/L (adapté de (McCallum et al., 2016)) ... 74
Tableau 22. Constantes d’équilibre utilisées pour la simulation ... 76
Tableau 23. Solutions aqueuses et conditions d’extraction utilisées pour valider la procédure de simulation... 76
Tableau 24. Statistiques sur les écarts entre les extractions observées et simulées ... 79
Tableau 25. Teneurs en ETR de la solution synthétique d’alimentation et constantes d’équilibre utilisées pour la simulation du circuit de séparation de la figure 39 ... 81
Tableau 26. Récupérations simulées (%) des ETR dans les flux de sortie du circuit de la figure 39 ... 83
Tableau 27. Récupérations simulées (%) et réconciliées (%) pour les différents flux de sorties du diagramme d’écoulement de la figure 39 appliqué à une solution synthétique ... 84
IX
Tableau 28. Recherche par simulation des conditions optimales d’extraction pour la
solution d’ETR dont la composition est donnée au tableau 25 ... 85 Tableau 29. Concentration en ETR et en impuretés de la solution d’alimentation du circuit d’extraction par solvant ... 87 Tableau 30. Récupérations simulées (%) et réconciliées (%) pour les différents flux de sorties du diagramme d’écoulement appliqué à une solution réelle ... 89 Tableau 31. Données pour la simulation des isothermes d’extraction des ETR avec du Cyanex 572 ... 105
X
Liste des figures
Figure 1. Classification des ETR dans le document ... 1
Figure 2. Concentration relative au lanthane des ETR dans le minerai de Niobec avec le prix des OTR en 2016 ... 2
Figure 3. Différentes méthodes de production d’une liqueur mère d’ETR pour alimenter une usine de séparation ... 3
Figure 4. Extraction par solvant, avant et après agitation ... 7
Figure 5. Les étapes d’un circuit d’extraction ... 9
Figure 6. Reflux de la solution d’élution à l’étape d’élution partielle et déplacement du lanthane de la phase organique par le néodyme ... 14
Figure 7. Fonctionnement d’une unité mélangeur-décanteur ... 15
Figure 8. Diagramme à bloc simplifié de la séparation des ETR d’une usine d’extraction par solvant (Goode, 2016) ... 16
Figure 9. Circuit d’extraction par solvant pour un système à contre-courant ... 17
Figure 10. Banc de mélangeur-décanteurs en série dans un circuit d’extraction par solvant à contre-courant pour l’étape d’extraction ... 17
Figure 11. Photographie d’un banc de mélangeurs-décanteurs industriels ... 17
Figure 12. Diagramme des thèmes de recherche du projet ETR CRSNG-Niobec ... 21
Figure 13. Problématique des dilutions et de l’analyse des ETR au MP-AES ... 26
Figure 14. Notions de justesse et de précision ... 27
Figure 15. Déviation des analyses d’ETR et du Th par le MP-AES par rapport aux valeurs de référence certifiées du minerai OKA-2 ... 30
Figure 16. Appareil utilisé pour l’agitation des ampoules à décanter ... 31
Figure 17. Illustration de l’extraction par solvant dans une ampoule à décanter ... 33
Figure 18. Cinétique d’extraction pour différents ETR lors d’extraction dans une ampoule à décanter avec du Cyanex 572 à 15% v/v ... 35
Figure 19. Cinétique d’extraction pour différents ETR lors d’extraction dans une ampoule à décanter avec du D2EHPA à 15% v/v ... 37
Figure 20. Diagramme de McCabe-Thiele pour l’extraction d’un métal (adapté de Ritcey et Asbrook, 1984) ... 39
Figure 21. Isothermes d’extraction d’ETR (concentrations en ppm) avec l’extracteur Cyanex 572 15% v/v ... 40
Figure 22. Détermination de la Keq du Nd avec la méthode par régression linéaire ... 42
Figure 23. Résultats attendus de la Keq du Nd avec la méthode par régression linéaire ... 44
Figure 24. Distribution des résidus réduits des concentrations en ETR dans les solutions mères pour tous les tests du tableau 10 ... 59
Figure 25. Distribution des résidus réduits des pH des solutions mères pour tous les tests du tableau 10 ... 59
Figure 26. Distribution des résidus réduits des concentrations en ETR pour les raffinats pour tous les tests du tableau 10 ... 60
Figure 27. Distribution des résidus réduits des pH pour les raffinats pour tous les tests du tableau 10 ... 61
Figure 28. Facteur de séparation Nd/Pr (pente) de Keq:Nd en fonction de Keq:Pr pour chaque série de tests ... 63
Figure 29. Facteur de séparation Sm/Nd (pente) de Keq:Sm en fonction de Keq:Nd pour chaque série de tests ... 63
XI
Figure 30. Constantes d’équilibre du néodyme estimées en fonction du nombre d’éléments présents dans la solution ... 67 Figure 31. Constantes d’équilibre du néodyme estimées à différentes concentrations totales en ETR ... 68 Figure 32. Constantes d’équilibre du néodyme estimées pour des tests à différents pH de solution mère ... 68 Figure 33. Constantes d’équilibre du néodyme estimées en fonction de la concentration en extracteur dans la phase organique ... 69 Figure 34. Circuit d’extraction par solvant pour la séparation des ETR légers et lourds ... 73 Figure 35. Extractions simulées et mesurées de quatre ETR à différents ratios O/A pour la série de tests 1 ... 77 Figure 36. Extractions simulées et mesurées de quatre ETR à différents ratios O/A pour la série de tests 2 ... 77 Figure 37. Extractions simulées et mesurées de quatre ETR à différents ratios O/A pour la série de tests 3 ... 78 Figure 38. pH d’équilibre simulé et mesuré à différents ratios O/A pour les tests conduits avec les trois solutions mères décrites au tableau 23... 80 Figure 39. Diagramme d’écoulement à co-courant simulé et réalisé en laboratoire sur une solution synthétique ... 82 Figure 40. Production de la liqueur mère alimentant le circuit d’extraction par solvant à partir d’un concentré de flottation des ETR ... 86 Figure 41. Diagramme d’écoulement à co-courant simulé et réalisé en laboratoire sur une solution réelle ... 88 Figure 42. Précipitation des ETR présents dans le raffinat sous forme d’oxalate et
transformation en oxydes... 92 Figure 43. Concentré d’oxydes d’ETR légers (La-Ce-Pr-Nd) produit à partir du raffinat d’extraction par solvant obtenu par le traitement d’une solution obtenue du minerai de Niobec ... 92 Figure 44. Schéma du processus d’estimation des constantes d’équilibre par minimisation d’un critère des moindres carrés ... 104 Figure 45. Isothermes pour le lanthane et le néodyme avec un pH de solution mère de 3,5 et les conditions du tableau 31 ... 106 Figure 46. Isothermes pour le lanthane et le néodyme avec un pH de solution mère de 2,5 et les conditions du tableau 31 ... 106 Figure 47. Production d’une solution d’ETR provenant d’un concentré du minerai de Niobec ... 108 Figure 48. Production de la solution mère alimentant le circuit d’extraction par solvant à partir d’un concentré de flottation des ETR ... 109
XII
Liste des abréviations et des sigles
ETR : Éléments de terres raresETR légers : Éléments de terres rares légers (La, Ce, Pr, Nd) SEG : Éléments de terres rares (Sm, Eu, Gd)
ETR lourds : Éléments de terres rares lourds (Tb, Dy, Ho, Er, Tm, Yb, Lu, Y, Sc) SX : Extraction par solvant
KEq : Constante d’équilibre d’extraction par solvant
RO/A : Volume de phase organique sur le volume de phase aqueuse
Ln : Lanthanides (utilisé dans les équations mathématiques pour représenter les ETR) OTR : Oxydes d’éléments de terres rares
0: Concentration initiale avant extraction 𝑒𝑞: Concentration d’une espèce à l'équilibre
𝑎𝑞: Concentration d’une espèce dans la phase aqueuse 𝑜𝑟𝑔: Concentration d’une espèce dans la phase organique 𝑇: État d’une variable pour un test T (expérimental ou simulé) ̂ : Estimé d’une valeur
XIII
Remerciements
Je tiens à remercier mon directeur de recherche, le professeur Claude Bazin pour avoir guidé mes travaux et pour son soutien constant. Son éthique de travail et son approche de la recherche scientifique sont des modèles dont je m’inspirerai pour toujours. Je tiens aussi à remercier le professeur Dominic Larivière qui m’a permis d’étendre mes compétences dans le domaine de l’analyse élémentaire. Je remercie particulièrement mes deux collègues de travail dans le domaine de la production des éléments de terres rares, Jean-François Boulanger et Laurence Whitty-Léveillé, pour le travail formidable accompli en équipe. Un merci particulier à Vicky Dodier pour son aide au laboratoire. De plus, je remercie l’ensemble des membres du personnel et des étudiants gradués du département de génie des mines de la métallurgie et des matériaux. Je suis reconnaissant pour l’aide apportée par les collaborateurs aux projets des éléments de terres rares de la Polytechnique, de McGill, de l’Université Laval et de Niobec, principalement le professeur Jamal Chaouki et son assistant Mohammad Latifi. Finalement, je remercie ma compagne, Joannie Moussette, pour son support tout au long de ces années d’études.
1
1
Introduction
1.1 Les éléments de terres rares
Les éléments de terres rares (ETR) regroupent 16 éléments (la série des lanthanides, l’yttrium et le scandium). Le prométhium n’étant pas un élément stable, il n’est pas inclus dans la famille éléments de terres rares dans ce document. Ces 16 éléments se retrouvent habituellement ensemble dans les minéraux d’où ils sont extraits. L’utilisation de ces éléments dans les matériaux impose de les séparer les uns des autres. Présentement, il n’existe aucune méthode physique pour les séparer. La séparation de ces éléments nécessite l’utilisation de procédés chimiques comme l’extraction par solvant. Les ETR sont souvent divisés en sous-groupes comme les ETR légers (lanthane à néodyme), les SEG pour le groupe (samarium, europium et gadolinium) et les ETR lourds (terbium à lutécium, scandium et yttrium). La figure 1 présente les éléments de terres rares dans le tableau périodique ainsi que les sous-groupes utilisés dans le document.
Figure 1. Classification des ETR dans le document
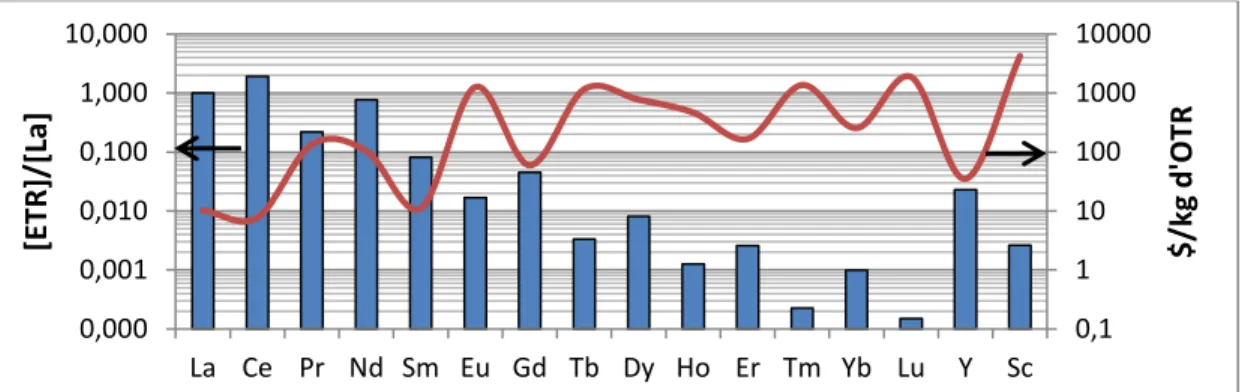
Ces éléments ne se trouvent pas en même concentration dans les minéraux et leurs teneurs respectives varient grandement. La valeur marchande des ETR dépend de leur rareté, mais aussi, de l’offre et de la demande selon la nécessité de ces éléments dans différentes applications spécifiques allant en 2016 de 8 $/kg pour l’oxyde de lanthane à 1200 $/kg pour l’oxyde d’europium. Le lien entre la concentration dans un minerai et le prix des oxydes de terres rares (OTR) est montré à la figure 2. Le développement d’un circuit de séparation des
2
ETR doit donc prendre en compte le prix de chaque ETR afin de maximiser le rendement économique de l’opération de séparation.
Figure 2. Concentration relative au lanthane des ETR dans le minerai de Niobec avec le prix des OTR en 2016
1.2 La production des ETR et la place de l’extraction par solvant
Les ETR sont majoritairement produits à partir de minerais contenant des minéraux d’ETR et en faible partie du recyclage de matériaux. Les principaux minéraux exploités sont la Bastnaesite (LnFCO3) et la monazite (LnPO4) où Ln désigne la famille des lanthanides (La à Lu). La teneur de ces minéraux dans les gisements est habituellement faible. Par exemple, la mine Niobec (Saint-Honoré, Québec) possède un gisement potentiel d’ETR avec une teneur dans le minerai de 1,3% ETR. La figure 3 présente différentes approches utilisées afin de produire une solution d’ETR qui alimentera une usine de séparation des ETR par extraction par solvant.
0,1 1 10 100 1000 10000 0,000 0,001 0,010 0,100 1,000 10,000 La Ce Pr Nd Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Y Sc $ /kg d 'OTR [ET R] /[La]
3 Traitement du minerai Craquage acide et lixiviation Vers extraction par solvant Gangue non-réactive Minerai broyé Argiles ioniques Solution de sels (NH4+, Na+) Purification Impuretés (Th, Fe, Ce (IV)) Oxyde mixte d’ETR Lixiviation Rejet Concentré d’ETR
Solution d’ETR impure lixiviation Séparation solide-liquide (filtration) Solution d’ETR Minerai broyé
A. Production et lixiviation d’un concentré d’ETR
C. Lixiviation d’argiles ioniques
D. Lixiviation directe d’un oxyde d’ETR mixte B. Lixiviation directe d’un minerai d’ETR
Figure 3. Différentes méthodes de production d’une liqueur mère d’ETR pour alimenter une usine de séparation
La production d’un concentré d’ETR par traitement du minerai (chemin A, figure 3) est la méthode la plus utilisée pour produire une solution qui alimentera l’usine d’extraction par solvant (Krishnamurthy & Gupta, 2004). Les procédés de concentration physiques comme la flottation sont utilisés pour produire un concentré riche en minéraux porteurs d’ETR. La production d’un concentré permet de réduire la quantité d’acides et de bases nécessaires au craquage et à la lixiviation des minéraux d’ETR en plus de limiter la quantité d’impuretés mises en solution. Cependant, la concentration des minéraux d’ETR est difficile, car différents minéraux d’ETR se retrouvent dans un même minerai et ces minéraux se comportent différemment dans les procédés de concentration ce qui fait que la performance globale du procédé de concentration est souvent décevante. Le concentré de minéraux d’ETR est par la suite craqué pour libérer les ETR dans une solution aqueuse souvent acide. Une solution d’ETR contenant aussi des éléments non désirés est ainsi obtenue. Le solide est filtré et envoyé au parc à résidus. Des étapes de purification sur la solution de lixiviation permettent d’obtenir une solution exempte d’impuretés contenant seulement des ETR. La purification peut être effectuée par neutralisation avec une base afin de précipiter le thorium
4
et le fer sous forme d’hydroxydes à un pH avoisinant 4 tout en maintenant les ETR en solution puisque ces derniers précipitent sous forme d’hydroxydes à pH plus élevé (Schweitzer & Pesterfield, 2010). La formation d’un précipité d’oxalate d’ETR permet aussi de récupérer les ETR sous la forme d’oxalates solides exempts d’impuretés. Ces oxalates sont ensuite dissouts pour produire une solution d’ETR (Chi & Xu, 1999). La solution purifiée alimente le circuit d’extraction par solvant où sont séparés les ETR.
Des méthodes de lixiviation directes (chemin B, figure 3) sont étudiées pour certains projets (Dreisinger et al., 2016; J.-F. Boulanger et al., 2016). Dans ce cas, le minerai est lixivié tel quel, et ce, même si la teneur en ETR est faible. Cette approche est utilisée lorsque le minerai ne se prête pas à la production d’un concentré. L’idée est que même si une plus grande quantité d’acide est nécessaire à la lixiviation, il est plus rentable de procéder à un traitement direct du minerai puisqu’il n’y a pas de pertes d’ETR associées à l’étape du traitement du minerai pour la production d’un concentré. Certains minerais sont plus propices à utiliser une lixiviation directe. Pour un minerai dont la gangue et le minéral porteur d’ETR sont composés majoritairement de silicates, la lixiviation directe est intéressante, car la majorité de la gangue ne sera pas affectée par l’acide de lixiviation. Cela permet de récupérer les ETR tout en limitant la consommation d’acide (J.-F. Boulanger et al., 2016). L’étape de purification est similaire au traitement d’un concentré. Cependant, la quantité d’impuretés à éliminer de la solution est généralement plus élevée dans ce cas que pour le traitement d’un concentré.
La mise en solution d’ETR adsorbés sur des argiles ioniques (chemin C, figure 3) par des solutions de sels de sodium et/ou de sels d’ammonium se fait principalement en Chine (Moldoveanu & Papangelakis, 2012). Par un processus d’échange ionique, les ETR sont facilement mis en solution à même le sol argileux. Ces argiles ioniques sont relativement rares et les masses d’ETR pouvant en être extraits sont faibles (Krishnamurthy & Gupta, 2004). Le Canada ne possède pas de telles argiles. Ce procédé permet de produire, à faible coût, des solutions d’ETR riches en SEG et ETR lourds.
5
Certains producteurs d’ETR ne vendent qu’un concentré contenant tous les ETR sous forme d’oxydes (chemin D, figure 3). Ce mixte d’oxydes doit être traité par une usine de séparation afin de séparer les ETR. Un concentré mixte a moins de valeur que les éléments séparés. La mise en solution de ces oxydes se fait avec des acides et permet de produire directement une solution pure d’ETR prête à être séparée. Certaines compagnies se spécialisent dans la séparation des ETR. Par exemple, l’usine de séparation de Solvay à La Rochelle achète des concentrés et produit les ETR séparés (Yahorava, 2013).
Le procédé d’extraction par solvant est actuellement le principal procédé de séparation des éléments de terres rares utilisés industriellement (Krishnamurthy & Gupta, 2004). Le procédé général est bien détaillé dans la littérature (Ritcey & Ashbrook, 1984). Cependant son application à la séparation des ETR est peu détaillée et plusieurs informations sensibles ne se trouvent pas dans la littérature à cause du secret industriel requis pour la compétitivité du peu d’usines de séparation en opération dans le monde.
L’extraction par solvant appliquée aux ETR est un procédé complexe nécessitant un grand nombre d’étapes. Puisque les ETR sont chimiquement très similaires, la séparation nécessite beaucoup plus d’étapes que pour d’autres systèmes dans lequel l’extraction par solvant est utilisée comme c’est le cas de la production du cuivre des minerais oxydés (Aminian et al., 2000). Le développement d’outils de simulation du procédé pour simplifier la conception des circuits de séparation est une partie importante des travaux présentés dans ce document.
Bien que plusieurs procédés de séparation des ETR soient en développement, l’extraction par solvant est, en 2017, la méthode de séparation industrielle la plus utilisée. Par exemple, la compagnie Lynas Corp. en Australie, qui a débuté ses opérations en 2011, utilise l’extraction par solvant pour séparer les ETR. Alors que certaines méthodes alternatives étaient disponibles (Goode, 2016), la compagnie a choisi de construire une usine d’extraction par solvant, le LAMP (Lynas Advanced Materials Plant), puisque l’extraction par solvant est un procédé bien établi alors que l’efficacité des méthodes alternatives reste encore à démontrer. Cependant, dans le milieu des ETR, la connaissance du procédé
6
d’extraction par solvant est concentrée en Chine qui génère 95% de la production mondiale d’ETR (Xie et al., 2014). Certaines compagnies extérieures à la Chine, comme Solvay en France (Goode J.R., 2016), possèdent des connaissances avancées et produisent des ETR par le procédé d’extraction par solvant. Cependant, le partage des connaissances est limité par le secret industriel et la compétitivité. Notre projet ne vise donc pas à réinventer le procédé, mais de le comprendre afin que les promoteurs de projets d’exploitation de gisements d’ETR puissent s’appuyer sur une expertise canadienne. La littérature disponible sur la séparation industrielle des ETR par extraction par solvant fait souvent référence aux mêmes articles datant d’avant l’an 2000 (Leveque & Maestro, 1993). De l’information est disponible sur le fonctionnement de l’usine de séparation de Molycorp (Mountain Pass, États-Unis) avant leur première fermeture en 2002 (Krishnamurthy & Gupta, 2004). Cependant, les diagrammes d’écoulement du circuit d’extraction par solvant des usines sont difficiles à obtenir et souvent incomplets. Les conditions opératoires (débit et composition des solutions) sont rarement disponibles.
Il est relativement facile de trouver dans la littérature les concepts généraux sur la séparation des ETR par extraction par solvant (Jha et al., 2016; Xie et al., 2014; Zhang et al., 2016). Cependant, on retrouve très peu de données de production comme les débits de solution, les rendements de séparation, les pH d’opération, les proportions recirculées ou reflux (section 1.3). Le manque de détails de ces documents fait en sorte que la science de la séparation des ETR n’appartient qu’à un nombre très limité d’experts qui vendent à fort prix leur expertise.
Ce mémoire vise à développer un diagramme d’écoulement de la séparation des ETR avec le procédé d’extraction par solvant et d’en décrire les conditions d’opérations. Pour ce faire, des tests d’extraction par solvant sont réalisés en laboratoire afin de produire les informations non disponibles dans la littérature. La compréhension du procédé et des réactions impliqués dans l’extraction par solvant est le premier pas dans la réalisation de ces objectifs.
7
1.3 Théorie de l’extraction par solvant
Lors de ce procédé, deux phases non miscibles sont mises en contact. Habituellement, une phase aqueuse chargée avec les éléments de valeur est mélangée à une phase organique contenant un extracteur dilué dans un solvant organique appelé diluant. Le diluant utilisé dans ce projet est un kérosène appelé Orfom SX-12 (produit par Chevron Phillips, Bartlesville, É.-U.). L’extracteur est une molécule qui se complexe sélectivement avec les éléments en solution afin de permettre le transfert de certains éléments de la phase aqueuse à la phase organique. La quantité d’éléments transférés dans la phase organique dépend de l’affinité entre les molécules d’extracteur et les éléments extraits. Plusieurs types d’extracteurs existent : cationiques, anioniques et neutres. Pour la séparation des ETR, les extracteurs de types cationiques sont principalement utilisés. Le transfert de matière pour la réaction entre un métal en solution et un extracteur cationique est décrit par l’équation (1) suivante :
𝑀𝑎𝑞𝑛++ 𝑛𝑅𝐻𝑜𝑟𝑔 ←
→ 𝑀𝑅𝑛:𝑜𝑟𝑔+ 𝑛𝐻𝑎𝑞+ (1)
Où 𝑅𝐻𝑜𝑟𝑔 est l’extracteur libre en phase organique et 𝑀𝑎𝑞𝑛+ le cation métallique en phase aqueuse qui se complexent pour former 𝑀𝑅𝑛:𝑜𝑟𝑔 le complexe métal-extracteur en phase organique. La réaction implique que 𝑛 moles de proton (𝐻𝑎𝑞+ ) soient transférées dans la phase aqueuse lors de l’extraction en fonction du nombre 𝑛 de moles de 𝑅𝐻𝑜𝑟𝑔 pour permettre de complexer une mole de métal en solution. Le transfert produit donc une acidification de la solution aqueuse. Le procédé d’extraction par solvant est schématisé à la figure 4. M+ MRn M+ M+ HR HR HR HR H+ M+ M+ HR HR HR M+ H+ HR MR MR MR H+ Agitation Séparation HR Liqueur mère Organique frais Organique chargée Raffinat
8
Pour qu’un atome d’un ETR soit extrait dans la phase organique, il faut former un complexe neutre. Les molécules d’extracteur peuvent perdre un proton et devenir chargées négativement. Puisque les ETR se trouvent majoritairement en état d’oxydation 3+ en solution, il faut généralement trois molécules d’extracteurs de type cationiques pour neutraliser la charge et former un complexe neutre (Xie et al., 2014). Appliquée aux ETR qui se trouvent en solution avec un degré d’oxydation III, l’équation (1) devient:
𝐿𝑛𝑎𝑞3++ 3𝑅𝐻 𝑜𝑟𝑔
←
→ 𝐿𝑛𝑅3𝑜𝑟𝑔+ 3𝐻𝑎𝑞+ (2)
Où :
Ln3+ : Lanthanide (ETR) en phase aqueuse
LnR3org : complexe ETR-extracteur en phase organique
Un circuit d’extraction par solvant comporte habituellement trois étapes : l’extraction, l’élution partielle et l’élution. L’extraction est l’étape lors de laquelle les éléments d’intérêt sont transférés de la phase aqueuse vers la phase organique. Cependant, dans le cas de la séparation des ETR, il est difficile d’extraire seulement les éléments d’intérêt. La figure 5 présente un schéma d’extraction simplifié dans lequel un élément B doit être séparé d’un élément A. Chaque bloc (rectangle) de la figure 5 comporte en fait les étapes d’agitation et de séparation de phases montrées à la figure 4.
9 Extraction Acide dilué Liqueur mère Acide concentré Élution partielle Élution So lv an t c h ar gé Conditionnement du solvant So lv an t d é ch ar gé A lim e n ta ti o n d u s o lv an t o rg an iq u e Raffinat Raffinat Solution de l’élément B A A A B B A B B B B
Figure 5. Les étapes d’un circuit d’extraction
La séparation est effectuée en transférant l’élément B dans la phase organique alors que l’élément A reste dans la phase aqueuse. Cependant, la séparation parfaite lorsque deux ETR sont adjacents dans le tableau périodique est impossible. En réalité, lorsque l’on extrait l’élément B, on extrait aussi l’élément A. L’étape d’élution partielle permet de transférer sélectivement les espèces non désirées (A) dans une nouvelle phase aqueuse qui peut être renvoyée à l’étape d’extraction. Après l’élution partielle, la phase organique contient principalement les éléments désirés. Lors de l’élution, les éléments dans la phase organique (soit l’élément B pour l’exemple de la figure 5) sont transférés dans une phase aqueuse. La phase organique déchargée peut être réutilisée après un reconditionnement (voir figure 5). La réaction qui décrit les étapes d’élution partielle et d’élution est l’inverse de la réaction d’extraction (2)(3), soit :
𝐿𝑛𝑅3𝑜𝑟𝑔+ 3𝐻𝑎𝑞+ → 𝐿𝑛← 𝑎𝑞3++ 3𝑅𝐻𝑜𝑟𝑔 (3)
L’étape de conditionnement du solvant permet de nettoyer la phase organique de l’acide entrainé lors de l’étape d’élution. Ce nettoyage de la phase organique évite de retourner le solvant contaminé avec de l’acide fort à l’étape d’extraction qui s’effectue à un pH moins
10
acide que l’élution. Généralement, le conditionnement se fait avec une solution aqueuse vide ayant un pH similaire à celui de la phase aqueuse de l’étape d’extraction. Il est aussi possible de saponifier l’extracteur avant d’envoyer la phase organique à l’étape d’extraction. La saponification consiste à remplacer une partie des protons (H+
) des molécules d’extracteur échangés lors de la réaction (1) par un cation de sodium (Krishnamurthy & Gupta, 2004). L’avantage de saponifier l’extracteur est de limiter la variation de pH lors de l’extraction qui affecte la quantité de métal extrait en fonction de l’acidité. Cependant, dans le cadre de ce mémoire, à moins d’un avis contraire, l’extracteur utilisé n’est pas saponifié.
Le procédé d’extraction par solvant est une réaction de transfert de matière avec des produits et des réactifs (1). De ce fait, une constante d’équilibre d’extraction par solvant peut être calculée pour chaque ETR. L’hypothèse que les solutions sont idéales permet de poser que les activités chimiques des espèces sont proportionnelles aux concentrations molaires de ces espèces. Cette hypothèse semble être vérifiée par les résultats présentés à la section 3.10. Pour la réaction (2)(3), la constante d’équilibre pour un ETR est décrite par :
𝐾𝐸𝑞:𝐿𝑛 =[𝐿𝑛𝑅3]𝑜𝑟𝑔[𝐻 +] 𝑎𝑞 3 [𝐿𝑛3+] 𝑎𝑞[𝑅𝐻]𝑜𝑟𝑔3 (4)
Pour un extracteur, un diluant et une température fixés, chaque élément a théoriquement une seule constante d’équilibre. Une autre équation de la constante d’équilibre est décrite dans la littérature (Xie et al., 2014) qui prend en compte la dimérisation possible de certains extracteurs dans la phase organique :
𝐾𝐸𝑞:𝐿𝑛= [𝐿𝑛(𝑅2𝐻)3]𝑜𝑟𝑔[𝐻 +] 𝑎𝑞 3 [𝐿𝑛3+] 𝑎𝑞[𝑅2𝐻2]𝑜𝑟𝑔3 (5)
Le coefficient distribution, 𝐸𝑖, pour un élément i est le rapport entre les concentrations d’équilibre de l’élément i dans les phases organique et aqueuse :
𝐸𝑖 =[𝐿𝑛𝑅3]𝑜𝑟𝑔:𝑖 [𝐿𝑛3+]
𝑎𝑞:𝑖
11
Le facteur de séparation (𝛾𝑖:𝑗) entre deux éléments (i et j) correspond à : 𝛾𝑖:𝑗 =𝐸𝑖
𝐸𝑗 (7)
Les facteurs de séparation sont très utilisés pour quantifier l’efficacité de séparation des ETR pour différents extracteurs et même pour la simulation du procédé d’extraction par solvant (Xie et al., 2014). Puisque l’extraction par solvant est utilisée comme technique de séparation, ce sont principalement les facteurs de séparation des ETR pour un extracteur donné que l’on retrouve dans la littérature (Krishnamurthy & Gupta, 2004). Plus le facteur de séparation est grand, plus la séparation entre les deux éléments est facile permettant ainsi de diminuer le nombre d’extractions nécessaire à leur séparation. Une grande partie de la recherche actuelle sur l’extraction par solvant des ETR porte sur le développement de nouveaux extracteurs ayant des facteurs de séparation élevés pour des ETR adjacents dans le tableau périodique. Les constantes d’équilibre sont rarement rapportées dans la littérature puisque les facteurs de séparation sont plus faciles à estimer que les constantes d’équilibre. Toutefois, les facteurs de séparation ne prennent pas en compte les conditions d’extraction qui ont un effet sur l’extraction telles que le pH de la phase aqueuse, la concentration des espèces en solutions (aqueuse et organique) et la concentration d’extracteur libre dans la phase organique. Cela peut limiter leur utilisation pour la simulation des opérations d’extraction, d’élution partielle et complète. Dans le cadre de ce mémoire, nous allons vérifier la possibilité d’utiliser les constantes d’équilibre pour la simulation d’un circuit d’extraction par solvant pour la séparation des ETR, incluant les opérations d’élution de la phase organique.
La combinaison des équations (4) et (6) permet d’écrire : 𝐸𝑖 = 𝐾𝐸𝑞:𝑖(
𝑅𝐻 𝐻+)
3
12 Puisque la portion (𝑅𝐻
𝐻+)
3
de l’équation (8) est équivalente pour toutes les espèces en solution, les facteurs de séparations entre deux éléments sont donc aussi décrits par le rapport entre les constantes d’équilibre de deux éléments :
𝛾𝑖:𝑗 = 𝐾𝐸𝑞:𝑖
𝐾𝐸𝑞:𝑗 (9)
Dans l’optique de simuler un système d’extraction par solvant fonctionnant à différents pH ou concentration d’extracteur libre en phase organique, la simple connaissance des facteurs de séparation n’est pas suffisante. Toutefois, nous pensons et nous allons vérifier expérimentalement que l’utilisation des constantes d’équilibre permet le développement d’un simulateur général d’un circuit complet de séparation des ETR.
1.4 L’extraction par solvant de plusieurs espèces dans une même phase aqueuse
La séparation des éléments de terres rares par le procédé d’extraction par solvant est basée sur la différence de sélectivité d’un extracteur pour chaque ETR. Cette différence de sélectivité est quantifiée par la constante d’équilibre de la réaction d’extraction (équation (4)). Par exemple, pour trois éléments (La, Pr et Nd) extraits en solution, trois réactions d’équilibre peuvent être écrites :
𝐿𝑎𝑎𝑞3++ 3𝑅𝐻 𝑜𝑟𝑔 ← → 𝐿𝑎𝑅3𝑜𝑟𝑔+ 3𝐻𝑎𝑞+ (10) 𝑃𝑟𝑎𝑞3++ 3𝑅𝐻𝑜𝑟𝑔 ← → 𝑃𝑟𝑅3𝑜𝑟𝑔+ 3𝐻𝑎𝑞+ (11) 𝑁𝑑𝑎𝑞3++ 3𝑅𝐻 𝑜𝑟𝑔 ← → 𝑁𝑑𝑅3𝑜𝑟𝑔+ 3𝐻𝑎𝑞+ (12)
Les réactions (10) à (12) montrent que la concentration d’extracteur libre et de proton transféré varie selon les espèces extraites. Une constante d’équilibre peut être calculée pour chacun de ces trois éléments : 𝐾𝑒𝑞:𝐿𝑎, 𝐾𝑒𝑞:𝑃𝑟, 𝐾𝑒𝑞:𝑁𝑑. La valeur des constantes d’équilibre est différente pour chaque ETR pour l’exemple précédent on trouve que :
13
Si la constante d’équilibre du néodyme est plus grande que celle du praséodyme, une plus grande quantité relative de néodyme sera transférée dans la phase organique lors de l’extraction. Avec les valeurs de constantes de l’équation (13), pour une concentration équivalente de chaque élément dans une phase aqueuse avec un organique non-chargé, les concentrations des éléments après extraction dans la phase organique varieront comme suit :
[𝐿𝑎𝑅3]𝑜𝑟𝑔 < [𝑃𝑟𝑅3]𝑜𝑟𝑔 < [𝑁𝑑𝑅3]𝑜𝑟𝑔 (14)
Pour les étapes d’élution, puisque la réaction est l’inverse de la réaction d’extraction, les concentrations des éléments en phase aqueuse après transfert de la phase organique vont varier selon :
[𝐿𝑎𝑎𝑞3+] > [𝑃𝑟𝑎𝑞3+] > [𝑁𝑑𝑎𝑞3+] (15)
L’extraction par solvant permet de séparer sélectivement les éléments en utilisant ces propriétés. Les étapes d’extraction et d’élution sont complémentaires dans l’atteinte de la séparation des ETR. En effet, si une faible quantité de lanthane est transférée la phase organique lors de l’extraction selon l’équation (14), une élution partielle de la phase organique favorisera le transfert du lanthane entraîné vers la phase aqueuse d’élution. Il est aussi possible de contrôler les concentrations des différentes espèces dans chacune des phases afin de déplacer les réactions de transfert dans la direction désirée. Ainsi, en dopant la solution d’élution partielle avec un peu de néodyme on favorise un déplacement du lanthane dans la phase organique vers la phase aqueuse par du néodyme qui, lui, sera récupéré à l’élution finale. C’est le concept de reflux qui est considéré comme stratégique pour la séparation des ETR, mais dont la pratique industrielle est malheureusement très peu documentée dans la littérature (Leveque & Maestro, 1993).
Le reflux consiste à utiliser une partie de la solution aqueuse de sortie chargée de l’étape d’élution partielle ou d’élution dans une autre étape (extraction ou élution partielle) afin de favoriser l’extraction des éléments cibles et de diminuer la consommation d’acide. Dans l’exemple à 3 éléments (La, Pr, Nd), le reflux de la solution acide d’élution qui est riche en néodyme vers l’étape d’élution partielle permet d’acidifier la solution d’élution partielle.
14
De plus, la présence de Nd dans la solution d’élution partielle favorise le déplacement du lanthane présent dans la phase organique vers la phase aqueuse au profit de néodyme. La figure 6 présente le concept de reflux.
Phase aqueuse Phase organique La Pr Nd Nd Solution d’élution partielle Reflux d’élution Nd3+, 3H+ Nd3+ 3H+ La R3 R3 R3 R3 R3
Figure 6. Reflux de la solution d’élution à l’étape d’élution partielle et déplacement du lanthane de la phase organique par le néodyme
1.5 L’extraction par solvant dans l’industrie
En industrie, chaque étape d’extraction par solvant se produit généralement dans une unité mélangeur-décanteur. La figure 7 présente une unité mélangeur décanteur. Les deux phases sont mélangées dans le mélangeur avec un agitateur. Les phases mélangées débordent dans le décanteur pour y être séparées simplement par décantation selon la masse volumique des phases. La phase la moins dense, généralement la phase organique, est récupérée à la surverse du décanteur alors que la phase la plus dense (aqueuse) est récupérée à la sousverse du décanteur. En général, le volume du décanteur correspond à 3 fois le volume du mélangeur (Mular & Poulin, 1998). Le volume du mélangeur doit être choisi afin d’obtenir un temps de séjour suffisant pour l’atteinte de l’équilibre de la réaction de transfert de matière ; i.e. :
𝜏 = 𝑉𝑀é𝑙
𝐷𝐴𝑄+ 𝐷𝑂𝑅𝐺 (16)
Où D Désigne un débit volumique et V un volume. Nos essais rapportés à la section 2.3 du mémoire ont permis de déterminer que 30 secondes sont en général
15
suffisantes pour atteindre la condition d’équilibre pour l’extraction des ETR, donc 𝜏 > 30 secondes puisque le mélangeur n’est pas un réacteur en lot.
Figure 7. Fonctionnement d’une unité mélangeur-décanteur
Pour obtenir une séparation satisfaisante entre deux ETR voisins dans le tableau périodique, plusieurs extractions consécutives dans des mélangeurs-décanteurs en série sont nécessaires. Par exemple, la séparation du néodyme et du praséodyme est reportée comme nécessitant plus de cent étapes d’extraction par solvant (Hsu et al., 1980). Pour une solution mère contenant tous les ETR, l’approche qui est généralement favorisée est la séparation en sous-groupes des différents ETR tel que montré dans la figure 8. Sachant que la séparation de chaque sous-groupe d’ETR se fait en plusieurs étapes, il est évident que la séparation complète des ETR va nécessiter de nombreux mélangeurs-décanteurs. Certains auteurs (Leveque & Maestro, 1993) parlent même d’usines comptant plus de 1000 unités mélangeur-décanteurs.
16
Figure 8. Diagramme à bloc simplifié de la séparation des ETR d’une usine d’extraction par solvant (Goode, 2016)
Les circuits industriels de séparation des éléments de terres rares décrits dans la littérature sont généralement des systèmes à contre-courant (Goode, 2016). C’est-à-dire que les deux phases immiscibles voyagent à contre sens dans le circuit. Un schéma d’un circuit d’extraction par solvant à contre-courant est présenté à la figure 9. Chaque étape (extraction, élution partielle et élution) est un banc de plusieurs mélangeur-décanteurs tel que montré à la
figure 10 où les mélangeurs-décanteurs sont agencés en alternance de façon à minimiser les étapes de pompage entre les réacteurs. Une photographie d’un banc de mélangeurs-décanteurs est montrée à la figure 11. Les avantages d’utiliser un système à contre-courant sont un plus grand chargement de la phase organique et une meilleure récupération des différentes espèces dans leurs sorties respectives (Ritcey & Ashbrook, 1984) par une maximisation des gradients de concentration entre les phases. Ainsi, la phase organique la plus concentrée en extracteur libre est en contact avec la phase aqueuse la moins concentrée. Le reflux est aussi utilisé dans les systèmes à contre-courant.
17 Extraction Élution partielle Élution Conditionnement du solvant Solution d’élution Solution d’élution partielle Solution mère Raffinat Reflux Reflux
Figure 9. Circuit d’extraction par solvant pour un système à contre-courant
Solvant organique déchargé Solution mère
Organique chargé
Raffinat
Figure 10. Banc de mélangeur-décanteurs en série dans un circuit d’extraction par solvant à contre-courant pour l’étape d’extraction
18
Bien que le procédé utilisé pour séparer les éléments de terres rares soit bien connu, les informations disponibles dans la littérature sont généralement vagues sur les différents paramètres industriels utilisés. Des informations telles que les pH d’extraction et d’élution, le nombre de mélangeurs-décanteurs et la concentration d’extracteur dans la phase organique sont rarement divulguées ce qui rend pratiquement impossible le développement d’un circuit d’extraction par solvant en ne se basant que sur les données de la littérature.
Le fait d’utiliser un logiciel de simulation devient donc important dans l’optique de concevoir un circuit d’extraction comprenant plusieurs centaines de mélangeurs-décanteurs permettant la séparation des différents ETR. Quelques compagnies possèdent les outils de simulation nécessaires à la conception de circuit d’extraction par solvant (Larochelle & Kasaini, 2016; McCallum et al., 2016). Cependant, ces outils sont des logiciels propriétaires dont l’accessibilité est limitée et dont les prédictions sont difficilement vérifiables par manque de données valables.
1.6 Conception et opération d’une usine d’extraction par solvant
Cette section est un préambule à la présentation de l’objectif du mémoire. La plupart des compagnies qui considèrent amorcer l’exploitation d’un gisement de minerai d’éléments de terres rares font les études de faisabilité jusqu’à la production d’un concentré mixte des ETR, i.e. que le produit de l’usine est un mélange d’oxydes ou de chlorures des ETR présents dans le minerai. Il faut par la suite trouver un acheteur pour ce concentré vrac. Cet acheteur est une raffinerie qui opère une usine de séparation des ETR. L’avantage de produire un concentré vrac par rapport à séparer les ETR réside dans le fait que la compagnie n’a pas à concevoir et opérer un circuit de séparation des ETR. Le désavantage de produire un concentré vrac d’ETR plutôt que des ETR séparés est lié au fait qu’il est nécessaire de trouver un acheteur pour le concentré vrac et de payer des frais de raffinage pouvant aller jusqu’à 50% de la valeur en ETR contenu dans le concentré vrac. Par exemple, une tonne de concentré vrac pourrait rapporter 2 000 $ si les ETR étaient séparés sur le site de l’usine de traitement du minerai alors que la vente de celui-ci à une raffinerie, ne rapporterait que 1 000 $ à cause des frais de raffinage. De plus, il peut s’avérer difficile
19
de trouver un acheteur pour un concentré vrac d’ETR. La plupart des raffineries se trouvant en Chine, et puisque l’offre de concentré vrac dépasse la demande, les raffineurs peuvent avoir des exigences difficiles et coûteuses à rencontrer pour les exploitants des gisements d’ETR.
La décision de ne pas construire et opérer une usine de séparation des ETR sur le site d’une exploitation d’un minerai d’ETR est souvent justifiée par la méconnaissance des circuits de séparation par les opérateurs d’usines de traitement des minerais et par la difficulté associée au pilotage des circuits de séparation afin d’anticiper les problèmes qui pourraient survenir avec une usine de capacité industrielle. En effet, SGS-Canada a récemment mis en opération une usine pilote de séparation (Bourricaudy et al., 2016) pour traiter un débit de 7 ml/min de solution d’ETR alors qu’une usine pleine échelle en traiterait plus de 150 L/min. Les auteurs rapportent que la simple séparation des ETR légers des SEG et des ETR et lourds exige plus de 120 mélangeurs-décanteurs et nécessite au moins 10 jours d’opération pour stabiliser le circuit ce qui fait rapidement exploser les coûts d’évaluation en étude de faisabilité. Le pilotage d’un circuit complet pour la séparation des 16 ETR serait donc très complexe et coûteux et pourrait décourager un exploitant potentiel d’évaluer la possibilité d’effectuer lui-même la séparation des ETR plutôt que de se limiter à production d’un concentré vrac pour le vendre à un raffineur qui exigerait des frais élevés pour le raffinage. Les exploitants pourraient donc profiter d’outils leur permettant de concevoir rapidement et économiquement une usine de séparation, et ce, avec un minimum de travail en usine pilote. Cette conception devrait être accompagnée d’une évaluation des coûts en capital et des coûts d’opération afin de fournir un estimé des revenus supplémentaires que la séparation des ETR pourrait générer par rapport à la production d’un concentré vrac d’ETR.
1.7 Objectifs de la maîtrise
L’objectif principal de cette maîtrise est le développement d’un circuit de séparation des éléments de terres rares en trois groupes (Légers, SEG et Lourds) à partir d’une solution de lixiviation purifiée d’un minerai d’ETR. Le procédé choisi pour y arriver est l’extraction par solvant, car cette technique représente encore aujourd’hui la seule méthode industrielle
20
utilisée pour la séparation de ces éléments. De par la complexité des systèmes de séparation par solvant pour les ETR, une approche par simulation est privilégiée. Ces travaux de simulation devraient permettre de concevoir rapidement et économiquement une usine de séparation. L’objectif final étant d’évaluer rapidement les coûts en capital et d’opération, et ainsi, d’estimer les revenus potentiels de la séparation des ETR. Un simulateur co-courant utilisant les constantes d’équilibre des différents éléments est donc développé afin d’atteindre ces objectifs.
En plus, ce travail vise à rapporter du mieux possible les conditions et les résultats obtenus lors des tests expérimentaux afin de contribuer à la connaissance du procédé. Puisque les constantes d’équilibre des différents extracteurs ne se trouvent pas dans la littérature, elles sont déterminées par des tests d’extraction en laboratoire. Une nouvelle approche par réconciliation de données parallèle à l’estimation des constantes d’équilibre a été développée afin d’utiliser au maximum l’information disponible pour les tests d’extraction. Puisqu’il n’y a pas de littérature disponible sur la réconciliation de données appliquée à des tests d’extraction par solvant avec cette approche, notre travail est novateur en ce qui concerne le procédé d’extraction par solvant. La méthode développée diminue l’incertitude sur les estimés des constantes d’équilibre et permet de détecter la présence de biais dans les données expérimentales. Nous allons aussi vérifier que la méthode d’estimation des constantes d’équilibre à partir de solutions aqueuses préparées avec des oxydes commerciaux d’ETR demeure valable pour des solutions d’ETR obtenues par lixiviation d’un minerai d’ETR. Une vérification qui est absente de la littérature, mais qui est souvent demandée par les personnes qui évaluent les projets de traitement des ETR. Nous allons aussi évaluer si l’approche de simulation développée pour l’étape d’extraction peut être utilisée pour l’élution, i.e. si l’hypothèse de solutions idéales est valide pour les solutions considérées et circulant dans un circuit d’extraction par solvant des ETR, un aspect qui n’a pratiquement pas été discuté dans la littérature et qui s’avère le point faible des modèles disponibles pour simuler les circuits de séparation des ETR. Afin de produire des résultats justes et précis, une méthode de détermination des ETR en solution par un spectrophotomètre à émission atomique à plasma induit par micro-onde a aussi été développée dans le cadre de ce projet de maîtrise.
21
1.8 Contexte du projet
Le projet de séparation des éléments de terres rares présenté dans ce document fait partie d’un projet initié et piloté par Jamal Chaouki de la Polytechnique de Montréal. Plus de dix étudiants aux deuxième et troisième cycles des universités Polytechnique de Montréal, McGill University et Laval collaborent à ce projet supporté financièrement par la mine Niobec et le Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG). Le principal objectif de ce projet conjoint est de développer un procédé complet permettant de passer du minerai d’ETR aux éléments individuels. Le projet va générer une expertise canadienne dans les différente étapes des procédés de production des ETR (flottation, lixiviation et extraction par solvant) et d’étudier de nouveaux procédés, comme la calcination en lit fluidisé, la séparation par liquides ioniques et par émulsions, pouvant être appliqués à la production des ETR. Les principaux thèmes de recherche du projet et les liens entre ceux-ci sont montrés à figure 12. L’encadré (Ph.D. 4 à la figure 12) positionne la partie de séparation individuelle des ETR par extraction par solvant qui fait l’objet de ce mémoire qui devait initialement être un projet de doctorat.
22
1.9 Division du mémoire
Le corps du mémoire est séparé en quatre (4) chapitres. Le chapitre 2 traite de la méthodologie expérimentale du projet utilisé pour l’analyse des échantillons, pour produire les résultats expérimentaux d’extraction par solvant et pour étudier la cinétique des réactions et interpréter les données obtenues. Le chapitre 3 décrit la méthode d’estimation des constantes d’équilibres développée qui permet de simultanément réconcilier les données expérimentales et d’estimer une constante d’équilibre pour chaque élément. Le chapitre 4 décrit la procédure utilisée pour la simulation du procédé d’extraction par solvant et compare des résultats expérimentaux à des simulations pour des solutions synthétiques et réelles d’ETR afin de valider l’approche de simulation sélectionnée. La conclusion est présentée au chapitre 5.
23
2
Méthodologie expérimentale
2.1 Analyses chimiques des ETR
Une difficulté rencontrée dans le domaine des éléments de terres rares est le dosage de ces éléments autant en phase solide que liquide. La quantification juste et précise des ETR est importante pour l’avancement du projet puisque les équations d’équilibre sont basées sur des mesures de concentration des éléments dans les différentes phases. Une méthode d’analyse des ETR en solution aqueuse a été développée pour un spectrophotomètre à émission atomique à plasma induit par micro-onde (MP-AES 4100) de Agilent Technologie (Santa Clara, CA). Nous avons été parmi les premiers à l’Université Laval à avoir fait l’acquisition d’un tel appareil et une partie importante du projet a consisté à développer une expertise dans l’utilisation de cet instrument pour le dosage des ETR en solution. Après calibration et la mise au point de méthodes pour corriger les interférences entre éléments, cet instrument permet quantifier rapidement et avec précision les ETR dans les phases aqueuses des solutions obtenues expérimentalement.
Lorsque la concentration en élément dans la phase organique doit être déterminée, deux méthodes peuvent être utilisées. La mesure de la concentration d’un élément dans la solution mère et dans un raffinat (i.e. en condition d’équilibre, indice eq) permet de déduire la concentration dans la phase organique avec :
[𝐿𝑛𝑅3]𝑜𝑟𝑔:𝑒𝑞 = 𝛥𝐿𝑛𝑎𝑞
𝑅𝑂/𝐴
+ [𝐿𝑛𝑅3]𝑜𝑟𝑔:0 (17)
Où 𝛥𝐿𝑛𝑎𝑞 est donné par :
Avec [𝐿𝑛3+]𝑎𝑞:0 la concentration d’un ETR dans la solution mère (indice 0) et [𝐿𝑛3+]𝑎𝑞:𝑒𝑞 la concentration dans le raffinat (indice eq). Une autre méthode pour mesurer la concentration d’un élément dans la phase organique consiste à éluer la phase organique avec un acide concentré exempt d’ETR. Afin de s’assurer de l’élution complète, deux élutions consécutives sont effectuées sur la phase organique. Les concentrations des phases [𝐿𝑛3+]𝑎𝑞:0− [𝐿𝑛3+]𝑎𝑞:𝑒𝑞 = 𝛥𝐿𝑛𝑎𝑞 (18)
24
aqueuses des solutions d’élution sont déterminées avec le MP-AES. Si la concentration en ETR dans la deuxième solution d’élution tend vers zéro, l’élution est considérée comme complète. Les concentrations mesurées sont combinées pour donner une seule teneur par ETR dans la phase aqueuse et la teneur dans la phase organique se calcule comme suit :
[𝐿𝑛𝑅3]𝑜𝑟𝑔:𝑒𝑞 =
[𝐿𝑛3+]𝑎𝑞:é𝑙𝑢𝑡𝑖𝑜𝑛 𝑅𝑂/𝐴
(19)
Certains auteurs (Bourricaudy et al., 2016) suggèrent de calciner (brûler) la phase organique et digérer le résidu de la combustion pour obtenir la solution à analyser, mais nous n’avons pas utilisée cette technique plus exigeante en temps et possiblement plus propice à l’introduction d’erreurs de manipulation que les deux premières approches.
2.1.1 Fonctionnement du MP-AES
Le principe de fonctionnement du MP-AES est similaire à un spectromètre d’émission atomique à plasma induit (ICP-OES). Tout comme un ICP-OES, le MP-AES est un instrument multi-élémentaire de mesure d’émission atomique. C’est-à-dire que l’appareil mesure des longueurs d’onde d’émission spécifiques à un élément qui proviennent d’atomes ionisés par un plasma. Cependant, quelques différences font du MP-AES un instrument adapté pour l’analyse des ETR.
Premièrement, le plasma du MP-AES est entretenu par de l’azote comparativement à de l’argon pour la plupart des instruments à émission atomique. À l’Université Laval, un générateur connecté à l’instrument utilise une ligne d’air comprimé pour produire de l’azote pur à 99,7%. Cela permet de diminuer les coûts en consommables de l’instrument par rapport à un spectromètre utilisant de l’argon. L’utilisation de l’azote au lieu de l’argon diminue légèrement la sensibilité de l’instrument et augmente la limite de détection (Arai et al., 2014). La plupart des éléments analysés par le MP-AES sont quantifiables entre 0,1 ppm et 100 ppm.
La principale différence entre un MP-AES et un ICP-OES est la méthode de formation du plasma. L’utilisation des micro-ondes pour former le plasma conduit à un plasma plus «
25
froid » pour le MP-AES que pour l’ICP-OES. La température d’un plasma micro-ondes varie entre 5000 et 6000K (Jankowski & Reszke, 2010) alors que celle d’un ICP-OES est d’environ 7000 K (Huang & Hieftje, 1989). Cette différence de température du plasma se traduit par un plasma avec une plus faible capacité d’ionisation pour le MP-AES.
Les ETR sont des éléments contenant plusieurs orbitales atomiques et puisque les longueurs d’onde d’émission proviennent de l’ionisation d’électrons des orbitales atomiques, le spectre d’émission des ETR est complexe. L’utilisation d’un ICP-OES pour l’analyse des ETR est toujours difficile à cause de la complexité des spectres d’émission de ces éléments (Navarro et al., 2002). Pour l’analyse des ETR avec le MP-AES, une faible capacité d’ionisation est donc un avantage puisque seulement les électrons facilement ionisables le sont. Cela simplifie le spectre d’émission et permet l’analyse des ETR avec peu d’interférences spectrales. Cependant, le MP-AES est limité par la capacité de son plasma à ioniser la totalité des éléments en solutions. Le plasma du MP-AES a une certaine énergie disponible pour l’ionisation de tous les éléments en solution. Puisque les ETR sont plus difficiles à ioniser que des éléments comme le sodium (Sansonetti & Martin, 2005), le plasma ionise les éléments facilement ionisables en premier et par la suite, les ETR. Le MP-AES peut donc sous-estimer la concentration en ETR de solutions contenant une grande quantité de solides dissouts. Cela peut poser un problème lors de l’analyse des solutions de lixiviation de minerais d’ETR puisque la lixiviation acide utilisée pour les mettre en solution dissout une grande quantité de métaux (Ca, Mg Fe, Al) qui sont, de même que l’acide, plus facilement ionisables que les ETR. L’ajout d’un standard interne dans les solutions permet de corriger ces problèmes d’ionisation (Skoog et al., 2017), cependant cela s’est révélé problématique pour les solutions analysées dans le cadre de ce projet. En effet, un bon standard interne devrait avoir une énergie d’ionisation similaire aux ETR afin de compenser l’ionisation partielle du plasma. Un des standards internes testés est le baryum. Cet élément se comporte de manière similaire aux ETR. Cependant, il se retrouve aussi dans les minerais porteurs d’ETR ce qui le rend inapte à servir de standard interne. De plus, puisque le MP-AES est une technique d’émission atomique, les analyses sont affectées par les interférences spectrales des autres éléments présents en solution. Il est possible de contourner ce problème en diluant suffisamment les échantillons à analyser afin




![Figure 22. Détermination de la K eq du Nd avec la méthode par régression linéaire [Nd]aq[Nd]org[RH]org](https://thumb-eu.123doks.com/thumbv2/123doknet/5519479.131783/55.918.123.790.590.739/figure-détermination-nd-méthode-régression-linéaire-nd-nd.webp)